Amnis量化成像流式细胞仪在血液学研究中的应用
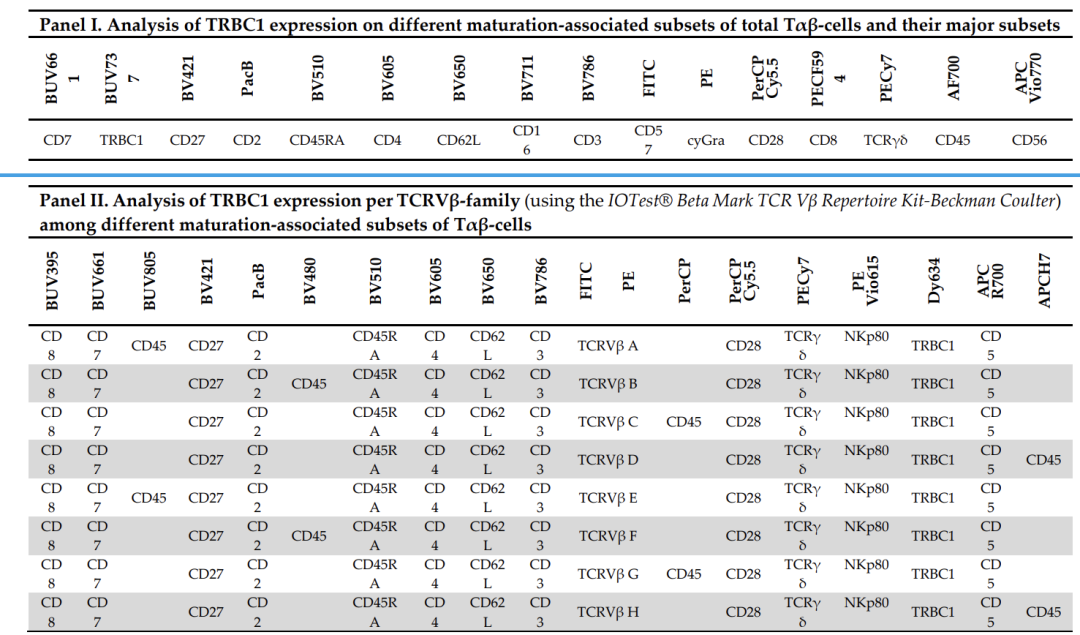
Amnis量化成像流式细胞仪在血液学研究中的应用 白血病是一类造血干细胞恶性克隆性疾病。克隆性白血病细胞因为增殖失控、分化障碍、凋亡受阻等机制在骨髓和其他造血组织中大量增殖累积,并浸润其他非造血组织和器官,同时抑制正常造血功能。白血病的诊断、分类和预后分层需要综合运用形态学、免疫表型和遗传分析方法,而传统上这需要在多个平台上进行检测以便得到最终结果。 成像流式细胞术可以在一个仪器上产生以上所有结果,从而为白血病的诊断和研究开辟了新的工具。基于图像的流式细胞术结合高分辨率数字图像和标准流式细胞仪所获得的定量荧光信息,可以确定细胞抗原的定位(即细胞表面、细胞质、细胞核),并且可根据荧光强度、细胞形状、细胞大小和纹理信息等组合变量选择特定的细胞群体进行分析,而这是标准流式细胞仪无法实现的特征。 急性早幼粒细胞白血病(APML)为急性髓细胞白血病的一种特殊类型,急性早幼粒细胞白血病可以通过观察早幼粒细胞中粒细胞白血病蛋白- PML蛋白的异常弥散分布来进行快速检测。在正常细胞中,大部分PML蛋白以不连续点状方式分布在细胞核内,而在APML细胞中PML蛋白会呈弥散性分布。常规检测方法为显微镜观察,免疫组化,荧光原位杂交以及传统流式细胞术,但这些方法主观性很强,灵敏度低。Lizz Grimwade等人[1]尝试利用Amnis® 量化成像流式技术,根据 PML蛋白分布的模式的不同,对正常细胞和APML细胞的PML蛋白分布进行客观的区分。对病人样本进行自动检测,通过统计发生PML蛋白聚集的细胞比率来评估 APML发病的风险。结果表明,Amnis量化成像流式技术能够分析大量样本,确定PML蛋白的分布形式,从而找到潜在的异常细胞,增加了检测的灵敏度和准确率。图1. 急性早幼粒细胞白血病(APML)免疫荧光显微镜染色显示(A)在非APML患者中聚集的PML小体和(B) APML患者中弥散性PML小体 (红色,罗丹明抗PML;蓝色,DAPI核染色)。Modulation纹理分析分别显示在非APML病例(C)和(D)在APML病例中的结果。(E)和(F)分别显示非APML患者FITC标记的PML聚集体和APML患者弥散性PML。(G) 显示非APML患者和APML患者之间弥散染色的细胞百分比差异。 慢性淋巴细胞白血病(CLL)是最常见的白血病,其特征表型和预后在很大程度上取决于是否存在细胞遗传学畸变。检测这些细胞遗传学异常的金标准是在载玻片上的细胞涂片或组织切片上进行荧光原位杂交(FISH)。荧光原位杂交(FISH)是一种显微镜技术,使用荧光探针检测DNA序列,通常在载玻片上完整细胞的中期细胞涂片或间期细胞核上进行。来自澳大利亚的科学家Henry Hui等[2]展示了使用自动、高通量的Amnis量化成像流式细胞仪评估数千个细胞悬液中CLL细胞染色体的特异性FISH探针信号。成像流式细胞仪的EDF景深扩展能力使FISH探针信号能够被解析并定位在免疫表型细胞的(染色的)细胞核内。多色流式细胞术免疫表型分析最常用于诊断白血病,因为CLL细胞具有特征性表型,它们是成熟B淋巴细胞(CD19、CD20阳性),特征为共表达CD5和CD23抗原。CLL还表现为异质性遗传不稳定性。超过80%的病例预先存在细胞遗传学畸变,最常见的是11q、13q或17p缺失和12三体(15%的病例),这些可用于将患者分为高、中、低和极低预后风险类别。图2展示利用Amnis成像流式进行12号染色体三体CLL细胞的分析方法。使用Amnis ImageStreamX Mk II平台在血液样品上开发的自动化“immuno-flowFISH”方法在CLL中评估12号染色体的临床方法可能应用于疾病分层的诊断和后续治疗以评估疾病预后。这些应用将帮助临床医生优化治疗决策,从而改善患者的治疗效果。 图2. Amnis成像流式细胞仪进行12号染色体三体CLL细胞的分析方法。(A)分别根据明场图像的清晰度、面积、宽长比等参数对聚焦细胞进行识别。(B)细胞通过SYTOX AADvanced荧光强度(Intensity_MC_Ch05)进一步鉴定有核细胞,排除增殖细胞或紧密重叠的细胞。(C)和(D)根据CD19-BV480 (Ch07)、CD3-AF647 (Ch11)和CD5-BB515 (Ch02)表达差异对细胞进行分群,分为T细胞(CD3+CD5+CD19-), B细胞(CD3-CD5-CD19+)和CLL细胞(CD3-CD5+CD19+)。(E-G)对每个细胞亚群在CEP12-SpectrumOrange探针(Ch03)通道进行FISH小点计数的结果。(H)可在图像库中查看细胞免疫表型或FISH小点计数的亚群,以确认定量分析。259细胞为CD19-BV480阴性,CD3-AF647阳性,CD5-BB515阳性,12号染色体正常T细胞;细胞4419是一个CD19+CD3-CD5-12号染色体正常B细胞;细胞7805是一个CD19+CD3-CD5-12号染色体三体CLL细胞;细胞1851是一个CD19+CD3-CD5+12号染色体正常B细胞;和细胞1828是一个CD19+CD3-CD5+12号染色体三体CLL细胞。 Amnis量化成像流式细胞仪可以让科学研究更加生动,富有乐趣,其高灵敏度的检测和成像分析的大数据则让文章充满亮点,是您科学研究的好帮手。 相关阅读:Amnis® 量化成像流式细胞仪系列 利用传统流式细胞检测技术,研究人员可以分析成千上万个细胞,获得每个细胞的散射光信号和荧光信号,从而得到细胞群体的各种统计数据,但是传统流式细胞检测技术获得的细胞信息相对有限。细胞对研究人员来说,只是散点图上的一个点,而不是真实的细胞图像,缺乏细胞形态学、细胞结构及亚细胞水平信号分布的相关信息。要想获得细胞图像,研究人员就必须使用显微镜进行观察,但显微镜能够观察的细胞数量是非常有限的,很难提供细胞群体的量化与统计数据。Luminex公司Amnis® 量化成像流式技术开创性地将流式细胞技术与荧光显微成像技术结合于一体,在传统流式抽象的统计学数据基础上,既能提供细胞群的统计数据,又还可以获得单个每个单细胞的明场和荧光图像,从而为研究人员提供了细胞形态学、细胞结构和亚细胞信号分布的完整信息。 Amnis量化成像流式细胞仪具有高达12个检测通道,可以对通过流动室中的每个细胞进行成像,并对图像进行多参数量化分析,获得全新的细胞形态统计学数据。系统配有功能强大的数据分析软件IDEAS,可以对每个细胞图像通道分析超过上百种量化参数。这些参数不仅包括细胞整体的散射光和荧光信号强度,还包括对细胞形态,荧光分布、小点计数、荧光共定位等多种信息的分析。随着Amnis高速显微成像流式细胞技术的发展成熟,越来越多的科研人员开始将这种革命性的技术手段运用到自身的研究领域,并发表了大量有影响力的论文。图3.路明克斯Amnis量化成像流式细胞仪,左为FlowSight® ,右为ImageStream® X Mk II 参考文献: [1] Grimwade, L., Gudgin, E., Bloxham, D., Scott, M. A., & Erber, W. N. (2010). PML protein analysis using imaging flow cytometry. Journal of Clinical Pathology, 64(5), 447–450. doi:10.1136/jcp.2010.085662 [2] Hui, H., Fuller, K. A., Chuah, H., Liang, J., Sidiqi, H., Radeski, D., & Erber, W. N. (2018). Imaging flow cytometry to assess chromosomal abnormalities in chronic lymphocytic leukaemia. Methods, 134-135, 32–40. doi:10.1016/j.ymeth.2017.11.003