测甘油杂质需要做一个系统适用性,其中用到甘油浓度为400mg/ml,请问必须要对照品吗,用分析纯可以吗
HPLC测定时需要做系统适用性,那么这个系统适用性到底该用供试品溶液做还是用对照溶液做?
色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂(5~10μm);0.2mol/L硫酸盐缓冲液(取无水硫酸钠28.4g,加水溶解后,加磷酸2.7ml、水800ml,用乙醇胺调节pH值至2.3,加水至1000ml)-乙腈(74:26,或适宜比例)为流动相;柱温为40℃;检测波长为214nm。取重组人胰岛素对照品,用0.01mol/L盐酸溶液制成每1ml中含1mg的溶液,室温放置至少24小时后,取2ul注入液相色谱仪,胰岛素峰和A21脱氨胰岛素峰的分离度应不小于1.8,拖尾因子不大于1.8。请问我在工作中做系统适用性实验时,是进上文中的1mg/ml的放置24小时的溶液5针,以其做系统实用性试验;还是进上文中的1mg/ml的放置24小时的溶液1针,再进对照品5针,以5针对照品作为系统适用性试验,而一开始进的只看一下分离度?
向大家请教关于系统适用性实验的问题:同一样本中有A(A为样本),B(杂质)两种成分,且需要同时测定A,B两种物质的含量,那么在进行系统适用性实验时,是否可以用A和B的混合对照品,连续进样5针,分别计算A和B的RSD???

[img=,480,596]https://ng1.17img.cn/bbsfiles/images/2018/09/201809260906045200_3378_2449119_3.png!w480x596.jpg[/img]请教各位同仁: 上述是盐酸雷尼替丁含量测定方法,其中划红线的是系统试液。可见系统适用性试液是用氢氧化钠进行破坏的溶液,因该物质极易被氢氧化钠破坏,故在进样5针后,其重复性不满足要求。故在进样过程中,只测试一针。 [b] 疑问:[/b]1.测试一针是合理的,但是否还要用对照品溶液连续测试5针来验证系统适用性?2.盐酸雷尼替丁的有关物质方法同含量测定,采用的是自身对照法,请问测试有关物质与含量不是同一天,请问有关物质方法中系统适用性试验如何测试?是继续用破坏性试液测试1针,还是用什么测试5针?目前有没有对有关物质方法中系统适用性试验测试要求?3.请问有关物质测试中,是对照溶液和供试品溶液各进1针,各配1个样?还是双样双针?单样双针?希望有比较权威的解答!感谢各位
做系统适用性时,到底该用对照品还是供试品啊,看到很多说法都不一样......
[b]高效液相色谱系统适用性试验设计的变化趋势[/b][i]周晓源,李雪茹[/i]高效液相色谱法(HPLC 法)是药物分析中常用的一种定性、定量色谱分析方法。具有较强的专属性,相对较高的检测灵敏度和良好的量化功能。2005版《中国药典》使用 HPLC 法的品种中,色谱系统适用性试验设计有了较大的变化:指标更加细致、周到,检测更重实效,色谱系统适用性的试验用溶液的制备方法也呈现多样化,体现出一些变化趋势。 1. 色谱系统适用性试验的设计与实验目的更加匹配 系统适用性试验的严格细腻程度取决于实验目的。首先应考虑色谱系统被用于何种实验,根据实验目的来设计系统适用性试验。如果一个 HPLC 方法仅用于定性鉴别,就其色谱系统的适用性试验而言可以相对简单宽松,只要可以确保被测成分峰与其他色谱峰有一定的分离度,具有适宜的出峰时间即可达到实验目的。 如果用于定量分析(如含量测定),则除要保证被测成分峰具有适宜的出峰时间外,还需检验系统是否能够保证被测成分峰与其他色谱峰完全分离,分离度一般应在1.5以上,同时还应测试被测成分峰峰面积的重复性是否良好,对照品溶液连续进样5针的峰面积相对标准偏差应不大于2%,被测成分峰的峰型也应基本对称,以保证分离效果和测量精度。对于小峰(如占总面积10%以下的色谱峰)峰面积的定量,或用峰高法定量时,就应对拖尾因子或对称因子加以严格的规定,一般来说,拖尾因子应在 0.95~1.05之间,因为峰的对称性对测量结果影响较大。 如果检查某种药品的有关物质,且还需要分别检查单个杂质和杂质总量,那么系统适用性试验还应有一个重点,就是要有常见杂质难分离物质对分离度的测定指标。此外系统的检测灵敏度试验也就相对比较重要。如盐酸二甲双胍的有关物质检查项下要求: 盐酸二甲双胍与双氰胺的分离度应大于1.5,检测灵敏度要求调节双氰胺峰高为满量程的10%。 如 果色谱系统是一个梯度洗脱系统,有时一个难分离物质对分离度的测试也不能完全达到实验目的。如果在梯度变化的前后均有需要检测的杂质,分离度的测定指标一般应根据需要在梯度变化之前和之后都可加以制订。在梯度洗脱系统中某个成分峰的保留时间也经常用来做系统适用性检测的指标,给出吐峰时间范围,如头孢地尼,主成分头孢地尼峰的保留时间要求22分钟,E-异构体峰保留时间约为33分钟,理论板数按头孢地尼峰计算应不低于 7000。 在2000年版《中国药典》中,有些标准色谱系统适用性试验的要求就与其色谱系统的实验目的不完全匹配。如有些品种含量测定与有关物质共用一套色谱系统,且有关物质还需要分别检查单个杂质和杂质总量,但系统适用性试验指标仅有一个理论板数的要求,或对分离度的设计为“被测成分峰与相邻杂质峰间的分离度应符合规定”这样一个对系统性能缓冲空间很大的一个指标要求。在2005年版《中国药典》中,这种实属很虚的指标开始减少。如2000年版头孢曲松反式异构体(光降解产物)峰的保留时间应为头孢曲松峰保留时间的1.3倍,两峰之间的分离度应不小于3.0,理论板数按头孢曲松峰计算应不低于1500,2005年版修订为头孢曲松峰和头孢曲松反式异构体峰间的分离度应不小于6.0。2.系统适用性试验用溶液的制备更加注重方便性、实用性和可操作性系统适用性试验用溶液的配制方法,最简单的莫过于用主成分对照品与杂质对照品混合配制,但有些杂质对照品不能得到,如性质不稳定或与主成分理化性质太接近,分离提取技术要求太高,成本太大等,但这些杂质峰恰恰又是与主成分峰最难分离的色谱峰,且较常存在于 药 品中需要检查的,在2005年版《中国药典》中,这一问题得到了较好的解决。如喹诺酮类药物中较常出现光降解产物,而此光降解产物是引起这类药物不良反应的主要因素,所以需要在有关物质检查中做为重点检测的杂质之一。 因 此 ,在2005年 版 《 中 国 药 典 》中,这些药物系统适用性试验用溶液的制备就通 过把对照 品溶液进行 光 照 处理,得到能产生明显光降解产物色谱峰的溶液。 3.实验过程、操作步骤趋于严谨规范 色谱系统适用性试验设计、规定的完备、灵敏度检测试验的规范,溶剂的选择、溶解制备方式等各方面均体现出对实验目的的理解更加明确,对实验细节考虑更加严谨周到,标准的书写格式均更 加规范 、统 一 ,如2005年 版《中 国 药典》收载的 β-内酰胺类抗生素中检查高分子聚合物的品种将原来收载的8个品种的色谱条件与系统适用性试验均修订与新增 13个品种项下书写格式相同,系统适用性试验统一为理论板数以蓝色葡聚糖2000峰计算均不低于……。拖尾因子均应小于2.0,在两种流动相系统中蓝色葡聚糖 2000峰保留时间比值均应在0.93~1.07之间,对照品溶液主峰与供试品溶液中聚合物峰与相应色谱系统中蓝色葡聚糖 2000峰保留时间的比值均应在0.93~1.07之间。
本人饲料行业,液相做中间产物的时候,系统适用性可以改为每周做一次,其余天数只走回针考察吗ps:液相不是不停运行的、对照品有效期为一周

http://ng1.17img.cn/bbsfiles/images/2012/03/201203081038_353205_1638724_3.jpg上文中的阿莫西林系统适用性对照品就是含量测定用的对照品吗?
大家在做方法验证的时候,系统实用性溶液怎么配的,浓度多大,遵循什么原则。例如我有个产品活性成分含量大约50%,HPLC就出这一个峰,系统适用性溶液怎么配呢,是不是配置50%的对照品溶液,还是多大浓度的啊!谢谢
微生物菌落计数方法适用性验证中,供试品对照组可以有菌落的吗?
[align=center]阿卡波糖系统适用性试验[/align][align=center]-遵循2015中国药典[/align][align=center] [/align][b]色谱条件:[/b]色谱柱:Kromasil 100- 5-NH2,4.6*250mm货号:M05NHA25流动相:磷酸盐缓冲液:乙腈=25:75流速:2ml/min柱温:室温波长:210nm进样量:10uL[b]系统适用性实验图谱:[/b][align=center][img=,554,268]https://ng1.17img.cn/bbsfiles/images/2024/03/202403181713142962_1500_2785_3.png[/img][/align][b]结论[/b][list=1][*]杂质I相对于阿卡波糖的保留时间约为0.9[*]杂质I的峰高与杂质I和阿卡波糖两峰之间的峰谷之比大于2.0[*]理论塔板数按阿卡波糖计算大于2000[/list]结果完全符合2015中国药典 [b]小贴士:[/b]实验前不要忘记平衡色谱柱和柱效测试哦[img]http://simg.instrument.com.cn/bbs/images/default/em09502.gif[/img]

2010 版中国药典 VIII R 规定TOC分析仪是要定期进行系统适用性测试,GE为客户提供即开即用的液体系统适用性标准品,省心省力。8月15日-9月15日,GE携全国代理商惠馈客户,优惠活动如下:如果了解更多有关TOC的系统适用性测试知识,可以点击此处http://ng1.17img.cn/bbsfiles/images/2012/08/201208221014_385307_2359237_3.jpg
如题,在进行方法验证时,系统适用性怎么验证?我最初接受的培训是:因为系统适用性是证明系统对于分析方法是适用的,是每天在分析样品之前进行的,因此在分析方法验证的每一天进行各项验证前,需分析系统适用性,分离度、理论塔板数、拖尾因子或峰面积RSD%(含量计算时对照溶液RSD计算如果定为系统适用性的话,每天必须将系统适用性几样5针)等符合要求才能进行后面的验证;然后将每天的系统适用性数据进行统计。同样的,在进行耐用性验证时,也必须先进系统适用性。后来,我去了其他公司,看到的方式是:系统适用性作为专属性的一部分,在验证专属性时,将各个杂质配制成含约1%或0.1%的混合溶液,分析分离度等,符合要求即认为系统适用性符合要求。各位来讨论讨论,那种方式更为合理?
采用面积归一化法测定高分子杂质,但系统适用性的对照品溶液峰面积rsd达到9%以上,这样会影响杂质定量么,有人说峰面积归一化法不用对照品峰面积,不用管,有做过的么?(对照品溶液和杂质不是一个物质)
关于液相系统适用性的问题,由于系统适用性需要用到杂质标准品,但如果一直使用杂质标准品,费用又很高。如果公司自己制作内部标准品,有没有这样的科研力量。如何解决?
在做薄层色谱分析时需做系统适用性试验,那么对于已知杂质的薄层分析系统适用性试验该如何做?已知杂质的限度是0.2%,系统适用性试验:1.将杂质与供试品按照0.2%:1制成混合溶液进行系统展开2.将杂质与供试品按照0.2%:0.2%制成混合溶液进行系统展开上述两种系统适用性试验应选择哪种?选择1很容易出现杂质被包裹现象,两种系统适用性试验分离度都能满足要求。求指点~~
阿奇霉素系统适用性标准图谱谁有?中检所出对照了,可是没标准图谱
系统适用性的五个项目(塔板数、分离度、灵敏度、拖尾因子、重复性)每次实验都需要做吗?如果实验方法里没有提系统适用性,还用做吗?
USP中规定用填充柱检测,现改为用毛细管柱是否违背系统适用性的要求
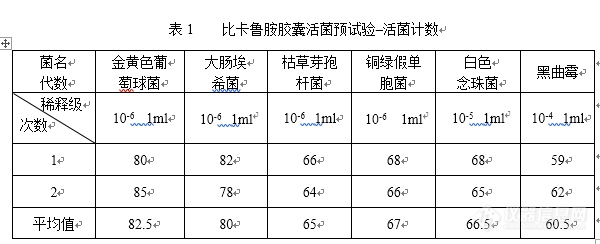
[align=center][b]xxxx胶囊微生物限度方法适用性试验[/b][/align] 根据中国药典2015年版要求,为保证该分析方法有效性,确保检验结果的准确性和可靠性,对xxxx囊检查的方法适用性试验进行了考察,现将测定结果报告如下:[b]1. 供试品:xxxx胶囊三批[/b]批号:20151001 20151002 20151003[b]2. 培养基:[/b]胰酪大豆胨液体培养基(150629) 胰酪大豆胨琼脂培养基(150611) 沙氏葡萄糖液体培养基(150821) 沙氏葡萄糖琼脂培养基(150827) PH7.0氯化钠—蛋白胨缓冲溶液(140725) 麦康凯液体培养基(150911) 麦康凯琼脂培养基(150907) 胰酪大豆胨肉汤对照培养基(135026-201401) 胰酪大豆胨琼脂对照培养基(135025-201402) 麦康凯琼脂对照培养基(135009-201102) 沙氏葡萄糖肉汤对照培养基(1305008-201102)沙氏葡萄糖琼脂对照培养基(135013-201001)麦康凯液体对照培养基(135030-201501) 以上培养基均由中国食品药品检定研究院提供。[b]3. 菌种:[/b]菌落计数用菌用:金黄色葡萄球菌 白色念珠菌 枯草芽孢杆菌 大肠埃希菌黑曲霉 铜绿假单胞菌控制菌检查用菌种:大肠埃希菌 以上菌种均由中国食品药品检定研究院提供。[b]4. 所用仪器:[/b]双人单面垂直净化工作台BJ-2CD型 编号ZB-HY-174(上海博迅实业有限公司)净化工作台 SB-JC-IA型 编号ZB-HY-023(上海博迅实业有限公司)生化培养箱 SPX-250B-Z型 编号 ZB-HY-080(上海博迅实业有限公司)生化培养箱 SPX-250B-Z型 编号 ZB-HY-081(上海博迅实业有限公司)生化培养箱 SPX-250B-Z型 编号 ZB-HY-172(上海博迅实业有限公司)生化培养箱 SPX-250B-Z型 编号 ZB-HY-173(上海博迅实业有限公司)调速多用振荡器 HY-4型 编号ZB-HY-087(金坛市岸头国瑞实验仪器厂)立式压力蒸汽灭菌器 YXQ-LS-100A型 编号ZB-HY-175(上海博迅实业有限公司)手提式电热灭菌锅 YX280B型 编号ZB-HY-003(上海三申医疗器械有限公司)[b]5.环境要求[/b]:微生物限度室在C级条件下的A级环境进行,试验环境达到无菌检查的要求,检验全过程严格遵守无菌操作,防止微生物污染,防止污染的措施不得影响供试品中微生物的检出。[b]6. 微生物计数[/b]按照中国药典2015年版微生物限度检查法进行微生物计数的方法适用性试验及菌落计数。6.1 菌液制备(1)接种金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌、铜绿假单胞菌的新鲜培养物至10ml胰酪大豆胨液体培养基中,30~35℃培养18~24小时,取此培养液1ml加pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液9ml,采用10倍递增稀释法,稀释至10[sup]-5[/sup]~10[sup]-7[/sup],使菌数不大于100cfu/ml,见表1。(2)接种白色念珠菌的新鲜培养物至10ml沙氏葡萄糖液体培养基中,20~25℃培养2~3天,取此培养液1ml加pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液9ml,采用10倍递增稀释法,稀释至10[sup]-4[/sup]~10[sup]-6[/sup],使菌数不大于100cfu/ml,见表1。(3)接种黑曲霉的新鲜培养物至沙氏葡萄糖琼脂培养基斜面培养基上,20~25℃培养5~7天,使大量的孢子成熟,加入3~5ml 含0.05%(ml/ml)聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液,振摇或用接种针将孢子洗脱。然后,用管口带有薄的无菌棉花或纱布能过滤菌丝的无菌毛细吸管吸出孢子悬液至无菌试管内,用含0.05%(ml/ml)聚山梨酯80的pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成每1ml含孢子数小于100cfu的孢子悬液。[img=,600,244]https://ng1.17img.cn/bbsfiles/images/2018/10/201810311814113392_7928_2204446_3.png!w600x244.jpg[/img][b]6.2 培养基的适用性检查[/b]6.2.1胰酪大豆胨琼脂培养基、沙氏葡萄糖琼脂培养基 分别取不大于100cfu的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉,注入无菌平皿中,立即倾入胰酪大豆胨琼脂培养基;30~35℃培养不超过三天。分别取不大于100cfu的白色念珠菌、黑曲霉,注入无菌平皿中,立即倾入沙氏葡萄糖琼脂培养基,每株试验菌制备2个平皿,混匀,凝固,20~25℃培养不超过五天,计数。用相应的对照培养基替代被检培养基进行上述试验。结果见表2。[img=,583,548]https://ng1.17img.cn/bbsfiles/images/2018/10/201810311814344516_9988_2204446_3.png!w583x548.jpg[/img]结论:被检培养基上的菌落平均数与对照培养基上的菌落平均数的比值均在0.5-2范围内,该培养基的适用性检查符合规定。6.2.2胰酪大豆胨液体培养基 将不大于100cfu的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌接种至胰酪大豆胨液体培养基试管中,30~35℃培养不超过三天。用相应的对照培养基替代被检培养基进行上述试验。结果见表3。[img=,628,219]https://ng1.17img.cn/bbsfiles/images/2018/10/201810311814563036_8094_2204446_3.png!w628x219.jpg[/img]结论:被检培养基管与对照培养基管比较,被检培养基管试验菌生长良好,该培养基的适用性符合规定。6.2.3麦康凯液体培养基6.2.3.1 麦康凯液体培养基促生长能力检查分别接种不大于100cfu的大肠埃希菌于麦康凯液体培养基和麦康凯液体对照培养基试管中,在42~44℃培养24~48小时,与对照培养基管比较,被检培养基管试验菌生长良好,结果见表4。6.2.3.2 麦康凯液体培养基抑制能力检查分别接种不大于100cfu的金黄色葡萄球菌于麦康凯液体培养基和麦康凯液体对照培养基试管中,在42~44℃培养24~48小时,被检培养基管内试验菌未生长,结果见表4。6.2.4麦康凯琼脂培养基6.2.4.1 麦康凯琼脂培养基促生长能力检查 取大肠埃希菌0.1 ml涂布于麦康凯琼脂培养基和麦康凯琼脂对照培养基上,在30~35℃培养18~72小时,被检培养基上大肠埃希菌的菌落大小、形态特征、与对照培养基一致,结果见表4。6.2.4.2麦康凯琼脂培养基指示特性检查 取大肠埃希菌0.1 ml涂布于麦康凯琼脂培养基和麦康凯琼脂对照培养基上,在30~35℃培养18~72小时,被检培养基上大肠埃希菌的菌落大小、形态特征、指示剂反应情况等与对照培养基一致,结果见表4[img=,610,225]https://ng1.17img.cn/bbsfiles/images/2018/10/201810311815494696_355_2204446_3.png!w610x225.jpg[/img]结论:被检培养基上的生长显示与对照培养基一致,该培养基的适用性符合规定。6.2.5沙氏葡萄糖液体培养基6.2.5.1沙氏葡萄糖液体培养基促生长能力检查分别接种不大于100cfu的白色念珠菌于沙氏葡萄糖液体培养基和沙氏葡萄糖肉汤对照培养基试管中,在20~25℃培养2~3天,与对照培养基管比较,被检培养基管试验菌生长良好,结果见表5。[img=,635,136]https://ng1.17img.cn/bbsfiles/images/2018/10/201810311817326133_7606_2204446_3.png!w635x136.jpg[/img]结论:被检培养基上的生长显示与对照培养基一致,该培养基的适用性符合规定。6.3 供试液制备:取供试品10g,加pH7.0氯化钠-蛋白胨缓冲液(≤45℃)至100ml,振摇溶解使成1:10的供试液。6.4 试验方法(1)菌液对照组:取1ml菌液加入稀释液至100ml,另取1ml注入培养基,培养。采用平皿计数法。(2)供试品对照组:取1ml供试液,注入培养基,培养。采用平皿计数法。(3)试验组:将1ml菌液加入至制备好的供试液中,另取1ml注入培养基,培养。采用平皿计数法。进行了3次独立的平行试验,并分别计算试验组菌落数减去供试品对照组菌落数与菌液对照组菌落数的比值。测定结果见表9。6.5 测定结果按照中国药典2015年版微生物限度方法适用性试验,该供试品对金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉的回收试验中,试验组菌落数减去供试品对照组菌落数与菌液对照组菌落数的比值均在0.5~2范围内。采用平皿法可进行本品的微生物检查。[b]7. 大肠埃希菌[/b]按照中国药典2015年版微生物限度检查法进行控制菌的检查方法适用性试验及检查。7.1 菌液制备:接种大肠埃希菌的新鲜培养物至10ml胰酪大豆胨液体培养基中,30~35℃培养18~24小时,取此培养液1ml加pH7.0无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液9ml,采用10倍递增稀释法,稀释至10[sup]-5[/sup]~10[sup]-7[/sup],使菌数不大于100cfu/ml。7.2.2供试液的制备:取供试品10g,加pH7.0氯化钠-蛋白胨缓冲液(≤45℃)至100ml,药物摇匀溶解使成1:10的供试液。7.2.3试验方法(1)试验组分别取供试液10ml,加到胰酪大豆胨液体培养基100ml中,重复两份,其是一份作为供试品组,另一份再加入大肠埃希菌不大于100cfu作为试验组;另取大肠埃希菌不大于100cfu,加到胰酪大豆胨液体培养基100ml中(不加供试液)作阳性对照,30~35℃培养18~24小时。取上述培养物1ml接种至麦康凯液体培养基中,42~44℃培养24~48小时,取麦康凯液体培养物划线接种于麦康凯琼脂培养基上,置30~35℃培养18~72小时,观察结果,见表7。(2)阴性对照组取胰酪大豆胨液体培养基100ml,加入PH7.0无菌氯化钠蛋白胨缓冲液10ml作为阴性对照,30~35℃培养18~24小时,取上述培养物1ml接种至麦康凯液体培养基中,42~44℃培养24~48小时,取麦康凯液体培养物划线接种于麦康凯琼脂培养基上,置30~35℃培养18~72小时,观察结果,见表6。[img=,596,265]https://ng1.17img.cn/bbsfiles/images/2018/10/201810311820557634_9209_2204446_3.png!w596x265.jpg[/img]由表6可见,试验组可检出大肠埃希菌,阴性菌对照组未检出,本法适用于本品的控制菌检查。[b]8. 结论[/b]根据上述试验结果,本品的微生物检查可采用平皿法,控制菌检查采用常规法测定即可。三批样品测定:8.1 取供试品10g,加入pH7.0氯化钠-蛋白胨缓冲液100ml使成1:10的溶液,稀释成1:10[sup]1[/sup],1:10[sup]2[/sup],1:10[sup]3[/sup]稀释级。取各稀释级供试液1ml,置直径为90mm的无菌平皿中,然后注入15~20ml温度不超过45℃的溶化的胰酪大豆胨琼脂培养基和沙氏葡萄糖琼脂培养基,混匀,凝固,倒置培养。每稀释级每培养基各制备2个平板,平板计数。阴性对照试验:另取pH7.0氯化钠-蛋白胨缓冲液100ml,取1ml,置无菌平皿中,注入上述两种培养基中,混匀,凝固,倒置培养。每种培养基各制备2个平板。样品测定结果见表8。8.2大肠埃希菌测定取供试品10g,加pH7.0氯化钠-蛋白胨缓冲液(≤45℃)至100ml,振摇溶解使成1:10的供试液。(1)样品测定:取样品的供试液10ml,加到100ml胰酪大豆胨液体培养基中培养18~24小时。(2)阳性对照试验:取样品的供试液10ml,取大肠埃希菌10[sup]-6[/sup]稀释液1ml,加入100ml胰酪大豆胨液体培养18~24小时。(3)阴性对照试验:取pH7.0氯化钠-蛋白胨缓冲液10ml,加入100ml胰酪大豆胨液体培养基中,经培养18~24小时。取上述培养物1ml接种至麦康凯液体培养基中,42~44℃培养24~48小时,取麦康凯液体培养物划线接种于麦康凯琼脂培养基上,置30~35℃培养18~72小时,观察结果,见表7。[img=,595,566]https://ng1.17img.cn/bbsfiles/images/2018/10/201810311823378838_9210_2204446_3.png!w595x566.jpg[/img][align=left][img=,611,235]https://ng1.17img.cn/bbsfiles/images/2018/10/201810311824514031_6226_2204446_3.png!w611x235.jpg[/img] [/align][align=left]不同试验菌回收率测定结果如下:[/align][align=left][img=,690,416]https://ng1.17img.cn/bbsfiles/images/2018/10/201810311827356326_5887_2204446_3.png!w690x416.jpg[/img][img=,690,251]https://ng1.17img.cn/bbsfiles/images/2018/10/201810311827558476_8031_2204446_3.png!w690x251.jpg[/img][/align][align=left][b]总结:[/b][/align][align=left] 通过对不同培养基的适用性实验分析,本品的微生物检查可采用平皿法,控制菌检查采用常规法测定,就可以满足该产品出厂检验需求。[/align]

[color=#444444]一、[/color][b][color=#444444]以下内容为[/color][color=#444444]FDA发给中国某机构的警告信中摘抄片段。[/color][color=#444444] [/color][/b][color=#444444]You failed to routinely establish system suitabilitywhen testing samples for OSCS.[/color][color=#444444]你们在检测样品的OSCS项目时,日常检测未运行系统适用性。[/color][color=#444444]Furthermore, on December 26, 2014, you conducted asystem suitability test that failed. You did not investigate why your equipmentfailed system suitability for detection of OSCS, or determine the reliabilityof other OSCS tests conducted prior to the date of the system suitabilityfailure.[/color][color=#444444]另外,2014年12月26日,你们运行了系统适用性,但系统适用性失败。你们未调查为什么仪器的OSCS检测用系统适用性会失败,也没有确定该系统适用性失败之前其它OSCS检测结果是否可靠。[/color][color=#444444]System suitability testing determines whetherrequirements for precision are satisfied and ensures the NMR spectrometer isfit for the intended testing before analyzing samples. It is critical that yoursystem be demonstrated as suitable for detecting OSCS contamination in heparinto avoid the possibility of samples erroneously passing when an instrument isnot working properly.[/color][color=#444444]系统适用性检测决定了精密度是否满足要求,在开始样品分析之前确保NMR仪器适合既定检测。证明系统适合于检出肝素中的OSCS污染,避免仪器不正常工作时使得样品错误地通过检测是非常重要的。[/color][color=#444444][/color][b][color=#3e3e3e]二、从[/color][color=#444444]美国[/color][color=#444444]FDA警告信[/color][color=#3e3e3e]中获得的信息[/color][color=#3e3e3e](个人理解)[/color][color=#3e3e3e][/color][color=#3e3e3e]1、[/color][/b][color=#444444]You failed to routinely establish system suitabilitywhen testing samples for OSCS.[/color][color=#444444]你们在检测样品的OSCS项目时,日常检测未运行系统适用性。[/color][b][color=#3e3e3e]理解:系统适用性需要日常中进行[/color][color=#3e3e3e]而不仅仅是在方法验证中进行,即在使用中进行[/color][color=#3e3e3e]。[/color][color=#3e3e3e]2、[/color][/b][color=#444444]Furthermore, on December 26, 2014, you conducted asystem suitability test that failed. You did not investigate why your equipmentfailed system suitability for detection of OSCS, or determine the reliabilityof other OSCS tests conducted prior to the date of the system suitabilityfailure.[/color][color=#444444]另外,2014年12月26日,你们运行了系统适用性,但系统适用性失败。你们未调查为什么仪器的OSCS检测用系统适用性会失败,也没有确定该系统适用性失败之前其它OSCS检测结果是否可靠。[/color][b][color=#444444]理解:一旦系统适用性失败,需要对失败前的结果进行追溯。[/color][/b]3、[color=#444444]System suitability testing determines whetherrequirements for precision are satisfied and ensures the NMR spectrometer isfit for the intended testing before analyzing samples. It is critical that yoursystem be demonstrated as suitable for detecting OSCS contamination in heparinto avoid the possibility of samples erroneously passing when an instrument isnot working properly.[/color][color=#444444]系统适用性检测决定了精密度是否满足要求,在开始样品分析之前确保NMR仪器适合既定检测。证明系统适合于检出肝素中的OSCS污染,避免仪器不正常工作时使得样品错误地通过检测是非常重要的。[/color][b]理解:系统适用性不仅仅针对色谱系统,NMR(核磁共振)也需要做系统适用性检查。[/b][color=#3e3e3e]三、什么是系统适用性[/color][color=#3e3e3e][/color][color=#444444]1、国外关于系统适用性的定义[/color][color=#444444]2015[/color][color=#444444]年[/color][color=#444444]7月 FDA 发布了"analytical procedures and methods validation for drugs and biologics"[/color][color=#444444]《FDA分析方法验证指南》,其中[/color][color=#444444]“[/color][color=#444444]2.8 [/color][color=#444444]款[/color][color=#444444] [/color][color=#444444]系统适应性[/color][color=#444444]:[/color][color=#444444]对测试程序和参数进行确证以保证系统(仪器、数据工作站和分析操作要点和分析的控制点)能在使用时作为一个整体正确运行。适用于对照控制和样品的系统适用性的可接受标准,如拖尾因子、精密度和分辨率可接受标准,在适当时可以进行要求。色谱系统的系统适用性,参见FDA行业指南《色谱方法的验证》和USP通论色谱[/color][color=#444444]附件[/color][color=#444444]《色谱方法的验证》[/color][color=#444444]https://wenku.baidu.com/view/3f634e115f0e7cd18425367d.html?re=view[/color][color=#444444]2、国内关于系统适用性的定义[/color][color=#444444]GB/T 32467-2015中9.6款 明确了分析系统以及分析系统适应性的概念[/color][img=,690,108]http://ng1.17img.cn/bbsfiles/images/2017/08/201708112027_01_3243837_3.jpg[/img]附件:[color=#444444]GB/T 32467-2015 [/color][url=http://www.doc88.com/p-2562805803443.html]www.doc88.com/p-2562805803443.html[/url]四、为什么国内的检测实验室很容易忽略系统适用性国内的实验室认证认可主要为CNAS认可,CMA计量认证,以及一些行业认真如农业的CATL等,而相关的评审准则例如CNAS-CL01、《检验检测机构资质认定评审准则》、《食品检验机构资质认定条件》、《农产品质量安全检查机构考核评审细则》等均未对系统适应性做出明确要求,这就导致经过相关部门行政许可的检验检测实验室很容易忽略系统适用性,甚至没有什么概念。五、国内是否有相关标准或者文件对系统适用性做出明确要求呢?GB/T 32465-2015中明确了在方法验证和确认以及日常检测时要进行系统适用性的内容附件:[color=#444444]GB/T 32465-2015 [url]http://www.doc88.com/p-6764562110886.html[/url][/color][color=#444444][/color][b][color=#3e3e3e]六、那么[/color][color=#3e3e3e]如何进行[/color][color=#3e3e3e]系统适用性[/color][color=#3e3e3e]核查[/color][color=#3e3e3e][/color][/b]GB/T 32465-2015 中9.6.1明确了核查的一般原则[b][color=#3e3e3e][img=,750,399]http://ng1.17img.cn/bbsfiles/images/2017/10/2017081120583719_01_3243837_3.jpg[/img][/color][color=#3e3e3e]GB/T 32465-2015中9.6.3明确了系统适用性核查的频率[/color][color=#3e3e3e]GB/T 32465-2015中9.6.4明确了系统适用性核查的工具[/color][color=#3e3e3e](内容比较多请自行查看标准)[/color][color=#3e3e3e][/color][color=#3e3e3e]七、我们在日常检验检测过程中应如何去做[/color][color=#3e3e3e][/color][color=#3e3e3e]1、在方法使用前的确认或证实过程要明确构成系统的要素,并给出相关的技术参数指标,该指标要被证明能够满足相关要求给出准确检测结果。[/color][color=#3e3e3e]2、编制SOP时将这些指标在SOP中明确,并且要给出详尽具体操作方式。[/color][color=#3e3e3e]3、日常检测过程中要按照SOP进行系统适用性检查,通常使用质控样品。[/color][color=#3e3e3e]4、这些质控样品通常是自己进行的质控,绘制质控图用以对整个系统进行控制,参考GB/T 27407和GB/T 32464[/color][color=#3e3e3e]5、除了日常质控外还可以集合实验室比对、能力验证等手段进行系统适用性核查。[/color][color=#3e3e3e]6、同时应给出不系统的确定度(一般在方法确认或证实阶段进行,后期也需要定期进行),将不确定度结合到质控图中。[/color][color=#3e3e3e][/color][color=#3e3e3e]个人感觉第1、2、3、4款是必须进行的,5,6款可以根据自身条件进行。[/color][/b][color=#3e3e3e][/color][b][color=#3e3e3e]八、结论以及系统适用性[/color][color=#3e3e3e]核查的必要性[/color][/b]总而言之,[color=#444444]在每次日常检测前,进行系统适用性检查,看似比较繁琐,但是从法律举证角度上来说,系统适用性检查十分必要[/color][color=#444444]目前很多检测报告都涉及到食品安全、政府的监督抽检、企业委托,在涉及的不合格样品后续处理过程中需要举证。不做系统适用性检[/color][color=#444444]查[/color][color=#444444],严格来说不能够作为法庭相关证据,你在检测样品时,不能证明你的整个检测系统[/color][color=#444444]在检测时[/color][color=#444444]是可靠的,被告方完全可以以此为突破点对数据进行推翻。建议大家仔细阅读GB/T 32465-2015,来运用有依有据的手段,规避日常检测过程中的风险。[/color][color=#444444]个人感觉相关的检验检测认证认可准则也应加系统适用性方面的要求,保证出具的检测结果具有法律效力。[/color][b][color=#3e3e3e]九、[/color][color=#3e3e3e]以上内容仅为个人观点,不对之处欢迎大家指正。[/color][/b]
求教各位老师,药品的方法研究中系统适用性和方法的专属性指的是什么,该怎么做?
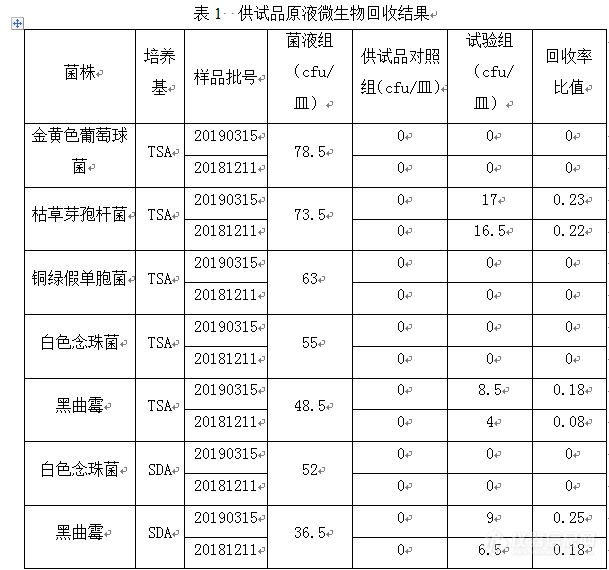
妇科止痒洗剂微生物限度检查方法适用性试验一、检验依据:《中国药典》2015年版四部1105、1106二、仪器与实验材料1、仪器 高压锅 型号:G154DW 致微(厦门)仪器有限公司生物安全柜 型号:AC2-4S1 新加坡艺思高公司生化培养箱 型号:SHP-350 上海精宏实验设备有限公司生化培养箱 型号:LRH-250 上海一恒科学仪器有限公司天平 型号:LD3102 沈阳龙腾电子有限公司恒温水温箱 型号:S.HH.W21.600S 上海跃进医疗器械有限公司2、样品 品名:妇科止痒Ⅰ号洗剂 批号:20190221;20190315;20181211 规格: 250ml/瓶 生产单位:南平市人民医院3、培养基胰酪大豆胨液体培养基(TSB)(批号:1901222)沙氏葡萄糖液体培养基(SDB)(批号:180925)胰酪胨大豆琼脂培养基(TSA)(批号:1901162)沙氏葡蔔糖琼脂培养基(SDA)(批号:190116)梭菌增菌培养基(批号:181213)哥伦比亚琼脂培养基(批号:170914)以上培养基均由北京三药科技有限公司提供;溴化十六烷基三甲铵培养基(批号:20180403)由海博生物技术有限公司提供;甘露醇氯化钠琼脂培养基(批号:3104327)由广东环凯微生物科技有限公司提供。4、菌种枯草芽孢杆菌【CMCC(B)63501】(第4代)金黄色葡萄球菌【CMCC(B)26003】(第4代)铜绿假单胞菌【CMCC(B)10 104】(第4代)白色念珠菌【CMCC(F)98001】(第3代)黑曲霉【CMCC(F)98 003】(第3代)大肠埃希菌【CMCC(B)44 102】(第5代)生孢梭菌【CMCC(B)64 941】(第3代)以上菌种均来源于广东环凯微生物科技有限公司。三、菌液制备1、接种金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、大肠埃希氏菌至胰酪大豆胨液体培养基中,经30~35℃培养18~24小时后,分别取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、大肠埃希氏菌的胰酪大豆胨液体培养基培养物1ml,用0.9%无菌氯化钠溶液,10倍稀释至10-5~10-7,做活菌计数备用,选择适宜梯度使细菌数不大于100cfu/ml。2、将生孢梭菌接种于梭菌增菌培养基中置厌氧条件下30~35℃培养24~48小时,用0.9%无菌氯化钠溶液制成菌悬液或者孢子悬液,10倍稀释至10-3~10-5做活菌计数备用,选择适宜梯度使菌数不大于100cfu/ml。3、接种白色念珠菌至沙氏葡萄糖液体培养基中,经20~25℃培养48~72小时取白色念珠菌液体培养物1ml,用0.9%无菌氯化钠溶液,10倍稀释至10-4~10-6做活菌计数备用,选择适宜梯度使菌数不大于100cfu/ml。4、接种黑曲霉至沙氏葡萄糖琼脂培养基中,经20~25℃培养7天,取黑曲霉新鲜培养物,加入5ml含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱,吸出孢子悬液用0.9%无菌氯化钠溶液进行10倍稀释至10-4~10-6,做活菌计数备用,选择适宜梯度使菌数不大于100 cfu/ml。四、计数方法适用性试验1、供试液制备 取10mL供试品,用胰酪大豆胨液体培养基稀释制成1:10的供试液,备用。2、供试品中微生物的回收试验组:取上述制备好的供试液,加入金黄色葡萄球菌菌悬液,混匀,使每1ml供试液中含菌量不大于100 cfu,取该混合液2ml(lml/皿),分别置直径为90mm的无菌平皿中,注入15~20ml温度不超过45℃相应的琼脂培养基。置规定温度、时间培养,观察计数结果。铜绿假单胞、桔草芽孢杆菌、白色念珠菌、黑曲霉均依法操作。供试品对照组:取制备好的供试液,以稀释液代替菌液同试验组操作。菌液组:取相应的稀释液代替供试液,按试验组操作加入试验菌液并进行微生物回收试验。3.结果判断计数方法适用性试验中,采用平皿法时,试验组菌落数减去供试品对照组菌落数的值与菌液对照组菌落数的比值应在0.5~2范围内,若各试验菌的回收试验均符合要求,照所用的供试液制备法及计数方法进行该供试品的需氧菌总数、霉菌和酵母菌总数计数。试验结果详见表1。[img=,609,570]https://ng1.17img.cn/bbsfiles/images/2019/09/201909152300475214_6517_2232106_3.png!w609x570.jpg[/img]表1结果表明:按此方法进行适用性检查,所有试验菌的回收比值均小于0.5,试验菌的回收比值均不在0.5~2范围内,因此采用1:10的供试液重新进行适用性试验。[img=,432,585]https://ng1.17img.cn/bbsfiles/images/2019/09/201909152302434224_4507_2232106_3.png!w432x585.jpg[/img]表2结果表明:按此方法进行适用性检查,所有试验菌的回收比值均在0.5~2范围内,故可采用制备1:10供试液按平皿法进行该供试品的需氧菌总数、霉菌和酵母菌总数计数。五、控制菌1、铜绿假单胞菌试验组:取1:10供试液10ml接种至100ml的胰酪大豆胨液体培养基中,加入54cfu/ml的铜绿假单胞菌菌悬液1ml,混匀,30~35℃培养18~24小时,取上述培养物划线接种于溴化十六烷基三甲铵琼脂培养基平板上,30~35℃培养18~72小时,观察并记录。阴性对照组:以稀释液代替供试液,不加试验菌,其他同试验组的控制菌检查。阳性对照组:不加供试液,其他同试验组的控制菌检查。供试品对照组:不加试验菌,其他同试验组的控制菌检查。[img=,650,235]https://ng1.17img.cn/bbsfiles/images/2019/09/201909152303530254_4222_2232106_3.png!w650x235.jpg[/img]2、金黄色葡萄球菌试验组:取1:10供试液10ml接种至100ml的胰酪大豆胨液体培养基中,加入72 cfu/ml的金黄色葡萄球菌菌悬液1ml,混匀,30~35℃培养18~24小时,取上述培养物划线接种于甘露醇氯化钠琼脂培养基平板上,30~35℃培养18~72小时,观察并记录。阴性对照组:以稀释液代替供试液,不加试验菌,其他同试验组的控制菌检查。阳性对照组:不加供试液,其他同试验组的控制菌检查。供试品对照组:不加试验菌,其他同试验组的控制菌检查。[img=,658,530]https://ng1.17img.cn/bbsfiles/images/2019/09/201909152305306414_5621_2232106_3.png!w658x530.jpg[/img][img=,602,169]https://ng1.17img.cn/bbsfiles/images/2019/09/201909152305386274_4226_2232106_3.png!w602x169.jpg[/img]注:+代表沙氏葡萄糖琼脂培养基平板上有典型菌落生长,-代表沙氏葡萄糖琼脂培养基平板上无典型菌落生长。4、梭菌试验组:取1:10供试液10ml,另取一份1:10供试液10ml置80℃保温10min后迅速冷却分别接种至100ml的梭菌增菌培养基中,分别加入71cfu/ml生孢梭菌菌悬液1ml,混匀,置厌氧条件下30~35℃培养48小时。取上述培养物划线接种于哥伦比亚琼脂培养基平板上,置厌氧条件下30~35℃培养48~72小时。阴性对照组:以稀释液代替供试液,不加试验菌,其他同试验组的控制菌检查。阳性对照组:不加供试液,其他同试验组的控制菌检查。供试品对照组:不加试验菌,其他同试验组的控制菌检查。[img=,674,615]https://ng1.17img.cn/bbsfiles/images/2019/09/201909152307107304_5206_2232106_3.png!w674x615.jpg[/img]
大家做系统适用性时,一般怎么排序列啊?排在样品前面?中间?还是?
最近用waters做系统适用性的时候,同一标品进的六针一般都是第一针和后面的几针差的比较多,这是什么原因呢?我觉得几针之间不应该有什么区别啊
2010版药典中许多药品用液相色谱法测定,系统适用性增加的较多,但一部分规定主峰的出峰时间及杂质的相对保留时间(例如:酒石酸美托洛尔原料、盐酸雷尼替丁原料等,实际操作中不同的柱子、不同厂家的试剂及不同的仪器要保证这些条件均符合要求有时很难满足,并且相对保留时间药典也没有规定误差是多少,不知道各位老师在实际操作中怎样掌握?
在高效液相色谱法系统适用性试验中,有常用的四个参数:分离度、柱效、重复性和拖尾因子,其中分离度和柱效是二个最重要、也更具有实用意义的参数。分离度是判断两物质在一个方法中分离的程度,虽然与柱效相关,但在衡量系统适用性时,首先强调的应该是分离度,只有当色谱图中仅有一个色谱峰或测定微量成分时,规定柱效才有其特殊重要性。由于我们国家药典对使用的色谱柱只有原则上要求,因此,在药品质量标准中制定杂质(尤其是特定杂质)检查方法时,其系统适用性试验中尽可能列入分离度用溶液和要求,显得非常重要。但我们国家的许多药品标准,往往忽略这一点,有时柱效定的也不合理,以致于造成试验判断上的误差和困难。中国药典中规定了某些色谱条件可在一定范围内调节,但无具体内容,为保证系统适用性,参照国外药典,建议某些条件的调节范围如下,供试验人员参考。(1)柱长(-50%到+100%),柱内径(±25%);(2)填料粒径(-50%);(3)流速(±5%);(4)流动相的PH值(±0.5PH单位);(5)缓冲盐浓度(相对浓度±30%,绝对浓度±2%);(6)进样体积可减小至可接受的定量精度;(7)柱温(±10℃)。由于各色谱条件对分离效果具有累积效应,故同时调节多项条件应予避免。
有谁知道waters的工作站在哪里可以把理论塔板数这个系统适用性参数调出来吗?右键点击E图标并没有找到[img]https://ng1.17img.cn/bbsfiles/images/2019/10/201910290837572404_6366_3413672_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2019/10/201910290837573164_6798_3413672_3.png[/img]
在高效液相色谱法系统适用性试验中,有常用的四个参数:分离度、柱效、重复性和拖尾因子,其中分离度和柱效是二个最重要、也更具有实用意义的参数。分离度是判断两物质在一个方法中分离的程度,虽然与柱效相关,但在衡量系统适用性时,首先强调的应该是分离度,只有当色谱图中仅有一个色谱峰或测定微量成分时,规定柱效才有其特殊重要性。由于我们国家药典对使用的色谱柱只有原则上要求,因此,在药品质量标准中制定杂质(尤其是特定杂质)检查方法时,其系统适用性试验中尽可能列入分离度用溶液和要求,显得非常重要。但我们国家的许多药品标准,往往忽略这一点,有时柱效定的也不合理,以致于造成试验判断上的误差和困难。中国药典中规定了某些色谱条件可在一定范围内调节,但无具体内容,为保证系统适用性,参照国外药典,建议某些条件的调节范围如下,供试验人员参考。(1)柱长(-50%到+100%),柱内径(±25%);(2)填料粒径(-50%);(3)流速(±5%);(4)流动相的PH值(±0.5PH单位);(5)缓冲盐浓度(相对浓度±30%,绝对浓度±2%);(6)进样体积可减小至可接受的定量精度;(7)柱温(±10℃)。由于各色谱条件对分离效果具有累积效应,故同时调节多项条件应予避免。http://www.zjyj.org.cn/jykjdetial.asp?id=269