蛋白组学和质谱组学的区别
[摘要] 质谱对于现代蛋白质化学研究是一项重要的技术。也可用于蛋白组分析,在同一时间监控上千种蛋白的表达情况。首先蛋白质混合物可以用双向凝胶电泳分开,再用质谱及随后的蛋白质数据库检索对单个蛋白进行鉴定和分析。最近几年,质谱领域取得了令人鼓舞的进展,使得全自动、高通量的蛋白检测成为可能。质谱也可以用来分析蛋白的转录后调节以及研究蛋白质复合体。本文将介绍目前蛋白组研究中质谱方法的应用并对其优缺点进行讨论。关键词: 质谱;二维电泳(2-DE);蛋白组分析MALDI-TOF1 前 言蛋白组学是研究生物特定组织或细胞内表达的所有蛋白质成分,蛋白质组的一门学科。蛋白组分析一般是用双向凝胶电泳(2-DE),质谱(MS)以及数据检索来完成。2-DE要回顾到20世纪70年代初[1],但是用质谱技术对蛋白质进行鉴定和分析是在近十年内才成为可能。其中最重要的一个原因是新的软离子技术即基质辅助激光解析电离(MALDI)[2]和电喷雾电离(ESI)[3,4]技术的发展和应用,以及样本制备技术和质谱仪的发展等。从数据库中获得成指数上升的序列信息也促进了质谱技术的发展。跟转录组学中的全自动DNA微阵列技术相比,蛋白组分析需要更多的手工操作,尤其在2-DE上会出现很多问题[5,6]。尽管存在很多困难,蛋白组学的重要性还是公认的。DNA微阵列技术是建立在对mRNA稳定水平的检测上,然而蛋白组学研究的对象是细胞中最活跃的因子——蛋白质。最近有研究证明,mRNA的表达和蛋白的水平并非具有相关性[7,8]。蛋白质有转录后修饰过程,并会以不同的形式出现。而这些修饰过程是相应的DNA测序技术所不能预测的。质谱技术在蛋白质修饰分析过程中具有重要的作用。2 质谱对蛋白质的检测质谱仪是由离子源,质量分析,离子检测器,以及数据检索等单元组成。首先,被分析的分子在离子源中被离子化,然后在质量分析器里根据不同的质荷比分开,再对分开的离子进行检测。随着MALDI和EIS的出现,质谱技术已经广泛用来分析蛋白质。质量分析器有很多种,最常用的方法是将飞行时间检测器(TOF)与MALDI或三级四级串联质谱仪联用,或者将四级杆-TOF,离子阱等连接到ESI上。蛋白组分析中,可以用两种不同的方法检测电泳分离后的单个蛋白质。最简单的方法叫做肽指纹谱测定(PMF)[9~13]。这个方法是用特殊的酶对2-DE分离后的蛋白质点进行降解,产生的肽从凝胶中分离出来后再用质谱分析和检测肽的分子量。数据库检测能够产生所有蛋白质理论上的PMF,把它们和质谱分析所获得的肽片进行比较就可以得出结果。第二种方法是在质谱仪中把凝胶分离后的肽分解成片段,产生局部的氨基酸序列(序列标签)。那么就可以用分子量或者序列信息进行数据库检索[14,15]。PMF一般用MALDI-TOF来实现,序列标签可以用串联质谱技术MS-MS进行检测[16~18]。用质谱检测蛋白的灵敏性可以精确到飞摩的水平,甚至已有报道其精确度可以达到阿摩水平[19]。3 用MALDI-TOF进行肽指纹谱分析凝胶分离后的蛋白质鉴定以及肽指纹谱分析是目前质谱实验室常规使用的方法。在进行MALDI分析之前需要最优化的凝胶上消化[20~22]和脱盐过程。胰岛素是最常用的凝胶消化酶,因为它在赖氨酸和精氨酸位点能够特异性切割蛋白质,产生分子量在600~2500Da之间的小分子肽,并能够从凝胶上有效的分离出来。MALDI-TOF是质谱技术中相对简单并很容易使用的一种方式,对样本中的盐和其他污染物有很高的耐受性,这点优于ESI。提取的肽片混合物中较小的片段可以直接沉积在靶板上做PMF分析,剩下的样本可以储存起来作为以后的ESI-MS分析。如果经凝胶分离后所有的肽全用来做MALDI分析,那么样本经脱盐以后将会取得更好的结果。脱盐的过程可以用商品化的试剂盒ZipTip(Millipore),或者在凝胶电泳仪的末端放置一个小的逆向塑料柱来实现[23,24]。PMF中非常重要的一个因素就是质谱测量分子量的准确度[25]。现代的MALDI-TOF仪都具有延迟取样反射器装置,用它们检测的肽段分子量可以精确到10~30ppm。这样的精确度使得4~5个肽段足以清楚的鉴定蛋白质的分子量。MALDI产生的大多数都是单电荷离子,所以它的图谱很容易解释。4 肽质指纹谱分析的自动化为了实现高通量蛋白检测,样本准备,质谱检测,资料分析和数据检索必须实现自动化操作。目前有些实验室用机器人对蛋白质进行自动化取点,凝胶上消化,样本脱盐以及对MALDI平板进行定点测定等。而且,现代化的MALDI-TOF仪完全能够让MALDI检测自动化。资料分析和数据检索过程同样可以自动化。在进行蛋白组分析时,如果在凝胶上不用单个分离就可以对所有蛋白质进行鉴定将是非常具有诱惑力的。为此,研究人员做了很多努力,由Hochestrasser及其同事建立了一套称作分子探测术的方法(molecular scanner)[26,27]。它是将整个2-DE胶上蛋白质样本同时酶解,并将酶解片段一起原位转移至另一张膜上,再直接用MALDI- TOF 质谱对膜上样本进行整体扫描,为实现蛋白质组学研究的自动化、规模化以及临床应用提供了一个崭新的思路和方法。这种思路的优点是显而易见的,不过按照目前的方法,要普及此种技术主要的难点是,质谱扫描一张图谱所需的时间过长,如用0.4mm的精度扫描一张4cm×4cm的膜需55个小时,这就意味着一张16cm×16cm的常用膜的扫描,至少需要36天不间断的工作和大约40G的磁盘空间存储如此庞大的原始数据。5 用ESI-MS/MS的方法创建序列标签只有当被消化的蛋白存在于已有的蛋白或基因组数据库中,并且能从MALDI分析器中得到四五个肽片的数据才能成功进行。如果在EST数据库中只有目的蛋白的部分序列,那么就需要知道肽片的序列信息。创建序列标签的优势在于,用肽的分子量和序列作为数据库检索对象比只用分子量作为检索对象具有更高的特异性。有了序列标签信息后,也可以用EST数据库进行检索[28]。通常来自于一个肽上的序列标签就足以鉴定蛋白质。同MALDI相比,纳升-ESI-MS/MS费时费力,而且在做ESI分析之前必须对样本进行脱盐处理。这些问题可以通过ESI-MS与HPLC联用得到解决。做ESI分析对样本浓度很敏感,用现代化的纳升-HPLC方法可以提供很高的局部肽片凝聚物,分离后的样本可以直接用于质谱分析,而不需要再分解。当分析混合物的时候,在质谱之前做LC分离尤其重要,因为它使得数据依赖的实验(DDE)成为可能,在DDE中,所有的离子都进入检测器进行测量,如果从HPLC到质谱之间出现一个峰的话,软件将自动从质谱转换到MS/MS模式并对产生的离子进行扫描。跟纳升-ESI相比,用这个方法可以从一份标本产生更多的MS/MS数据。Yates等已经详细叙述了如何进行[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS全自动蛋白检测的策略[29]。
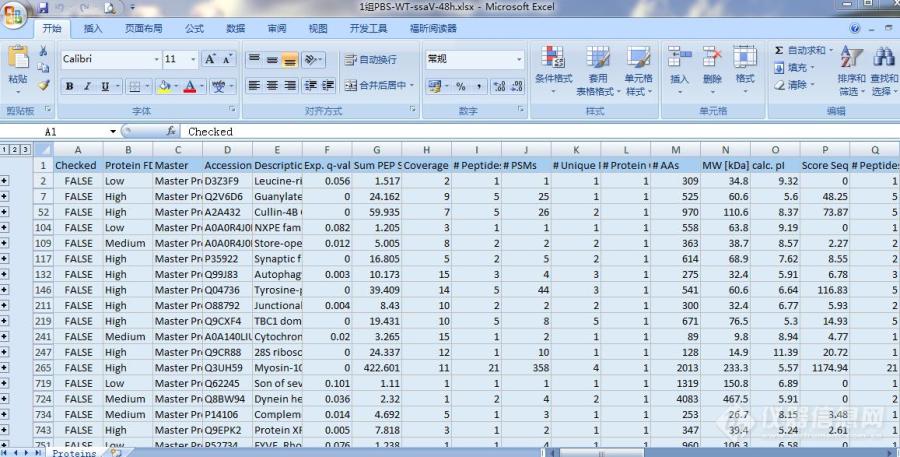
[img=,690,350]https://ng1.17img.cn/bbsfiles/images/2019/11/201911271720191732_5668_3311681_3.jpg!w690x350.jpg[/img]1.蛋白组学下机数据,请问q.value有些是0,代表什么意思。2.该组数据得出的是Abundance Ratio: (Medium, F2) / (Heavy, F2)这样的一个蛋白在中标和轻标样本里面表达丰度的比值,这种情况下还需要做P值校正吗?还是直接卡表达量的变化倍数就可以说明它是表达上升还是下降了
我们单位要做蛋白组学,可是自己又是新手,最近一直在联系几个公司想买一台[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url], 但是又不知道哪个厂家的最合适。现在可以供考虑的就是:1)Thermo-fisher (和finnigan是不是一家啊?)2) varian3) waters4) agilent5) shimadzu其实如果不考虑品牌,不考虑预算,主要想知道哪一种mass analyser(或者串联的)最适合于做蛋白组学(定性,定量),哪位大虾知道的话告诉我吧。还有就是:obitrap这种mass analyser的应用主要在哪些方面呢?好像是比较新的技术,成熟么?谢谢了
hey,大家好,不知道这里有没有蛋白组实验室的,想交流一下关于质谱性能测试样品的选择。我指的不是校正液哦。一般我们实验室就是平常自己BSA酶切后上质谱来看多肽峰的丰度,保留时间,当然搜库后还可以看看序列覆盖度等。有时评估一些前处理的技术有时也会用到BSA酶切后的多肽。我想问一下国内有没有卖已经酶切好的BSA?或者有没有比较便宜的TPCK-trypsin可以买? 老是用promega的质谱级胰酶切BSA感觉有点贵。谢谢了!
1994年,Marc Wilkins在Siena双向凝胶电泳(two-dimensional electrophoresis,2-DE)会议上最早提出了蛋白质组(proteome)概念,并于1995年7月的Electrophoresis杂志上发表。随着高通量、高灵敏度、高分辨率生物质谱技术的出现,蛋白质组学技术取得飞速发展,人们不再满足于对一个细胞或组织的蛋白质进行定性研究,而是着眼于蛋白质量的研究,于是蛋白质组学概念就被提出,并得到了广泛的应用。蛋白质组学(Proteomics)是蛋白质(protein)与 基因组学(genomics)两个词的组合体,表示“一种基因组所表达的全套蛋白质”,即包括一种细胞乃至一种生物所表达的全部蛋白质。蛋白质组学研究,就是要把一个基因组表达的绝大多数蛋白质或一个复杂的混合体系中绝大多数蛋白质进行精确的定量和鉴定。蛋白质组本质上指的是在大规模水平上研究蛋白质的特征,包括蛋白质的表达水平,翻译后的修饰,蛋白与蛋白相互作用等,由此获得蛋白质水平上的关于疾病发生,细胞代谢等过程的整体而全面的认识。蛋白质组学是一门以全面的蛋白质性质研究为基础,在蛋白质水平对疾病机理、细胞模式、功能联系等方面进行探索的科学。目前最新的iTRAQ蛋白定量分析技术在此基础上被提出,并被得到广泛应用。仅仅知道蛋白质的身份并不足以对蛋白质给出最终定论,因为蛋白质的浓度对于实现其在细胞中的功能来说极其重要,一种特殊蛋白质在浓度上的变化,就能预示细胞的突变过程。因此,科学家能够对蛋白质的相对和绝对浓度进行测量,是很重要的事情。过去,科学家通常先进行二维(2D)凝较电泳,切断条带,再用质谱方法测量条带中的蛋白质。可是,这种方法不是很理想:既不是非常敏感,也不是非常精确。新泽西医学及牙科大学的蛋白组学研究中心主任Hong Li说:“当我们开始蛋白组学研究时,就采用2D凝胶技术,但得出的信息量却让大伙很失望,因为许多蛋白质已经改变了自身的代谢过程,如热休克蛋白或者是管家蛋白。”蛋白组学中的方法一直在不断提高。基于高度敏感性和精确性的串联质谱方法,不需要凝胶,就可以获得相对和绝对定量的蛋白质结果。iTRAQ和iCAT是这些新进展中的两大主力,但是,新技术也有不尽如人意的地方,需要不断改进。iTRAQ技术是由美国应用生物系统公司(Applied Biosystems Incorporation,ABI)2004年开发的同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)技术,是一种新的、功能强大的可同时对四种样品进行绝对和相对定量研究的方法,这种方法是建立在iTRAQ试剂的基础上。上海舜百生物公司目前所采用的就是这种iTRAQ技术。该技术的主要特点在于:1. 分离能力强、分析范围广;2. 定性分析结果可靠,可以同时给出每一个组分的分子量和丰富的结构信息;3. MS具备高灵敏度、检测限低;4. 分析时间快,分离效果好;5. 自动化程度高;6. iTRAQ技术不仅可发现胞浆蛋白,还有膜蛋白、核蛋白、胞外蛋白。iTRAQ技术可检测出低丰度蛋白、强碱性蛋白、小于10KD或大于200KD的蛋白。上海舜百生物使用的液相色谱仪的型号是日本岛津公司2D-nano-HPLC,质谱仪型号是美国ABI公司的MALDI-TOF-TOF 4700,标记试剂盒是美国ABI公司的ITRAQ标记试剂盒。舜田生物所采用的iTRAQ试剂是一种小分子同重元素化学物质,包括三部分:一端是报告部分(reporter group ),另一端是肽反应部分(peptide reactive group),中间部分是平衡部分(balance group)。 其中,reporter group:质量为114Da、115 Da、116 Da、117 Da,因此iTRAQ试剂共四种。 peptide reactive group:将reporter group与肽N端及赖氨酸侧链连接,几乎可以标记样本中所有蛋白质。 balance group:质量为31 Da、30 Da、29 Da、28 Da,使得四种iTRAQ试剂分子量均为145 Da,保证iTRAQ标记的同一肽段m/z相同。舜百生物公司iTRAQ的操作程序如下:将蛋白质裂解为肽段,然后用iTRAQ试剂进行差异标记。再将标记的样本相混合,这样就可以对其进行比较。与样本结合后,通常用MudPIT多维蛋白质鉴定技术进行下一步的操作,用2D液相色谱串联质谱进行分析。在质谱分析鉴定特殊肽离子片断结构的基础上,采用美国应用生物系统公司的软件包MASCOT和Protein Pilot对每一个肽段进行鉴定。其具体操作如下图所示: http://img.dxycdn.com/trademd/upload/userfiles/image/2013/11/A1383890263png_small.jpgiTRAQ技术对检测标本也有一定要求。舜百生物要求检测蛋白量最低不少于50 ug,浓度最低不少于5 ug/uL,否则同位素无法标记。而对蛋白提取试剂也要求使用普通的组织、细胞裂解液即可,切忌不要使用二维电泳试剂提取。iTRAQ技术区别与以往二维电泳技术具有更明显的优势,两者比较如下:1. 二维电泳所检测的发生表达变化的蛋白都位于细胞浆内,而iTRAQ可检测到蛋白有胞浆蛋白外,还有线粒体蛋白、膜蛋白和核蛋白。2. 二维电泳观察到的蛋白变化在2倍以上,而用iTRAQ计算出的蛋白变化在1.3-1.6倍之间。3. iTRAQ技术在鉴定大分子和小分子蛋白方面也有优势。4. 二维电泳是通过切断条带,再用质谱方法测量条带中的蛋白质,但该方法既不是非常敏感,也不是非常精确,获取的信息量很少。 而itraq技术是基于高度敏感性和精确性的串联质谱方法,不需要凝胶,就可以获得相对和绝对定量的蛋白质结果。5. iTRAQ可以对任何类型的蛋白质进行鉴定,包括高分子量蛋白质、酸性蛋白质和碱性蛋白质,而二维电泳对这些蛋白质都束手无策。由此,舜百生物得出结论:iTRAQ技术比二维电泳技术能发现更多数量和种类的蛋白,但在比较胞浆蛋白及蛋白量的变化方面,二维电泳技术有一定长处,对iTRAQ的实验结果有互补作用。
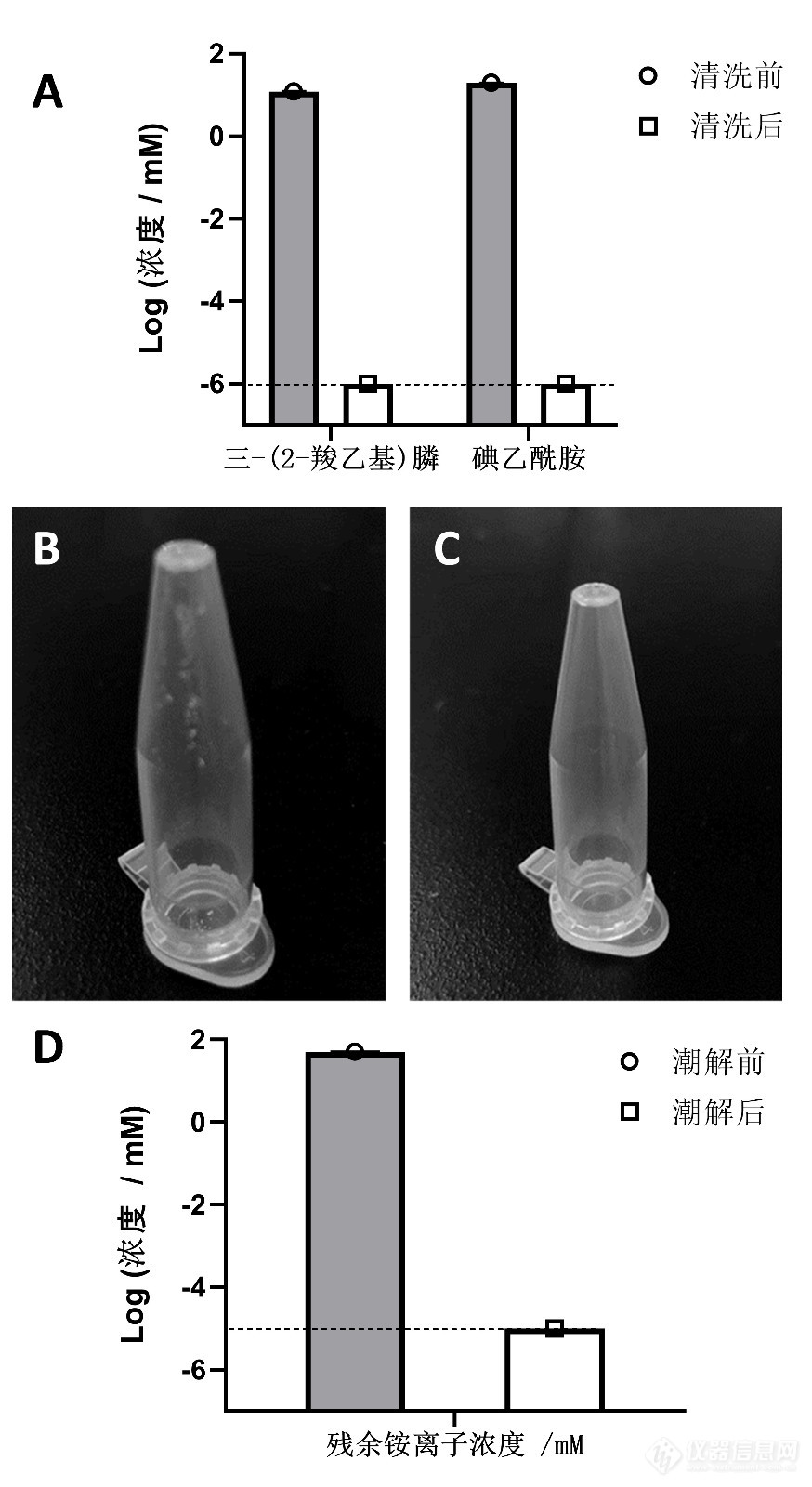
[align=center]免脱盐柱除盐的蛋白组学前处理方法[/align][align=center]季学猛,史爱莹,张 燕,王 硕[/align][align=center](南开大学 医学院, 天津 300071)[/align]摘 要:现有的蛋白组样品前处理中脱盐柱除盐的方法存在步骤繁多、易损失微量样品等缺点。这里,一种超滤管辅助酶解及加热潮解除盐的蛋白组学前处理方法被提出。具体而言,是利用超滤管辅助,通过离心在酶解前将缓冲液置换成碳酸氢铵溶液,酶解后多肽溶液中的碳酸氢铵被加热除去,最终得到脱盐的纯净多肽。该方法操作简便,无需洗脱步骤,可以方便地与[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]直接衔接,而且可以减少前处理引起的氨基酸残基去酰胺和氧化修饰,有利于蛋白组学及其蛋白修饰分析。关键词:蛋白组学;样品前处理;脱盐柱 加热 碳酸氢铵中图分类号:O657.63 文献标识码:[align=center]An Improved Proteomic Pretreatment Method without Desalination Column [/align][align=center]JI Xuemeng,SHI Aiying,ZHANG Yan,WANG Shuo[/align][align=center](School of Medicine, Nankai University, Tianjin 300071, China)[/align]Abstract: The existing method for desalting protein samples in pre-processing is associated with several drawbacks, including a high number of procedural steps and the potential loss of minute sample quantities. In this context, a novel protein sample pre-processing method is proposed, which utilizes ultrafiltration tubes to assist in enzymatic digestion and employs heat-induced desalting. Specifically, the ultrafiltration tubes are employed to facilitate the replacement of the buffer solution with an ammonium bicarbonate solution via centrifugation before enzymatic digestion. Subsequently, following enzymatic digestion, the ammonium bicarbonate within the peptide solution is removed through a heating process, ultimately yielding desalted and pure peptides. This method offers simplicity in operation, eliminates the need for elution steps, enables seamless integration with [url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url], and serves to mitigate the formation of amino acid residue deamidation and oxidation modifications that may be induced during pre-processing, thereby benefiting both proteomics and protein modification analyses.Key words: Proteomic analysis Sample pre-treatment Desalting column Heating Ammonium bicarbonate通过高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]串联质谱对生物系统中全蛋白进行定性定量,已经成为一种主流的分析工具。通过高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]串联质谱对生物系统中全蛋白进行定性定量,已经成为一种主流的分析工具。大规模的蛋白组研究依赖于蛋白被切割成肽段,然后进行后续的定性定量分析。目前,蛋白组学样品前处理方法通常使用胰蛋白酶将蛋白质样品切割成多肽。胰蛋白酶的最适作用pH为7.5-8.5[sup][back=yellow][1][/back][/sup],碳酸氢铵是质谱预处理中最常用到的一种盐,50mM碳酸氢铵水溶液可以提供酶解过程需要的弱碱性环境。然而,碳酸氢铵在酶解过程中大量存在,容易影响后续质谱分析。目前常用反相C18树脂去除盐和缓冲液[sup][back=yellow][2-4][/back][/sup]。多肽在高水相流动相中与反相柱结合,盐和缓冲液被洗去,然后用高有机相流动相洗脱多肽。然而,多肽对C18吸附性有差异,包括磷酸化多肽在内的亲水肽可能不能与C18树脂很好地结合,疏水性强的多肽与C18树脂可能结合牢固,不易被洗脱[sup][back=yellow][5-7][/back][/sup],这些问题可能导致样品的损失;而且,用来洗脱多肽的有机溶剂还需进一步通过真空离心干燥去除,极性较小的有机溶剂还可能溶解塑料制品中聚合物,造成多肽样品的聚合物污染,导致质谱峰偏移[sup][back=yellow][8,9][/back][/sup]。这些问题可能导致蛋白质检出种类减少、重复性差、甚至无检出信号等问题。基于这种临床和科研上的需求, 需要对蛋白组学样品前处理方法进行改进。1? 实验原理蛋白质组学是后基因组时代的产物。基因需要依赖于转录和翻译后后的产物蛋白质行使功能。基因组是固定不变的,而蛋白质组会响应环境的变化。因此,同一生物在生物体不同部位、生命的不同时期以及不同的环境中,具有不同的蛋白质表达。人类基因组测序计划的完成并没有给人提供解开生命的密钥,科学家把兴趣转到蛋白质,希望通过蛋白质组的研究来进一步解开生命的本质。目前鸟枪法是蛋白质组学分析应用最广的分析策略[sup][back=yellow][10-12][/back][/sup]。该方法先将蛋白酶解成肽段,然后通过色谱分离肽段混合物,再用质谱的电喷雾电离(ESI)技术将肽段碎裂,根据碎裂谱图的离子峰信息进行数据库搜索来鉴定肽段,最后将鉴定的肽段进行组装、重新归并为蛋白质[sup][back=yellow][13][/back][/sup]。电喷雾电离具体包括以下几个过程:样品首先通过一个毛细管喷针被喷出来,进入质谱仪,在喷针的外面用鞘气加热样品,辅助样品的雾化。加热雾化过程中溶液中的流动相或者溶剂挥发,剩下的气态离子在毛细管喷针尖端被电离。这些离子在质谱仪入口处被真空抽到质谱仪里,电场驱动进入质谱仪进行分子量的检测[sup][back=yellow][14][/back][/sup]。一般来说,电喷雾质谱法对盐类的容忍度较低。一方面是因为小分子盐类在电喷雾系统中存在较强的竞争性电离效应,从而导致强烈的离子抑制效应,使待测物的灵敏度明显降低[sup][back=yellow][15][/back][/sup]。其次,盐类的存在会产生一系列的离子加成峰,这使得谱图的解析变得复杂[sup][back=yellow][16-18][/back][/sup]。此外,过多的盐分会腐蚀和污染质谱系统的硬件,严重时导致硬件损坏,需要及时清洗[sup][back=yellow][19][/back][/sup]。因此,蛋白组学样品前处理过程中,脱盐步骤是非常必要的。2? 存在问题为减少机器的损坏,并且提高检测灵敏度,上机前一般都会要求对蛋白组学样品脱盐处理。目前脱盐常用的方法是反相C18树脂脱盐柱法。脱盐柱法分为结合、清洗、洗脱三步。首先,利用疏水相互作用,多肽在高水相流动相中与反相柱结合。然后,使用水反复清洗盐和缓冲液。最后,用有机溶剂破坏多肽与C18的结合,洗脱多肽。然而,该方法存在一系列的弊端,比如多肽对C18吸附性有差异,包括磷酸化多肽在内的亲水性比较强的多肽可能不能与C18树脂很好地结合,会造成结合阶段的样品损失,而疏水性强的多肽与C18树脂结合牢固,洗脱阶段却难以洗脱下来,所以亲水性强的多肽和疏水性强的多肽都会在脱盐柱脱盐过程中损失,进而导致样品的选择性偏好,会损坏质谱结果的客观性。而且,最终多肽样品上机前需要在0.1%甲酸溶液中溶解,因此,有机溶剂洗脱后的多肽不能很好的与[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]衔接,还需真空离心干燥去除有机溶剂。使用有机溶剂洗脱样品可能会造成样品的PEG聚合物污染,导致质谱峰偏移。这些问题导致脱盐柱脱盐后的蛋白组学样品重复性差、检出蛋白质种类低问题,因此亟需一种脱盐柱脱盐的替代方法。3? 改进措施将酶解前超滤管中的缓冲液通过反复离心置换成碳酸氢铵水溶液。酶解后利用碳酸氢铵加热潮解的特性除去多肽溶液中的碳酸氢铵成分,最终得到纯净的多肽。多肽样品溶解在0.1%甲酸溶液中后可以直接上机检测。4? 改进后效果首先取100μg蛋白样品,用6 M 盐酸胍稀释至400μL。加入10μL 500mM 三-(2-羧乙基)膦、 8 μL 1M 碘乙酰胺,混匀。室温避光振荡反应 40 min。将样品转移至10KD超滤管,室温10000g离心30分钟。加入400 μL 50mM碳酸氢铵溶液置换5次。用200 μL 50 mM 碳酸氢铵溶液垂悬,加入2μg胰蛋白酶,于37 ℃酶解过夜。10000g离心10分钟,收集滤液。真空离心干燥滤液,干燥后观察管底,如有白色盐粉末,加入少量超纯水溶解白色盐,转入75℃金属浴烘干,碳酸氢铵在烘干过程中分解挥发。上机前加入50μL 0.1% 甲酸溶液,装入超洁净样品瓶,上机检测。4.1 潮解脱盐效果评估利用高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url](HPLC)分析表明,在五次洗涤步骤后 ,三-(2-羧乙基)膦和碘乙酰胺的浓度至少降低了100000倍,并且降至检测阈值以下,表明五次连续洗涤足以将杂质降低到不干扰的水平([color=#c45911]图1A[/color])。酶解后,离心[color=black]收集到滤液200μL。试纸法测滤液pH,呈弱碱性(pH 7.5-8.0)。[/color]多肽样品经过真空离心干燥后,观察管底,可见白色盐粉末,如[color=#c45911]图1B[/color]所示。加入2μL 超纯水溶解白色盐,转入75℃金属浴烘干,碳酸氢铵在烘干过程中分解挥发,白色粉末消失,如[color=#c45911]图1C[/color]所示。用200[color=black]μL超纯水复溶多肽,测pH为7.0。[/color]这些结果说明碳酸氢铵被去除。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411135143_5595_5680383_3.jpg[/img][color=#c45911]图1 [/color][color=#c45911]脱盐的效果与验证。A:高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url](HPLC)分析图;B:多肽干燥后可观察到管壁上残留白色盐分;C:加热碳酸氢铵潮解后管壁上白色盐分消失; D:潮解前后的氨离子浓度对比图。数据来自三次独立重复实验(n = 3)。[/color]为了直接确认碳酸氢铵的去除,采用分光光度尼斯勒试剂法对氨浓度进行定量。分光光度尼斯勒试剂法包括以下步骤:将样品用去离子水稀释,向样品中加入一定量的分光光度尼斯勒试剂,封闭瓶子并摇动,让混合物静置5-10分钟,使用分光光度计在紫外-可见光谱范围内的波长630nm处测量吸光度,通过相同方法处理一系列氨标准溶液,测量吸光度值并绘制标准曲线,最后,通过使用样品的吸光度值查找标准曲线上相应的氨离子浓度来计算样品浓度。实验结果显示氨离子浓度从50 mM降低到不到10 nM,证实了通过热力潮解去除碳酸氢铵的有效性([color=#c45911]图1D[/color])4.2 新方法对不同分子量的蛋白质进行的蛋白质回收性能的研究蛋白质的分子量分布范围很大,从几千到几十万道尔顿不等。为了研究在酶解之前,超滤管辅助酶解及加热潮解除盐的蛋白组学前处理方法(以下称为新方法)在蛋白质回收方面是否存在偏好,在酶解前比较了溶液法(in-solution)、过滤辅助样品制备法(Filter-Aided Sample Preparation, FASP) 和本研究提出的新方法中的蛋白质回收率。蛋白质定量采用了与还原剂相容的BCA蛋白质测定试剂盒,吸光度在分光光度计(Agilent Technologies,美国)上以562纳米的波长读取。在本研究中测试的蛋白质包括细胞色素C(约12.4 kDa)、绿色荧光蛋白(GFP)(约27 kDa)、抗凝血酶III(约58 kDa)、转铁蛋白(约80 kDa)、免疫球蛋白G(IgG)(约150 kDa)和纤维连接蛋白(具有广泛的分子量范围,通常超过200 kDa)。实验进行了三次重复,并使用小提琴图来呈现结果。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411144597_3153_5680383_3.jpg[/img][color=#c45911]图2使用溶液法、过滤辅助样品制备法和新方法对不同分子量的蛋白质进行的蛋白质回收率评估图。[/color]结果清晰地表明,在不同分子量的蛋白质中,无论是在溶液法、过滤辅助样品制备法还是新方法中,所有三种方法在蛋白质回收率方面均达到了80%以上(图2)。总的来说,在所测试的分子量范围内,过滤辅助样品制备法和新方法之间的蛋白质回收率没有显著差异。然而,值得注意的是,对于低分子量蛋白质,溶液方法展现了略高的回收率,这可能归因于使用了10 kDa分子量截止滤器。 具体来说,对于低分子量蛋白质细胞色素C,过滤辅助样品制备法和新方法的平均回收率分别为85%和83%,而溶液方法的回收率为96%。然而,随着蛋白质分子量的增加,过滤辅助样品制备法和新方法的回收率显著提高。例如,对于分子量约为27 kDa的绿色荧光蛋白(GFP),过滤辅助样品制备法和新方法的回收率约为93%,而溶液方法对GFP蛋白的回收率为97%。此外,对于分子量超过50 kDa的较大蛋白质,如抗凝血酶III,使用过滤辅助样品制备法和新方法的回收率与溶液方法没有显著差异,均达到约98%。可见,本发明方法在蛋白质酶解之前对不同分子量的蛋白质回收率能达到83%至98%范围,达到了较好的蛋白截流作用。4.3新方法中潮解脱盐对不同大小和亲水性的肽段回收性能的研究为了探究不同方法酶解后对不同分子量的肽段进行潮解除盐的潜在偏好,对潮解法脱盐和C18脱盐的多肽回收率进行比较分析。在脱盐过程之前和之后,使用高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url](HPLC)测量了肽段的浓度。使用了一个反相柱,并监测了220 nm处的吸光度。受测试的肽段包括亮氨酸脑啡肽(分子量:555.68 Da,由五个氨基酸组成)、血管加压素(分子量:1084.23 Da,由九个氨基酸组成)、生长抑素(分子量:约1637.89 Da,由十四个氨基酸组成)和胰高血糖素(分子量:约3483.87 Da,由二十九个氨基酸残基组成),三次重复实验的结果呈现在小提琴图中(图3A)。结果显示,通过C18柱脱盐得到的回收率在75%到90%之间,与肽段的分子量之间没有明显的相关性。这可能是由于在C18柱脱盐过程中样品损失的因素,比如柱子的结合性能和洗脱效率。相比之下,潮解脱盐在所有测试的肽段中实现了超过96%的回收率,而不受它们的分子量影响。这一结果表明,潮解脱盐在回收不同分子量的肽段方面非常有效。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411149252_2052_5680383_3.jpg[/img][color=#c45911]图3肽段回收性能比较。A:使用两种脱盐方法(潮解去盐和脱盐柱脱盐)评估不同分子量的肽段回收率;B:使用潮解去盐和脱盐柱脱盐对高亲水性和疏水性肽段进行比较回收分析;实验均进行了三次独立的重复。[/color]接下来,使用C18脱盐柱脱盐和潮解脱盐对高亲水性和疏水性肽段的回收率进行了比较分析。选择了抗菌肽(Cat. No. LL37-05MG)和细胞穿膜肽(CAS号:697226-52-1)分别代表疏水性和亲水性肽段。结果显示,脱盐柱脱盐对抗菌肽和细胞穿膜肽的回收率相对较低,平均回收率分别为45%和39%。相比之下,新方法潮解除盐后对这两种肽段都实现了超过95%的回收率,而不受它们的亲水性影响(图3B)。这些发现表明,脱盐柱脱盐中的回收率受到肽段亲水性的影响。这可能归因于脱盐柱脱盐依赖于疏水相互作用将肽段结合到C18柱树脂上,然后使用亲水溶剂进行洗脱,这可能导致不同亲水性的肽段被选择性保留。另一方面,潮解脱盐提供了原位操作的优势,从而在脱盐过程中避免了肽段的损失。我们的研究结果表明,潮解脱盐不会导致肽段的损失,并实现了比C18柱脱盐更高的多肽回收率。4.4 新方法在实际蛋白质组学分析中的应用比较小鼠肠组织用PBS磷酸盐缓冲液润洗两次,以去除任何残留物质,然后与蛋白酶抑制剂混合。将组织使用组织研磨仪进行破壁,然后在冰浴中使用超声波(200W)裂解,直到悬浮液变清澈。通过孔径为0.22μm的微孔滤器纯化得到裂解物。使用BCA分析试剂盒测定蛋白质浓度。随后,采用三种方法进行了酶解:溶液法、过滤辅助样品制备法和新方法[color=black](蛋白组学原始数据保存于PXD044209)[/color]。酶解后,使用高性能[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]将蛋白质分离,并使用QE质谱仪进行分析。具体来说,酶解后的肽样品采用Q Exactive Plus质谱仪联用EASY nano[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]系统进行分析,该系统配备了EASY纳米电喷雾接口。色谱装置包括Pepmap纳米捕获柱(C18,5 μm,100 ?,100 μm × 2 cm)和EASY-Spray柱(Pepmap RSLC,C18,2 μm,100 ?,50 μm × 15 cm)。在色谱梯度中使用溶剂A(0.1%甲酸)和溶剂B(80% CH3CN/0.1%甲酸),梯度如下:0–8% B持续3分钟,8–28% B持续42分钟,28–38% B持续5分钟,38–100% B持续10分钟。质谱数据经Maxquant软件处理,Maxquant分析考虑至少具有两个肽段的蛋白质,并根据特定的参数和说明搜索UniProt数据库。修饰方面,半胱氨酸的烷基化修饰被设置为固定修饰,而氧化(M)被考虑为可变修饰。设置蛋白质为胰蛋白酶的特异性剪切,最多允许两个漏切位点。片段质量容差设置为0.02 Da。为确保可靠的鉴定,要求蛋白质和肽段的最大假阳性发现率(FDR)均为1.0%。蛋白质的鉴定基于至少有一个唯一的肽段鉴定,而蛋白质的定量是通过计算每个蛋白质的唯一肽段的中位数来执行的。每种方法产生了不同的蛋白质鉴定结果,如[color=#c45911]图4A[/color]所示。总体而言,新方法鉴定的蛋白质数量最多(2975±52),其次是过滤辅助样品制备法(2964±102),最后是溶液法(2803±57)。每种方法的已鉴定肽段数量如[color=#c45911]图4B[/color]所示。使用溶液法,鉴定了10931±16个独特的肽段。过滤辅助样品制备法和新方法分别鉴定了10981±48和10959±23个独特的肽段。平均而言,在溶液法中每个蛋白质匹配到3.90个独有肽段,在过滤辅助样品制备法中匹配到3.70个独有肽段,在新方法方法中匹配到3.68个独有肽段。这表明新方法表现出最高的蛋白质鉴定效率。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411151149_9928_5680383_3.png[/img][color=#c45911]图 4 不同蛋白组学前处理方法在实际蛋白质组学分析中的应用。A:使用三种方法(溶液法、过滤辅助样品制备法和新方法)比较蛋白质鉴定结果;图B为每种消化方法鉴定的独特肽段,结果代表了三次生物学实验;图C为使用组内相关系数(ICC)评估无标签定量分析的可重复性;每种方法都有三次生物学重复。[/color]随后,使用ICC评估无标签定量分析的可重复性([color=#c45911]图4C[/color])。发现新方法显示出最佳的可重复性,平均ICC值为0.622,有1375个蛋白质的ICC值大于0.4。过滤辅助样品制备法表现出稍弱的可重复性,平均ICC值为0.533,有1180个蛋白质的ICC值大于0.4。相比之下,溶液法的可重复性最差,平均ICC值仅为0.477,有1017个蛋白质的ICC值大于0.4。4.5 新方法有助于减少氨基酸残基的不利修饰[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310271411148874_7284_5680383_3.png[/img][color=#c45911]图 5 样品制备方法对氨基酸残基修饰的影响。A:比较三种样品制备方法(溶液法、过滤辅助样品制备法和新方法)引入的单氧化修饰;B:三种方法对氨基酸残基脱酰胺化修饰的影响,该实验作为生物学重复进行了三次。[/color]氧化修饰和去酰胺修饰通常在天然蛋白质和多肽样本中被观察到,研究这些修饰对于理解蛋白质的固有应激至关重要。然而,样品预处理引起的人为修饰可能会对修饰蛋白组学分析带来挑战。为了评估在样品处理过程中引入的这些不利修饰对样品的影响,我们比较了三种方法:溶液法、过滤辅助样品制备法和新方法,关于它们对氧化和去酰胺修饰的影响。我们鉴定和定量了不同数量的单氧化和去酰胺修饰,但未检测到双氧化和三氧化修饰。在这三种方法中,新方法和溶液法显示出相对较低水平的单氧化修饰([color=#c45911]图5A[/color])。此外,新方法还减少了非必要的去酰胺修饰([color=#c45911]图5B[/color]),鉴定了具有去酰胺修饰的蛋白质最少(473±8),其次是溶液法(485±23),最后是过滤辅助样品制备法(544±23)。考虑到有机溶剂中的羟基可以与酰胺键形成氢键,因此在溶液法和过滤辅助样品制备法中观察到较高水平的去酰胺修饰可能归因于在去盐过程中使用有机溶剂,而新方法更加高效的样品处理可能有助于减少人为的氧化修饰。总之,新方法有效减少了氨基酸残基的去酰胺和氧化修饰。5? 结语南开大学医学院实验室改进的蛋白组学样品前处理方法,利用超滤管将酶解缓冲液置换成碳酸氢铵水溶液,酶解后利用碳酸氢铵加热潮解的特性除去多肽溶液中的碳酸氢铵成分,最终得到纯净的多肽,可以方便地与[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]直接衔接,进行质谱分析。与传统的方法相比,无样品损失,提高了蛋白质检测数目,同时操作简单快捷。值得注意的是,与传统的过滤辅助样品制备法相比,新方法在最小化氧化和去酰胺修饰方面表现出卓越的性能。这一创新的方法代表了蛋白质组学分析的重大进展,为质谱分析提供可靠和高效的结果。虽然新方法和过滤辅助样品制备法在使用基于滤膜的蛋白质截断方法方面有相似之处,但它们之间的关键区别变得显而易见。过滤辅助样品制备法在酶解前需要进行更彻底的洗涤,通常需要使用碳酸氢铵水溶液进行5次洗涤,而过滤辅助样品制备法通常只需要进行2次洗涤[sup][color=black][back=yellow][20][/back][/color][/sup]。此外,新方法可以通过轻度加热实现原位样品脱盐和纯化方法的完美集成。相比之下,过滤辅助样品制备法通常需要额外的脱盐柱纯化步骤。与新方法和过滤辅助样品制备法不同,悬浮陷阱法(S-Trap)采用三维多孔材料来捕获蛋白质 [sup][color=black][back=yellow][21][/back][/color][/sup]。由于其较大(亚微米级)的孔径,悬浮陷阱法滤膜的每个离心循环只需1分钟,实现了比本文中新方法和过滤辅助样品制备法更高的洗涤效率[sup][color=black][back=yellow][22][/back][/color][/sup]。然而,值得注意的是,与悬浮陷阱法相比,超滤管目前的成本较低,悬浮陷阱法在酶解后需要多次使用有机溶剂(如甲酸和乙腈)进行洗涤。悬浮陷阱法还涉及额外的脱盐柱纯化步骤,增加了实验的复杂性。总之,本文描述了一种独特的蛋白组学前处理方式,显著提高了高效样品制备的能力。6? 数据可用性声明本研究所有数据均包含在论文中。所有的蛋白质组学质谱数据已被存储在ProteomeXchange,并可通过访问编号PXD044209:[url=https://proteomecentral.proteomexchange.org/cgi/GetDataset?ID=PXD044209][color=#0563c1]https://proteomecentral.proteomexchange.org/cgi/GetDataset?ID=PXD044209[/color][/url] [sup][color=black][back=yellow][23, 24][/back][/color][/sup]来获取。参考文献(References):[1]? Solari F A, Kollipara L, Sickmann A, et al. Two birds with one stone: parallel quantification of proteome and phosphoproteome using iTRAQ[M]//Proteomics in Systems Biology. Humana Press, New York, NY, 2016: 25-41.[2]? Zhang G, Xue W, Dai J, et al. Quantitative proteomics analysis reveals proteins and pathways associated with anthocyanin accumulation in barley[J]. Food chemistry, 2019, 298: 124973.[3]? Zhu Z, Chen T, Wang Z, et al. Integrated Proteomics and Metabolomics Link Acne to the Action Mechanisms of Cryptotanshinone Intervention[J]. Frontiers in pharmacology, 2021, 12: 700696.[4]? Liu C, Si X, Yan S, et al. Development of the C12Im-Cl-assisted method for rapid sample preparation in proteomic application[J]. Analytical Methods, 2021, 13(6): 776-781.[5]? Liu Q, Shi J, Sun J, et al. Graphene and graphene oxide sheets supported on silica as versatile and high‐performance adsorbents for solid‐phase extraction[J]. Angewandte Chemie, 2011, 123(26): 6035-6039.[6]? Kecskemeti A, Bako J, Csarnovics I, et al. Development of an enzymatic reactor applying spontaneously adsorbed trypsin on the surface of a PDMS microfluidic device[J]. Analytical and bioanalytical chemistry, 2017, 409(14): 3573-3585.[7]? Li L, Wu R, Yan G, et al. A novel method to isolate protein N-terminal peptides from proteome samples using sulfydryl tagging and gold-nanoparticle-based depletion[J]. Analytical and bioanalytical chemistry, 2016, 408(2): 441-448.[8]? Shieh I F, Lee C Y, Shiea J. Eliminating the interferences from TRIS buffer and SDS in protein analysis by fused-droplet electrospray ionization mass spectrometry[J]. Journal of Proteome Research, 2005, 4(2): 606-612.[9]? LaCava J, Molloy K R, Taylor M S, et al. Affinity proteomics to study endogenous protein complexes: pointers, pitfalls, preferences and perspectives[J]. Biotechniques, 2015, 58(3): 103-119.[10]? Dupree E J, Jayathirtha M, Yorkey H, et al. A critical review of bottom-up proteomics: The good, the bad, and the future of this field[J]. Proteomes, 2020, 8(3): 14.[11]? Duong V A, Park J M, Lee H. Review of three-dimensional liquid chromatography platforms for bottom-up proteomics[J]. International Journal of Molecular Sciences, 2020, 21(4): 1524.[12]? 翟芳. 鸟枪法蛋白质组学质谱平台性能标准和参考数据集的建立[D]. 重庆大学, 2018.[13]? Shen Y, Toli? N, Zhao R, et al. High-throughput proteomics using high-efficiency multiple-capillary liquid chromatography with on-line high-performance ESI FTICR mass spectrometry[J]. Analytical Chemistry, 2001, 73(13): 3011-3021.[14]? Livesay E A, Tang K, Taylor B K, et al. Fully automated four-column capillary LC? MS system for maximizing throughput in proteomic analyses[J]. Analytical chemistry, 2008, 80(1): 294-302.[15]? Ca?as B, Pi?eiro C, Calvo E, et al. Trends in sample preparation for classical and second generation proteomics[J]. Journal of chromatography A, 2007, 1153(1-2): 235-258.[16]? Wheeler A R, Moon H, Bird C A, et al. Digital microfluidics with in-line sample purification for proteomics analyses with MALDI-MS[J]. Analytical chemistry, 2005, 77(2): 534-540.[17]? Kim K H, Compton P D, Tran J C, et al. Online matrix removal platform for coupling gel-based separations to whole protein electrospray ionization mass spectrometry[J]. Journal of proteome research, 2015, 14(5): 2199-2206.[18]? Wang C, Wu Z, Yuan J, et al. Simplified quantitative glycomics using the stable isotope label Girard’s reagent p by electrospray ionization mass spectrometry[J]. Journal of Proteome Research, 2014, 13(2): 372-384.[19]? Righetti P G, Boschetti E, Lomas L, et al. Protein Equalizer? Technology: The quest for a “democratic proteome”[J]. Proteomics, 2006, 6(14): 3980-3992.[20]? Homsi C, Rajan R E, Minati R, et al. A Rapid and Efficient Method for the Extraction of Histone Proteins[J]. Journal of Proteome Research, 2023, 22(8): 2765-2773.[21]? Fu Q, Murray C I, Karpov O A, et al. Automated proteomic sample preparation: The key component for high throughput and quantitative mass spectrometry analysis[J]. Mass Spectrometry Reviews, 2023, 42(2): 873-886.[22]? Duong V A, Lee H. Bottom-Up Proteomics: Advancements in Sample Preparation[J]. International Journal of Molecular Sciences, 2023, 24(6): 5350.[23]? Ma J, Chen T, Wu S, et al. iProX: an integrated proteome resource[J]. Nucleic acids research, 2019, 47(D1): D1211-D1217.[24]? Chen T, Ma J, Liu Y, et al. iProX in 2021: connecting proteomics data sharing with big data[J]. Nucleic Acids Research, 2022, 50(D1): D1522-D1527.[size=12px]收稿日期:[/size][size=12px]2023-10-27[/size] [size=12px]修改日期:[/size][size=12px] [/size]基金项目:国家重点研发计划(32030083)。作者简历:季学猛,硕士,实验师,研究方向为微生物学、蛋白组学。E-mail:jixuemeng@nankai.edu.cn。
蛋白组学谁用过安捷伦的QTRAPTOF这款仪器么?,如何啊?
[font=宋体][font=宋体]泛素化是一种细胞内的蛋白质标记系统,蛋白质泛素化是指将小的蛋白质泛素共价地连接到其他蛋白质分子上的过程。泛素([/font][font=Calibri]ubiquitin[/font][font=宋体])是一种高度保守的蛋白质,其结构由[/font][font=Calibri]76[/font][font=宋体]个氨基酸残基组成。泛素连接到目标蛋白质上的过程,经历了泛素激活、泛素转移和靶蛋白接受三个主要步骤。[/font][/font][font=宋体] [/font][font=宋体]蛋白质泛素化具有多种特点,例如它是高度选择性的,不同蛋白质泛素化的位置和数量可以影响其功能;它是可逆的,通过去泛素化反应可以调控蛋白质的泛素化状态;它还是动态调控的,受到多种因素的调控,如细胞信号通路和环境刺激。[/font][b][font=宋体]泛素化蛋白大小:[/font][/b][font=宋体] [/font][font=宋体][font=宋体]蛋白泛素化是指将小蛋白颗粒泛素([/font][font=Calibri]Ubiquitin[/font][font=宋体])与其他蛋白质共价结合的修饰过程。 泛素化修饰通常会导致泛素共价连接在蛋白质的赖氨酸残基上形成多重泛素链。 这种蛋白质泛素化增加了蛋白质的分子量,因为每个泛素分子的质量大约为[/font][b][font=Calibri]8.5[/font][font=宋体]千达尔顿([/font][font=Calibri]kDa[/font][/b][font=宋体][b])[/b]。[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]泛素化蛋白质组学在许多领域有重要的应用,主要包括:[/font][/b][font=宋体] [/font][font=宋体]①疾病机制研究:泛素化是一种广泛存在于细胞中的蛋白质修饰方式,参与了细胞的生长、分化、修复和调控等多个生命活动。泛素化蛋白质组学的研究可以帮助我们了解泛素化修饰的生物学功能和调控机制,为疾病发生机制和治疗策略的研究提供重要线索。例如,在癌症、代谢综合征、神经退行性疾病等疾病中,则会出现异常泛素化。[/font][font=宋体]②药物研发:通过分析药物对泛素化蛋白质的影响,可以评估药物的效力和选择性,为药物研发提供指导。[/font][font=宋体]③临床诊断:泛素化蛋白质组学鉴定与定量分析技术可以揭示细胞调控的机制,通过分析泛素化蛋白质的组学数据,可以确定泛素化修饰在细胞信号转导、蛋白质降解和细胞周期调控等过程中的重要作用。此外,通过比较病态和正常样品中泛素化蛋白质的差异,可以鉴定与疾病发生发展相关的泛素化修饰靶点,并进一步理解疾病的分子机制。因此,这些技术也可用于临床诊断。[/font][font=宋体]④蛋白质降解调控:在癌症、神经退行性疾病和免疫相关疾病等病症中,蛋白质降解调控出现异常。而泛素化蛋白组在调控蛋白质降解中发挥重要作用。通过与泛素连接,目标蛋白质被送入蛋白酶体或蛋白酶体样体中进行降解。这个过程是细胞清除异常、老化或受损蛋白质的重要途径。[/font][font=宋体]⑤高通量技术应用:高通量泛素化蛋白质组学鉴定与定量分析技术的发展包括质谱鉴定和抗体鉴定两种方法。质谱鉴定技术利用质谱仪的高灵敏度和分辨率,能够鉴定泛素化修饰的蛋白质及其泛素化位点。抗体鉴定技术则通过特异性抗体的使用,可以富集和鉴定泛素化修饰的蛋白质。这些技术为全面了解泛素化在细胞中的作用机制和调控网络提供了可能。[/font][font=宋体]总的来说,泛素化蛋白质组学在多个领域都有重要的应用价值,推动了我们对生命过程的深入理解以及疾病治疗的创新发展。[/font][font=宋体] [/font][font=宋体]更多详情关于[url=https://cn.sinobiological.com/resource/protein-review][b]蛋白资源[/b][/url]详情可以参看:[/font][url=https://cn.sinobiological.com/resource/protein-review][u][font=宋体][color=#0000ff][font=Calibri]https://cn.sinobiological.com/resource/protein-review[/font][/color][/font][/u][/url][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
6 质谱仪的最新进展用质谱检测蛋白,首先考虑到用PMF与 MALDI-TOF联用,如果无法检测,下一步就用ESI-MS/MS创建序列标签。在PMF分析中,MALDI的平板中只需一小部分样本就足以检测,剩下的样本就可以用来创建序列标签。并且,在MALDI-TOF仪器上,用一种叫做“源后延迟”的方法可以对只有部分序列的肽段进行检测。然而,用这个方法产生的质谱图比较难说明,精确性也很差。最近,用MALDI联合四级杆-时间质谱分析器[30,31]以及原始的MALDI-TOF/TOF[32]方法产生了。因此同一份标本可以首先考虑用PMF检测蛋白[33],如果有必要的话,再用MS/MS创建序列标签。MALDI联合四级杆-TOF检测高通量蛋白是有希望的[31]。7 蛋白质组研究中的转录后修饰分析蛋白组分析很重要的一点就是能对蛋白表达水平以及转录后修饰,如磷酸化和糖基化进行研究。蛋白质的磷酸化是很有趣的,因为在信号转导途径中它扮演了重要的角色。最早检测蛋白质表达水平的方法是进行2-DE之前用35S-Met对样本进行代谢性标记,再在2-DE上进行放射自显影[34-36]。在凝胶中,不同蛋白的磷酸化和糖基化位点通常在凝胶中显示一连串蛋白质点,但是还需要做更详细的分析来确定修饰类型。蛋白质磷酸化的改变既可以用32P标记细胞,也可以用特异性磷酸化抗体做western blotting进行研究。如果用32P标记的方法,仍然需要做2-DE。经过凝胶比较后,把感兴趣的点从胶上切下来,然后用质谱鉴定[36]。Soskic使用的是印迹法,两个2-DE同时进行,一个用于做特异的磷酸化抗体实验,另一个做常规染色。蛋白质磷酸化和糖基化更为详细的特性可以用质谱来检测,但是需要更多的起始材料而不仅仅是二维凝胶上的一个点。另外这些分析不能产生直接的序列信息,技术上也比用质谱检测蛋白要难的多。在蛋白上查找磷酸化位点有很多种方法。为了检测消化后的混和肽中哪一个是磷酸化的,可以用MALDI-MS在磷酸化前后对混合肽做PMF分析:经过磷酸酯酶处理后,磷酸化的肽将会失去一个磷酸基团,分子量将比处理前小80Da.糖基化研究中,多聚糖从蛋白中释放出来,对多聚糖结构的检测就是从这些游离的多聚糖中得到的。一般把MALDI仪和外源性糖苷酶[37-40]联合使用进行检测。如果需要更为详细的信息,可以用ESI-MS联合使用前体离子扫描仪[41-44]。到目前为止,能够用电泳分离后的蛋白进行糖蛋白结构检测的报道很少。其中有一项研究是N端糖蛋白酶切以后用一维SDS-PAGE分离,然后用MALDI-MS以及外源性的糖苷酶进行结构分析[45]。8 用质谱研究蛋白-蛋白之间的作用经典的蛋白组学着重于研究蛋白质在何时何处表达。因为大部分的细胞功能都是由蛋白质复合体而不是由单个蛋白来执行的,所以鉴定蛋白质的成分和相互作用是非常重要的。这个过程可以用生物化学方法纯化蛋白质后用质谱来鉴定不同的成分,如人类剪接体的成分,酵母的核孔复合体[46]以及核蛋白体等都可以用此策略检测出来。一般的蛋白复合体是用亲和层析的方法纯化和分离,如免疫沉淀反应[47,48]。 DNA结合蛋白可以用同它们有特异性亲和力的核酸来分离,然后用质谱来鉴定[49]。Rigaut等人在串联层析的基础上,建立了一种通用的蛋白质复合体纯化方法[50]。在这个方法中,一种TAP标签和靶蛋白融合在一起,然后把蛋白转移到宿主细胞或者组织中,融合蛋白在宿主细胞和组织中能持续表达。TAP标签包括一种A蛋白和一种钙调蛋白,在标签之间有一个TEV蛋白酶切位点。用串联亲和层析法能将融合蛋白及与它相互作用的蛋白成分从细胞提取物中有效的分离,纯化出来。Rappsiber等人分别用亲和层析,交叉耦合以及质谱等方法[51]对酵母的核孔复合物Nup85p的亲和性进行研究。经过层析以后,用一维SDS-PAGE方法就可以分离蛋白复合体中的各个成分,因此二维电泳的不足之处就可以避免。同样也有可能直接用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]方法分析大分子量蛋白质复合体[52]。蛋白组分析的优越之处主要是用于蛋白和蛋白之间的相互作用以及蛋白的转录后修饰的研究,同时也可以用于基因表达水平的研究。质谱对于蛋白组分析来说是一项非常重要的技术,近年来仪器以及数据库软件的发展使得质谱成为能力更强大的工具。参考文献[1] O’Farrell PH. J Biol Chem,1975,250:4007–4021.[2] Karas M, Bachmann D, Bahr U, et al. Int J MassSpecrom Ion Process,1987,78:53–68.[3] Meng CK, Mann M, Fenn JB. et al. Atoms, Mol Clusters,1988,10:361–368.[4] Fenn JB, Mann M, Meng CK, et al.Science,1989,6(246):64–71.[5] Corthals GL, Wasinger VC, Hochstrasser DF, et al.Electrophoresis,2000,21:1104–1115.[6] Celis JE, Kruhoffer M, Gromova I, et al. FEBS Lett,2000,480:2–16.[7] Anderson L, Seilhamer J. Electrophoresis,1997,18:533–537.[8] Gygi SP, Rochon Y, Franza BR, et al. Mol Cell Biol,1999,19:1720–1730.[9] Henzel WJ, Stults JT, Wong SC, et al. ProcNatl Acad Sci USA,1993,90:5011–5015.[10] Mann M, Hojrup P, Roeppstorff P. Biol Mass Spectrom,1993,22:338–345.[11] Pappin DJ, Hojrup P, Bleasby AJ. Curr Biol,1993,3:327–332.[12] James P, Quadroni M, Carafoli E, et al. Biochem BiophysRes Commun,1993,195:58–64.[13] Yates JRD, Speicher S, Griffin PR, et al. AnalBiochem,1993,214:397–408.[14] Mann M, Wilm M. Anal Chem,1994,66:4390–4399.[15] Eng JK, McCormack AL, Yates JR. J Am Soc Mass Spectrom,1994,5:976–989.[16] Wilm M, Mann M. Int J Mass Spectrom Ion Process,1994,136:167–180.[17] Wilm M, Shevchenko A, Houthaeve T, et al. Nature 1996 379:466–469.[18] Wilm M, Mann M. Anal Chem,1996,68:1–8.[19] Morris HR, Paxton T, Panico M, et al. JProtein Chem,1997,16:469–479.[20] Rosenfeld J, Capedeville J, Guillemot JC, et al. AnalBiochem,1992,203:173–179.[21] Shevchenko A, Wilm M, Mann M. Anal Chem,1996,68:850–858.[22] Pandey A, Andersen JS, Mann M. Science’s STKE: www.stke.org/cgi/content/full/OC–sigtrans 2000/37/pl1.[23] Kussmann M, Nordhoff E, Rahbek-Nielsen H, et al. J Mass Spectrom,1997,32:593–601.[24] Gobom J, Nordhoff E, Mirgorodskaya E, et al. J Mass Spectrom,1999,34:105–116.[25] Clauser KR, Baker P, Burlingame AL. Anal Chem,1999,71:2871–2882.[26] Binz PA, Muller M, Walther D, et al. Anal Chem,1999,71:4981–4988.[27] Bienvenut WV, Sanchez JC, Karmime A, et al. Anal Chem,1999,71:4800–4807.[28] Neubauer G, King A, Rappsilber J, et al. Nat Genet,1998,20:46–50.[29] Yates III JR, Carmack E, Hays L, et al. MethodsMol Biol,1999,112:553–569.[30] Loboda AV, Krutchinsky AN, Bromirski M, et al. Rapid Commun Mass Spectrom,2000,14:1047–1057.[31] Shevchenko A, Loboda A, Schevchenko A, et al. Anal Chem,2000,72:2132–2141.[32] Medzihradszky KF, Campbell JM, Baldwin MA, et al. Anal Chem 2000,72:552–558.[33] Krutchinsky AN, Zhang W, Chait BT. J Am Soc Mass Spectrom,2000,11:493–504.[34] Nyman TA, Matikainen S, Sareneva T, et al. Eur J Biochem 2000 267:4011–4019.[35] Celis JE, editor. Cell Biology: A Laboratory Handbook, vol. 4,2nd. Academic Press, 1998,375–385.[36] Gerner C, Frohwein U, Gotzmann J, et al. J Biol Chem,2000,Sep 7 [epubahead of print].[37] Colangelo J, Orlando R. Anal Chem,1999,71:1479–1482.[38] Geyer H, Schmitt S, Wuhrer M, et al. Anal Chem1999 71:476–482.[39] Harvey DJ. Mass Spectrom Rev,1999,18:349–450.[40] Nyman TA, Kalkkinen N, et al. Eur J Biochem,1998,253:485–493.[41] Sheeley DM, Reinhold VN. Anal Chem,1998,70:3053–3059.[42] Reinhold VN, Reinhold BB, Costello CE. Anal Chem,1995,67:1772–1784.[43] Kuster B, Hunter AP, Wheeler SF, et al. Electrophoresis,1998,19:1950–1959.[44] Rout MP, Aitchison JD, Suprapto A, et al. J Cell Biol,2000,148:635–651.[45] Yamaguchi K, Subramanian AR. J Biol Chem ,2000,275:28 466–28 482.[46] Yamaguchi K, von Knoblauch K, Subramanian AR. J BiolChem,2000,275:28 455–28 465.[47] Rotheneder H, Geymayer S, Haidweger E. J Mol Biol,1999,293:1005–1015.[48] Boehning D, Joseph SK. EMBO J,2000,19:5450–5459.[49] Nordhoff E, Krogsdam AM, Jorgensen HF, et al. Nat Biotechnol,1999,17:884–888.[50] Rigaut G, Shevchenko A, Rutz B, et al. Nat Biotechnol,1999,17:1030–1032.[51] Rappsilber J, Siniossoglou S, Hurt EC, et al. Anal Chem2000 72:267–275.[52] Link AJ, Eng J, Schieltz DM, et al. Nat Biotechnol,1999,17:676–682.T.A. Nyman /Biomolecular Engineering, 2001:18 .221–227.
褚福亮,王福生, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室 北京市 100039项目负责人 王福生, 100039 ,北京市丰台路26号, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室. fswang@public.bta.net.cn电话:010-66933332 传真:010-63831870收稿日期 2002-08-15 接受日期 2002-09-03摘要新近广泛应用蛋白质芯片(ProteinChipâ Array)系统成功鉴定出了一些重要疾病(如肿瘤和危害性较大的传染病)新的、特异性的生物标记(biomarkers),后者不仅在生物医学的基础方面具有重要的科学价值,而且在临床疾病的诊断、治疗和预防发挥重要的指导作用,显示了良好的发展前景.本文就表面增强的激光解析电离-飞行时间-质谱(SELDI-TOF-MS)相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.此外,我们就蛋白质谱分析技术在病毒性肝炎、肝硬化和肝癌等一系列肝病方面的应用策略和前景进行了分析.褚福亮,王福生. 蛋白质谱分析方法特点及其在蛋白组学研究领域中的应用.世界华人消化杂志 2002 10(12):1431-14350 引言人类基因组计划已经进入后基因组时代-即功能基因组时代[1],作为基因功能的直接体现者-蛋白质,及其之间的相互作用越来越引起基础和临床科学家们的关注[2-6] .因为要彻底了解生命的本质,只把基因测出来还是不够的,还必须要了解其在生物生长、发育、衰老和整个生命过程中的功能、不同蛋白质之间的相互作用以及他们与疾病发生、发展和转化的规律[7-14] .正因为如此,有关上述问题的蛋白质组学研究成了今天生命科学最重要的焦点之一[15] .为了阐明蛋白质在上述生命现象中的作用和相关机制,人们设计了许多新的方法技术,如:二维电泳、质谱分析、微距阵列、酵母双杂交和噬菌体展示等,这些方法在一些特定的情况下,虽然显示出了他们各自不同的优点,但是同样也存在着较大的局限性,难以开展大规模、超微量、高通量、全自动筛选蛋白质等方面的分析,因而设计更全面、同时研究多种蛋白质相互作用的技术,在功能基因组和蛋白组学的研究中建立一个更有效的技术平台,成为本领域中优先关注的问题[16] .近来,美国Ciphergen(赛弗吉)公司研制的ProteinChipâ Array的仪器,并建立了一种新的蛋白质飞行质谱-表面增强的激光解析离子化-飞行时间-质谱(surface-enhanced laser desorption/inionation-time of flight-mass spectra, SELDI-TOF-MS),已取得可喜的进展,筛选出了许多与疾病相关的新型生物标志,不仅为临床疾病的诊断和治疗等提供了新的选择,而且在基础科学、新药研制和疾病预防等方面具有广泛的应用前景[16-18] .本文就SELDI-TOF-MS相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.1 ProteinChipâ Array系统和SELDI-TOF-MS的特点1.1 蛋白质芯片系统的组成和原理 蛋白质芯片系统由三部分组成:蛋白质芯片、芯片阅读器和芯片软件.供研究用芯片上有6-10芯池,不同的芯片表面上的化学物质不同,芯片表面分为两大类:一类为化学类表面,包括经典的色谱分析表面,如:结合普通蛋白质的正相表面,用于反相捕获的疏水表面,阴阳离子交换表面和捕获金属结合蛋白的静态金属亲合捕获表面;另一类称为生物类,特定的蛋白质共价结合于预先活化的表面阵列,可以用来研究传统的抗体一抗原反应,DNA和蛋白质作用,受体、配体作用和其他的一些分子之间的相互作用[19] . 根据检测目的不同,可以选用不同的芯片,或者自己设计芯片.将样本和对照点到芯池上以后,经过一段时间的结合反应,用缓冲液或水洗去一些不结合的非特异分子,再加上能量吸收分子(energy absorbing molelule,EAM)溶液,使样本固定在芯片表面.当溶液干燥后,一个含有分析物和大量能量吸收分子“晶体”就形成了.能量吸收分子对于电离来说非常重要.经过以上步骤,就可经把芯片放到芯片阅读器中进行质谱分析. 在阅读器的固定激光束下,芯片上、下移动,使样本上每一个特定点都被“读”到.激光束的每一次闪光释放的能量都聚集在该区一个非常小的点上(focused laser beam,聚焦激光束).这样,每个区都含有丰富的,可寻址(addressable)的位置.蛋白质芯片处理软件精确控制激光寻读过程.当样本受到激发,就开始电离和解除吸附.不同质量的带电离子在电场中飞行的时间长短不同,计算检测到的不同时间,就可以得出质量电荷比,把他输入电脑,形成图像[19].Ball et al [20]采用一种称为人工神经网络(artifical neural network,ANN)的算法处理出现的成千上万的峰,鉴定出三个分子量为13 454、13 457和14 278的生物标记分子,使疾病预测率达到97.1 %.1.2 ProteinChipâ Array芯片和SELDI-TOF-MS的特点 新型蛋白芯片与以往的蛋白芯片不同之处:SELDI-TOF-MS,他是在MALDI(matrix-assisted laser desorption/inionation)[21,22]基础上,改进后实行表面增强的飞行质谱.SELDI-TOF-MS优于MALDI-TOF表现为他不会破坏蛋白质,或使样本与可溶的基质共结晶来产生质谱信号.对SELDI-TOF来说,可以直接将血清、尿液、组织抽取物等不需处理直接点样检测[40] 由于一部分非特异结合的分析物被洗去,因而出现的质峰非常一致,有利于后期分析[23,24] . 与二维电泳相比:二维电泳分析蛋白质的分子量在30 KDa以上时电泳图谱较清楚,对在组织抽提物中占很大比例的低丰度的蛋白质不能被检出;其次,二维电泳胶上的蛋白质斑点很大一部分包含一种以上的蛋白质;而且,二维电泳耗时长,工作量大,对象染色转移等技术要求高,不能完全实现自动化.而SELDI-TOF在200 Da-500 KDa区间都可以给出很好的质谱,对一个样本的分析在几十分钟内就可以完成[19],处理的信息量远远大于二维电泳;对于低丰度物质,即使浓度仅attomole(10-18)的分子,只要与表面探针结合,就可以检测到,这也是二维电泳所不具备的[24,25] . 对于微距阵蛋白芯片来说,需要一种不破坏折叠的蛋白质构象的固定技术,再与另外的蛋白质反应,经检测莹光来观察蛋白质之间的作用[26] .而基于SELDI-TOF-MS的ProteinChip分析蛋白质不需溶解、不需染色、廉价、针对性强. 因而蛋白质芯片仪具有以下优势:(1)可直接使用粗样本,如:血清、尿液、细胞抽提物等[27] .(2)使大规模、超微量、高通量、全自动筛选蛋白质成为可能;(3)他不仅可发现一种蛋白质或生物标记分子,而且还可以发现不同的多种方式的组合蛋白质谱,可能与某种疾病有关[28] (4)推动基因组学发展,验证基因组学方面的变化,基于蛋白质特点发现新的基因.可以推测疾病状态下,基因启动何以与正常状态下不同,受到那些因素的影响,从而跟踪基因的变化[2,14,15] . 其存在的问题:对于不同的样本,根据检测的目标采取或者设计几种芯片,理论上可以把所有的相同性质蛋白质捕获,但是实际上仍有少量的分子没与表面探针结合.使用SELDI-TOF-MS,仅能给出蛋白质的分子量,不能给出C端、N端的序列,也没法知道蛋白质的构型,因此需要将蛋白质充分纯化后,用蛋白酶消化芯片上的蛋白质,分析肽段,再用生物信息学方法鉴定蛋白质序列[18,24] .另外,在国内,该芯片费用较高,分析质谱需要大量后续工作支持.
[font='times new roman'][size=18px]常规蛋白组学分析方法[/size][/font][font='times new roman'][size=16px][color=#000000]蛋白质组学是中心法则的下游,因此它要比基因组学更加复杂。和以相对稳定的方式存在的基因组比较,蛋白质组会由于蛋白质和基因的多种生化反应以及环境的影响而发生多种改变。首先计算并比较两组中三种样品之间蛋白质的差异表达状况,然后计算每组样品中蛋白质差异表达的显著性[/color][/size][/font][font='times new roman'][size=16px][color=#000000]P[/color][/size][/font][font='times new roman'][size=16px][color=#000000]值,选定表达差异倍数大于[/color][/size][/font][font='times new roman'][size=16px][color=#000000]1.5[/color][/size][/font][font='times new roman'][size=16px][color=#000000]倍或小于[/color][/size][/font][font='times new roman'][size=16px][color=#000000]0.67[/color][/size][/font][font='times new roman'][size=16px][color=#000000]倍且[/color][/size][/font][font='times new roman'][size=16px][color=#000000]P-value[/color][/size][/font][font='times new roman'][size=16px][color=#000000]([/color][/size][/font][font='times new roman'][size=16px][color=#000000]significance A[/color][/size][/font][font='times new roman'][size=16px][color=#000000])小于[/color][/size][/font][font='times new roman'][size=16px][color=#000000]0.05[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的蛋白质界定为差异表达蛋白质。通过基因本体数据库([/color][/size][/font][font='times new roman'][size=16px][color=#000000]Gene Ontology[/color][/size][/font][font='times new roman'][size=16px][color=#000000],[/color][/size][/font][font='times new roman'][size=16px][color=#000000]GO[/color][/size][/font][font='times new roman'][size=16px][color=#000000])分析和京都基因与基因组百科全书([/color][/size][/font][font='times new roman'][size=16px][color=#000000]Kyoto encyclopedia of genes and genomes[/color][/size][/font][font='times new roman'][size=16px][color=#000000],[/color][/size][/font][font='times new roman'][size=16px][color=#000000]KEGG[/color][/size][/font][font='times new roman'][size=16px][color=#000000])通路富集分析进行相关生物信息学分析[/color][/size][/font][font='宋体'][size=16px][color=#000000]。[/color][/size][/font][font='宋体'][size=16px][color=#000000]1 火山图[/color][/size][/font][font='times new roman'][size=16px][color=#000000]火山图可查看蛋白在两组样品中表达水平的差异以及差异的统计学显著性。图中每一个点表示一个蛋白,横坐标表示某一个蛋白在两样品中表达量差异倍数的对数值[/color][/size][/font][font='times new roman'][size=16px][color=#000000] [/color][/size][/font][font='times new roman'][size=16px][color=#000000]纵坐标表示[/color][/size][/font][font='times new roman'][size=16px][color=#000000]P-value[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的负对数值。横坐标绝对值越大,说明表达量在两样品间的表达量倍数差异越大[/color][/size][/font][font='times new roman'][size=16px][color=#000000] [/color][/size][/font][font='times new roman'][size=16px][color=#000000]纵坐标值越大,表明差异表达越显著,筛选得到的差异表达蛋白越可靠。[/color][/size][/font][font='times new roman'][size=16px][color=#000000] [/color][/size][/font][font='times new roman'][size=16px][color=#000000]2 [/color][/size][/font][font='times new roman'][size=16px][color=#000000]热图[/color][/size][/font][font='times new roman'][size=16px][color=#000000]差异表达蛋白层次聚类分析热图:前三列代表对照组样品,后三列代表实验组样品。红色代表与对照组相比表达上调的蛋白,蓝色代表下调的蛋白。颜色亮度的深浅代表差异表达蛋白表达上调或下调的程度。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]3[/color][/size][/font][font='times new roman'][size=16px][color=#000000] [/color][/size][/font][font='times new roman'][size=16px][color=#000000]在对目标蛋白质集合进行[/color][/size][/font][font='times new roman'][size=16px][color=#000000]GO[/color][/size][/font][font='times new roman'][size=16px][color=#000000]注释或[/color][/size][/font][font='times new roman'][size=16px][color=#000000]KEGG[/color][/size][/font][font='times new roman'][size=16px][color=#000000]通路注释的富集分析时,使用[/color][/size][/font][font='times new roman'][size=16px][color=#000000] [/color][/size][/font][font='times new roman'][size=16px][color=#000000]Fisher[/color][/size][/font][font='times new roman'][size=16px][color=#000000]精确检验来比较每个[/color][/size][/font][font='times new roman'][size=16px][color=#000000]GO[/color][/size][/font][font='times new roman'][size=16px][color=#000000]分类或[/color][/size][/font][font='times new roman'][size=16px][color=#000000]KEGG[/color][/size][/font][font='times new roman'][size=16px][color=#000000]通路在目标蛋白质集合和总体蛋白质集合中的分布情况,然后再评价某个[/color][/size][/font][font='times new roman'][size=16px][color=#000000]GO term[/color][/size][/font][font='times new roman'][size=16px][color=#000000]或[/color][/size][/font][font='times new roman'][size=16px][color=#000000]KEGG[/color][/size][/font][font='times new roman'][size=16px][color=#000000]通路蛋白质富集度的显著性水平。[/color][/size][/font]

【网络会议】:蛋白组学新领域——食品品控研究【讲座时间】:2015年12月03日 14:00【主讲人】:丁小军赛默飞大分子质谱应用工程师。致力于蛋白质组学、生物制药、大分子食品安全领域的应用开发、技术支持和科学研究。拥有一线科研机构七年的生物质谱蛋白质定性分析,翻译后修饰以及定量研究相关的技术咨询与技术服务工作经历,参与完成过nature,science等数十篇高水平文章的质谱部分工作。【会议介绍】自从2013年欧盟“马肉风波”之后,中国肉类掺假的现象也屡见报道,进一步加深了人们对肉类真实性的担忧。这种非标明的添加,极大的扰乱的市场次序,影响相关宗教人士、特殊风俗与部分肉类禁食人士的情感与健康,也带来了潜在致病性和疾病控制的难题。随着生物质谱技术的成熟,大规模的定性和定量研究蛋白表达谱的技术已经很成熟。因此,利用质谱技术寻找不同肉类样品特征性蛋白或者多肽,并进行定量,能够避免现在最常用的PCR技术和ELISA所面临的上面的种种问题,其优点包括:不受食品加工的过程影响,因为氨基酸序列比核酸序列在加工过程中更容易保存;同时实现定性与定量,避免假阳性且定量结果更加准确可靠;能够同时监测多种添假。本期讲座的主要内容为:肉类真实性鉴别研究;食品中的过敏原研究。-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名,通过审核后即可参会。2、报名并参会用户有机会获得100元手机充值卡一张哦~3、报名截止时间:2015年12月03日 13:304、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/15895、报名及参会咨询:QQ群—379196738 快速报名,请扫描或长按下方二维码!http://ng1.17img.cn/bbsfiles/images/2015/10/201510301029_571692_2507958_3.png
[b]职位名称:[/b]产品与应用专员(蛋白组学)[b]职位描述/要求:[/b]岗位职责:1、有机质谱与生物质谱产品管理2、售前支持、新产品培训、演示应用和方案开发3、技术研发及项目管理4、成果发布与文献整理任职要求:1、生物、生物化学、组学及蛋白组学类相关专业,硕士及以上学历2、有1年以上经验者优先,硕士应届生亦可3、优秀的执行力、亲和力、表达和抗压能力4、英语六级以上,听说读写优良薪资待遇: 带薪休假+五险一金+定期培训+补贴工作时间:9:00-18:00 周末双休[b]公司介绍:[/b] 华质泰科生物技术(北京)有限公司(简称“华质泰科”或“ASPEC”)是一家为用户提供生物分析和测试仪器及总体解决方案的专业供应商,在制药、食品与药品安全检测、生命科学、临床检验、物证分析、生物预警、环境保护、化工与材料、三方检验等领域提供端到端的领先产品与服务。面对日益增长的、复杂的生物及化学样品分析需求及法规全球化挑战,我们提供全方位的一站式项目咨询、方法开发、人员培训、技术指导、设备提...[url=https://www.instrument.com.cn/job/user/job/position/67932]查看全部[/url]
[size=16px][color=#ff0000][b][url=https://www.instrument.com.cn/job/position-93211.html]立即投递该职位[/url][/b][/color][/size][b]职位名称:[/b]应用工程师-蛋白组学[b]职位描述/要求:[/b]岗位职责:1、对蛋白质组相关的样本制备、[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]分析以及组学数据分析非常有经验。精通从样本制备到数据分析流程者优先。2、有自己动手操作纳升[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]﹣高分辨质谱仪器的经验,对标记定量蛋白组、非标记定量蛋白组的原理非常清楚并能熟练应用。3、了解蛋白质组数据分析软件(比如MaxQuant,Proteome Discover, Skyline, Spectronaut等),及R或Python。4、有专利、论文写作经验;有较强的自学能力。能独立工作,也能团队协作,有团队合作意识。岗位要求:1、生物化学,生物学,分析化学,生物信息或相关学科毕业,硕士以上学历;2、要求有基于质谱的蛋白质组领域的经验和科研经历;3、能够适应短期出差;4、了解样品前处理的各个环节,有实验室有机样品前处理工作经验;5、良好的沟通协调能力,责任心强,性格开朗。职位福利:五险一金、带薪年假、补充医疗保险、定期体检、周末双休、节日福利、创业公司职位亮点:高新技术企业+华南理工大学产学研合作基地[b]公司介绍:[/b] 广州智达实验室科技有限公司成立于2018年,由一个从事在线自动化软硬件研究开发十五年以上的团队组建而成,主营业务是色谱质谱在线前处理和多功能进样系统。智达技术中心拥有[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GCMS[/color][/url],[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]GCMS[/color][/url]MS,[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LCMS[/color][/url]MS,多套自动化平台等先进分析设备;拥有专利软著等50多项知识产权,认证通过了ISO9000质量管理体系、瞪羚企业、国家级高新技术企业和广东省专精特新企业等荣誉;并获得深圳高新投集团战略融资。公司总...[url=https://www.instrument.com.cn/job/position-93211.html]查看全部[/url][align=center][img=,178,176]https://ng1.17img.cn/bbsfiles/images/2021/08/202108160948175602_3528_5026484_3.png!w178x176.jpg[/img][/align][align=center]扫描二维码,关注[b][color=#ff0000]“仪职派”[/color][/b]公众号[/align][align=center][b]即可获取高薪职位[/b][/align]
1月2日,佛山奥素博新科技有限公司(以下简称奥素科技)宣布完成近亿元A轮融资。本轮融资由鲁信创投领投,老股东启明创投、线性资本、同创伟业等持续加码,凯乘资本(WinX Capital)担任财务顾问。本轮融资后,奥素科技将进一步加速在单细胞蛋白组学领域的商业化推广,提供差异化的产品和服务,填补实验室样本预处理、功能发现及验证等需求的空白,力争将中国制造的先进生命科学仪器推向全球市场。奥素科技成立于2021年,具有全球领先的有源数字微流控液滴操控平台,在两年多时间内已连续获得四轮融资,股东包括诸多顶级VC及知名产业投资人。公司推出的第一款商业化产品Boxmini? SCP,是全球首款全流程微流控片上单细胞蛋白组学样本前处理工具,高效协助用户实现高通量、快速、精确的微量样本控制,一站式完成复杂的单细胞蛋白质样本前处理工作,且对无标记和TMT标记处理方案均可适配,产品推出后备受市场关注。[img=图片]https://img1.17img.cn/17img/images/202401/uepic/ea05f042-359a-4e3c-a6db-2edf2fa796f0.jpg[/img]对于本次融资,[b]奥素科技创始人兼CEO马汉彬博士[/b]表示:“将消费电子半导体技术引入到生命科学领域,奥素团队已经完成了0到1的积累:特别是在单细胞蛋白质组学样本前处理应用场景,我们通过有源数字微流控微芯片上纳升样本精准操控及全流程集成能力,获得了海内外多位头部PI的认可并产生了对整个领域有促进意义的实验结果;在单细胞多组学、微生物及合成生物学等其他领域,奥素也将与不同的下游伙伴携手前行,加速新产品的开发及商业化落地。我们将在新老股东的支持下,利用产品技术优势,迅速开拓海内外市场,以单细胞蛋白质组学产品为突破点,通过开放式数字微流控共享平台打造半导体技术的生物芯片生态,让生命科学实验室及医疗检验自动化快速迈入消费电子时代。”此前,在仪器信息网[url=https://www.instrument.com.cn/webinar/meetings/icca2023][font=arial][color=#000000]第六届细胞分析网络大会(iCCA2023)的【单细胞分析技术】专题会场中,[/color][/font][/url][url=https://www.instrument.com.cn/webinar/meetings/icca2023]马汉彬[/url]研究员分享《[url=https://www.instrument.com.cn/webinar/meetings/icca2023][font=arial][color=#c00000] [/color][/font][color=#c00000]基于有源数字微流控的单细胞分选和操控系统[/color][/url]》的主题报告。[url=https://www.instrument.com.cn/webinar/meetings/icca2023][i](详情点击)[/i][/url][align=center][url=https://www.instrument.com.cn/webinar/meetings/icca2023][img=,200,200]https://img1.17img.cn/17img/images/202308/uepic/34781884-5a9f-4e5a-b5df-03783a77c663.jpg[/img][/url][/align][align=center][url=https://www.instrument.com.cn/webinar/meetings/icca2023]马汉彬 中国科学院苏州生物医学工程技术研究所 研究员[/url][/align]马汉彬研究员课题组也在2023年成功研发出了一套基于大面积薄膜晶体管开关阵列的有源数字微流控平台,在Analytical Chemistry发表并被选为当期的封面论文。[url=https://www.instrument.com.cn/news/20230817/680090.shtml][i](详情点击)[/i][/url][align=center][img=7872d6238fc05517bb5f145142a71dee_7b4ffe77-43f0-48a2-886a-b31b248d32ca.jpg,350,465]https://img1.17img.cn/17img/images/202401/uepic/e362de5d-8580-4bc7-baf3-7272a8a7d52c.jpg[/img][/align]本轮领投方,[b]鲁信创投副总经理邱方[/b]表示:“鲁信创投作为国有控股的专业创投机构,一贯秉持以创业投资形式,支持我国自主的研究平台、仪器设备成果应用转化,将实现我国高水平科技自立自强的任务放在首位。奥素科技掌握有源数字微流控的核心底层技术,有潜力将实验室自动化推进到一个全新的局面,形成新的研究平台。公司推出的单细胞蛋白组学产品,为单细胞多组学等前沿研究提供先进工具,在包括鲁信已投企业在内的下游客户中引起强烈关注,体现出国产科学仪器的高水平自立自强,即将迎来新的局面。鲁信创投将支持奥素科技,打好科学仪器设备国产化攻坚战。”[b]启明创投合伙人陈侃[/b]表示:“启明创投作为上轮领投方,已连续两轮增资奥素科技。公司凭借强大的研发能力和优秀的执行力,快速的推出了单细胞领域的尖刀产品,面向一片蓝海市场。我们对公司未来充满信心,继续助力公司海外市场的商业化,期待奥素科技将“中国智造”先进科学仪器推向世界。”[b]线性资本董事总经理郑灿[/b]表示:“线性资本作为天使轮领投方,坚定认为投资要找到正确的人。我们亲眼见证了马汉彬博士从一名科研工作者向现代企业家的转变。马汉彬博士的为人、科学素养、前沿视野和企业家精神令我们印象深刻。在他带领下,公司首先推出了具有划时代意义的单细胞蛋白质组学解决方案,为全球蛋白组学领域研究再填一把火。我们本轮继续增持,推动奥素科技向先进科学仪器标杆企业迈进。”[b]同创伟业北京医药基金合伙人郗砚彬[/b]表示:“我们始终认为,奥素科技的数字微流控芯片系统,有望成为下一代生命科学微反应器的关键载体,持续为科学研究、医药工业等提供创新解决方案。公司的单细胞蛋白组学产品,将蛋白组学研究推进到了切实可行的单细胞颗粒度,使客户能够不再受工具所限,以全新的角度验证所知和探索未知。我们本轮继续增持,期待奥素科技能够让先进技术在应用层面全面开花。”[b]凯乘资本创始合伙人邹国文[/b]表示:“凯乘资本很荣幸连续第三轮担任奥素科技融资的财务顾问,见证了奥素从初创、一路飞速发展及商业化;作为数字微流控行业头部企业,奥素能够穿越市场周期,在不到三年的时间连续获得四轮融资,充分体现了资本端对公司的高度认可。期待奥素在下游领域的进一步拓展,成为世界领先的生命科学工具企业。”[b]关于鲁信创投:[/b]鲁信创投是山东省鲁信投资控股集团有限公司控股的省内最大、国内具有重要影响力的专业创投机构,是国内资本市场首家上市的创投机构(股票代码:600783.SH)。成立20余年以来,管理运作各类基金已达40余只,基金规模约200亿元,覆盖医疗健康、军民融合、先进制造、电子信息、新能源、新材料等细分产业,境内外上市公司40余家,在医疗健康领域先后投资了思路迪、硅基仿生、中科新生命、爱博泰克、唯迈医疗、美东汇成、英赛斯、荣昌生物等一批优秀企业。[来源:仪器信息网] 未经授权不得转载[align=right][/align]

[font=none][size=16px][color=#004be0]第16届原创大赛继续与中国仪器仪表学会合作。凡符合要求的原创作品将被推荐到“ 科研仪器案例库 ”,被案例库收录后,将由中国仪器仪表学会授予“科研仪器案例库收录证书”;征集活动结束后,被评为优秀案例的,将由中国科协授予“优秀案例授予证书”,助力参赛者评定职称。(注:往届获奖作品若有投递案例库的意向,可咨询主办方)[/color][/size][/font][align=center][size=18px][b]【科研仪器案例库收录文章展示】:免脱盐柱除盐的蛋白组学前处理方法[img=,690,491]https://ng1.17img.cn/bbsfiles/images/2024/01/202401191644483441_3917_3237657_3.png!w690x491.jpg[/img][img=,690,322]https://ng1.17img.cn/bbsfiles/images/2024/01/202401191645088078_8778_3237657_3.png!w690x322.jpg[/img]原文链接:[/b][url]https://bbs.instrument.com.cn/topic/8279851[/url][/size][/align]
[font=&][size=16px]仪器信息网将于 [/size][/font][font=&][size=18px][i][b]7月22日[/b][/i][/size][/font][font=&][size=16px][i] [/i]举办 [/size][/font][font=&][size=18px][i][b]第一届女性质谱学者国际研讨会[/b]([url=https://www.instrument.com.cn/webinar/meetings/fems2021/]会议页面戳这里[/url])。[/i][/size][/font][align=center][i][img=,690,151]https://ng1.17img.cn/bbsfiles/images/2021/07/202107141042105831_9881_2507958_3.jpg!w690x151.jpg[/img][/i][/align][font=&][size=18px][b]会议介绍[/b][/size][/font][font=&] 科学究其本质就是一种磨练,得益于那些好奇心无限、智慧超然并愿意为世界和个体生活带来真正改变的人们。正因如此,科学界一直不乏杰出的女性智者和先驱,她们为其所在领域带来了翻天覆地的改变。在质谱学领域,越来越多的女院士、女教授、女专家,还有资深女工程师……正在通过自己的思考与行动影响着该行业的发展。[/font][font=&] 当前,质谱技术在生物、医药、材料、食品、环境、公共安全等众多领域发挥着不可替代的作用。女性学者在质谱领域的占比也越来越高,并在其各自的岗位发挥着重要作用。受社会角色影响,女性学者面临工作和生活中更多的困难和挑战。[/font][font=&] 基于此,仪器信息网在Females in Mass Spectrometry(FeMS)组织的大力支持下,于2021年[b][color=#ff0000]7月22日[/color][/b]举办“第一届女性质谱学者国际研讨会”,旨在[b][color=#ff0000]为质谱领域的女性学者从学业生活到个人心路历程等方面搭建沟通、交流的平台[/color][/b],激励质谱领域女性学者的工作热情、帮助领域内女性学者的事业发展。[/font][b]会议日程[/b][table=92%][tr][td=1,1,189]分会场Sessions[/td][td=1,1,87]时间 Time[/td][td=1,1,203]报告题目Topic[/td][td=1,1,250]演讲嘉宾The Speakers[/td][/tr][tr][td=1,13][b]Multi-omics Enlightens Chemistry and Life Sciences (质谱在多组学研究的技术应用进展)(07月22日)[/b][/td][td=1,1,87]09:00[/td][td=1,1,203]Multidimensional Characteristics for Highly Confident Measurements and Scientists基于多维特征分析实现高可信度高可信度质谱检测[/td][td=1,1,250]Erin S. Baker( North Carolina State University[北卡罗莱纳州立大学])[/td][/tr][tr][td=1,1,87]09:30[/td][td=1,1,203]Single cell proteomics in neurons 单神经元蛋白组学[/td][td=1,1,250]John R. Yates III(Scripps Research[斯克利普斯研究所])[/td][/tr][tr][td=1,1,87]10:00[/td][td=1,1,203]On-tissue Spatially Resolved Multiomics Analyses Enabled by MALDI MS Imaging Coupled with In-situ Chemical Reactions MALDI质谱成像辅助原位化学反应实现空间分辨的组织原位多组学分析[/td][td=1,1,250]Lingjun Li[李灵军](School of Pharmacy University of Wisconsin[威斯康星大学麦迪逊分校])[/td][/tr][tr][td=1,1,87]10:30[/td][td=1,1,203]Top-down Proteomics and Metabolomics for Precision Medicine 精准医学中的Topdown蛋白组学和代谢组学研究[/td][td=1,1,250]Ying Ge[葛瑛](University of Wisconsin-Madison[威斯康星大学])[/td][/tr][tr][td=1,1,87]11:00[/td][td=1,1,203]Community-building: Plasma Lipidomics and Beyond 搭建研究群体:血浆脂质组学[/td][td=1,1,250]Anne K Bendt( National University of Singapore [新加坡国立大学])[/td][/tr][tr][td=1,1,87]11:30[/td][td=1,1,203]Lunch Break[/td][td=1,1,250]午休[/td][/tr][tr][td=1,1,87]14:00[/td][td=1,1,203]In-depth urine and serum proteome maps immune responses associated with the COVID-19 disease 深度尿液和血清蛋白质组与新冠的免疫谱图[/td][td=1,1,250]Catherine Wong [黄超兰](Peking University [北京大学医学部精准医疗多组学研究中心])[/td][/tr][tr][td=1,1,87]14:30[/td][td=1,1,203]Chemical proteomics reveal functional targets for glycolytic metabolites 化学蛋白质组学解密糖酵解代谢物的功能靶标[/td][td=1,1,250]Hui Ye[叶慧](China Pharmaceutical University[中国药科大学])[/td][/tr][tr][td=1,1,87]14:50[/td][td=1,1,203]MS-based approaches for analysis of glycosylation and their application 蛋白质糖基化质谱分析新方法及应用[/td][td=1,1,250]Ying Zhang [张莹](Fudan University [复旦大学])[/td][/tr][tr][td=1,1,87]15:30[/td][td=1,1,203]Fragment Ion-based Quantitation Methods enable accurate, precisive and dynamic proteome analysis 基于碎片离子的高精准蛋白质组动态分析新方法[/td][td=1,1,250]Jianhui Liu[刘健慧](CAS[中科院大连化学物理研究所])[/td][/tr][tr][td=1,1,87]15:45[/td][td=1,1,203]Redox Chemoproteomics氧化还原蛋白质组学[/td][td=1,1,250]Ling Fu[付玲](National Proteome Center[国家蛋白质科学中心])[/td][/tr][tr][td=1,1,87]16:00[/td][td=1,1,203]Deep-Profiling of Aminophospholipids from Biological Samples via Two Orthogonal Derivatizations 基于正交衍生的氨基磷脂组深度分析策略[/td][td=1,1,250]Qiaohong Lin[林巧红](Tsinghua University[清华大学])[/td][/tr][tr][td=1,1,87]16:15[/td][td=1,1,203]Microparticle assisted protein precipitation strategy for drug target screening基于微球辅助的蛋白质沉淀策略的药物靶点筛选研究[/td][td=1,1,250]Jiawen Lyu[吕佳纹](CAS[中科院大连化学物理研究所])[/td][/tr][/table][font=&][color=#ff0000][size=18px]欢迎大家参会,[url=https://www.instrument.com.cn/webinar/meetings/fems2021/]报名请戳这里[/url][/size][/color][/font]
[size=16px]仪器信息网将于 [/size][size=18px][i][b]7月22日[/b][/i][/size][size=16px][i] [/i]举办 [/size][font=&][size=18px][i][b]第一届女性质谱学者国际研讨会[/b]([url=https://www.instrument.com.cn/webinar/meetings/fems2021/]会议页面戳这里[/url])。[/i][/size][/font][font=&][size=18px][i][/i][/size][/font][align=center]=======================================================================[/align][align=center][i][img=,690,151]https://ng1.17img.cn/bbsfiles/images/2021/07/202107141042105831_9881_2507958_3.jpg!w690x151.jpg[/img][/i][/align][font=&][size=18px][b]会议介绍[/b][/size][/font] 科学究其本质就是一种磨练,得益于那些好奇心无限、智慧超然并愿意为世界和个体生活带来真正改变的人们。正因如此,科学界一直不乏杰出的女性智者和先驱,她们为其所在领域带来了翻天覆地的改变。在质谱学领域,越来越多的女院士、女教授、女专家,还有资深女工程师……正在通过自己的思考与行动影响着该行业的发展。 当前,质谱技术在生物、医药、材料、食品、环境、公共安全等众多领域发挥着不可替代的作用。女性学者在质谱领域的占比也越来越高,并在其各自的岗位发挥着重要作用。受社会角色影响,女性学者面临工作和生活中更多的困难和挑战。 基于此,仪器信息网在Females in Mass Spectrometry(FeMS)组织的大力支持下,于2021年7月22日举办“第一届女性质谱学者国际研讨会”,旨在为质谱领域的女性学者从学业生活到个人心路历程等方面搭建沟通、交流的平台,激励质谱领域女性学者的工作热情、帮助领域内女性学者的事业发展。[b]会议日程[/b][table=92%][tr][td=1,1,189]分会场Sessions[/td][td=1,1,87]时间 Time[/td][td=1,1,203]报告题目Topic[/td][td=1,1,250]演讲嘉宾The Speakers[/td][/tr][tr][td=1,13][b]Multi-omics Enlightens Chemistry and Life Sciences (质谱在多组学研究的技术应用进展)(07月22日)[/b][/td][td=1,1,87]09:00[/td][td=1,1,203]Multidimensional Characteristics for Highly Confident Measurements and Scientists基于多维特征分析实现高可信度高可信度质谱检测[/td][td=1,1,250]Erin S. Baker( North Carolina State University[北卡罗莱纳州立大学])[/td][/tr][tr][td=1,1,87]09:30[/td][td=1,1,203]Single cell proteomics in neurons 单神经元蛋白组学[/td][td=1,1,250]John R. Yates III(Scripps Research[斯克利普斯研究所])[/td][/tr][tr][td=1,1,87]10:00[/td][td=1,1,203]On-tissue Spatially Resolved Multiomics Analyses Enabled by MALDI MS Imaging Coupled with In-situ Chemical Reactions MALDI质谱成像辅助原位化学反应实现空间分辨的组织原位多组学分析[/td][td=1,1,250]Lingjun Li[李灵军](School of Pharmacy University of Wisconsin[威斯康星大学麦迪逊分校])[/td][/tr][tr][td=1,1,87]10:30[/td][td=1,1,203]Top-down Proteomics and Metabolomics for Precision Medicine 精准医学中的Topdown蛋白组学和代谢组学研究[/td][td=1,1,250]Ying Ge[葛瑛](University of Wisconsin-Madison[威斯康星大学])[/td][/tr][tr][td=1,1,87]11:00[/td][td=1,1,203]Community-building: Plasma Lipidomics and Beyond 搭建研究群体:血浆脂质组学[/td][td=1,1,250]Anne K Bendt( National University of Singapore [新加坡国立大学])[/td][/tr][tr][td=1,1,87]11:30[/td][td=1,1,203]Lunch Break[/td][td=1,1,250]午休[/td][/tr][tr][td=1,1,87]14:00[/td][td=1,1,203]In-depth urine and serum proteome maps immune responses associated with the COVID-19 disease 深度尿液和血清蛋白质组与新冠的免疫谱图[/td][td=1,1,250]Catherine Wong [黄超兰](Peking University [北京大学医学部精准医疗多组学研究中心])[/td][/tr][tr][td=1,1,87]14:30[/td][td=1,1,203]Chemical proteomics reveal functional targets for glycolytic metabolites 化学蛋白质组学解密糖酵解代谢物的功能靶标[/td][td=1,1,250]Hui Ye[叶慧](China Pharmaceutical University[中国药科大学])[/td][/tr][tr][td=1,1,87]14:50[/td][td=1,1,203]MS-based approaches for analysis of glycosylation and their application 蛋白质糖基化质谱分析新方法及应用[/td][td=1,1,250]Ying Zhang [张莹](Fudan University [复旦大学])[/td][/tr][tr][td=1,1,87]15:30[/td][td=1,1,203]Fragment Ion-based Quantitation Methods enable accurate, precisive and dynamic proteome analysis 基于碎片离子的高精准蛋白质组动态分析新方法[/td][td=1,1,250]Jianhui Liu[刘健慧](CAS[中科院大连化学物理研究所])[/td][/tr][tr][td=1,1,87]15:45[/td][td=1,1,203]Redox Chemoproteomics氧化还原蛋白质组学[/td][td=1,1,250]Ling Fu[付玲](National Proteome Center[国家蛋白质科学中心])[/td][/tr][tr][td=1,1,87]16:00[/td][td=1,1,203]Deep-Profiling of Aminophospholipids from Biological Samples via Two Orthogonal Derivatizations 基于正交衍生的氨基磷脂组深度分析策略[/td][td=1,1,250]Qiaohong Lin[林巧红](Tsinghua University[清华大学])[/td][/tr][tr][td=1,1,87]16:15[/td][td=1,1,203]Microparticle assisted protein precipitation strategy for drug target screening基于微球辅助的蛋白质沉淀策略的药物靶点筛选研究[/td][td=1,1,250]Jiawen Lyu[吕佳纹](CAS[中科院大连化学物理研究所])[/td][/tr][/table][color=#ff0000][size=18px]欢迎大家参会,[url=https://www.instrument.com.cn/webinar/meetings/fems2021/]报名请戳这里[/url][/size][/color]
用毛细管电泳分离蛋白组分时,样品峰比较宽,怎么样使样品峰变窄?
来自清华大学生科院、医学院、普林斯顿大学Lewis Thomas实验室等单位的研究人员报道了一种重要的转运因子的蛋白结构,这一结构的6个跨膜区域以未报道过的新折叠形式出现,这一发现对于了解核黄素(维生素B2)的运输,以及进一步拓展其生物学结构具有重要意义。研究论文发表在最近一期《自然》(Nature)杂志上。 文章的通讯作者是清华大学生命科学院院长施一公教授,其研究组主要致力于运用结构生物学和生物化学的手段研究肿瘤发生和细胞调亡的分子机制:专注于肿瘤抑制因子和细胞凋亡调节蛋白的结构和功能研究、重大疾病相关膜蛋白的结构与功能研究、胞内生物大分子元件的结构与功能研究。另外两位作者分别是王佳伟(Jiawei Wang)和张鹏(Peng Zhang)。该研究组近期研究发现了一类重要的蛋白:能量耦合因子(energy-coupling factor,ECF)转运蛋白,这类蛋白是一些微量营养元素的运输因子,负责原核生物的维生素摄入。每个ECF转运因子都包含一种嵌入细胞膜的能结合底物的蛋白结构——S组件。这一结构是能量耦合的关键部件,由两个ATP结合蛋白和一个跨膜蛋白组成。然而目前这一结构的具体构架,以及运输机制并不清楚。
[font=inherit]一、项目基本情况[/font]项目编号:B0708-CMC23N7109项目名称:国家心血管病中心重大传染病防控经费精准蛋白组学检测试剂采购预算金额:402.050000 万元(人民币)采购需求:[table][tr][td][align=center]货物名称[/align][/td][td][align=center]数量[/align][/td][td][align=center]采购预算[/align][align=center](人民币 万元)[/align][/td][td][align=center]简要技术要求[/align][/td][td][align=center]交货期[/align][/td][td][align=center]备注[/align][/td][/tr][tr][td][align=center]精准蛋白组学检测试剂[/align][/td][td][align=center]1批[/align][/td][td][align=center]402.05[/align][/td][td]试剂盒内容物:包含检测人源样本蛋白质组相关试剂,优先选择获得人类蛋白质图谱数据库(The Human Protein Atlas)或人类蛋白质组组织(HUPO)的认可推荐的技术方案[/td][td][align=center]合同签订后90天内[/align][/td][td][align=center]可采购进口货物[/align][/td][/tr][/table]注.投标人必须对要求的所有货物和服务给予报价。投标文件正、副本必须分开装订成册。合同履行期限:详见招标文件本项目( 不接受 )联合体投标。[font=inherit]二、申请人的资格要求:[/font]1.满足《中华人民共和国政府采购法》第二十二条规定;2.落实政府采购政策需满足的资格要求:2.1投标人不能是被列入“信用中国”网站(www.creditchina.gov.cn)失信被执行人、重大税收违法案件当事人名单的供应商,不能是被列入“中国政府采购网”网站(www.ccgp.gov.cn)政府采购严重违法失信行为记录名单中仍被禁止参加政府采购活动的供应商。2.2单位负责人为同一人或者存在直接控股、管理关系的不同供应商,不得参加同一包的投标或者未划分包的同一招标项目的投标。违反上述规定的相关投标均无效。3.本项目的特定资格要求:无[font=inherit]三、获取招标文件[/font]时间:2023年11月06日 至 2023年11月10日,每天上午9:00至12:00,下午12:00至16:00。(北京时间,法定节假日除外)地点:电汇购买招标文件。方式:请电汇购买招标文件。招标文件售价为800元人民币,售后不退。有兴趣的供应商可在2023年11月6日至2023年11月10日期间每个工作日下午16:00(北京时间)前汇款(不接受个人汇款)至采购代理机构指定账户,汇款时请必须注明“23N7109标书款”。汇款后请将汇款凭证和填写完毕的《购买招标文件/采购文件登记表》(1份可编辑的word版本及1份不可编辑的PDF版本),同时以电子邮件形式发送至liuzemin@cmc.gt.cn。采购代理机构工作日当日16:00时前收到邮件的于当日发送招标文件,16:00时后收到的将视为是下一个工作日收到的邮件。售价:¥800.0 元,本公告包含的招标文件售价总和[font=inherit]四、提交投标文件截止时间、开标时间和地点[/font]提交投标文件截止时间:2023年11月27日 09点30分(北京时间)开标时间:2023年11月27日 09点30分(北京时间)地点:北京市西城区北礼士路167号中国医学科学院阜外医院科研楼二层咖啡厅会议室。接收投标文件时间:2023年11月27日09:00-09:30(北京时间)。[font=inherit]五、公告期限[/font]自本公告发布之日起5个工作日。[font=inherit]六、其他补充事宜[/font]1 银行账户:开户名:中国机械进出口(集团)有限公司开户银行:工商银行北京大郊亭支行人民币账号:0200 0484 1920 0210 659行号:1021 0000 48472 本项目招标公告、更正公告及中标结果将在中国政府采购网(http://www.ccgp .gov.cn)上刊登。3 购买招标文件费用只开立纸质增值税普通发票并于开标当天现场领取。4 “购买招标文件登记表”请在招标公告标题右下角“显示公告概要”的附件中下载。为便于识别,请将电子邮件名称写为“23N7109-购买招标文件登记表-(公司名称)”。5 采购项目需要落实的政府采购政策:5.1 政府采购促进中小企业发展5.2 政府采购支持监狱企业发展5.3 政府采购鼓励节能、环保产品5.4 扶持不发达地区和少数民族地区5.5促进残疾人就业政府采购政策[font=inherit]七、对本次招标提出询问,请按以下方式联系。[/font]1.采购人信息名 称:国家心血管病中心地址:北京市门头沟区永定镇冯村西里联系方式:侯丽波,010-608667682.采购代理机构信息名 称:中国机械进出口(集团)有限公司地 址:北京市丰台区金泽东路通用时代中心C座联系方式:刘泽民,电话:010-811682633.项目联系方式项目联系人:刘泽民电 话: 010-81168263
单位打算买一台[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]来做蛋白质组学,预算700左右,有推荐的嘛?
[font=等线][size=15px]采用ABPP、蛋白组学以及代谢组学联合策略,揭示[/size][/font][size=15px][b][font=&][font=等线]雷公藤红素([/font]Celastrol, Cel[font=等线])直接结合[/font][/font][font=等线]多靶点[/font][font=等线]蛋白,[/font][font=等线]影响[/font][font=&][font=等线]能量代谢相关的生物过程,如[/font]TCA[font=等线]循环,糖酵解,脂肪酸代谢等途径,诱导线粒体相关的细胞凋亡,最终诱发肾毒性[/font][/font][/b][font=等线]。[/font][/size][size=15px][font=&][font=等线]雷公藤红素([/font]Celastrol, Cel[font=等线])是雷公藤的有效活性成分之一,具有悠久的临床应用历史,在抗类风湿性关节炎、抗肿瘤、抗氧化、神经保护等方面具有显著药效,[/font]2007[font=等线]年被[/font][/font][i][font=&]Cell[/font][/i][font=&][font=等线]评为[/font]“[font=等线]最具成药潜力[/font]”[font=等线]的五种天然化合物之一。在基础研究中,[/font]Cel[font=等线]的心脏毒性、生殖毒性已被明确,而[/font][/font][b][font=&][font=等线]相关的中成药或者复方在临床应用发生的肾脏损伤事件频发,其具体机制不明,[/font]Cel[font=等线]的肾毒性机制亟待阐明[/font][/font][/b][font=等线]。[/font][/size] [size=15px][b][font=等线]中国中医科学院王继刚[/font][font=等线]团队长期致力于天然产物的药物靶标及其机制的研究,建立了成熟的天然产物筛选平台。[/font][/b][font=等线]此前已经对雷公藤主要成分展开了广泛的靶向药理研究。例如:[/font][font=&][font=等线]基于活性的蛋白质谱([/font]ABPP[font=等线])通过结合活性探针和蛋白质组学技术,[/font][/font][font=等线]诠释了[font=&]Cel[/font]靶向[font=&]PRDX[/font]家族蛋白发挥抗肝纤维化的药理机制[font=&][Acta Pharm Sin B, (2022) 12(5):2300-2314][/font]。此外,其靶向[font=&]HMGB1[/font]发挥抗炎效应[font=&][Military Medical Research. (2022) 9(1):22.[/font];[font=&]Journal of Neuroinflammation, (2021) 18(1):174.][/font]。随后[/font][font=&][font=等线]证实了[/font]Cel[font=等线]与寄生虫中的许多蛋白质([/font]PfSpdsyn[font=等线]和[/font]PfEGF1-α[font=等线])结合,干扰亚精胺和寄生虫蛋白的从头合成,从而起到抗疟效果[/font][/font][font=&][Cell Commun Signal. (2024) Feb 20 22(1):139][/font][font=&][font=等线];可以选择性靶向电压依赖性阴离子通道[/font]2[font=等线]([/font]VDAC2[font=等线]),诱导肝癌细胞中由[/font]ROS[font=等线]介导的铁死亡以及细胞凋亡,而其脂质体在增强其靶向性的同时,还可以降低其毒副作用[/font][[/font][font=&]ASIAN J PHARM SCI, (2023) Nov 18(6):100874[/font][font=&]][font=等线];[/font]Cel[font=等线]通过共价结合并差异调节多种共脑核(杏仁核、海马体以及中缝背核)中[/font]PDIA3[font=等线]的表达,从而缓解肥胖与抑郁共病表型[/font][[/font][font=&]Journal of pharmaceutical analysis. 2023. doi:10.1016/j.jpha.2022.12.002[/font][font=&]][font=等线];[/font]Cel[font=等线]直接靶向神经元表达的发育下调[/font]4[font=等线]([/font]Nedd4[font=等线]),抑制其与[/font]Nrf2[font=等线]之间的相互作用并减少缺血性脑卒中中[/font]Nrf2[font=等线]的降解,从而起到神经保护作用[/font][[/font][font=&]Journal of pharmaceutical analysis. 2024. doi:10.1016/j.jpha.2023.10.002[/font][font=&]][font=等线]。[/font][/font][/size][size=15px][b][font=等线]二、[/font][font=等线]研究思路[/font][font=&][/font][/b][/size][size=15px][font=等线]在此[/font][font=等线],本研究[/font][b][font=&][font=等线]基于[/font]ABPP[font=等线]的化学蛋白质组学和代谢组学,分析并鉴定了[/font]Cel[font=等线]在肾脏中的共价结合靶[/font][/font][font=等线]点[/font][/b][font=&][font=等线]。本研究结果表明,许多[/font]Cel[font=等线]靶向蛋白参与了一些重要的生物学活动,特别是线粒体功能。[/font][/font][font=等线]随后,[/font][font=等线]使用细胞热迁移实验[/font][font=等线]([/font][font=&]CETSA-WB[/font][font=等线])[/font][font=&][font=等线]和[/font]pull down[/font][font=&]-[/font][font=&]WB[/font][font=等线]等生物学技术[/font][font=等线]对几种重要的[/font][font=等线]靶蛋白[/font][font=等线]进行验证[/font][font=等线],并借助[/font][font=等线]代谢组学和蛋白质组学分析[/font][font=等线],以及其他技术[/font][font=等线]进一步证明了[/font][b][font=&]Cel[/font][font=等线]的肾毒性与[/font][font=等线]线粒体功能损伤[/font][font=等线]密切相关[/font][/b][font=等线]。[/font][b][font=&]Cel[font=等线]可能通过靶向特定蛋白的复杂机制[/font][/font][font=等线]来诱导[/font][font=等线]肾毒性[/font][/b][font=等线]。[/font][/size][font=等线][/font] [img=,690,547]https://ng1.17img.cn/bbsfiles/images/2024/09/202409091652384055_1608_6541583_3.png!w690x547.jpg[/img]
[align=center][font='宋体'][size=21px]以肝癌组织单外泌体表面蛋白组为基础的肝癌预后模型构建[/size][/font][/align]1、 [font='宋体']:[/font][align=left][size=16px]研究内容[/size][/align][align=left][size=16px]从肝细胞肝癌和癌旁组织中提取外泌体,深入探讨肝癌组织外泌体和癌旁组织外泌体的差异,通过生物信息学手段发现关键分子,并通过实验验证关键分子的作用,[/size][size=16px]结合临床信息构建肝癌预后模型,[/size][size=16px]具体研究内容为:[/size][/align][align=left][font='calibri'][size=16px][color=#000000]1[/color][/size][/font][font='calibri'][size=16px][color=#000000])临床样本收集:收集肝细胞肝癌和癌旁组织[/color][/size][/font][font='calibri'][size=16px][color=#000000]20[/color][/size][/font][font='calibri'][size=16px][color=#000000]例,分别提取外泌体;后期验证收集肝细胞肝癌和癌旁组织[/color][/size][/font][font='calibri'][size=16px][color=#000000]80[/color][/size][/font][font='calibri'][size=16px][color=#000000]例。[/color][/size][/font][/align][align=left][font='calibri'][size=16px][color=#000000]([/color][/size][/font][font='calibri'][size=16px][color=#000000]2[/color][/size][/font][font='calibri'][size=16px][color=#000000])外泌体表面蛋白测定及关键分子检测:前期采[/color][/size][/font][font='calibri'][size=16px][color=#000000]?[/color][/size][/font][font='calibri'][size=16px][color=#000000]邻近编码技术([/color][/size][/font][font='calibri'][size=16px][color=#000000]Proximity Barcoding Assay, PBA[/color][/size][/font][font='calibri'][size=16px][color=#000000])对单外泌体进行分析,对样本中的外泌体进行高通量、单颗粒、多种蛋白的检测;[/color][/size][/font][font='calibri'][size=16px][color=#000000]miRNA[/color][/size][/font][font='calibri'][size=16px][color=#000000]组学分析:与疾病发生相关的外泌体源功能分子;差异分子的功能、通路的富集与注释;组织外泌体验证关键分子;关键分子上下游通路预测、功能富集、表型预测;[/color][/size][/font][/align][font='calibri'][size=16px][color=#000000]([/color][/size][/font][font='calibri'][size=16px][color=#000000]3[/color][/size][/font][font='calibri'][size=16px][color=#000000])功能机制研究:获得或缺失关键分子后的外泌体处理肿瘤细胞,检测干性表型;体内实验验证[/color][/size][/font][font='calibri'][size=16px][color=#000000]其对小鼠成瘤的影响。[/color][/size][/font]1、 [font='宋体']研究方案:[/font][font='宋体'][size=16px]1.研究方案(有关方法、技术路线、实验手段、关键技术等说明,项目可行性分析)[/size][/font][font='宋体'][size=16px]研究方法[/size][/font][font='宋体'][size=16px](1)临床样本收集:收集肝细胞肝癌和癌旁组织20例,分别提取外泌体;[/size][/font][font='宋体'][size=16px](2)[/size][/font][font='宋体'][size=16px]外泌体表面蛋白测定及关键分子检测:[/size][/font][font='宋体'][size=16px]前期采用[/size][/font][font='宋体'][size=16px]邻近编码技术([/size][/font][size=16px]Proximity Barcoding Assay[/size][size=16px],[/size][size=16px] [/size][size=16px]PBA[/size][font='宋体'][size=16px])对单外泌体进行分析,[/size][/font][font='宋体'][size=16px]对样本中的外泌体进行高[/size][/font][font='宋体'][size=16px]通量、单颗粒、多种[/size][/font][font='宋体'][size=16px]蛋白[/size][/font][font='宋体'][size=16px]的检测;[/size][/font][size=16px]miRNA[/size][font='宋体'][size=16px]组学分析:与疾病发生相关的[/size][/font][font='宋体'][size=16px]外泌体[/size][/font][font='宋体'][size=16px]源功能分子;差异分子的功能、通路的富集与注释;组织外泌体验证关键分子;关键分子上下游通路预测、功能富集、表型预测[/size][/font][font='宋体'][size=16px];[/size][/font][font='宋体'][size=16px](3)功能机制研究:获得或缺失关键分子后的外泌体处理肿瘤细胞,检测干[/size][/font][font='宋体'][size=16px]性表型;体内实验验证其对小鼠成瘤的影响;[/size][/font][font='宋体'][size=16px]([/size][/font][font='宋体'][size=16px]4[/size][/font][font='宋体'][size=16px])预后模型的构建:将临床信息与关键分子信息相结合,构建肝癌预后模型。[/size][/font][font='宋体'][size=16px]实验方案[/size][/font][font='宋体'][size=16px]一、组织外泌体的提取[/size][/font][font='宋体'][size=16px]1.组织切片解离,获得[/size][/font][font='宋体'][size=16px]外泌体[/size][/font][font='宋体'][size=16px]悬液[/size][/font][size=16px]([/size][size=16px]1[/size][size=16px])冰冻切片机对组织进行切片处理[/size][size=16px], [/size][size=16px]([/size][size=16px]2[/size][size=16px])将提前配好的消化酶转移到[/size][size=16px]50[/size][size=16px] [/size][size=16px]ml[/size][size=16px]的离心管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]3[/size][size=16px])[/size][font='宋体'][size=16px]将[/size][/font][size=16px]装有切片组织的离心管转移至于[/size][size=16px]37℃[/size][size=16px]水浴锅中水浴孵育[/size][size=16px] 10[/size][size=16px]-[/size][size=16px]15[/size][size=16px] [/size][size=16px]min[/size][size=16px],过程每隔[/size][size=16px] 5[/size][size=16px] [/size][size=16px]min[/size][size=16px]充分混合一次观察组织形态消化情况。[/size][size=16px] [/size][size=16px]([/size][size=16px]4[/size][size=16px])[/size][size=16px]37℃[/size][size=16px]孵育结束后将组织消化混合液放置在冰上,用[/size][size=16px]70[/size][size=16px] [/size][size=16px]μm[/size][size=16px]滤膜过滤上述溶液到新的[/size][size=16px]15[/size][size=16px] [/size][size=16px]ml[/size][size=16px]的离心管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]5[/size][size=16px])向每个[/size][size=16px]15[/size][size=16px] [/size][size=16px]ml[/size][size=16px]的离心管中加入[/size][size=16px] 25[/size][size=16px] [/size][size=16px]ul [/size][size=16px]蛋白酶和磷酸酶抑制剂[/size][size=16px]([/size][size=16px]1:100[/size][size=16px])[/size][size=16px]。[/size][size=16px] [/size][size=16px]2.[/size][size=16px]外泌体[/size][size=16px]悬液差速离心[/size][size=16px] [/size][size=16px]([/size][size=16px]1[/size][size=16px])[/size][size=16px]4℃[/size][size=16px],[/size][size=16px]300×g[/size][size=16px],离心[/size][size=16px] 10 min[/size][size=16px],转移上清到新的[/size][size=16px] 15[/size][size=16px] [/size][size=16px]ml [/size][size=16px]离心管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]2[/size][size=16px])[/size][size=16px]4℃[/size][size=16px],[/size][size=16px]2000×g[/size][size=16px],离心[/size][size=16px] 10 min[/size][size=16px],转移上清到新的[/size][size=16px] 15[/size][size=16px] [/size][size=16px]ml [/size][size=16px]离心管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]3[/size][size=16px])[/size][size=16px]4℃[/size][size=16px],[/size][size=16px]10, 000×g[/size][size=16px],离心[/size][size=16px] 20 min[/size][size=16px],上清转移到新的[/size][size=16px] 15[/size][size=16px] [/size][size=16px]ml [/size][size=16px]离心管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]4[/size][size=16px])步骤([/size][size=16px]3[/size][size=16px])得到的上清液用[/size][size=16px] 10[/size][size=16px] [/size][size=16px]ml [/size][size=16px]注射器通过[/size][size=16px] 0.22[/size][size=16px] [/size][size=16px]μm [/size][size=16px]滤膜过滤进入大超离管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]5[/size][size=16px])[/size][size=16px]4℃[/size][size=16px],[/size][size=16px]150,000[/size][size=16px] [/size][size=16px]×g[/size][size=16px],超离[/size][size=16px]2 h[/size][size=16px]。[/size][size=16px] [/size][font='宋体'][size=16px]([/size][/font][size=16px]6[/size][size=16px])超离结束后,弃上清,沉淀以[/size][size=16px]0.4 ml+0.4 ml[/size][size=16px]遇冷的[/size][size=16px]PBS[/size][size=16px](含有蛋白酶和磷酸酶抑制剂)溶解后,获得小囊泡。[/size][size=16px] [/size][size=16px]3. SEC [/size][size=16px]排阻[/size][size=16px]+[/size][size=16px]超滤[/size][size=16px] [/size][size=16px]([/size][size=16px]1[/size][size=16px])将超离后[/size][size=16px]1[/size][size=16px] [/size][size=16px]ml[/size][size=16px]的[/size][size=16px]PBS[/size][size=16px]洗涤的外泌体加入到排阻柱中,待液面下降至上筛板时,依次加入[/size][size=16px]PBS[/size][size=16px],并同时[/size][size=16px]([/size][size=16px]2[/size][size=16px])收集对应馏分加入[/size][size=16px] 100kd [/size][size=16px]超滤管中。[/size][size=16px] [/size][size=16px]([/size][size=16px]3[/size][size=16px])[/size][size=16px]4℃[/size][size=16px],[/size][size=16px]4000×g[/size][size=16px],离心[/size][size=16px] 1min[/size][size=16px]。[/size][size=16px]([/size][size=16px]4[/size][size=16px])超滤至合适体积后,对着滤膜反复吹打,吸出[/size][size=16px]200[/size][size=16px] [/size][size=16px]ul[/size][size=16px]后进行[/size][size=16px]BCA[/size][size=16px]蛋白浓度检测。[/size][size=16px] [/size][size=16px]4. BCA[/size][size=16px]检测[/size][size=16px] [/size][size=16px]将超滤得到的外泌体进行[/size][size=16px]BCA[/size][size=16px]蛋白浓度检测。[/size][size=16px]二、外泌体表面蛋白及[/size][size=16px]miRNA[/size][size=16px]组学分析[/size][size=16px]1.[/size][size=16px] [/size][size=16px]与疾病发生相关的[/size][size=16px]外泌体[/size][size=16px]源功能分子,差异分子的功能、通路的富集和注释。[/size][size=16px]2.[/size][size=16px] [/size][size=16px]组织外泌体验证关键分子,供体细胞的推断。[/size][size=16px]3.[/size][size=16px] [/size][size=16px]关键分子上下游通路预测,功能富集,表型预测。[/size][size=16px]4.[/size][size=16px] [/size][size=16px]预后模型的构建:将临床信息与关键分子信息相结合,构建肝癌预后模型。[/size][size=16px]三、功能机制研究[/size][size=16px]1.[/size][size=16px] [/size][size=16px]获得或缺失关键分子后的外泌体处理肿瘤细胞,检测干性表型。[/size][size=16px]2.[/size][size=16px] [/size][size=16px]体内实验验证其对小鼠成瘤的影响:经溯源分析得出不同亚群外泌体的来源,将特定来源的外泌体注入小鼠体内,研究其对小鼠成瘤的影响。[/size][size=16px]可行性分析[/size][size=16px]本课题组前期进行了外泌体提取的相关研究,已取得学术成果。[/size][size=16px]1[/size][size=16px])科研基础扎实:申请者研究团队从事相关基础研究多年,近年在国内外期刊上发表论文多篇,具备高质量完成项目的能力。[/size][size=16px]2[/size][size=16px])研究目标切实:本课题密切联系外泌体研究现状,旨在研究组织外泌体与疾病关系,并为疾病的诊断和治疗提供切实合理的方案。[/size][size=16px]3[/size][size=16px])技术平台与硬件设施完善:申请者所在单位的分子生物学及生物信息学各项研究方法比较成熟,具备完成实验所需的全套设备,并且已熟练掌握上述技术路线涉及的各种实验方法。[/size][size=16px]4[/size][size=16px])项目组成员近年来连续从事外泌体捕获及分离方法研究,熟悉该研究领域的动态前沿,有一定的研究功底。[/size][size=16px]5[/size][size=16px])本项目的研究团队人员配置合理,骨干成员均为年富力强的中青年科学工作者和技术骨干,有较强科研履约能力和良好履约记录。[/size]创新点:[size=16px]目前对于外泌体的研究大多局限于体液外泌体,体液来源的[/size][size=16px]外泌体[/size][size=16px]在疾病研究和早诊方面存在一定的局限性。首先,体液[/size][size=16px]外泌体[/size][size=16px]来源于机体内的各种细胞、组织导致其组成复杂,鉴定出的标志物是否为肿瘤所特异并无清晰阐述。其次,组织微环境中包括肿瘤细胞和其他各种细胞的复杂作用。本研究直接从组织中提取的[/size][size=16px]外泌体([/size][size=16px]Ti-EVs[/size][size=16px])[/size][size=16px]具有组织特异性、准确反映组织微环境以及携带更丰富的信息等优点。[/size]
生物质谱技术帮助发现精神分裂症特征蛋白 (2006-12-28 9:34:47,新闻来源:人民网) 日前,四川泸州医学院附属医院硕士研究生姜伟,在导师王开正教授指导下,利用表面增强激光解析电离飞行时间质谱技术,发现了一组对精神分裂症的早期预警、鉴别诊断、治疗观察具有重要意义的蛋白标志物。 目前鉴别诊断精神分裂症缺乏有效的病理学、影像学和实验诊断依据,也缺乏客观的检查指标用于早期诊断,这也是造成对某些精神分裂症的评定产生分歧、鉴定困难的原因之一。 姜伟等人应用获得诺贝尔化学奖、高灵敏度高解析度的表面增强激光解析电离飞行时间质谱技术,检测精神分裂症血清蛋白质指纹图谱,将40名精神分裂症患者血清与44名其他人对照血清随机分为训练集和验证集,将筛选训练集精神分裂症差异蛋白建立人工神经网络诊断模型,再将验证集验证该模型的诊断效率。结果发现精神分裂症患者与对照组血清蛋白质指纹图谱有15个差异表达的蛋白质荷比峰,筛选出其中6个有明显表达差异的标志蛋白,建立的人工神经网络诊断模型对精神分裂症的诊断灵敏度和特异性分别为95.0%和95.8%,阴性预测值和阳性预测值分别为95.8%和95.0%。姜伟等人依据这一结果认为,精神分裂症患者血清具有高表达的特征蛋白,建立的人工神经网络模型为精神分裂症的实验诊断提供了一种蛋白组学的新方法。这种方法检查过程快速、简便,不会破坏所测定的蛋白质,结果可靠,可重复检测。 ————2006.12.27健康报也有报道--------------------------------------------------------------------另:两毫升血5小时鉴别精神分裂症 作者:周丽 文章来源:泸州晚报 点击数:0 更新时间:2006-12-20 只需要从体内抽取两毫升鲜血,经过5个小时的实验室检测,就能诊断是否患有精神分裂症。昨(19)日记者获悉,如此简便的方法已经在我市投入使用,这也是西南地区首次将诺贝尔化学奖应用到精神分裂症的实验室诊断中。 据悉,该技术在泸医附院检验科正式投入使用。泸医附院检验科主任王元正告诉记者,泸医附院引进的表面增强激光解析电离飞行时间质谱技术是获得2002年诺贝尔化学奖的高新技术,通过对患者的抽血检测,发现了一组对精神分裂症的早期预警、鉴别诊断、治疗观察具有重要意义的蛋白标志物。 而泸医附院引进的这种技术,将精神分裂症患者血清蛋白指纹图与健康人做差异蛋白组学分析,利用计算机程序找到了精神分裂症患者特征表达的蛋白质,将6个蛋白的相对含量建立人工神经网络诊断模型并进行盲法验证。结果显示,对精神分裂症的诊断灵敏度为95.0%,特异性为95.8%。整个实验检测过程只需要5个小时。 目前,全国对此技术的利用并不广泛,泸医附院在西南地区率先引进使用。这种技术还用于肿瘤、心血管疾病、风湿免疫性疾病、感染性疾病等疑难疾病的鉴别诊断,特别是对各种肿瘤的早期诊断灵敏度和特异性都在95%以上。
[size=16px][color=#ff0000][b][url=https://www.instrument.com.cn/job/position-92510.html]立即投递该职位[/url][/b][/color][/size][b]职位名称:[/b]蛋白或代谢组学分析-长春市[b]职位描述/要求:[/b]招聘部门:长春中医药大学公共实验中心编制类型:实验系列薪资待遇:正常事业单位待遇岗位职责:1、完成蛋白组学、代谢组学或者中药小分子分析相关实验;2、根据需要进行测试服务或技术辅导。3、部门安排的其他工作。任职条件:1、博士学历,化学、分析化学、生物、药学及相关专业;2、有组学研究相关工作经验者优先;3、专业理论基础扎实,熟悉质谱测试原理、技术,做事认真负责,有条理,善于思考;4、有良好的英文阅读及写作能力,能够主动解决实验中的相关问题;5、有较好的团队协作能力,及良好的沟通能力。联系人:杨老师,yanghm0327@sina.cn[b]公司介绍:[/b] 为更精准的帮用户选择高校,科研院所相关就业机会,特发布此职位专区,便于求职者第一时间锁定优质的就业机会。...[url=https://www.instrument.com.cn/job/position-92510.html]查看全部[/url][align=center][img=,178,176]https://ng1.17img.cn/bbsfiles/images/2021/08/202108160948175602_3528_5026484_3.png!w178x176.jpg[/img][/align][align=center]扫描二维码,关注[b][color=#ff0000]“仪职派”[/color][/b]公众号[/align][align=center][b]即可获取高薪职位[/b][/align]
体积排阻色谱分离蛋白质,分子量范围100万~1万,其中有分子量47000的组份,要分析分子量68000的杂蛋白含量,采用TSK4000SW,长度为60厘米的色谱柱,分离分子量68000与47000的2个组份,分离度在0.9~1.0左右,分离度达不到1.5,有什么方法解决?
[font='times new roman'][size=14px]药物靶蛋白鉴定方法[/size][/font][font='times new roman'][size=14px]非蛋白质组学鉴定方法[/size][/font][font='times new roman'][size=14px]非蛋白质组学的传统药物靶蛋白鉴定方法,如免疫印迹法、内肽的化学测序、已知或未知蛋白的迁徙分析等方法,通常耗时、耗力且不适合进行高流通量的筛选。目前,所使用的技术包括:第一,蛋白鉴定的图象分析,利用产生的表观分子量的网格来估计蛋白的分子量,未被修饰的小蛋白错误率大约[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]30%[/size][/font][font='times new roman'][size=14px],而翻译后修饰蛋白错误率更高,故需联合其他技术完成鉴定;第二,微量测序,首先使经凝胶分离的蛋白直接印迹在[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]PVDF [/size][/font][font='times new roman'][size=14px]膜,经过一系列操作后将其置于测序仪中进行蛋白质鉴定,但该方法仍然存在一些缺点,如由于酸性水解或者部分降解而产生氨基酸的变异,故应联合其他的蛋白质属性进行鉴定。[/size][/font][font='times new roman'][size=14px]化学蛋白质组学方法[/size][/font][font='times new roman'][size=14px]化学蛋白质组学方法一般先将小分子化合物通过与蛋白质溶液反应,使化学探针或小分子化合物与固相联接,得到被修饰的固相微球,然后利用合适的分离技术将这些蛋白质纯化,结合[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px][url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url] [/size][/font][font='times new roman'][size=14px]分析,得到靶蛋白的信息。[/size][/font][font='宋体']亲和色谱法[/font][font='times new roman'][size=14px]亲和色谱法是化学蛋白质组学策略中较为经典的方法之一,它主要应用于研究蛋[/size][/font][font='times new roman'][size=14px]白质与生物活性小分子或蛋白质与蛋白质的相互作用[/size][/font][font='times new roman'][sup][size=14px][17][/size][/sup][/font][font='times new roman'][size=14px]。该方法通过官能团将配体结合在固相基质中,然后与蛋白质孵育,此时与配体结合的蛋白会留在基质上,最后通[/size][/font][font='times new roman'][size=14px]过变性或与自由配体竞争将结合蛋白洗脱下来,再通过凝胶电泳或者[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px][url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url][/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]进行分[/size][/font][font='times new roman'][size=14px]析。该方法的缺陷在于所研究分子衍生物活性不确定、材料配体结合力差异性以及非特异性吸附都将会干扰研究结果。[/size][/font][font='宋体']基于活性的化学蛋白质组学技术[/font][font='times new roman'][size=14px]基于活性的化学蛋白质组学技术([/size][/font][font='times new roman'][size=14px]ABPP[/size][/font][font='times new roman'][size=14px])是广泛使用的技术之一。[/size][/font][font='times new roman'][size=14px]ABPP [/size][/font][font='times new roman'][size=14px]是由美国的[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]Cravatt[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]课题组在[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]2002 [/size][/font][font='times new roman'][size=14px]年首次提出,最早用于酶谱分析,之后被应用于药物靶蛋白筛选。[/size][/font][font='times new roman'][size=14px]ABPP [/size][/font][font='times new roman'][size=14px]技术的关键是合成同时带有反应基团和标记物的[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]ABPP [/size][/font][font='times new roman'][size=14px]探针,可进一步与待测的蛋白质发生相互反应。药物靶点筛选领域设计的[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]ABPP [/size][/font][font='times new roman'][size=14px]探针通常包括三[/size][/font][align=center][font='times new roman'][size=14px]3[/size][/font][/align][align=center][/align][font='times new roman'][size=14px]个功能部分:反应基团、连接基团和报告基团。与二维凝胶电泳法([/size][/font][font='times new roman'][size=14px]2-DE[/size][/font][font='times new roman'][size=14px])、同位素编码亲和标签([/size][/font][font='times new roman'][size=14px]ICAT[/size][/font][font='times new roman'][size=14px])等技术相比,[/size][/font][font='times new roman'][size=14px]ABPP [/size][/font][font='times new roman'][size=14px]技术着重研究蛋白质的表达和功能,[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]可从天然蛋白质组样品中直接筛选出与小分子特异性结合的蛋白质,从而能更直接快速地明确小分子和蛋白质之间的相互作用,确定小分子的作用靶点,这对于筛选具有低亲和力的靶蛋白极为有利。另外,根据富集和鉴定策略的不同,[/size][/font][font='times new roman'][size=14px]ABPP [/size][/font][font='times new roman'][size=14px]技术可分为竞争性标记方法和生物正交的探针模拟物标记方法。[/size][/font][font='times new roman'][size=14px]1.%2.%3 [/size][/font][font='times new roman'][size=14px]非化学修饰的蛋白质组学方法[/size][/font][font='times new roman'][size=14px]1.1.%3.%4 [/size][/font][font='times new roman'][size=14px]细胞热位移测定[/size][/font][font='times new roman'][size=14px]在过去[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]20 [/size][/font][font='times new roman'][size=14px]年中,热位移分析([/size][/font][font='times new roman'][size=14px]TSA[/size][/font][font='times new roman'][size=14px])已成为最广泛使用的无修饰药物靶点发现方法之一。这种方法简单直接,但探针无法区分不同的蛋白质,因此[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]TSA [/size][/font][font='times new roman'][size=14px]仅适用于纯化蛋白质的实验。为了规避这个问题,[/size][/font][font='times new roman'][size=14px]Molina [/size][/font][font='times new roman'][size=14px]等人开发了一种概念上相似的技术,称为[/size][/font][font='times new roman'][size=14px]细胞热位移测定[/size][/font][font='times new roman'][size=14px]([/size][/font][font='times new roman'][size=14px]C[/size][/font][font='times new roman'][size=14px]ETSA[/size][/font][font='times new roman'][size=14px])[/size][/font][font='times new roman'][size=14px],用于直接研究细胞环境中的药物[/size][/font][font='times new roman'][size=14px]-[/size][/font][font='times new roman'][size=14px]靶标相互作用。如图[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]([/size][/font][font='times new roman'][size=14px]A[/size][/font][font='times new roman'][size=14px])所示,细胞裂解物或完整细胞的多个等分试样首先用药物或载体处理,加热到不同的温度并冷却,然后通过离心分离出可溶性部分。随着温度的升高,蛋白质逐渐展开以暴露疏水核,导致蛋白质在高温下沉淀。蛋白质越稳定,蛋白质对热诱导沉淀的抵抗力越高,因此,可以测定可溶性蛋白质随温度变化的稳定性曲线。例如,该[/size][/font][url=https://www.sciencedirect.com/topics/chemistry/antifolate][font='times new roman'][size=14px]方法通过叶酸[/size][/font][/url][font='times new roman'][size=14px]抗癌药物[/size][/font][url=https://www.sciencedirect.com/topics/chemistry/methotrexate][font='times new roman'][size=14px]甲氨蝶呤[/size][/font][/url][font='times new roman'][size=14px]与[/size][/font][url=https://www.sciencedirect.com/topics/chemistry/dihydrofolates][font='times new roman'][size=14px]二氢叶酸[/size][/font][/url][font='times new roman'][size=14px]还原酶的结合、雷替曲塞与胸苷酸合成酶的结合进行了药物靶标的验证。[/size][/font][font='times new roman'][size=14px]CETSA[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]是一种允许研究活细胞中药物靶点的方法。[/size][/font][font='times new roman'][size=14px]CETSA[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]结合小分子库可用于筛选潜在抑制剂、评估靶标参与效率和监测靶标特异性。此外,[/size][/font][font='times new roman'][size=14px]CETSA[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]还可用于筛选[/size][/font][font='times new roman'][size=14px]新药和表型化合物的靶点,解决脱靶蛋白、结合机制、药物疗效和完整细胞耐药性等[/size][/font][font='times new roman'][size=14px]问题。[/size][/font][font='times new roman'][size=14px]1.2.%3.%4 [/size][/font][font='times new roman'][size=14px]热蛋白组学分析[/size][/font][font='times new roman'][size=14px]热蛋白组学分析([/size][/font][font='times new roman'][size=14px]TPP[/size][/font][font='times new roman'][size=14px])首先将蛋白在有或无活性小分子情况下孵育,并加热到不同的温度以诱导蛋白变性,剩余的可溶性蛋白用缓冲液提取。如图所示,在每个温度下,可溶性蛋白通过高分辨质谱进行量化,画出变性曲线,进一步测[/size][/font][align=center][font='times new roman'][size=14px]4[/size][/font][/align][align=center][/align][font='times new roman'][size=14px]定热稳定性和识别配体引起的变化。其中,[/size][/font][font='times new roman'][size=14px]50% [/size][/font][font='times new roman'][size=14px]蛋白发生聚沉时的温度为[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]Tm[/size][/font][font='times new roman'][size=14px]([/size][/font][font='times new roman'][size=14px]melting temp[/size][/font][font='times new roman'][size=14px]e[/size][/font][font='times new roman'][size=14px]r[/size][/font][font='times new roman'][size=14px]a[/size][/font][font='times new roman'][size=14px]tur[/size][/font][font='times new roman'][size=14px]e[/size][/font][font='times new roman'][size=14px])[/size][/font][font='times new roman'][size=14px],通过对比加药前后[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]T[/size][/font][font='times new roman'][size=14px]m[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]的变化,确定活性分子的靶蛋白。[/size][/font][font='times new roman'][size=14px]TPP[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]可以[/size][/font][font='times new roman'][size=14px]通过定量[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]MS [/size][/font][font='times new roman'][size=14px]分析,在蛋白质组水平评估活细胞中活性分子与蛋白结合的情况。[/size][/font][font='times new roman'][size=14px]图[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]([/size][/font][font='times new roman'][size=14px]A[/size][/font][font='times new roman'][size=14px])[/size][/font][font='times new roman'][size=14px]细胞热位移测定和[/size][/font][font='times new roman'][size=14px]([/size][/font][font='times new roman'][size=14px]B[/size][/font][font='times new roman'][size=14px])[/size][/font][font='times new roman'][size=14px]热蛋白组学分析简要工作流程[/size][/font][font='times new roman'][size=14px][14][/size][/font][font='times new roman'][size=14px]药物亲和反应的靶点稳定性技术[/size][/font][font='times new roman'][size=14px]药物亲和反应的靶点稳定性技术([/size][/font][font='times new roman'][size=14px]DARTS[/size][/font][font='times new roman'][size=14px])是一种鉴定药物靶标的新方法。药物[/size][/font][font='times new roman'][size=14px]与靶蛋白结合后,靶蛋白对蛋白酶的敏感性降低,与对照组相比,药物结合蛋白更不[/size][/font][url=https://www.sciencedirect.com/topics/chemistry/protein-hydrolysis][font='times new roman'][size=14px]易水解[/size][/font][/url][font='times new roman'][size=14px]。这种差异可通过蛋白凝胶电泳和质谱等技术对差异蛋白进行鉴定,可以确定[/size][/font][font='times new roman'][size=14px]药物直接作用的靶点蛋白[/size][/font][font='times new roman'][size=14px],最大优势是不需要对药物进行任何化学修饰,即可以确定药物的直接结合蛋白。[/size][/font][font='times new roman'][size=14px]DARTS[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]在天然小分子靶点的鉴定中发挥了重要的作用,例如[/size][/font][font='times new roman'][size=14px]对[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]ecumicin[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]、白藜芦醇[/size][/font][font='times new roman'][size=14px]([/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]resveratrol [/size][/font][font='times new roman'][size=14px])[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]等多种天然产物蛋白靶点的鉴定[/size][/font][font='times new roman'][sup][size=14px]。但[/size][/sup][/font][font='times new roman'][size=14px]DARTS[/size][/font][font='times new roman'][size=14px] [/size][/font][font='times new roman'][size=14px]也存在局限性,例如细胞裂解液中的低丰度蛋白的鉴定和非特异性结合会导致[/size][/font][font='times new roman'][size=14px]蛋白对蛋白酶的敏感性升高增加。利用这一特性,研究者还开发了药物亲和力响应靶稳定性的方法用于药物靶点筛选。[/size][/font]
蛋白质组学的发展方兴未艾,是后基因组时代重点关注的热点领域,新思路,新技术层出不穷,应用领域和场景不断拓展。Seer公司就是在这种大背景下诞生的一家科技新锐,其提供的Proteograph?XT平台利用经过特殊制作的纳米粒子磁珠,在跨数十个数量级丰度之间,非特异性地结合各类蛋白,无需额外去除高丰度蛋白,再利用高性能的质谱技术,达到高精度测量。在兼顾深度,增强蛋白组分析通量的情况下,实现对大规模血液蛋白的可重复性定量分析,创造了无偏差高通量探寻生物标记物的机会。[align=center][img=seer logo.png]https://img1.17img.cn/17img/images/202401/uepic/42b422db-bf9d-414d-a2f0-de6930c6639e.jpg[/img][/align]在近期召开的JPM Healthcare 2024期间,Seer公司董事长兼CEO Omid Farokhzad说,Seer相信即将发布的使用其Proteograph产品组合的学术出版物将有助于推动对该平台的兴趣,并最终推动销售。然而,这个过程需要时间。Seer公司总裁兼CFO David Horn指出,关于2024年,他说公司对前景保持“相对谨慎的态度。”“外面仍有一些宏观不确定性,”Horn说。“而且......我认为我们正处于真正展示该平台所支持的生物学见解积累的阶段。”[align=center][img=seer-蛋白质组学发展.png,600,328]https://img1.17img.cn/17img/images/202401/uepic/e82b98c6-09ca-42b3-bcb0-ba5cb2363a67.jpg[/img][/align]Seer的技术利用纳米粒子富集等离子样品进行蛋白质组分析,这是2023年等离子蛋白质组学取得重大进展的重要组成部分。在2023年的美国质谱学会年会上,[b][color=#ff0000]赛默飞使用Seer的新Proteograph XT试剂盒在其Orbitrap Astral仪器上检测了近6000种等离子蛋白。[/color][/b]在2024年的JP Morgan会议上,Farokhzad展示了一项[b][color=#ff0000]涉及2500个样本的研究数据,显示Proteograph XT与Orbitrap Astral的组合总共识别出10000多种蛋白。[/color][/b]他补充说,到目前为止,约50%的Seer客户已从原来的Proteograph转向XT。[align=center][img=seer-astral.png,600,495]https://img1.17img.cn/17img/images/202401/uepic/e1df9c01-100c-4e1e-9adf-9eac13934b76.jpg[/img][/align]尽管取得这些进步,Seer公司Proteograph系统的销售速度在2023年比预期慢。6月,Seer公司启动了Seer技术访问中心(STAC)服务业务,研究人员可以通过该中心使用Orbitrap Astral上的Proteograph XT。到目前为止,STAC计划已经为48个研究组织提供服务,包括6家大型制药公司,Farokhzad说。[url=https://www.instrument.com.cn/news/20230919/684691.shtml][color=#ff0000](延伸阅读:赛默飞宣布与Seer扩大合作)[/color][/url][align=center][img=seer 发表论谈.png,600,329]https://img1.17img.cn/17img/images/202401/uepic/ec75c405-e342-4776-9811-a296b9b35f13.jpg[/img][/align]最后,Seer认为Proteograph销售增长取决于论文发表展示该技术应用效果的数据。Farokhzad强调了该公司预计将在今年的同行评议出版物中发表的几篇使用Seer技术的预印本,包括诊断公司PrognomiQ的工作。推荐文章:1. [url=https://www.instrument.com.cn/news/20240111/701026.shtml]从JPM2024看科学仪器市场机会——重点趋势关键词盘点[/url]2. [url=https://www.instrument.com.cn/news/20240110/700731.shtml]JPM亮点|赛默飞CEO看好这两类仪器与这一市场前景[/url]3. [url=https://www.instrument.com.cn/news/20240110/700659.shtml]JPM2024亮点|布鲁克2023年营收涨13%,中国投资蛋白质组学推动增长[/url]4. [url=https://www.instrument.com.cn/news/20231023/688717.shtml]14国科学家齐聚广州,为了这个蛋白质组学计划![/url][来源:仪器信息网] 未经授权不得转载[align=right][/align]