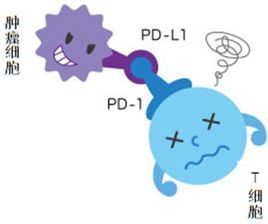
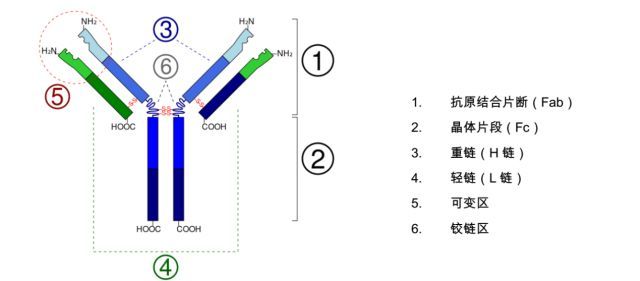
行研报告:抗体药行业研究报告
p style=" text-align: center " span style=" color: rgb(89, 89, 89) " strong 目录 /strong br/ /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 1 抗体概述 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 1.1 抗体 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 1.2 抗体的制备过程 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 2 抗体药概述及市场分析 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 2.1 抗体药概述及发展历程 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 2.2 抗体药的分类 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 2 抗体药概述及市场分析 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 2.3 抗体药作用机制 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 2.4 抗体药物的核心技术 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 2.5 抗体药物的技术发展趋势 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 2.6 抗体药物的应用进展 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 2.7 抗体药与化学药相比的优势 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 3 国际抗体药分析 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 3.1 国际抗体药市场发展 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 3.2 国际抗体药技术发展 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 4 国内抗体药分析 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 4.1 国内抗体药市场布局 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 4 国内抗体药分析 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 4.2 政策有利我国抗体药发展 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 4.3 国内抗体药研究情况 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 4.4 国内抗体药研发企业概况 /strong /span /p p style=" text-align: left " span style=" color: rgb(89, 89, 89) " strong 4.5 国内抗体药产业投资分布 br/ br/ /strong /span strong style=" text-align: center " 一、抗体概述 br/ /strong strong style=" text-align: center " 1.抗体 /strong /p p 抗体(antibody)指的是由抗原刺激后由免疫细胞产生的能与抗原发生特异性反应的免疫球蛋白,典型的抗体结构由两条重链(H 链)和两条轻链(L 链)构成,每条链又分为稳定区(C 区)和可变区(V 区), 其中可变区的多样性决定了抗体的多样性与特异性,使得抗体具有结合特定抗原的能力。比较不同特异性抗体的VL和VH的氨基酸顺序显示,变异仅集中在其中少数区域的氨基酸上(15%~20%),称为超变区。(hypervariable)超变区是抗体的抗原结合位,与抗原决定簇的结构互补,故又称为互补决定区(complementarity-determining regions,CDRs) 。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/25de6df2-9266-4c9c-a549-9d2f67756128.jpg" title=" 1.jpg" alt=" 1.jpg" width=" 426" height=" 199" style=" width: 426px height: 199px " / /p p 抗原以异源蛋白居多,通常情况下免疫系统能够识别抗原上面的多个位点,针对不同的位点会特异性的产生针对该位点的抗体来结合抗原,由此产生的抗体集合我们称之为多克隆抗体。多克隆抗体由多种针对不同抗原的抗体组成,因而特异性差,使用时容易出现交叉免疫反应,故治疗范围较小,仅限于免疫学检测、被动免疫治疗和紧急预防。鉴于多抗的种种不足,医疗工作者便开始试想能够筛选制备出由单细胞增殖产生的,针对某一特定抗原决定簇的抗体,这样可以大幅提高抗体的特异性,减少交叉免疫副作用,拓展治疗范围, 这类具有高度均一性抗体就被称为单克隆抗体(monoclonal antibody,简称单抗或 mab)。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/a02af7bf-79f2-4a29-ac42-bfc1678adab5.jpg" title=" 2.jpg" alt=" 2.jpg" / /p p style=" text-align: center " 图1. 单抗和多抗 /p p style=" text-align: center " 资料来源: 渤海证券研究所 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/7c4cda66-5941-49c6-8a3e-de4b33dc5fca.jpg" title=" 3.jpg" alt=" 3.jpg" / /p p style=" text-align: center " 图2. 抗体产生过程 /p p style=" text-align: center " 资料来源: 长江证券研究所 /p p strong 单克隆抗体具有以下三个特点: /strong /p p 特异性: 单抗只针对含有特定抗原的病灶细胞(如肿瘤细胞),因而专一性强、副作用较小 /p p 特效性: 单抗主要被用于肿瘤和自体免疫疾病(如类风湿)等发病率较高、对人类健康影响较大的复杂疾病,现存疗法(如放化疗、激素疗法)副作用强,效果有限。单抗的问世使其自然而然的成为了此类疾病的特效药 /p p 改造潜力大: 单抗药物具有很强的改造潜力,在单抗或单抗片段上?“加挂”放化疗药物可以使药物?精确“制导”到达病灶,大幅减少了用药量和副作用。 /p p strong 目前,单克隆抗体在医学上的应用主要有以下三类: /strong /p p 诊断试剂:主要用于检测淋巴细胞表面分子,鉴别淋巴细胞 鉴定病原体,准确诊断传染病 肿瘤诊断和分型 测定体内激素含量等 /p p 医学科研:主要用于纯化抗原 分析抗原结构和抗原决定簇分子功能等 /p p 单抗药物: 包括多个小类,细胞表面分子单抗用于移植排斥反应的防治 细胞因子单抗用于自身免疫性疾病的治疗 抗肿瘤单抗用于肿瘤治疗。 /p p 在上述用途中, 单抗药物无疑是最为重要、市场最大的应用领域。 相对于多抗和传统化学药物,单抗药物具有多方面的优势,这些特点使得单抗被广泛的应用于抗肿瘤、自体免疫疾病治疗、抗器官移植排异、抗感染等临床治疗领域。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/0e2ac6b1-1771-402d-b854-0e4b278cf34c.jpg" title=" 4.jpg" alt=" 4.jpg" / /p p style=" text-align: center " 表1. 单抗与多抗、传统化学药物对比 /p p style=" text-align: center " 资料来源:兴业证券研究所 /p p strong 2.抗体的制备过程 /strong /p p 由于单一的 B 淋巴细胞克隆是比较活跃的细胞,它们往往因为自身活跃的基因表达状 态,而比较容易凋亡,因此单独获得 B 淋巴细胞以后也很难大批量的获取单抗。但 Georeges Kohler 和 Cesar Milstein 发明的“单克隆杂交瘤技术”解决了这个难题:他们将B细胞克隆和骨髓瘤细胞进行细胞融合,如此形成的杂交细胞具有肿瘤细胞不死的性质而大大延长了B细胞表达单克隆抗体的能力,使得单克隆抗体的运用成为可能。 /p p 在细胞体外培养技术尚未成熟前,科研人员将融合细胞注入小鼠体内,生产肿瘤,进而 产生大量腹水,单抗主要集中在腹水中,人们收集小鼠的腹水,然后提纯得到单抗。但是该方法的缺点非常明显,就是无法大规模的生产。随着细胞体外培养技术的成熟,目前我们可 以将融合细胞在培养基中大规模的培养获取单抗,这也为单抗药物的诞生创造了有利条件。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/72e15082-e36e-4802-b95d-8ed00b5e7049.jpg" title=" 5.jpg" alt=" 5.jpg" / /p p style=" text-align: center " 图2.人工制备单克隆抗体的过程 br/ strong 二 /strong strong 抗体药概述及市场分析 /strong /p p strong 1.抗体药概述及发展历程 /strong /p p 抗体药物是以细胞工程技术和基因工程技术为主体的抗体工程技术制备的药物,具有特异性高、性质均一、可针对特定靶点定向制备等优点,在各种疾病治疗,特别是肿瘤治疗领域的应用前景备受关注。 /p p 第一代抗体药物源于动物多价抗血清,主要用于一些细菌感染性疾病的早期被动免疫治疗。虽然具有一定的疗效,但异源性蛋白引起的较强的人体免疫反应限制了这类药物的应用,因而逐渐被抗生素类药物所代替。 /p p 第二代抗体药物是利用杂交瘤技术制备的单克隆抗体及其衍生物。单克隆抗体由于具有良好的均一性和高度的特异性,因而在实验研究和疾病诊断中得到了广泛应用。1986年,美国FDA批准了世界上第一个单抗治疗性药物——抗CD3单抗OKT3进入市场,用于器官移植时的抗排斥反应。此时抗体药物的研制和应用达到了顶点。随着使用单抗进行治疗的病例数的增加,鼠单抗用于人体的毒副作用也越来越明显。由于大多数单抗均为鼠源性,在人体内反复应用会引起人抗鼠抗体(HAMA)反应,从而降低疗效,甚至可引起过敏反应。 /p p 近年来,抗体药物的研发进入了第三代,即基因工程抗体时代。与第二代单抗相比,基因工程抗体具有如下优点:①通过基因工程技术的改造,可以降低甚至消除人体对抗体的排斥反应 ②基因工程抗体的分子量较小,可以部分降低抗体的鼠源性,更有利于穿透血管壁,进入病灶的核心部位 ③根据治疗的需要,制备新型抗体 ④可以采用原核细胞、真核细胞和植物等多种表达形式,大量表达抗体分子,大大降低了生产成本。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/a8d6d77e-a080-418e-9b3e-4d8496afd2d2.jpg" title=" 6.jpg" alt=" 6.jpg" / /p p style=" text-align: center " 资料来源: 中商情报网、 FDA、 长城证券研究所 /p p strong 2.抗体药的分类 /strong /p p 随着基因工程技术的发展,人们开始改变鼠源单抗的结构,使其更接近人源蛋白的构造,从而减轻其在人体内的免疫反应。目前的单抗产品主要可以分为以下四类:鼠源化抗体、嵌合型抗体、人源化抗体以及完全人源化抗体。 /p p 鼠源化抗体顾名思义就是完全分泌自小鼠细胞的抗体,其与人体的兼容性最差,容易引 起较强的免疫反应,目前已经较少使用。 /p p 嵌合型抗体就是把鼠源抗体的活性区域嵌合到人源抗体的稳定区域中,这样鼠源活性区 域仍能够发挥活性,识别目标蛋白。而新抗体 70%以上的区域均为人源抗体的稳定区域, 这样可以大大降低抗体的异源性,使得嵌合抗体的效价更高。此外,嵌合抗体结合目标抗原 以后,其人源保守区域能够被免疫系统识别,达到通过人体免疫来清除抗原的效果。 /p p 人源化抗体是将鼠源抗体基因中的活性片段转接到人源抗体的基因表达框中,这样表达 出来的抗体人源化区域的比例更高,能够达到 90%左右,这样能够进一步提高单抗在人体 内的活性。 /p p 完全人源化抗体是将小鼠体内的目标抗体基因敲出,然后用对应的人源抗体基因代替, 这样产生的抗体与人体内产生的抗体几乎完全一样,效价能能够达到最高。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/77a936c3-daa0-4ca7-9228-5b9c1be1db3a.jpg" title=" 7.jpg" alt=" 7.jpg" / /p p style=" text-align: center " 图4.各种类型单抗的比较 /p p style=" text-align: center " 资料来源:兴业证券研究所 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/844567fb-f131-4eae-9884-d0ca67814338.jpg" title=" 8.jpg" alt=" 8.jpg" / /p p style=" text-align: center " 表2. 四代单抗技术对比 /p p style=" text-align: center " 资料来源: Current Pharmaceutical Biotechnology、Methods、兴业证券研究所 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/47a0ea49-7099-452a-bfef-7dcf560f8249.jpg" title=" 9.jpg" alt=" 9.jpg" / /p p style=" text-align: center " 图5. 1980-2004 年每年进入临床试验的各类型单抗产品数量 /p p style=" text-align: center " 资料来源:长江证券 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/ac26a08d-774d-4731-aab9-0ac57d3b940a.jpg" style=" " title=" 10.jpg" / /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/7b11b88b-0496-453a-a714-b8c3dfc5ff19.jpg" style=" " title=" 11.jpg" / /p p style=" text-align: center " 表1. 美国FDA批准的抗体药物 /p p style=" text-align: center " (Therapeutic monoclonal antibodies approved by the US FDA) /p p style=" text-align: center " strong 二 抗体药概述及市场分析 /strong /p p strong 3.抗体药作用机制 /strong /p p 抗体药物作用机制比较复杂,但一般可归结为以下5类:细胞毒性药物、抑制细胞增殖、调节细胞的激活和相互作用、调节人自身免疫系统、中和抗原。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/758a6ec4-3cea-4369-a2d4-c84bc8b6d16e.jpg" title=" 12.jpg" alt=" 12.jpg" / /p p style=" text-align: center " 图6. 单抗作用原理 /p p style=" text-align: center " 资料来源:生物制药小编 /p p 3.1 抑制细胞的生长和增殖 /p p 某些抗体药物可以通过结合肿瘤细胞增殖的生长因子,阻断生长和增殖过程,可以用来治疗癌症。如西妥昔单抗、Necitumumab、帕尼单抗靶向EGFR,用来治疗头颈癌和非小细胞癌等。帕妥珠单抗、曲妥珠单抗和ado-trastuzumab靶向HER2(EGFR family),用于治疗乳腺癌。VEGF靶点与血管增生有关,癌细胞的增殖需要大量能量,通常伴随血管增生。如阿柏西普、雷莫芦单抗、雷珠单抗、贝伐珠单抗、康柏西普等,可用来治疗癌症和wet-AMD等。 /p p 3.2 细胞毒性 /p p 癌症、自身免疫疾病的一个首要目标就是杀死异常细胞,抗体可以通过各种机制诱导细胞的死亡。ADC药物通过细胞毒素杀死细胞,抗体药物均可以通过ADCC、ADCP、CDC作用杀死细胞。 /p p 3.3 调节人自身免疫系统 /p p 自身免疫疾病从抗体药物的发展中获益巨大,如TNF-α抗体是迄今最为成功的药物靶点。依那西普、英夫利昔单抗、阿达木单抗,都是年销售额80亿美元以上的重磅炸弹药物,阿达木单抗更是继立普妥之后坐稳药王宝座,2015年销售额143亿美元,2016年上半年即销售77亿美元。除了TNF-α,还有多个涉及调节炎症性反应的细胞因子靶点,如IL-1、IL-5、IL-6/L-6R、IL-12、IL-17A、IL-23、BCMA等。 /p p 3.4 调节细胞激活和相互间作用 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/43a45803-bda2-4141-a92f-1c520b452351.jpg" title=" 13.jpg" alt=" 13.jpg" / /p p 如上图A中,T细胞的激活需要2种信号通路的协同作用:抗原呈递细胞(APC)上的MHC与T细胞上的TCR(其中一个亚基为CD3)结合、APC上的CD80/86与T细胞上的CD28结合。FDA历史上第一个抗体药物Muromomab就是靶向CD3的,近年来双特异性抗体的一个核心发展方向也是结合其他靶标与CD3,达到募集T细胞与靶细胞的作用,2014年,FDA批准了双特异性抗体Blincyto(靶向CD19/CD3)。阿巴西普、贝拉西普则靶向CD80/CD86。这些抗体药物的目的都是阻止T细胞的激活,从而治疗自身免疫病或者器官移植后的排斥反应。还可以通过靶向T细胞上其他蛋白(如阿法赛特靶向CD2)、相关炎症调节因子的受体(如巴利昔单抗、达利珠单抗靶向CD25)来阻止T细胞的激活。 /p p 在针对癌症适应症的时候,则需要激活内源免疫系统来杀灭癌细胞。如伊匹单抗靶向CTLA4、纳武单抗和派姆单抗靶向PD-1、阿替珠单抗(Atezolizumab)靶向PD-L1,即所谓的免疫检点抑制剂,通过解除癌细胞对免疫细胞的抑制作用,杀伤癌细胞。 /p p 3.5 中和外源分子 /p p FDA批准的第一个此类抗体药物是怕利珠单抗,靶向RSV病毒F蛋白。瑞西巴库单抗、obiltoxaximab是FDA批准的另外两个抗毒素抗体,均用于避免炭疽杆菌的感染。2015年,FDA批准了Idarucizumab,用于中和达比加群酯,主要用于逆转达比加群酯的抗凝作用,使得后者的使用更有保险。 /p p strong 4.抗体药物的核心技术 /strong /p p 单抗的研发生产是一个技术密集型流程,大体可分为抗体筛选、抗体表达和抗体纯化三个环节,每个环节都拥有其核心技术,这些核心技术环环相扣,形成了单抗生产企业的核心竞争力。 /p p 4.1 抗体筛选:噬菌体展示技术已成全人源单抗筛选主流 /p p 随着单抗人源化进程的不断深入,以噬菌体展示技术(详见附录)为核心的大规模单抗筛选平台日益受到重视。该技术不仅可以获得全人单抗, 而且不需要细胞融合, 不经过免疫动物, 实验周期短,过程简单,这是人源抗体制备技术的重大突破,目前国际上主流单抗生产企业均使用噬菌体展示技术筛选单抗药物。 /p p 4.2 表达培养技术: 方法、规模、体系和表达量是?四要素 /p p 作为单抗研发生产链条中承上启下的一环,表达培养技术是单抗产量形成和质量控制的关键,而判断企业这方面技术水平高低的指标主要有表达方法、反应器规模、表达体系和表达量这“四要素”。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/54f98542-b88e-41a4-adc7-744586fc68c7.jpg" title=" 14.jpg" alt=" 14.jpg" / /p p style=" text-align: center " 表3. 表达培养技术四要素 /p p style=" text-align: center " 资料来源:兴业证券研究所 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/4e4464a3-7926-4800-abae-e3214e1d5084.jpg" title=" 15.jpg" alt=" 15.jpg" / /p p style=" text-align: center " 图4. 工业化单抗生产流程 /p p style=" text-align: center " 资料来源:兴业证券研究所 /p p 4.3 分离纯化技术 /p p 在得到单抗之后如何有效的从培养液中分离纯化产物是单抗生产最后一道关键环节,工业上一般采用硫酸铵沉淀、离子交换层析、蛋白-Sepharose 亲和层析等方式纯化单抗,由于平均每增加一个纯化步骤产品得率会降低约 13%,因而在保证纯度的同时尽可能提高得率也考验着生产商的技术水平。 /p p 总的来说,一个单抗生产商如果在上游能够通过出色的研发平台筛选出理想的单抗药物 在中游能够高效大规模的进行发酵培养,表达单抗 在下游能够高效、高纯度的分离纯化单抗,那么该公司就拥有了单抗研发生产的核心竞争力。 /p p strong 5. 抗体药物的技术发展趋势 /strong /p p 根据单抗本身的技术特性和近年来的发展情况,我们认为未来单抗技术发展将呈现以下几方面趋势: /p p 单抗全人化: 由于高人源化比例抗体在药效和副作用方面的优势,在过去 20 年中人源和全人单抗比例持续上升(08 年底销售占比分别为 31%和 11%),而鼠源和嵌合单抗比例则不断下降(08 年底占比分别为 10%和 49%),随着全人化单抗筛选技术的成熟,在研的新型单抗药物越发倾向于使用全人抗体技术,我们预计未来 5 年内新问世的单抗药物中全人单抗将占一半以上。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/89c525c7-c5eb-4bf8-b25a-c82ed46b36ba.jpg" title=" 16.jpg" alt=" 16.jpg" / /p p style=" text-align: center " 图5. 人源化比例提高是大势所趋 /p p style=" text-align: center " 资料来源:兴业证券研究所 /p p 抗体多样化: 除了人源化比例的不断提高,单抗研发也在多样性上不断推进。一方面, 单抗的药物靶位逐渐多样化,除了传统的细胞表面抗原(CD 表面抗原,负责多种细胞信号转导,截止 2009 年发现 390 种分子),还包括了常见的细胞因子(如肿瘤坏死因子 TNF,血管内皮生长因子 VEGF,白介素 IL 等),部分研制中的单抗药物甚至可以识别多个抗原表位,具有更好的抗突变功能 另一方面,单抗药物的结构也不再限于完整的单抗分子,而是包括了如 Fab、 scFV 等抗体 V区片断或其复合物,这些片断可以通过原核表达体系快速低成本表达,从而降低了药物成本。 /p p 治疗联合化: 虽然在单抗治疗肿瘤方面单抗具有副作用小、特异性高的特点,但由于中晚期肿瘤病灶巨大,一般单靠单抗并不能完全消除,这就需要使用单抗配合手术的治疗方案,通过手术切除肿瘤主体,再使用单抗治疗剩余病灶或防止病灶转移。除手术外,化学药物和单抗联合治疗方案也日益受到医疗工作者的重视,如实验证实 FOL+FOX4 方案(Avastin+奥沙利铂+亚叶酸钙+氟尿嘧啶)可以延长肿瘤患者生存期 2.5 个月。 /p p strong 6.抗体药物的应用进展 /strong /p p 目前正在进行开发和已经投入市场的抗体药物主要有以下几种用途:1.器官移植排斥反应的逆转 2.肿瘤免疫诊断 3.肿瘤免疫显像 4.肿瘤导向治疗 5.哮喘、牛皮癣、类风湿性关节炎、红斑狼疮、急性心梗、脓毒症、多发性硬化症及其他自身免疫性疾病 6.抗独特型抗体作为分子瘤苗治疗肿瘤 7.多功能抗体(双特异抗体、三特异抗体、抗体细胞因子融合蛋白、抗体酶等)的特殊用途。 /p p 在进行器官移植时,可以采用某些抗体类药物来逆转器官移植引起的排斥反应。如最早批准(1986年)进入美国市场的治疗性抗体类药物——抗CD3单抗即被用于肾、心脏、肝脏移植排斥的逆转。抗体药用于器官移植免疫排斥反应已发展比较完善。 /p p 近年来人们将更多的目光集中在治疗肿瘤的抗体药物开发上。“生物导弹”,即将各种毒素、放射性同位素、化疗药物与识别肿瘤特异抗原或肿瘤相关抗原的抗体偶联后,能够特异杀伤肿瘤细胞的一类药物。这种药物经由静脉注入人体内,药效分子集中作用于肿瘤细胞,既增强疗效又减少对机体的毒副作用。 /p p 抗体药物目前市场占有度较多的领域为抗癌和自身免疫性疾病,其次用于抗感染、心血管疾病、器官移植免疫排斥反应等。从近年来进入临床试验的单克隆抗体的适应症来看,未来一段时期内,肿瘤治疗仍是抗体药应用的主要占比。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/dd78be75-1b98-4c90-a646-cd180e697ff7.jpg" title=" 17.png" alt=" 17.png" / /p p style=" text-align: center " 表2. 截止2016年全球上市抗体药物数量 /p p style=" text-align: center " 数据来源:药渡 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/9744ba94-12e2-447a-bb2a-7064942b2343.jpg" title=" 18.jpg" alt=" 18.jpg" / /p p style=" text-align: center " 表3. 截止2016年全球上市药物销售额 /p p style=" text-align: center " 数据来源:药渡 /p p 对于后期开发阶段(Ⅲ期临床和BLA)的抗体药物,《MAbs》杂志主编Reichert, J.M自2009年底起连续9年每年推出“Antibodies to watch in ?.year”系列综述,2010年初到2017年初的8年间后期开发阶段抗体数目依序分别为26个、32个、25个、29个、38个、45个、60个和61个(备注:此处61个产品均为首次进入Ⅲ期临床阶段的未上市新产品,而上述IMGT数据库查询结果124个包括了已经上市产品正在进行的Ⅲ期临床适应症扩展)。其中处于Ⅲ期临床阶段的抗体药物数目及其适应症构成如图2,从中可以看出针对非肿瘤适应症类的抗体药物占比有增多趋势,在研抗体药物种类更加多样化。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/d1991550-3f49-4acd-aaa4-22776bd9a226.jpg" title=" 19.jpg" alt=" 19.jpg" / /p p style=" text-align: center " 表2. 2010-2017年初III期临床阶段产品适应症分布 /p p style=" text-align: center " 数据来源:Reichert系列综述 /p p strong 7.抗体药与化学药相比的优势 /strong /p p 相对于小分子药物,单抗产品最大的优点就是“精确”,能够针对特异性的靶点进行治疗,降低副反应的同时增强了功效。以单抗产品使用最为广泛的肿瘤治疗为例。在传统的治疗中,肿瘤患者一般会接受化疗和放疗两种治疗,但是不论哪种方式都会对患者的身体造成极大的伤害。在化疗过程中,患者一般会出现肠胃功能混乱,免疫力降低,造血功能受抑制等副作用 而放疗使患者本身就要受到辐射伤害。究其原因,是因为这两种传统治疗方法都是“广谱”治疗,也就是不论对肿瘤细胞还是正常细胞都会杀伤,这样造成效价较低。而单抗产品能够精确到细胞级别,针对病灶进行治疗,效价较高。 /p p 单抗药物开发更具资金和时间优势。与开发创新化学药物(包括小分子靶向药物)相比,开发单抗药物具有明显的资金和时间优势。开发一种创新型化学药物需要在临床前阶段进行大量的分子筛选和动物试验,有机化学家需要花费大量时间筛选出新的化学分子以发现“引导”化合物或对既有“引导”化合物进行新的修饰,并再次通过动物试验来初步评价药品的安全性以及收集吸收、代谢、排泄等相关生物效应数据,以保证该化合物可以进入人体临床测试阶段即成为“研究用新药”。整个过程一般需要 5-7 年,花费上亿美金。 /p p style=" text-align: center " strong 三 国际抗体药分析 /strong /p p strong 1.国际抗体药市场发展 /strong /p p 单克隆抗体由于可精确的攻击靶分子,且具有较少的毒副作用而成为人们期望中的理想药物。经过一段曲折的发展历程之后,于二十世纪九十年代进入了一个新的快速成长期。 /p p 随着技术的不断发展,1997 年,全球迎来了首个治疗肿瘤的嵌合单抗药物——Rituxan(美罗华)。Rituxan 是 Genetech 生产的一种用于治疗 B 细胞非霍奇金淋巴瘤(NHL)的单抗药物,通过联合化疗能显著延长患者的生存期,同时作为嵌合单抗,Rituxan 的副作用相对较小,因而其在 B 细胞 NHL 的治疗中得到了广泛应用,加上次年 Remicade(类克)、Herceptin(赫赛汀)等重磅单抗药物的上市,全球单抗产业开始了突飞猛进地发展。 /p p 1997-2015 年全球单抗产业发展迅猛,CAGR高达37.2%。1997年,全球单抗产业市场规模仅约 3.1 亿美元,到 2015年,市场规模已达到916.3亿美元,年均复合增长率高达37.2%。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/5d1703a1-d791-4f29-a0a8-7e81a2636685.jpg" title=" 20.jpg" alt=" 20.jpg" / /p p style=" text-align: center " 图7.单抗药物2005-2015年全球总销售额(单位亿美元) /p p style=" text-align: center " 资料来源:长城证券 /p p 1997-2007年是全球单抗产业增长的爆发期,2008年后增速放缓明显,但仍要显著高于全球医药行业的整体增速水平。1997-2007 年是全球单抗产业增长的爆发期,十年CAGR高达 58.6%。2008年以后,全球单抗产业增速放缓明显, 年均复合增长率降至 14.8%,但仍要显著高于全球医药行业约5%的增速水平。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/4d3d63ce-3654-4f8a-90f8-2927c60c00e3.jpg" title=" 21.jpg" alt=" 21.jpg" / /p p style=" text-align: center " 图8. 1997-2015 年全球单抗产业市场增速与全球医药行业增速对比 /p p 单抗产业现已成为全球生物制品行业中占比最大的子行业。经过多年的高速发展,单抗在全球生物制品行业中的市场占比已由 1997 年 2.5%上升到 2015年的 34.7%,成为全球生物制品行业中市场占比最大的子行业。与此同时,在单抗制品的带动下,生物制品在全球药品市场中的占比也逐年攀升。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/d58ff098-d216-4bdc-9437-a09ca2705332.jpg" title=" 22.jpg" alt=" 22.jpg" / /p p style=" text-align: center " 图9. 1997-2015 年单抗在全球生物制品行业中的市场占比 /p p strong 2.国际抗体药技术发展 /strong /p p 2.1大型药企优势明显 /p p 单克隆抗体研发的技术壁垒较高,研发周期较长,需要强大的资金和技术支持,因此在 单抗技术方面大型企业具有明显的优势,因此目前国外重磅的单抗产品主要集中在罗氏(基 因泰克),安进、GSK 和强生等公司,这些公司构建了成熟的单抗研发平台,在靶位基因的 筛选,基因的测序,抗体结构的构建,以及工业化生产等一系列流程上有着技术优势。从目 前已经上市销售的品种来看,我们可以发现单抗产品已经由初期的鼠源性和嵌合性产品逐步 转向了人源化和完全人源化产品,大型企业在蛋白结构重组方面也有自己的优势。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/bd44cdeb-6d56-4eae-8dd0-39745c9bcf80.jpg" style=" " title=" 23.jpg" / /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/485f10af-9064-4086-a32e-7d17c68f73fa.jpg" style=" " title=" 24.jpg" / /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/fefdc633-d80d-486c-a013-98cba0bffb3e.jpg" style=" " title=" 25.jpg" / /p p style=" text-align: center " 表2 国外单抗产品列表 /p p span style=" color: rgb(0, 112, 192) " CTLA4:细胞毒T淋巴细胞蛋白, PD-1:程序性细胞死亡蛋白1 /span /p p span style=" color: rgb(0, 112, 192) " PD-L1:程序性细胞死亡配体1, PD-L2:程序性细胞死亡配体2 /span /p p span style=" color: rgb(0, 112, 192) " 4-IBB:肿瘤坏死因子受体-9, IDO1:吲哚胺2,3-双加氧酶1 /span /p p span style=" color: rgb(0, 112, 192) " LAG3:淋巴细胞活化基因蛋白3, KIR:杀伤细胞免疫球蛋白样受体 /span /p p span style=" color: rgb(0, 112, 192) " OX40:肿瘤坏死因子受体4 /span /p p span style=" color: rgb(0, 112, 192) " TCR(T Cell Receptor,T细胞受体)、CAR(Chimeric Antigen Receptor,嵌合抗原受体) /span /p p style=" text-align: center " 数据来源:中国医学科学院陈晓光教授 /p p 2.2靶点和适应症 /p p 各大公司在研产品很多,其大的研发趋势是新靶点的发现和新增适应症,近年来看,在研产品还是以肿瘤治疗为主,在原本治疗淋巴癌、乳腺癌的产品基础上,新增了对实体瘤、黑色素瘤、血液肿瘤、霍奇金淋巴瘤等有效的产品。 /p p 适应症的新增,与新靶点的发现紧密相关。过去,是以传统的 CD 系列、IL 系列和 EGFR 靶点为主,近年随着PD-1、PD-L1、PD-L2、OX40等新靶点的发现,研发种类也日趋多样。当然我们也不能忽视同一靶点可以开发不同适应症,一般来说,同一个靶点在人的不同细胞中都存在,并且可能发挥不同的作用,因此充分发掘一个靶点在不同细胞通路中的作用,对于扩大一个单抗产品的适应症有重要的意义。 /p p IMGT数据库显示目前(2017年2月17日)有针对298个靶标的抗体药物正在进行开发或已经上市,较2016年同期的269个增加了29个靶标。除去前述的已有产品上市的40个靶点,在研的新靶标有258个。仍然是靶向肿瘤和免疫类的两大类疾病占绝大多数。据Reichert“Antibodies to watch in 2017”,2017年或近几年有可能上市的新靶标有32个,可能获批的新适应症约有18种。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/bb4b4356-d39d-46d7-9df9-bcb852abbc84.jpg" title=" 26.jpg" alt=" 26.jpg" / /p p style=" text-align: center " 表2. 近几年可能上市的新靶标和新适应症 /p p style=" text-align: center " 资料来源:IMGT 网站 /p p style=" text-align: center " strong 四 国内抗体药分析 /strong /p p strong 1.国内抗体药市场布局 /strong /p p 目前全球化学制药的创新已经进入瓶颈期,而生物制药的创新则层出不穷,随着新靶点 的发现和现有产品适应症的不断扩大,治疗性单抗产品的应用范围不断拓展。 /p p 我国单抗行业处于高速发展期,2010-2015年 CAGR近50%。我国单抗行业起步较晚,直到 1999 年才上市了第一个国产单抗药物——注射用抗人 T 细胞 CD3 鼠单抗,主要用于器官移植排斥反应。经过十多年的发展,至2015年,我国单抗产业市场规模已达到75亿元,近5年 CAGR 近 50%(2010年国内单抗产业市场规模约10.3亿元),发展迅猛。 /p p 2016-2020 年国内单抗行业 CAGR 达 30%。据中投顾问预测:到 2020 年,我国单抗产业市场规模将达到280亿元,2016-2020 年年均复合增长率达30%,仍远超 Research and Markets预测的未来5年全球单抗产业9.84%的增速水平。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/8e08f4da-a481-45b0-90df-c0dfbad39ea6.jpg" title=" 27.jpg" alt=" 27.jpg" / /p p style=" text-align: center " 图10. 2010-2020 年我国单抗产业市场规模及预测 /p p style=" text-align: center " 数据来源:长江证券 /p p 肿瘤治疗的巨大需求推动我国抗体药市场发展。国内单抗药物主要应用于抗肿瘤领域。不同于国际市场,目前国内上市单抗药物主要应用于抗肿瘤领域,相应市场占比超过70%。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/f803e304-6545-4b7c-aad1-f877c3c88540.jpg" title=" 28.png" alt=" 28.png" / /p p style=" text-align: center " 图11. 当前我国单抗药物主要应用疾病领域 /p p style=" text-align: center " 资料来源:长江证券 /p p 我国恶性肿瘤患病人数不断增加,市场规模持续扩大。受人口老龄化、环境污染等因素影响,我国恶性肿瘤发病率逐年上升,患病人数持续增长。2015 年,我国抗肿瘤药物市场规模已接近1000亿元, 2020年则有望突破2000亿元,市场空间巨大。 /p p style=" text-align: center " strong 四 国内抗体药分析 /strong /p p strong 2. 政策有利我国抗体行业发展 /strong /p p 2.1 产业政策 /p p 作为生物产业的重点发展方向之一,政府近年来出台了一系列政策来鼓励和支持我国单抗产业的发展。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/aefd999e-106b-435a-8046-b3955a76c20d.jpg" style=" " title=" 29.jpg" / /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/16b2311a-e78f-41c9-9a75-48a15b5e1a8b.jpg" style=" " title=" 30.jpg" / /p p style=" text-align: center " 表3.近年我国政府出台的鼓励抗体行业发展的相关政策 /p p style=" text-align: center " 数据来源:政府网站,渤海证券研究所 /p p 2.2医保政策 /p p 越来越多的单抗药物进入到地方医保目录。单抗药物价格通常较高,因而暂时未能进入到国家医保目录,但随着其治疗效果不断被认可,越来越多的单抗药物被增补到地方医保目录。随着人社部在时隔七年之后再次对基本医保药品目录展开调整,不排除有重磅级单抗药物进入到国家医保目录的可能。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/9cd91990-a4c7-46cd-89d9-a5f5c0baf50f.jpg" style=" " title=" 31.jpg" / /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/726ee7a1-e1d4-48d3-8f73-2077b4674d2a.jpg" style=" " title=" 32.png" / /p p style=" text-align: center" br/ /p p style=" text-align: center " 表4. 部分进入我国地方医保的单抗药物 /p p style=" text-align: center " 数据来源:药智网、药源网 /p p 药品审评审批政策:新药审评时间长阻碍了我国创新药的发展。长时间以来,我国新药审评耗时冗长,2014 年我国1.1和3.1类新药从申请临床到上市获批平均耗时63个月,远远 长于同期美国新药的平均审评时间(约 10 个月)。新药审评时间长不仅降低了我国药企对创新药研发的热情,也使得我国在全球创新药的竞争中逐渐处于劣势。药品审评审批制度改革将加快我国单抗行业发展。2015年8月,国务院发布《改革药品医疗器械审评审批制度的意见》,明确将加快创新药的审评审批,对创新药实行特殊审评审批制度,单抗药物作为创新药的一员,必将受益于此次药审改革,得到快速发展。 /p p strong 3. 国内抗体药研发概况 /strong /p p 至2017年2月17日,目前我国共有82家研制单位正在CDE进行171个抗体药物的注册研究,较去年同期增加企业11家,新增抗体32个。年度新增企业数屡创新高,2016年高达17家 加之以前进行过临床注册或已有产品获批但现无注册申报的6家企业,国内涉及抗体药物研制的单位共计88家。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/cdbc4590-5e6c-4fa9-b390-28a61845ce46.jpg" title=" 33.jpg" alt=" 33.jpg" / /p p style=" text-align: center " 表2. 各企业申报抗体数 /p p style=" text-align: center " 资料来源:生物制品圈 /p p 在这171个抗体药中,生产注册的仅有4个【上海百迈博的抗TNFα嵌和(CXSS1200005),中信国健的抗CD20嵌和(CXSS1100021)、抗HER2人源化(CXSS0700053,CXSS1100005),山东新时代的TNFαR-Fc融合蛋白(CXSS1000005) 不计数武汉生物制品研究所已终止的抗出血热鼠单抗(CXSS0800002)】。近5年无新申报生产注册的产品,且随着我国生物类似药原则的出台、标准的提高及与国际接轨,之前BLA申报的抗体的审评结局尚不得知。统计CDE“药物临床试验登记与信息公示平台”中登记的抗体药物信息,至今有30家国内本土企业的共计43个抗体药物处于各临床研究阶段。 /p p 在前述申报的171个产品中,以“1类新药”申报的有48个,占比28%。然而许多产品虽然以1类新药申报但国外已经有了相同或相似产品上市,非真正意义上的“国内外尚无产品上市”的1类新药。因可获得的产品确切信息有限,粗略估判国内申报的产品中的85%可归类为抗体类似药或抗体仿创药。其中仅抢仿7大热门“重磅炸弹”抗体的申报数就高达91个,Bevacizumab、Adalimumab、Rituximab、Trastuzumab、Cetuximab、Etanercept、Infliximab的抢仿厂家数分别为23家、21家、15家、10家、9家、8家和5家,合计起来的总占比虽然有降低趋势,但仍达到了注册抗体的一半以上(91/171=53%),如果这些抗体类似药都能够顺利进入市场,可以预见未来市场竞争态势将会异常惨烈。 /p p 就开发热点而言,国内企业已有了抗PD-1单抗、ADC药物、去岩澡糖化抗CD20抗体、抗PD-L1抗体、抗PCSK-9抗体、双特异性抗体的申报。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/cd122f45-5c13-421c-9b56-7ade8b17f5f3.jpg" title=" 34.jpg" alt=" 34.jpg" / /p p style=" text-align: center " 表5. 国内企业关于热点抗体的申报情况 /p p style=" text-align: center " 数据来源:生物制品圈 /p p 综上可见,全球抗体药物产业强劲发展,中国抗体药物上市及原始创新产品开发严重不足。无论是已上市销售的还是正在注册研究的抗体药物,国内企业在抗体靶标和新抗体基因发现、新抗体药物创制、产品种类等诸多方面,都与欧美日等发达国家有较大的差距。如火如荼的抗体类似药开发,对于解决国内抗体药物临床需求迫切、药物可及性差等问题意义重大。但国内在研抗体同质化较为严重,需提升我国创新抗体药物的开发及产业转化能力。 /p p strong 4.国内抗体药研发企业概况 /strong /p p 目前我国已形成以北京、上海、西安、武汉等为中心的产业基地,但我国企业研发能力相对薄弱,国产单抗药物主要为仿制药,在国内单抗市场,进口药仍占主导,国内企业市场份额仅占15%。但随着国家政策大力支持国产药品、进口药品专利到期增加等利好因素的叠加,国内抗体药物行业迎来发展机遇。 /p p 目前,在中国上市的抗体药物共有 23 个,其中,13 个是进口药,中国人开发生产的抗体只有10个,并且4个鼠源的抗体已无销售。2016年,中国抗体市场规模为 13.8 亿美元,其中,83% 的市场份额被进口抗体药物垄断。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/703fffda-96a9-458c-b9f7-a03aeda42bbe.jpg" style=" " title=" 36.jpg" / /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/9e50230c-0e8f-4249-84c2-7eab670dc623.jpg" style=" " title=" 37.png" / /p p style=" text-align: center" br/ /p p style=" text-align: center " 表4. 国内已上市抗体药 /p p style=" text-align: center " 资料来源:长江证券 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/ed00826f-82ab-485f-80c1-619b30179f3d.jpg" title=" 38.jpg" style=" text-align: center white-space: normal " / /p p style=" text-align: center " 表2. 国内抗体药研发现状 /p p style=" text-align: center " 数据来源:医药时间 /p p 近几年,中国创新生物药的发展取得了一些令人瞩目的成绩,我国第一个具有全球知识产权的单克隆抗体类药物康柏西普直通(专利持有人为成都康弘生物科技有限公司)美国 FDA 临床 III 期。我国在PD-1、PD-L1方面的研究不断取得突破,已成功报批的药企就有7家:君实生物(我国首个PD-1单抗获批)、恒瑞(2016年2月PD-1单抗获批临床)、百济神州、嘉和(2016年4月PD-1单抗临床申请获受理)、信达生物、思路迪(我国首个PD-L1单抗新药)、誉衡。同时,国内药企与国外企业抗体药物合作不断增加,如药明康德和阿斯利康、恒瑞和Incyte、信达和礼来、广东的中山康方等等。 /p p 目前国内抗体药研发实力较强的公司包括,传统优势药企,如复星、恒瑞、齐鲁、海正等,以及创业型企业,如信达、康宁杰瑞、百济神州等。还有一些科研院所。目前申报抗体品种数大于5家以上的企业有齐鲁制药、海正药业、复宏汉霖、上海恒瑞、深圳龙瑞等9家企业。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/bdac5972-2b9e-4c8f-a40e-66704f3fa056.jpg" title=" 39.jpg" alt=" 39.jpg" / /p p style=" text-align: center " 表2. 国内治疗性抗体申报情况 /p p style=" text-align: center " 数据来源:火石创造 /p p strong 抗体研发企业大概可以分为以下几类: /strong /p p 1、以中信国健、百泰为代表,国内最早拥有上市抗体药物产品的生物药物企业,有研发、生产、营销的完整产业链。但在产业剧烈变革的时代,也面临诸多挑战。 /p p 2、 以海正药业、康弘药业为代表,本身已经具有一定规模的中药、化药企业,最早一批重金布局抗体药物领域的企业。海正在研产品线丰富,但上市产品安百诺营销压力大,后续面临新一批抗体药物研发企业的激烈竞争。康弘的郎沐虽上市较晚,但头顶首个获得 WHO INN 的光环,占据了地利人和,获得了初步成功,后续仍有 KH903、KH906 等pipeline 储备。但俞德超走后,生物药长远如何布局,还要再看。 /p p 3、以齐鲁制药、嘉和生物、复宏汉霖为代表,资本充足,起步较晚,以符合国际标准的高质量生物类似药为突破点来破局。但这类企业也最多,竞争也最为激烈。包括正大天晴、华海药业等一大批企业。 /p p 4、以恒瑞医药、百济神州等为代表,研发水平着眼国际水准,靠自主创新达到核心竞争力。这里面又分为两类,一类是已经拥有雄厚资本的恒瑞药业,立志于成为国际一流的创新推动型药企,一类是百济神州这种研发型企业,通过资本市场以及合作开发方式,来获得前期研发需要的资本。这也是欧美通行的研发模式。 /p p 5、不得不提的还有国内的生物药物 CRO/CMO 产业,这类企业在整个抗体药物发展过程中将发挥巨大作用,甚至影响产业格局。 /p p strong 5.国内抗体药产业投资分布 /strong /p p 投资简介 /p p 抗体产业的热度也吸引了众多的资本介入,从2012年到2017年上半年抗体药物企业共披露融资次数47次,涉及融资金额达130亿元。从披露投融资情况看,从2015年开始,抗体产业不管是从融资次数还是融资金额上都有大幅提升,产业热度居高不下,融资次数和融资金均以A轮和B轮居多,提示我国抗体产业仍处于上升阶段。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/f2b8cdb0-1393-448f-a7ca-628f75a59255.jpg" title=" 40.jpg" alt=" 40.jpg" / /p p style=" text-align: center " 表2. 近5年国内抗体药物企业披露投融资金额及笔数 /p p 以高领资本、元禾原点、毓承资本、礼来亚洲基金、启明创投为代表的投资机构为抗体领域的繁荣提供了资本支持。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201810/uepic/42f7de45-55d4-4b8a-9ebd-ba7cd0417afe.jpg" title=" 41.png" alt=" 41.png" / /p p & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp 表2. 资本主要投资项目 br/ strong 投资风险 /strong /p p 对于生物创新药来说,由于其开发的复杂性,众多国内企业选择合作开发模式以共担风险。由于生物医药专利的复杂性、抗体领域靶点和技术的易重叠性,抗体药物专利问题愈发突出与明显, BMS和默沙东的PD1专利大战、安进/赛诺菲关于PCSK9表位的专利之争更是为国内企业在抗体领域专利布局敲响警钟。 /p