有奖问答’对错题:填充物为羽绒的产品,对填充物要标明羽绒的 含绒量,充绒量,总重量 三项内容?( )
请教:羽绒产品中含绒量与充绒量这两个概念有什么不同吗?
GB/T 223.82-2007 钢铁 氢含量的测定 惰气脉冲熔融热导法[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=191591]GBT 223.82-2007 钢铁 氢含量的测定 惰气脉冲熔融热导法.pdf[/url]
羽绒服在充绒期间(羽绒加在充绒机里面使用时),有没有“加湿”的标准,是哪个标准?
对不起,没记住你的ID,又迷失了留言的路径.所以只好采取这样的方式,不好意思了.国标没找到,我们测试用方法为企标.具体如下,供你参考用.(如果我找到留言方法,我会再给你留言的,今天事情较多,所以先发这儿.) 充油橡胶样品充油量的测定充油橡胶中芳烃充油橡胶充油含量份数的分析,系采用[b]SH/T1539-92[/b]标准进行快速测定。即取1克挥发分份合格的干燥条形样品,用100ml ETA(甲苯:乙醇=30:70)混合溶剂进行萃取,回流10分钟(最多60分钟)。然后倾去溶剂,并加入丙酮继续回流15分钟。继而倾去丙酮,余下部分进行干燥,直至所余样品恒重。 再联系~
一、缓冲容量 (一)缓冲容量的概念 为了定量地表示缓冲溶液缓冲能力的大小,采用缓冲容量(也称缓冲指数或缓冲值)β来衡量。 定义:使1L或1ml缓冲溶液的pH值改 变一个单位所需加入一元强酸或一元 强碱的物质的量(mol或mmol), 称为该缓冲溶液的缓冲容量。
谁有新标准GB/T11261-1989 脉冲加热惰气熔融红外线吸收法测定氧量?
时下补充维生素成了日常保健的常见环节,但其实补充维生素不当容易中毒。维生素是人体必需的微量营养元素,但过多补充也是浪费,其中一些维生素补充过量易中毒。水溶性维生素如维生素B、C等,服用过量后可随尿液排出体外,毒性较小。而过量补充脂溶性的维生素,易引起中毒。脂溶性维生素包括维生素A、E、K、D等。其中滥用维生素E可引起高血压、乳腺肿瘤。大量服用维生素C可致泌尿系结石。服大量维C会破坏血清中及体内贮存的维生素B12。因此脂溶性维生素必须按照国家规定的量来补。
求助1:此处异丙醇的作用是什么?分析测定SO4 根含量时,在异丙醇、乙酸存在情况下,以偶氮胂-Ⅲ为显色剂,用乙酸钡滴定。偶氮胂-Ⅲ在弱酸环境中显玫瑰红色,到达滴定终点时,过量的钡离子与偶氮胂-Ⅲ形成紫蓝色的络合物。据查,有些资料中测定SO4 加入了 乙醇(但滴定用的是BaCl2),是减小硫酸钡溶解度,提高灵敏度的作用,请问这里异丙醇是 何作用?如果是相似作用,乙醇与异丙醇有什么区别?求助2:醋酸钡和醋酸 能构成缓冲溶液吗?其pH值为多少?此反应要求的pH为大于3,本人猜测这里 醋酸钡和醋酸 是不是构成了一种缓冲溶液?求助3:在配制 乙酸钡滴定溶液时,还加入了少量的 乙酸铅,请问这里是什么作用?是不是复盐沉淀的 作用,减小 硫酸钡的溶解度,使沉淀更完全?以上为抛转引玉,请高手指点?万分感谢。我现在还没有积分,嘿嘿,以后可以补上的!
水质 烷基汞的测定 [url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法GB/T 14204-93附录C 溶剂冲洗进样技术(补充件)用清洁的样品溶剂冲洗进样器几次,把少量样品溶剂(1μL)抽入进样器,再抽入0.5μL空气,然后将进样器针头插入样品容器内,慢慢地抽入2~4μL样品,使针头离开样品,将进样器柱塞慢慢提起,样品完全抽入针筒内,并抽入0.5μL空气,此时可见两个液体柱两个空气柱:溶剂和样品。中间由空气柱隔开。样品量可由针筒刻度准确计量,针头内不含样品。快速进样。这种进样方式重复性好,可保证同一样品连续进样两针,响应值相对偏差≤4%。----------------有人试过这样做吗?
对溶液的酸度起稳定作用的溶液叫缓冲溶液。缓冲溶液能调节和控制备稳定溶液的PH值,其PH值不因加入酸、碱,或稀释而产生显著变化。如测硬度时,使用NH3.H2O-NH4Ci缓冲溶液,当溶液中产生少量H-时,H++OH- H2O,使溶液中﹝OH-﹞减少,NH3.H2O NH4+-OH-的反应向右进行,溶液中的OH-含量不会显著的减少。当溶液中产生少量OH-时,OH-+ NH4+ NH3.H2O的反应向右进行,溶液中的OH-含量不会显著增加,当溶液稀释时,H+、OH-浓度虽减少,但电离度增加,PH值亦不会发生显著变化。所以缓冲溶液能够起到稳定溶液PH值的作用
我们想买一台悬臂梁冲击仪、一台简支梁冲击仪、一台熔指仪,请问哪个牌子比较耐用啊? 我们原先使用的金建产品太差啦,2年内坏了5次。现想更换比较耐用的出名的品牌,请大家介绍介绍。谢谢!
文章中没有显示公式啥的 http://simg.instrument.com.cn/bbs/images/brow/em09508.gif想下载的可以找到链接 进行下载资料库————缓冲溶液的配制与性能http://www.instrument.com.cn/download/shtml/204329.shtmlhttp://simg.instrument.com.cn/bbs/images/brow/em09505.gif缓冲溶液的配制与性能一 实验目的(1)学习缓冲溶液的配制方法,加深对缓冲溶液性质的理解(2)了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系:(3)练习吸量管的使用方法。二 实验原理 能抵抗外来少量强酸、强碱或适当稀释而保持pH值基本不变的溶液叫缓冲溶液。缓冲溶液一般是由弱酸及其盐、弱碱及其盐、多元弱酸的酸式盐及其次级盐组成。缓冲溶液的pH值可用下式计算: 或 缓冲溶液pH值除主要决定于pKb(pKb)外,还与盐和酸(或碱)的浓度比值有关,若配制缓冲溶液所用的盐和酸(或碱)的原始浓度相同均为C,酸(碱)的体积为Va(Vb),盐的体积为Vs总体积为V,混合后酸(或碱)的浓度为 ,盐的浓度为 ,则 所以缓冲溶液pH值可写为 或 配制缓冲溶液时,只要按计算值量取盐和酸〔或碱)溶液的体积,混合后即可得到一定pH值的缓冲溶液。缓冲容量是衡量缓冲溶液的缓冲能力大小的尺度。为获得最大的缓冲容量,应控制 (或 )=1,酸[font
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=149967]GB-T+223(1).82-2007+钢铁+氢含量的测定+惰气脉冲熔融热导法[/url]
最近在配制流动相缓冲溶液时,发现用缓冲溶剂pH计算公式算出的结果与实测值有些差距,比如:为了配制pH是7的磷酸氢钠-磷酸二氢钠缓冲液,利用缓冲溶液pH计算公式算出所需磷酸氢钠和磷酸二氢钠的量,然后按照这个量来进行配制,用pH计测量,发现实测的pH约在6.6的样子,不知道是什么原因?我想请问大家在配制流动相缓冲溶液的时候,是用买到的,固定pH的试剂包直接配制的?还是查网上那些标准pH缓冲液配方,根据配方进行称量和配制?或者是用其它比较准确的计算公司计算出来份量后,进行配制?请大家教我!
由于此贴已经锁定,只有另发新贴补充说明。1)确定NaOH溶液中有没有很高的氯离子,作为背景。2)可以减少土壤样品量,减小那个峰的高度。3)在样品溶液中加氯离子标准,如果是一个峰出现,那就是氯,如果峰分叉那就不是。4)可以改变色谱条件,如果任然与氯离子保留时间一致,就是氯离子。
甲醛缓冲溶液吸收--盐酸副玫瑰苯胺法测定空气中SO2含量,显色时为什么要把溶液倒进PRA的比色管中为什么
ph计的定位只需要选用一种标准缓冲溶液吗?还是要两种?测定醋酸含量应选用哪种缓冲溶液呢?
理化检验- 化学分册PTCA (PARTB :CHEM. ANAL . ) 2005 年 第41 卷 2知识与经验示差脉冲溶出伏安法测定食盐中痕量铅李新华(山西雁北师范学院化学系, 大同037000)中图分类号: O657. 1 文献标识码: B 文章编号: 100124020 (2005) 0220119202 铅是一种具有蓄积性、多亲和性的毒物,对人体各组织都有毒性作用,主要损害神经系统、造血系统、消化系统和肾脏,还损害人体的免疫系统,使机体抵抗力下降,因此在环境监测及食品分析中,铅的准确测定受到人们的普遍关注。人类每天要摄入一定量的食盐,如果食盐中的铅含量大于等于1. 0 mgkg - 1 ,就会对人体产生危害。因此,选择一种简便、灵敏、快速、准确的测铅方法,就显得非常重要测定铅的方法报道较多的是[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收光谱[/color][/url]法[1 ,2 ]电化学分析法也有报道[3 ,4 ] ,本文研究了用示差脉冲溶出伏安法测定铅[5~9 ] ,本法的仪器设备简单、灵敏度高、准确度好,操作简便,且避免了具有污染的汞电极,有很好的实用性。
缓冲剂及缓冲溶液 能抵抗外加的少量酸、碱或稀释而保持本身的 PH 值基本不变的溶液叫做缓冲溶液,用来配制缓冲溶液的试剂又称缓冲剂。 缓冲溶液一般是具有同离子效应的弱酸和弱酸盐或弱碱和弱碱盐组成的。例如:乙酸 - 乙酸钠、氨 - 氯化铵、碳酸氢钠 - 硫酸钠、硼砂 - 硼酸、磷酸二氢钾 - 磷酸氢二钠等都可以配成缓冲溶液,缓冲溶液根据用途不同分成几种。
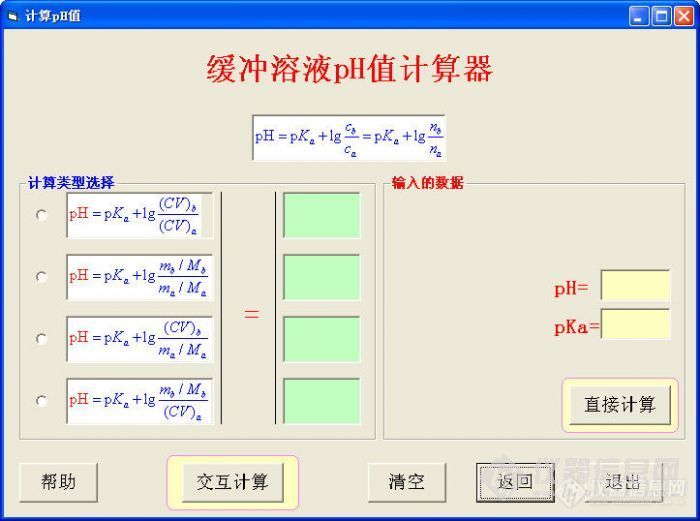
酸碱缓冲溶液是化学分析和仪器分析中应用最为广泛的试剂溶液之一。虽然任何分析方法和标准中都有缓冲溶液的配制方法,但实际工作中(包括科研实验中)根据PH值要求,因地制宜地配制某种缓冲溶液,仍然具有很实用的意义。附件是本人最近编写的“酸碱缓冲溶液计算”软件中的一部分,侧重于:指定PH值、溶液总浓度和总体积,用弱酸(或强酸弱碱盐)的浓溶液或固体、弱碱(或强碱弱酸盐)的浓溶液或固体来混合配制缓冲溶液的用量计算(计算称取的质量、量取的溶液体积)。 一、软件界面及用法演示 此Flash包含在附件中,也可以在软件的“操作演示”中弹出。界面如下http://ng1.17img.cn/bbsfiles/images/2011/01/201101292333_276528_1644756_3.jpg 打开软件后,请及时在PH、PKa、C(总)、V(总)四个文本框中输入数据,它们分别对应于 (1)要配制的PH值(如醋酸缓冲溶液,配成PH5.0 (2)弱酸或共轭酸的酸离解常数的负对数 如醋酸为4.74,氨缓冲体系,可以查到氨的碱离解常数PKb=4.74,则共轭酸铵根的PKa=14.00-4.74=9.26,都可以查表得到。 (3)缓冲溶液的总浓度(混合液中共轭酸碱的浓度和,例如:0.10MHAc+0.15M NaAc,则总浓度为0.25M,当然,一类情况是给定总浓度,不给各自的浓度) (4)缓冲溶液的总体积(最终配成的体积) 下部分的四个绿色框是计算后自动填充的数据,右上角的绿色框也是自动生成的共轭酸碱的摩尔比。中间的M(弱酸)为弱酸的式量,M(弱碱)为弱碱的式量,这七个框的数据都是自动填充的。 你要做的工作就是:要计算弱酸固体,就单击“计算酸m”,会弹出提示和输入框,根据提示,你输入对应的式量即可,同理,要计算弱酸的体积,就单击“计算酸V”,在弹出的提示和输入框中输入浓度值即可,弱酸的固体或溶液也如此炮制,剩下的计算和填充由软件来完成。http://simg.instrument.com.cn/bbs/images/brow/em09503.gif 温馨提示:我在软件中设置了一个定时器,每5秒钟检查一次你的PH、PKa、C(总)、V(总)是否都输入了数据,如果没有输入完全,就会自动弹出一个提示框,告知请你输入(因为软件等着计算呢),如果你还没有来得及输入它就弹出来,你只要按下“确定”,在它退出后,你再输入数据,再弹出来时,你再按下“确定”,继续输入数据,输完四个数据,它就不再弹出! 虽然它的弹出有点“讨厌”,不过,你就不会忘记该做的工作了。 酸碱的质量或体积都计算出来后,你可以按下“配制清单”,会呈现一张没有格式的配制清单:总体积是多少,要称多少什么?要量多少什么? 如果上面的介绍还不清楚的话,你可以单击软件界面左下部的“操作演示”,看看动画,下面是动画演示:http://ng1.17img.cn/bbsfiles/images/2017/10/201101300007022924_01_0_3.swf 二、几种缓冲溶液配制实例(供练习) 1、PH=5,醋酸-醋酸钠,总浓度0.5,总体积500ml(PKa=4.74) 方法一:醋酸溶液+醋酸钠固体,按“计算酸V”和“计算碱m” 方法二:醋酸溶液+醋酸钠溶液,按“计算酸V”和“计算碱V” 注:醋酸钠为共轭碱(按质子理论划分) 2、PH=10,氨水-氯化铵,总浓度0.5,总体积1000ml(PKa=9.26) 方法一:氨水溶液+氧化铵固体,按“计算酸m”和“计算碱V” 方法二:氨水溶液+氧化铵溶液,按“计算酸V”和“计算碱V” 三、配制时的失误提醒 使用两种溶液混合来配制缓冲溶液时,如果单个的原溶液浓度太小,可能要达到总摩尔数相等时的混合溶液体积会超过规定的数据,即总浓度太低,这时,软件会自动提醒你,用浓溶液或固体来配制。 四、软件安装 软件可解压到任何目录下使用,直接运行文件夹中的可执行文件即可打开计算界面,不必安装。 五、软件预告 缓冲溶液的各类计算已经编制好一个综合软件,有近20种计算类型,帮助文件还没写,先看看界面,提提意见吧:http://ng1.17img.cn/bbsfiles/images/2011/01/201101300018_276530_1644756_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/01/201101300020_276531_1644756_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/01/201101300022_276532_1644756_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/01/201101300023_276533_1644756_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/01/201101300024_276534_1644756_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/01/201101300026_276535_1644756_3.jpg 欢迎建议和意见。
pH缓冲溶液的保存时间关于pH缓冲溶液的保存时间大家也有不同的看法,首先我们还是老规矩看下度娘是怎么说的:??网络上也是很多保存时间各不相同,那么我们发现了一个关于pH缓冲溶液的行业标准,JB/T8276-1999PH测量用缓冲溶液制备方法(已废止)。我们参考标准中的时间是:缓冲溶液一般可保存两个月~三个月,若发现有混浊、或沉淀现象时不能继续使用。当然,此标准已经废止,时间我们也只能是参考,现在很多企业在制作标准缓冲溶液,我们查看证书可知?有效期是一年,未开封的缓冲溶液保质期是一年。关于具体保存时间,没有发现现行有效的标准。缓冲溶液的保存大家需要注意的是,碱性的缓冲溶液,应装入低压高密度聚乙烯瓶中保存。
pH缓冲溶液是一种能使pH值保持稳定的溶液。如果向这种溶液中加入少量的酸或碱,或者在溶液中的化学反映产生少量的酸或碱,以及将溶液的pH值基本上稳定不变,这种能对抗少量酸或碱或稀释,而使pH值不易发生变化的溶液就称为pH缓冲溶液。pH标准缓冲溶液具有以下特点:1.标准溶液的pH值是已知的,并达到规定的准确度。2.标准溶液的pH值具有良好的复现性和稳定性,具有较大的缓冲容量,较小的稀释值和较小的温度系数。3.溶液的制备方法简单。
维权声明:本文为zlhuang0132原创作品,本作者与仪器信息网是该作品合法使用者,该作品暂不对外授权转载。其他任何网站、组织、单位或个人等将该作品在本站以外的任何媒体任何形式出现均属侵权违法行为,我们将追究法律责任。pH缓冲溶液的组成、作用及计算zlhuang0132 pH缓冲溶液是分析测试中应用最为广泛的试剂溶液。其作用是用来稳定溶液的pH值,以满足测试中对恒定pH的要求。虽然pH缓冲溶液的组成并不复杂,但关于pH缓冲溶液的计算却是酸碱滴定分析中计算最为复杂的内容。下面介绍一下pH缓冲溶液的组成和各种类型的化学计算方法。1 pH缓冲溶液的组成和作用1.1 pH缓冲溶液的类型与作用 pH缓冲溶液包括两大类:标准缓冲溶液和普通缓冲溶液。 标准缓冲溶液主要用在酸度计测量溶液pH值时的仪器校正和定位,要求数值准确、精确。因此对试剂纯度、浓度准确性、温度等都有严格要求,这类缓冲溶液有专门的化学试剂商品,可以购买配制,也可以用优级纯试剂按资料的配比配制。 普通缓冲溶液主要用于化学分析和仪器分析中要控制一定pH值的测定过程中。几乎所有的EDTA络合滴定都必须在一定的pH范围内进行,因此,需要加入pH缓冲溶液,例如,测定铅、锌用到HAc缓冲溶液,测定钙、镁、锌用到氨缓冲溶液。又如,氧化还原滴定中,碘量法测铜要用到NH4HF2,碘量法测砷、锑要加NaHCO3。 普通缓冲溶液的配制并不需要像标准缓冲溶液配制那样严格和苛刻,因为对缓冲溶液的pH值要求并不需要非常精确,因此,可以用分析纯试剂来配制,也可以用已有的酸、碱、盐溶液来“搭配”(后述)。1.2 普通pH缓冲溶液的类型 普通pH缓冲溶液按组成不同可分三大类:弱酸-弱碱型缓冲溶液(即共轭酸碱缓冲溶液)、酸式盐缓冲溶液、强酸或强碱溶液。在一些特殊情况下也使用混合体系的缓冲溶液(两种pKa相近的共轭酸碱缓冲溶液混合而成)。大家比较熟悉的是共轭酸碱缓冲溶液,例如,HAc-NaAc、HF-NH4F、NH3-NH4Cl。其实,酸式盐也可作为缓冲溶液,因为酸式盐的pH值大多是恒定的,随其浓度增减的变化不大,例如,NaHCO3溶液在1.0M至0.01M之间,其pH值几乎都在8左右(理论值为8.3),同样可以抵抗溶液中产生的少量强酸、强碱(或外加),保持溶液的pH值恒定或变化微小。强酸、强碱溶液也能缓冲滴定过程中产生的少量强酸或强碱,保持溶液的pH值变化很小,故强酸强碱也可作为广义的pH缓冲溶液(以前的分析化学教材就是这样分的),例如,EDTA络合滴定铋,需另外加入一定量的0.1mol/L硝酸溶液,就是为了增强溶液对滴定中产生的H+的缓冲作用。下面重点介绍最常用的共轭酸碱缓冲溶液的相关知识。 弱酸-弱碱型缓冲溶液的构成与配制。这类缓冲溶液的组成为:弱酸+弱酸盐(即共轭碱)、弱碱+弱碱盐(即共轭酸)。常见的实例有:HAc-NaAc、[font=Tim
各位高手:大家好!!我是一位刚用毛细管电泳的新手,请问如何配制缓冲溶液?比如说,10mM的磷酸盐缓冲溶液(由磷酸氢钠与磷酸二氢钠组成)PH=8,如何理解??是这两种磷酸盐配好后他们在缓冲溶液中的浓度分别为10mM,还是缓冲溶液中的磷酸根的累积浓度为10mM,请各位指教!!!!!!!谢谢了!!!!!
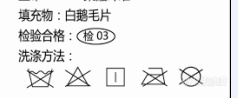
羽绒服填充标注白鹅毛片是不是可以,这个没有绒,可以作为羽绒服吗?[img=,238,98]http://ng1.17img.cn/bbsfiles/images/2018/04/201804181346423598_4124_2154459_3.png!w238x98.jpg[/img]
请问 [url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]用填充柱系统分析气体样品,填充柱进样口,一般来说进样量多大合适?进1ml样品可以吗 ?会不会太大
缓冲溶液与缓冲作用原理 (一)缓冲作用与缓冲溶液 纯水在25℃时PH值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH值降到5.5左右。1滴浓盐酸(约12.4molL-1)加入1升纯水中,可使[H+]增加5000倍左右(由1.0×10-7增至5×10-4 molL-1),若将1滴氢氧化钠溶液(12.4molL-1)加到1升纯水中,PH变化也有3个单位。可见纯水的PH值因加入少量的强酸或强碱而发生很大变化。然而,1滴浓盐酸加入到1升HOAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,[H+]的增加不到百分之一(从1.00×10-7增至1.01×10-7 molL-1),PH值没有明显变化.这种能对抗外来少量强酸\强碱或稍加稀释不引起溶液PH值发生明显变化的作用叫做缓冲作用 具有缓冲作用的溶液,叫做缓冲溶液。 (二)缓冲溶液的组成 缓冲溶液由足够浓度的共轭酸碱对组成。其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。 1.弱酸及其对应的盐 例如,HOAc-NaOAc(实际上是OAc-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(邻苯二甲酸-邻苯二甲酸氢钾);H3BO3-Na2B4O7(四硼酸钠水解后产生H2BO-3)。 2.多元弱酸的酸式盐及其对应的次级盐,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(柠檬酸二氢钠)-Na2HC6H5O7;KHC8H4O4-K2C8H4O4。 3.弱碱及其对应的盐 例如NH3-NH+4CL-;RNH2-RNH+3A-(伯胺及其盐);Tris-TrisH+A-(三羟甲基烷及其盐)。 (三)缓冲溶液的作用原理 现以HOAc-NaOAc缓冲溶液为例,说明缓冲溶液之所以能抵抗少量强酸或强碱使PH稳定的原理。醋酸是弱酸,在溶液中的离解度很小,溶液中主要以HOAc分子形式存在,OAc-的浓度很低。醋酸钠是强电解质,在溶液中全部离解成Na+和OAc-,由于同离子效应,加入NaOAc后使HOAc离解平衡向左移动,使 HOAc的离解度减小,[HOAc]增大。所以,在HOAc-NaOAc混合溶液中,存在着大量的HOAc和OAc-。其中HOAc主要来自共轭酸HOAc,OAc-主要来自NaOAc。这个溶液有一定的[H+],即有一定的PH值。在HOAc-NaOAc缓冲溶液中,存在着如下的化学平衡: 在缓冲溶液中加入少量强酸(如HCL),则增加了溶液的[H+]。假设不发生其他反应,溶液的PH值应该减小。但是由于[H+]增加,抗酸成分即共轭碱OAc-与增加的H+结合成HOAc,破坏了HOAc原有的离解平衡,使平衡左移即向生成共轭碱HOAc分子的方向移动,直至建立新的平衡。因为加入H+较少,溶液中OAc-浓度较大,所以加入的H+绝大部分转变成弱酸HOAc,因此溶液的PH值不发生明显的降低。 在缓冲溶液中加入少量强碱(如NaOH),则增加了溶液中OH-的浓度。假设不发生其他反应,溶液的PH值应该增大。但由于溶液中的H+立即加入的OH-结合成更难离解的H2O,这就破坏了HOAc原有的离解平衡,促使HOAc的离解平衡向右移动,即不断向生成H+和OAc-的方向移动 ,直至加入的OH-绝大部分转变成H2O,建立新的平衡为止。因为加入的OH-少,溶液中抗碱成分即共轭酸HOAc的浓度较大,因此溶液的PH值不发生明显升高。 在溶液稍加稀释时,其中[H+]虽然降低了,但[OAc-]同时降低了,同离子效应减弱,促使HOAc的离解度增加,所产生的H+可维持溶液的PH值不发生明显的变化。所以,溶液具有抗酸、抗碱和抗稀释作用。 多元酸的酸式盐及其对应的次级盐的作用原理与前面讨论的相似。例如,在NaH2PO4-Na2HPO4溶液中存在着离解平衡: HPO2-4是抗酸成分,通过平衡移能对抗外加酸的影响。H2PO2-4是抗碱成分,通过平衡右移能对抗外加碱的影响。 弱碱及其对应盐的缓冲作用原理,例如,NH3-NH4CL(即NH3-NH+4)溶液中,NH3能对抗外加酸的影响是抗酸成分,NH+4能对抗外加碱的影响是抗碱成分。前者通过下述平衡向右移动而抗酸,后者通过平衡向左移动而抗碱,从而使溶液的PH值稳定。
日本一齐分析法中用的0.5M的磷酸盐缓冲液的配比是这样的:将52.7gK2HPO4和30.2gKH2PO4在500ml水中溶解,用1MNaOH或1MHcl调pH7.0后,加水定容到1L.可以用磷酸钠盐.有个问题总是想不明白,就是如果按中学化学学的算0.5M的磷酸盐缓冲液怎么也算不出这两个数据的,按中学化学算出的数据不对吗?
(一)缓冲作用与缓冲溶液 纯水在25℃时PH值为7.0,但只要与空气接触一段时间,因为吸收二氧化碳而使PH值降到5.5左右。1滴浓盐酸(约12.4mol·L-1)加入1升纯水中,可使增加5000倍左右(由1.0×10-7增至5×10-4 mol·L-1),若将1滴氢氧化钠溶液(12.4mol·L-1)加到1升纯水中,PH变化也有3个单位。可见纯水的PH值因加入少量的强酸或强碱而发生很大变化。然而,1滴浓盐酸加入到1升HOAc-NaOAc混合溶液或NaH2PO4-Na2HPO4混合溶液中,的增加不到百分之一(从1.00×10-7增至1.01×10-7 mol·L-1),PH值没有明显变化.这种能对抗外来少量强酸\强碱或稍加稀释不引起溶液PH值发生明显变化的作用叫做缓冲作用;具有缓冲作用的溶液,叫做缓冲溶液。 (二)缓冲溶液的组成 缓冲溶液由足够浓度的共轭酸碱对组成。其中,能对抗外来强碱的称为共轭酸,能对抗外来强酸的称为共轭碱,这一对共轭酸碱通常称为缓冲对、缓冲剂或缓冲系,常见的缓冲对主要有三种类型。 1.弱酸及其对应的盐 例如,HOAc-NaOAc(实际上是OAc-);H2CO3-NaHCO3;H2C8H4O4-KHC8H4O4(邻苯二甲酸-邻苯二甲酸氢钾);H3BO3-Na2B4O7(四硼酸钠水解后产生H2BO-3)。 2.多元弱酸的酸式盐及其对应的次级盐,例如,NaHCO3-Na2CO3;NaH2PO4-Na2HPO4;NaH2C5HO7(柠檬酸二氢钠)[font=Arial