
[size=18px][b][font=宋体][color=red]2022[/color][/font][font=宋体][color=red]年6月24日9:00[/color][/font][/b][/size][font=宋体][size=17px][color=#656565],仪器信息网联合Cytiva将共同举办“2022转化医学系列讲座之肿瘤免疫学研究专场”,[/color][/size][/font][b][font=宋体][color=#00886f]与您共同探讨免疫学热门词汇调节性T细胞、TIL、TCR-T细胞及其相关免疫疗法的新进展和新技术[/color][/font][/b][font=宋体][size=17px][color=#18181b]。[/color][/size][/font][img]https://simg.instrument.com.cn/bbs/images/brow/em17.gif[/img][size=18px]亮点先览:[url=https://www.instrument.com.cn/webinar/meetings/transmed2022/][color=#ff0000]【点击报名参会】[/color][/url][/size][font=黑体, SimHei][color=#0070c0]1.重点介绍FOXP3+调节性T细胞功能可塑性及稳定性分子机制研究新进展,以及组织特异性Treg, 特别是自身免疫病,肥胖及衰老相关糖尿病以及肿瘤微环境中FOXP3+Treg功能与免疫疗法相关新进展[/color][/font][font=黑体, SimHei][color=#0070c0]2.通过研究免疫系统和肿瘤之间的相互作用,鉴定肿瘤特异的免疫细胞,尤其是识别肿瘤抗原的T细胞,以及肿瘤细胞抵抗免疫攻击的逃逸机制,从中发现新的治疗靶标,建立高效的肿瘤免疫治疗新方法[/color][/font][font=黑体, SimHei][color=#0070c0]3.肿瘤浸润淋巴细胞TIL疗法的进展与挑战[/color][/font][font=黑体, SimHei][color=#0070c0]4.Cytiva层析技术助力肿瘤免疫学研究[img=,690,1338]https://ng1.17img.cn/bbsfiles/images/2022/06/202206201552215665_2656_2507958_3.jpg!w690x1338.jpg[/img][/color][/font]
[font=Calibri][size=10.5pt][font=宋体]仪器信息网于[/font]5[/size][/font][font=Calibri][size=10.5pt][font=宋体]月[/font]19[font=宋体]日组织召开[/font][b] “安捷伦免疫治疗与肿瘤免疫细胞分析”网络研讨会[/b][/size][/font][font=Calibri][size=10.5pt][font=宋体],特邀嘉宾[url=https://www.instrument.com.cn/webinar/meetings/News/expert?id=3142]David Ferrick(安捷伦)[/url][/font][font=宋体],带来报告[b]《[url=https://www.instrument.com.cn/webinar/meetings/News/expert?id=3142]调谐免疫细胞效力、命运和适应性的代谢驱动因素[/url]》[/b];[/font][/size][/font][font=宋体]欢迎感兴趣的你,报名参会![/font][url=https://www.instrument.com.cn/webinar/meetings/6604/][b][u][font='Times New Roman'][color=#0563c1]https://www.instrument.com.cn/webinar/meetings/immunotherapy/[/color][/font][/u][/b][/url]

[font=&][size=16px][color=#656565] 本次研讨会中,各位专家将从科研层面对肿瘤免疫治疗涉及的基因编辑技术,效价评估、代谢水平研究等领域进行分享,助力科研人员在快速发展的肿瘤免疫治疗领域突破创新,同时还将对临床治疗的疗效与副作用评估,安全性与毒性监测以及治疗方案优化进行介绍与探讨,为肿瘤患者带来希望。[/color][/size][/font][font=&][size=16px][color=#656565][/color][/size][/font][size=16px][color=#656565]直播时间:9月9日 14:00[/color][/size][size=16px][color=#656565][b][url=https://www.instrument.com.cn/webinar/meetings/cell/]在线答疑,戳此参会[/url][/b][/color][/size][size=16px][color=#656565][url=https://www.instrument.com.cn/webinar/meetings/cell/][img=,690,327]https://ng1.17img.cn/bbsfiles/images/2021/08/202108261828101924_8724_2507958_3.jpg!w690x327.jpg[/img][/url][/color][/size][size=16px][color=#656565][/color][/size]
[font=&][size=16px][color=#343a40] 肿瘤免疫治疗是一种利用人体免疫系统来战胜肿瘤的治疗方案。成功与否的关键就在于免疫系统能否被激活到足够去特异性地杀死肿瘤的程度。在临床实验前,人们需要借助体外实验先行评估治疗方案的效力。 Axion BioSystems公司革命性地推出了使用生物电感应技术的Maestro Z/ZHT平台,完美具备评估体外效力的必要条件。它能在免除标记物影响的同时,在长达几天的时间中,以非侵入的方式对细胞的健康和活动开展监测,并自动且实时地获得多至384个样本的完整实验信息。其秘诀就是通过埋设在微孔板底部的高灵敏度电极来进行生物电阻抗的测试。这种技术能够追踪微小的细胞变化,从而能够揭示出远低于其它技术最低检出限的生物学信息。[/color][/size][/font][font=&][size=16px][color=#343a40][b]--利用Maestro Z/ZHT评估T细胞对胶质母细胞瘤的杀伤效力(car T治疗):[/b][/color][/size][/font][font=&][size=16px][color=#343a40][b]人体免疫系统中的效应T细胞,对肿瘤细胞有着高特异性和与生俱来的细胞毒性,在未来的脑胶质瘤治疗中被人们寄予很高的期望。Maestro Z的阻抗测试有着高灵敏、无标记及无损的特点,能够实时监测肿瘤细胞的增殖和T细胞介导的细胞溶解等过程,在体外评估免疫治疗的效价方面有着突出的优势。美国乔治亚大学的科学家们借助Maestro Z平台,对不同条件活化后的T细胞,开展了恶性胶质母细胞瘤杀伤效力的对比评估。详情点击:[url=http://www.axionbio.cn/page_1.html]CAR-T治疗 (axionbio.cn)[/url][/b][/color][/size][/font][font=&][size=16px][color=#343a40][/color][/size][/font][font=&][size=16px][color=#343a40][b]--利用Maestro Z 评估药物对COVID-19病毒感染力的中和作用:[/b][/color][/size][/font][color=#343a40][b][font=&][size=16px]病毒学研究的重点就在于开发抗病毒药物用于预防和治疗病毒感染。其中的挑战在于筛选到能够选择性抑制病原体复制并对宿主没有损害的化合物。病毒导致的细胞病变效应(CPEs)常常和靶细胞在形态、胞间贴合度、附着力及活力等方面的变化相关联。研究者可在体外联合使用宿主细胞、病原体和药物来模拟三者在体内的互作,借助 Maestro Z 定量CPE引起的阻抗变化。轻松实现在筛选药效的同时,完成安全性的初步评沽。[b]详情点击:[/b][url=http://www.axionbio.cn/page_4.html]page_4 - (axionbio.cn)[/url][/size][/font][/b][/color][font=&][color=#343a40][b][font=&][/font][/b][/color][/font]
[size=15px][font=宋体][color=black]免疫抑制性肿瘤微环境([/color][/font][font=&][color=black]immunosuppressive tumor microenvironment, ITME[/color][/font][font=宋体][color=black])的存在是导致当前肿瘤免疫治疗效果不佳的主要原因之一,诱导肿瘤细胞发生免疫原性细胞死亡([/color][/font][font=&][color=black]immunogenic cell death[/color][/font][font=宋体][color=black],[/color][/font][font=&][color=black]ICD[/color][/font][font=宋体][color=black])已成为改善[/color][/font][font=&][color=black]ITME[/color][/font][font=宋体][color=black]的有效策略。竹节香附素[/color][/font][font=&][color=black]A[/color][/font][font=宋体][color=black]([/color][/font][font=&][color=black]Raddeanin A[/color][/font][font=宋体][color=black],[/color][/font][font=&][color=black]RA[/color][/font][font=宋体][color=black])是中药竹节香附中天然的三萜皂苷,对肝癌、卵巢癌、肺癌等均具有良好的抗肿瘤活性,然而目前[/color][/font][font=&][color=black]RA[/color][/font][font=宋体][color=black]的抗癌作用机制尚未明确,特别是在抗肿瘤免疫方面。 [/color][/font][/size][size=15px][b][font=宋体][color=red]竹节香附素[/color][/font][font=&][color=red]A[/color][/font][font=宋体][color=red]可直接靶向反式激活应答[/color][/font][font=&][color=red]DNA[/color][/font][font=宋体][color=red]结合蛋白[/color][/font][font=&][color=red]-43[/color][/font][font=宋体][color=red]([/color][/font][font=&][color=red]transactive responsive DNA-binding protein 43, TDP-43[/color][/font][font=宋体][color=red]),激活[/color][/font][font=&][color=red]mtDNA-cGAS/STING[/color][/font][font=宋体][color=red]通路诱导肿瘤细胞发生免疫原性细胞死亡,促进树突状细胞依赖性[/color][/font][font=&][color=red]CD8+ T[/color][/font][font=宋体][color=red]细胞的激活[/color][/font][/b][font=宋体][color=black],从而为临床上肿瘤的免疫治疗提供了新思路。[/color][/font][font=&][color=black][/color][/font][/size] [align=center] [/align][size=15px][b][font=&][color=#4472c4]1[/color][/font][font=宋体][color=#4472c4]、筛选确定竹节香附素[/color][/font][font=&][color=#4472c4]A[/color][/font][font=宋体][color=#4472c4]是潜在[/color][/font][font=&][color=#4472c4]ICD[i][/i][/color][/font][font=宋体][color=#4472c4]诱导剂[/color][/font][font=&][color=#4472c4][/color][/font][/b][/size][size=15px][font=&][color=black]HMGB1[/color][/font][font=宋体][color=black]是公认的[/color][/font][font=&][color=black]ICD[/color][/font][font=宋体][color=black]标志物之一,为了确定可能诱导肿瘤细胞死亡和增强[/color][/font][font=&][color=black]T[/color][/font][font=宋体][color=black]细胞反应的新化合物,作者通过建立了[/color][/font][font=&][color=black]HMGB1-Gluc[/color][/font][font=宋体][color=black]报告基因筛选模型,结合三种细胞共培养体系(小鼠[/color][/font][font=&][color=black]B16-OVA[/color][/font][font=宋体][color=black]细胞、小鼠骨髓来源的树突状细胞[/color][/font][font=&][color=black]BMDCs[/color][/font][font=宋体][color=black]和[/color][/font][font=&][color=black]CD8+ T[/color][/font][font=宋体][color=black]细胞杂交瘤细胞[/color][/font][font=&][color=black]B3Z[/color][/font][font=宋体][color=black]),从天然生物活性小分子化合物库([/color][/font][font=&][color=black]2569[/color][/font][font=宋体][color=black]种天然产物)中发现竹节香附素[/color][/font][font=&][color=black]A[/color][/font][font=宋体][color=black]表现出良好的诱导[/color][/font][font=&][color=black]ICD[/color][/font][font=宋体][color=black]和激活[/color][/font][font=&][color=black]T[/color][/font][font=宋体][color=black]细胞的活性。此外,[/color][/font][font=&][color=black]RA[/color][/font][font=宋体][color=black]能显著提高共培养的[/color][/font][font=&][color=black]CD8+ T[/color][/font][font=宋体][color=black]细胞分泌的[/color][/font][font=&][color=black]IL-2[/color][/font][font=宋体][color=black]、[/color][/font][font=&][color=black]IFN-γ[/color][/font][font=宋体][color=black]、[/color][/font][font=&][color=black]GZMB[/color][/font][font=宋体][color=black]和[/color][/font][font=&][color=black]TNF-α[/color][/font][font=宋体][color=black]水平,促进[/color][/font][font=&][color=black]BMDCs[/color][/font][font=宋体][color=black]成熟,增强其抗原呈递功能,在小鼠体内诱导产生免疫记忆效应[/color][/font][font=宋体][color=black]。[/color][/font][font=&][color=black][/color][/font][/size][align=center][img=图片,1,]data:image/svg+xml,%3C%3Fxml version='1.0' encoding='UTF-8'%3F%3E%3Csvg width='1px' height='1px' viewBox='0 0 1 1' version='1.1' xmlns='http://www.w3.org/2000/svg' xmlns:xlink='http://www.w3.org/1999/xlink'%3E%3Ctitle%3E%3C/title%3E%3Cg stroke='none' stroke-width='1' fill='none' fill-rule='evenodd' fill-opacity='0'%3E%3Cg transform='translate(-249.000000, -126.000000)' fill='%23FFFFFF'%3E%3Crect x='249' y='126' width='1' height='1'%3E%3C/rect%3E%3C/g%3E%3C/g%3E%3C/svg%3E[/img][/align][size=15px][font=宋体][color=black][/color][/font] [font=宋体][color=black][/color][/font][font=&][color=black][/color][/font][/size][size=15px][b][font=&][color=#4472c4]2[/color][/font][font=宋体][color=#4472c4]、竹节香附素[/color][/font][font=&][color=#4472c4]A[/color][/font][font=宋体][color=#4472c4]处理的肿瘤细胞促进树突状细胞介导的[/color][/font][font=&][color=#4472c4]T[/color][/font][font=宋体][color=#4472c4]细胞活化[/color][/font][font=&][color=#4472c4][/color][/font][/b][/size][size=15px][font=宋体][color=black]接下来,作者确定了[/color][/font][font=&][color=black]RA[/color][/font][font=宋体][color=black]处理的肿瘤细胞激活[/color][/font][font=&][color=black]T[/color][/font][font=宋体][color=black]细胞和[/color][/font][font=&][color=black]DC[/color][/font][font=宋体][color=black]的能力。结果显示在与[/color][/font][font=&][color=black]RA[/color][/font][font=宋体][color=black]预处理的肿瘤细胞共培养的[/color][/font][font=&][color=black]B3Z T[/color][/font][font=宋体][color=black]细胞中,[/color][/font][font=&][color=black]T[/color][/font][font=宋体][color=black]细胞来源的[/color][/font][font=&][color=black]IL-2[/color][/font][font=宋体][color=black]和[/color][/font][font=&][color=black]IFN-γ[/color][/font][font=宋体][color=black]的上清液水平显著上调,同时伴随着[/color][/font][font=&][color=black]T[/color][/font][font=宋体][color=black]细胞活化标志物[/color][/font][font=&][color=black]CD69[/color][/font][font=宋体][color=black]的表达水平升高。由于[/color][/font][font=&][color=black]DC[/color][/font][font=宋体][color=black]在肿瘤抗原与[/color][/font][font=&][color=black]T[/color][/font][font=宋体][color=black]细胞的交叉呈递中起着关键作用,作者发现[/color][/font][font=&][color=black]RA[/color][/font][font=宋体][color=black]处理的肿瘤细胞显著增加了[/color][/font][font=&][color=black] BMDC[/color][/font][font=宋体][color=black]上激活标志物的表面表达。数据表明[/color][/font][font=&][color=black]RA[/color][/font][font=宋体][color=black]治疗的肿瘤细胞促进[/color][/font][font=&][color=black]DCs[/color][/font][font=宋体][color=black]成熟和随后的[/color][/font][font=&][color=black]CD8 T[/color][/font][font=宋体][color=black]细胞活化([/color][/font][/size] [size=15px][font=宋体][color=black][/color][/font][font=&][color=black][/color][/font][/size][size=15px][b][font=&][color=#4472c4]3[/color][/font][font=宋体][color=#4472c4]、竹节香附素[/color][/font][font=&][color=#4472c4]A[/color][/font][font=宋体][color=#4472c4]通过激活抗肿瘤免疫抑制肿瘤生长[/color][/font][font=&][color=#4472c4][/color][/font][/b][/size][size=15px][font=宋体][color=black]接着,作者通过体内研究发现,[/color][/font][font=&][color=black]RA[/color][/font][font=宋体][color=black]抑制[/color][/font][font=&][color=black]MC38[/color][/font][font=宋体][color=black]荷瘤小鼠肿瘤大小和肿瘤重量。此外,肿瘤浸润淋巴细胞([/color][/font][font=&][color=black]TIL[/color][/font][font=宋体][color=black])谱分析显示,[/color][/font][font=&][color=black]RA[/color][/font][font=宋体][color=black]显著升高肿瘤浸润性[/color][/font][font=&][color=black] CD8 T [/color][/font][font=宋体][color=black]细胞和[/color][/font][font=&][color=black] CD103 CD11 DC[/color][/font][font=宋体][color=black]的数量。同时,[/color][/font][font=&][color=black] RA[/color][/font][font=宋体][color=black]增加肿瘤微环境([/color][/font][font=&][color=black]TME[i][/i][/color][/font][font=宋体][color=black])中[/color][/font][font=&][color=black]CD8 T[/color][/font][font=宋体][color=black]细胞效应分子[/color][/font][font=&][color=black]GZMB[/color][/font][font=宋体][color=black]和[/color][/font][font=&][color=black]IFN-γ[/color][/font][font=宋体][color=black]的水平,这意味着[/color][/font][font=&][color=black]RA[/color][/font][font=宋体][color=black]增强了体内有效[/color][/font][font=&][color=black]T[/color][/font][font=宋体][color=black]细胞的活化。而在[/color][/font][font=&][color=black]T[/color][/font][font=宋体][color=black]细胞功能缺陷的[/color][/font][font=&][color=black]BALB / c[/color][/font][font=宋体][color=black]裸鼠中,[/color][/font][font=&][color=black]RA[/color][/font][font=宋体][color=black]未能抑制[/color][/font][font=&][color=black]MC38[/color][/font][font=宋体][color=black]的肿瘤生长,通过细胞色素[/color][/font][font=&][color=black]c[/color][/font][font=宋体][color=black]([/color][/font][font=&][color=black]Cyt c[/color][/font][font=宋体][color=black])耗尽了[/color][/font][font=&][color=black]DC[/color][/font][font=宋体][color=black]消除了[/color][/font][font=&][color=black] RA [/color][/font][font=宋体][color=black]对[/color][/font][font=&][color=black] MC38[/color][/font][font=宋体][color=black]肿瘤生长的抑制,表明抗原呈递对[/color][/font][font=&][color=black] RA [/color][/font][font=宋体][color=black]介导的抗肿瘤作用至关重要,[/color][/font][font=&][color=black]RA[/color][/font][font=宋体][color=black]可以通过[/color][/font][font=&][color=black]DCs[/color][/font][font=宋体][color=black]和[/color][/font][font=&][color=black]CD8 T[/color][/font][font=宋体][color=black]细胞依赖性方式抑制肿瘤生长[/color][/font][/size] [size=15px][font=宋体][color=black][/color][/font][font=&][color=black][/color][/font][/size][size=15px][b][font=&][color=#4472c4]4[/color][/font][font=宋体][color=#4472c4]、竹节香附素[/color][/font][font=&][color=#4472c4]A[/color][/font][font=宋体][color=#4472c4]触发[/color][/font][font=&][color=#4472c4]cGAS/STING[/color][/font][font=宋体][color=#4472c4]依赖性[/color][/font][font=&][color=#4472c4]NF-κB[/color][/font][font=宋体][color=#4472c4]和[/color][/font][font=&][color=#4472c4]I[/color][/font][font=宋体][color=#4472c4]型[/color][/font][font=&][color=#4472c4]IFN[/color][/font][font=宋体][color=#4472c4]信号激活[/color][/font][font=&][color=#4472c4][/color][/font][/b][/size][size=15px][font=宋体][color=black]为了研究[/color][/font][font=&][color=black]RA[/color][/font][font=宋体][color=black]如何诱导肿瘤细胞[/color][/font][font=&][color=black]ICD[/color][/font][font=宋体][color=black],作者开展了[/color][/font][font=&][color=black]RNA-seq[/color][/font][font=宋体][color=black],发现[/color][
最新发现与创新 中国科技网讯 对于恶性肿瘤患者而言,最可怕的莫过于肿瘤出现转移扩散,因为这意味着肿瘤病变已经发展到晚期,也是肿瘤治疗失败的重要原因之一。今天(7日)在第七届中国肿瘤学术大会上披露,国际权威学术杂志《抗癌研究》(Anticancer Research)刊发了英国卡迪夫大学关于中药抑制肿瘤转移的研究报告,在国际上引起广泛关注。 英国卡迪夫大学医学院研究证实,我国抗肿瘤创新中药养正消积胶囊可有效抑制肿瘤细胞侵袭转移。研究人员指出,在肿瘤细胞的侵袭转移过程中,磷酸肌醇 3-激酶/蛋白激酶 B(PI3K/AKT) 信号通路的过度激活起到了关键作用,养正消积胶囊可以显著干预 PI3K/AKT 通路,从而对乳腺癌、肠癌、前列腺癌、肺癌、胃癌和骨肉瘤等肿瘤细胞的黏附和迁移起到明显抑制作用,有效控制肿瘤的病变发展。 有关专家介绍,恶性肿瘤细胞非常容易从原发病灶上脱落,每克肿瘤组织每天可向血液中释放300—400万个肿瘤细胞,脱落的肿瘤细胞随血液或淋巴流布全身,一旦条件成熟就会迅速生长,形成转移性病灶。控制肿瘤细胞的侵袭扩散是避免肿瘤恶化、提高肿瘤治疗效果、改善患者生存质量及延长患者寿命的有效措施。 专家认为,这一研究结果对恶性肿瘤的临床治疗具有极高的指导意义,对于尚未出现转移病灶的早中期肿瘤患者,使用养正消积胶囊可以控制肿瘤转移扩散,从而增加手术、介入等治疗手段的成功几率。此外,对于已经发展为全身性病变的晚期肿瘤患者,养正消积胶囊还具有增效减毒作用,可增加化疗疗效,减轻化疗中出现的消化道反应及免疫、造血系统损害,改善患者临床症状,明显提高患者的生存质量,延长患者的生存时间,是辅助治疗恶性肿瘤的一种安全、可靠、疗效满意的治疗方法。(通讯员 杨叁平 李瑞) 《科技日报》(2012-9-8 一版)
单克隆抗体药物治疗肿瘤的研究现状与展望[关键词] 单克隆抗体 免疫偶联物 抗肿瘤药物 单克隆抗体 (简称单抗)药物用于治疗肿瘤的研究已获得重要进展。抗肿瘤单抗药物一般包括 单抗治疗剂与单抗偶联物。研究表明,单抗药物对肿瘤相关靶点显示特异性结合,对肿瘤细 胞有选择性杀伤作用并在动物实验有显著的疗效。单抗药物已开始应用于临床肿瘤治疗。抗 肿瘤单抗药物研究的发展趋势是继续寻求新的分子靶点、抗体人源化以及偶联物分子的小型 化。由于单抗有高度特异性,研制单抗药物有巨大的潜力,单抗药物将在肿瘤治疗中发挥重 要作用。 生物技术药物(biotechnology medicines)近年来获得迅速发展。通过淋巴细胞杂交瘤技术或基因工程技术制备的单克隆抗体(单抗)药物是生物技术药物领域的重要方面。单抗作为诊断剂或检测剂,近20年来已在医学和生物学领域得到广泛应用;单抗作为治疗剂的研究也已获得重要进展。单抗药物(monoclonal antibody agents)可能用于治疗肿瘤、病毒性感染、心血管病以及其它疾患,尤其是用于治疗肿瘤,已显示出良好的前景。抗肿瘤单抗药物一般包括两类,一是抗肿瘤单抗;二是抗肿瘤单抗偶联物,或称免疫偶联物(immunoconjugate)。免疫偶联物分子由单抗与“弹头”药物两部分构成。单抗所针对的靶标通常为肿瘤细胞表面的肿瘤相关抗原或特定的受体。用作“弹头”的物质主要有三类,即放射性核素、药物和毒素;其与单抗连接分别构成放射免疫偶联物、化学免疫偶联物和免疫毒素。自80年代以已对抗肿瘤单抗药物进行了大量研究,特别是自1997年以来,Ritux an、Herceptin在美国相继获批准用于临床肿瘤治疗,单抗药物的研究与开发有了新的发展势头,成为生物技术药物的新热点[1,2]。 单抗药物的研究进展 抗肿瘤单抗药物研究已取得多方面进展,研究结果为应用于肿瘤治疗的可行性提供了重要依据[3,4]。 单抗药物对肿瘤细胞的选择性杀伤作用 研究结果表明,单抗与药物偶联物或与毒素偶联物对肿瘤靶细胞显示选择性杀伤作用,对表达有关抗原的肿瘤细胞作用强,对抗原性无关细胞的作用弱或无作用。研究还表明,单抗药物偶联物对肿瘤细胞的杀伤活性比无关抗体偶联物的活性强;药物与单抗偶联后对肿瘤靶细胞的活性比游离药物强。这种选择性杀伤作用是单抗药物用于肿瘤治疗的重要基础。免疫电镜观察可见单抗或单抗偶联物能结合到细胞表面,经过受体介导的内化过程进入细胞。结合到肿瘤靶细胞表面的数量多,到非靶细胞的数量少;进入靶细胞内的数量多,进入非靶细胞内的数量少。这种特异性结合和内化进一步阐明了单抗或单抗偶联物对靶细胞选择性杀伤作用的机制。 单抗药物具有更高的疗效 由抗人体肿瘤的单抗与药物构成的偶联物对移植于裸鼠的相应人体肿瘤生长有抑制作用。偶联物与相应的游离药物比较,一般具有更高的疗效或显示较低的毒性。曾与单抗进行偶联并在裸鼠进行疗效观察的抗癌药物有阿霉素、柔红霉素、平阳霉素、博安霉素、丝裂霉素、新制癌菌素、氨甲蝶呤、苯丁酸氮芥、苯丙氨酸氮芥、顺铂以及长春碱类衍生物等。使用的肿瘤模型包括肺癌、肝癌、胃癌、结肠癌、乳癌、卵巢癌、脑胶质瘤、黑色素瘤、淋巴瘤和白血病等。来源于植物或细菌的毒素,由于有强烈毒性,很难作为治疗剂使用;但毒素( 或单链毒素)与单抗的偶联物可在动物模型显示疗效。研究表明,单抗药物在动物体内呈特异性分布。静脉内注射抗肿瘤单抗,在肿瘤部位的浓度较高,显示特异性定位。单抗与药物的偶联物通常仍保留原来单抗的分布特征,在靶肿瘤的浓度较高。确定单抗或单抗偶联物在体内具有靶向性,为进一步阐明其疗效提供了依据。 单抗药物对肿瘤相关靶点的特异性作用 特定受体或特定的基因表达蛋白可能作为单抗药物的靶点。Rituxan是以B细胞的CD20 分子为靶点的人鼠嵌合抗体,对非霍奇金B细胞淋巴瘤有疗效,是第一个获美国FD A批准用于治疗恶性肿瘤的单抗[5]。Herceptin 是抗HER-2/neu 癌基因编码蛋白的单抗,临床研究对乳腺癌有效,与化疗药物联合有更显著的疗效 [6],亦已获批准用于治疗肿瘤。表皮细胞生长因子受体(EGFr)在人鳞癌、乳腺癌和脑胶质瘤等均有较高的表达。有报道,抗 EGFr 单抗与长春碱衍生物的偶联物在裸鼠体内试验显示良好的抗癌效果。抗 EGFr 的人鼠嵌合抗体已进入临床研究[7]。转铁蛋白受体在某些肿瘤有较高的表达。抗转铁蛋白受体单抗构成的免疫毒素对脑瘤细胞有高度细胞毒性;高度恶性的肿瘤对免疫毒素的敏感性更高[8]。在人体乳腺癌和卵巢癌常见HER-2 基因扩增而且相应的HER-2 蛋白含量增高。抗HER-2 蛋白单抗与抗 EGFr 单抗联合使用对卵巢癌细胞的作用增强,显示相加的抗增殖作用。CD30 受体在霍奇金淋巴瘤的肿瘤细胞高度表达,可以作为免疫毒素攻击的靶点。近年来,以血管内皮细胞为靶点的单抗药物受到广泛关注。实体瘤的生长与血管密切相关,肿瘤细胞增殖如果缺乏相应的血管新生成将不能发展为肿瘤。以内皮细胞为靶点的单抗药物,抑制血管新生成,可能达到抑制肿瘤生长的目的;而且静脉注射的单抗药物也易于到达靶部位(内皮细胞),不需要穿越细胞外间隙到达实体瘤深部的肿瘤细胞。血管内皮生长因子(VEGF)在血管生成中有重要作用。据报道,抗VEGF 的中和性单抗具有广谱的抗肿瘤作用,对移植于裸鼠的人体癌瘤有显著疗效 [9]。 单抗药物对抗药性肿瘤细胞的杀伤作用 单抗偶联物对于抗药性肿瘤细胞仍显示较强的杀伤活性。对于长期使用氨甲蝶呤而出现抗药性的成骨肉瘤细胞,单抗氨甲蝶呤偶联物仍显示较强的杀伤作用。对于具有多药抗性(MDR)的肿瘤细胞,抗 P-170 糖蛋白单抗构成的免疫毒素可显示选择性杀伤作用。说明单抗药物有可能用于克服肿瘤细胞抗药性。 存在的问题与解决途径 单抗药物的临床研究结果已为其应用于治疗肿瘤展示出良好的前景,但仍有些问题需要进一步研究解决[3]。单抗药物存在的问题主要涉及免疫学和药理学两方面。免疫学方面问题主要是人抗鼠抗体(HAMA)反应。因为多年来用于临床研究的单抗药物多数使用小鼠单抗制备,往往导致HAMA反应。此外,肿瘤细胞群体在抗原性方面的异质性,肿瘤细胞的抗原性调变等也可能影响单抗药物的疗效。药理学方面的问题主要是到达肿瘤的药量不足。单抗药物在体内运送过程受多种因素影响。由于它是异体蛋白,会被网状内皮系统摄取,有相当数量将积聚于肝、脾和骨髓。单抗药物是大分子物质,通过毛细血管内皮层以及穿透肿瘤细胞外间隙均受到限制。解决问题的主要途径包括: 降低单抗药物的免疫原性 目前多数单抗药物使用鼠源性抗体制备,在临床使用可导致HAMA 反应。据报告,在黑色素瘤、结肠癌、乳癌和卵巢癌患者,HAMA发生率高达100%。 HAMA 对注入的单抗药物起中和作用,从而抵消其疗效。避免或减少 HAMA 反应的主要途径是使鼠源性单抗人源化或研制完全的人源抗体。单抗人源化主要通过基因工程技术制备嵌合抗体(chimeric antibody)或改形抗体(reshaping antibody)。嵌合抗体是将 Fc 段置换为人源性,其它部分仍为鼠源性。改形抗体是指除互补决定区(CDR)为鼠源性外,其它部分均为人源性。临床研究表明,嵌合抗体的副反应轻,HAMA 反应率较鼠源性单抗低,在血中半衰期也较长。已获准在临床应用的抗肿瘤单抗药物 Rituxan 和 Herceptin 均属嵌合抗体。 植物或细菌来源的毒素为大分子肽类物质,具有较强的免疫原性。在人体使用免疫毒素,不仅鼠源性单抗部分可引起 HAMA 反应,而且毒素部分亦可导致产生抗毒素的抗体。使用人源化单抗仍不能解决“弹头”(毒素)的免疫原性问题。使用化疗药物为“弹头”则可避免此部分的抗体反应。 提高单抗药物在肿瘤组织的浓度 单抗药物具有体内分布特异性,但有研究表明,能到达肿瘤细胞的药物量仍属有限。据推算,肿瘤组织的单抗摄取量约为 0.005% (注入剂量/克组织),说明可到达靶部位的药物量甚少。单抗药物在体内的运送过程受多种因素影响。首先与肿瘤局部的血供状况有关,动物实验表明,血管丰富、血流量较大的肿瘤,用单抗药物治疗的效果也较好。 单抗及其偶联物均为大分子物质。以IgG型单抗为导向载体、以蓖麻毒素 A 链为“弹头”制成的免疫毒素,其相对分子质量约为 180 000;用 IgM 型单抗为导向载体,偶联物的相对分子质量更大。庞大的药物分子难于透过毛细管内皮层和穿过肿瘤细胞外间隙到达实体瘤的深部。用体外培养的多细胞球体观察表明,免疫毒素对多细胞球体的穿透性很差,培养1 h 仅到达球体外周的 2 至 3 层细胞。对在裸鼠移植的肿瘤进行观察,发现静脉注射免疫毒素 1 天后,瘤结外围部分与中心部分的浓度比为 2∶1;在注射后 5 天才达到 1∶1[ 10]。使用抗体片段,如 Fab、Fab′ 制备分子量较小的偶联物,可能提高对细胞外间隙的穿透性,增加到达深部肿瘤细胞的药物量。为提高药物在肿瘤的浓度,单抗药物分子的小型化是研制的重要途径。 提高单抗药物在肿瘤浓度的另一种办法是局部注射。据报告,在移植人
四军医大发现并命名一种新的肿瘤类型 作者: 来源:科技日报 发布者: 亦云 类别:新闻扫描 日前,一种起源于淋巴管内皮细胞的恶性肿瘤类型,即真正意义上的淋巴管肉瘤,在第四军医大学被首次发现并证实。该项发现,填补了WHO淋巴管肿瘤分类中空缺淋巴管恶性肿瘤的空白,对肿瘤学的分类、诊断和治疗具有重要的理论和临床意义。 据了解,该肿瘤由第四军医大学基础部病理学与病理生理学教研室王哲、黄高昇两位教授领衔的科研团队发现,并将其命名为“炎症性单形性未分化肉瘤”。所撰写的论文,已经全文发表在肿瘤学国际权威杂志临床肿瘤学(《J Clinical Oncology》)上。 据介绍,该肿瘤常发生于年轻患者的骨和软组织,患者临床表现为疼痛性肿物生长,肿物局部有红、肿、热、痛等化脓性炎症,伴有全身发热、白细胞升高的化脓性炎症表现。 肿瘤形态非常特殊,由单一的胞浆丰富的上皮样细胞组成,胞浆嗜酸性,胞膜明显;泡状肿瘤细胞核大、圆形或卵圆形,染色质开放,具有巨大的嗜酸性核仁;肿瘤中可见大量的嗜中性粒细胞浸润,并有许多微脓肿形成。该肿瘤生长迅速,早期发生局部复发和淋巴结转移,对多种化疗方案无反应,患者均在发病后4月内死于广泛转移和严重并发症。肿瘤局部可穿刺抽出脓液,但多种微生物培养均为阴性结果,多种抗生素治疗无效。通过免疫组化和电镜等技术,未能发现肿瘤细胞特异的分化。 王哲说,炎症性单形性未分化肉瘤的临床表现、病理学形态和预后特征独特,与目前已发现的肿瘤都不相同,在世界卫生组织的肿瘤病理学分类中没有相似类型。澳大利亚皇家病理学院的官方病理专业杂志对此次新肿瘤类型的发现进行了报道。 肿瘤类型是由第四军医大学首次发现并命名的,具有自主知识产权,是我国病理界学者首个自主发现和命名的新的肿瘤类型。
长期以来,手术、放疗、化疗三大疗法一直主宰着肿瘤治疗的统治地位。一方面,由于三大疗法本身技术的发展和完善,使得肿瘤治疗较过去有了可喜的进步,手术联合放化疗在很大程度上提高了肿瘤的治疗效果。另一方面是过度治疗事与愿违,对于晚期病人而言,其复发和转移的比例一直居高不下,治疗效果仍然不理想,五年生存率普遍较低。 六步自然疗法抗肿瘤新突破 21世纪,随着分子生物学和微生态学以及免疫学的发展,一种全新的抗肿瘤方法“六步综合疗法”应运而生,所谓“六步综合疗法”是将中药治疗、营养、体能锻炼等多种方法科学地运用到患者的综合治疗中,调整病人心理状态,提高免疫功能,以期达到提高生存率、延长生存期,改善生存质量,使肿瘤患者能最大限度地回归社会,像健康人一样生活和工作。 发酵中药为六步自然疗法第一步 发酵中药是国内首例通过仿生学手法和微生物发酵工艺研制而成的中药微生态制剂,圆了无痛苦消瘤的千年梦想。众所周知,中药在肿瘤的综合治疗中发挥着重要的作用。传统的中药生产工艺落后,不能在临床上起到作用。发酵中药它创造性地采用了人体仿生学手法,在体外模拟健康人的消化系统,中药成分经过生物转化,使大分子物质变成小分子物质,从而被人体吸收和利用,使药效提高4至28倍。 国际自然抗癌学会副会长史宗山教授认为:中药中的有效成份是其中的次生代谢物,是在随中药进入人体后,经过人体细胞代谢产生的物质而发挥治病作用。这些有效成分通过对致癌基因的抑制、抑癌基因的激活和生长调控基因的修复,来实现多靶点作用。发酵中药正是通过高科技生物转化后的有效成分,在细胞分子水平上调节了这些对肿瘤有影响的机制而发挥抗肿瘤、抗复发、抗转移功能。 发酵中药五大革命性突破 发酵中药抗肿瘤成功实现五大突破:1)首次把中药抗肿瘤活性成分从大分子转变成小分子,有效成分可迅速穿透毛细血管壁直达肿瘤病灶;2)首次激活传统中药未被开发的抗肿瘤活性物质-CSD因子,诱导肿瘤细胞分化凋亡;3)首次实现中药多靶点靶向识别、抑杀肿瘤细胞,抑制肿瘤新生血管形成,防止复发转移。4)中药无毒化,通过益生菌对中药有效成分的多次仿生分解及转化,彻底去除中药有毒成分,并大幅提高中药药效及吸收效果。5)口感良好,真正改变了中药良药苦口世界形象。
美国杜克大学医学中心的研究人员设计出了一种新的肿瘤靶向疗法,试图通过附着在活体肿瘤RNA上的适配分子,直接将药物传送至肿瘤所在的位置,以达到治疗的效果。相关文章发表在11月29日《自然·化学生物学》杂志的在线版上。 适配分子是RNA中的一小部分,通常附着于蛋白质等特定的目标分子上。其简单易用,可轻易再生和修改,对抗体等其他介质的兼容性很强。值得注意的是,适配分子对免疫系统的侵害很小,这为其成为肿瘤诊断和治疗的重要候选途径增加了关键的筹码。 研究人员对患有肝癌的啮齿类动物体内的适配分子进行了筛选。这类肿瘤属于转移性肿瘤,通常由结肠癌瘤所致。他们从肿瘤中分离出特定的RNA,将其扩展化,并重新植入,以确定哪类分子与肿瘤的RNA附着最紧密。经过多次测试后,科学家找到了与肿瘤蛋白契合度最好的适配分子,其可附着在RNA内特定的解旋酶P68上。该解旋酶为结直肠瘤产生的核内蛋白。 研究人员表示:“十分重要的是,在甄选过程之前,研究人员并不需要对疾病中的蛋白质变化有深入的了解,这大大简化了分子探针的发展过程。被选定的适配分子可用于发掘之前并未与疾病相关联的蛋白质,这将对提高寻找有效肿瘤疗法的速率有所裨益。” 作为肝胆肿瘤领域的专家,布赖恩·克莱里博士也谈到,这种适配分子不仅能附在细胞培养状况下生成的P68蛋白上,还能直接附着于活体内的肿瘤,对于乳腺癌和肺部肿瘤等疾病也有良好的适用性。其下一步的研究方向是在需要时,适配分子如何能将具有杀死肿瘤功能的试剂准确传送至患处。
[size=14px] [/size] [size=14px]葫芦素B ( cucurbitacin B,CuB ) 是瓜蒂等葫芦科清热解毒中药的主要药效成分, 是葫芦素家族中含量最丰富的成员,具有保肝、消炎和抗肿瘤等广泛的药理活性。虽然已经有很多学者研究了CuB的不同抗癌机制,但大多数都是下游途径和疗效表型,CuB在多种肿瘤中的直接作用靶点至今尚未明确。[/size] [size=14px]今天为大家分享2篇关于葫芦素B在抗肿瘤应用中的高水平文章,分别发表在Acta Pharm Sin B(IF=14.5)和ACS Central Science(IF=18.2),思路经典,以供学习参考。[/size] [size=14px]文献1:葫芦素B抑制结膜黑色素瘤的直接靶点[/size] [size=14px]2022年5月23日,华东理工大学药学院李剑、上海九院眼科徐晓芳/贾仁兵团队合作在Acta Pharm Sin B(IF=14.5)上发表了题为“Cucurbitacin B-induced G2-M cell cycle arrest of conjunctival melanoma cells mediated by GRP78–FOXM1–KIF20A pathway”的文章,揭示了葫芦素B抑制结膜黑色素瘤直接靶点及相关机制。[/size] [size=14px] [/size] [size=14px]研究首先利用结膜黑色素瘤(Conjunctival melanoma,CM)细胞株筛选自建的上市老药库(含1400个化药和天然药),发现葫芦素B对NRAS和BRAF突变的CM细胞均表现出突出的抗增殖活性。接着作者利用细胞实验发现CuB抑制CM细胞增殖并导致G2/M细胞周期停滞,并通过RNA-Seq、q[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]和Western blot发现CuB抑制CM细胞FOXM1/PLK1 -KIF20A通路。进一步作者采用ABPP识别CuB的直接靶蛋白,在9种候选蛋白中,GRP78已被报道为多种癌症的潜在生物标志物和治疗靶点,可抑制癌细胞的进展、增殖、侵袭和转移。作者通过Pulldown+WB、MST、TSA等验证了两者直接结合,并通过质谱鉴定发现CuB通过α-β-不饱和酮部分与GRP78的Lys326位点互作。最后Rescue实验发现GRP78敲低削弱CuB抑制细胞增殖的作用,而GRP78过表达强化CuB抑制细胞增殖的作用,表明葫芦素B通过GRP78发挥功能。总之,CuB通过结合GRP78抑制GRP78-FOXM1-KIF20A通路进而抑制CM细胞周期发挥功能。[/size] [size=14px] [/size] [size=14px]文献2:中药瓜蒂活性成分葫芦素B抗肿瘤作用分子靶点及作用机制[/size] [size=14px]2022年5月17日,北京大学药学院屠鹏飞/曾克武团队在ACS Cent Sci(IF=18.2)上发表了题为“Allosteric regulation of IGF2BP1 as a novel strategy for the activation of tumor immune microenvironment”的文章,揭示了葫芦素B发挥抗肿瘤作用的直接靶点及相关机制。[/size] [size=14px] [/size] [size=14px]研究首先通过体内外实验发现IGF2BP1(m6A reader protein)敲低能够募集肿瘤浸润性免疫细胞,阻断PD-L1表达,增强抗肿瘤免疫抑制HCC进展。进一步采用高通量筛选系统(基于IGF2BP1可识别并结合m6A探针,小分子抑制IGF2BP1与m6A探针结合,SPR检测结合能力)从先前建立的天然产物小分子库(889种)中筛选能够抑制IGF2BP1的小分子,发现6种候选化合物对m6A的抑制率达70%,进一步发现其中的葫芦素B对肝癌细胞增殖展现最佳抑制效果。随后SPR、ITC、CETSA、DARTS、Pulldown、分子对接证实IGF2BP1与葫芦素B的直接结合。机制上,葫芦素B通过共价修饰IGF2BP1的253位半胱氨酸,诱导IGF2BP1蛋白变构,抑制IGF2BP1对下游m6A的识别,并且影响多个肿瘤相关靶基因的表达,发挥诱导肿瘤细胞凋亡和改善肿瘤免疫微环境的作用。[/size] [size=14px]总结[/size] [size=14px]越来越多的中药活性成分被发现在多种疾病中发挥药理活性,发现其在不同疾病中的不同的直接作用靶点将有助于深入挖掘其作用机制。近年来筛选并验证中药活性成分的直接靶点的技术手段越来越多,且各具特色,这将极大的推动中药现代化研究进程。[/size]
近日,具有自主知识产权、国内首款脂代谢抗肿瘤新药——德氮吡格及其注射液,在我重庆研制成功,并有望两年后进入临床使用阶段。 目前国内常用的抗肿瘤药物,尽管能够杀死肿瘤,帮助患者缓解病痛,但其具有的毒性,会给患者的免疫及造血系统带来损害。更重要的是,长期服用此类药品,病人会由此产生依赖性,不利于疾病的治疗。该项目负责人、重庆医科大学药学院教授余瑜介绍,这款抗肿瘤新药与国内其他的抗肿瘤药物相比,最大价值在于,在国内首次运用干扰肿瘤细胞脂代谢特异性的方式来杀死肿瘤细胞,减少了药物在治疗过程中产生的副作用,从而降低药物对病人的影响,提高肿瘤治疗的成功率。 德氮吡格可广泛地运用在肝癌、肺癌、脑癌、肾癌等疾病的治疗上。目前,该药物正在申报注册国家一类新药,该药获得了2006年度重庆市科学技术发明三等奖。
肿瘤是指体内细胞的异常增生,可以是良性的或恶性的。良性肿瘤(例如息肉)生长缓慢且通常局限在一个区域,不会侵犯周围组织或扩散到其他部位。恶性肿瘤(即癌症)具有侵袭性,可以快速生长并通过血液或淋巴系统扩散到其他身体部位,形成远处转移。癌症是一种严重威胁人类健康和生命的疾病,2020年全球有1 930万新增癌症病例和1 000万癌症死亡病例,且我国癌症发病率和死亡率均位居全球第一[1]。最常见的癌症类型是乳腺癌、肺癌、结直肠癌和前列腺癌。因此,寻找新的抗肿瘤药物,阐明抗肿瘤药物的分子机制,是解决当前临床肿瘤治疗难点的有效策略。中药具有多种有效成分,因其不良反应低、多靶点、多通路等优点,已成为抗肿瘤药物开发的重要来源和研究热点[2]。目前,常规的肿瘤症治疗方法为手术、放射治疗和化学治疗等,但这些方法往往伴随着较大的不良反应和毒性,而且对某些难治性或复发性肿瘤效果不佳[3]。因此,寻找有效、低毒的抗肿瘤药物是当前临床研究的重要方向。 苍术是一种常用的中药材,分为茅苍术Atractylodes lancea (Thunb.) DC.和北苍术A. chinensis (DC.) Koidz.,分别来源于菊科植物茅苍术或北苍术的干燥根茎。苍术具有燥湿健脾、祛风散寒的功效,在《神农本草经》中列为上品[4]。近年来,苍术在抗微生物、抗炎、抗肿瘤、免疫调节、调节消化系统、心血管系统和神经系统等方面的药理作用受到了广泛关注。苍术中含有挥发油、多糖、倍半萜类、聚乙炔类等[5]多种化学成分。其中一些成分已经被证实具有抑制或杀伤多种肿瘤细胞的能力,其作用机制涉及诱导凋亡、抑制增殖、迁移、侵袭和转移,以及调控免疫功能等方面[6]。然而,苍术中的抗肿瘤活性成分及其作用机制尚未完全明确,需要进一步深入地探索和验证。本文通过整理国内外研究文献,对苍术活性成分、苍术与其他药物联合抗肿瘤及其分子机制进行总结,探讨苍术在抗肿瘤方面的应用规律和思路,为苍术资源的开发利用以及抗肿瘤临床疗法的研究提供理论参考。 1 苍术主要化学成分 茅苍术与北苍术化学成分相似,药理作用也较为相似,目前已从苍术中分离出多种化学成分,主要含有包括萜类、聚乙烯炔类、有机酸类、糖苷类化合物等[7-8]。苍术主要抗肿瘤化学成分,见图1。茅苍术与北苍术中主要化学成分如表1所示。 图片 图片 2 苍术的抗肿瘤机制 苍术中含有苍术内酯Ⅰ、Ⅱ、Ⅲ、苍术酮、β-桉叶醇和苍术素等有效成分,这些成分不仅可以抗炎、抗氧化、抗菌、保肝、降血糖,还可以抗肿瘤[14-15]。近年来,苍术及其有效成分对肿瘤的抑制作用受到了广泛的关注。研究发现,苍术有效成分对多种肿瘤细胞都有抑制作用,可以通过多种途径和机制影响肿瘤细胞的生长、迁移、侵袭和血管生成,诱导肿瘤细胞的凋亡和自噬,调节肿瘤微环境和免疫系统。 2.1 抑制肿瘤细胞增殖 肿瘤是由于细胞增殖失控而形成的一种疾病[16]。细胞周期是细胞增殖的基本过程,由细胞周期蛋白(cyclin,CCN)和细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)复合物共同调控[17]。干预细胞周期是抑制肿瘤发展的有效策略之一[18]。Kotawong等[19]发现,苍术中的苍术素、苍术内酯I和β-桉叶醇等有效成分可以通过影响肿瘤细胞周期的不同阶段来抑制肿瘤细胞的增殖。这些成分可以通过抑制磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)、磷酸化蛋白激酶B(protein kinase B,AKT)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路来诱导肿瘤细胞在G1期停滞;Yu等[20]发现苍术内酯I通过上调周期蛋白依赖性激酶抑制剂1A(cyclin-dependent kinase inhibitor 1A,p21)和下调cyclinB1、CDK1和细胞分裂周期25C蛋白(cell division cyclin25,Cdc25c)等关键分子来抑制肿瘤细胞在G2/M期的进入,在动物模型中,苍术内酯I可以显著抑制膀胱癌的生长,且无明显不良反应。Zhang等[21]实验发现苍术内酯Ⅱ可以通过改变结直肠癌细胞内的蛋白表达从而抑制结直肠癌细胞的增殖和活性,并且还显著增强了结直肠癌细胞的化疗敏感性。Pongsakorn等[22]发现,苍术提取物可以通过抑制细胞外信号调节激酶信号级联(ERK-signaling cascade,ERK)信号通路来抑制胆管癌细胞的增殖。ERK信号通路是一种重要的细胞内信号转导机制,参与调节细胞生长、分化和凋亡等过程。苍术提取物可以下调ERK及其下游分子的表达,从而抑制胆管癌细胞的生长和增殖,不同类型的胆管癌细胞对苍术提取物的敏感度不同,其中人胆管HuCCT-1癌细胞最为敏感。 2.2 诱导肿瘤细胞凋亡 细胞凋亡是一种程序性细胞死亡形式,它通过限制细胞的增殖和分化来维持组织稳态或去除潜在的有害细胞[23]。目前已知的细胞凋亡途径主要有3种,即外源性途径(死亡受体介导)、内源性途径(线粒体介导)和内质网途径。其中,线粒体途径是最重要的一种,它涉及线粒体外膜透化(outer mitochondrial membrane,MOMP)、细胞色素C释放和半胱天冬酶(cysteine aspartic acid protease,Caspase)激活[24]。多项研究发现,苍术酮可以通过降低线粒体膜电位、提高活性氧水平、抑制B细胞淋巴瘤-2基因(B-cell lymphoma-2,Bcl-2)表达、促进BCL2-相关X蛋白(BCL2-associated X protein,Bax)裂解和Caspase-3表达[25],以及下调PI3K/AKT/mTOR信号通路来诱导肿瘤细胞凋亡[26]。Narahara等[27]研究表明,β-桉叶醇和苍术内酯Ⅲ[27]可以通过增加Caspase-3、Caspase-8、Caspase-9和Bax等凋亡相关蛋白的表达、下调Bcl-2表达、释放细胞色素C和降低线粒体膜电位来诱导胆管癌细胞凋亡。此外,Li等[28]使用β-桉叶醇处理的白血病HL60细胞,发现β-桉叶醇可以通过激活c-JunN端激酶(c-Jun N-terminal kinase,JNK)丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路来诱导白血病HL60细胞凋亡。Li等[29]研究发现,苍术素可以通过降低Bcl-2表达、激活p53肿瘤蛋白(p53 tumor protein,p53)、Bax和Caspase-3、-8、-9等凋亡因子来诱导人乳腺癌MCF-7细胞凋亡,并表现出浓度依赖的毒性效应。Li等[30]研究表明,苍术内酯I和苍术内酯Ⅱ[31]可以通过与对两面针激酶2(Janus kinase 2,JAK2)直接相互作用而负调节信号传导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)磷酸化,从而抑制其活化,进而导致糖酵解的抑制和结肠、直肠癌细胞凋亡的诱导。 2.3 抑制肿瘤细胞转移 肿瘤细胞转移是指肿瘤细胞通过血液循环从原发部位转移到其他部位的过程,这是癌症治疗的难点,也是癌症死亡的主要原因[32]。上皮间质转化(epithelial-mesenchymal transition,EMT)是一种与癌症发生相关的细胞程序,它使癌细胞具有移动性、侵袭性和抗凋亡能力,从而促进转移。苍术的一些活性成分具有抑制肿瘤细胞转移的潜在作用,其机制可能涉及对EMT的调控[33]。Acharya等[34]研究发现,β-桉叶醇可以改变EMT相关标志物的表达,从而抑制结肠癌细胞的增殖、迁移和侵袭。同时它还可以影响PI3K、AKT、p38丝氨酸/苏氨酸蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)信号通路,以及肺癌细胞中的活性氧水平,从而降低癌细胞的黏附和迁移能力[35]。麦静愔等[36]发现苍术酮可以通过抑制EMT过程等途径抑制肿瘤细胞的迁移和侵袭能力,此外,苍术酮还可以通过下调基质金属蛋白酶(matrix metalloproteinase,MMP)的表达从而抑制肿瘤细胞的迁移和侵袭能力。MMP是一类能够降解细胞外基质(extracellular matrix,ECM)的锌依赖性内肽酶,在癌症进展中的作用与它们参与ECM降解以及黏附和细胞骨架蛋白、生长因子、趋化因子的调节和加工有关[37]。且有动物实验表明,苍术酮可以明显抑制肝癌生长,没有明显的毒性。Zhong等[38]在观察了苍术多糖在U-2 OS人骨肉瘤细胞中对内皮细胞选择素(endothelial cell selectin,E-Selectin)和路易斯X三糖(Lewis-X Trisaccharide,LacCer Lex)的影响,发现苍术多糖可通过降低U-2 OS细胞上的E-Selectin抑制U-2 OS细胞对人脐静脉内皮细胞HUVECs的黏附、迁移和侵袭。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)在促进肿瘤转移中发挥重要作用,Zhang等[39]发现苍术内酯II可以有效抑制肿瘤细胞极化,从而抑制肺癌细胞在体内和体外的转移。铁死亡是一种新的细胞死亡模式,其特征是铁过载导致脂质过氧化而导致膜损伤,过度的铁死亡会影响肿瘤的转移,从而抑制肿瘤的进展[40]。He等[41]发现,苍术素可通过抑制谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)和铁蛋白轻链(ferritin light chain,FTL)的表达,以及上调酰基辅酶A合成酶长链家族成员4(acyl-CoA synthetase long-chain family member 4,ACSL4)和转铁蛋白受体(transferrin receptor,TFR1)的表达来诱导肝癌HCCM细胞的铁死亡。 2.4 诱导肿瘤细胞自噬 细胞自噬是一种分解代谢通路,能清除不必要的或功能失调的细胞成分并回收代谢底物[42]。目前已知有3种主要的细胞死亡方式:细胞凋亡(Ⅰ型)、自噬性细胞死亡(Ⅱ型)和坏死(Ⅲ型)。自噬性细胞死亡是指自噬过程中产生的自噬体过多或过大,导致细胞质溶解和细胞死亡。自噬体是由双层膜包裹的囊泡,内含被降解的细胞器和蛋白质。微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)是自噬体形成的关键标志物,它以微管相关蛋白1A/1B-轻链3(microtubule-associated protein 1 light chain 3,LC3-I)和微管相关蛋白1轻链3的脂化形式(lipidated form of microtubule-associated protein 1 light chain 3,LC3-Ⅱ)2种形式存在,LC3-Ⅰ转化为LC3-Ⅱ是自噬体形成的必要步骤[43-44]。Li等[29]使用苍术素处理乳腺癌MCF-7细胞时发现,苍术素可以增加了LC3Ⅰ向其脂化形式的LC3Ⅱ的转化,并增加了苄氯素1(beclin-1,BECN1)的表达,下调了人乳腺癌MCF-7细胞中的p62蛋白(p62 protein,p62)表达,改变凋亡和自噬相关生物标志物。Acharya等[45]研究发现,苍术素通过调节PI3K、AKT、mTOR、p38MAPK信号通路的活性,可以诱导胆管癌HuCCT-1细胞发生自噬,并抑制其生长、迁移和侵袭,SB202190(p38MAPK诱导剂)和3-MA(p38MAPK抑制剂)分别显著增加和降低苍术素诱导的自噬速率。 2.5 抑制肿瘤血管生成 血管生成本身不会导致恶性肿瘤的形成,但可以为肿瘤的生长和转移提供条件。肿瘤在发展到一定阶段后,需要依赖新生血管来满足其对氧气和营养的增加的需求,以及排除代谢废物,因此,抑制血管生成是一种有效的抗肿瘤策略[46]。血红素加氧酶1(heme oxygenase 1,HO-1)是一种在肿瘤组织中高表达的酶,它可以促进肿瘤的血管生成和抗氧化应激,为肿瘤细胞提供生存优势。因此,抑制HO-1的表达或活性是治疗肿瘤的另一种有效策略之一。Mathema等[47]研究发现,苍术素可以抑制胆管癌CL6肿瘤细胞的集落形成和伤口愈合能力,其机制与抑制HO-1的表达、下调信号转导及转录激活蛋白1/3(signal transducer and activator of transcription 1/3,STAT1/3)和核因子κB(nuclear factor kappa-B,NF-κB)的信号通路有关。β-桉叶醇也具有抑制胆管癌细胞中HO-1的表达的能力,其机制与浓度依赖性地抑制STAT1/3和NF-κB信号通路有关[48]。β-桉叶醇还可以通过抑制生长因子信号通路中的环磷腺苷效应元件结合蛋白(cyclic-AMP response binding protein,CREB)激活来阻断血管生成,从而抑制肿瘤的发展[49]。Tsuneki等[50]有动物实验表明,β-桉叶醇可以通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)来刺激大鼠嗜铬细胞瘤细胞中的神经突生长,且β-桉叶醇还表现出了体外和体内的抗血管生成活性,其阻断了由碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)或血管内皮生长因子(vascular endothelial growth factor,VEGF)诱导的人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)中CREB蛋白的磷酸化,从而抑制bFGF刺激的HUVEC迁移和HUVEC在基质胶中的管形成。同时,它还能显著降低小鼠皮下植入的Matrigel栓塞和小鼠佐剂诱导的肉芽肿中的血管生成[51]。 2.6 免疫调节作用 随着肿瘤的发生和发展,或在接受化疗、放疗等治疗的过程中,肿瘤患者机体免疫力的显著下降。因此,调节或刺激机体免疫能力,可能是一种有效的主动抗癌策略。免疫治疗作为一种新型的抗癌手段,已经引起了广泛的关注和研究[52]。巨噬细胞是机体内重要的免疫细胞,在机体免疫中发挥着重要的作用[53]。Qin等[54]从苍术中分离得到两种多糖成分:中性多糖和酸性多糖。研究表明,酸性多糖能够显著地刺激小鼠单核巨噬细胞白血病细胞(RAW264.7)细胞的增殖、吞噬能力、NO产生和细胞因子分泌,并且呈现出剂量相关性,而中性多糖则相对较弱。此外,中性多糖和酸性多糖均能够激活淋巴结Peyers patch细胞中的T细胞,并促进集落刺激因子的产生。而酸性多糖也表现出比中性多糖更好的肠道免疫调节活性。吲哚胺-2,3-二氧化酶(indoleamine 2,3-dioxygenase,IDO)是一种通过犬嘌呤途径氧化分解色氨酸的限速酶,是抗肿瘤免疫治疗中小分子药物开发的潜在目标。IDO可在肿瘤微环境中通过与许多肿瘤相关的自发炎症和T细胞激活而被诱导。Liu等[55]研究发现,苍术内酯Ⅰ可以通过下调Toll样受体4/髓样分化蛋白2复合物(toll-like receptor 4/myeloid differentiation 2 complex,TLR4/MD-2)的表达,抑制人卵巢癌细胞(EOCSKOV3)中髓样分化主要反应蛋白88(myeloid differentiation primary response protein 88,MyD88)、NF-κB、Akt和IDO1的信号通路的活化,从而减少白细胞介素-6(interleukin-6,IL-6)、转化生长因子-β1(transforming growth factor beta 1,TGF-β1)、VEGF和白细胞介素-17A(interleukin-17A,IL-17A)等促进肿瘤免疫逃逸的因子的分泌。同时,还可以降低调节性T细胞(Treg细胞)在肿瘤微环境中的比例,改善T淋巴细胞受到EOCSKOV3细胞上清液抑制而导致的增殖反应降低和抗肿瘤细胞毒性减弱。Liu等[56]研究发现,苍术内酯Ⅲ可以通过直接结合JAK3蛋白,从而抑制γ-干扰素(interferon gamma,IFN-γ)触发的JAK3/STAT3通路,从而达到抑制IDO激活的目的。 苍术抗肿瘤成分的潜在分子机制见图2。对苍术抗肿瘤有效成分及其抗肿瘤作用进行归纳总结,见表2。 图片 图片 3 联合用药 西医治疗肿瘤的常用手段有手术切除、药物化疗和高能射线放疗等,这些手段去除肿瘤西医的治疗方式更为直接,适合前期控制病情,化疗药物虽然能够杀死肿瘤细胞,但同时也伴有严重的副作用,影响患者的生活质量和治疗效果。中药具有不良反应小、安全性高的特点,因此中药与化疗药物的联合应用被广泛关注和探索[57]。 阿帕替尼是全球第一个在晚期胃癌被证实安全有效的小分子抗血管生成靶向药物,也是晚期胃癌标准化疗失败后,明显延长生存期的单药。Zhou等[58] 分析了不同苍术多糖提取方法的影响。比较了热水浸提法、超声浸提法和酶浸提法提取苍术多糖的得率、总糖含量、相对分子质量分布、单糖组成、并测定苍术多糖与阿帕替尼的协同活性。结果发现其中超声浸提法表现出最强的协同作用。这也与超声浸提的苍术多糖相对分子质量小、β-构型高、半乳糖含量高的事实相一致。Srijiwangsa等[59]发现,β-桉叶醇可以通过抑制胆管癌细胞和细胞裂解物中的NAD(P)H醌氧化还原酶1[NAD(P)H quinonedehydrogenase 1,NQO1]的活性和蛋白表达,增强氟尿嘧啶和多柔比星对细胞迁移的细胞毒性活性和抑制活性。Mai等[60]将不同浓度的苍术内酯I、硼替佐米以及硼替佐米+苍术内酯I作用于U266细胞结果研究发现,苍术内酯可以调节JAK2/STAT3通路上的IL-6、JAK2、STAT3等基因表达抑制U266肿瘤细胞的增殖和促进其凋亡并呈剂量依赖性,并能与硼替佐米产生协同作用,当苍术内酯I与硼替佐米联合使用时,可显著增强对U266细胞增殖的抑制作用。 紫杉醇是第一个获得批准的草药衍生化疗药物[61]。并且作为一种已知的Toll受体4配体(toll-like receptor 4 ligand,TLR4),可激活TLR4/MyD88依赖性途径,该通路介导了上皮性卵巢癌的化学耐药性和肿瘤进展。苍术内酯I是一种新型TLR4拮抗剂,通过干扰紫杉醇与人白细胞膜TLR4的结合,来抑制TLR4信号传导。Huang等[62]研究发现苍术内酯-I可以减弱紫杉醇诱导的IL-6、VEGF和存活蛋白的蛋白表达,并增强MyD88(+)EOC人卵巢癌细胞的早期凋亡和生长抑制;苍术内酯I被发现更加亲和人髓样分化蛋白2(myeloid differentiation 2,MD-2)的疏水囊,并通过对接模拟与紫杉醇的结合位点部分重叠,这表明苍术内酯-I可能阻断MyD88(+)EOC细胞中MD-2介导的TLR4/MyD88依赖性紫杉醇信号传导。因此,苍术内酯-I可以通过阻断MD-2介导的TLR4/MyD88信号传导,显著提高MyD88(+)EOC细胞对紫杉醇的反应。 结缔组织生长因子(connective Tissue Growth Factor,CTGF)是一种多功能信号调节剂,可通过调节细胞增殖、迁移、侵袭、耐药性和EMT来促进癌症的发生、进展和转移。CTGF还参与大多数节点的肿瘤微环境,包括血管生成、炎症和肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)激活[63]。Wang等[64]研究发现,苍术内酯-I可以下调三阴性乳腺癌细胞中CTGF的表达和分泌。除了通过CTGF抑制三阴性乳腺癌细胞迁移外,苍术内酯-I还下调了成纤维细胞中CTGF的表达,降低了乳腺癌细胞将成纤维细胞转化为CAFs的能力,从而增加了三阴性乳腺癌细胞对紫杉醇的敏感性。在小鼠肿瘤模型中,发现苍术内酯-I治疗可以增强紫杉醇对肿瘤的化疗作用,减少肿瘤向肺和肝的转移。在用苍术内酯-I与紫杉醇联合治疗的小鼠中,源自接种肿瘤的原代培养的成纤维细胞表达相对较低水平的CAFs标志物。 研究表明了苍术内酯-I可以通过阻断CTGF表达和成纤维细胞活化来使三阴性乳腺癌细胞对紫杉醇敏感,还可以通过阻断MD-2介导的TLR4/MyD88信号传导,显著提高肿瘤细胞对紫杉醇的反应并。这些机制有助于未来研究以确定苍术内酯I在临床环境中的价值。对苍术化学成分联合治疗归纳总结,见表3。 图片 4 结语与展望 苍术中含有多种抗肿瘤成分,其中多为倍半萜类成分,如苍术酮、苍术素和苍术内酯等,这些成分多是通过调控PI3K/Akt/mTOR通路来发挥抗肿瘤的作用,但作用靶点与方式却各不相同。例如苍术内酯主要通过降低Akt的磷酸化水平、上调Bax和Bad蛋白表达、增加脂质磷酸酶(PTEN)活性来抑制该通路进而诱导肿瘤细胞凋亡[20];β-桉叶醇能通过激活p27抑制cyclinD1和CDK4蛋白表达最终导致细胞周期停滞于G1期[19]。这些成分通过多途径、多靶点影响肿瘤细胞的生存、运动、代谢和迁移进而共同发挥抗肿瘤作用。正因为其作用机制的不同,使其各有效成分对不同肿瘤的作用具有一定特异性。因此苍术抗肿瘤活性成分联合化疗药物减副增效在科学研究及临床用药时可根据其作用机制进行选择。目前关于苍术化合物对肿瘤细胞的研究还存在一些不足之处,如缺乏对不同肿瘤细胞类型和不同剂量的系统比较、缺乏对苍术化合物与其他药物或放化疗的协同作用的评价,以及缺乏对苍术化合物在体内代谢和药效学的深入分析等。 因此,今后还需要加强对苍术化合物抗肿瘤作用的基础和临床研究。后续可以根据苍术有效成分的抗肿瘤作用机制,筛选出具有最强抗肿瘤活性和最低毒性的化合物,作为候选药物进行进一步的优化和改造,提高其药效和安全性;分析苍术中有效成分的药代动力学特征,研究其在体内的吸收、分布、代谢和排泄等过程,确定其最佳的给药途径、剂量和方案,减少其不良反应和药物相互作用;根据苍术中有效成分的药效学特征,研究其对不同类型、分期和分子标志物的肿瘤细胞的作用差异,确定其最适合的治疗对象和指标,提高其个体化和精准化的治疗效果;根据苍术有效成分的协同增效或拮抗作用,探索其与其他抗癌药物或放化疗的联合应用,实现其对肿瘤细胞的多靶点、多途径和多机制的综合干预,增强其抗肿瘤效能和克服肿瘤耐药性,以期为开发新型的抗肿瘤药物提供更多的选择和可能性。 苍术与化疗药物的联合应用被广泛关注和探索。作为苍术的主要成分,现有研究已表明倍半萜类具有显著的抗肿瘤活性,其与化疗药物的联合临床用药有着巨大的潜力。但倍半萜类化合物分子结构中含有多个疏水基团,导致它们的极性较低,难以与水分子形成氢键或静电相互作用,在水中的溶解度小、生物利用度低。随着现代药物研究技术的现代化和多学科的交叉融合,这些问题也可以通过引入基团、采用纳米技术制备纳米载体、采用共晶技术制备倍半萜类化合物的共晶体等方式来提高其水溶性,进而增强其生物利用度。这些技术在药物化学领域已比较成熟,也已逐步应用于临床药物的开发。例如,抗疟活性药物青蒿素同样具有水溶性差应用困难的问题,通过引入羧酸基团,显著提高了其水溶性和生物利用度[65-66]; 此外,共晶体可以改变倍半萜类化合物的晶型和晶格参数,从而降低其结晶度和熔点,增加其自由能和溶解度[67]。苍术内酯也可通过与尼可替尼(一种具有较高水溶性的抗肿瘤药物)制备共晶体,可以显著提高其水溶性。因此,苍术抗肿瘤有效成分和化疗药物的联合用药在临床环境中的开发和应用具有很高的研究价值。 苍术作为中医临床常用的化湿药。其药性辛、苦、温,归脾、胃、肝经,其苦温燥湿,可以去湿浊、辛温健脾以和脾胃,多用于湿
肿瘤是指体内细胞的异常增生,可以是良性的或恶性的。良性肿瘤(例如息肉)生长缓慢且通常局限在一个区域,不会侵犯周围组织或扩散到其他部位。恶性肿瘤(即癌症)具有侵袭性,可以快速生长并通过血液或淋巴系统扩散到其他身体部位,形成远处转移。癌症是一种严重威胁人类健康和生命的疾病,2020年全球有1 930万新增癌症病例和1 000万癌症死亡病例,且我国癌症发病率和死亡率均位居全球第一[1]。最常见的癌症类型是乳腺癌、肺癌、结直肠癌和前列腺癌。因此,寻找新的抗肿瘤药物,阐明抗肿瘤药物的分子机制,是解决当前临床肿瘤治疗难点的有效策略。中药具有多种有效成分,因其不良反应低、多靶点、多通路等优点,已成为抗肿瘤药物开发的重要来源和研究热点[2]。目前,常规的肿瘤症治疗方法为手术、放射治疗和化学治疗等,但这些方法往往伴随着较大的不良反应和毒性,而且对某些难治性或复发性肿瘤效果不佳[3]。因此,寻找有效、低毒的抗肿瘤药物是当前临床研究的重要方向。 苍术是一种常用的中药材,分为茅苍术Atractylodes lancea (Thunb.) DC.和北苍术A. chinensis (DC.) Koidz.,分别来源于菊科植物茅苍术或北苍术的干燥根茎。苍术具有燥湿健脾、祛风散寒的功效,在《神农本草经》中列为上品[4]。近年来,苍术在抗微生物、抗炎、抗肿瘤、免疫调节、调节消化系统、心血管系统和神经系统等方面的药理作用受到了广泛关注。苍术中含有挥发油、多糖、倍半萜类、聚乙炔类等[5]多种化学成分。其中一些成分已经被证实具有抑制或杀伤多种肿瘤细胞的能力,其作用机制涉及诱导凋亡、抑制增殖、迁移、侵袭和转移,以及调控免疫功能等方面[6]。然而,苍术中的抗肿瘤活性成分及其作用机制尚未完全明确,需要进一步深入地探索和验证。本文通过整理国内外研究文献,对苍术活性成分、苍术与其他药物联合抗肿瘤及其分子机制进行总结,探讨苍术在抗肿瘤方面的应用规律和思路,为苍术资源的开发利用以及抗肿瘤临床疗法的研究提供理论参考。 1 苍术主要化学成分 茅苍术与北苍术化学成分相似,药理作用也较为相似,目前已从苍术中分离出多种化学成分,主要含有包括萜类、聚乙烯炔类、有机酸类、糖苷类化合物等[7-8]。苍术主要抗肿瘤化学成分,见图1。茅苍术与北苍术中主要化学成分如表1所示。 图片 图片 2 苍术的抗肿瘤机制 苍术中含有苍术内酯Ⅰ、Ⅱ、Ⅲ、苍术酮、β-桉叶醇和苍术素等有效成分,这些成分不仅可以抗炎、抗氧化、抗菌、保肝、降血糖,还可以抗肿瘤[14-15]。近年来,苍术及其有效成分对肿瘤的抑制作用受到了广泛的关注。研究发现,苍术有效成分对多种肿瘤细胞都有抑制作用,可以通过多种途径和机制影响肿瘤细胞的生长、迁移、侵袭和血管生成,诱导肿瘤细胞的凋亡和自噬,调节肿瘤微环境和免疫系统。 2.1 抑制肿瘤细胞增殖 肿瘤是由于细胞增殖失控而形成的一种疾病[16]。细胞周期是细胞增殖的基本过程,由细胞周期蛋白(cyclin,CCN)和细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)复合物共同调控[17]。干预细胞周期是抑制肿瘤发展的有效策略之一[18]。Kotawong等[19]发现,苍术中的苍术素、苍术内酯I和β-桉叶醇等有效成分可以通过影响肿瘤细胞周期的不同阶段来抑制肿瘤细胞的增殖。这些成分可以通过抑制磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)、磷酸化蛋白激酶B(protein kinase B,AKT)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路来诱导肿瘤细胞在G1期停滞;Yu等[20]发现苍术内酯I通过上调周期蛋白依赖性激酶抑制剂1A(cyclin-dependent kinase inhibitor 1A,p21)和下调cyclinB1、CDK1和细胞分裂周期25C蛋白(cell division cyclin25,Cdc25c)等关键分子来抑制肿瘤细胞在G2/M期的进入,在动物模型中,苍术内酯I可以显著抑制膀胱癌的生长,且无明显不良反应。Zhang等[21]实验发现苍术内酯Ⅱ可以通过改变结直肠癌细胞内的蛋白表达从而抑制结直肠癌细胞的增殖和活性,并且还显著增强了结直肠癌细胞的化疗敏感性。Pongsakorn等[22]发现,苍术提取物可以通过抑制细胞外信号调节激酶信号级联(ERK-signaling cascade,ERK)信号通路来抑制胆管癌细胞的增殖。ERK信号通路是一种重要的细胞内信号转导机制,参与调节细胞生长、分化和凋亡等过程。苍术提取物可以下调ERK及其下游分子的表达,从而抑制胆管癌细胞的生长和增殖,不同类型的胆管癌细胞对苍术提取物的敏感度不同,其中人胆管HuCCT-1癌细胞最为敏感。 2.2 诱导肿瘤细胞凋亡 细胞凋亡是一种程序性细胞死亡形式,它通过限制细胞的增殖和分化来维持组织稳态或去除潜在的有害细胞[23]。目前已知的细胞凋亡途径主要有3种,即外源性途径(死亡受体介导)、内源性途径(线粒体介导)和内质网途径。其中,线粒体途径是最重要的一种,它涉及线粒体外膜透化(outer mitochondrial membrane,MOMP)、细胞色素C释放和半胱天冬酶(cysteine aspartic acid protease,Caspase)激活[24]。多项研究发现,苍术酮可以通过降低线粒体膜电位、提高活性氧水平、抑制B细胞淋巴瘤-2基因(B-cell lymphoma-2,Bcl-2)表达、促进BCL2-相关X蛋白(BCL2-associated X protein,Bax)裂解和Caspase-3表达[25],以及下调PI3K/AKT/mTOR信号通路来诱导肿瘤细胞凋亡[26]。Narahara等[27]研究表明,β-桉叶醇和苍术内酯Ⅲ[27]可以通过增加Caspase-3、Caspase-8、Caspase-9和Bax等凋亡相关蛋白的表达、下调Bcl-2表达、释放细胞色素C和降低线粒体膜电位来诱导胆管癌细胞凋亡。此外,Li等[28]使用β-桉叶醇处理的白血病HL60细胞,发现β-桉叶醇可以通过激活c-JunN端激酶(c-Jun N-terminal kinase,JNK)丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路来诱导白血病HL60细胞凋亡。Li等[29]研究发现,苍术素可以通过降低Bcl-2表达、激活p53肿瘤蛋白(p53 tumor protein,p53)、Bax和Caspase-3、-8、-9等凋亡因子来诱导人乳腺癌MCF-7细胞凋亡,并表现出浓度依赖的毒性效应。Li等[30]研究表明,苍术内酯I和苍术内酯Ⅱ[31]可以通过与对两面针激酶2(Janus kinase 2,JAK2)直接相互作用而负调节信号传导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)磷酸化,从而抑制其活化,进而导致糖酵解的抑制和结肠、直肠癌细胞凋亡的诱导。 2.3 抑制肿瘤细胞转移 肿瘤细胞转移是指肿瘤细胞通过血液循环从原发部位转移到其他部位的过程,这是癌症治疗的难点,也是癌症死亡的主要原因[32]。上皮间质转化(epithelial-mesenchymal transition,EMT)是一种与癌症发生相关的细胞程序,它使癌细胞具有移动性、侵袭性和抗凋亡能力,从而促进转移。苍术的一些活性成分具有抑制肿瘤细胞转移的潜在作用,其机制可能涉及对EMT的调控[33]。Acharya等[34]研究发现,β-桉叶醇可以改变EMT相关标志物的表达,从而抑制结肠癌细胞的增殖、迁移和侵袭。同时它还可以影响PI3K、AKT、p38丝氨酸/苏氨酸蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)信号通路,以及肺癌细胞中的活性氧水平,从而降低癌细胞的黏附和迁移能力[35]。麦静愔等[36]发现苍术酮可以通过抑制EMT过程等途径抑制肿瘤细胞的迁移和侵袭能力,此外,苍术酮还可以通过下调基质金属蛋白酶(matrix metalloproteinase,MMP)的表达从而抑制肿瘤细胞的迁移和侵袭能力。MMP是一类能够降解细胞外基质(extracellular matrix,ECM)的锌依赖性内肽酶,在癌症进展中的作用与它们参与ECM降解以及黏附和细胞骨架蛋白、生长因子、趋化因子的调节和加工有关[37]。且有动物实验表明,苍术酮可以明显抑制肝癌生长,没有明显的毒性。Zhong等[38]在观察了苍术多糖在U-2 OS人骨肉瘤细胞中对内皮细胞选择素(endothelial cell selectin,E-Selectin)和路易斯X三糖(Lewis-X Trisaccharide,LacCer Lex)的影响,发现苍术多糖可通过降低U-2 OS细胞上的E-Selectin抑制U-2 OS细胞对人脐静脉内皮细胞HUVECs的黏附、迁移和侵袭。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)在促进肿瘤转移中发挥重要作用,Zhang等[39]发现苍术内酯II可以有效抑制肿瘤细胞极化,从而抑制肺癌细胞在体内和体外的转移。铁死亡是一种新的细胞死亡模式,其特征是铁过载导致脂质过氧化而导致膜损伤,过度的铁死亡会影响肿瘤的转移,从而抑制肿瘤的进展[40]。He等[41]发现,苍术素可通过抑制谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)和铁蛋白轻链(ferritin light chain,FTL)的表达,以及上调酰基辅酶A合成酶长链家族成员4(acyl-CoA synthetase long-chain family member 4,ACSL4)和转铁蛋白受体(transferrin receptor,TFR1)的表达来诱导肝癌HCCM细胞的铁死亡。 2.4 诱导肿瘤细胞自噬 细胞自噬是一种分解代谢通路,能清除不必要的或功能失调的细胞成分并回收代谢底物[42]。目前已知有3种主要的细胞死亡方式:细胞凋亡(Ⅰ型)、自噬性细胞死亡(Ⅱ型)和坏死(Ⅲ型)。自噬性细胞死亡是指自噬过程中产生的自噬体过多或过大,导致细胞质溶解和细胞死亡。自噬体是由双层膜包裹的囊泡,内含被降解的细胞器和蛋白质。微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)是自噬体形成的关键标志物,它以微管相关蛋白1A/1B-轻链3(microtubule-associated protein 1 light chain 3,LC3-I)和微管相关蛋白1轻链3的脂化形式(lipidated form of microtubule-associated protein 1 light chain 3,LC3-Ⅱ)2种形式存在,LC3-Ⅰ转化为LC3-Ⅱ是自噬体形成的必要步骤[43-44]。Li等[29]使用苍术素处理乳腺癌MCF-7细胞时发现,苍术素可以增加了LC3Ⅰ向其脂化形式的LC3Ⅱ的转化,并增加了苄氯素1(beclin-1,BECN1)的表达,下调了人乳腺癌MCF-7细胞中的p62蛋白(p62 protein,p62)表达,改变凋亡和自噬相关生物标志物。Acharya等[45]研究发现,苍术素通过调节PI3K、AKT、mTOR、p38MAPK信号通路的活性,可以诱导胆管癌HuCCT-1细胞发生自噬,并抑制其生长、迁移和侵袭,SB202190(p38MAPK诱导剂)和3-MA(p38MAPK抑制剂)分别显著增加和降低苍术素诱导的自噬速率。 2.5 抑制肿瘤血管生成 血管生成本身不会导致恶性肿瘤的形成,但可以为肿瘤的生长和转移提供条件。肿瘤在发展到一定阶段后,需要依赖新生血管来满足其对氧气和营养的增加的需求,以及排除代谢废物,因此,抑制血管生成是一种有效的抗肿瘤策略[46]。血红素加氧酶1(heme oxygenase 1,HO-1)是一种在肿瘤组织中高表达的酶,它可以促进肿瘤的血管生成和抗氧化应激,为肿瘤细胞提供生存优势。因此,抑制HO-1的表达或活性是治疗肿瘤的另一种有效策略之一。Mathema等[47]研究发现,苍术素可以抑制胆管癌CL6肿瘤细胞的集落形成和伤口愈合能力,其机制与抑制HO-1的表达、下调信号转导及转录激活蛋白1/3(signal transducer and activator of transcription 1/3,STAT1/3)和核因子κB(nuclear factor kappa-B,NF-κB)的信号通路有关。β-桉叶醇也具有抑制胆管癌细胞中HO-1的表达的能力,其机制与浓度依赖性地抑制STAT1/3和NF-κB信号通路有关[48]。β-桉叶醇还可以通过抑制生长因子信号通路中的环磷腺苷效应元件结合蛋白(cyclic-AMP response binding protein,CREB)激活来阻断血管生成,从而抑制肿瘤的发展[49]。Tsuneki等[50]有动物实验表明,β-桉叶醇可以通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)来刺激大鼠嗜铬细胞瘤细胞中的神经突生长,且β-桉叶醇还表现出了体外和体内的抗血管生成活性,其阻断了由碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)或血管内皮生长因子(vascular endothelial growth factor,VEGF)诱导的人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)中CREB蛋白的磷酸化,从而抑制bFGF刺激的HUVEC迁移和HUVEC在基质胶中的管形成。同时,它还能显著降低小鼠皮下植入的Matrigel栓塞和小鼠佐剂诱导的肉芽肿中的血管生成[51]。 2.6 免疫调节作用 随着肿瘤的发生和发展,或在接受化疗、放疗等治疗的过程中,肿瘤患者机体免疫力的显著下降。因此,调节或刺激机体免疫能力,可能是一种有效的主动抗癌策略。免疫治疗作为一种新型的抗癌手段,已经引起了广泛的关注和研究[52]。巨噬细胞是机体内重要的免疫细胞,在机体免疫中发挥着重要的作用[53]。Qin等[54]从苍术中分离得到两种多糖成分:中性多糖和酸性多糖。研究表明,酸性多糖能够显著地刺激小鼠单核巨噬细胞白血病细胞(RAW264.7)细胞的增殖、吞噬能力、NO产生和细胞因子分泌,并且呈现出剂量相关性,而中性多糖则相对较弱。此外,中性多糖和酸性多糖均能够激活淋巴结Peyers patch细胞中的T细胞,并促进集落刺激因子的产生。而酸性多糖也表现出比中性多糖更好的肠道免疫调节活性。吲哚胺-2,3-二氧化酶(indoleamine 2,3-dioxygenase,IDO)是一种通过犬嘌呤途径氧化分解色氨酸的限速酶,是抗肿瘤免疫治疗中小分子药物开发的潜在目标。IDO可在肿瘤微环境中通过与许多肿瘤相关的自发炎症和T细胞激活而被诱导。Liu等[55]研究发现,苍术内酯Ⅰ可以通过下调Toll样受体4/髓样分化蛋白2复合物(toll-like receptor 4/myeloid differentiation 2 complex,TLR4/MD-2)的表达,抑制人卵巢癌细胞(EOCSKOV3)中髓样分化主要反应蛋白88(myeloid differentiation primary response protein 88,MyD88)、NF-κB、Akt和IDO1的信号通路的活化,从而减少白细胞介素-6(interleukin-6,IL-6)、转化生长因子-β1(transforming growth factor beta 1,TGF-β1)、VEGF和白细胞介素-17A(interleukin-17A,IL-17A)等促进肿瘤免疫逃逸的因子的分泌。同时,还可以降低调节性T细胞(Treg细胞)在肿瘤微环境中的比例,改善T淋巴细胞受到EOCSKOV3细胞上清液抑制而导致的增殖反应降低和抗肿瘤细胞毒性减弱。Liu等[56]研究发现,苍术内酯Ⅲ可以通过直接结合JAK3蛋白,从而抑制γ-干扰素(interferon gamma,IFN-γ)触发的JAK3/STAT3通路,从而达到抑制IDO激活的目的。 苍术抗肿瘤成分的潜在分子机制见图2。对苍术抗肿瘤有效成分及其抗肿瘤作用进行归纳总结,见表2。 图片 图片 3 联合用药 西医治疗肿瘤的常用手段有手术切除、药物化疗和高能射线放疗等,这些手段去除肿瘤西医的治疗方式更为直接,适合前期控制病情,化疗药物虽然能够杀死肿瘤细胞,但同时也伴有严重的副作用,影响患者的生活质量和治疗效果。中药具有不良反应小、安全性高的特点,因此中药与化疗药物的联合应用被广泛关注和探索[57]。 阿帕替尼是全球第一个在晚期胃癌被证实安全有效的小分子抗血管生成靶向药物,也是晚期胃癌标准化疗失败后,明显延长生存期的单药。Zhou等[58] 分析了不同苍术多糖提取方法的影响。比较了热水浸提法、超声浸提法和酶浸提法提取苍术多糖的得率、总糖含量、相对分子质量分布、单糖组成、并测定苍术多糖与阿帕替尼的协同活性。结果发现其中超声浸提法表现出最强的协同作用。这也与超声浸提的苍术多糖相对分子质量小、β-构型高、半乳糖含量高的事实相一致。Srijiwangsa等[59]发现,β-桉叶醇可以通过抑制胆管癌细胞和细胞裂解物中的NAD(P)H醌氧化还原酶1[NAD(P)H quinonedehydrogenase 1,NQO1]的活性和蛋白表达,增强氟尿嘧啶和多柔比星对细胞迁移的细胞毒性活性和抑制活性。Mai等[60]将不同浓度的苍术内酯I、硼替佐米以及硼替佐米+苍术内酯I作用于U266细胞结果研究发现,苍术内酯可以调节JAK2/STAT3通路上的IL-6、JAK2、STAT3等基因表达抑制U266肿瘤细胞的增殖和促进其凋亡并呈剂量依赖性,并能与硼替佐米产生协同作用,当苍术内酯I与硼替佐米联合使用时,可显著增强对U266细胞增殖的抑制作用。 紫杉醇是第一个获得批准的草药衍生化疗药物[61]。并且作为一种已知的Toll受体4配体(toll-like receptor 4 ligand,TLR4),可激活TLR4/MyD88依赖性途径,该通路介导了上皮性卵巢癌的化学耐药性和肿瘤进展。苍术内酯I是一种新型TLR4拮抗剂,通过干扰紫杉醇与人白细胞膜TLR4的结合,来抑制TLR4信号传导。Huang等[62]研究发现苍术内酯-I可以减弱紫杉醇诱导的IL-6、VEGF和存活蛋白的蛋白表达,并增强MyD88(+)EOC人卵巢癌细胞的早期凋亡和生长抑制;苍术内酯I被发现更加亲和人髓样分化蛋白2(myeloid differentiation 2,MD-2)的疏水囊,并通过对接模拟与紫杉醇的结合位点部分重叠,这表明苍术内酯-I可能阻断MyD88(+)EOC细胞中MD-2介导的TLR4/MyD88依赖性紫杉醇信号传导。因此,苍术内酯-I可以通过阻断MD-2介导的TLR4/MyD88信号传导,显著提高MyD88(+)EOC细胞对紫杉醇的反应。 结缔组织生长因子(connective Tissue Growth Factor,CTGF)是一种多功能信号调节剂,可通过调节细胞增殖、迁移、侵袭、耐药性和EMT来促进癌症的发生、进展和转移。CTGF还参与大多数节点的肿瘤微环境,包括血管生成、炎症和肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)激活[63]。Wang等[64]研究发现,苍术内酯-I可以下调三阴性乳腺癌细胞中CTGF的表达和分泌。除了通过CTGF抑制三阴性乳腺癌细胞迁移外,苍术内酯-I还下调了成纤维细胞中CTGF的表达,降低了乳腺癌细胞将成纤维细胞转化为CAFs的能力,从而增加了三阴性乳腺癌细胞对紫杉醇的敏感性。在小鼠肿瘤模型中,发现苍术内酯-I治疗可以增强紫杉醇对肿瘤的化疗作用,减少肿瘤向肺和肝的转移。在用苍术内酯-I与紫杉醇联合治疗的小鼠中,源自接种肿瘤的原代培养的成纤维细胞表达相对较低水平的CAFs标志物。 研究表明了苍术内酯-I可以通过阻断CTGF表达和成纤维细胞活化来使三阴性乳腺癌细胞对紫杉醇敏感,还可以通过阻断MD-2介导的TLR4/MyD88信号传导,显著提高肿瘤细胞对紫杉醇的反应并。这些机制有助于未来研究以确定苍术内酯I在临床环境中的价值。对苍术化学成分联合治疗归纳总结,见表3。 图片 4 结语与展望 苍术中含有多种抗肿瘤成分,其中多为倍半萜类成分,如苍术酮、苍术素和苍术内酯等,这些成分多是通过调控PI3K/Akt/mTOR通路来发挥抗肿瘤的作用,但作用靶点与方式却各不相同。例如苍术内酯主要通过降低Akt的磷酸化水平、上调Bax和Bad蛋白表达、增加脂质磷酸酶(PTEN)活性来抑制该通路进而诱导肿瘤细胞凋亡[20];β-桉叶醇能通过激活p27抑制cyclinD1和CDK4蛋白表达最终导致细胞周期停滞于G1期[19]。这些成分通过多途径、多靶点影响肿瘤细胞的生存、运动、代谢和迁移进而共同发挥抗肿瘤作用。正因为其作用机制的不同,使其各有效成分对不同肿瘤的作用具有一定特异性。因此苍术抗肿瘤活性成分联合化疗药物减副增效在科学研究及临床用药时可根据其作用机制进行选择。目前关于苍术化合物对肿瘤细胞的研究还存在一些不足之处,如缺乏对不同肿瘤细胞类型和不同剂量的系统比较、缺乏对苍术化合物与其他药物或放化疗的协同作用的评价,以及缺乏对苍术化合物在体内代谢和药效学的深入分析等。 因此,今后还需要加强对苍术化合物抗肿瘤作用的基础和临床研究。后续可以根据苍术有效成分的抗肿瘤作用机制,筛选出具有最强抗肿瘤活性和最低毒性的化合物,作为候选药物进行进一步的优化和改造,提高其药效和安全性;分析苍术中有效成分的药代动力学特征,研究其在体内的吸收、分布、代谢和排泄等过程,确定其最佳的给药途径、剂量和方案,减少其不良反应和药物相互作用;根据苍术中有效成分的药效学特征,研究其对不同类型、分期和分子标志物的肿瘤细胞的作用差异,确定其最适合的治疗对象和指标,提高其个体化和精准化的治疗效果;根据苍术有效成分的协同增效或拮抗作用,探索其与其他抗癌药物或放化疗的联合应用,实现其对肿瘤细胞的多靶点、多途径和多机制的综合干预,增强其抗肿瘤效能和克服肿瘤耐药性,以期为开发新型的抗肿瘤药物提供更多的选择和可能性。 苍术与化疗药物的联合应用被广泛关注和探索。作为苍术的主要成分,现有研究已表明倍半萜类具有显著的抗肿瘤活性,其与化疗药物的联合临床用药有着巨大的潜力。但倍半萜类化合物分子结构中含有多个疏水基团,导致它们的极性较低,难以与水分子形成氢键或静电相互作用,在水中的溶解度小、生物利用度低。随着现代药物研究技术的现代化和多学科的交叉融合,这些问题也可以通过引入基团、采用纳米技术制备纳米载体、采用共晶技术制备倍半萜类化合物的共晶体等方式来提高其水溶性,进而增强其生物利用度。这些技术在药物化学领域已比较成熟,也已逐步应用于临床药物的开发。例如,抗疟活性药物青蒿素同样具有水溶性差应用困难的问题,通过引入羧酸基团,显著提高了其水溶性和生物利用度[65-66]; 此外,共晶体可以改变倍半萜类化合物的晶型和晶格参数,从而降低其结晶度和熔点,增加其自由能和溶解度[67]。苍术内酯也可通过与尼可替尼(一种具有较高水溶性的抗肿瘤药物)制备共晶体,可以显著提高其水溶性。因此,苍术抗肿瘤有效成分和化疗药物的联合用药在临床环境中的开发和应用具有很高的研究价值。 苍术作为中医临床常用的化湿药。其药性辛、苦、温,归脾、胃、肝经,其苦温燥湿,可以去湿浊、辛温健脾以和脾胃,多用
4月9日,沪上首台磁共振加速器在复旦大学附属肿瘤医院正式投入临床使用,这意味恶性肿瘤的精准放射治疗又新添了一把“利器”。该治疗系统治疗的肿瘤主要是头颈部肿瘤、乳腺癌、肝脏肿瘤、胰腺癌、胃、结直肠等,接下来,医院还将针对软组织肿瘤、食管癌、宫颈癌、前列腺癌等其它肿瘤开展治疗。此外,基于磁共振加速器的系列科学研究已经在持续开展中,包括基于MR-LINAC的一站式自适应放疗的临床应用、MR引导下直肠癌新辅助放化疗联合免疫治疗的前瞻性临床研究等。这是一种光子放疗新模式,其创新在于:加速器根据实时的核磁共振图像,精准区分患者肿瘤组织和周围器官,通过高精度放射线照射肿瘤组织,医生全程“透视”并追踪肿瘤形态变化、实时调整治疗策略。复旦大学附属肿瘤医院放射治疗中心主任章真教授说:“作为肿瘤治疗的主要手段之一,放射治疗也被誉为'隐形的手术刀’。其通过高能量的放射线照射肿瘤组织,实现杀灭肿瘤的效果。70%的肿瘤患者在整个治疗过程中需要接受放射治疗,放疗早已不是既往公众认知中的'姑息性疗法’。'精准放疗时代的到来,越来越多的新'武器’让放射治疗再上新台阶。”章真说,“将影像设备和加速器结合在一台设备上,让医生能够在放射治疗过程中可以实时观察肿瘤状态和周围组织的运动,无疑可以引导放射线更精准地照射肿瘤,最大程度上减少对正常组织的损伤,减少放射治疗的并发症。”据了解,此次投入临床使用的磁共振加速器,便是将磁共振和加速器融为一体。凭借高分辨率、无辐射的磁共振成像,实时显示患者肿瘤病灶的清晰边界,无疑为放射治疗医生增加了一双“透视眼”,能够全程监测肿瘤患者的病灶状态,进而引导放射线精准治疗。该中心副主任胡伟刚教授介绍,通过该设备的在线自适应放射治疗管理系统,医生还可以根据患者的实际情况,实时调整放射治疗计划,为患者提供个性化的精准放疗方案。[来源:复旦大学附属肿瘤医院][align=right][/align]
各国争相发展的重点项目 iPS技术,即诱导性多能干细胞技术,是一种将成体成熟、分化的体细胞重编程获得类似胚胎干细胞的新兴技术。2007年11月美国和日本科学家分别独立宣布可将人类皮肤细胞转化为iPS细胞。这一发现被《自然》和《科学》杂志分别评为2007年第一和第二大科学进展。之后,iPS细胞研究迅猛发展,不同的国家和实验室纷纷报道了多种方法建立的iPS细胞系。就连世界第一只体细胞克隆动物多利羊的培育者伊恩·威尔莫特也宣布放弃人类胚胎干细胞克隆研究,转而进行 iPS 细胞研究,因为他认为这种细胞比胚胎干细胞更具潜在优势。 我国连续多年将干细胞研究列入“863”、“973”、国家自然基金重点项目。国务院2006年发布的《国家中长期科学和技术发展规划纲要(2006-2020年)》中,干细胞作为五项生物技术之一成为未来15年我国前沿技术的重点研究领域。 致瘤风险浮出水面 Yamanaka研究组在《自然·生物技术》上发表的文章显示,用iPS细胞诱导的神经干细胞,即使不含c-Myc(曾被认为是导致肿瘤的主要原因),在植入NOD/SCID免疫缺陷小鼠后仍有很强的致瘤性,甚至高于胚胎干细胞。 他们共研究了36个iPS细胞克隆,在诱导方式上,有些诱导剂配方中含有c-Myc基因,有些没有,因此具有较好的代表性。同时他们选择了3株胚胎干细胞作为对照。在45周的观察中,移植胚胎干细胞来源神经干细胞的34只小鼠有4只长出肿瘤。在100只移植胚胎成纤维细胞来源的iPS神经干细胞小鼠中34只发现肿瘤,概率和胚胎干细胞相当。在55只移植成人成纤维细胞来源的iPS神经干细胞小鼠中46只发现肿瘤,概率远高于胚胎干细胞。在36只移植肝细胞来源的iPS神经干细胞小鼠中10只发现肿瘤,概率高于胚胎干细胞。8只移植胃上皮细胞来源的iPS神经干细胞小鼠中未发现肿瘤。病理学检查证实肿瘤均为畸胎瘤,部分为恶性畸胎瘤。 研究还发现,以前认为致瘤性很强的c-Myc在去掉后并没有减少iPS神经干细胞的致瘤性,相反以前认为没有致瘤性的Nanog基因却可以明显增强iPS神经干细胞的致瘤性。 这次试验的另一个意外结果是并未发现在生成的肿瘤细胞中有c-Myc或其他基因的激活。以前的观点认为,转入的癌基因是iPS致瘤性的基础,只要在iPS细胞诱导成功后通过各种方法去除已完成使命的癌基因即可使iPS细胞免于致瘤性。这次试验的结果无疑给这些想法留下了阴影,而且使iPS致瘤的机制更加扑朔迷离。
[align=center]抗肿瘤单克隆抗体药物的研究进展[/align][align=center] [/align][align=center]摘 要[/align][align=center] [/align] 通过淋巴细胞杂交瘤技术或基因工程技术制备单克隆抗体药物,已经成为生物制药领域的一个重要方面,特别是对抗肿瘤单克隆抗体药物的研究已获得了重要进展。多年来,许多研究证实了抗肿瘤单克隆抗体药物的作用,为其应用于肿瘤治疗提供了重要依据。这类药物的特异性强,疗效显著。本文主要就近年来抗肿瘤单克隆抗体药物的研究进展进行了综述,并对抗肿瘤单克隆抗体药物的发展前景进行了展望。[align=left] [/align][align=left]关键词:抗肿瘤;单克隆抗体;研究进展[/align][align=center] [/align][align=center] [/align][b]一 引言[/b]抗肿瘤单抗药物因与烷化剂、抗代谢药、抗肿瘤抗生素、铂类配合物、植物药等抗肿瘤药物相比,具有高效价、高特异性、血清交叉反应少等特点与优点,在肿瘤治疗中起着不可替代的作用。单抗药物是当前生物技术药物领域甚为活跃的部分。针对特定的分子靶点(抗原),单抗有高度特异性。针对各种不同的抗原,可以制备为数众多的、各不相同的单抗;因此,作为药物来源,单抗又具有高度多样性。由于其特异性和多样性,研制单抗药物有巨大的潜力。单克隆抗体药物治疗恶性瘤主要机制有两种[sup][/sup]:一是利用单克隆抗体本身来阻断癌细胞生长的信号,单克隆抗体在癌细胞膜外与生长因子竞争结合受体,阻断信号传递过程,从而阻止癌细胞的生长和扩散,诱导细胞凋亡或者间接激活宿主的抗肿瘤免疫反应;二是利用单克隆抗体作为药物载体的靶向治疗,如将有细胞毒性的药物或有放射性的药物靶向性的运送到肿瘤细胞,从而杀伤肿瘤细胞。目前,国际上与肿瘤治疗相关的抗体研究主要集中在将抗体与耦联物作用后直接杀伤肿瘤细胞,利用抗体促进肿瘤细胞凋亡和抑制肿瘤血管生成等方面。此外,研究表明静脉内注射抗肿瘤单抗,在肿瘤部位的浓度较高,显示特异性定位;单抗与药物的偶联物通常仍保留原来单抗的分布特征,在靶肿瘤的浓度较高[sup][/sup]。[align=center]二 单克隆抗体药物作用靶点[/align]特定受体或特定的基因表达蛋白可能作为单抗药物的靶点。Rituxan是以B细胞的CD20分子作为靶点的人鼠嵌合抗体,对非霍奇金氏B细胞淋巴瘤有疗效,是第一个获美国FDA批准用于治疗恶性肿瘤的单抗。Herceptin是抗HER-2/neu癌基因编码蛋白的单抗,临床研究对乳腺癌有效,与化疗药物联合有更显著的疗效。Mylotarg是由抗CD33单抗与calicheamicin构成的偶联物,已获批准用于治疗急性复发性髓性白血病[sup][/sup]。表皮细胞生长因子受体(EGFr)在人的鳞癌、乳腺癌和脑胶质瘤等均有较高的表达。有报道,抗EGFr单抗与长春碱衍生物的偶联物在裸鼠体内试验,显示良好的抗癌效果。抗EGFr的人鼠嵌合抗体已进入临床研究。血管内皮生长因子(VEGF)在血管生成中有重要作用。据报道,抗VEGF的中和性单抗具有广谱的抗肿瘤作用,对移植于裸鼠的人体癌瘤有显著疗效[sup][/sup]。[b]三 单抗诱发肿瘤细胞凋亡[/b][align=left] 3.1 通过免疫细胞表面抗原的交联作用而诱导恶性肿瘤细胞的凋亡[/align]用于治疗血液系统恶性肿瘤的单克隆抗体药物大多是通过免疫细胞表面抗原的交联作用诱导恶性肿瘤细胞凋亡而起作用的,如目前用的抗-CD20的单克隆抗体——美罗华。其单克隆抗体的作用机制是通过诱导CD20分子在B细胞膜上的脂筏区聚集,再在一系列激酶的作用下使脂筏信号传导区域的CD20分子亲和性增强,从而形成CD20交联形式;交联的CD20分子启动了细胞内凋亡信号的传导通路,使线粒体释放出细胞色素C,激活下游的caspase级联反应,最终导致细胞凋亡[sup][/sup]。3.2 作用于恶性肿瘤细胞膜上的生长因子及其受体而诱导细胞凋亡许多生长因子及其受体通过作用于细胞的存活途径、刺激细胞的有丝分裂、促进细胞的生长增殖来阻止细胞凋亡。与正常细胞中生长因子信号传导的严格调控相比,肿瘤细胞中的失控则导致细胞的恶性增殖,从而使恶性细胞获得“永生”。单克隆抗体通过作用于恶性肿瘤细胞膜上的生长因子及其受体可阻断存活信号传导通路,从而导致其凋亡,同时还能对化疗和放疗有正协同作用。目前主要集中在对血管内皮生长因子(VEGF)及其受体、表皮生长因子受体(EGFR)等的研究。美国FDA于2006年批准了第一个用于治疗头颈部鳞状细胞癌的单克隆抗体药物——Cetuximab,它为一种IgG1单克隆抗体,主要通过干扰癌细胞表面EGFR的生长,从而减少癌细胞进入正常组织的概率,控制癌细胞的转移,达到抗癌目的[sup][/sup]。最初想到制备针对恶性肿瘤凋亡相关分子的单克隆抗体药物时,虽然从理论上来说无疑是给人们注入了一针兴奋剂,但在实际应用中则并不然,所以在通过单克隆抗体药物诱导恶性肿瘤细胞凋亡的研究和治疗中,还有待进一步开发新的、更经济、更有效地药物。[b]四 单克隆抗体耦联物[/b]4.1 抗体与化疗药物耦联目前,国内外研究较多的与单克隆抗体耦联的化学药物有平阳霉素、柔红霉素、丝裂霉素、多柔比星(阿霉素)、顺铂以及长春碱类衍生物等。同时还可以通过脂质体靶向制剂作为化疗药靶向治疗肿瘤,利用脂质体制剂将药物导向靶标进行有选择性地杀伤癌细胞和抑制癌细胞的繁殖,以达到提高疗效和高度定向作用。目前已上市的脂质体有复方氟脲嘧多相脂质体、喜树碱多相脂质体、阿霉素脂质体和紫杉醇脂质体等。4.2 抗体导向酶耦联利用抗体与肿瘤细胞表面抗原的特异性结合,将前体药物的专一性活化酶与单抗耦联,导向输入到靶细胞部分,再注入前体药物,使其在酶的作用下转化为活性药物,进而杀伤肿瘤细胞[sup][/sup]。目前这种用作前体药物的抗癌药有苦杏仁苷、氮芥、鬼臼乙叉苷、阿霉素、丝裂霉素等。而作为活化前体药物的导向酶有碱性磷酸酶、青霉素V或G酰胺酶、羧基酶肽、胸腺嘧啶核苷酶、β葡萄苷酶等。临床研究表明,单抗耦联物对于抗药性肿瘤细胞仍显示较强的杀伤活性。对由于长期使用氨甲蝶呤而出现抗药性的成骨肉瘤细胞,单抗氨甲蝶呤耦联物仍显示较强的杀伤作用。对于具有多药抗药性(MDR)的肿瘤细胞,抗P-170糖蛋白单抗构成的免疫毒素可显示选择性杀伤作用[sup][/sup]。这说明,单抗药物有可能用于克服肿瘤细胞抗药性。[b]五 单克隆抗体靶向药物[/b]单抗靶向药物是利用单抗对肿瘤表面相关抗原或特定的受体特异性识别,从而把药物直接导向肿瘤细胞,提高药物的疗效,降低药物对循环系统及其他部位的毒性。研究表明,单抗靶向药物具有很好的疗效,在免疫偶联物对移植于裸鼠的相应人体肿瘤生长有抑制作用。免疫偶联物与相应的游离物比较,具有更高更好的疗效和较低的细胞毒性[sup][/sup]。单克隆抗体体积小,能更有效地透入肿瘤;分子小、消除快、累积毒性小;所携带的弹头脱离后,可较快被清除 循环中免疫靶向结合物对靶细胞的竞争作用小;半衰期短;穿透性好;能穿过血脑屏障[sup][/sup],因而还可以作为新一代靶向载体。与化学药物、毒素、放射性核素、生物因子、基因、分化诱导剂、光敏剂、酶等物质构成单克隆抗体靶向药物,把杀伤肿瘤细胞的活性物质特异的输送到肿瘤部位,利用单抗对肿瘤表面相关抗原或特定的受体特异性识别,从而把药物直接导向肿瘤细胞,提高药物疗效,降低药物对循环系统及其他部位的毒性。近年来,随着医学、药学和生物工程学及技术的进步,临床对肿瘤的根治和对癌细胞的攻击锁定于表皮生长因子和血管内皮生长因子等靶位,使药物治疗的切入点由细胞水平提升到分子和抗体水平,从而提高了肿瘤综合治疗的效果。[align=center]六 人源化单克隆抗体[/align]单克隆抗体是近年竞相开发的品种,自1997年第1个单克隆抗体rituximab通过食品与药物管理局(FDA)批准应用于临床以来,目前已经上市的单克隆抗体靶向药物的疗效令人瞩目,在抗肿瘤、类风湿性关节炎和自身免疫系统缺陷治疗领域得到了有力的推广,其以独特的作用优势,在肿瘤的治疗中不但能够选择性杀伤癌细胞,且在体内表现出特异的分布特性,具有高效、低毒的特点,从而在生物技术产品领域中占据了1/3的市场[sup][/sup]。目前用于治疗肿瘤的单克隆抗体药已有多个,包括伊珠单抗奥加米星、帕尼单抗、曲妥珠单抗等。伊珠单抗奥加米星又名CMC-544,是以人源化抗CD22的抗体伊珠单抗与 CalichDMH偶联形成的ADC药物,用来治疗复发性或难治性B细胞非霍奇金淋巴瘤(B cell-NHL)和急性淋巴细胞白血病(ALL),目前已经进入临床 III期试验[sup][/sup]。帕尼单抗是一种IgG2单克隆抗体完全人源化可以与EGFR高度特异性地结合,进而阻断配体诱导的信号激活,从而抑制肿瘤生长。有临床研究选择既往未治疗过的ⅢB或Ⅳ期非小细胞肺癌患者比较卡铂(AUC=6,每3周),加紫杉醇(200mg/m21次/3周) 联合或不联合帕尼单抗(2.5 mg/m2,1次/周) 化疗的疗效及其安全性。研究结果显示,单纯化疗组与帕尼单抗联合化疗组之间在PFS(5.3个月对比4.2个月、P=0.55)和总生存( Overall survival,OS)(8.0个月对比8.5个月,P =0.81)上均无显著差异。结果提示帕尼单抗联合一线化疗方案可能对晚期非小细胞肺癌无明显疗效[sup][/sup]。曲妥珠单抗是一种抗Her2的单克隆抗体,他可以和肿瘤细胞的HER2/neu特异性地结合,从而阻断细胞内生长信号的转导,同时曲妥珠单抗还可以诱导体内巨噬细胞以及自然杀伤细胞攻击肿瘤细胞,以达到抑制和杀伤肿瘤细胞的目的。比较用或不用曲妥珠单抗联合一线化疗方案用以治疗ⅡB/Ⅲ期HER2/neu阳性的 NSCLC患者差异的两项大型的随机Ⅱ期临床试验,其结果显示两个试验结论相似,曲妥珠单抗不能提高化疗的疗效,但也不加重化疗的不良反应。试验中HER2/neu值为3+的患者对曲妥珠单抗治疗的反应性较好,提示曲妥珠单抗对这一较少见类型的NSCLC效果要更好[sup][/sup]。在临床治疗中使用鼠派生单抗的主要障碍之一是产生人抗鼠抗体(HAMA)反应,通过基因工程技术制备嵌合抗体的I-IPdVIA反应率较鼠源性单抗低,但完全的人源抗体才是单抗药物的发展目标。噬茵体抗体库技术和转基因小鼠技术是制备完全人源单抗的两种方法[sup][/sup]。因此,只有不断地完善单克隆抗体人源化的技术,才能更好地将完全人源化的单克隆抗体用于肿瘤分子靶向治疗中,从而使医学界迈向更高的台阶。[b]七 问题与对策[/b]在限制单克隆抗体临床治疗效果的因素有:(l)循环免疫复合物导致的肝肾功能损害。(2)可溶性肿瘤抗原释放造成的体液中的封闭作用。(3)异种蛋白反应。(4)特异性还不够专一,引起了正常细胞的伤害。(5)天然免疫功能低下(如补体介异的细胞毒,网状内皮系统清除和ADCC作用等)。(6)主要的问题还在这种免疫疗法会导致靶细胞(肿瘤细胞)上抗原的转换。为了解决这些问题,今后的研究应着重:(1)制备对肿瘤抗原有高度特异性的单克隆抗体。(2)选择不易诱导抗原转换的单克隆抗体。(3)研究副作用较少,既安全疗效又高的偶联制剂。单抗(Mab)药物存在的一个最关键问题就是人抗鼠抗体反应(HAMA)。由于用于临床研究的Mab药物一般使用鼠源Mab,这不可避免地会引起HAMA反应,所以尽量避免HAMA反应这一副作用才是Mab药物能否真正适合治疗肿瘤性疾病的重点[sup][/sup]。近些年来,Mab药物的研究主要是向减轻宿主对外源抗体的排斥,促进抗体人源化,改变抗体的氨基酸序列而增加或降低该抗体的生物学效应,加抗体的亲和力,制备双特异性抗体,改造抗体重链恒定区以增强抗体功能,以及寻找新的分子靶点(相对特异的肿瘤抗原)等方向发展[sup][/sup]。Mab药物的不断更新,必将为全球的肿瘤患者带来更大的希望。[align=center]八 总结与展望[/align]目前肿瘤治疗中使用最广泛的仍是化疗以及放射性疗法,其毒副作用较大。随着基因工程技术和DNA重组技术的兴起,利用单克隆抗体治疗肿瘤已经日渐取代副作用较大的传统疗法而成为新的发展趋向。所以,如何研制更多的单克隆抗体以及怎样更好的利用单克隆抗体治疗肿瘤,将成为肿瘤治疗研究中的又一艰巨任务。同时,生物技术以及抗肿瘤化学药物的发展也必将推动单抗药物的发展与进步,单克隆抗体药物将在各种肿瘤的治疗中发挥越来越重要的作用。在未来10年内,单克隆抗体药将成为国内、外生物药品发展的主旋律。此外,利用与肿瘤细胞相关抗原的特异结合力,相应的单克隆抗体可以用于肿瘤早期诊断和预后判定。例如用放射标记抗体能够确定肿瘤存在的位置,扩散的部位和范围,以便确定手术时机和化疗方案。通过测定抗体结合白血病细胞的增减,可以检查白血病的化疗效果[sup][/sup]。利用单克隆抗体检测某些癌的特异性产物,如前列腺癌产生的酸性磷酸酶,绒毛膜上皮癌产生的促性腺激素,结肠癌产生的癌胚抗原及肝癌产生的甲胎蛋白等,有助于癌肿的早期诊断[sup][/sup]。单克隆抗体在肿瘤的治疗中的作用功不可没,但同时也面临着巨大的挑战,例如如何选择优势人群、进一步提高疗效、降低不良反应的发生都是需要进一步解决的。如贝伐单抗的突出不良反应是出血,在NCCN指南中特别指出贝伐单抗仅适用非鳞癌的[sup][/sup],既往无咯血史的患者,限制了贝伐单抗的临床应用。而其他大部分单克隆抗体均需与其他化疗药物联用,单独应用的疗效仍有限,选择合适的指标以及合适人群应用单克隆抗体仍任重而道远。[b]参考文献[/b] Adams GP, Weiner LM.Monoclonalantibody therapy of cancer .Nat Biotechnol,2005,23(9):1147~1148 甄永苏.抗肿瘤抗生素和单克隆抗体药物的研究进展.中国抗生素杂志,2002,27(1):1~5 Sievers E L, Larson R A, Stadtmauer E A, [i]et al[/i].Effica-cy and safety ofgemtuzumab ozogamicin in patients withCD33-positive acute myeloid leukemia infirst relapse .Clin Oncol,2001,19(21):3244~3246 Kamiya K, Konno H, Tanaka T, [i]et al[/i].Antitumor effect on humangastric cancer and induction of apoptosis by vascular endothelial growth factorneutralizing antibody .Jpn J Cancer Res,1999,4(21):794~798 邹学,李俊,尹庆春.单克隆抗体药物诱发肿瘤细胞凋亡的研究进展.总装备部医学学报,2008,10(2):115~117 Rao AV, Schmader K.Monoclonalantibodies as targeted therapy in hematologic malignancies in older adults .Am J GeriatrPharmacother,2007,5(3):247~250 杨海东,罗傲雪,范益军.单克隆抗体在治疗肿瘤中的研究进展.时珍国医国药,2007,18(11):2685~2686 甄红英,薛玉川,甄永苏.抗肿瘤抗生素C1027抑制血管生成及其抗肿瘤转移作用.中华医学杂志,1997,77(21):657~660 刘霆.抗肿瘤单克隆抗体靶向药物的研究进展.国外医学生理、病理科学与临床分册,2003,23(3):254~257 Plw a JL,Britta E,Jayne L,[i]et al[/i].Targeting rat anti-mouse transferrinreceptor monoclonal antibody through blood-brain barrier in mouse .pharmacology andexperiment therapeu-ties,2000,4(21):1048~1057 刘德忠,张石革.分子和抗体靶向抗肿瘤药的研究进展.中国药房,2007,18(26):2067~2068 丰雪,龙亚一,廖翰.抗肿瘤抗体-药物偶联物的临床研究进展.现代生物医学进展,2013,16(21):3164~3168 江山,杨小琼.晚期非小细胞肺癌单克隆抗体治疗的研究进展.吉林医学,2013,34(35):7482~7483 SpicerJ,Harper P.Targetedtherapies for non-small cell lung cancer .In t J C l in Pract,2005,59(9):1055~1057 彭建柳,杨丽华.人源化单克隆抗体用于肿瘤分子靶向治疗的研究进展.现代医院,2009,9(5):8~11 王飞,董军,黄强等.转基因完全人抗体的制备及其抗肿瘤作用研究.中华神经外科疾病研究杂志,2002,1(1):90~91 Kim J A.Targeted therapies for thetreatment of cancer .Am J Surg,2003,186(9):264~269 侯盛,郭亚军.单克隆抗体在肿瘤治疗中的应用.中国处方药,2007,4(61):53~56 清水惠司.抗肿瘤用药的应用及进展.临床免疫,2009,13(11):912~915 沈倍奋.抗体药物研究进展.第二军医大学学报,2002,23(10):1047~1049
Cancer Res.:敲除NLRP3蛋白可使肿瘤对治疗性癌症疫苗的反应增强四倍上世纪90年代初,加利福尼亚州斯坦福大学医学院的免疫学家埃德加?恩格尔曼宣布他发现了一种疫苗,能利用人体的免疫细胞来治疗癌症,并表示在几年内他将开发出可以投入使用的癌症疫苗。自此后,癌症疫苗作为一种新的癌症治疗策略一度燃起了癌症患者及其家庭对于疾病治疗的希望。然而,在过去的20年癌症疫苗的发展之路却并未能如人们当初希望那样顺畅。其中的一个巨大挑战就是科学家们尚无法找到既可终止癌症生长又不会抑制免疫系统的细胞靶点。近日来自北卡罗来纳大学Lineberger综合癌症中心的科学家们称他们的实验发现有希望能够提高癌症疫苗的疗效。研究人员证实敲除NLRP3蛋白可使肿瘤对治疗性癌症疫苗的反应增强四倍。相关论文发表在2010年12月15日的Cancer Research杂志上。论文的作者Jonathan Serody说:“这一研究结果表明NLRP3在疫苗的开发中可起到意想不到的作用,为我们提供了一个有潜力的药物靶点提高疫苗的效力。”该研究工作由北卡罗来纳大学Lineberger免疫学计划的两位负责人:肿瘤免疫学专家Serod博士和NLR蛋白家族研究领域的先驱Jenny Ting共同领导。Serody是北卡罗来纳大学血液学和肿瘤学系的教授。Ting是北卡罗来纳大学微生物学和免疫学系教授、炎症研究中心的负责人。研究人员证实敲除NLRP3蛋白可抑制肿瘤相关的髓样抑制细胞的作用,使得达到肿瘤生长位点的髓样抑制细胞降低了五倍。在过去的研究中Serody和同事们曾证实这些骨髓细胞在肿瘤逃逸免疫反应中发挥了极其重要的作用。新研究发现是第一次将髓样抑制细胞、NLRP3蛋白与癌症疫苗反应联系起来。Serody说:“我们本以为NLRP3蛋白失活会降低免疫系统对癌症的反应能力。过去的研究表明NLRP3在抗肿瘤免疫应答中发挥着决定性的作用。然而我们的研究发现当这些蛋白失活时,癌症疫苗会变得更为有效。这是因为NLRP3蛋白失活使得髓样抑制细胞无法到达肿瘤位点促进肿瘤生长和降低疫苗的效力。”尽管研究人员一直致力于开发出有效的癌症疫苗,但是到目前为止只有Dendreon公司研发的Provenge被美国FDA批准成为首个上市的治疗性疫苗,主要针对晚期前列腺癌患者。Provenge被证实能够将患者的生存期延长3-4个月。
[size=16px][color=#ff0000][b][url=https://www.instrument.com.cn/job/position-78730.html]立即投递该职位[/url][/b][/color][/size][b]职位名称:[/b]现场应用科学家(细胞/免疫/肿瘤/NGS))[b]职位描述/要求:[/b]职责描述:1、熟悉所负责的产品知识、应用和操作。2、负责售前/售后技术支持,进行产品宣讲、组织实验演示等相关产品技术工作。3、负责制作产品相关销售、市场与应用支持等相关工具材料。4、收集產品讯息,制定所负责产品的应用推广策略。5、收集和反馈市场信息,与销售部同事形成团队力量开发潜在客户。6、拟定产品培训计划,支持所负责产品的内部与外部培训课程。任职要求:1、硕士及以上学历;生物技术相关专业,欢迎应届毕业对前沿生物技行业有兴趣,愿意接受公司专业培训者。2、具备NGS或分子?生物学相关实验经验者优先。3、英语六级及以上,能熟练阅读英文原版技术资料,能与外国专家进行行文书与口语沟通。4、有良好的宣讲和人际交流能?力力,乐于跟客户沟通和保持良好关系。5、有良好的团队协作精神,主动学习的态度并乐于接受挑战。6、能接受出差并有较强的抗压性。#福利待遇#13薪+奖金带薪年假+带薪病假餐费补贴通讯补贴年度体检生日礼物节日津贴年度旅游[b]公司介绍:[/b] 上海同腾生物科技有限公司成立于2018年初,公司骨干团队由在科学仪器行业外企服务多年,拥有丰富行业经验的成员组成,目前公司拥有近30名员工,公司立足华东,辐射全国:为以上海、江苏、浙江等地为主的华东的生物制药、生命科学客户提供完备的实验室及工艺开发解决方案;同时依托部分全国总代产品和自主品牌产品为全国各地客户提供高质量和高性价比的产品。www.ttbiotech.com (同腾生物) www.tt...[url=https://www.instrument.com.cn/job/position-78730.html]查看全部[/url][align=center][img=,178,176]https://ng1.17img.cn/bbsfiles/images/2021/08/202108160948175602_3528_5026484_3.png!w178x176.jpg[/img][/align][align=center]扫描二维码,关注[b][color=#ff0000]“仪职派”[/color][/b]公众号[/align][align=center][b]即可获取高薪职位[/b][/align]
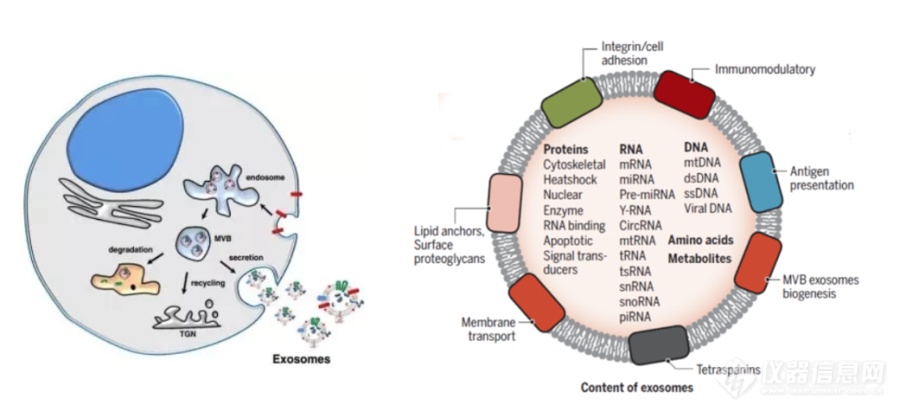
[align=center][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体[/size][/font][font='times new roman'][size=16px]富集及在肿瘤诊断中的作用[/size][/font][/align]外泌体是直径30-200 nm,由细胞内陷产生的具有磷脂双分子层结构的细胞外小囊泡,是细胞间通讯的重要介质。此外,由于其易于获取、高度稳定且在体液中广泛分布,外泌体已成为液体活检中最有前途的生物标志物[font='宋体']。[/font][align=left][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的生发与分布[/size][/font][/align]外泌体是具有磷脂双分子层结构的细胞外小囊泡,它携带原始母细胞重要的物质信息,能够反应原始细胞的一些重要信息。随着研究的深入,已有研究证实外泌体是通过细胞内陷产生的胞外囊泡,如图1-1所示,它是起源于细胞内吞系统中的多囊泡内体,通过出芽、内陷、多泡体形成和分泌等形成的一种具有磷脂双分子层结构的小泡,形态呈球形、扁形或杯状小体,直径为30-200 nm。此外,外泌体的分布非常广泛,几乎分布在所有的体液中,如血液,尿液,乳汁,汗液等。携带活性生物分子(蛋白质、核酸和脂质等)和他们的母细胞有相似的特征,这可能适用于正常细胞和病理细胞的鉴别。特别是,外泌体膜蛋白的水平与癌症的动态密切相关,从而为癌症诊断和治疗提供了新的机会预后。[img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310171529195086_7813_6197418_3.png[/img][align=center][font='黑体'][size=14px]图1.[/size][/font][font='黑体'][size=14px]1 外[/size][/font][font='黑体'][size=14px]泌[/size][/font][font='黑体'][size=14px]体的生发与组成[/size][/font][/align][align=left][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的通讯作用[/size][/font][/align]外泌体含有多种生物活性物质,这些被包裹的生物大分子可以在靶细胞中发挥一系列作用,是细胞间接通讯的重要媒介。外泌体与靶细胞间的信息传递主要通过三条途径实现:受体-配体相互作用;质膜直接融合;吞噬作用内吞。外泌体的生物学功能包括物质传递、信息交流、细胞增殖分化、血管生成、免疫调节等,在肿瘤发生发展、侵袭、转移、预后等过程中起重要的调控作用。肿瘤细胞较正常细胞分泌更多的外泌体,来源母细胞不同,所分泌的外泌体量与成分也不同。其次,由于其具有磷脂双分子层结构,生物学相对稳定,难于降解。外泌体的一个关键功能是将其内含物从供体细胞转运到受体细胞,使受体细胞的基因和表型修饰[font='宋体']。[/font][align=left][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体的富集方法[/size][/font][/align]由于外泌体丰度相对较低且大分子干扰,高质量外泌体的分离仍然具有挑战性。基于不同的分离机制,已经提了各种分离方法。作为金标准的超速离心法在外泌体的分离中使用最广泛。其他策略,如免疫亲和的富集方法,微流控芯片等,这些方法大多依赖于抗体和适配体。分离的外泌体的质量和纯度受限于外泌体表面抗原等活性分子的缺失,失活和降解,并且不适合大规模捕获应用。[align=left][font='times new roman'][size=16px]外[/size][/font][font='times new roman'][size=16px]泌[/size][/font][font='times new roman'][size=16px]体与肿瘤[/size][/font][/align]肿瘤发病机制复杂,早期诊断困难,病程进展快,是严重威胁人类生命和社会发展的重大公共卫生问题。外泌体是由细胞分泌产生的纳米级囊泡,在肿瘤的发生发展、诊断和治疗方面发挥着重要作用。外泌体携带多种肿瘤相关因子,可以作为治疗靶点。外泌体以其天然的物质转运特性、相对较小的分子结构、优良的生物相容性及免疫原性低可避免被单核吞噬系统吞噬,可作为优良的药物载体,允许它们穿过生理病理屏障将其携带的物质递送到下面的组织。基于这些特性,越来越多的人关注外泌体在疾病特别是靶向治疗领域的研究[font='宋体']。[/font]
[align=center]抗肿瘤单克隆抗体药物的研究进展[/align][align=center] [/align][align=center]摘 要[/align][align=center] [/align] 通过淋巴细胞杂交瘤技术或基因工程技术制备单克隆抗体药物,已经成为生物制药领域的一个重要方面,特别是对抗肿瘤单克隆抗体药物的研究已获得了重要进展。多年来,许多研究证实了抗肿瘤单克隆抗体药物的作用,为其应用于肿瘤治疗提供了重要依据。这类药物的特异性强,疗效显著。本文主要就近年来抗肿瘤单克隆抗体药物的研究进展进行了综述,并对抗肿瘤单克隆抗体药物的发展前景进行了展望。[align=left] [/align][align=left]关键词:抗肿瘤;单克隆抗体;研究进展[/align][align=center] [/align][align=center] [/align][b]一 引言[/b]抗肿瘤单抗药物因与烷化剂、抗代谢药、抗肿瘤抗生素、铂类配合物、植物药等抗肿瘤药物相比,具有高效价、高特异性、血清交叉反应少等特点与优点,在肿瘤治疗中起着不可替代的作用。单抗药物是当前生物技术药物领域甚为活跃的部分。针对特定的分子靶点(抗原),单抗有高度特异性。针对各种不同的抗原,可以制备为数众多的、各不相同的单抗;因此,作为药物来源,单抗又具有高度多样性。由于其特异性和多样性,研制单抗药物有巨大的潜力。单克隆抗体药物治疗恶性瘤主要机制有两种[sup][/sup]:一是利用单克隆抗体本身来阻断癌细胞生长的信号,单克隆抗体在癌细胞膜外与生长因子竞争结合受体,阻断信号传递过程,从而阻止癌细胞的生长和扩散,诱导细胞凋亡或者间接激活宿主的抗肿瘤免疫反应;二是利用单克隆抗体作为药物载体的靶向治疗,如将有细胞毒性的药物或有放射性的药物靶向性的运送到肿瘤细胞,从而杀伤肿瘤细胞。目前,国际上与肿瘤治疗相关的抗体研究主要集中在将抗体与耦联物作用后直接杀伤肿瘤细胞,利用抗体促进肿瘤细胞凋亡和抑制肿瘤血管生成等方面。此外,研究表明静脉内注射抗肿瘤单抗,在肿瘤部位的浓度较高,显示特异性定位;单抗与药物的偶联物通常仍保留原来单抗的分布特征,在靶肿瘤的浓度较高[sup][/sup]。[align=center]二 单克隆抗体药物作用靶点[/align]特定受体或特定的基因表达蛋白可能作为单抗药物的靶点。Rituxan是以B细胞的CD20分子作为靶点的人鼠嵌合抗体,对非霍奇金氏B细胞淋巴瘤有疗效,是第一个获美国FDA批准用于治疗恶性肿瘤的单抗。Herceptin是抗HER-2/neu癌基因编码蛋白的单抗,临床研究对乳腺癌有效,与化疗药物联合有更显著的疗效。Mylotarg是由抗CD33单抗与calicheamicin构成的偶联物,已获批准用于治疗急性复发性髓性白血病[sup][/sup]。表皮细胞生长因子受体(EGFr)在人的鳞癌、乳腺癌和脑胶质瘤等均有较高的表达。有报道,抗EGFr单抗与长春碱衍生物的偶联物在裸鼠体内试验,显示良好的抗癌效果。抗EGFr的人鼠嵌合抗体已进入临床研究。血管内皮生长因子(VEGF)在血管生成中有重要作用。据报道,抗VEGF的中和性单抗具有广谱的抗肿瘤作用,对移植于裸鼠的人体癌瘤有显著疗效[sup][/sup]。[b]三 单抗诱发肿瘤细胞凋亡[/b][align=left] 3.1 通过免疫细胞表面抗原的交联作用而诱导恶性肿瘤细胞的凋亡[/align]用于治疗血液系统恶性肿瘤的单克隆抗体药物大多是通过免疫细胞表面抗原的交联作用诱导恶性肿瘤细胞凋亡而起作用的,如目前用的抗-CD20的单克隆抗体——美罗华。其单克隆抗体的作用机制是通过诱导CD20分子在B细胞膜上的脂筏区聚集,再在一系列激酶的作用下使脂筏信号传导区域的CD20分子亲和性增强,从而形成CD20交联形式;交联的CD20分子启动了细胞内凋亡信号的传导通路,使线粒体释放出细胞色素C,激活下游的caspase级联反应,最终导致细胞凋亡[sup][/sup]。3.2 作用于恶性肿瘤细胞膜上的生长因子及其受体而诱导细胞凋亡许多生长因子及其受体通过作用于细胞的存活途径、刺激细胞的有丝分裂、促进细胞的生长增殖来阻止细胞凋亡。与正常细胞中生长因子信号传导的严格调控相比,肿瘤细胞中的失控则导致细胞的恶性增殖,从而使恶性细胞获得“永生”。单克隆抗体通过作用于恶性肿瘤细胞膜上的生长因子及其受体可阻断存活信号传导通路,从而导致其凋亡,同时还能对化疗和放疗有正协同作用。目前主要集中在对血管内皮生长因子(VEGF)及其受体、表皮生长因子受体(EGFR)等的研究。美国FDA于2006年批准了第一个用于治疗头颈部鳞状细胞癌的单克隆抗体药物——Cetuximab,它为一种IgG1单克隆抗体,主要通过干扰癌细胞表面EGFR的生长,从而减少癌细胞进入正常组织的概率,控制癌细胞的转移,达到抗癌目的[sup][/sup]。最初想到制备针对恶性肿瘤凋亡相关分子的单克隆抗体药物时,虽然从理论上来说无疑是给人们注入了一针兴奋剂,但在实际应用中则并不然,所以在通过单克隆抗体药物诱导恶性肿瘤细胞凋亡的研究和治疗中,还有待进一步开发新的、更经济、更有效地药物。[b]四 单克隆抗体耦联物[/b]4.1 抗体与化疗药物耦联目前,国内外研究较多的与单克隆抗体耦联的化学药物有平阳霉素、柔红霉素、丝裂霉素、多柔比星(阿霉素)、顺铂以及长春碱类衍生物等。同时还可以通过脂质体靶向制剂作为化疗药靶向治疗肿瘤,利用脂质体制剂将药物导向靶标进行有选择性地杀伤癌细胞和抑制癌细胞的繁殖,以达到提高疗效和高度定向作用。目前已上市的脂质体有复方氟脲嘧多相脂质体、喜树碱多相脂质体、阿霉素脂质体和紫杉醇脂质体等。4.2 抗体导向酶耦联利用抗体与肿瘤细胞表面抗原的特异性结合,将前体药物的专一性活化酶与单抗耦联,导向输入到靶细胞部分,再注入前体药物,使其在酶的作用下转化为活性药物,进而杀伤肿瘤细胞[sup][/sup]。目前这种用作前体药物的抗癌药有苦杏仁苷、氮芥、鬼臼乙叉苷、阿霉素、丝裂霉素等。而作为活化前体药物的导向酶有碱性磷酸酶、青霉素V或G酰胺酶、羧基酶肽、胸腺嘧啶核苷酶、β葡萄苷酶等。临床研究表明,单抗耦联物对于抗药性肿瘤细胞仍显示较强的杀伤活性。对由于长期使用氨甲蝶呤而出现抗药性的成骨肉瘤细胞,单抗氨甲蝶呤耦联物仍显示较强的杀伤作用。对于具有多药抗药性(MDR)的肿瘤细胞,抗P-170糖蛋白单抗构成的免疫毒素可显示选择性杀伤作用[sup][/sup]。这说明,单抗药物有可能用于克服肿瘤细胞抗药性。[b]五 单克隆抗体靶向药物[/b]单抗靶向药物是利用单抗对肿瘤表面相关抗原或特定的受体特异性识别,从而把药物直接导向肿瘤细胞,提高药物的疗效,降低药物对循环系统及其他部位的毒性。研究表明,单抗靶向药物具有很好的疗效,在免疫偶联物对移植于裸鼠的相应人体肿瘤生长有抑制作用。免疫偶联物与相应的游离物比较,具有更高更好的疗效和较低的细胞毒性[sup][/sup]。单克隆抗体体积小,能更有效地透入肿瘤;分子小、消除快、累积毒性小;所携带的弹头脱离后,可较快被清除 循环中免疫靶向结合物对靶细胞的竞争作用小;半衰期短;穿透性好;能穿过血脑屏障[sup][/sup],因而还可以作为新一代靶向载体。与化学药物、毒素、放射性核素、生物因子、基因、分化诱导剂、光敏剂、酶等物质构成单克隆抗体靶向药物,把杀伤肿瘤细胞的活性物质特异的输送到肿瘤部位,利用单抗对肿瘤表面相关抗原或特定的受体特异性识别,从而把药物直接导向肿瘤细胞,提高药物疗效,降低药物对循环系统及其他部位的毒性。近年来,随着医学、药学和生物工程学及技术的进步,临床对肿瘤的根治和对癌细胞的攻击锁定于表皮生长因子和血管内皮生长因子等靶位,使药物治疗的切入点由细胞水平提升到分子和抗体水平,从而提高了肿瘤综合治疗的效果。[align=center]六 人源化单克隆抗体[/align]单克隆抗体是近年竞相开发的品种,自1997年第1个单克隆抗体rituximab通过食品与药物管理局(FDA)批准应用于临床以来,目前已经上市的单克隆抗体靶向药物的疗效令人瞩目,在抗肿瘤、类风湿性关节炎和自身免疫系统缺陷治疗领域得到了有力的推广,其以独特的作用优势,在肿瘤的治疗中不但能够选择性杀伤癌细胞,且在体内表现出特异的分布特性,具有高效、低毒的特点,从而在生物技术产品领域中占据了1/3的市场[sup][/sup]。目前用于治疗肿瘤的单克隆抗体药已有多个,包括伊珠单抗奥加米星、帕尼单抗、曲妥珠单抗等。伊珠单抗奥加米星又名CMC-544,是以人源化抗CD22的抗体伊珠单抗与 CalichDMH偶联形成的ADC药物,用来治疗复发性或难治性B细胞非霍奇金淋巴瘤(B cell-NHL)和急性淋巴细胞白血病(ALL),目前已经进入临床 III期试验[sup][/sup]。帕尼单抗是一种IgG2单克隆抗体完全人源化可以与EGFR高度特异性地结合,进而阻断配体诱导的信号激活,从而抑制肿瘤生长。有临床研究选择既往未治疗过的ⅢB或Ⅳ期非小细胞肺癌患者比较卡铂(AUC=6,每3周),加紫杉醇(200mg/m21次/3周) 联合或不联合帕尼单抗(2.5 mg/m2,1次/周) 化疗的疗效及其安全性。研究结果显示,单纯化疗组与帕尼单抗联合化疗组之间在PFS(5.3个月对比4.2个月、P=0.55)和总生存( Overall survival,OS)(8.0个月对比8.5个月,P =0.81)上均无显著差异。结果提示帕尼单抗联合一线化疗方案可能对晚期非小细胞肺癌无明显疗效[sup][/sup]。曲妥珠单抗是一种抗Her2的单克隆抗体,他可以和肿瘤细胞的HER2/neu特异性地结合,从而阻断细胞内生长信号的转导,同时曲妥珠单抗还可以诱导体内巨噬细胞以及自然杀伤细胞攻击肿瘤细胞,以达到抑制和杀伤肿瘤细胞的目的。比较用或不用曲妥珠单抗联合一线化疗方案用以治疗ⅡB/Ⅲ期HER2/neu阳性的 NSCLC患者差异的两项大型的随机Ⅱ期临床试验,其结果显示两个试验结论相似,曲妥珠单抗不能提高化疗的疗效,但也不加重化疗的不良反应。试验中HER2/neu值为3+的患者对曲妥珠单抗治疗的反应性较好,提示曲妥珠单抗对这一较少见类型的NSCLC效果要更好[sup][/sup]。在临床治疗中使用鼠派生单抗的主要障碍之一是产生人抗鼠抗体(HAMA)反应,通过基因工程技术制备嵌合抗体的I-IPdVIA反应率较鼠源性单抗低,但完全的人源抗体才是单抗药物的发展目标。噬茵体抗体库技术和转基因小鼠技术是制备完全人源单抗的两种方法[sup][/sup]。因此,只有不断地完善单克隆抗体人源化的技术,才能更好地将完全人源化的单克隆抗体用于肿瘤分子靶向治疗中,从而使医学界迈向更高的台阶。[b]七 问题与对策[/b]在限制单克隆抗体临床治疗效果的因素有:(l)循环免疫复合物导致的肝肾功能损害。(2)可溶性肿瘤抗原释放造成的体液中的封闭作用。(3)异种蛋白反应。(4)特异性还不够专一,引起了正常细胞的伤害。(5)天然免疫功能低下(如补体介异的细胞毒,网状内皮系统清除和ADCC作用等)。(6)主要的问题还在这种免疫疗法会导致靶细胞(肿瘤细胞)上抗原的转换。为了解决这些问题,今后的研究应着重:(1)制备对肿瘤抗原有高度特异性的单克隆抗体。(2)选择不易诱导抗原转换的单克隆抗体。(3)研究副作用较少,既安全疗效又高的偶联制剂。单抗(Mab)药物存在的一个最关键问题就是人抗鼠抗体反应(HAMA)。由于用于临床研究的Mab药物一般使用鼠源Mab,这不可避免地会引起HAMA反应,所以尽量避免HAMA反应这一副作用才是Mab药物能否真正适合治疗肿瘤性疾病的重点[sup][/sup]。近些年来,Mab药物的研究主要是向减轻宿主对外源抗体的排斥,促进抗体人源化,改变抗体的氨基酸序列而增加或降低该抗体的生物学效应,加抗体的亲和力,制备双特异性抗体,改造抗体重链恒定区以增强抗体功能,以及寻找新的分子靶点(相对特异的肿瘤抗原)等方向发展[sup][/sup]。Mab药物的不断更新,必将为全球的肿瘤患者带来更大的希望。[align=center]八 总结与展望[/align]目前肿瘤治疗中使用最广泛的仍是化疗以及放射性疗法,其毒副作用较大。随着基因工程技术和DNA重组技术的兴起,利用单克隆抗体治疗肿瘤已经日渐取代副作用较大的传统疗法而成为新的发展趋向。所以,如何研制更多的单克隆抗体以及怎样更好的利用单克隆抗体治疗肿瘤,将成为肿瘤治疗研究中的又一艰巨任务。同时,生物技术以及抗肿瘤化学药物的发展也必将推动单抗药物的发展与进步,单克隆抗体药物将在各种肿瘤的治疗中发挥越来越重要的作用。在未来10年内,单克隆抗体药将成为国内、外生物药品发展的主旋律。此外,利用与肿瘤细胞相关抗原的特异结合力,相应的单克隆抗体可以用于肿瘤早期诊断和预后判定。例如用放射标记抗体能够确定肿瘤存在的位置,扩散的部位和范围,以便确定手术时机和化疗方案。通过测定抗体结合白血病细胞的增减,可以检查白血病的化疗效果[sup][/sup]。利用单克隆抗体检测某些癌的特异性产物,如前列腺癌产生的酸性磷酸酶,绒毛膜上皮癌产生的促性腺激素,结肠癌产生的癌胚抗原及肝癌产生的甲胎蛋白等,有助于癌肿的早期诊断[sup][/sup]。单克隆抗体在肿瘤的治疗中的作用功不可没,但同时也面临着巨大的挑战,例如如何选择优势人群、进一步提高疗效、降低不良反应的发生都是需要进一步解决的。如贝伐单抗的突出不良反应是出血,在NCCN指南中特别指出贝伐单抗仅适用非鳞癌的[sup][/sup],既往无咯血史的患者,限制了贝伐单抗的临床应用。而其他大部分单克隆抗体均需与其他化疗药物联用,单独应用的疗效仍有限,选择合适的指标以及合适人群应用单克隆抗体仍任重而道远。[b]参考文献[/b] Adams GP, Weiner LM.Monoclonalantibody therapy of cancer .Nat Biotechnol,2005,23(9):1147~1148 甄永苏.抗肿瘤抗生素和单克隆抗体药物的研究进展.中国抗生素杂志,2002,27(1):1~5 Sievers E L, Larson R A, Stadtmauer E A, [i]et al[/i].Effica-cy and safety ofgemtuzumab ozogamicin in patients withCD33-positive acute myeloid leukemia infirst relapse .Clin Oncol,2001,19(21):3244~3246 Kamiya K, Konno H, Tanaka T, [i]et al[/i].Antitumor effect on humangastric cancer and induction of apoptosis by vascular endothelial growth factorneutralizing antibody .Jpn J Cancer Res,1999,4(21):794~798 邹学,李俊,尹庆春.单克隆抗体药物诱发肿瘤细胞凋亡的研究进展.总装备部医学学报,2008,10(2):115~117 Rao AV, Schmader K.Monoclonalantibodies as targeted therapy in hematologic malignancies in older adults .Am J GeriatrPharmacother,2007,5(3):247~250 杨海东,罗傲雪,范益军.单克隆抗体在治疗肿瘤中的研究进展.时珍国医国药,2007,18(11):2685~2686 甄红英,薛玉川,甄永苏.抗肿瘤抗生素C1027抑制血管生成及其抗肿瘤转移作用.中华医学杂志,1997,77(21):657~660 刘霆.抗肿瘤单克隆抗体靶向药物的研究进展.国外医学生理、病理科学与临床分册,2003,23(3):254~257 Plw a JL,Britta E,Jayne L,[i]et al[/i].Targeting rat anti-mouse transferrinreceptor monoclonal antibody through blood-brain barrier in mouse .pharmacology andexperiment therapeu-ties,2000,4(21):1048~1057 刘德忠,张石革.分子和抗体靶向抗肿瘤药的研究进展.中国药房,2007,18(26):2067~2068 丰雪,龙亚一,廖翰.抗肿瘤抗体-药物偶联物的临床研究进展.现代生物医学进展,2013,16(21):3164~3168 江山,杨小琼.晚期非小细胞肺癌单克隆抗体治疗的研究进展.吉林医学,2013,34(35):7482~7483 SpicerJ,Harper P.Targetedtherapies for non-small cell lung cancer .In t J C l in Pract,2005,59(9):1055~1057 彭建柳,杨丽华.人源化单克隆抗体用于肿瘤分子靶向治疗的研究进展.现代医院,2009,9(5):8~11 王飞,董军,黄强等.转基因完全人抗体的制备及其抗肿瘤作用研究.中华神经外科疾病研究杂志,2002,1(1):90~91 Kim J A.Targeted therapies for thetreatment of cancer .Am J Surg,2003,186(9):264~269 侯盛,郭亚军.单克隆抗体在肿瘤治疗中的应用.中国处方药,2007,4(61):53~56 清水惠司.抗肿瘤用药的应用及进展.临床免疫,2009,13(11):912~915 沈倍奋.抗体药物研究进展.第二军医大学学报,2002,23(10):1047~1049

6种AOBO粗提物NO释放活性及抗肿瘤活性测定 某中药AOBO,多以果实入药,现代药理学显示该药具有抗菌,抗炎、镇痛作用,而且具有抗肿瘤及心血管系统方面等新的活性,具有较高的研究价值和开发前景。 本实验为了阐明其活性部位与活性成分,对其乙醇总提取物和不同极性的有效部位进行抗炎活性筛选;对分离到的几类单体进行了抗肿瘤活性的初步筛选。生物体中NO由NO合成酶(NOS)来调控产生,目前为止已经确定了3种同工酶,分别为神经型NOS(nNOS),血管内皮型NOS(eNOS)和诱导型NOS(iNOS)。通常状态下,人体中nNOS和eNOS都是在正常生理条件下调控NO的释放而起到正常的生理作用。iNOS的表达与炎症和癌症反应有密切的关联。由iNOS诱发的NO释放过多,会非选择性的对细胞组织造成损伤,引起局部的炎症反应。近年的研究表明,NO与癌症及癌症组织的增生也有关系。高浓度的NO还会损伤正常细胞的DNA合成,能够诱导细胞变异。今后iNOS选择性阻碍剂在抗炎抗肿瘤药剂的开发中被给予厚望。1、抑制NO释放活性实验材料和仪器RAW2647细胞,Ham,sF12培养基,INF-r,LPS,MTT;Griess试药。酶连免疫检测仪样品均由实验室自制,1号为AOBO95%乙醇提取浸膏,2号为石油醚萃取浸膏,3号为氯仿萃取浸膏,4号为乙酸乙脂萃取浸膏,5号为正丁醇萃取浸膏,6号为水层萃取浸膏。试验方法用含10%FBS的Ham,sF12培养液配制RAW2467细胞悬液,浓度为1.2x106/mL,每孔200uL[

片姜黄提取物14种挥发油的抗肿瘤活性研究试验 从国内外对姜黄挥发油的药理活性的研究报道发现,姜黄挥发油具有显著的抗肿瘤、抑制细胞增殖的作用。他们可通过直接杀伤肿瘤细胞、抑制肿瘤细胞生长或转移、诱导肿瘤细胞凋亡或诱导肿瘤细胞分化使其逆转、增强和刺激机体免疫功能等多种方式起到抗肿瘤作用。 本研究采用体外方法评价了从片姜黄中提取分离得到的14种挥发油单体化合物在体外对HL-60(人白血病细胞)、Du145(人前列腺癌细胞)、Hep-3B(人肝癌细胞)、U87(人胶质瘤细胞)的细胞毒活性。实验结果表明,部分受试化合物显示出不同强度的抗肿瘤活性。挥发油单体结构式如下:http://ng1.17img.cn/bbsfiles/images/2014/11/201411281001_525011_2188679_3.jpghttp://ng1.17img.cn/bbsfiles/images/2014/11/201411281001_525012_2188679_3.jpg实验部分1实验材料1.1受试品14个单体化合物(化合物1-14)由合作单位离得到并进行结构鉴定,阳性对照购自药店。1.2 实验细胞株HL-60(人白血病细胞),Du145(人前列腺癌细胞),Hep-3B(人肝癌细胞),U87(人胶质瘤细胞),购自ATCC2实验试剂 RPMI1640培养基:Gibco 胎牛血清:天津市灏洋生物制品有限公司甲基偶氮唑盐(MTT):美国Sigma二甲基亚砜(DMSO),NaCl,KCl,KH2PO3,Na2HPO3,NaHCO3:沈阳化学试剂厂酶标仪:奥地利TECAN 96孔细胞培养板:Costar公司3.试验方法3.1药物的处理[fon
[align=center][font='楷体']免疫微环境角度探索NSCLC患者免疫治疗标记物[/font][/align][font='楷体'][size=16px]本实验[/size][/font][font='楷体'][size=16px]纳入100例一线接受免疫治疗且临床信息完整的晚期NSCLC患者,并对其基线组织标本分别进行以下检测:多基因NGS测序、PD-L1表达、肿瘤浸润淋巴细胞(TILs)多重免疫荧光(Microenvironment analysis panel,MAP)检测和T细胞炎性基因表达谱(GEP)检测;同时在整个治疗过程中密切随访,直至一线免疫治疗进展。本研究通过收集患者的临床转归资料,探讨患者肿瘤组织DNA变异情况、PD-L1表达情况、以及免疫微环境特征(包括TILs和GEP)等多维度指标与免疫联合化疗疗效之间的关系。从基因突变、TMB、PD-L1表达以及免疫微环境特征等多维度探寻潜在的生物标志物,旨在利用综合指标体现肿瘤免疫微环境的真实状态,为受益人群的精准选择提供全面准确的依据。[/size][/font][size=16px]本研究通过探讨患者肿瘤组织[/size][size=16px]DNA[/size][size=16px]变异情况、[/size][size=16px]PD-L1[/size][size=16px]表达情况、以及免疫微环境特征(包括[/size][size=16px]TILs[/size][size=16px]和[/size][size=16px]GEP[/size][size=16px])等多维度指标与免疫联合化疗疗效之间的关系,从基因突变、[/size][size=16px]TMB[/size][size=16px]、[/size][size=16px]PD-L1[/size][size=16px]表达以及免疫微环境特征等多维度探寻免疫治疗潜在的生物标志物。为[/size][size=16px]NSCLC[/size][size=16px]患者精准免疫治疗提供更多参考。[/size][size=16px]从基因突变、[/size][size=16px]PD-L [/size][size=16px]表达以及免疫微环境角度探索[/size][size=16px]NSCLC[/size][size=16px]患者免疫治疗疗效标记物,构建可预测免疫治疗疗效的模型。[/size][font='楷体']创新点[/font][font='楷体'][size=16px]1[/size][/font][font='楷体'][size=16px])本研究采用靶向捕获测序的方式对520个基因进行突变筛查,其中310个基因进行全外显子捕获,210个基因进行热点区域的捕获。采用专利算法进行TMB计算和MSI状态的评估,前期经过大量临床验证,保证算法的准确性和结果的可靠性;[/size][/font][font='楷体'][size=16px]2[/size][/font][font='楷体'][size=16px])采用靶向RNA测序的方式检测81个T细胞炎性基因的表达量,采用独特的链特异性建库技术和双端UMI矫正,保证90%的捕获效率,确保可利用低起始量的FFPE样品实现准确的基因表达分析;[/size][/font][font='楷体'][size=16px]3[/size][/font][font='楷体'][size=16px])采用多重免疫荧光检测技术,进行组织免疫微环境相关指标的分析。在同一张组织切片上从包括肿瘤实质和肿瘤间质的维度上实现CD3+T细胞、CD8+细胞毒性T细胞、PD-1、PD-L1表达的检测。[/size][/font][font='楷体'][size=16px]1[/size][/font][font='楷体'][size=16px])通过基因芯片目标区域捕获和高通量测序对非小细胞肺癌患者进行遗传、治疗、预后及风险控制全方位信息分析;[/size][/font][font='楷体'][size=16px]2[/size][/font][font='楷体'][size=16px])对非小细胞肺癌肿瘤细胞进行全面免疫微环境特征分析,包括RNA测序检测T细胞炎性基因表达谱的分析,以及多重免疫组化进行肿瘤T淋巴细胞浸润[/size][/font][font='楷体'][size=16px]分析;[/size][/font][font='楷体'][size=16px]3[/size][/font][font='楷体'][size=16px])综合分析基因变异、PD-L1表达及免疫微环境特征(包括TILs和GEP)在非小细胞肺癌中表达及其与免疫治疗临床效果相关性。[/size][/font][font='楷体'][size=16px](1)[/size][/font][font='楷体'][size=16px]小结[/size][/font][font='楷体'][size=16px]1)明确[/size][/font][font='楷体'][size=16px]NSCLC患者[/size][/font][font='楷体'][size=16px]突变特征,包含高频突变基因、突变类型等,探讨[/size][/font][font='楷体'][size=16px]NSCLC[/size][/font][font='楷体'][size=16px]临床表型-基因型相关性;[/size][/font][font='楷体'][size=16px]2)明确[/size][/font][font='楷体'][size=16px]NSCLC患者[/size][/font][font='楷体'][size=16px]免疫微环境特征,包括各类型免疫细胞在该类患者中的浸润情况,探讨[/size][/font][font='楷体'][size=16px]NSCLC[/size][/font][font='楷体'][size=16px]临床表型-免疫特征相关性;[/size][/font][font='楷体'][size=16px]3)将[/size][/font][font='楷体'][size=16px]患者[/size][/font][font='楷体'][size=16px]免疫治疗的疗效标记物与[/size][/font][font='楷体'][size=16px]突变[/size][/font][font='楷体'][size=16px]、[/size][/font][font='楷体'][size=16px]PD-L[/size][/font][font='楷体'][size=16px]1[/size][/font][font='楷体'][size=16px]表达以及免疫微环境特征([/size][/font][font='楷体'][size=16px]包括TILs和GEP[/size][/font][font='楷体'][size=16px])[/size][/font][font='楷体'][size=16px]相关联,[/size][/font][font='楷体'][size=16px]构建预后模型,用于预测NSCLC免疫治疗的疗效[/size][/font][font='楷体'][size=16px];[/size][/font][font='楷体'][size=16px]本研究拟采用高通量测序[/size][/font][font='楷体']、[/font][font='楷体'][size=16px]多重免疫荧光平台[/size][/font][font='楷体'][size=16px]以及靶向RNA测序平台[/size][/font][font='楷体'][size=16px]研究[/size][/font][font='楷体'][size=16px]NSCLC免疫治疗疗效标记物,构建疗效预测模型,[/size][/font][font='楷体'][size=16px]为该类患者的治疗决策提供有益的理论指导。[/size][/font]
3月15日,复旦大学与美国HUYA(沪亚)公司在上海达成协议,复旦大学生命科学学院教授杨青将具有自主知识产权的用于肿瘤免疫治疗的IDO抑制剂有偿许可给美国HUYA公司。此次许可转让将至多为复旦大学和杨青教授带来6500万美元的收益。据了解,IDO抑制剂作为具有新药靶、新机制的药物,可应用于治疗肿瘤、阿尔茨海默病、抑郁症、白内障等多种重大疾病,社会、经济效益前景广阔。目前,国外医药行业对于IDO抑制剂药物的市场前景颇为看好,多家国外知名药企均宣布要加入IDO抑制剂的研发竞争。但现有的IDO抑制剂普遍抑制效力低下,尚无IDO抑制剂药物问世。截至目前,美国New link Genetics公司与美国Incyte公司研发的相关化合物已经进入了临床试验阶段。而杨青带头研发的新型IDO抑制剂,已经申请了国内专利和PCT国际专利,有望成为第三个进入临床实验研究的IDO抑制剂。据悉,协议签订后,美国HUYA公司将向复旦大学支付一定额度的首付款。若该IDO抑制剂在在国外临床试验结果取得优效;在欧盟、美国、日本成功上市;以及年销售额达到不同的目标后,美国HUYA公司向复旦大学支付累计不超过6500万美金的各项里程碑付款来源:澎湃新闻网
[align=center][size=16px]NSCLC[/size][size=16px]免疫治疗[/size][size=16px]策略探索[/size][/align][size=16px]2020[/size][size=16px]年[/size][size=16px]9[/size][size=16px]月[/size][size=16px]20[/size][size=16px]日,[/size][size=16px]“[/size][size=16px]肺癌免疫治疗临床病理研讨会暨中国非小细胞肺癌[/size][size=16px]PD-L1[/size][size=16px]表达检测临床病理专家共识发布会[/size][size=16px]”[/size][size=16px]在北京举行,由中国抗癌协会肿瘤病理专业委员会、中国临床肿瘤学会肿瘤病理专家委员会、中国临床肿瘤学会非小细胞肺癌专家委员会等组织编写的《中国非小细胞肺癌[/size][size=16px]PD-L1[/size][size=16px]表达检测临床病理专家共识》正式发布。[/size][size=16px]目前,关于[/size][size=16px]NSCLC[/size][size=16px]免疫治疗的研究大多是西方人群的数据。中国人群是否能从中获益、安全性如何都有待研究证实。[/size][size=16px]CheckMate[/size][size=16px]?[/size][size=16px]078[/size][size=16px]入组来自中国、俄罗斯和新加坡的晚期[/size][size=16px] NSCLC[/size][size=16px]患者,按照[/size][size=16px]2[/size][font='宋体'][size=16px]∶[/size][/font][size=16px]1[/size][size=16px]的比例随机接受[/size][size=16px]Nivolumab[/size][size=16px]和多西他赛治疗。结果显示中国患者的临床研究数据与世界其他研究数据基本一致[/size][size=16px][23][/size][size=16px]。正是基于这项研究,中国在[/size][size=16px]2018[/size][size=16px]年[/size][size=16px]6[/size][size=16px]月[/size][size=16px]15[/size][size=16px]日批准[/size][size=16px] Nivolumab[/size][size=16px]用于晚期[/size][size=16px]NSCLC[/size][size=16px]患者的二线治疗。[/size][size=16px]2019[/size][size=16px]年报道的[/size][size=16px]SHR[/size][size=16px]?[/size][size=16px]1210[/size][size=16px]?[/size][size=16px]11[/size][size=16px]?[/size][size=16px]201[/size][size=16px]研究是[/size][size=16px]1[/size][size=16px]项[/size][size=16px]Ⅱ[/size][size=16px]期伞状研究,入组人群为既往接受过治疗的晚期或转移性[/size][size=16px]NSCLC[/size][size=16px]的中国患者,结果显示中国患者的[/size][size=16px]PD[/size][size=16px]?[/size][size=16px]L1[/size][size=16px]表达率较高,且可以从免疫治疗中获益[/size][size=16px][24][/size][size=16px]。[/size][size=16px]近年来人们对肺癌精准治疗的认识明显提高,但非小细胞肺癌的治疗仍面临挑战,驱动基因阴性患者的治疗方式十分有限,晚期患者的预后仍较差。免疫治疗药物可以通过阻断免疫检查点使抗肿瘤[/size][size=16px]T[/size][size=16px]细胞免疫反应恢复或增强,或者[/size][size=16px]T[/size][size=16px]细胞受体转导的[/size][size=16px]T[/size][size=16px]细胞免疫疗法靶向大部分的肿瘤特异性抗原从而起到抗肿瘤作用。目前,仅免疫检查点治疗的临床试验表明,非小细胞肺癌中非选择性人群的客观缓解率为[/size][size=16px]10%~20%[/size][size=16px],仍有大部分患者不能从免疫治疗中获益,故优势人群的筛选仍十分重要。[/size][size=16px]PD-L1[/size][size=16px]是目前最常用的免疫治疗的疗效预测标志物,但仍存在一定的局限性,不能作为常规标志物应用于临床。另外,肿瘤突变负荷、肿瘤浸润淋巴细胞、微卫星不稳定等都是预测免疫治疗疗效的重要生物标志物,研究还在不断进行中。[/size][size=16px]随着分子生物学技术的日益发展,基于基因检测指导下的精准医疗已成为非小细胞肺癌的主要诊治模式。二代测序技术[/size][size=16px](next generation sequencing technologies[/size][size=16px],[/size][size=16px]NGS)[/size][size=16px]可以检测非小细胞肺癌的基因表达谱、基因组结构、基因突变以及筛查单核苷酸多态性[/size][size=16px](single nucleotide [/size][size=16px]polymophism[/size][size=16px], SNP)[/size][size=16px],从基因水平上对非小细胞肺癌进行分型,发现新的非小细胞肺癌类型和亚型,从而可以更加准确的进行临床诊断,辅助免疫治疗方案的制订及判断预后,并同时进行免疫治疗的疗效预测及标志物的探索。[/size]
经药理学研究和临床实践证明,有许多中草药具有影响机体免疫功能的作用。如人参、党参、丹参、黄芪、黄连、猪苓、茯苓、当归、鹿茸、何首乌、女贞子等60多味中草药能增加白细胞的数量,增强巨噬细胞的吞噬功能,提高机体诱生干扰素的能力,因而具有增强机体免疫功能的作用,临床上常用人参、黄芪、党参治疗肿瘤、预防感冒、防治小儿哮喘等;而甘遂、雷公藤、生地黄、龙胆草、北沙参等能减少T淋巴细胞的增生医学|教育网搜集整理,能使机体抗体水平降低,因而具有抑制机体免疫功能的作用,临床上常用甘遂、雷公藤、生地黄治疗风湿性关节炎和类风湿性关节炎。另外有些中草药对机体的免疫功能则具有双向作用,如冬虫夏草对单核-巨噬细胞系统呈现明显的增强作用,对体液免疫则具有抑制作用;青蒿素一方面能减少机体的抗体水平,另一方面又能诱生干扰素。
文章来源:新华网 时间:2012.06.03 新华网专电 美国医疗研究团队说,两种增强免疫能力的抗癌新药在试验初期阶段显现良好效用,有必要扩大研究在更多患者中试验疗效。 这两种药物由美国百时美施贵宝公司研发。药物的基本药理是,一边打破肿瘤细胞的防护层,一边促进人体免疫系统,而后靠人体免疫系统“主动反攻”癌细胞。 大约500名癌症患者参与两种药物的初期试验,这些患者患有非小细胞肺癌、黑素瘤皮肤癌或肾癌,一般临床疗法对他们已验证无效。法新社2日报道,这些患者在使用两种新药后,肿瘤明显收缩。 两种新药均为蛋白质阻断药。编号为BMS-936558的药物可阻断PD-1型蛋白,编号为BMS-936559的药物可阻断PD-L1型蛋白。先前研究表明,阻断这两种蛋白可能激活免疫系统中的T细胞,使受感染T细胞重新恢复“抗敌”效用。 在使用BMS-936558药物的群体中,非小细胞肺癌患者、黑素瘤皮肤癌患者、肾癌患者均出现肿瘤收缩的积极信号,有明显疗效的比例分别是18%、28%和27%;而在使用BMS-936559药物的群体中,三个比例分别是10%、17%和12%。 对两种药物不应答的患者比例分别是5%和9%。 研究参与者、美国霍普金斯大学外科与肿瘤学教授苏珊·托帕利安说:“由于药物持续表现出积极作用,我们相信有必要推进临床新研究。”
[font='calibri'][size=13px]免疫学检测形成的原因有哪些?免疫学[/size][/font][font='calibri'][size=13px]检测包括哪些?[/size][/font]免疫学检测形成的原因:免疫学检测是基于免疫系统对外来物质或抗原的反应而产生的,可分为体液免疫学检测和细胞免疫学检测两大类。体液免疫学检测是通过血液、唾液、乳汁等体液样本中的免疫球蛋白、补体、免疫复合物等成分的含量及其分布来反映机体的免疫状态。当机体受到病原体或某些生物物质的刺激时,免疫系统会产生相应的抗体和细胞因子等免疫反应,这些免疫反应产物可通过体液免疫学检测方法进行检测。细胞免疫学检测是通过检测机体内的免疫细胞和免疫分子的含量及其分布来反映机体的免疫状态。当机体受到病原体或某些生物物质的刺激时,免疫系统会产生相应的抗原提呈细胞,并引导记忆细胞和效应细胞的产生,这些记忆细胞和效应细胞可以在特定情况下识别和消灭病原体或肿瘤细胞,这些细胞和效应细胞本身也可以被检测出来。总之,免疫学检测的目的是通过检测机体的免疫反应,了解机体的免疫状态,为疾病的诊断、治疗和预防提供重要的依据。免疫学检测包括哪些?免疫学检测是指通过各种方法检测机体对病原体或某些生物物质的免疫反应程度,以及机体内的免疫细胞、免疫分子和免疫活性物质的含量及其分布等情况的一种医学技术。免疫学检测广泛应用于各种疾病的诊断、治疗和预防,包括感染性疾病、自身免疫性疾病、肿瘤免疫学诊断等。以下是一些常见的免疫学检测项目:体液免疫学检测:主要包括免疫球蛋白的测定,如IgA、IgM、IgE等;补体检测,如总补体溶血活性、补体C1、C2等;免疫复合物检测,如抗体-抗原复合物、补体-抗体复合物等;细胞免疫学检测:主要包括T细胞亚群分析、B淋巴细胞分化抗原检测、自然杀伤细胞抗体检测、T细胞活化抗体检测等;抗体检测:如抗药抗体、中和抗体等;细胞因子检测:如白细胞介素-2、-4、-6等;自身抗体检测:如抗核抗体、抗胰岛素抗体等;感染免疫检测:如病毒特异性抗体、细菌特异性抗体等。总之,免疫学检测是一种非常重要的医学技术,可以帮助医生判断机体的免疫状态,为疾病的诊断和治疗提供重要的依据。免疫学检测是根据抗原、抗体反应的原理,利用已知的抗原检测未知的抗体或利用已知的抗体检测未知的抗原,可定性、定位和定量的检测。依托自主研发生产的优质抗体、蛋白试剂、先进的实验仪器以及经验丰富的技术人员,义翘神州建立了全面的免疫学检测平台,包括ELISA、Western Blot、IHC、IF、Flow Cytometry、IP/Co-IP、Biacore、Octet等检测技术。义翘神州免疫学检测服务包含:①WB/Sally Sue高通量检测服务②[url=https://cn.sinobiological.com/services/flow-cytometry-service]流式细胞检测服务[/url]③免疫组化检测服务④多重免疫荧光和免疫组化服务⑤免疫荧光检测服务⑥HE染色及特殊染色服务⑦ELISA/ELISpot检测服务⑧IP/Co-IP检测服务⑨TMA芯片定制服务更多详情可以查看:https://cn.sinobiological.com/services/immunoassay-service
自噬促进肿瘤形成:一种新观点Tangdl2000点评 细胞自噬(autophagy)是一种基本的细胞应激调控机制,细胞可以通过自噬和溶酶体,消除、降解和消化受损、变性、衰老和失去功能的细胞、细胞器和变性蛋白质与核酸等生物大分子。为细胞的重建、再生和修复提供必须原料,实现细胞的再循环和再利用。它既是体内的“垃圾处理厂”,也是“废品回收站”;它既可以抵御病原体的入侵,又可保卫细胞免受细胞内毒物的损伤。 自噬与肿瘤关系密切,主要体现在两个方面:1)调控肿瘤发生,2)影响肿瘤治疗疗效。过去传统的观点是认为自噬抑制了肿瘤形成,主要证据有:1)很多人类肿瘤在遗传学上出现自噬基因的缺失;2)自噬基因敲除老鼠(例如Beclin1, UVRAG等)出现自发性肿瘤。但是,随着研究的深入,2010年12月13日,《Oncogene》杂志在线发表了杜克大学的一项研究成果,该研究表明自噬不但能够肿瘤形成,而且也能促进白血病肿瘤的形成,这无疑是对现有理论体系的补充和挑战。也再次提醒人们重视一些基本的自然规律,即事物具有双面性。同时我们也应该清楚的看到生物是多样性的,肿瘤也不例外,每种肿瘤的发生机制并不完全一样。 杜克大学的这项研究的主要发现有:利用一种条件性Atg3自噬基因敲除老鼠体内外证实了抑制自噬防治了BCR-Abl融合基因介导的白血病发生。BCR-Abl融合基因是人体细胞第9号染色体上的Abl原癌基因与第22号染色体上的Bcr基因相互易位形成的融合基因。可引起蛋白激酶持续性激活,使白细胞过分增殖而出现慢性粒细胞白血病。此外,作者发现抑制自噬后增加了细胞凋亡(apoptosis),包括p53磷酸化,上调p21和PUMA等促凋亡通路。 值得注意的事,近年来也出现了有关细胞凋亡促进肿瘤发生的研究报告。例如CD95促进了肝癌以及卵巢癌肿瘤的发生,PUMA促进了淋巴瘤的发生。这一系列研究清楚的表明自噬或者凋亡促进或者抑制肿瘤发生具有细胞和组织特异性。总之我们在关注这些基本细胞机制和通路的“主要角色”的同时,要注意其“次要角色”,关注“阴阳”。