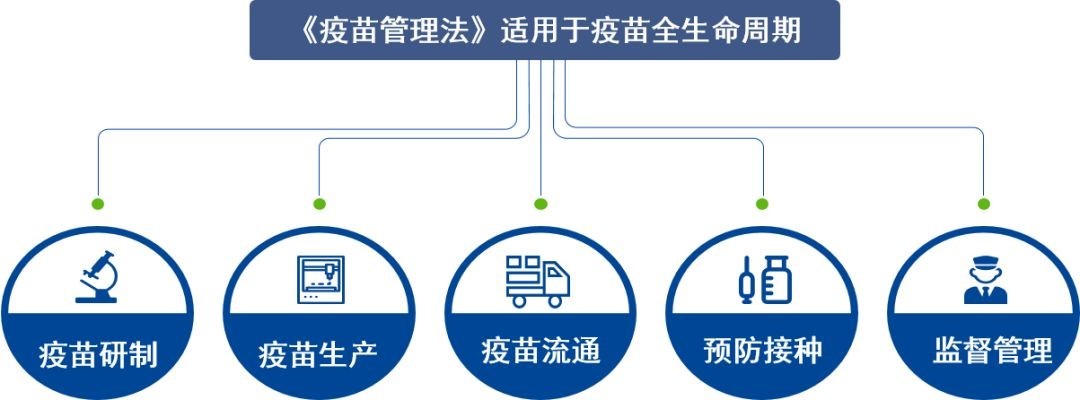
冒牌、水货九价HPV疫苗齐聚香港 这些检测让其原形毕露
p style=" text-align: center text-indent: 0em line-height: 1.5em " img src=" https://img1.17img.cn/17img/images/201907/uepic/65378f4a-90c3-4471-9b56-4d42be6f4f61.jpg" title=" 冒牌HPV疫苗惊现香港.png" alt=" 冒牌HPV疫苗惊现香港.png" width=" 428" height=" 243" style=" max-width: 100% max-height: 100% width: 428px height: 243px " / br/ /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" font-size: 18px color: rgb(255, 255, 255) background-color: rgb(79, 129, 189) " strong 事件回顾:冒牌疫苗或已取代水货疫苗,在香港各区显露原形 /strong /span /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 2019年4月底,香港《大公报》报道香港环亚集团为牟取暴利,以正版美国默沙东药厂生产的九价HPV疫苗招揽内地顾客,再换成来历不明的 span style=" font-family: 楷体, 楷体_GB2312, SimKai color: rgb(192, 0, 0) " strong “水货疫苗” /strong /span 为顾客接种。此事引发社会关注。 /span /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 6月5日,环亚体检集团贴出公告,宣称清盘结业。 /span /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 7月10日,香港海关与卫生署展开联合行动,突击搜查一间位于观塘的医务中心,查获共76盒疑似 strong span style=" font-family: 楷体, 楷体_GB2312, SimKai color: rgb(192, 0, 0) " 假冒的“九价HPV疫苗” /span /strong 。继环亚体检集团被爆出非法提供HPV疫苗事件后,再次引发民众对疫苗来源的担忧。 /span /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 7月12日,香港卫生署与香港海关采取联合行动,突击搜查加维医务及疫苗中心,检获约162盒疑似冒牌子宫颈癌疫苗及163盒含有第1部毒药的疫苗,拘捕35岁医务中心女董事及2名女职员。样本被送往特区政府化验所化验,并由香港海关及卫生署负责调查。 /span /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 7月17日,据香港文汇网报道,位于香港尖沙咀宝勒巷万事昌广场的加维医务及疫苗中心,疑似使用 span style=" font-family: 楷体, 楷体_GB2312, SimKai color: rgb(192, 0, 0) " strong 冒牌子宫颈癌(HPV)疫苗 /strong /span ,其诊所于7月16日早晨暂停营业。 /span /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" font-family: 宋体, SimSun " 香港HPV假疫苗事件引起赴港接种疫苗恐慌,根据香港政府一站通官网显示,香港卫生署七月二十四日公布就本月早前联合行动中检获的怀疑冒牌疫苗的中期化验结果。 /span /p p style=" text-align: center line-height: 1.5em " img style=" max-width:100% max-height:100% " src=" https://img1.17img.cn/17img/images/201907/uepic/964c4418-4ecb-4256-9e21-61d32f8353e7.jpg" title=" 香港政府一站通官网发布公告.jpg" alt=" 香港政府一站通官网发布公告.jpg" / /p p style=" text-indent: 0em text-align: center line-height: 1.5em " 香港政府一站通官网发布公告(图源于网络) /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" font-size: 18px background-color: rgb(79, 129, 189) color: rgb(255, 255, 255) " strong 化验结果:无有害杂质,更无疫苗成分,无菌检验仍在进行 /strong /span /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 其公告显示,卫生署与香港海关早前公布,分别于七月十日及十二日在两间医务中心进行联合行动,并于该两个处所检获怀疑冒牌疫苗。为确定检获产品的性质及是否含有害成份,检获疫苗的样本被送到政府化验所及认可化验所进行化验。 /span /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 当中,有关 strong span style=" font-family: 楷体, 楷体_GB2312, SimKai color: rgb(192, 0, 0) " 化学及金属杂质 /span /strong 、可见异物及化学指标成份等检验已有结果。至目前为止,样本中没有发现有害杂质或可见异物。另外,分析结果显示检验的样本 strong span style=" font-family: 楷体, 楷体_GB2312, SimKai color: rgb(192, 0, 0) " 不含人类乳头瘤病毒疫苗 /span /strong span style=" font-family: 楷体, 楷体_GB2312, SimKai color: rgb(192, 0, 0) " strong (又称子宫颈癌疫苗即HPV疫苗)的成分 /strong /span 。其中在一间位于观塘的医务中心检取样本的分析结果显示,样本内含常见于 strong span style=" font-family: 楷体, 楷体_GB2312, SimKai color: rgb(192, 0, 0) " 生理盐水中的钠和氯 /span /strong 。 /span /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 有关样本的 strong span style=" font-family: 楷体, 楷体_GB2312, SimKai color: rgb(192, 0, 0) " 无菌检验仍在进行中 /span /strong ,预计可于八月中完成,结果将再作公布。卫生署及海关的调查工作仍在进行中。 /span /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" font-size: 18px color: rgb(255, 255, 255) background-color: rgb(79, 129, 189) " strong 让假疫苗“现原形”的检测技术与科学仪器 /strong /span /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " 疫苗的检验需要多种实验方法与检测技术,用到数十种专业仪器。 /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " 在进行 strong 理化性质的检测 /strong 时使用常见的化学分析技术手段如质谱、高效液相色谱等。 /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " 在进行 strong 免疫学检测 /strong 时,主要对疫苗原免疫学特性进行鉴定。包括体外鉴定技术,如凝集试验、免疫沉淀试验、蛋白质印迹等检测疫苗重要组分的免疫原性、免疫反应性;体内鉴定,主要指动物实验。在对动物接种后检测各种免疫学指标,以判定疫苗之效果,同时也可观察疫苗的不良反应和毒性作用。 /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " 在进行 strong 微生物检测 /strong 时,以组织培养、电镜技术检测是否有病毒污染,以纯菌实验检测诸如减毒活菌苗自身菌体的活菌量、总菌量以及是否有其他杂菌的存在。 /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " strong 疫苗检测及相应质量控制中用到哪些技术与仪器? /strong 您可点击仪器信息网相关资讯查看: span style=" color: rgb(0, 112, 192) " a href=" https://www.instrument.com.cn/news/20190621/487427.shtml" target=" _blank" title=" 疫苗" style=" text-decoration: underline " span style=" color: rgb(0, 112, 192) " 疫苗管理法出台在即 将严抓疫苗生产、检验和质量控制 /span /a /span /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" font-size: 18px color: rgb(255, 255, 255) background-color: rgb(79, 129, 189) " strong 不可不知的“最严格”疫苗管理法 /strong /span /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " 前段时间“最严格”疫苗管理法正式发布,自2019年12月1日起施行。该疫苗管理法对疫苗违法犯罪行为规定了严厉处罚和严肃问责,明确疫苗犯罪行为依法从重追究刑事责任;对有严重违法行为的责任人员,规定了行政拘留的处罚。 /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " 规定了生产、销售的疫苗属于假药的,并处违法生产、销售疫苗货值金额15倍以上50倍以下的罚款;生产、销售的疫苗属于劣药的,并处违法生产、销售疫苗货值金额10倍以上30倍以下的罚款。 /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " 详情点击查看仪器信息网相关资讯: a href=" https://www.instrument.com.cn/news/20190702/488152.shtml" target=" _blank" title=" 疫苗" span style=" color: rgb(0, 112, 192) " span style=" text-decoration: underline " “最严格”疫苗管理法正式发布!全国45家疫苗企业 10亿剂次年产能 /span /span /a /p p style=" text-align: justify text-indent: 2em line-height: 1.5em " span style=" color: rgb(242, 242, 242) " strong span style=" background-color: rgb(0, 112, 192) " 后记 /span span style=" background-color: rgb(255, 255, 255) " & nbsp /span /strong /span span style=" font-family: 楷体, 楷体_GB2312, SimKai " 接种疫苗是最普遍的预防和控制疾病的措施,但疫苗的质量安全关系到生命健康。一方面,希望商家不要被利益蒙蔽双眼和良知,要敬畏生命,守住做人的底线;另一方面,相应的监督部门一定要对疫苗的生产标准、质量控制、尤其流通环节进行严格管控,让大众得以信赖,用到放心、安心的疫苗产品。 /span /p p style=" text-align: center text-indent: 0em line-height: 1.5em " span style=" background-color: rgb(255, 192, 0) " strong 扫码关注 span style=" background-color: rgb(255, 192, 0) color: rgb(0, 112, 192) " 【3i生仪社】 /span ,解锁生命科学行业新鲜资讯! /strong /span /p p style=" text-indent: 0em text-align: center line-height: 1.5em " span style=" background-color: rgb(255, 192, 0) " strong /strong /span /p p style=" text-align: center line-height: 1.5em " img style=" max-width:100% max-height:100% " src=" https://img1.17img.cn/17img/images/201907/uepic/f4d8610e-d22e-4e2c-835e-d62fa5c21fd6.jpg" title=" 小icon.jpg" alt=" 小icon.jpg" / /p