兽用疫苗分离纯化研究进展
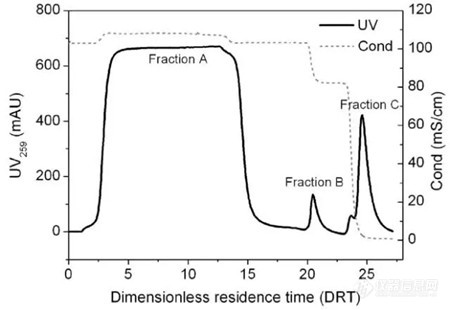
p strong span style=" color: rgb(112, 48, 160) " 兽用疫苗很重要 /span /strong /p p 我国是全球最大的家禽、家畜生产国和消费国。兽用疫苗在家禽、家畜疾病的预防和控制中发挥了重要作用,为畜牧业的健康和可持续发展提供了重要保障。我国的兽用疫苗从无到有,从粗放式到规范化快速发展,已发展成为一个品种多、覆盖面广的高增长行业。2015年的市场规模已达120多亿元,近7年年均复合增长率超过17%,在未来的5-10年里仍将保持13-15%的高速增长。 /p p 为保证疫苗的安全性和有效性,降低接种疫苗的副作用和杂质的免疫干扰,需要对疫苗进行有效的分离纯化,去除细胞培养液中的其它杂质,提高疫苗有效成分的含量和纯度。 /p p 由于兽用疫苗对生产成本控制要求极高,以及早期人们对兽用疫苗纯化技术与工艺缺乏系统的研究,传统的纯化技术大多采用微滤、超滤、沉淀(PEG沉淀、硫酸铵沉淀等)、超速离心等初级的纯化方法,杂质去除效果有限,导致疫苗纯度低、安全性差、副作用大。 /p p 随着市场对高端疫苗需求的日益扩大,疫苗研发机构及生产厂家对提高疫苗质量的重视和投入,以往人用疫苗纯化所采用的各种层析技术及分析检测技术逐渐开始应用于兽用疫苗的分离纯化和分析检测中来。与人用疫苗相比,兽用疫苗对生产成本极其敏感,对纯度要求相对较低,如何简化纯化工艺、提高纯化效率、降低纯化成本,对于兽用疫苗的产业化尤其重要。 /p p strong span style=" color: rgb(112, 48, 160) " 需要什么样的兽用疫苗 /span /strong /p p 为保证疫苗的安全性和有效性,降低接种疫苗的副作用和杂质的免疫干扰,需要对疫苗进行有效的分离纯化,去除细胞培养液中的其它杂质,提高疫苗有效成分的含量和纯度。 /p p 由于兽用疫苗对生产成本控制要求极高,以及早期人们对兽用疫苗纯化技术与工艺缺乏系统的研究,传统的纯化技术大多采用微滤、超滤、沉淀(PEG沉淀、硫酸铵沉淀等)、超速离心等初级的纯化方法,杂质去除效果有限,导致疫苗纯度低、安全性差、副作用大。 /p p 随着市场对高端疫苗需求的日益扩大,疫苗研发机构及生产厂家对提高疫苗质量的重视和投入,以往人用疫苗纯化所采用的各种层析技术及分析检测技术逐渐开始应用于兽用疫苗的分离纯化和分析检测中来。与人用疫苗相比,兽用疫苗对生产成本极其敏感,对纯度要求相对较低,如何简化纯化工艺、提高纯化效率、降低纯化成本,对于兽用疫苗的产业化尤其重要。 /p p strong span style=" color: rgb(112, 48, 160) " 传统疫苗纯化技术 /span /strong /p p strong span style=" color: rgb(0, 112, 192) " 沉淀法 /span /strong /p p 沉淀法,即通过向蛋白质溶液中加入盐、有机溶剂、聚合物,改变溶液的pH或温度,从而使蛋白质沉淀出来的方法。最常用的沉淀剂主要有硫酸铵、硫酸钠、乙醇、丙酮、PEG等。例如在口蹄疫病毒的纯化中,所采用的沉淀方法主要包括硫酸铵沉淀法、PEG沉淀法、等电点沉淀法、鱼精蛋白沉淀法等。沉淀法对疫苗的纯化效果有限,单步处理所得到的疫苗纯度质量较低,往往作为样品预处理的一种有效方法。 /p p strong span style=" color: rgb(0, 112, 192) " 超滤法 /span /strong /p p 超滤法是利用超滤膜在一定的驱动力下使水、无机盐等小分子通过,截留一定大小的大分子或病毒等颗粒,进而使大颗粒得到浓缩的方法。超滤法已成为蛋白质浓缩和缓冲液置换的首选方法。超滤膜的材料一般选用聚砜、聚醚砜等多聚物 而在疫苗等生物大分子领域,应用最多的是再生纤维素。超滤法是从大量病毒原料液中浓缩病毒样品的一种非常快捷高效的方法,其优点是操作条件简单、处理量大、疫苗损失小 在进行浓缩的同时还可以根据分子大小的差异(类似凝胶过滤层析)起到一定的纯化效果,但超滤法的选择性不高,只能透过或截留一定分子量的物质,使得最终得到的浓缩液中还会含有大量的大分子杂质,分辨率低于凝胶过滤层析。在超滤过程中,选择合适的膜组件以及优化合适的操作条件,对疫苗回收率的影响非常大。此外,疫苗等分子在膜上的吸附和超滤过程中的浓差极化现象,对超滤的应用效果也有显著的负面影响。 /p p 王振辉等[1]采用超滤方法对效力检验不合格的猪繁殖与呼吸综合征(PRRS)病毒灭活液进行浓缩和纯化处理(0.6/0.8/1.0微米的微滤膜过滤碎片等杂质、陶瓷膜过滤器(10k)浓缩和纯化、0.22微米滤膜无菌过滤)。结果表明,杂蛋白去除率达到62-70% 免疫至63 d时中和抗体效价(ELISA)平均高达245.7 稀释倍数,比常规疫苗中和抗体效价平均高出66.3 稀释倍数。 /p p strong span style=" color: rgb(0, 112, 192) " 超速离心法 /span /strong /p p 超速离心技术主要包括差速离心和密度梯度离心2种类型,可用于样品浓缩、样品分析和生物大分子(病毒颗粒等)的分离纯化。差速离心法常用于对纯度和产量要求不高时的分离,通过不同的离心速度使颗粒从溶液中沉淀出来,并根据目的蛋白所在的位置选择保留上清还是沉淀。差速分离最常见的实际应用是通过其他手段浓缩和纯化上清液中的病毒之前,用差速离心法去除病毒裂解物中的细胞碎片等杂质。通过差速离心法能够将病毒离心沉淀与小颗粒的杂质分开,但是在沉淀或重悬过程中,病毒的结构可能会被破坏 此外一些病毒沉淀后难以再溶解,这就影响后续的纯化或分析。如果要得到活性和结构良好、分散均一并且纯度较高的病毒样品,那么就应该考虑密度梯度离心法。 /p p Kaaden O R等[2]人先用PEG沉淀法(PEG 6000、8-10%(W/V)浓度)从BHK-21型细胞病毒养液中对口蹄疫病毒(FMDV)进行预处理,然后采用蔗糖密度梯度离心,得到高纯度的口蹄疫病毒。Barzilai R[3]等人通过氯化铯密度梯度离心,直接从细胞质裂解液中获得了FMDV纯品,回收率达到95%。但超速离心存在操作繁琐、离心时间长、重复性差、设备成本高、处理量小、不易于放大等问题,只适用于实验室规模的病毒纯化和分析,难以满足工业化生产需求。 /p p strong span style=" color: rgb(0, 112, 192) " 新型疫苗纯化技术 /span /strong /p p 层析技术具有分辨率高、操作条件温和、重复性好、易于放大、分离系统可实现管道化和自动化(更好满足密闭无菌要求)等突出优势,在生物制品(重组蛋白、疫苗、抗体等)的分离纯化中扮演着极其重要的角色。层析技术应用广泛,在疫苗纯化中已有大量成功的案例,绝大多数人用疫苗(乙肝疫苗、百日咳疫苗、狂犬疫苗等)都采用层析技术进行纯化和大规模生产[3]。 /p p 层析技术根据分离原理的不同,主要包括凝胶过滤层析、离子交换层析、疏水层析和亲和层析4大类。各种层析技术的特点和应用情况如表1所示,其中离子交换层析技术的应用最为广泛。 /p p strong 表1.层析技术的特点和应用情况 /strong /p p /p table border=" 0" cellpadding=" 0" cellspacing=" 0" width=" 648" colgroup col width=" 72" span=" 5" style=" width:54pt" / /colgroup tbody tr height=" 18" style=" height:13.5pt" class=" firstRow" td height=" 13" class=" xl63" style=" border-color: windowtext border-width: 1px border-style: solid " width=" 129" 层析技术 /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" 特点 /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" 捕获& nbsp /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 130" 精纯& nbsp /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 130" 精制 /td /tr tr height=" 18" style=" height:13.5pt" td height=" 13" class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" 离子交换 /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" 高分辨率、高载量、高流速;低盐上样 /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" *** /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 130" *** /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 130" *** /td /tr tr height=" 18" style=" height:13.5pt" td height=" 13" class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" 台风(TY) /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" 高分辨率、中等载量、高流速;高盐上样 /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" ** /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 130" *** /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 130" * /td /tr tr height=" 18" style=" height:13.5pt" td height=" 13" class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" 凝胶过滤 /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" 高分辨率;低载量、低流速 /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" - /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 130" * /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 130" *** /td /tr tr height=" 18" style=" height:13.5pt" td height=" 13" class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" 亲和 /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" 高分辨率、中/高载量、高流速 /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 129" *** /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 130" *** /td td class=" xl64" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 130" ** /td /tr /tbody /table p 随着市场需求的扩大、研发机构及疫苗厂家的研发投入和技术积累,越来越多的兽用疫苗开始使用层析技术进行分离纯化,工艺开发和小批量制备取得了重要进展,部分产品已进入后续的中试放大阶段。中科院过程工程研究所生化工程国家重点实验室是我国分离纯化领域的知名机构和优势单位,拥有一支高水平的人才队伍、配置齐全的分离纯化和分析检测平台,在人用疫苗领域具有10多年的研发和产业化经验(与企业合作)。近年来在兽用疫苗的分离纯化、分析检测、结构稳定性研究等领域也开展了一系列富有成效的工作[4-7]。 /p p 苏志国、张松平等[4]通过对口蹄疫病毒结构特点的研究、培养液中杂质的组成和特性分析,在对介质选型、操作条件优化的基础上,建立了1条由离子交换层析和凝胶过滤层析组成的分离纯化工艺,口蹄疫灭活病毒的纯化倍数达到217倍,纯度达到95%以上,收率为37.5%。为提高疫苗的收率和降低纯化成本,又进一步研究疏水层析技术在口蹄疫病毒分离纯化中的应用效果,最终建立的由疏水层析、超滤浓缩和凝胶过滤层析组成的分离纯化工艺,取得了更好的分离纯化效果,纯化倍数达到247倍,收率达到75.4%,纯度接近电泳纯 该工艺进一步提高了疫苗收率,更有利于提高纯化效率和降低疫苗的纯化成本,为大规模制备口蹄疫灭活病毒疫苗奠定了基础。 /p p style=" text-align: center" img src=" http://img1.17img.cn/17img/images/201711/insimg/d040dc05-cfd0-42b9-87a8-be93c3088b2e.jpg" style=" " title=" 1_副本.jpg" / /p p style=" text-align: center" img src=" http://img1.17img.cn/17img/images/201711/insimg/a7545038-4f01-43fb-89d8-cd7b9eda952f.jpg" style=" " title=" 2_副本.jpg" / /p p style=" text-align: center" img src=" http://img1.17img.cn/17img/images/201711/insimg/8a3f7210-7fb4-4ec4-aa4b-89e9aec73c98.jpg" style=" " title=" 3_副本.jpg" / /p p 图1:丁基疏水层析分离纯化FMDV层析谱图 /p p 图2 :凝胶过滤层析精制纯化FMDV层析谱图 /p p 图3:图3 SDS-PAGE和Western blot分析(1、FMDV培养液,2、HIC初纯样品,3、超滤浓缩样品,4、凝胶过滤样品 5、凝胶过滤样品的VP1条带进行Western blot分析) /p p 除了灭活病毒疫苗,基因工程重组疫苗(重组蛋白抗原或重组融合(标签)蛋白抗原)也可以有效抑制病毒感染,有望发展成为更为安全有效的疫苗品种。基因工程重组疫苗,特别是带有标签的重组疫苗,分离纯化难度大大降低,分离效率大大提高。熊毅等[8]分别构建了带His和GST标签的重组表达载体,成功表达了A型口蹄疫病毒(FMDV)的结构蛋白VP1(包涵体形式),并分别采用金属螯合层析和GST亲和层析进行纯化,得到电泳纯的VP1蛋白 活性鉴定结果表明重组蛋白具有良好的特异性和抗原性,可用于易感动物的免疫及血清抗体筛查。 /p p strong span style=" color: rgb(112, 48, 160) " 疫苗检测技术 /span /strong /p p 分析检测技术应用于疫苗培养、纯化、质控的各个阶段。快速、准确地对疫苗进行分析表征,对于疫苗分离纯化工艺的开发和优化,意义重大。人用疫苗研究历史悠久、技术完善,相关技术都可以直接用于兽用疫苗的分析检测。疫苗表征内容主要包括纯度、结构和活性 相应的分析检测技术主要包括电泳(以及Western blot)、ELISA、高效液相色谱、超速离心、动态光散射、透射电镜、差示扫描量热等技术[4-8]。 /p p strong 表2 疫苗分析检测技术 /strong /p table border=" 0" cellpadding=" 0" cellspacing=" 0" width=" 648" colgroup col width=" 72" span=" 3" style=" width:54pt" / /colgroup tbody tr height=" 18" style=" height:13.5pt" class=" firstRow" td height=" 13" class=" xl65" style=" border-color: windowtext border-width: 1px border-style: solid " width=" 215" 技术名称 /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 特点& nbsp /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 应用& nbsp /td /tr tr height=" 18" style=" height:13.5pt" td height=" 13" class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 215" 电泳& nbsp /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 操作简单,定性半定量& nbsp /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 纯度、分子量 /td /tr tr height=" 18" style=" height:13.5pt" td height=" 13" class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 215" ELISA /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 体外活性& nbsp /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 活性表征 /td /tr tr height=" 18" style=" height:13.5pt" td height=" 13" class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 215" 高效液相色谱 /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 快速、准确 /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 纯度、颗粒大小、分子量 /td /tr tr height=" 18" style=" height:13.5pt" td height=" 13" class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 215" 场流分级 /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 无损伤表征疫苗真实结构 /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 纯度、颗粒大小、分子量 /td /tr tr height=" 18" style=" height:13.5pt" td height=" 13" class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 215" 高效液相色谱 /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 分析速度慢、操作繁琐 /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 纯度 /td /tr tr height=" 18" style=" height:13.5pt" td height=" 13" class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 215" 动态光散射 /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 快速、准确 /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 颗粒大小和分布 /td /tr tr height=" 18" style=" height:13.5pt" td height=" 13" class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 215" 高效液相色谱 /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 方便快捷直观昂贵 /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 分子大小和形貌 /td /tr tr height=" 18" style=" height:13.5pt" td height=" 13" class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 215" 差示扫描量热 /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 快速、疫苗稳定性条件筛选 /td td class=" xl65" style=" border-width: 1px border-style: solid border-color: windowtext " width=" 216" 结构稳定性 /td /tr /tbody /table p /p p 在上述分析检测技术中,疫苗结构及其变化的表征对于疫苗分离纯化工艺和产品保存稳定性的研究越来越引起研究者的关注。高效液相色谱(或场流分级)与光散射技术(如多角度激光)联用,广泛用于各种疫苗的颗粒大小、分子量,以及结构变化的表征[4, 6, 7]。差示扫描量热技术也被广泛应用于疫苗稳定性研究中,无论是分离纯化过程中疫苗稳定结构条件(温度、缓冲液(pH、盐种类和浓度)、添加剂等)的筛选,还是疫苗成品的制剂研究[5]。 /p p strong span style=" color: rgb(112, 48, 160) " 结论与展望 /span /strong /p p 我国兽用疫苗市场潜力巨大,未来一段时间都将保持高速发展的态势。近年来,疫苗品质不断提高,市场逐步由政府招标向市场化转变,因此,疫苗分离纯化必将成为今后疫苗发展的重要趋势,只有经过浓缩、纯化等技术处理的高品质疫苗,才有可能在越来越激烈的市场竞争中占有一席之地。 /p p 单从技术层面来看,兽用疫苗和人用疫苗的分离纯化与分析检测技术是相通的。目前广泛用于各种人用疫苗分离纯化和分析检测的技术都可用于兽用疫苗研发和生产中。但在市场价格方面,与人用疫苗相比,兽用疫苗市场价格相对较低,因此兽用疫苗的工业化生产对分离纯化技术及成本控制的要求也极为苛刻。如何借鉴人用疫苗的分离纯化技术和成功经验,设计和简化纯化工艺、提高疫苗稳定性和疫苗收率、降低介质等关键材料的使用成本,对于高端兽用疫苗的研发和产业化,意义重大。 /p p strong span style=" color: rgb(112, 48, 160) " 作者介绍 /span /strong :黄永东,博士,中科院过程工程研究所副研究员,长期致力于蛋白质分离纯化工艺研发和层析分离介质研制工作。先后主持了9项国家自然科学基金、国家重点研发计划等课题,以及多项和生物医药企业的合作课题 先后开发了乙肝疫苗、百日咳疫苗、胸腺肽等多种生物活性物质的分离纯化工艺,以及10多种层析分离介质,相关技术和产品在200多家科研单位和企业得到应用。在纯化工艺开发和介质筛选等方面具有高超的理论水平和丰富的实战经验。 /p p strong span style=" color: rgb(112, 48, 160) " 参考文献 /span /strong /p p [1] 武桂梅, 何玉友, 王振辉, 李鹏, 郑洪娟. 膜分离法纯化浓缩猪繁殖与呼吸综合征灭活病毒的效果试验. 中国兽医杂志, 2015, 51 (9): 99-102. /p p [2] Kaaden OR, Dietzschold B, Matheka HD, Tokui T. Konzentrierung und Reinigung von Maul-und-Klauenseuche-(MKS-) Virus durch Polyä thylenglykol (PEG). Archiv fü r die gesamte Virusforschung, 1971. 35(1): 104-113. /p p [3] Barzilai R, Lazarus L H, Goldblum N. Viscosity-Density Gradient for Purification of Foot-and-Mouth Disease Virus. Archly fü r die gesamte Virusforschung, 1972, 34: 141-146. /p p [4] Li H, Yang YL, Zhang Y, Zhang SP, Zhao Q, Zhu YY, Zou XQ, Yu MR, Ma GH, Su ZG. A hydrophobic interaction chromatography strategy for purification of inactivated foot and mouth disease virus. Protein Expression and Purification, 2015, 113: 23-29. /p p [5] Yang YL, Zhao QZ, Li ZJ, Sun LJ, Ma GH, Zhang SP, Su ZG. Stabilization study of inactivated foot and mouth disease virus vaccine by size-exclusion HPLC and differential scanning calorimetry. Vaccine, 2017, 35: 2413-2419. /p p [6] Chen Y, Zhang Y, Zhou YF, Luo J, Su ZG. Asymmetrical flow field-flow fractionation coupled with multi-angle laser light scattering for stability comparison of virus-like particles indifferent solution environments. Vaccine, 2016, 34: 3164-3170. /p p [7] Yang YL, Li H, Li ZJ, Zhang Y, Zhang SP, Chen Y, Yu MR, Ma GH, Su ZG. Size-exclusion HPLC provides a simple, rapid, and versatile alternative method for quality control of vaccines by characterizing the assembly of antigens. Vaccine 33 (2015) 1143–1150 /p p [8] 颜健华, 何奇松, 蒋家霞, 冯淑萍, 黄胜斌, 韦达有, 易春华, 许瑞胜, 梁晟, 熊毅. A型口蹄疫病毒结构蛋白VP1的原核表达、纯化及鉴定. 南方农业学报, 2016, 47 (2): 301-305. /p p br/ /p