化学药品中杂质控制及测定方法
我国生物制品质控水平基本接轨国际中国药学会生物药品与质量研究专业委员会成立大会暨生物制品质量评价创新研究与发展趋势论坛在日前召开的2012年中国药学大会暨第12届中国药师周期间举办。有关专家在会上表示,经过努力,我国生物制品质量控制整体技术能力已提升至国际先进水平,质控水平基本和国际接轨,部分产品的质控指标甚至超过国际同类产品。 全国人大常委会副委员长、中国药学会理事长桑国卫院士表示,随着生物医药产业的迅速崛起,其临床治疗领域不断扩大,人们对生物医药产品的需求也日益增加,由此导致全球生物医药研发快速发展。目前,生物制品占世界医药市场份额已达到医药产品的1/3,成为国际竞争的焦点,细胞工程药物、基因工程药物、人源化单克隆抗体、重组疫苗等不断涌现。 生物制品是以微生物、细胞、动物或人源组织和体液等为原材料,应用传统技术或现代生物技术制备而成的疫苗、抗毒素及免疫血清、血液制品、重组DNA及抗体产品等制品。它在人类疾病的预防、治疗和诊断中发挥了极其重要的作用。桑国卫谈到,我国是研发和生产各种生物制品的大国,现有疫苗生产企业34家,血液制品生产企业30家,重组技术产品生产企业约40家,各类相关研发机构600余家,众多科研院所正在进行生物制品的研发工作。桑国卫强调,生物制品的质量和疗效是其享有竞争力的核心,也是一个产业长期发展的重要支柱。建立有效、科学、符合国际标准规范的生物制品的质量标准和检验方法,对支撑我国创新药物的研发及上市后产品健康快速发展,保障公众用药安全有效将发挥十分重要的作用。 中国食品药品检定研究院副院长王军志研究员介绍,我国生物制品产业经历了从小到大、从弱到强的发展过程。特别是2000年以来,在国家科技支撑计划、国家“863”计划、传染病重大专项和重大新药创制等项目支持下,我国研究建立了与国际接轨的质量控制技术体系,保证了我国上市的可预防26种传染病的48个疫苗纳入批签发管理。现每年签发疫苗近5000批次,近10亿人份,在确保产品质量的同时也保障了市场供给。该体系成功支持甲型H1N1流感疫苗、幽门螺旋杆菌疫苗、戊型肝炎疫苗和重组干扰素-a1b、神经生长因子、重组人p53腺病毒注射液等国家一类新药在国际率先上市。 “目前,我国生物制品质量控制水平已基本和国际接轨,部分产品的质控指标甚至超过国际同类产品。”王军志举例说,比如:在2010年10月配合国家卫生部消灭麻疹行动计划中,10天集中接种完成的1.1亿儿童接种麻疹减毒活疫苗,其不良反应低于国际平均水平,证明疫苗安全有效。2009年率先上市的甲流H1N1疫苗两个月应用近1亿人份,研究结果均证明产品质量可靠。我国疫苗监管体系(NRA)已于2011年3月1日正式通过世界卫生组织(WHO)的评估,标志我国生物制品质量控制整体技术能力提升至国际先进水平,同时也为国产疫苗走出国门创造了条件。 桑国卫认为,伴随着NRA正式通过WHO的评估,以及中国食品药品检定研究院申请加入WHOCC实验室和WHOPQ实验室的进程不断推进,我国生物制品走向国际指日可待。
[em0801][em0802]药品质量管理是一个复杂的体系,是一个大的系统工程。至少包括五个子系统,从药品的研究(GLP/GCP)开始,经过生产(GMP/GAP)、经营(GSP)、使用(GUP)、最后是药品上市后的再评价(ADR)。只有这五个阶段的质量都得到可靠的保证,整个药品的质量才可万无一失。它们构成了药品质量管理的完整链环。本讲义针对这五方面展开![img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=108451]药品质量管理与质量控制[/url]
亲们,我刚接手药品质控部qc检验的文件管理工作。之前没有这一岗位,没有可以借鉴的经验。关于管理规程、操作规程、检验记录等文件如何受控、发放、归档、回收、作废等管理没有具体的管理制度。恳请各位大神帮忙指点一二。不胜感激!
参加2015年中国药品质量安全年会公开课件(pdf版),学习,交流,分享01-化学药品质量状况及风险分析02-中国制药工业发展现状与展望03-药品安全与化学药品国家标准浅谈04-从药剂师的角度看药物风险管理05-我国化学制药大输液的生产情况及其风险控制06-多组分生化药品质量风险控制要点07-药用辅料对仿制药一致性评价的影响08-抗病毒类化学药物的质量分析09-三种药用酶的质量研究10-脂肪乳注射液质控要点及质量分析11-艾司唑仑片评价方法研究经验分享12-酒石酸美托洛尔片评价方法研究经验分享13-拉米夫定片评价方法研究经验分享14-药品检验方法的质量评价
随着“欣弗”、“齐二药”等药品不良事件的发生,药品质量成为药品研发、生产、评价、监管、使用等各环节最关注的焦点。如何对药品生产全过程进行良好的质量控制,从而获得高质量的药品以满足临床需要,是药品研发者、生产者以及评价者共同关心的问题。本人结合对审评工作中的一些浅显认识,就有效改进质量控制模式,提升质量控制水平提出一点个人不成熟的看法,欢迎大家批评指正。所谓质量控制,其范围包括了为确保药品的质量可控性并进而对安全有效性提供支持的全部药学研究工作,强调了对原料或制剂生产全过程进行控制,是药品研发和生产的关键环节和基础。目前一般认为,质量控制包括过程控制和终点控制两方面,其中过程控制与生产过程同步进行,以经验证的参数为依据,可在全过程中进行多点控制;而终点控制属于滞后行为,于生产结束后进行,并以质量标准为依据进行单点控制。总体上,在实际生产过程中,应以过程控制和终点控制双管齐下的模式进行,以便持续地规模化生产出质量稳定、安全有效性有保障的药品。纵观我国药品生产的历程,不难发现,根据对过程控制和终点控制权重的认识和把握,质量控制方面存在着检验模式??生产模式??设计模式的逐级递进:1、检验模式检验模式主要特征为仅通过终端检验确认药品质量,惯常的做法是以药品质量标准为检验依据,根据质量研究以及稳定性结果判断药品质量是否符合标准的限度要求,并进而判断药品质量是否符合要求。在我国药品研发的早期,此种模式应用普遍,然而已不能满足现阶段对药品质量的要求:1.1 质量标准的局限性导致无法全面体现药品质量。通常,不论自拟标准还是已有国家标准,都无法将检查项目覆盖到药品质量的方方面面,这样就不可避免会出现药品某一方面质量已不符合要求但仍能通过标准检验的情况。例如,多数质量标准都不会将辅料的相关检查项订入标准,而如果辅料种类发生替换,必然影响药品质量,却无法通过标准检验获知这一改变。1.2 质量标准部分项目无法反映药品质量实际情况。即使对于已订入标准的项目,因其自身的局限性也会导致无法反映药品质量。以无菌检查为例,由于微生物在药品中的分布不均匀,且抽检样品数量有限,故所得结果不能真实代表整批药品的无菌状态。1.3 依据标准检验可能会导致一旦产生质量问题难以着手加以解决。依据质量标准只能进行是非判断,无法对异常原因进行溯源。以溶出度为例,如某批片剂药品溶出度检查不合格,而影响溶出度不合格的因素有很多,处方种辅料的来源、性能、制粒过程、中间体粒度、干燥时间、压片压力等等都在其中,此时无法简单判断引起变化的关键点,必须逐项排查,无形中降低了效率,提高了成本。综上,单一的检验模式已不能有效对药品的质量进行控制。2、生产模式鉴于检验模式的局限,业界在上个世纪九十年代参考国外药品生产情况进一步提出了“好的药品是生产出来的,不是检验出来的”这一观点,并正式引入了生产模式概念。生产模式的核心是在检验模式的基础上,将控制重心前移至生产过程中,通过强化过程控制来保证药品质量。与检验模式相比,生产模式在一定程度上解决了一些问题:2.1 全面的过程控制可较好体现药品质量。与质量标准不同,生产过程的全程控制对药品质量有了全方位的覆盖,更能全面反映药品实际质量。只要控制点完善合理,任何未纳入质量标准而可能影响产品质量的因素都会得到有效控制。2.2 与质量标准不同,如果控制得当,质量即可得到保证。仍以无菌检查为例,对于注射液,只要进行了规范的灭菌工艺研究和验证,例如掌握了灭菌前微生物污染水平且灭菌工艺经微生物挑战试验,通过F0的计算,就能保证产品的无菌保证水平(Sterility Assurance Level, SAL)≥6,符合无菌安全性要求。2.3 多数问题得以避免且一旦发生可及早解决。通过过程跟踪,中间体或终产品如出现问题可及时追溯到原因。仍以溶出度为例,如通过过程控制发现某批片剂在制粒干燥过程中设备温度曾发生过变化,其他步骤均无明显变化,最终产品溶出度不合格,则必然是干燥步骤带来的影响,可马上针对此点加以解决。综上,生产模式可较好地保证药品质量。然而,仅仅通过对生产过程的监控来被动“保证”产品质量还不足够,仍需进一步考虑措施主动“决定”药品质量。3、设计模式基于生产模式仍不能完全满足质量控制要求,近两年,国外特别是美国FDA提出了“质量源于设计(Quality by Design, QbD)”的概念,进一步指出如果要确定药品质量,必须有好的设计作为前提,也就是说,好的药品是通过良好设计而生产出来的,如此一来,设计模式的概念应运而生(FDA关于QbD的试点工作将另行撰文介绍)。该模式的核心是在生产模式的基础上,将控制重心进一步前移,在最初确定研发目标时就强化全盘设计的理念,通过系统的设计,预估出拟生产产品的质量,并严格生产过程以达到预期的药品质量。与生产模式相比,设计模式使得提升药品质量成为可能。常规的QbD模式思路是:首先确认目标(该目标不仅仅指一个具体药物或制剂,而是包括了该药物或制剂的相关物理、化学、生物学等具体指标),在设计理念已确认到位的前提下,全方位收集设计目标的相关信息(包括理论、文献以及试验信息),然后全面考虑确定生产方案设计,并通过试验等手段确定关键影响因素(Critical Quality Attributes, CQAs),同时将所有的CQAs与原辅料影响因素和工艺参数关联,根据认知和对工艺的控制程度,逐步建立设计空间(Design Space),最终完成设计并完善整体战略方案,并在药品整个生命周期(Life Cycle)包括后续的质量提升过程中进行有效管理。应该说,药品质量在这样的模式应能得以真正的控制。除了控制产品质量,QbD还很好地在设计中引入风险评估概念,通过对每一设计步骤的评估,可更好地帮助药品研发者判断前进方向(即使是通过评估认为应停止继续研发,及时中止研发也是风险的降低),引导研发。此外,QbD的设计空间对于变更研究还有重要的意义:只要空间设计合理,在所述设计空间内,生产工艺的调整变更风险明显降低,这也有助于药品监管当局拓展出更灵活的变更管理办法。总体来说,设计模式对目前的药品质量控制有很大优势。
随着新版《药品注册管理办法》的实施,对药品注册的相关技术提出了新的要求,特别是抗生素类高风险产品,目的是全面提升注册上市药品的质量和品质。 杂质研究是药物质量控制研究的重要项目。对抗生素而言,由于其多为半发酵、半合成产品,所含的杂质种类与杂质含量都比普通合成化学药物复杂;同时由于国内抗生素使用范围较广,面临的安全性问题更为突出,因此,杂质研究和杂质控制更是抗生素质量控制研究的关键项目。 对于仿制国内外已上市抗生素的品种,根据仿制药的基本技术要求,应选择被仿药物进行系统的质量对比研究,以保证其质量的一致性。 在杂质研究方面,根据相关技术要求,结合我国抗生素生产和研发的历史以及现实情况,提出如下要求:
随着公众对药物安全性的日益关注,控制药物中杂质已成为控制药品质量的关键因素之一,也是困扰着广大药物分析工作者的难题之一。由于药物杂质的来源广泛,已知的杂质可以通过现有的分析手段进行定性定量,未知的杂质则成为分析的难题,因此对于药品的杂质控制首要解决的问题就是将所有杂质进行完全分离。为了让广大药物分析工作者能实现有效地药品杂质控制,全国医药技术市场协会于2012年4月10日-13日在上海市举办“2012药物研究分析中新技术、新方法应用及杂质控制研讨会”。 制药企业和新药研究机构的研发人员,各级药品检验所(院)和口岸药品检验所人员,药品生产企业研发技术与质量管理负责人,新药研发CRO实验室人员及高管,各高等院校、科研院所等相关专业人员100多人参加了此次会议。 在此次会议上,多位行业知名专家钟大放(中科院药物研究所),王洪允(协和医院临床药理中心),胡昌勤(中国食品药品检定研究院),周立春(北京市药检所),王玉(江苏省检品检验所),张尊建(中国药科大学分析测试中心)分别讲解了当前药物分析领域中各种新技术、新方法,探讨分析新技术在药品研发及药品质量控制中的应用,特别是用于生物标志物、活性成份、药物代谢等高通量、定性、定量的各种分析技术,以及新版药典对药物分析方法新要求与国外药典比较等内容。 作为全球色谱消耗品领先的制造商,迪马科技一直致力于为食品、药品检测行业提供完善的技术服务,除与参会专家进行技术交流外,迪马科技技术应用工程师还与广大与会者共同分享了《Dikma 高效液相色谱柱技术应用于药品杂质控制分析》技术报告。 对于药品中杂质控制分析,首先要借助色谱柱进行良好的分离,迪马科技在此次技术报告中重点讲解了在杂质控制中色谱柱的分离性能所起关键作用及迪马科技多款液相色谱柱:Ø Diamonsil(钻石)—通用型反相色谱柱,超高的分离性能特别适合分析复杂的样品及杂质;Ø Spursil(思博尔)—通用型极性改性反相色谱柱,耐受100%水相-100%有机相,特别适用于强碱性化合物和极性化合物的分析;Ø Endeavorsil(奋进)—1.8 μm UHPLC专用色谱柱,超高的柱效满足您UHPLC分离杂质的需求;Ø Leapsil(飞跃)—2.7μm兼容UHPLC/HPLC色谱柱,低柱压设计,高选择性可在HPLC上拥有UHPLC色谱柱的分离能力;[font=Wing
品质控制模式导语“我们有做好产品的初衷,我们也愿意花代价,但产品还是差强人意”,这是围绕很多杭州开发商的困惑。专业态度、经验、人才、组织结构、制度化、程序化……这是品牌开发商实现品质控制的要素。品质开发商具备三种能力绿城集团执行总经理 马力品质房产开发商必须同时具备三种能力:整合资源能力,品质控制能力,学习、借鉴、总结和创新能力。这三种能力将是衡量开发商核心竞争力的坐标。绿城认为,规划设计的品质直接决定房产品的品质,因为房产品开发理念是通过规划设计得以实现,并据此作为施工依据。目前绿城已聚集了数以百计的优秀设计师,有一批规划设计方面的专家从企业内部成长。项目规划设计工作正式展开以前,绿城就根据项目的特征,邀请国内外擅长该类产品设计的著名规划设计师、建筑师,共同进行项目的考察、研究,参与方案的规划设计。绿城已逐步建立、提升和完善了公司内部的专业管理团队,通过专门的规划设计管理部门和控制流程来整合、统筹、集成和协调把控各设计阶段的品质。绿城成立了规划、建筑、景观、户型、精装修五个专家小组,一个产品的定型,设计往往经历了多次的专家小组评审,无数次的修整。绿城设计流程近年来已有比较大的变化,以前往往是拿到一块土地,就去请人设计,做完设计以后,再去请销售策划专家做推广,最后等主体下来,才开始做景观,可以说是一个单线串联方式。现在,绿城正逐步建立起一套科学、优化的“立体交叉设计”流程,即在规划设计阶段,甚至在方案阶段,就开始同步进行规划、建筑、景观、室内精装修及各专业设计,各项工作“齐头并进”,以达到项目的规划、设计的经济性、科学性、领先性和人性化等方面整体最优目的。同样的设计单位,没有开发商品质控制的能力,仍然难以达到高品质,至少会大打折扣。
品质控制的基本知识品质控制的演变1.操作者控制阶段:产品质量的优劣由操作者一个人负责控制。.班组长控制阶段:由班组长负责整个班组的产品质量控制。3.检验员控制阶段:设置专职品质检验员,专门负责产品质量控制.4.统计控制阶段:采用统计方法控制产品质量,是品质控制技术的重大突破,开创了品质控制的全新局面。5.全面质量管理(TQC):全过程的品质控制。6.全员品质管理(CWQC):全员品管,全员参与二,品质检验方法1、全数检验:将送检批的产品或物料全部加以检验而不遗漏的检验方法。 适用于以下情形:①批量较小,检验简单且费用较低;②产品必须是合格;③产品中如有少量的不合格,可能导致该产品产生致命性影响。2、抽样检验:从一批产品的所有个体中抽取部分个体进行检验,并根据样本的检验结果来判断整批产品是否合格的活动,是一种典型的统计推断工作。①适用于以下情形:a. 对产品性能检验需进行破坏性试验;b. 批量太大,无法进行全数检验;c. 需较长的检验时间和较高的检验费用;d. 允许有一定程度的不良品存在。②抽样检验中的有关术语:a.检验批:同样产品集中在一起作为抽验对象;一般来说,一个生产批即为一个检验批。可以将一个生产批分成若干检验批,但一个检验批不能包含多个生产批,也不能随意组合检验批。b.批量:批中所含单位数量;c.抽样数:从批中抽取的产品数量;d.不合格判定数(Re):Refuse的缩写即拒收;e.合格判定数(Ac):Accept的缩写即接收;f.合格质量水平(AQL):Acceptable Quality Level的缩写。通俗地讲即是可接收的不合格品率。3、抽样方案的确定: 我厂采用的抽样方案是根据国家标准GB2828《逐批检验计数抽样程序及抽样表》来设计的。具体应用步骤如下①确定产品的质量判定标准:②选择检查水平:一般检查水平分Ⅰ、Ⅱ、Ⅲ;特殊检查水平分S-1、S-2、S-3、S-4,一般情况下,采用一般水平Ⅱ。③选择合格质量水平(AQL):AQL是选择抽样方案的主要依据,应由生产方和使用方共同商定。④确定样本量字码,即抽样数。⑤选择抽样方案类型:如一次正常抽样方案,加严抽样方案,还是多次抽样方案。⑥查表确定合格判定数(AC)和不合格判定数(Re)。三、检验作业控制1、进料(货)检验(IQC):是工厂制止不合格物料进入生产环节的首要控制点。(Incoming Quality Control)①进料检验项目及方法 :外观:一般用目视、手感、对比样品进行验证;b尺寸:一般用卡尺、千分尺等量具验证;c特性:如物理的、化学的、机械的特性,一般用检测仪器和特定方法来验证②进料检验方法:a 全检, b抽检③检验结果的处理:a 接收 b拒收(即退货) c 让步接收 d全检(挑出不合格品退货)e 返工后重检④依据的标准:《原材料、外购件技术标准》、《进货检验和试验控制程序》、《理化检验规程》等等。2、生产过程检验(IPQC):一般是指对物料入仓后到成品入库前各阶段的生产活动的品质控制,即Inprocess Quality Control。而相对于该阶段的品质检验,则称为FQC(Final Quality Control)。①过程检验的方式主要有:a. 首件自检、互检、专检相结合;b. 过程控制与抽检、巡检相结合;c. 多道工序集中检验; d. 逐道工序进行检验;e. 产品完成后检验; f. 抽样与全检相结合;②过程品质控制(IPQC):是对生产过程做巡回检验。a. 首件检验; b. 材料核对;c. 巡检:保证合适的巡检时间和频率,严格按检验标准或作业指导书检验。包括对产品质量、工艺规程、机器运行参数、物料摆放、标识、环境等的检验 d检验记录,应如实填写。③过程产品品质检验(FQC):是针对产品完工后的品质验证以确定该批产品可否流入下道工序,属定点D检验或验收检验。a. 检验项目:外观、尺寸、理化特性等;b. 检验方式:一般采用抽样检验;c.不合格处理;d.记录;④依据的标准:《作业指导书》、《工序检验标准》、《过程检验和试验程序》等等。3、最终检验控制:即成品出货检验。4、品质异常的反馈及处理:①自己可判定的,直接通知操作工或车间立即处理;②自己不能判定的,则持不良样板交主管确认,再通知纠正或处理;③应如实将异常情况进行记录;④对纠正或改善措施进行确认,并追踪处理效果;⑤对半成品、成品的检验应作好明确的状态标识,并监督相关部门进行隔离存放。5、质量记录:为已完成的品质作业活动和结果提供客观的证据。必须做到:准确、及时、字迹清晰、完整并加盖检验印章或签名还要做到:及时整理和归档、并贮存在适宜的环境中。
裴夏收集整理 一.品质控制的演变 1.操作者控制阶段:产品质量的优劣由操作者一个人负责控制。 2.班组长控制阶段:由班组长负责整个班组的产品质量控制。 3.检验员控制阶段:设置专职品质检验员,专门负责产品质量控制。 4.统计控制阶段:采用统计方法控制产品质量,是品质控制技术的重大突破,开创了品质控制的全新局面。 5.全面质量管理(TQC):全过程的品质控制。 6.全员品质管理(CWQC):全员品管,全员参与。 二,品质检验方法 1、全数检验:将送检批的产品或物料全部加以检验而不遗漏的检验方法。 适用于以下情形: ①批量较小,检验简单且费用较低; ②产品必须是合格; ③产品中如有少量的不合格,可能导致该产品产生致命性影响。 2、抽样检验:从一批产品的所有个体中抽取部分个体进行检验,并根据样本的检验结果来判断整批产品是否合格的活动,是一种典型的统计推断工作。 ①适用于以下情形:a. 对产品性能检验需进行破坏性试验; b. 批量太大,无法进行全数检验; c. 需较长的检验时间和较高的检验费用; d. 允许有一定程度的不良品存在。 ②抽样检验中的有关术语: a.检验批:同样产品集中在一起作为抽验对象;一般来说,一个生产批即为一个检验批。可以将一个生产批分成若干检验批,但一个检验批不能包含多个生产批,也不能随意组合检验批。 b.批量:批中所含单位数量; c.抽样数:从批中抽取的产品数量; d.不合格判定数(Re):Refuse的缩写即拒收; e.合格判定数(Ac):Accept的缩写即接收; f.合格质量水平(AQL):Acceptable Quality Level的缩写。通俗地讲即是可接收的不合格品率。 3、抽样方案的确定: 我厂采用的抽样方案是根据国家标准GB2828《逐批检验计数抽样程序及抽样表》来设计的。具体应用步骤如下: ①确定产品的质量判定标准: ②选择检查水平:一般检查水平分Ⅰ、Ⅱ、Ⅲ;特殊检查水平分S-1、S-2、S-3、S-4,一般情况下,采用一般水平Ⅱ。 ③选择合格质量水平(AQL):AQL是选择抽样方案的主要依据,应由生产方和使用方共同商定。 ④确定样本量字码,即抽样数。 ⑤选择抽样方案类型:如一次正常抽样方案,加严抽样方案,还是多次抽样方案。 ⑥查表确定合格判定数(AC)和不合格判定数(Re)。 三、检验作业控制 1、进料(货)检验(IQC):是工厂制止不合格物料进入生产环节的首要控制点。(Incoming Quality Control) ①进料检验项目及方法 : a 外观:一般用目视、手感、对比样品进行验证; b尺寸:一般用卡尺、千分尺等量具验证; c特性:如物理的、化学的、机械的特性,一般用检测仪器和特定方法来验证。 ②进料检验方法:a 全检, b抽检 ③检验结果的处理:a 接收 b拒收(即退货) c 让步接收 d全检(挑出不合格品退货) e 返工后重检 ④依据的标准:《原材料、外购件技术标准》、《进货检验和试验控制程序》、《理化检验规程》等等。 2、生产过程检验(IPQC):一般是指对物料入仓后到成品入库前各阶段的生产活动的品质控制,即Inprocess Quality Control。而相对于该阶段的品质检验,则称为FQC(Final Quality Control)。 ①过程检验的方式主要有: a. 首件自检、互检、专检相结合;b. 过程控制与抽检、巡检相结合; c. 多道工序集中检验; d. 逐道工序进行检验; e. 产品完成后检验; f. 抽样与全检相结合; ②过程品质控制(IPQC):是对生产过程做巡回检验。 a. 首件检验; b. 材料核对;c. 巡检:保证合适的巡检时间和频率,严格按检验标准或作业指导书检验。包括对产品质量、工艺规程、机器运行参数、物料摆放、标识、环境等的检验 d检验记录,应如实填写。 ③过程产品品质检验(FQC):是针对产品完工后的品质验证以确定该批产品可否流入下道工序,属定点 检验或验收检验。a. 检验项目:外观、尺寸、理化特性等;b. 检验方式:一般采用抽样检验;c.不合格处理;d.记录; ④依据的标准:《作业指导书》、《工序检验标准》、《过程检验和试验程序》等等。 3、最终检验控制:即成品出货检验。(Outgoing Q.C) 4、品质异常的反馈及处理: ①自己可判定的,直接通知操作工或车间立即处理; ②自己不能判定的,则持不良样板交主管确认,再通知纠正或处理; ③应如实将异常情况进行记录; ④对纠正或改善措施进行确认,并追踪处理效果; ⑤对半成品、成品的检验应作好明确的状态标识,并监督相关部门进行隔离存放。 5、质量记录:为已完成的品质作业活动和结果提供客观的证据。 必须做到:准确、及时、字迹清晰、完整并加盖检验印章或签名。 还要做到:及时整理和归档、并贮存在适宜的环境中。[color=#DC143C](下文接着以下)[/color]
国家食药监管总局即日起至12月5号就《药品飞行检查办法(征求意见稿)》公开征求意见,药品飞行检查覆盖面大幅拓宽,药品监督管理将进一步规范和加强。此规定,将药品的飞行检查纳入整个药品监管的日常检查中,可以使我国的药品监管能力和水平进一步成熟、提高。 据中国之声《全国新闻联播》消息,国家食药监管总局即日起至12月5号就《药品飞行检查办法(征求意见稿)》公开征求意见, 药品飞行检查覆盖面大幅拓宽,药品监督管理将进一步规范和加强。 药品飞行检查 药品监管 药品质量 所谓“药品飞行检查”,是药品监督管理部门针对药品生产、经营等环节开展的不预先告知的突击检查或者暗访调查。在《药品飞行检查办法(征求意见稿)》之前,原国家食品药品监督管理局2006年《关于印发药品GMP飞行检查暂行规定的通知》是目前药监部门执法检查的主要依据。中国药学会医药政策研究中心执行主任宋瑞霖介绍,两者相比,征求意见稿的覆盖范围大大拓宽。 宋瑞霖:GMP是指导制药企业、保证药品质量的重要规范。我们从原料进料到生产全过程,GMP包括了最核心点,但它不是药品生产的全部。现在我们把GMP检查改成药品飞行检查,把它扩展到整个药品质量的控制体系中来了。 征求意见稿规定,被检查单位及有关人员应当及时按照检查组要求,提供真实、有效的记录、票据、凭证等相关材料,开放相关计算机管理系统,不得拒绝和隐瞒。不配合或者阻挠检查、拒绝提供或者提供虚假材料、故意隐瞒违法违规生产经营行为,其违法违规事实一经查实,按情节严重情形从重处罚。宋瑞霖表示,尽管相比当前的药品飞行检查规定,征求意见稿并没有作出大幅更改,但规范飞行检查、强化药品监管是大势所趋。 宋瑞霖:最大的区别是把药品的飞行检查纳入整个药品监管的日常检查中,我们的药品监管能力和水平进一步成熟、提高。

2015年04月16-17日第五届中国药品质量安全大会在杭州开元名都大酒店成功举行,此次大会组委会邀请中外著名专家学者、企业家代表出席,对我国药品安全相关法规政策及新的技术标准做解读,并进行新技术应用方案交流。吸引了全国各地方药检机构,制药企业、科研院所等领域专家和学者近600人前来交流学习。http://ng1.17img.cn/bbsfiles/images/2017/10/2015042216524214_01_1987954_3.jpg2015第五届中国药品质量安全大会会议现场迪马科技作为全球领先的色谱消耗品制造商,始终关注药品质量安全,并积极为药品检测机构及企业提供整体解决方案,开发了一系列关于药品含量测定、杂质分析、有关物质鉴定、药物合成等方面的应用。目前在迪马科技官网应用数据库可检索到的药品应用近千篇,《迪马科技产品发表文献集》收录的国内外使用迪马科技产品发表的药品质量安全文献近3500篇,以实际行动为药品质量安全保驾护航。http://ng1.17img.cn/bbsfiles/images/2015/04/201504221658_543079_1987954_3.jpg迪马科技应用数据库及产品发表文献集参与此次药品质量安全大会,迪马科技为与会药品分析工作者带来了多款可用于药品分析检测的气、液相色谱柱,特别带来了Diamonsil(钻石)家族新产品——Diamonsil Plus,该产品具有“超长使用寿命 & 极性改性 & 100%水相~100%有机相 & 快速分析 & 超高柱效”等多重优异性能于一身,极大扩展色谱柱应用范围,减少色谱柱选择和方法开发时间。同时超长的色谱柱使用寿命,极大降低色谱柱使用成本,为药品质量安全控制提供了检测利器。另外,迪马科技也为参会者现场实物展示了ProElut系列固相萃取柱、2 mL样品瓶、针头式过滤器等药品质量分析过程中涉及的色谱消耗品,各参会专家和学者纷纷前来与迪马工作人员进行交流,咨询相关产品及药品检测应用案例。两天的药品质量安全会议已落下帷幕,但迪马科技关注药品质量安全的行动仍将继续。我们将始终践行为药品安全保驾护航的诺言,以更多的应用,更好的产品服务于药品质量控制分析工作者。http://ng1.17img.cn/bbsfiles/images/2015/04/201504221659_543080_1987954_3.jpg迪马科技展位现场
3月26日,中国食品药品检定研究院(以下简称中检院)发布《国家药品抽检年报(2023)》(以下简称《年报》)。《年报》显示,2023年国家药品抽检共完成132个品种18762批次制剂产品与中药饮片的抽检任务,样品来源涉及1114家药品生产、2528家经营企业和511家使用单位,由中检院等47个承检机构负责检验样品,检出136批次不符合规定产品。抽检结果显示,当前我国药品安全形势总体平稳可控,药品质量持续保持在较高水平。 药品抽检作为药品上市后监管的重要手段之一,是实现风险管理、科学管理、监管前置的重要技术支撑。2023年,国家药监局紧紧围绕药品监管实际需求,聚焦重点任务,完善运行机制,创新监管方式,采取“分散抽样、集中检验、探索研究、综合评价”的抽检模式,此外,通过优化抽检模式,进一步提升抽检服务监管的效能。 抽检制剂产品16604批次 2023年国家药品抽检共抽检制剂产品16604批次。经检验,16531批次产品符合规定,73批次产品不符合规定。 在化学药品方面,共抽检74个品种10893批次,经检验不符合规定44批次,不符合规定项目包括检查和含量测定。 在中成药方面,共抽检43个品种5584批次,涉及11个剂型。经检验,不符合规定29批次,不符合规定项目主要涉及鉴别和检查。 在生物制品方面,共抽检6个品种127批次。经检验,所检项目均符合规定,合格率为100%。 根据制剂产品抽检结果,《年报》对生产企业、经营企业加强管理进行了提示,并给予监管部门建议。《年报》建议监管部门严格审查企业批生产记录,核查原辅料投料量,推动质量标准提升 加强对生产企业的监督检查,督促其严格按照处方工艺投料,严格执行GMP规范,从而保证中成药的质量及疗效。 《年报》还显示,2023年国家药品抽检共抽检国家基本药物39个品种6140批次,不符合规定13批次,国家基本药物整体质量状况较好 共抽检国家集中采购中选品种20个品种3435批次,集中采购涉及样品均符合规定,国家药品集中采购中选品种整体质量状况较好 共抽检进口药品309批次,均符合规定。 2023年,国家药监局继续组织开展中药饮片专项抽检,共抽检9个中药饮片品种2158批次,不符合规定63批次 继续组织开展中药材质量监测,共监测9个品种251批次样品。抽检及监测结果显示,我国中药饮片总体质量状况良好,但中药饮片全产业链参与者应进一步增强质量意识和责任意识,中药饮片生产企业应提升全程质量控制意识。 充分利用探索性研究利器 在国家药品抽检过程中,探索性研究可为进一步提升药品质量水平、加强药品监管提供技术支持。在多年技术储备的基础上,2023年各药品检验机构充分利用探索性研究这一监管利器,全面考察药品质量的稳定性、现行标准的完善性,同时探寻可能存在的潜在风险,为提升药品质量标准、提高监督管理水平提供科学可靠的技术支撑。 2023年国家药品抽检探索性研究发现的主要问题有:中药制剂生产中使用伪品、中药材及饮片掺伪问题仍然存在 个别企业违法违规生产问题,如擅自改变生产工艺,低限或使用伪品、替代品投料,擅自改变或添加辅料、防腐剂、抑菌剂等 因原料药质量差异、生产工艺不稳定等原因,导致产品均一性较差 外源性有害物质超限,个别批次产品重金属、农药、真菌毒素残留量超限 包装材料相容性问题影响产品质量稳定性等。 据《年报》,对探索性研究中发现的有关生产工艺、处方、原辅料、包装材料、说明书等方面可能存在的一般性问题,药品监管部门通过“药品质量提示函”等形式反馈相关企业,提升企业的质量意识,加强企业主体责任的落实。相关企业主动采取修订内控标准、完善工艺、加强供应商审计、修订说明书等整改措施,提升产品质量水平 各省级药监局也通过多部门联席会、约谈企业、风险沟通、跟踪检查等方式,利用提示信息强化对企业的监督指导。通过寓服务于监管的风险提示,加深了监管部门、药检机构和企业之间的信任与理解,促进了持有人主体责任的落实,是主动排查、预防为主监管方式的有益探索。 记者获悉,对探索性研究发现的个别企业涉嫌存在的违法违规线索,监管部门在综合分析研判的基础上,及时对涉及企业开展了有针对性的有因检查,并根据检查结果及时采用有效的风险控制等措施。例如,今年1月,湖北省药监局根据2023年国家药品抽检探索性研究结果对武汉贝参药业股份有限公司某厂区进行了有因检查,发现该公司杏苏止咳糖浆生产质量管理存在严重缺陷2项、主要缺项3项、一般缺陷8项,不符合《药品生产质量管理规范》(2010年修订) 2月21日,湖北省药监局发布公告,依据相关法律法规,决定暂停该品种的生产、销售。 应用结果推动产业提质升级 2023年,国家药监局通过政策支持、开展专项风险监测、深入排查风险、公开信息等方式加强抽检工作,并积极运用抽检成果持续提升药品质量,推动产业提质升级,助力产业高质量发展。 为推动抽检工作更加科学,国家药监局持续加强抽检制度建设和顶层设计,于2023年印发《关于进一步做好地方药品抽检有关工作的通知》,对地方抽检工作提出更为明确且具体的要求,加强国家与地方抽检的衔接互补。同时,持续推进药品抽检制度体系优化创新,健全完善抽检工作机制和工作程序,加快推进修订《药品抽检探索性研究原则及程序》,规范指导探索性研究 修订《药品抽样原则及程序》,细化完善中药材和中药饮片取样,探索网抽购样方式方法。据悉,《药品抽检探索性研究原则及程序》即将于近日发布。 近年来,国家药品抽检每年设置不同专项,对重点品种进行专项研究。2023年,针对可能的风险点,国家药品抽检还设置溶剂残留研究、网络抽检等专项,潜在风险得到有效控制,其中溶剂残留研究的相关工作成果已被收入《国际药典》。 2023年,国家药监局依照“风险控制-依法处置-排查原因并整改-信息公开”的监管模式,确保风险关闭、警示用药安全,严厉打击了制售假劣药品的行为,发挥震慑不法企业、净化市场环境的作用。此外,国家药监局在2023年共发布药品补充检验方法4个,为打击隐蔽性极强的掺杂掺假等违法行为提供了监管利器,也为企业提供了保障药品质量安全的科学依据。 2023年,国家药监局共发布药品抽检通告7期,对全部不符合规定药品及涉及企业依法公开,震慑不法企业、警示安全用药。中检院在官方网站持续公开国家药品抽检的探索性研究结果,新发布39个品种的新建检验方法,累计发布新建检验方法601个。通过信息的共享利用,进一步促进药品上市许可持有人及相关生产经营企业的质量安全意识和主体责任自律意识,增强药品质量风险控制能力,促进产品研发创新升级。[size=14px][color=#707d8a][ 来源:中国食品药品网 ][/color][/size][size=14px][color=#707d8a][i]编辑:张圣斌[/i][/color][/size]
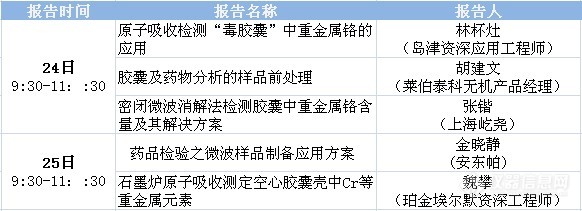
http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_646471_1604352_3.gif【免费在线讲座】“毒胶囊中重金属铬的检测及药品质量控制”专题网络研讨会主办:仪器信息网 活动时间:2012年4月24、25日(周二、周三) 上午 9:30—11:30http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_646471_1604352_3.gif 近期,央视《每周质量报告》曝光9大药企,13个批次药用胶囊重金属铬超标,部分超过国家标准接近90倍。据悉,这些药用胶囊用皮革废料所生产的明胶做原料。此事件一经曝光立即引起了群众极大的关注。 胶囊类药品作为广泛使用的一类药物,人们大多关注于药品本身的功效及成分,但是作为辅料的胶囊同样也会被人体消化吸收,亦会影响服药者的身体健康。仪器信息网针对本次事件,聚焦“毒胶囊”中重金属铬的检测及药品质量控制等问题,特举办专题研讨会,邀请4-6位资深应用专家进行相关报告,在线介绍“毒胶囊”中重金属铬的检测方法及我国药品检测方面的技术进展、解决方案及质量控制现状等,“面对面”解答用户问题。http://ng1.17img.cn/bbsfiles/images/2012/04/201204191411_362254_2961690_3.gifhttp://ng1.17img.cn/bbsfiles/images/2012/04/201204201002_362408_1632253_3.jpg1、报名条件:只要您是仪器网注册用户均可报名参加。2、参加人数:100-200人。3、参与互动:本次讲座采取网络讲堂直播模式,欢迎大家积极发言提问。 *参会期间您还可以将有疑问的数据通过上传的形式给老师予以展示,并寻求解答*4、报名参会:"毒胶囊中重金属铬的检测及药品质量控制"专题网络研讨会(上)http://simg.instrument.com.cn/meeting/images/20100414/baoming.jpg"毒胶囊中重金属铬的检测及药品质量控制"专题网络研讨会(下)http://simg.instrument.com.cn/meeting/images/20100414/baoming.jpg5、环境配置:只要您有电脑、外加一个耳麦就能参加。建议使用IE浏览器进入会场。6、提问时间:现在就可以在此帖提问啦,截至2012年4月23日7、会议进入:2012年4月24日9:00点就可以进入会议室8、开课时间:2012年4月24日9:309、http://simg.instrument.com.cn/webinar/20110223/images/zb_11.gif特别说明:报名并通过审核将会收到1 封电子邮件通知函(您已注册培训课程),请注意查收,并按提示进入会议室!为了使您的报名申请顺利通过,请填写完整而正确的信息哦~http://ng1.17img.cn/bbsfiles/images/2012/04/201204191411_362254_2961690_3.gif
(申明:本文只是参与本科答辩的论文,没有公开发表,只为参加原创,一共四篇,11月份发布了《GSP中药品购进管理的思考》和《对GSP中药品储存管理的认识与思考》;继“购进管理”和“储存管理”后,今天发布“验收管理”和“销售环节管理”两篇,至此,我们小组四人的本科答辩论文也就发布完了,作为2011年最后一个月个人原创大赛参赛的收尾,2012年原创再见)浅谈GSP中药品质量验收管理学生:周小丽 指导老师:罗玉臻 : 目的:认识GSP中药品质量验收管理的必要性以及具体要求,并就有关问题提出对策及建议。方法:通过参与实践,查阅文献并结合省内药品经营单位的相关资料进行汇总、分析。结果:企业管理制度不系统,管理方法落后,质量验收人员培训不严格等问题是当前GSP中药品质量验收存在的主要问题。结论:只有重视GSP中药品质量验收管理,进一步完善管理体系,采取更先进的方法,才能更进一步的把好药品经营单位的质量关。 GSP 药品质量 验收 管理It is shallow to talk the GSP Chinese herbal medicine amount of quality checks before acceptance the managementSpecial subject student: Zhou Xiao-liLead teacher: Luo Yu-zhen Purpose The cognition GSP Chinese herbal medicine amount of quality checks before acceptance necessity and concrete requests of the management, combining to put forward related counterplan and suggestions for the relevant problem. Method Pass to participate the fulfillment, check combinative drugs inside the province that cultural heritage combine related data operate the unit proceeds to gather, analyze. Results Business enterprise management system not system, manage the method fall behind, the quantity checks before acceptance the personnel the training not wait strictly the problem is a key problem that current GSP Chinese herbal medicine amount of quality check before acceptance the inside. Conclusions Only valuing the GSP Chinese herbal medicine amount of quality checks before acceptance the management, further perfect management system, adopt the more advanced method, the talent is further to operate the quantity pass of the unit to good drugs. GSP Drugs quantity Check before acceptance Management 《药品经营质量管理规范》对应的英文是good supply practice, 缩写是GSP,意为良好供应规范。我国现行的GSP是2000年6月原国家药品监督管理局发布的《药品经营质量管理规范》。GSP是药品经营企业管理的基本准则,适用于中国境内经营药品的专营或兼营企业。GSP的基本精神是:药品经营企业应在药品的购进、储运、销售等环节实行质量管理,建立包括组织结构、职责制度、过程管理和设施设备等方面的质量体系,并使之有效运行。药品经营过程的质量管理,是药品生产质量管理的延伸,是控制、保证已形成的药品质量的保持,也是药品使用质量管理的前提和保证。药品经营过程质量管理的目的是,控制和保证药品的安全性、有效性、稳定性不变化、药品不变质;控制和保证假药、劣药及一切不合格、不合法的药品不进入流通领域,不到使用者手中,做到按质、按量、按期、按品种,以合格的价格满足医疗保健的需求。我国GSP的主要内容包括管理职责、人员与培训、设施与设备、进货、验收与检验、储存与养护、出库与运输、销售与售后服务等。其中验收工作是药品经营企业把好药品质量关的关键。1. 药品质量验收管理的必要性药品是一种特殊的商品,它是用于预防、治疗、诊断人的疾病,有目的地调节人的生理功能并规定有适应证或者功能与主治、用法和用量的物质。药品与人体健康紧密相连,且药品具有高质量性的特征,药品的纯度、稳定性、均一性与药品的使用价值有密切关系,杂质、异物混入药品,可出现异常生理现象、毒副作用、药品不良反应,甚至中毒。因此对药品质量的把关显得尤为重要。而验收正是药品经营企业中把握质量的关键程序。因此,验收工作也就显得尤为重要了。2. GSP中对药品质量验收管理的具体要求[font
[font=Calibri][size=10.5pt][font=宋体]仪器信息网于[/font]5[/size][/font][font=Calibri][size=10.5pt][font=宋体]月[/font]18[font=宋体]日组织召开[/font][b] 2020药典——“药品微生物检测技术”主题网络研讨会[/b][/size][/font][font=Calibri][size=10.5pt][font=宋体],特邀嘉宾陈向东(中国药科大学)[/font][font=宋体],带来报告[b]《微生物检测新技术在药品质量控制中的应用》[/b];[/font][/size][/font][font=宋体]欢迎感兴趣的你,报名参会![/font][url=https://www.instrument.com.cn/webinar/meetings/6604/][b][u][font='Times New Roman'][color=#0563c1]https://www.instrument.com.cn/webinar/meetings/Drug2020/[/color][/font][/u][/b][/url]
求助:药品质量研究规范的标准。谢谢好心人能给我提供一个标准,主要是质量研究的内容太多,而且知道的都是大框架,而不知道细枝末节。谢谢啦
内部质控,不外乎人员比对、复测、方法比对、仪器比对、加标回收等。《药典》中检测方法并无其它行业关于精密度的说法。那么,内部质控中,若复测或人员比对中,对数据应当如何评判?有没有国家性药品检测的质控类文件,若有,请提供网站或文件。
[size=6][b]“首届全国药品质量分析论坛”顺利开幕[/b][/size]http://www.instrument.com.cn 来源:仪器信息网 2010-3-11 23:13:11 点击427次[align=left] [b]仪器信息网讯[/b] 2010年3月11日,由中国药学会药物分析杂志编辑部主办、国家食品药品监督管理局药品市场监督办公室协办的“首届全国药品质量分析论坛”在河南省郑州市嵩山饭店顺利召开,会期两天;本次会议旨在为了不断提高药品质量,交流药物分析技术及方法,促进药品生产工艺改进,保障公众用药安全有效。从事药品检验、药物分析、药品生产质量控制等相关领域专业人员约500余人参加了此次会议。[/align][align=center][b][font=楷体_GB2312][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20103/2010311231459653.jpg[/img][/font][/b][/align][align=center][b][font=楷体_GB2312]会议现场[/font][/b][/align] 论坛开幕式由中国药品生物制品检定所原常务副所长、药物分析杂志主编金少鸿研究员主持,中国药品生物制品检定所丁丽霞副书记和河南省食品药品监督管理局陶勉超副局长分别致辞;当日上午主题报告会由中国药品生物制品检定所党委副书记丁丽霞研究员和药物分析杂志编辑部杨腊虎主任主持。[align=center][b][font=楷体_GB2312][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20103/2010311231459490.jpg[/img][/font][/b][/align][align=center][b][font=楷体_GB2312]中国药品生物制品检定所党委副书记丁丽霞研究员致辞[/font][/b][/align][align=center][b][font=楷体_GB2312][/font][/b][/align][align=center][b][font=楷体_GB2312][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20103/20103120844686.jpg[/img][/font][/b][/align][align=center][b][font=楷体_GB2312]河南省食品药品监督管理局陶勉超副局长致辞[/font][/b][/align][align=center][b][font=楷体_GB2312][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20103/2010311231459987.jpg[/img][/font][/b][/align][align=center][b][font=楷体_GB2312]药物分析杂志编辑部杨腊虎主任主持专题报告会[/font][/b][/align] 本次论坛以“药品质量分析研究”为主题,内容涉及“化学药品、药用辅料、药品包装材料质量分析,生化药物、抗生素质量分析,中药质量分析”三大方面。除邀请多位药品质量分析专家做专题报告外,论坛还采用了大会报告、分会交流、壁报展览的表现形式。现对主题报告内容作基本介绍,以飨读者。[align=center][b][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20103/2010311231459454.jpg[/img][/b][/align][align=center][b][font=楷体_GB2312]中国药品生物制品检定所原常务副所长、药物分析杂志主编 金少鸿研究员[/font][/b][/align][align=center][b][font=楷体_GB2312]报告题目:我国药品质量分析研究的实践与进展[/font][/b][/align] 金少鸿研究员在报告中首先从当前常用药品的特点、药品质量观点的变迁、药品质量分析的分类与目的等方面系统回顾了我国药品质量分析的历史;同时,对药品质量分析研究的现状也进行了系统阐述,自2008年全国开展药品评价性分析以来,各级药检机构通过对市场流通的不同生产厂家200种药品样品进行全方位检验与深入分析,获得令人瞩目的成果:提出了质量标准必须提高,指出了检测方法必须修订,发现了检测方法必须修订,发现了生产工艺必须改进,提示了包装材料必须重视,揭示了企业诚信必须加强。 最后,指出了药品质量分析研究的几点展望:(1)药品质量分析与质量标准提高相结合;(2)药品质量分析与药品检测技术研究相结合;(3)药品质量分析与药品不良反应监测相结合;(4)药品质量分析与药品市场监督检查相结合;(5)药品质量分析与药品上市后再评价相结合;(6)药品质量分析与药品定价招标采购相结合;(7)药品质量分析与药品检验人员培养相结合。[align=center][font=楷体_GB2312][b][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20103/2010311231459406.jpg[/img][/b][/font][/align][align=center][font=楷体_GB2312][b]总后卫生部药品仪器检验所副所长 姜雄平主任药师[/b][/font][/align][align=center][font=楷体_GB2312][b]报告题目:溶出度及其评价[/b][/font][/align] 姜雄平主任药师在报告中从药品制剂质量分析谈起,对影响固体制剂质量的关键因素(安全与稳定、有效)进行了简单解释,通过引用大量数据与实验事例系统分析了溶出度适用范围、方法的建立与验证、溶出曲线的测定、溶出过程评价;最后提出了几个方面的问题与建议:药品标准或处方工艺存在的问题;药品质量问题;药品再评价;溶出度再研究的目的;建立我国的“橙皮书”——确定参比制剂:国家规定有参比制剂的就要选择国家规定的参比制剂,没有规定的按“原创上产品、国内著名品牌产品、国内公认质量好的产品、国内销售量大的品牌产品”顺序选择参比制剂。

药品质量管理是PPT文件,共68页[img]http://ng1.17img.cn/bbsfiles/images/2009/03/200903310733_141385_1626679_3.jpg[/img][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=141386]药品质量管理[/url]
FDA药品质量办公室宣告正式成立大家翘首以待的美国FDA药品质量办公室(OPQ)经过2年多的筹备,终于正式成立了。美国政府的办公室(Office)相当于我国的司,通常编制从几十人到几百人,下属若干个处(Division)。但OPQ预计的编制上千人,下属8个司,属于“超级”办公室。OPQ一跃成为FDA药品审评与研究中心(CDER)中最大的办公室,超过了过去的新药、药学及合规等三个超级办公室。实际上,上述三个办公室中的药品质量部分,包括新药超级办公室(OND)下属的新药质量评估办公室(ONDQA),仿制药超级办公室(OGD)中所有化学审评功能(仿制药审评的核心部分),合规超级办公室(OC)中批准前检查及上市后监测部分今后都划归OPQ了。来自我国浙江的余煊强博士(Lawrence Yu),荣任OPQ唯一的副主任。值得注意的是在今天宣布的OPQ主任和副主任,以及8位下属办公室主任的任命中,绝大多数都是暂时(Acting)任命,只有余博士和生物技术产品办公室(OBP)主任两位是长期任命。鉴于代理主任Janet Woodcock博士是整个CDER的主任,OPQ的具体工作预计将会落在余博士的肩上,包括今后FDA对药品质量监管的整体思路、布局和具体实施等。这是全体旅美华人科学家和监管者的自豪。成立OPQ标志着FDA进入了药品质量监管的新时期,其主要变革点,余煊强博士在今年6月底在北京大学国际药物工程管理(IPEM)硕士项目举办的药品质量研讨会上已经明确指出,具体讲就是:(1)方向上改变 - 过去的质量标准是和数据连在一起,而不是和病人连在一起。今后,质量高不高,不是看标准高不高,而是看对病人的效果。(2)机制上改变:通过整合CMC审评、GMP合规审评、及GMP现场检查,实现质量监管统一的声音。药品质量监管历来不易,既要确保百姓用药安全,又不能给药企增加不必要的负担;既要科学合理,又要依附于国家的政法体系,同时还要与时俱进。FDA的药品监管及美国的药品质量,多年来已经走在国际前列,但其不满足于现状,抓住时机(包括近年发生的药品质量安全事故,行之有效并进一步扩大的收费制度)勇于进取的做法,值得借鉴。 药品质量办公室 药品审评与研究中心(CDER)下属药品质量办公室(OPQ)的使命是确保供应给美国公众高品质的药品。OPQ的职责OPQ是CDER创建的一个独立的致力于产品质量的新办公室。新架构将于2015年1月正式运行,预计将为CDER的所有药品质量工作,包括审评、检查和研究提供更好的定位。OPQ将把非强制执法相关的药品质量工作整合到一个超级办公室,发出统一的质量声音,通过药品生命周期改善监管质量。OPQ贯穿所有生产场区—无论国内还是国外,横跨所有药品领域—新药、仿制药和非处方药,建立一致的药品质量计划。OPQ的组织架构以及新的流程和政策,将支持我们的使命,以确保供应给美国公众安全、有效、高品质的药品。改变包括:将制药科学办公室的职能和人员重组到OPQ 将合规办公室(OC)的批准前和监测检查活动重组到OPQ 将合规办公室下科学调查办公室关于生物等效性/生物利用度和非临床研究的相关检查活动重组到转化科学办公室药品质量办公室下设机构及领导以下人员将于2015年1月起任职:代理主任:Janet Woodcock, M.D.副主任:Lawrence Yu, Ph.D.项目和监管运营办公室(OPRO):Giuseppe Randazzo(代理) 药品质量政策办公室(OPPQ):Ashley Boam (代理) 生物技术产品办公室(OBP):Steve Kozlowski 新药产品办公室(ONDP):Sarah Pope Miksinski(代理) 生命周期产品办公室(OLDP):Susan Rosencrance(代理) 检验和研究办公室(OTR):Lucinda (Cindy) Buhse (代理) 工艺和设施办公室(OPF):Christine Moore(代理) 监测办公室(OS):Theresa Mullin(代理)

【仪器微课堂·第2期】过程分析技术在中药制药品质均一性评价研究与应用 2016年,仪器论坛将陪伴大家多年的线上讲座与微信直播相结合,推出【仪器微课堂】栏目!4月20日晚八点,【仪器微课堂·第2期】过程分析技术在中药制药品质均一性评价研究与应用如期举行。分享嘉宾:北京中医药大学 副研究员硕士生导师 吴志生分享形式:微信群中ppt图片+语音参与人数:357人内容整理:近红外光谱(NIR)版面版主 Rambo 吴志生老师在仪器微课堂群中进行了微信直播,主题为:过程分析技术在中药制药品质均一性评价研究与应用,网友们反应热烈,表示受益非浅。为了让更多的版友看到这期讲座,Rambo版主整理了吴志生老师的讲课内容,内容包括图片与文字,图片为吴志生老师的PPT课件,文字为吴志生老师的口述,分享给大家。大家对讲课内容有什么疑问,可在近红外光谱(NIR)版块发帖,吴志生老师会去回复。嘉宾分享环节http://ng1.17img.cn/bbsfiles/images/2016/04/201604202125_590966_2542239_3.jpg讲述: 这个题目包括了三个关键词:关键词1 过程分析技术,它的定义是“应用分析科学检测和控制工业化学过程“。但从学科来看过程控制和过程分析是分开的。 参考褚小立主编的过程分析专著;关键词2 均一性;关键词3 中药制药品质,研究对象中药生产过程而不在于种植过程和炮制过程等。http://ng1.17img.cn/bbsfiles/images/2016/04/201604202144_590968_2542239_3.jpg讲述: 这次报告围绕以上三个关键词,从研究背景、研究思路和方法应用、主要技术平台、总结四方面介绍研究工作http://ng1.17img.cn/bbsfiles/images/2016/04/201604202147_590969_2542239_3.jpg讲述: 一是政策方面,对于制药行业来说,2004年是特殊而且具有历史性的一年,这一年美国FDA发布了PAT工业指南,制药行业者开始纷纷投入这一领域。第二个政策纲领是2008年,ICH提出了质量源于设计,设计空间等理念和方法,进一步使先进过程分析和过程控制推向一个更加清晰的位置。 简单来说过程分析和过程控制,它是通过对关键质量属性和工艺指标进行实时测量,实现对产品质量设计、分析和控制的目标。制药过程分析与控制能够解决产品质量的稳定均一问题。 第二,我们国家也在政策上提出制药领域的先进过程分析技术和过程控制方法应用。在十一五和十二五期间,立了不少重大科研课题,对于这个领域起到积极推动作用。 特别是当前,在我国加速医药工业化进程,实施医药制造2025关键时期。制药行业智能制造是《中国制造2025》计划的重点领域。结合当前国际制药行业对过程质量控制新要求(PAT、QbD),“中药制药4.0”已引起中药行业和各企业的高度关注。http://ng1.17img.cn/bbsfiles/images/2016/04/201604202204_590972_2542239_3.jpg讲述: 首先,分析化学技术的飞速发展,涌现了许多分析仪器,这些仪器满足了过程分析技术要求,快速、无损、简便和可靠的特性,从技术储备上为本领域提供了支撑。 同样也使得分析化学从静态分析到快速动态分析,从破坏试样分析到无损分析,从离线分析到在线分析的发展。http://ng1.17img.cn/bbsfiles/images/2016/04/201604202209_590973_2542239_3.jpg讲述: 图片中两个人是质量的鼻祖,朱兰提出的质量三部曲影响现代质量学的研究进程,克劳士比提出零缺陷的概念,从这里,我们会问质量和品质有什么关系?质量是符合要求,而品质是高于符合要求。药品也不例外。药品质量围绕中心四个词安全、有效、稳定、均一。也就是从这个四个方面提高质量,提升品质。制药过程也是如此。http://ng1.17img.cn/bbsfiles/images/2016/04/201604202217_590974_2542239_3.jpg讲述: 围绕稳定、均一开展中药质量实时分析方面研究,围绕中药原料、生产过程、中间体、成品、工艺信息、质量信息开展研究工作,建立在线分析方法和快速分析方法。这些年,我们对一些共性检测指标,比如浓度、湿度、密度、包衣厚度、粒度等建立实时评价方法,对一些典型剂型单元环节建立实时评价方法。http://ng1.17img.cn/bbsfiles/images/2016/04/201604202222_590975_2542239_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/04/201604202223_590976_2542239_3.jpg讲述: 过程分析技术大多数是多变量分析技术,多变量分析技术需要建立多变量模型,建立多变量模型需要化学计量学,这个领域里我们给他一个研究子领域叫过程化学计量学。 在这里我分享一下,我在多变量建模方法方面一些工作: 举个例子:大家多清楚,PLS模型在领域内运用广泛,但是实际在使用过程中,很多人对于数据预处理、变量选择和潜变量选择是单独考虑。 什么意思呢?比如:数据预处理,大家是否是基于一个固定了的潜变量和变量范围的模型,来选择数据预处理方法,而这个潜变量和变量范围往往不是最终模型最优的参数。 其实,从系统科学的角度很好解释了这一点,以前是基于元素的局部优化构建模型,现在我们考虑元素和元素的关系,构建模型。 因此,我们建立的PLS模型,比原来绿色的区域模型质量更高,不单单用我们的数据,用网上开源数据也是这个结论。http://ng1.17img.cn/bbsfiles/images/2016/04/201604202236_590977_2542239_3.jpg讲述: PLS实际使用过程用RPD和RMSEP指标评价模型,对于药学工作者,按照美国药典、中国药典、药品标准标准方法建立方法的可靠性和准确性的,因此,制药行业提出过程分析技术方法验证问题,建立PLS模型,统计学β期望参数90%、95%的置信区间来建立模型方法验证,包括方法验证的准确度、精密、不确定度等指标。也探讨中药不同体系、不同样本集、不同过

研究成果荣获2018年陕西省科学技术二等奖国家食品快速检测方法标准起草单位陕西省重点产业链项目支持陕西省科技统筹创新工程项目支持[align=center]快检质控样品[/align][align=center]—为快速检测准确可靠提供整体解决方案[/align][align=center]陕西省食品药品快速检测公共服务平台 研制[/align][b][color=#ff0000]用科学护航质量与安全![/color]xu 15339070117[color=#ff0000]www.chianshian.cn[/color][/b]快速检测结果不准确、不可靠的问题给基层工作带来极大困扰,而快检质控样品是快速检测过程质量控制最为简便、有效的保障措施。作为2018年陕西省科学技术二等奖科研成果产业化应用和推广,依托陕西省食品药品监督检验研究院和陕西省食品药品快速检测公共服务平台的顶级开发能力研究制备的质控样品,带领快检行业进入新阶段。质控样品配备应用指导,为监管单位量身定制,具有操作简单、准确高效等特点,适用于快速检测领域的过程质量控制、快检产品评价、盲样考核、能力比武等。针对社会关注的食品安全热点、快检结果准确性的难点问题提供创新性的整体解决方案。[b][color=#4f81bd] [/color][color=#4f81bd]快检质控样品[/color][/b]针对不同类别、基质、目标物,建立了整套完善的研制工艺,制备的质控样品与食品真实样品一致或者能够完全模拟食品实际状态;同时,采用实验室检测方法确保质控样品目标物量值准确,并可稳定保存。[b][color=#4f81bd] [/color][color=#4f81bd]快检质控样品使用方法[/color][color=#4f81bd] [/color][/b]每组待测样品检测时,嵌入质控样品随行待测样品同法检测,阴性质控样品测定结果应为阴性,阳性质控样品测定结果应为阳性。若质控试验测定结果与质控样品标示的阴、阳性不一致,则需排除可能造成结果有误的干扰因素。[b][color=#ff0000] [/color][color=#ff0000]您的最佳选择 [/color][/b]ü [b][color=#00b050]简便:[/color][/b]随行待测样品同步、同法操作,高效便携,为您第一时间保障现场检测结果质量。ü [b][color=#00b050]严谨:[/color][/b]量值确证、均匀性和稳定性检验等核心技术指标均符合国家规范要求。ü [b][color=#00b050]权威:[/color][/b]专业技术平台提供技术保障,具有多项独家专利,是您快检工作的可靠伙伴。ü [b][color=#00b050]全面:[/color][/b]针对快速检测中常见的问题进行定制化服务,为您量身打造整体解决方案。[b][color=#00b0f0] [/color][color=#00b0f0]生产能力[/color][/b]专业原料种植、养殖基地 经种植、饲喂方式获得农兽残类真实样品加工生产先进、多样的加工工艺专业检测严格控制均检、稳检、量值确证等技术环节[color=#000000] [/color]防腐、包装、储存通过特殊工艺技术保证样品稳定性[b][color=#00b0f0] [/color][color=#00b0f0] [/color][color=#ff0000]质控样品在食品安全领域的应用 [/color][color=#00b0f0]1.国家快检方法明确要求,实施质量控制[/color][/b]自2017年起,国家市场监管总局/原国家食药总局相继批准发布了20余项食品快速检测方法,自此,快速检测技术有据可依。陕西省食药院先后主持或验证了其中8项方法的起草。目前,所有快检方法均要求快检过程必须同步进行质控实验以确保快检结果的准确性。以《食品中亚硝酸盐的快速检测》(KJ201704)为例,本方法对质控样品的基质、量值、稳定性等技术指标均做出明确要求。[b][color=#00b0f0]2.评价、考核、比武,多种形式助力监管 [/color][/b]为保障快速检测在基层科学、有效应用,国家总局先后出台发布《食品快速检测方法评价技术规范》、《关于规范食品快速检测方法使用管理的意见》等文件,,要求确保快检结果质量。基层实际应用时,可采取多种技术措施,如快检产品使用前和在用评价、盲样考核、人员比对(大比武)、产品比对、现场核查等,多种质控形式均需嵌入质控样品。目前,系列质控样品已在陕西、山东、浙江、江西等地基层监管部门应用,反馈良好。[b][color=#ff0000] [/color][color=#ff0000]研发团队简介[/color][/b]2014年,陕西省批准设立“食品药品快速检测公共服务平台”,平台依托陕西省食品药品监督检验研究院,汇集国内众多核心技术及专家资源,建立了国内首个快检质控样品研发团队,专注于食品快速检测标准制定、质量控制和验证评价技术研究,取得了一系列具有国内领先水平的研究成果。2017年,经国家食品药品监管总局遴选,陕西省食药院成为全国7家食品快检产品评价机构之一。先后完成2项国家级食品快速检测评价研究;主持“食品中亚硝酸盐的快速检测”、“食品中硼酸的快速检测”等2项,参与孔雀石绿、罗丹明B等6项国家快检方法标准的制定;主持4项快检地方标准;主持的“食品安全关键快检方法开发和质量控制技术的研究与应用”项目获得2018年陕西省科学技术二等奖。目前,在快检质控样品研制方面,已建立原材料种植/养殖基地,遴选多个协作单位开展质控样品研制。已拥有快检质控样品策划、研发、测试、规模化生产的完整体系,开发的系列产品连续五年用于省内外食品承检机构考核,并辐射全国食品监管领域,已为全国10个省(区)快检招标成功提供全套技术保障。平台以领先的自主核心技术对质控样品全程严密监测,确保品质,为提高快速检测的准确可靠提供整体解决方案。
[b][size=2]2010《中国药典》的颁布,中药中的重金属等有害物质限量更为明确。日前从举行的中药配方颗粒高层论坛上获悉,我国已开始研制300味中药配方颗粒的国际组织标准,包括药品名称、来源、炮制、农药残留等在内的项目都要规范起来。世界中医药学会联合会副秘书长黄建银介绍,这项研究主要是为了通过标准的研制与推广,规范中药配方颗粒生产工艺和质量标准,提高生产水平,保证产品质量和安全性,以扩大我国在国际中药市场的份额,保证中医药在国际上健康有序地发展。研制300味中药配方颗粒国际组织标准,包括生产工艺标准和质量标准两个方面。生产工艺标准方面,主要是研究和规范各种高新技术,便于推广和提高中药配方颗粒制剂水平和生产效率。质量标准方面,主要研究和规范药品名称、来源、炮制、制法、性状、鉴别、检查、浸出物含量测定、重金属限度检查、农药残留限度检查、功能主治、用法用量、注意、规格、贮藏等项目。[/size][/b][size=6][b][size=2][font=SimSun]此外,日前台当局“卫生署”中医药委员会主委黄林煌昨受访时指出,过去的科学中药检验规定,限制多数处方的重金属含量必须低于100ppm、少数须低于50ppm,但是专家与社会多方反映,认为原先订立的限量标准太低、有待改善,中医药委员会于是根据这项需求,拟定《中药浓缩制剂含污秽物质限量》草案,并在日前获各药厂认可后公告,最快将自2010年6月1日起实施。[/font][/size][size=2][font=SimSun]黄林煌并表示,该草案除要求科学中药的总重金属含量,除了不得高于30ppm以外,另外还针对加味逍遥散等20种坊间常见的处方,规定其所含有的镉、汞、砷、铅等四种毒性较强的重金属,最高限量分别为0.5、0.5、3、10ppm.[/font][/size][color=#c9a601][size=3]因此,微波消解作为中药有害物质控制的样品制备方法无疑会大有作为,中国药典将其列入推荐方法。你认为呢?[/size][/color][/b][/size]
对于白酒的安全检测,要是是通过色谱-质谱联用、离子色谱、光谱等技术来进行。如在本次抽检中,不合格批次存在的问题主要集中在:氰化物指标不合格(国标GB 2757-2012规定蒸馏酒中氰化物指标≤8mg/kg, 以100%酒精度折算)、检出甜味剂(相关食品安全国家标准和白酒产品标准规定,白酒中不允许添加甜味剂)、酒精度不符合标示值、固形物含量不达标,这些物质主要是通过气相色谱或者气相-质谱联用技术检测的。最近数月,食药总局频频出拳,在本月继公布对婴幼儿配方乳粉、婴幼儿辅食、糖果和巧克力的专项监督抽查的检测结果之后,又公布了对白酒和花生油展开的专项监督抽查的结果。此专项监察开展于5月和6月,抽查范围涉及全国810家白酒生产企业2148个批次的白酒产品和16个省95家花生油生产企业的202批次花生油产品,其中白酒共78批次不合格,花生油1批次不合格。鉴于此次抽检中白酒的不合格率较高,本文着重总结了一下白酒的品质控制和检测方法。
[size=6][b]“首届全国药品质量分析论坛”落下帷幕[/b][/size]http://www.instrument.com.cn 来源:仪器信息网 2010-3-15 15:22:52 点击322次 [b]仪器信息网讯[/b] 为期2天的“首届全国药品质量分析论坛”于2010年3月12日下午在郑州嵩山饭店胜利落下帷幕。[align=center][font=楷体_GB2312][/font][/align][align=center][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20103/2010315152410924.jpg[/img][/align][align=center][font=楷体_GB2312][b]中国药学会药物分析专业委员会田颂九研究员主持论坛闭幕式主题报告会[/b][/font][/align] 赛默飞世尔科技SID色谱与质谱应用工程师刘婷女士、国家食品药品监督管理局药品市场监督办公室抽验处姜典才处长、国家药典委员会副秘书长王平研究员在闭幕式上分别做了报告,主题报告会由中国药学会药物分析专业委员会田颂九研究员主持。[align=center][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20103/2010315151729682.jpg[/img][/align][align=center][font=楷体_GB2312][b]赛默飞世尔科技SID色谱与质谱应用工程师 刘婷女士[/b][/font][/align][align=center][font=楷体_GB2312][b]报告题目:现代仪器在药品检验中的应用[/b][/font][/align] 刘婷女士介绍,药物从研发到生产,药物分析起着至关重要的作用。目前,药品检验的主要分析技术有分子光谱(傅里叶红外和拉曼光谱)、元素分析([url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICP-MS[/color][/url]和[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url])和色谱质谱([url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]联用、GS-MS联用和LC-GC)三大类。其中,分子光谱主要用于中药红外指纹图谱、中药材无损分析、药物降解和杂质分析、生产过程控制、药物含量定量检测等;元素分析用于药物中重金属含量及含金属元素药物的测定;色谱质谱技术则用于中药打假、中药指纹图谱、生物标志物鉴定、药物筛选、代谢组学研究等。这三种技术各有优势,若能综合其优点,将大大提高药物分析检验的能力。例如,[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]联用技术广泛应用于生物标志物鉴定、合成产物快速确证、天然产物有效成份筛选、中药分析和质量标准鉴定、药物质量控制等多个领域中;高分辨质谱则可以提高复杂样品的分析能力,主要用于中药、化药的质量分析、生产工艺控制及代谢组学的研究等。[align=center][font=楷体_GB2312][b][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20103/201031515180777.jpg[/img][/b][/font][/align][align=center][font=楷体_GB2312][b]国家食品药品监督管理局药品市场监督办公室抽验处 姜典才处长[/b][/font][/align][align=center][font=楷体_GB2312][b]报告题目:药品抽验机制探讨[/b][/font][/align] 通过国外药品上市后的监督体制,姜处长表示:“药品抽验机制符合国情,服务于药品监管,正在不断的发展完善,但可借鉴少。”经过多年的摸索探讨,我国的药品抽检模式已趋于科学化规范化。此外,姜处长就我国药品评价抽验模式还作了进一步地探讨: 抽验目的:评价抽验用于了解、掌握辖区内药品质量总体水平;监督抽验则是监督检查中发现的可疑药品进行的针对性抽验; 样品检验:分散检验与集中检验应有机结合,资源充分利用;检验标准应包括法定标准、探索性研究检验等; 结果方式:可以“合格或不合格、质量分析报告、质量风险评估及质量公告”等多种方式呈现; 结果利用:可作为管理部门间、管理部门与生产企业间的信息交流机制;也可用于产品使用的选择标准; 企业作用:树立正确的质量理念与责任感,调动企业积极性,积极参与,积极配合,积极整改。[align=center][font=楷体_GB2312][b][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20103/2010315151838226.jpg[/img][/b][/font][/align][align=center][font=楷体_GB2312][b]国家药典委员会副秘书长 王平研究员[/b][/font][/align][align=center][font=楷体_GB2312][b]报告题目:中国药典2010年版介绍及国家药品标准要求[/b][/font][/align] 王平副秘书长首先对标准、技术标准、国家药品标准的定义进行了细致入微地介绍。此外,关于《中国药典》2010版,王平副秘书长提到,2010年版《中国药典》药品安全性得到进一步保障、药品有效性与可控性大幅提升、技术现代化与标准国际化明显增加。与2005版药典相比,2010版药典占国标现存总数的比例有所增加,但仍有很大差距。下一阶段的工作重点将集中在以下三方面:国家药品标准提高行动、2010版配套工作(英文版和注释等)、2015版药典编制(编制大纲、组委会筹建等)。 最后,王平副秘书长表示,在全国同仁的共同努力下,2010年版《中国药典》取得了长足的进步和实质性的提升,其颁布实施必将在保证我国药品质量、提高药品质量标准及推进我国药品走向国际三方面起到重要的作用。
[b][size=4] 3.15又到了,质量问题是老生常谈也要谈啊,化药版块当然是关注药品质量问题了,以下各药品质量各方面,您对哪项最不放心,意见最大?[/size][/b]
中国实施GMP以来,虽然说药品质量取得很大的进步,得到了很大改善,但是为什么中国的药害事故仍然层出不穷呢,从齐二药、上海华联、安徽华源、百易~~~~~~~~到最近的完达山刺五加事件,可以说没有安静过!你认为这正常吗,中国的药品质量能让你信耐吗?请你参与,谢谢!
呵呵,各位同仁,想请大家帮个忙:一般药品质量的检测会用到哪些仪器设备?知道的请尽快回个贴,请大家帮帮忙了,很急的![em0804]