拥有60年历史的中国药品生物制品检定所今天迎来新生——更名为中国食品药品检定研究院,并获国家10.9亿元人民币投资,在北京大兴生物医药基地建设新院。新院占地200亩,建筑面积100383平方米,主要建筑包括药品检验楼、生物制品检验楼、医疗器械检验楼、生物安全实验楼、特殊实验楼、动物资源中心、标准物质楼、以及专家公寓、教学报告楼等。 在药品检验、生物制品检验、医疗器械检验、生物安全实验、特殊实验、动物资源中心、标准物质等方面,作为国家级的食品药品鉴定所,不仅要吸收一流的人才,同时也需要采购那些一流的设备,有哪些先进的设备或者正在研发中的设备会进入全新的中国食品药品检定研究院。 欢迎大家提供各方面可能用到的的最新仪器,或者正在研发中的仪器,依据内容给于2-10分奖励! 格式如下:【仪器名称】:【入围理由】:
请问哪里可以买到中国药品生物制品检定所编的《药品检验仪器检定规程》这本书?
有参加中国食品药品检定研究院β-受体激动剂能力验证吗?建群交流一下
中国药品生物制品检定所资料,与大家共享。[~71978~][~71979~]
有参加中国药品检定研究院奶粉中维生素A和维生素E能力验证的同学吗?进来交流
关于举办“有害残留物检测技术学习班”的通知各省、市食品药品检验所,及相关企业质检部门: 中药、保健食品及农产品中有害残留物问题为全社会所高度关注。在国内,《中国药典》及相关食品国家标准规定了一系列有害残留物检测方法与严格的限量标准;在国外,日本、欧盟、美国等均采取了严格的市场准入制度。为进一步配合各药检所、质量监督检验机构相关残留检测实验室建设,为《中国药典》2010版相关检测内容做技术准备,由中国药品生物制品检定所主办、青岛食品药品检验所承办的“有害残留物检测技术”第三期学习班将于2008年9月于山东省青岛市举行,现通知如下:一、培训内容:1、中药中外源性有害残留物的监控及相关国际法律环境介绍。2、日本《肯定列表制》实施情况及检测技术介绍。3、[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]、原子荧光法检测技术及在中药铅、镉、砷、汞、铜残留检测中应用。4、中药注射液中重金属及有害元素测定法。5、[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法、[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质联用[/color][/url]法检测技术及在农药多残留检测中的应用。6、有机氯、有机磷、拟除虫菊酯类农药残留量测定法。7、氨基甲酸酯类农药残留量的HPLC柱后衍生测定法及HPLC/MS农药多残留测定法。8、黄曲霉毒素残留量的HPLC测定法。9、二氧化硫残留量测定法。10、参观青岛市食品药品检验所,观摩重点试验步骤(重金属及农残测定的样品前处理、GC/MS及HPLC/MS分析)演示,并进行研讨。二、参加人员:主要面向食品药品检验所的检验人员、药品生产企业的骨干质检人员,以及商检、农业等行业相关质检人员。三、时间:2008年9月16~18日,15日报到。四、地点:山东省青岛市五、费用:每人1200元,含培训、讲义和相关试验观摩费用。食宿及交通费自理。六、报名方式:填写报名表后电子邮件或传真报名,培训的具体时间、地点采用电子邮件另行通知。报名联系人:杜庆鹏、孙磊 地址:北京市崇文区天坛西里二号,中国药品生物制品检定所中药室,邮编100050 电话:(010)67095424传真:(010)67023650电子邮件:dasunlei@sina.com青岛食品药品检验所联系人:吴爱英 地址:山东省青岛市隆德路7号 邮编:266071 传真: (0532)85734979 电话:(0532)85735184 附:报名表姓名单位性别职称/职务固定电话移动电话电子邮件 二○○八年七月十五日
关于举办“有害残留物检测技术学习班”的通知各省、市食品药品检验所,及相关企业质检部门: 中药、保健食品及农产品中有害残留物问题为全社会所高度关注。在国内,《中国药典》及相关食品国家标准规定了一系列有害残留物检测方法与严格的限量标准;在国外,日本、欧盟、美国等均采取了严格的市场准入制度。为进一步配合各药检所、质量监督检验机构相关残留检测实验室建设,为《中国药典》2010版相关检测内容做技术准备,由中国药品生物制品检定所主办、青岛食品药品检验所承办的“有害残留物检测技术”第三期学习班将于2008年9月于山东省青岛市举行,现通知如下:一、培训内容:1、中药中外源性有害残留物的监控及相关国际法律环境介绍。2、日本《肯定列表制》实施情况及检测技术介绍。3、[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收[/color][/url]、原子荧光法检测技术及在中药铅、镉、砷、汞、铜残留检测中应用。4、中药注射液中重金属及有害元素测定法。5、[url=https://insevent.instrument.com.cn/t/Mp]气相色谱[/url]法、[url=https://insevent.instrument.com.cn/t/bp][color=#3333ff]气质联用[/color][/url]法检测技术及在农药多残留检测中的应用。6、有机氯、有机磷、拟除虫菊酯类农药残留量测定法。7、氨基甲酸酯类农药残留量的HPLC柱后衍生测定法及HPLC/MS农药多残留测定法。8、黄曲霉毒素残留量的HPLC测定法。9、二氧化硫残留量测定法。10、参观青岛市食品药品检验所,观摩重点试验步骤(重金属及农残测定的样品前处理、GC/MS及HPLC/MS分析)演示,并进行研讨。二、参加人员:主要面向食品药品检验所的检验人员、药品生产企业的骨干质检人员,以及商检、农业等行业相关质检人员。三、时间:2008年9月16~18日,15日报到。四、地点:山东省青岛市五、费用:每人1200元,含培训、讲义和相关试验观摩费用。食宿及交通费自理。六、报名方式:填写报名表后电子邮件或传真报名,培训的具体时间、地点采用电子邮件另行通知。报名联系人:杜庆鹏、孙磊 地址:北京市崇文区天坛西里二号,中国药品生物制品检定所中药室,邮编100050 电话:(010)67095424传真:(010)67023650电子邮件:dasunlei@sina.com青岛食品药品检验所联系人:吴爱英 地址:山东省青岛市隆德路7号 邮编:266071 传真: (0532)85734979 电话:(0532)85735184 附:报名表姓名单位性别职称/职务固定电话移动电话电子邮件 二○○八年七月十五日
中国药品检验标准操作规范与药品检验仪器操作规程(2005)药物生物制品鉴定所 2005年编写,归纳所有的检定方法!http://www.instrument.com.cn/download/shtml/079420.shtml
中国食品药品检定研究院2012年专项仪器购置项目(中仪)中标公告 项目名称:2012年专项仪器购置项目(中仪) 项目编号:12CNIC-032079-19 采购人名称:中国食品药品检定研究院 采购代理机构全称:中国仪器进出口(集团)公司 评标地点:北京国二招宾馆 定标日期:2012年8月30日 评标方式:综合评分法 评标结果:包号推荐中标人名称/招标结果中标金额第01包广州市艾贝泰制药设备科技有限公司¥990,000.00第02包中锴元通投资(北京)有限公司¥427,800.00第03包北京科尔德科贸有限公司¥929,500.00第04包北京东方诺贝科技发展有限公司¥1,065,000.00第05包北京合众日盛科技有限公司¥1,159,000.00第06包北京远桥科技有限公司¥498,000.00第07包北京昊诺斯科技有限公司¥930,500.00第08包北京合众日盛科技有限公司¥691,000.00第09包北京益成恒达国际贸易有限公司¥1,586,000.00第10包北京合众日盛科技有限公司¥458,000.00第11包北京德泉兴业商贸有限公司¥2,418,000.00第12包北京超越未来科技发展有限公司¥2,998,000.00第13包深圳市泓腾生物科技有限公司¥910,080.00第14包中国科学器材公司¥2,002,000.00 评委专家名单专家姓名(中央政采专家)包号徐军01-14奚文龙01-14曹尔辰01-14于同泉01-14赵飞01-14专家姓名(采购人技术专家)包号刘甦苏04、13黄海伟10邢进04、07刘强05、08梁昊宇01、05李永红03、06、11邵明[
NIFDC-PT-080人参中有机氯类农药残留有机氯类《中国药典》2015年版第四部2341 农药残留测定法中国食品药品检定研究院QQ讨论群 464700281
药品和食品检验中对紫外分光光度计的参数有什什么要求,大家说说,另外那位老师那里有紫外分光光度计的检定规程麻烦发个
第一章 总 则 第一条 药品检验所是国家对药品质量实施监督检验的法定机构,按照《中华人民共和国药品管理法》和《中华人民共和国计量法》等有关法规的要求,为加强药品检验所实验室的标准化、规范化和科学化的管理,确保药品检验数据及检验结论的准确、公正,特制定本规范。 第二条 本规范是对药品质量检验和标准审核及其有关工作全过程的实施和对实验条件的规定。 第三条 本规范适用于省级以上药品检验所。 第二章 人 员 第四条 药品检验所所长应具有药学(或相应)专业知识及组织领导能力,能有效地领导全所工作,对药品检验结果负全面责任。 第五条 技术科室设科室主任。科室主任应具有相应专业理论水平和实践工作经验,能有效地组织、指导和开展本科室的业务工作,对药品监督检验中有关问题能作出正确判断和处理,并对检验结果负责。 第六条 药品检验人员需经过专业技术培训和岗位考核,经所长核准后方可上岗操作。非专业技术人员、无专业技术职称者不得从事药品检验的技术工作。 关于《人员要求》见(附件一)。 第七条 药品检验所应制订技术人员培养和业务进修规划,通过多种渠道、多种形式实施对各级技术人员的培训和考核,注重对业务技术骨干和学科带头人的培养,严格控制行政和后勤人员比例。 第三章 质量保证体系 第八条 药品检验所应建立质量保证体系,所涉及的方面有:①检测过程质量保证(如收检程序,检验依据及标准操作规程的执行,记录和报告的书写、核对、审核,检验数据的处理,报告书的签发等);②检测环境与仪器设备质量保证;③标准物质及实验动物、实验试剂的质量保证;④检验人员技术素质保证等。 质量保证体系中应有明确的分级责任制度,以确保药品检验全过程的工作质量,保证药品检验、新药审核、标准复核、科研结果等各项报告的准确可靠性。 第九条 为检查、督促各项质量保证制度的执行,药品检验所应设立质量保证监督检查员(下称质保督查员)。 质保督查员应具有多年药检实验室工作经验,具备中级以上技术职称,由所长聘任,独立地进行工作,直接对所长负责。 第十条 质保督查员应对收检、检验、实验记录、不合格药品或检验结果处于可疑情况的复验与处理、实验室设施和仪器设备、科研工作等进行督查。 第十一条 质保督查工作应制订年度计划;定期或不定期检查有关部门各项质量保证制度的执行情况;写出检查记录,包括日期、目的、内容、执行情况、建议和意见、检查者姓名等。发现重大问题及时报告。 在从事专项检查时,质保督查员中与该项目有关的人员应予回避。 第四章 实验室设施 第十二条 实验室条件应满足工作任务的要求,有完善的实验设施。实验室的环境应清洁、卫生、安静、无污染。实验室内的管线设置应整齐,要有安全管理措施和报警、应急及急救设施。用于放射性药品及菌毒种、疫苗检验的实验室,应有相适应的安全保护设施。 第十三条 药品检验所建筑面积(包括实验用房、辅助用房)应与其职能要求相适应。实验室应与办公室分开。 第十四条 具有与检品要求相适应的专用或兼用的采样间。 第十五条 具有符合留存样品要求的留样间。 第十六条 对于易燃、剧毒和有腐蚀性的物质,应按规定存放、使用。 各类压力容器的存放、使用,应有安全隔离设施。 第十七条 仪器放置的场所应符合要求,并便于仪器操作、清洁和维修,要有适当的防尘、防震、通风及专用的排气等设施;对温度或湿度变化敏感易影响检测结果的仪器,应备有恒温或除湿装置。仪器所用电源应保证电压恒定,有足够容量,并有良好的专用地线。 第十八条 无菌检查、微生物限度检查与抗生素微生物检定的实验室,应严格分开。 无菌检查、微生物限度检查实验室分无菌操作间和缓冲间。无菌操作间应具备相应的空调净化设施和环境,采用局部百级措施时,其环境应符合万级洁净度要求。进入无菌操作间应有人净和物净的设施。无菌操作间应根据检验品种的需要,保持对邻室的相对正压或相对负压,并定期检测洁净度。无菌操作间内禁放杂物,并应制定地面、门窗、墙壁、设施等的定期清洁、灭菌规程。 抗生素微生物检定实验室分为半无菌操作间和缓冲间。半无菌操作间设有紫外线灯;操作台宜稳固,并保持水平。实验室内应光线明亮,并有控制温度、湿度的设备。实验室内应注意防止抗生素的交叉污染。 第十九条 实验动物和动物实验设施应符合国家实验动物主管部门的有关规定。实验动物房的面积要满足工作的要求,各所可根据工作任务、使用动物品种、数量的不同而有所差异。 药品检定中使用的实验动物应具有质量合格证明,并确实达到合格证规定的质量标准。药品检定中使用的小鼠、大鼠等啮齿类动物应达到清洁级或无特定病原体(即SPF)级实验动物的标准。 动物实验设施及条件(含建筑设施、环境条件、饲料等)应与检定中使用的实验动物等级相一致,达到相应的国家标准,并符合药品检定工作的特殊要求。 各所应配备技术人员负责实验动物管理工作,从事实验动物工作的人员应具有相应的专业知识并进行定期培训。 不同种属或品系的动物应分舍饲养。同种但用于不同实验的动物,不宜在同室饲养;如同室饲养,至少应在空间上适当分隔,并作明显识别标志。 实验动物设施必须具有洗刷消毒设备,定期对笼器进行消毒。 第五章 仪器设备 第二十条 仪器设备的种类、数量、各种参数,应能满足所承担的药品检验、复核、仲裁等的需要,有必要的备品、备件和附件。仪器的量程、精度与分辨率等能覆盖被测药品标准技术指标的要求。 第二十一条 仪器应有专人管理,定期校验检定,对不合格、待修、待检的仪器,要有明显的状态标志,并应及时进行相应的处理。仪器使用人应经考核合格后方可操作仪器。 第二十二条 凡精密仪器设备应建立管理档案,其内容包括品名、型号、制造厂名、到货、验收及使用的日期、出厂合格证和检定合格证、操作维修说明书、使用情况、维修记录、附件情况等,进口仪器设备的主要使用说明部分应附有中文译文。 第二十三条 精密仪器的使用应有使用登记制度。 第六章 标准品和对照品的管理 第二十四条 中国药品生物制品检定所负责国家药品标准品、对照品的标定和管理。 第二十五条 省级药品检验所应协助中国药品生物制品检定所负责辖区内新药标准品、对照品原料的提供。 第二十六条 各级药检所应有专人负责标准品、对照品的管理。 第五章 标准操作规程 第二十七条 为提高检验工作质量,确保检验数据的可靠性,应制订各项检验的标准操作规程(SOP)。SOP应写明操作程序,其内容应明确、详细。 SOP的制定和修订,应按规定的程序进行,经所长批准后实施;制定内容及修订原因,应保存原始制定和修订记录并存档。 第二十八条 SOP应存放于各有关实验场所。 第二十九条 需制定SOP的项目有: (一)仪器与设备的使用 (二)通用的药品检验技术与方法 (三)专用的药品检验技术与方法 (四)动物及动物室的管理 (五)试剂及试药溶液的配制与管理 (六)其它 第八章 实验室管理制度 第三十条 为保证实验室工作的有序进行,药品检验所必须制订一系列的各项实验室管理制度,主要包括下列内容: (一)实验室工作制度。 (二)实验室安全制度。 (三)检品的收检、检验、留样制度(见附件二)。 (四)新药、仿制药品药学审核制度。 (五)科研工作管理制度。 (六)中药标本管理与使用制度。 (七)菌、毒种及细胞系保管制度。 (八)药品标准物质管理制度。 (九)计量管理制度。 (十)精密仪器管理制度。 (十一)保密制度。 (十二)差错事故管理制度。 (十三)技术人员培训进修制度。 (十四)计算机管理制度。 各所还可根据本所情况,补充有关制度。 第九章 检验记录与检验报告书 第三十一条 检验记录是出具检验报告书的原始依据。为保证药品检验工作的科学性和规范化,检验原始记录必须用蓝黑墨水或碳素笔书写,做到记录原始、数据真实、字迹清晰、资料完整。 第三十二条 原始检验记录应按页编号,按规定归档保存,内容不得私自泄露。 第三十三条 检验报告书是对药品质量作出的技术鉴定,是具有法律效力的
[color=red]转自小木虫论坛:重要推荐,限期一周下载。我自己当时没有下载,只是提供了信息。有侵权嫌疑啊![em53] 其实这两本书很好,可以买来看。240元一本,共480元。心疼钱的请与楼下的两位已经下载的朋友联系 茅茅 06.1.20留[/color] 2005年版中国药品检验标准操作规范与药品检验仪器操作规程,pdf文件,23.9M, 中国医药科技电子出版社,上下两卷!全书分为10压缩部分,全部下载后解压即可。全书1064页,是中国药品生物制品检定所组织全国各药品检验所共同编写了2005年版《中国药品检验标准操作规范》一书配套的电子版,可复制.全部内容。下载办法:在www.56.com申请一个信箱,登陆信箱后,选择共享资源beta,然后输入qcbnj即可看到该资料。http://bbs.sdatc.com/read.php?tid=3063
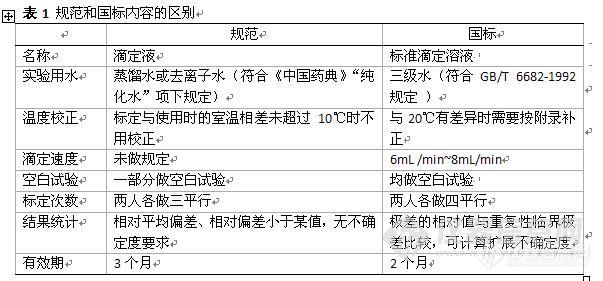
浅谈药品检验和食品检验用滴定液的区别Differences of Standard Solution between Drug Analysis and Food Analysis 随着食品药品监督管理部门行政监管范围的不断扩大,由其设置的药品检验机构所承担的检验对象也由原来单纯的药品扩大到现在的药品、食品、化妆品等。对于药品检验机构来说,要做好食品的检验工作,必须转变原有药品检验的业务管理模式,以适应食品、药品检验的不同需求。而对于容量分析中用到的滴定液,药品检验用和食品检验用,有着不同的要求,而滴定液是容量分析的基础,它的准确直接关系到容量分析结果的精确性。本文对药品、食品检验用的滴定液(标准滴定溶液)之间的区别做一比较和阐述。1依据文件 药品检验中用到的滴定液是按照《中国药典》2010年版二部附录ⅩV F【1】(以下简称药典)、《中国药品检验标准操作规范》2010年版【2】(以下简称规范)来配制标定。 食品检验中用到的滴定液均按照GB/T 601 2002 化学试剂 标准滴定溶液的制备【3】(以下简称国标)来配制标定。 药典主要登载滴定液的配制标定,规范主要登载滴定液的计算、注意事项等。 国标涵盖了滴定液配制标定的一般要求和具体要求,并包含了附录A 不同温度下标准滴定溶液的体积的补正值、附录B 标准滴定溶液浓度平均值不确定度的计算。 除个别品种外,两者之间的区别见表1。 http://ng1.17img.cn/bbsfiles/images/2011/08/201108312130_313397_1645752_3.jpg2品种数量及用语 药典载有32类滴定液的配制与标定,其中四苯硼钠、甲醇制氢氧化钾、甲醇钠、甲醇锂、氢氧化四丁基铵、氢氧化四甲基铵、烃胺盐、高氯酸钡、硝酸汞、硝酸铋、氯化钡、锌滴定液、醋酸钠滴定液13类滴定液是国标未有的。国标载有24类滴定液的配制与标定,其中碳酸钠、氯化锌、氯化镁、硝酸铅、氯化钠滴定液5类滴定液是药典未有的。药典和国标均载有的滴定液有19种,但具体的配制和标定均有差别。 一些用语的差异,如药典用ml,国标用mL;药典叫滤过,国标叫过滤;药典叫乙醇制氢氧化钾滴定液,国标叫氢氧化钾-乙醇标准滴定溶液。
想要一份药品检验所滴定液的费用,想参考一下
各省、自治区、直辖市食品药品监督管理局、新疆生产建设兵团食品药品监督管理局,中国食品药品检定研究院、各有关食品药品检验检测机构: 能力验证是加强实验室质量管理以及评价和提高实验室技术能力的重要手段,能力验证的结果可作为承担相应检验检测任务的参考依据。为进一步贯彻落实《食品药品监管总局关于加强食品药品检验检测体系建设的指导意见》,推动食品药品检验检测机构能力水平的全面提升,现就加强食品药品监管系统检验检测能力验证工作的有关事项通知如下: 一、能力验证工作的组织 食品药品监管总局(以下简称总局)负责食品药品检验检测能力验证工作的组织领导。中国食品药品检定研究院(以下简称中检院)承担总局能力验证工作的组织实施。相关省级食品药品检验机构根据需要配合中检院承担能力验证相关项目的具体实施工作。 各级食品药品监督管理部门负责组织、协调、指导所属检验检测机构参加总局组织的能力验证。 二、能力验证计划的制定和实施 总局负责组织制定和发布能力验证计划,指导能力验证计划的实施。每年的能力验证计划一般应于上一年度12月底前印发。 中检院根据总局能力验证计划,负责组织制定和实施能力验证工作方案,组织开展能力验证活动。 三、能力验证工作的要求 (一)各级食品药品监督管理部门要鼓励所属检验检测机构积极参加总局组织的能力验证。 (二)中检院和相关承担单位要高度重视总局组织的能力验证工作,及时制定能力验证工作方案并组织实施;要配备足够的资源,保证科学、规范地完成总局能力验证计划,建立并保存能力验证工作档案和相关记录。中检院应当于每年11月底前完成总局能力验证计划,并向总局科技标准司提交能力验证年度工作报告。 (三)各级食品药品监管部门所属检验检测机构要积极参加总局组织的能力验证;总局组织的能力验证也接受其他系统的检验检测机构和社会检验检测机构、实验室提出的能力验证申请。 (四)总局能力验证的参加者要正确认识和理解能力验证活动的本质,按照能力验证计划的要求真实、客观、及时地报送检测结果,并确保数据的完整、规范与真实。能力验证结果为可疑或离群的参加者,应当认真查找原因,主动采取整改和验证措施。中检院和相关省级检验检测机构应为相关参加者的整改工作提供必要的技术指导。 (五)总局能力验证的参加者应当保存相关记录,并向中检院及时反馈相关信息。对能力验证的结果有异议的,可以向中检院进行申诉;对于在能力验证工作中存在的违规行为,可以向总局投诉。 四、能力验证结果的公布 (一)对于在参加总局组织的能力验证活动中结果为满意的检验检测机构和实验室,总局将公布名录。 (二)对于在参加总局组织的能力验证活动中串通或伪造数据的检验检测机构和实验室,总局将予以通报。 食品药品监管总局科技标准司联系人:张学博,电话:010-88330923。 中检院检验机构能力评价研究中心联系人:项新华,电话:010-67095943。 食品药品监管总局办公厅 2016年8月19日
中国食品药品检定研究院2017年能力验证计划序号代码计划名称测试/测量项目可能涉及的测试/测量方法发样时间预计费用(元)备注1NIFDCNIFDCNIFDCNIFDC-PT-092溶液pH值测定pH值中国药典2015年版四部通版四部通则2017月5月1000食药总局项目2NIFDCNIFDCNIFDCNIFDC-PT-093尼美舒利的含量测定尼美舒利含量(电位滴定法)中国药典2015年版四部通年版四部通则07012017年3月1000食药总局项目;广东所实施3NIFDCNIFDCNIFDCNIFDC-PT-094六味安消胶囊含量测定大黄素、酚中国药典 2015版 含量测定2017年5月1200食药总局项目4NIFDCNIFDCNIFDCNIFDC-PT-095苯甲醇含量测定含量测定中国药典2015版四部 苯甲醇2017年5月1000食药总局项目5NIFDCNIFDCNIFDCNIFDC-PT-096输注器具溶出液铅镉含量溶液中铅、镉含量GB/T 14233.1-2008 医用输液、血注射器具检验方法第1部分:化学分化学分析方法2017年5月1000食药总局项目6NIFDCNIFDCNIFDCNIFDC-PT-097明胶中铬的测定铬GB 5009.123-2014食品安全国家标准 食品中铬的测定2017年3月1100食药总局项目7NIFDCNIFDCNIFDCNIFDC-PT-098乳粉中沙门氏菌检验沙门氏菌定性(血清分型选做)GB 4789.4GB 4789.4-2010 食品安全国家标准 食品微生物学检验 沙门氏菌检验2017年5月1000食药总局项目8NIFDCNIFDCNIFDCNIFDC-PT-099注射用青蒿琥酯含量测定青蒿琥酯含量(HPLC法)中国药典2015年版四部通年版四部通则05122017年3月1000广西所实施9NIFDCNIFDCNIFDCNIFDC-PT-100细菌内毒素检测能力验证计划细菌内毒素检测中国药典2015年版四部通年版四部通则11432017月5月1000
[color=#DC143C]2005版中国药品检验标准操作规范与药品检验仪器操作规程[/color] [size=4]药品生物制品鉴定所编[/size][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=163474]2005版中国药品检验标准操作规范与药品检验仪器操作规程[/url]
继之前6月26日中国食品药品检定研究院2013年专项仪器购置项目1800万元中标结果公布后,2013年7月10日,国信招标集团股份有限公司公布中国食品药品检定研究院2013年专项仪器购置项目结果,本次采购包括PCR、激光成像系统等专项仪器。 1. 项目名称:中国食品药品检定研究院2013年专项仪器购置项目(国信) 2. 招标编号:GXTC-1215022包号序号招标货物名称数量预算控制价(万元)第一包1-1基因扩增仪11001-2基因扩增仪1第二包2-1偏光显微镜1642-2生物显微镜12-3生物显微镜1第三包3-1-溶出度仪155第四包4-1激光成像系统179第五包5-1层析系统148第六包6-1多普勒弦线式体模1566-2可编程多普勒仿血流体模1第七包7-1红外激光光束分析仪1577-2分光辐射亮度仪1第八包[align=
您好:我用三氯化铁,2,2—联吡啶法测量维生素E,我将维生素E标准品(中国药品生物制品检定所)溶于无水乙醇中,加三氯化铁,2,2—联吡啶后溶液没有变色,您看这是因为什么。
链接:http://www.instrument.com.cn/news/20101026/049666.shtml 中国药品生物制品检定所药品检验装备购置项目招标公告 中国药品生物制品检定所药品检验装备购置项目配套资金已经落实,经主管采购单位审批,已具备政府采购公开招标条件。中国仪器进出口(集团)公司受中国药品生物制品检定所委托,按照《中华人民共和国招标投标法》、《中华人民共和国政府采购法》等相关法律法规的规定,对该项目所需服务进行政府采购公开招标。欢迎符合项目资质要求的投标人参与投标。项目基本信息如下: 一、项目编号:10CNIC-032079-20 二、项目名称:中国药品生物制品检定所药品检验装备购置项目 三、招标内容:包号采购设备品目数量台/套备注第一包电感耦合等离子体发射光谱仪1接受进口产品投标第二包毛细管电泳-二维芯片液相-四极杆飞行时间质谱联用仪1接受进口产品投标第三包基质辅助激光解离离子化-串联飞行时间质谱仪1接受进口产品投标第四包高效液相色谱仪1接受进口产品投标 具体要求见招标文件第六部分。 四、投标人资质要求: 1. 依照《中华人民共和国政府采购法》相关要求,投标人参加本次采购活动应当具备下列条件; a) 具有独立承担民事责任的能力; b) 具有良好的商业信誉和健全的财务会计制度; c) 具有履行合同所必需的设备和专业技术能力; d) 有依法缴纳税收和社会保障资金的良好记录; e) 参加招投标活动前三年内,在经营活动中没有重大违法记录; 2. 投标人企业注册资金(实收资本)不少于500万元人民币; 3. 投标人应就投标设备提交设备制造厂商针对本项目的授权; 4. 投标人应就投标设备提交设备制造厂商针对本项目的原厂售后服务承诺。 五、招标文件发售时间、地点和办法: 1. 招标文件发售时间:2010年10月20日至2010年10月29日,每个工作日9:00-11:00, 13:00-16:30。(北京时间,节假日除外)。 2. 招标文件发售地点:北京市西城区西直门外大街6号中仪大厦622室。 3. 招标文件发售方式:投标人应在本邀请规定时间、地点购买招标文件。本项目招标文件每包售价人民币300元,售后不退。投标人在购买招标文件时应同时递交经办人被授权相关证明原件(加盖投标人公章)及经办人身份证复印件作为备案。真实填写项目《招标文件购买登记表》。 六、接受投标时间、投标截止时间及开标时间: 1. 接受投标时间:2010年11月11日上午9:00前(北京时间)。 2. 投标截止时间:2010年11月11日上午9:00整(北京时间)。逾期或未按招标文件规定进行封装的投标文件将不被接受。 3. 开标时间:2010 年11月11日上午9:00整(北京时间)。 八、投标地点及开标地点: 北京市西城区西直门外大街6号中仪大厦3层会议室。届时欢迎投标企业的法定代表人或其授权的投标人代表出席项目开标会议。 九、招标公告发布媒介:中国政府采购网(www.ccgp.gov.cn); 十、其他要求: 1. 本次招标、投标、评标和合同授予均以包为单位,投标人必须就整个包进行响应,不完整的投标将被拒绝。 2. 本次招标不接受联合体投标。 3. 本次招标不接受备选方案及选择性投标。 4. 投标人购买招标文件后不参加投标的,请在开标前5天以书面形式通知招标代理机构。若该项目因不足三家而导致废标,未予书面通知的单位将被取消重新参加该项目投标的资格。 5. 本项目招标文件解释权归中国仪器进出口(集团)公司所有。 十一、招标代理机构信息 公司地址:北京市西直门外大街6号,中仪大厦622室 邮政编码:100044 联 系 人:张冠群、苏红、王黎曼 电 话:88316649、88316072、88316656 传 真:88316655 开户银行及账号: 户名:中国仪器进出口(集团)公司 开户银行:中国银行总行营业部 帐 号:00105008091001
比较全面的医院药品检验:一、医院药品检验的基本条件与要求 医疗单位制 无法入睡 抑郁症困扰 神奇的多囊肾新疗法! 聋哑耳鸣、头痛新疗法! 疤痕疙瘩、瘩痤疮找中医 剂室必须设立药检室,直属药剂科领导。并按制剂室规模高立化学分析间、仪器间、无菌间、留样观察定,动物饲养实验室等。 (一)药检室应配备药师以上的人员从事药检工作。 (二)药检室必须配备与所配制的制剂相适应的检验设备。如分析天平、酸度计、紫外分光光度计、自动旋光仪、显微镜、干燥箱、恒温培养箱、霉菌培养箱、冰箱、不溶性微粒检查装置、净化工作台、澄明度检测装置等。 (三)动物饲养实验室必须清洁卫生,通风良好,室温国差应符合实验要求,应有排水、污、采光、调温等设施。并应有专人管理。按编号挂牌、定期淘汰、更新,并有使用记录。 (四)制剂的成品要按规定进行全检,合格后方可使用。 (五)药检室必须有完整的检验卡。检验记录应编号归档,内容包括 质量标准来源,鉴别试验、测试数据;数据处理。结论等原始资料。 (六)根据检验结果应出具检验报告书,检验人、复核人签字后送药检室负责人审核签字(检验报告书一式二联,第一联存根、第二报告书)。全部的原始记录、检验报告单,按批号装订成册保存三年。检验记录应字迹清楚,内容真实完整并签字,不得撕毁和任意涂改。如需要更正时,应有更改人签字,并须使被更正的部分可以辨认。 (七)药检室对所配的制剂必须建立留样观察制度,指令专人管理,制剂在储存条件下的南量变化规律。留样数量,大输液每批4瓶。针剂(眼药制剂)每批20支。其它制剂品种视其质量稳定情况酌情留样。留样时间:灭制剂品种在本批号制剂用完后,留样留半年后可撤去。其它制剂品种可酌情而定。留样观察:在观察期内选取适当的批数进行规定项目的检验,大输液每月检查一次,其它制品种每月检查一次,认真填定记录,并保存三年。 (八)对制品种必须建立质量档案。内容包括原辅料情况、工艺、质量标准、检验方法的改进、留样观察结果及质量事故返工等。 (九)对质量事故和药物不良反应,应及时向医院药事管理委员会、院长和卫生行政部门汇报。 二、药品检验步骤 药品分析前,应对其外形特征如:色、嗅、味、批号、包装等情况进行说细观查。药品检验操作可作检品采取、鉴别、检查及含量测定等几个步骤。 (一)检品采取 1.检品采取要随机抽样。 2.乳浊液、混悬液等药品。要摇匀后采取。 3.散剂或颗粒状固体的检品,在采取前要经过粉碎、缩分。 4.检品取量。 (二)检品最低取样量,取决于下列条件: 1.颗粒愈大,最低取样量应愈大。 2.药品均匀度愈差,最低取样量应愈大。 3.分析要求准确愈高,允许误差愈小,最低取样量应愈大。 (三)鉴别 1.感官检查 检查外形特征如色、臭、昧等。 2.物理常数测定及光谙分析 如比重、折光率、比旋度及紫外、红外光谱分析等。 3.化学特性试验 是根据检品化学反结构特征与试剂产生反应,以示鉴别。常采用的方法有:试管法、点滴反应、显微结晶反应、及荧光反应法等。 (四)检查 一般检查其氯化物、硫酸盐、铁盐、重金属、砷盐、水分、鞣质、草酸盐及蛋白质等。常用的制剂则可按不同剂型做规定项目的检查。 (五)含量测定 药品经鉴别及检查后,方可按各有关项下规定的方法做含量测定。 (六)注意事项 1.检验人员操作时须谨慎仔细,并随时详细、真实而整洁地做好检验记录。 2.记录的内容可按不同需要而定,一般包括:检品名称、规格、制造日期、批号,检验目的、送检数量,包装。并记录检验方法,检验者校对者等项。3.检验人员每当检验完毕,要经详细校对,填写检验报告。并注明“可供药用”,“可供注射用”或、“检验不合格”等字样。 报告单需有检验者,校对者的签署,文字均应书定清晰不得涂改。三、药品的一般鉴别试验 (一)钾盐 (1)取铂丝,用盐酸湿润后,蘸取供试品,在无色炎焰中燃烧,火焰即显紫色。但有少量钠混合时,须隔蓝色玻璃透视方能辨认。 2K++[PtCI6]2-→K2PtCI6 (2)取供试品溶液,加亚硝酸钴钠试液与醋酸,即发生黄色沉淀。2K++Na++[Co(NO2)6]3-→K2Na[C(NO2)6]↓(黄色) 该反应在中性或微酸性溶液中进行,因而碱和酸均能分解试剂中的[Co(NO2)6]-3离子,妨碍鉴定。 在碱性中:[Co(NO2)6]3- +3OH-→Co(NH)3↓+6NO-2 在酸性中:[Co(NO2)6]3- +6H+→Co+3NO↑+3NO2↑+3H2O NH+4能干扰反应,NH的存在能与NH+4[Co(NO2)6]作用,生成生成(NH4)Na[Co(NO2)6]沉淀。在鉴定K前应除NH(可用灼烧法除去),I也有干扰作用(可在蒸发皿中加NHO3蒸发至干而除去)。 (3)取供试品,加热除去可能杂有的盐,放冷后,加水溶解,再加深.1%四苯硼钠溶液与醋权即生白色沉淀。 NaB(C6H5)4+K+→KB(C4H5)6↓+Na+反应条件须在酸笥(PH2-6.)中进行。
为落实《国家药监局关于改革完善放射性药品审评审批管理体系的意见》,鼓励有能力和条件的药品检验机构开展锝标记及正电子类放射性药品检验能力的建设,增加有资质的检验机构,国家药监局组织制定了锝标记及正电子类放射性药品检验机构评定程序,2024年3月7日发布,自发布之日起施行。在实验仪器设备方面,《国家药监局锝标记及正电子类放射性药品检验机构评定程序》对药品检验机构的要求如下:(1)应配备与放射性药品检验工作相适应的仪器设备,仪器设备应按检验项目进行功能划分,合理布局,避免不同检验项目相互干扰。放射性药品检验实验室配置的主要仪器设备可参考表1。(2)实验室应制定检验设备和辐射防护监测设备的操作规程、使用记录、维护保养、校准方案等相关文件。应确保设备功能正常并防止污染或性能退化。(3)放射性药品检验用仪器应进行检定、校准或核查。应配备仪器期间核查相关的放射性标准源,并定期进行复核和必要的调整,以保持对校准状态的可信度。(4)放射性药品检验用仪器的检定、校准或核查项目应满足检验要求。(5)放射性校准源应由具备能力的标准物质生产者提供(满足ISO17034要求的标准物质生产者被视为是有能力的)。应确保放射性标准源满足检验要求,如γ谱仪标准源的γ光子能量应涵盖待测核素的主要光子能量,大小、体积、介质和容器材料应与样品相同。[align=center][/align][align=center][b][color=#ff0000]表1:锝标记及正电子类放射性药品检验实验室建议配置的[/color][/b][/align][align=center][b][color=#ff0000]主要仪器设备[/color][/b][/align][table][tr][td=1,1,124]序号[/td][td=1,1,433]仪器设备名称[/td][/tr][tr][td=1,1,124]1[/td][td=1,1,433]放射性活度计[/td][/tr][tr][td=1,1,124]2[/td][td=1,1,433]放射性薄层色谱扫描仪[/td][/tr][tr][td=1,1,124]3[/td][td=1,1,433]γ能谱仪[/td][/tr][tr][td=1,1,124]4[/td][td=1,1,433]γ计数器[/td][/tr][tr][td=1,1,124]5[/td][td=1,1,433]液体闪烁计数器[/td][/tr][tr][td=1,1,124]6[/td][td=1,1,433]铅防护手套箱[/td][/tr][tr][td=1,1,124]7[/td][td=1,1,433]辐射剂量监测仪[/td][/tr][tr][td=1,1,124]8[/td][td=1,1,433]表面污染监测仪[/td][/tr][tr][td=1,1,124]9[/td][td=1,1,433]紫外可见分光光度计[/td][/tr][tr][td=1,1,124]10[/td][td=1,1,433][url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱仪[/color][/url][/td][/tr][tr][td=1,1,124]11[/td][td=1,1,433]高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱仪[/color][/url](含放射性检测器)[/td][/tr][tr][td=1,1,124]12[/td][td=1,1,433]电子分析天平[/td][/tr][tr][td=1,1,124]13[/td][td=1,1,433]酸度计[/td][/tr][tr][td=1,1,124]14[/td][td=1,1,433]微量渗透压测定仪[/td][/tr][tr][td=1,1,124]15[/td][td=1,1,433]可见异物测定仪[/td][/tr][tr][td=1,1,124]16[/td][td=1,1,433]照相显微镜[/td][/tr][tr][td=1,1,124]17[/td][td=1,1,433]电热干燥箱[/td][/tr][tr][td=1,1,124]18[/td][td=1,1,433]超净工作台或隔离器[/td][/tr][tr][td=1,1,124]19[/td][td=1,1,433]精密恒温水浴箱(或其他具备相同功能的设备)[/td][/tr][tr][td=1,1,124]20[/td][td=1,1,433]离心机[/td][/tr][tr][td=1,1,124]21[/td][td=1,1,433]低温冰箱[/td][/tr][tr][td=1,1,124]22[/td][td=1,1,433]蒸汽灭菌锅[/td][/tr][tr][td=1,1,124]23[/td][td=1,1,433]生物安全柜[/td][/tr][tr][td=1,1,124]24[/td][td=1,1,433]恒温培养箱[/td][/tr][tr][td=1,1,124]25[/td][td=1,1,433]浮游菌采样器[/td][/tr][tr][td=1,1,124]26[/td][td=1,1,433]尘埃粒子计数器[/td][/tr][tr][td=1,1,124]27[/td][td=1,1,433]旋涡混合器[/td][/tr][tr][td=1,1,124]28[/td][td=1,1,433]超纯水机[/td][/tr][/table]注:上述仪器设备为锝标记及正电子类放射性药品检验所需要的基本配备。[来源:仪器信息网] 未经授权不得转载[align=right][/align]
食品药品检验所现出具的药品检验报告是全国统一的样版,对检验合格(不合格)的药品检验结论为:本品按××××检验,结果符合(不符合)规定。但是报告做为食品药品监督管理局的处罚依据来说很不明了,没有直接给出该药品是假药还是劣药,以及判定假劣药的依据,对立案处罚不利。请教各位老师,在这一点上我们应该怎样规范呢?
食品与药品有其各自的属性,与之对应在检验理念、思路、方式、标准的制定上都有各自的不同,不能将其二者简单等同,也不能合并同类项,简单归为同类检验。食品是可供人类食用或饮用的物质,包括加工食品,半成品和未加工食品,不包括烟草或只作药品用的物质。药品是用于预防、治疗、诊断人的疾病,有目的的调节人的生理机能并规定有适应证、用法和用量的物质。下面就其二者在检验方面的“和而不同”予以分析。一、食品、药品检验需同等资质,要求不同要开展食品、药品的相关检验检测必须要获得检验资质,药品检验需要获得“实验室资质认定”资质,才能开展药品检验;食品检验需要获得“食品检验机构资质认定”资质,才能开展食品检验工作,“实验室资质认定”包括24个要素,“食品检验机构资质认定”除了与“实验室资质认定”的条件一致外,还包括8个特殊要素。二、食品、药品检验同性质,针对方向不同食品、药品的检验都是围绕着检验检测工作开展的,但针对的侧重点不同,食品检验重点是安全性,主要是对人体有害的物质,比如重金属、防腐剂、添加剂、有毒有害物质进行检验,而药品检验除了安全性外还要兼顾有效性,要针对其有效物质进行检验,对其每一项或主要成分检验,尤其是针对有效成分的含量是否达标进行检验。简而言之,就是食品检验重点是针对安全性;药品检验重点是安全性兼顾有效性。三、食品、药品检验同需标准,标准适用范围不同食品检验与药品检验都必须按照检验标准进行检验,食品检验的标准是按食品的分类进行制定的,概括起来就是“一标多类”或是“多类一标”,比如重金属的食品检验标准适用于餐饮食品、农产品、海鲜产品等,即一个标准适用多类食品;而药品检验是按照《中国药典》进行检验,而《中国药典》是按照药品的名称进行标准编写的,完全实现“一品一标”,即一个药品名称对应一个标准。四、食品、药品检验的技术手段相同,“批检验”程度不同食品、药品检验都需要借助相关仪器设备,比如:高效液相色谱仪、[url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url]、紫外分光光度计等,食品检验标准多是“一标多类”,在检验过程中的前处理、检验条件是相同的,在相应的检验检测仪器设备上可以进行一次性检验,也就是说一个食品标准里涵盖的各类食品可以进行“批检验”,而药品检验标准是“一品一标”,每个品种项下的检验方法、条件都不相同,只有同品种药品才能实现“批检验”。五、食品、药品检验过程相同、检验分配方式不同食品、药品检验过程需要经过检品的前处理,然后借助相关仪器设备进行检验检测,但检验分配方式不同,食品检验一般是以检验项目为主,检验设置,任务分配上都是以“项目”导向,而药品检验恰恰相反是以“品种”检验为主,在检验设置、任务分配、实验流程以品种为导向,是完成一个品种的检验。
[color=#8645ba][b]一、食品、药品检验需同等资质,要求不同[/b][/color]要开展食品、药品的相关检验检测必须要获得检验资质,药品检验需要获得“实验室资质认定”资质,才能开展药品检验;食品检验需要获得“食品检验机构资质认定”资质,才能开展食品检验工作,“实验室资质认定”包括24个要素,“食品检验机构资质认定”除了与“实验室资质认定”的条件一致外,还包括8个特殊要素。[color=#8645ba][b]二、食品、药品检验同性质,针对方向不同[/b][/color]食品、药品的检验都是围绕着检验检测工作开展的,但针对的侧重点不同,食品检验重点是安全性,主要是对人体有害的物质,比如重金属、防腐剂、添加剂、有毒有害物质进行检验,而药品检验除了安全性外还要兼顾有效性,要针对其有效物质进行检验,对其每一项或主要成分检验,尤其是针对有效成分的含量是否达标进行检验。简而言之,就是食品检验重点是针对安全性;药品检验重点是安全性兼顾有效性。[color=#8645ba][b]三、食品、药品检验同需标准,标准适用范围不同[/b][/color]食品检验与药品检验都必须按照检验标准进行检验,食品检验的标准是按食品的分类进行制定的,概括起来就是“一标多类”或是“多类一标”,比如重金属的食品检验标准适用于餐饮食品、农产品、海鲜产品等,即一个标准适用多类食品;而药品检验是按照《中国药典》进行检验,而《中国药典》是按照药品的名称进行标准编写的,完全实现“一品一标”,即一个药品名称对应一个标准。[color=#8645ba][b]四、食品、药品检验的技术手段相同,“批检验”程度不同[/b][/color]食品、药品检验都需要借助相关仪器设备,比如:高效液相色谱仪、[url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url]、紫外风光光度计等,食品检验标准多是“一标多类”,在检验过程中的前处理、检验条件是相同的,在相应的检验检测仪器设备上可以进行一次性检验,也就是说一个食品标准里涵盖的各类食品可以进行“批检验”,而药品检验标准是“一品一标”,每个品种项下的检验方法、条件都不相同,只有同品种药品才能实现“批检验”。[color=#8645ba][b]五、食品、药品检验过程相同、检验分配方式不同[/b][/color]食品、药品检验过程需要经过检品的前处理,然后借助相关仪器设备进行检验检测,但检验分配方式不同,食品检验一般是以检验项目为主,检验设置,任务分配上都是以“项目”导向,而药品检验恰恰相反是以“品种”检验为主,在检验设置、任务分配、实验流程以品种为导向,是完成一个品种的检验。
中国药品检验标准操作规范与药品检验仪器操作规程[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=96429]中国药品检验标准操作规范与药品检验仪器操作规程[/url][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=96428]中国药品检验标准操作规范与药品检验仪器操作规程[/url][color=#d40a00][size=5][b][i][u]试了一下,可以下载的,呵呵012304休改可惜楼主N/A了[/u][/i][/b][/size][/color]
(中国医药报6月1日A8版) 编者按:从事药品检验工作的专业人士都清楚:常规的药品检验是依照药品标准,使用规定的检验条件和检验方法对已知成分进行检验。而要对药品中的未知成分进行检验,则先要找到并确认未知成分,在此基础上,建立检验条件和检验方法,其难度不亚于大海捞针。齐齐哈尔第二制药有限公司(下称齐二药)假药事件发生后,广东省药品检验所检验人员在没有生产企业提供原辅料的情况下,经过五天五夜连续奋战,终于查出隐藏在亮菌甲素注射液中的元凶——“二甘醇”,为临床救治病人提供了科学依据,赢得了宝贵时间,也为食品药品监管部门判定该药为假药以及在全国范围内封杀齐二药产品提供了直接依据。 5月30日,在全国整顿和规范药品市场秩序工作会议上,谈及此次齐二药假药事件发生后,全国食品药品监管部门认真贯彻落实温家宝总理、吴仪副总理重要指示,迅速全面开展调查、取证、技术鉴定和查封扣押等工作,中国药品生物制品检定所所长桑国卫深有感触:“美国发生‘二甘醇’药害事件,用了近两个月才查清原因;海地发生‘二甘醇’药害事件,用了几年时间才查清原因。广东省药品检验所仅用5天时间,就从齐二药生产的亮菌甲素注射液中检测出‘二甘醇’,并建立了相关检测方法,说明该所的技术力量能够为药品安全突发事件提供有力的技术支撑。广东省药品检验所在这一事件中立了大功。”齐二药假药事件发生后,广东省药品检验所检验人员查阅大量中外文献资料,根据产品处方工艺设计了多套实验方案。以与相关辅料和其他厂家生产的相同品种进行比对实验和急性毒性预试验为突破口,展开了一系列资料排查和实验排查工作。该所检验人员放弃节日休假,与时间赛跑,终于赢得了这场“战斗”的胜利。 ■ADR监测:在关键时刻发挥巨大作用 药品不良反应(下称ADR)监测的价值在于在最广泛的范围内对所有与用药相关的有害事件进行全面的监控。广东省ADR监测中心自2002年建立以来,一直致力于全省药品ADR监测网络建设。目前,该省已初步建立起以省ADR监测中心为核心,以各市ADR监测中心为支持的网络模式。通过制定有关ADR监测标准工作流程和内部规范,使ADR的接收、录入、核实、评价、反馈、上报、统计等多个环节均有明确规定。一旦发现可疑的ADR,第一发现单位可立即通过全国ADR监测网进行网络上报;发现新的、严重的ADR,可通过电话或传真,在第一时间告知当地ADR监测中心,省ADR监测中心同时指导各地进行资料的收集、核实和汇总工作。 5月2日19时,广东省ADR监测中心接广州市ADR监测中心报告,称4月23日~30日,中山大学第三附属医院(下称中山三院)出现8例疑似急性肾功能衰竭病人。这些病人均使用了齐二药生产的规格为5mg/10ml、标示批号为06030501的亮菌甲素注射液。经医院专家会诊,发病原因怀疑与药品不良反应有关。该院于5月1日在全院范围内停用该药。 3日,广东省ADR监测中心工作人员协助中山三院把药品不良反应/事件报告表和相关情况上报国家ADR监测中心,并通过电话向国家食品药品监管局及广东省食品药品监管局报告情况。 同日,广东省ADR监测中心工作人员赶赴中山三院参加由全省肝肾病专家组成的专家小组讨论会,确认中山三院出现8例疑似亮菌甲素注射液引起急性肾功能衰竭的具体情况,并获得病历摘要等第一手资料。 鉴于不能排除药品质量问题,广东省ADR监测中心副主任邓剑雄立即向广东省食品药品监管局报告情况。 4日,广东省食品药品监管局分管领导、广东省ADR监测中心负责同志陪同国家食品药品监管局药品安全监管司和国家ADR监测中心专家赶赴中山三院,开展ADR关联性评价资料收集工作。 通过对中山三院使用亮菌甲素注射液历史情况的调查,专家意识到,这不是一起简单的药品不良反应,极有可能与药品质量有关。于是,一场针对药品质量的相关检查、检测工作全面展开。

为进一步加强食品药品检验检测体系建设,更好地发挥检验检测技术支撑的重要作用,国家食品药品监管总局制定了《关于加强食品药品检验检测体系建设的指导意见》(以下简称《指导意见》),2014年12月18日经总局局长办公会审议通过,于2015年1月23日印发。http://ng1.17img.cn/bbsfiles/images/2015/03/201503050951_537255_2987572_3.jpg 《指导意见》充分考虑了食品药品检验检测的专业性和技术性,按照优化配置资源、提升能力水平、保持检验检测体系的系统性的指导思想,确定了“到2020年,建立完善以国家级检验检测机构为龙头,省级检验检测机构为骨干,市、县级检验检测机构为基础,科学、公正、权威、高效的食品药品检验检测体系,充分发挥第三方检验检测机构的作用,使检验检测能力基本满足食品药品监管和产业发展需要”的总体目标。 《指导意见》提出了食品药品检验检测(wwwsumspringcom)体系“四三二”的层级架构模式,即食品(含保健食品)检验检测体系重点支持建设国家、省、市、县四级检验检测机构;药品化妆品(统称药品)检验检测体系重点支持国家、省、市三级检验检测机构;医疗器械检验检测体系重点支持建设国家、省两级检验检测机构;明确了各层级检验检测机构的功能定位,强化了检验检测体系服务食品药品监管的核心职能,突出了检验检测机构的公益性属性。部署了落实改革任务、强化硬件保障、加强人才队伍培养、完善制度体系、提升检验检测科研能力、推动检验检测信息共享六项重点任务,建立完善了统一认识、加强领导,明确机构、落实责任,统筹协调、形成合力,加强考核、促进发展四项保障机制。 《指导意见》的制定发布,标志着总局食品药品检验检测体系的顶层设计已初步完成,为进一步加强食品药品检验检测体系建设,提升检验检测能力,服务食品药品监管奠定良好基础。文章来自济南三泉中石实验仪器检测
1.概述 本文作者参与了深圳市药品检验所新建工程空调通风系统的设计,该所是负责深圳市药品、保健品、化妆品、医疗器械等产品检验及质量监督的法定机构,建筑物主要功能是对多种药品及医疗器械进行检验检测。该建筑从功能上分为管理部门、检验部门和配套服务部门。其中检测部门包括药品检验,医疗器械检测,保健品、化妆品检验,公共检测中心,动物房及动物实验室。检测部门总建筑面积约一万平方米。 各不同功能实验室分布如下:地上部分实验楼主楼呈Z型,分前楼及后楼,前楼为五层,后楼四层,中间由电梯厅走廊,卫生间及辅助用房连接。主楼底层前楼为检品收发厅及业务科,后楼为留样区及总务库房。主楼的二层,前楼为行政办公,后楼为中药室。主楼的三层,前楼为化学室,后楼为生测室及洁净区细胞实验室。主楼的四层,前楼为抗生素室,后楼(顶层)为洁净区细胞实验室。主楼的五层,前楼(顶层)为保健品化妆品室。北段医疗器械检测楼共四层。一层设有单独的检品收发室。 一~三层为医械检测实验及办公室。四层为公共检测中心。 本文介绍实验室通风系统的特点和要求以及通风柜的选择;介绍实验室通风系统和空调系统的设计方案选择;介绍各检测部门的实验室、仪器室和辅助用房的通风系统,并针对不同实验室通风系统进行分析和讨论。