极性大的药物进行药物代谢的研究,怎样进行生物样品前处理啊?
生物药物提取与检测方法
生物芯片技术在药物R&D中的应用(上)( 邓沱,宁志强,周玉祥,程京 )摘自“生物引擎” 1946年世界上第一台电子数字计算机ENIAC在美国Pennsylvania大学问世。在随后的50年里,以美国的硅谷为摇篮,计算机技术不断飞速发展,给我们的生活带来了巨大的变革。无独有偶,1991年又是在美国硅谷,Affymax公司开始了生物芯片的研制,他们将芯片光刻技术与光化学合成技术相结合制作了寡核苷酸阵列芯片。近年来,以DNA芯片为代表的生物芯片技术,得到了迅猛发展,已有多种不同功用的生物芯片问世。目前生物芯片技术已应用于分子生物学、疾病的预防、诊断和治疗、新药开发、生物武器的研制、司法鉴定、环境污染监测和食品卫生监督等诸多领域,已成为各国学术界和工业界所瞩目并研究的一个热点。 生物芯片的概念源自于计算机芯片,狭义的生物芯片即微阵列芯片,主要包括cDNA微阵列、寡核苷酸微阵列、蛋白质微阵列和小分子化合物微阵列。分析的基本单位是在一定尺寸的基片(如硅片、玻璃、塑料等)表面以点阵方式固定的一系列可寻址的识别分子,点阵中每一个点都可以视为一个传感器的探头。芯片表面固定的分子在一定的条件下与被检测物进行反应,其结果利用化学荧光法、酶标法、同位素法或电化学法显示,再用扫描仪等仪器记录,最后通过专门的计算机软件进行分析。广义的生物芯片是指能对生物成分或生物分子进行快速并行处理和分析的厘米见方的固体薄型器件,其主要种类有微阵列芯片、过滤分离芯片、介电电泳分离芯片、生化反应芯片和毛细管电泳芯片等。 随着二十一世纪的到来,制药公司正面临着一次严峻的市场挑战。这些公司为了保持或增强在市场上的竞争力,不得不寻求发展新的药物开发技术以提高药物发现的速度,缩短新药上市的时间,减少药物开发的成本。近年来生物芯片技术的飞速发展,引起了制药业的极大兴趣,使得生物芯片技术在药物研究与开发领域得到越来越广泛的应用,已逐渐渗入到药物研发过程中的各个步骤。本文将主要讨论生物芯片技术在药物靶点发现与药物作用机制研究、超高通量药物筛选、毒理学研究、药物基因组学研究以及药物分析中的应用。一、 生物芯片在药物靶点发现与药物作用机制研究中的应用 药物靶点发现与药物作用机制研究是生物芯片技术在药物研发中应用最为广泛的一个领域。在药物靶点发现和药物作用机制研究中所使用的生物芯片主要是指DNA芯片。在DNA芯片的表面,以微阵列的方式固定有寡核苷酸或cDNA。使用DNA芯片可以对研究者感兴趣的基因或生物体整个基因组的基因表达进行测定。在当代药物开发过程中发现和选择合适的药物靶点是药物开发的第一步,也是药物筛选及药物定向合成的关键因素之一。人体是一个复杂的网络系统,疾病的发生和发展必然牵涉到网络中的诸多环节。当今严重威胁人类健康的心脑血管疾病、恶性肿瘤、老年性痴呆症和一些代谢紊乱疾病都是多因素作用的结果,往往不能归结于单一因素的变化。应用一些基因寻找策略如DD-PCR等虽然为发现新的功能基因提供了一些线索,但还是有相当的局限性。而DNA芯片可以从疾病及药物2个角度对生物体的多个参量同时进行研究以发掘药物靶点并同时获取大量其他相关信息。因此可以说,在这种情况下,任何一元化的分析方法均不及DNA芯片这种集成化的分析手段更具有优势。 DNA芯片在药物靶点发现与药物作用机制研究中的应用具体表现在以下几个方面。(一) 比较正常不同组织细胞中基因的表达模式 基因的表达模式给它的功能提供了间接的信息。例如只在肾脏中表达的基因就不大可能与精神分裂症有关。一些药物的靶点是在整个身体中分布广泛的蛋白质,这类药物的副作用往往比较大。而选择只在特异组织中才表达的蛋白作为药物筛选的靶点,可以减少药物对整体产生的副作用,因而更引起人们的关注。例如骨质疏松症(osteoporosis)与破骨细胞(osteoclasts)的功能有关,破骨细胞可以破坏并吸收骨质,当骨质的形成与破坏出现不平衡的时候,就会导致骨质疏松症。如果破骨细胞的功能得到抑制,那么就可以控制骨质疏松症的发生和发展。利用已有的人类EST序列和DNA芯片技术,可以容易地得到只在破骨细胞中进行表达的基因如cathepsink基因,它编码半胱氨酸蛋白酶。以cathepsink基因作为靶标,筛选对它有抑制作用的药物,就有可能得到治疗骨质疏松症的药物。但是这种方法也有其局限性,它只能得到mRNA水平的表达谱,另外组织一般由多种细胞组成,而要将这些细胞分离很困难。(二) 研究正常组织与病理组织基因表达差异 正常组织在病变的过程中,往往伴随着基因表达模式的变化。基因表达水平的升高或降低,可能是病变的原因,也可能是病变的结果。若基因表达的变化是病变的原因,则以此基因为靶点的药物就可能逆转病变;若基因表达的变化是病变的结果,则以此基因为靶点的药物就可能减轻病变的症状。DNA芯片技术可以在病理组织与正常组织之间一次比较成千上万个基因的表达变化,找出病理组织中表达异常的基因。Heller等人提取正常及诱发病变的巨噬细胞、软骨细胞系、原代软骨细胞和滑膜细胞的mRNA,用包含细胞因子、趋化因子、DNA结合蛋白及基质降解金属蛋白酶等几大类基因的cDNA芯片进行筛选,发现了数种变化明显的基因。其中除了有已知与类风湿关节炎有关的TNF、IL-1、IL-6、IL-8、G-CSF、RANTES、VCAM的基因外,还有编码基质金属弹性蛋白酶HME、IL-3、ICE、趋化因子Groα等的基因。而以前认为金属弹性蛋白酶只存在于肺泡巨噬细胞和胎盘细胞中。弹性蛋白酶可以破坏胶原纤维及组织基底膜层,它在类风湿关节炎病理组织中的出现,为治疗该病提供了新的药物靶点。 利用DNA芯片来寻找疾病相关基因的策略尤其适用于病因复杂的情况。例如,恶性肿瘤的发生常常是多基因共同作用的结果,DNA芯片技术在肿瘤细胞基因表达模式及肿瘤相关基因发掘中具有重要的作用。Wang等人将一些看家基因、细胞因子及受体基因、细胞分裂相关基因及其他一些癌基因共5766个基因的cDNA探针固定在芯片上,对正常卵巢组织及卵巢癌组织的mRNA进行分析,发现两者之间30%基因表达相差两倍以上,9%相差3倍以上,其中上调较为明显的有CD9、上皮糖蛋白(epithelial glycoprotein)、p27及HE蛋白激酶抑制物等。这些结果不仅进一步证实了以前用其他方法获得的结果,还提供了一些新的信息。再如,Kapp等人用包含950个DNA探针的DNA芯片分析比较霍奇金病细胞系L428及KMH2与EB病毒永生化的B淋巴细胞系LGL-GK的基因表达谱,发现霍奇金病源的细胞系中白细胞介素-13(IL-13)及白细胞介素-5(IL-5)表达异常增高;用IL-13抗体处理霍奇金病源的细胞系可显著抑制其增殖。此发现提示,IL-13可能以自分泌形式促进霍奇金病相关细胞增殖。IL-13及其信号转导途径可能成为霍奇金病治疗及药物筛选的新靶点。(三) 建立模式生物细胞中的基因表达模型 采用模式生物细胞进行试验,条件容易控制,对模式生物基因表达的研究将启发人们发现和确认新的药物作用靶点。目前,已有多种模式生物(如酵母)的基因组计划已经完成。 酿酒酵母(saccharomyces cerevisiae)就是一种可用来进行药物筛选的较为理想的模式生物。它是真核生物而且基因组已全部测序,细胞繁殖快,易于培养,与哺乳动物细胞有许多共同的生化机制。现在已经发现,在酵母细
来源:石家庄日报日前,华北制药集团新药研发公司承建的微生物药物国家工程研究中心项目,通过了省发改委组织的验收。这标志着微生物药物国家工程研究中心正式落户华药。 微生物药物国家工程研究中心2004年经国家发改委批准建设,总投资约1.4亿元,是“十五”期间国家重点建设的23个国家工程研究中心之一,是我国在微生物药物方面唯一由国家命名的工程研究中心。 按照国家对国家级工程研究中心的定位,国家工程研究中心是代表我国相关领域内国家水平的专业性研究开发机构,具备原始创新、集成创新、对引进技术消化吸收和再创新的能力,形成从产品源头开发、中试到产业化的一整套技术体系。该中心依托于华北制药集团新药研究开发公司, 采用基因工程等现代生物技术,开展微生物菌种的选育、发酵、提取分离等方面的工艺研究,为微生物制药产业发展提供技术保障。 目前,该中心建成了27000株菌的微生物菌种资源库,54000种微生物产物的化合物库,微生物药物高通量筛选及活性评价技术平台、菌种选育技术平台、微生物药物工程化生产验证平台等,形成了规范化、专业化的微生物药物研发和工程化验证技术体系。建设期间,成功开发了9个微生物药物新产品,完成了柔性系统集成技术验证,初步具备了向行业转移相关技术的能力。 目前,华北制药已经成为河北省唯一拥有国家级企业技术中心、国家863高技术成果产业化基地、国家工程研究中心三个国家级重要称号的单位。
急求:生物药物分析 教案[em61] [em62] [em17]
国家《生物产业发展规划》中明确提出,未来几年,生物医药领域将是重点发展对象。毫无疑问,生物技术药物已经成为各国竞相追逐的焦点。近年来,全球生物制药市场呈现高速增长态势,年均增长15%~18%。2010年,全球生物制药的市场规模已达到1400亿美元,预计到2020年,生物制药产品有望占全球药品销售收入的1/3。据了解,目前全球已上市的生物制药产品达100多个,另有400多个品种可能完成临床研究投放市场。在全球最畅销的100个处方药中,生物技术药物所占比重将从2002年的15%提升到2010年的33%,预计到2016年将占到45%的比重。未来若干年之内,生物技术药物将在全球医药健康领域发挥不可替代的作用。 蓬勃发展的生物技术药物中,生物仿制药已经成为人们眼中的明珠。生物仿制药是指与生物专利药"高度相似"的生物制品。其非活性成分与被仿药可能有微小差别,但在安全性、纯度和效力上并无实际差异。生物仿制药有望以专利药10%到30%的折扣出售,有利于更多患者在重大疾病方面获得治疗机会。未来几年,一系列重磅炸弹级别的生物药物如赫赛汀(Herceptin)、恩利(Enbrel)、类克(Remicade)等均将失去专利保护,无时无刻不触动着全世界各大制药企业的敏感神经,让各大机构热血沸腾。 在全球蓬勃发展的生物仿制药势头下,目前主要市场份额仍然被国外大型制药公司掌控,有数据显示,目前市场上唱主角的多是国外厂商,山德士、梯瓦和Hospira三家厂商占据超过80%的市场份额。在市场规模最大的7个国家生物仿制药市场中,美国依然是最大的生物仿制药巨头。据统计预测,美国将成为全球生物仿制药市场的助理,并将推动全球生物仿制药市场规模在2020年达到110亿~250亿美元,从而使其占全球生物制剂市场的比例达到4%~10%。因此,开发生物仿制药已经成为衡量一个国家医药发展水平的重要指标,对国家医疗水平提高,国民健康素质的提升具有不可估量的意义。 生物仿制药的蛋糕无时不刻不吸引着众人,然而,天下没有免费的午餐,分享生物仿制药的盛宴需要具备相当高的门槛。 我国生物技术药物行业发展经历了20年,我国企业也已涉足这个巨大的市场,根据目前公开的资料显示,我国现已批准上市13类25只382个不同规格的基因工程药物和基因工程疫苗产品中,有6类9只21个规格的产品属于原创,其余的都属于仿制。 从技术层面上讲,生物仿制药的开发远难于化学药物,可以称为一个浩大的工程。生物仿制药通常研发需要8-10年,比化学药仿制药3-5年要长很多;研发经费通常需要1-2亿美元,远高于化学仿制药的100-500万美元;生物药物是特征复杂的大分子药物,具有复杂的空间结构,细胞培养的条件(温度和营养)、产品的加工、纯化、储存和包装都会影响产品的生产,整个过程中的微小差别会对最终产品的质量、纯度、生物特性以及临床效果产生巨大的影响。 目前国内涉足生物仿制药的企业逐步增多,据统计,目前销售阶段有5家,临床阶段8家,临床前或拟投资的15家,集中在几个国外畅销品。但是,总体来看,企业普遍面临着几个技术问题:细胞表达量低-通常稳定细胞株的表达量为20-50pg/cell/day,细胞培养工艺不成熟-fed-batch 或者perfusion工艺的选择,蛋白纯化工艺成本高以及仿制药质量标准的不明确等,而且中国企业在生物仿制药开发中QbD和PAT理念的应用与欧美国家相比相距甚远,也是影响生物仿制药开发的一个障碍。 另一方面,生物仿制药的法律监管方面,由于生物药大分子的复杂性,目前国内仍然处于摸索阶段。相关部门已经在加紧制定生物仿制药的申报指南,法规的出台会给国内生物仿制药的发展增添更大的动力。 习近平总书记,提出要全民努力,推动中华民族的伟大复兴,实现"中国梦"。对中国的生物仿制药开发来讲,如何把握住全球生物仿制药蓬勃发展的时机,早日突破技术和法律政策方面的障碍,上市更多重磅炸弹药物,降低药物成本,是中国政府和制药企业光荣的任务。可喜的是,目前中国政府和企业都在齐心协力开发生物仿制药和新生物技术药物,国内制药企业通过和海外大公司联姻迅速切入生物药物领域,政府通过人才计划,吸引一大批具有海外工业界工作经验的人才回国,为提升我国生物技术药物研发和产业化水平做出了极为重要的贡献。相信在不久的将来,中国会诞生更多质优价廉的生物仿制药和创新药,为开拓中国医药品牌,建设中国医药强国做出良好的铺垫。

[font=微软雅黑] [/font][img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241851267732_1187_2507958_3.jpg!w690x151.jpg[/img][font=微软雅黑][font=微软雅黑]近年来,生物技术药物占比大幅提升,化学品生物制造的渗透率显著提高。生物制药已然成为目前我国着力发展的战略新兴产业。生物技术药物多数为蛋白质或者多肽及其修饰物,分子量相对较大结构复杂,具有多样性和可变性。生物技术药物的结构特性容易受到各种理化因素的影响,且分离提纯工艺复杂。因此生物技术药物检测、评价及质量控制显得尤为重要。[/font][/font][font=微软雅黑]2020年09月09日,仪器信息网将举行“生物药物评价及检测技术”网络研讨会。会议将邀请生物制药领域的专家及技术人员,为大家介绍生物药物评价及最新检测技术。[/font][font=微软雅黑][font=微软雅黑]会议时间:[/font]2020年9月9日9:00-18:00[/font][font=微软雅黑][font=微软雅黑]会议安排:[/font][/font][img=,690,341]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241851437657_9367_2507958_3.jpg!w690x341.jpg[/img][img=,690,261]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241851544138_5221_2507958_3.jpg!w690x261.jpg[/img][font=微软雅黑][font=微软雅黑]报名地址:[url=https://www.instrument.com.cn/webinar/meetings/YoloBiodrugTest2020]点击打开链接[/url][/font][/font][font=微软雅黑][font=微软雅黑]欢迎报名参加![/font][/font]

[font=微软雅黑][font=微软雅黑][img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241855168745_3355_2507958_3.jpg!w690x151.jpg[/img][/font][/font][font=微软雅黑][font=微软雅黑]近年来,生物技术药物占比大幅提升,化学品生物制造的渗透率显著提高。生物制药已然成为目前我国着力发展的战略新兴产业。生物技术药物多数为蛋白质或者多肽及其修饰物,分子量相对较大结构复杂,具有多样性和可变性。生物技术药物的结构特性容易受到各种理化因素的影响,且分离提纯工艺复杂。因此生物技术药物检测、评价及质量控制显得尤为重要。[/font][/font][font=微软雅黑]2020年09月09日,仪器信息网将举行“生物药物评价及检测技术”网络研讨会。会议将邀请生物制药领域的专家及技术人员,为大家介绍生物药物评价及最新检测技术。[/font][font=微软雅黑][font=微软雅黑]会议时间:[/font]2020年9月9日9:00-18:00[/font][font=微软雅黑][font=微软雅黑]会议安排:[/font][/font][img=,690,341]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241855430882_5053_2507958_3.jpg!w690x341.jpg[/img][img=,690,261]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241855435325_6409_2507958_3.jpg!w690x261.jpg[/img][font=微软雅黑][font=微软雅黑]报名地址:[url=https://www.instrument.com.cn/webinar/meetings/YoloBiodrugTest2020]点击打开链接[/url][/font][/font][font=微软雅黑][font=微软雅黑]欢迎报名参加![/font][/font]
哪位朋友知道如何做土壤中的药物残留的生物(好氧)降解试验?应该具备什么条件?有实验指导吗?

[font=微软雅黑] [img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241853365070_4225_2507958_3.jpg!w690x151.jpg[/img][/font][font=微软雅黑][font=微软雅黑]近年来,生物技术药物占比大幅提升,化学品生物制造的渗透率显著提高。生物制药已然成为目前我国着力发展的战略新兴产业。生物技术药物多数为蛋白质或者多肽及其修饰物,分子量相对较大结构复杂,具有多样性和可变性。生物技术药物的结构特性容易受到各种理化因素的影响,且分离提纯工艺复杂。因此生物技术药物检测、评价及质量控制显得尤为重要。[/font][/font][font=微软雅黑]2020年09月09日,仪器信息网将举行“生物药物评价及检测技术”网络研讨会。会议将邀请生物制药领域的专家及技术人员,为大家介绍生物药物评价及最新检测技术。[/font][font=微软雅黑][font=微软雅黑]会议时间:[/font]2020年9月9日9:00-18:00[/font][font=微软雅黑][font=微软雅黑]会议安排:[/font][/font][img=,690,261]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241853534378_9041_2507958_3.jpg!w690x261.jpg[/img][img=,690,341]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241853531762_2396_2507958_3.jpg!w690x341.jpg[/img][font=微软雅黑][font=微软雅黑]报名地址:[url=https://www.instrument.com.cn/webinar/meetings/YoloBiodrugTest2020]点击打开链接[/url][/font][/font][font=微软雅黑][font=微软雅黑]欢迎报名参加![/font][/font]

[font=微软雅黑] [img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241854112663_9447_2507958_3.jpg!w690x151.jpg[/img][/font][font=微软雅黑][font=微软雅黑]近年来,生物技术药物占比大幅提升,化学品生物制造的渗透率显著提高。生物制药已然成为目前我国着力发展的战略新兴产业。生物技术药物多数为蛋白质或者多肽及其修饰物,分子量相对较大结构复杂,具有多样性和可变性。生物技术药物的结构特性容易受到各种理化因素的影响,且分离提纯工艺复杂。因此生物技术药物检测、评价及质量控制显得尤为重要。[/font][/font][font=微软雅黑]2020年09月09日,仪器信息网将举行“生物药物评价及检测技术”网络研讨会。会议将邀请生物制药领域的专家及技术人员,为大家介绍生物药物评价及最新检测技术。[/font][font=微软雅黑][font=微软雅黑]会议时间:[/font]2020年9月9日9:00-18:00[/font][font=微软雅黑][font=微软雅黑]会议安排:[/font][/font][img=,690,341]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241854285713_3420_2507958_3.jpg!w690x341.jpg[/img][img=,690,261]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241854289873_6313_2507958_3.jpg!w690x261.jpg[/img][font=微软雅黑][font=微软雅黑]报名地址:[url=https://www.instrument.com.cn/webinar/meetings/YoloBiodrugTest2020]点击打开链接[/url][/font][/font][font=微软雅黑][font=微软雅黑]欢迎报名参加![/font][/font]

[font=微软雅黑] [img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241852598920_7599_2507958_3.jpg!w690x151.jpg[/img][/font][font=微软雅黑][font=微软雅黑]近年来,生物技术药物占比大幅提升,化学品生物制造的渗透率显著提高。生物制药已然成为目前我国着力发展的战略新兴产业。生物技术药物多数为蛋白质或者多肽及其修饰物,分子量相对较大结构复杂,具有多样性和可变性。生物技术药物的结构特性容易受到各种理化因素的影响,且分离提纯工艺复杂。因此生物技术药物检测、评价及质量控制显得尤为重要。[/font][/font][font=微软雅黑]2020年09月09日,仪器信息网将举行“生物药物评价及检测技术”网络研讨会。会议将邀请生物制药领域的专家及技术人员,为大家介绍生物药物评价及最新检测技术。[/font][font=微软雅黑][font=微软雅黑]会议时间:[/font]2020年9月9日9:00-18:00[/font][font=微软雅黑][font=微软雅黑]会议安排:[/font][/font][img=,690,341]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241853206425_3088_2507958_3.jpg!w690x341.jpg[/img][img=,690,261]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241853210164_4039_2507958_3.jpg!w690x261.jpg[/img][font=微软雅黑][font=微软雅黑]报名地址:[url=https://www.instrument.com.cn/webinar/meetings/YoloBiodrugTest2020]点击打开链接[/url][/font][/font][font=微软雅黑][font=微软雅黑]欢迎报名参加![/font][/font]
急求 :生物药物分析课件(或者教案)谢谢
急求:生物药物分析课件 或教案
为什么要进行样品前处理?1、富集浓缩被测痕量组分(ppm,ppb, ppt 级)的作用,提高方法的灵敏度,降低最小检测限。2、消除基体对测定的干扰,提高方法的选择性3、使被测组分从复杂的样品中分离出来,制成便于测定的溶液形式4、通过衍生化的前处理方法,可以使一些在正常检测器上没有响应或响应值较低的化合物转化为具有很高效应值的化合物。5、样品经前处理后就变得容易保存和运输6、可以除去对仪器或分析系统有害的物质,如强酸或强碱性物质,如生物大分子等,延长仪器使用寿命,使分析测定能长期保持在稳定、可靠的状态下进行。有哪些要求?1.样品是否要预处理,如何进行预处理,采样何种方法,应根据样品的性状、检验的要求和所用分析仪器的性能第方面加以考虑。 2.应尽量不用或少使用预处理,以便减少操作步骤,加快分析速度,也可减少预处理过程中带来的不利影响,如引入污染、待测物损失等。3.分解法处理样品时,分解必须完全,不能造成被测组分的损失,待测组分的回收率应足够高。4.样品不能被污染,不能引入待测组分和干扰测定的物质。5.试剂的消耗应尽可能少,方法简便易行,速度快,对环境和人员污染少。食品样品前处理 样品前处理为食品检验的关键步骤,直接影响分析结果的精密度和准确度,选择合适的前处理方法,缩短样品的前处理时间,是在保证检验质量的同时提高检验效率的一个重要方法。本文主要针对食品中重金属检测前的前处理方法进行总结。分析了四种方法在食品金属检验中的应用和注意事项,为食品检验工作者选取合适的样品前处理方法提供一定的参考。1、湿消化法 湿消化法是在适量的食品样品中,加入氧化性强酸,加热破坏有机物,使待测的无机成分释放出来,形成不挥发的无机化合物,以便进行分析测定。湿法消化是目前应用比较广泛的一种食品样品前处理方法,该方法实用性强,几乎所有的食品都可以用该方法消化。 在实验过程中,只要控制好消化温度,大部分元素一般很少或几乎没有损失。例如,在测定酱油中的砷含量时采用湿法消化加入了硝酸高氯酸混合酸和硫酸,加标回收率为95%以上。即便像“汞”等极易挥发的元素,只要正确掌握消化温度,也不会有损失。 但是湿消化法也有一定的缺陷:样品氧化时间较长,且实验过程中一次不能消化超过10个样品。其次,样品消化时常使用的试剂硝酸、高氯酸、过氧化氢,硫酸都是具有腐蚀性且比较危险的。由于氧化反应过程中加入了浓酸,这些酸可能会对仪器产生损害进而影响试验结果,因此消解结束后需要排酸。2、干法灰化法 干法灰化具有操作简单,并且可以一次处理大批量样品的优点。但是干法灰化也有其局限性,首先,由于灰化温度比较高,一般都在500摄氏度左右,可能会有部分元素因为蒸发而损失掉,从而导致元素的部分损失。其次,实验过程比较长,样品碳化时间需要1个小时左右,灰化时间在4-6小时之间,中途如果灰化效果不好还需要加入助灰化剂。3、微波消解法 微波消解是指利用微波的穿透性和激活反应能力,使样品温度升高,同时采用密封装置,在加入一定量的酸溶液,达到使样品中有机物质分解的目的。 消化时间短,比传统的加热方式既快速又效率高,消化时间只需数十分钟,大大提高了反应速率,缩短样品制备的时间,与此同时微波消解还可以控制反应条件,使制样精度更高; 微波消化是在密闭容器内进行,易挥发元素损失少,回收率高,耗酸量减少(3-5ml),空白值大为降低,从而挺高了结果的准确性。最值得注意的是由于使用的是微波加热,实验过程中要防止微波的泄露。4、酸提取法 酸提取是指选用某种酸将样品中的待测元素提取出来。与上面三种方法不同的是,这种方法并没有破样品里的有机物质,而是直接用酸提取,因此该方法具有速度快、操作简便的优点 同时由于该方法不需要加热,因此也就避免了待测元素的损失。 总的来说,湿消化法为经典的消化方法,灰化法耗时长,且易引起待测元素的污染和损失,微波消解法具有待测元素不易损失的优点,但是处理成本较高,同时应注意操作安全。酸提取法直接进样技术具有操作简便、速度快、不污染环境、避免被测元素的挥发损失等优点,但只能应用于部分分析技术,食品检验工作者可以根据样品种类和实验室条件综合考虑采用何种前处理方法。生物样品分析前处理 生物样品的前处理涉及很多方面,但主要应考虑生物样品的种类,被测定药物的性质和测定方法三个方面的问题。1.样品的分离、纯化技术应该依据生物样品的类型。例如,血浆或血清需除蛋白,使药物从蛋白结合物中释出;唾液样品则主要采用离心沉淀除去粘蛋白;尿液样品常采用酸或酶水解使药物从缀合物中释出,当原型药物排泄在尿中时,可简单地用水稀释一定倍数后进行测定。2.样品于测定前是否需要纯化以及纯化到什么程度均与其后采用的测定方法的不同而不同。一般说来,放射免疫测定法由于具有较高的灵敏度和选择性,因此当初步除去主要干扰物质之后即可直接测定微量样品;而对灵敏度和专属性较差的紫外分光光度法,分离要求就要相应高一些;至于常用的高效液相色谱法,为防止蛋白质等杂质沉积在色谱柱上,上柱前需对生物样品进行去蛋白,有时对被测组分进行提取、制备衍生物等前处理。药物分析中样品前处理 根据被测定药物的结构、理化及药理性质、存在形式、浓度范围等,采取相应的前处理方法。药物在样品中的浓度相差很大,浓度大的样品,对前处理要求可稍低;浓度越低则样品前处理要求越高。在测定药物及其代谢物时,样品的前处理是十分重要的。除了少数情况,将体液经简单处理后进行直接测定外,一般要在测定之前进行样品的前处理,即进行分离、纯化、浓集,必要时还需对待测组分进行化学衍生化,从而为测定创造良好的条件。1.GC中化学衍生化法:药物的化学衍生化前处理对GC十分必要,衍生化可使药物分子中的极性基团,如羟基、氨基、羧基等变成无极性的、易于挥发的药物,从而使GC的温度不必很高即可适合GC的分析要求。主要的衍生化反应有烷基化、酰化、硅烷化等。其中已硅烷化用得最广泛。 异构体的分离也是十分重要的。分离光学异构体的方法之一,就是采用不对称试剂,使其生成非对映异构体衍生物,然后用GC法或HPLC法进行分析测定。2.HPLC中化学衍生化法:当采用HPLC法时,其衍生化目的是为了提高药物的检测灵敏度。一些在紫外、可见光区没有吸收或者摩尔吸收系数小的药物,可以使其与衍生成对可见-紫外检测器、荧光检测器及电化学检测器等具有高灵敏度的衍生物。、环境样品前处理 在现代环境检测和分析领域中,各种现代化分析仪器和测试手段的不断更新,使得环境样品的分析检测已经可以做到即时、在线、灵敏地分析痕量的多种环境样本,这充分得益于环境样品前处理技术的快速发展。样品采集及预处理一直是制约环境化学发展的瓶颈。传统的前处理方法存在耗时长、精密度及重现性差、难于自动化、智能化,并且大量使用有毒溶剂等不利因素。环境化学工作者经过不懈的探索和努力,改进并创新了一系列的环境样品预处理技术,这些方法有不同的适用范围,有各自不同的应用和发展前景。本文主要介绍具有代表性的吹扫捕集、加速溶剂萃取等现已应用较多的现代环境前处理方法。1、吹扫捕集(PT) 吹扫捕集技术的主要优点是不使用有机溶剂,不污染环境,操作简便,取样少,富集效率高,适合于大多数挥发性和半挥发性有机物的分离富集。 吹扫
我有一种药物需要检测其中是否含有特种微生物(大肠埃希菌,金黄葡萄球菌等),但是他们的抑制作用非常强,用膜过滤法时冲洗量达到2000都不行,请问有其他什么好办法吗?
国外药学专著译丛—药物微生物学(原著第7版)作者: 德尼尔 出版社:化学工业出版社 出版日期:2007-10-1 本书为原著第7版,是一部经典的指南性著作,本书兼顾简明性和权威性,对药物微生物不的原理、微生物药物和有关技术进行了详尽的阐述。 与上版相比本书新增内容包括: 进行了且面修订和更新,啬了新的章节反映芗微生物学技术与实践中的最新进展; 提供了学习目标和重点总结,例读者更易于阅读;

【网络研讨会】生物技术药物评价及检测技术(举行时间:5月10-11日)报名链接:http://www.instrument.com.cn/webinar/meetings/BiologicalPharmaceutical/ 2016年底,“十三五”生物产业发展规划正式印发。规划显示,到2020年,生物产业规模达到8至10万亿元。规划提出在“十三五”期间,生物技术药物占比大幅提升,化学品生物制造的渗透率显著提高。同时,到2020年,预计生物医学工程产业年产值达6000亿元。 生物制药已然成为目前我国着力发展的战略新兴产业。2017年5月10日-11日,仪器信息网计划组织“生物技术药物评价及检测技术”网络研讨会。会议将邀请生物制药领域的专家及技术人员,为大家介绍生物技术药物评价及最新检测技术。欢迎大家报名参加。 会议日程: 5月10日 09:00-09:50 人血白蛋白的质量控制 赵璇(北京市药检所) 09:50-10:30 先进LC-MS方案进行生物类似药分析表征与比对研究 陈熙(Waters) 10:30-11:10 高分辨质谱仪在生物制药表征中的应用 孙佳楠(赛默飞) 11:10-11:50 SCIEX生物药完整分析创新解决方案 罗继(Sciex) 14:00-14:50 生物制品检测用酶的性质及使用注意事项 李素霞(华东理工大学) 14:50-15:30 待定 安捷伦 15:30-16:10 岛津在抗体类药物生物分析领域的创新技术与应用 张歆媛(岛津) 5月11日 09:30-10:20 中药中活性物质单克隆抗体的制备及其免疫检测应用 张浩(盘锦检测中心) 10:20-11:00 Testo 生命科学解决方案: 温湿度监测系统和验证服务 郭卫民(德图) 11:00-11:40 生物技术药物热稳定性评价-DSC技术 韩佩韦(马尔文)http://ng1.17img.cn/bbsfiles/images/2017/04/201704131517_01_2507958_3.jpg
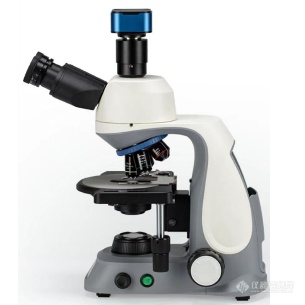
[align=center][size=18px][/size][/align][align=center][b][font='Arial',sans-serif][color=#548DD4]#[/color][/font][font=等线][color=#548DD4]每日一篇分享一篇解决方案:[/color][/font][/b][/align][align=center][b][font=等线][color=#548DD4]今日行业领域:石油[/color][/font][font='Arial',sans-serif][color=#548DD4]/[/color][/font][font=等线][color=#548DD4]化工[/color][/font][/b][/align][b][color=#9999ff]如何用生物显微镜观察药物晶体[/color][/b]一、生物显微镜应用在药物领域能观察什么物质药物晶体:生物显微镜可以观察和研究药物中的晶体结构。这对于药物的物理性质、稳定性和溶解性等方面的研究非常重要。细胞结构:生物显微镜可以观察和研究药物中的细胞结构,包括细胞核、细胞质、细胞器等。这对于了解药物的组成和作用机制非常重要。细菌和真菌:生物显微镜可以观察和鉴定药物中的细菌和真菌。这对于评估药物的微生物污染情况以及对药物的杀菌效果进行研究和监测非常关键。病原体:生物显微镜可以观察和鉴定药物中的病原体,如病毒、寄生虫等。这对于药物的疾病治疗效果评估和病原体的研究具有重要意义。药物颗粒:生物显微镜可以观察和分析药物中的颗粒,如微粒、纳米颗粒等。这对于药物的制备工艺、释放特性和药效等方面的研究具有重要意义。药物载体:生物显微镜可以观察和研究药物中的载体材料,如纳米粒子、聚合物等。这对于药物的控释特性、靶向性和药物传递等方面的研究非常关键。通过生物显微镜的应用,可以对药物的微观结构和性质进行观察和分析,为药物研发、质量控制和治疗效果评估提供重要的信息。二、如何运用生物显微镜观察药物晶体要观察药物晶体,可以按照以下步骤使用生物显微镜:准备样品:将药物晶体制备成适当的样品。可以将药物晶体直接放置在载玻片上,或者将其溶解在适当的溶剂中后滴在载玻片上。调整显微镜参数:将载玻片放置在生物显微镜的样品台上,调整显微镜的参数,如聚焦、光源亮度、放大倍数等,以获得清晰的图像。选择合适的放大倍数:根据药物晶体的大小和细节,选择合适的放大倍数。开始时可以选择较低的放大倍数,然后逐渐增加放大倍数以观察更详细的细节。观察和记录:通过显微镜观察药物晶体的形状、大小和结构。可以使用相机或者计数器来辅助记录。同时,可以通过调整焦距和光源角度来改善图像的清晰度和对比度。分析和测量:根据观察到的药物晶体图像,可以进行进一步的分析和测量。例如,可以测量晶体的尺寸、形状参数,或者使用显微镜图像分析软件进行晶体图像处理和测量。需要注意的是,药物晶体可能具有不同的形态和晶体结构,因此在观察时应注意选择典型的晶体区域进行观察。此外,一些药物晶体可能在常温下易溶解,因此在观察前可能需要采取适当的保护措施,如使用显微镜温台或封闭载玻片等。[align=center][img]https://img0.baidu.com/it/u=3594765546,1888245350&fm=253&fmt=auto&app=138&f=JPEG?w=500&h=516[/img][/align][font='宋体']三、药物晶体的分析执行标准包括以下几个方面:[/font][font='宋体']纯度分析:对药物晶体的纯度进行检验,包括有机杂质、无机杂质、水分等的含量分析。[/font][font='宋体']结晶性质分析:对药物晶体的结晶性质进行评估,包括晶体形态、晶体尺寸、晶体形貌等的表征。[/font][font='宋体']结晶度分析:对药物晶体的结晶度进行检验,包括晶体的结晶度、结晶速度等的测定。[/font][font='宋体']热性质分析:对药物晶体的热性质进行评估,包括熔点、热分解温度、热容等的测定。[/font][font='宋体']光学性质分析:对药物晶体的光学性质进行检验,包括吸收光谱、荧光光谱等的测定。[/font][font='宋体']结构分析:对药物晶体的晶体结构进行解析,包括X射线衍射、核磁共振等的测定。[/font][font='宋体']总之,通过生物显微镜的应用,可以观察和分析药物晶体的形态、结构和特征,为药物的物理性质、稳定性和溶解性等方面的研究提供重要的信息。[/font][font='宋体']在国货崛起的今天,[/font][font='宋体']徕[/font][font='宋体']科光学研发的各种型号的生物显微镜已经被越来越多的高校、研究所、科研单位、企业所运用,并且已成为各客户在研究工作中的主流设备产品,这些设备所呈现出的效果与进口设备的毫无差别,但其价格仅为进口设备的三分之一左右,依靠着科技感和[/font][font='宋体']创新感双强[/font][font='宋体']的研发力量,可以根据不同客户的需求定制出高性价比的产品方案、内核稳定的售后方案,更加直接且高效地为客户做好售前、售中、售后服务保障。[/font][font='宋体']徕[/font][font='宋体']科光学研发的各种型号的生物显微镜已不仅仅是已经是当下最流行且性能稳定的国际大品牌“平替”产品,其已经成为了行业最受欢迎的TOP明星产品。[/font][font='宋体'][size=20px][color=#4f5862]产品配置单:[/color][/size][/font][align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310161108245283_6991_5996718_3.png[/img][/align][align=center][url=https://www.instrument.com.cn/show/C532699.html][font='宋体']生物显微镜LK-83[/font][/url]([url=https://www.instrument.com.cn/netshow/SH101998/][size=14px]天津[/size][size=14px]徕[/size][size=14px]科光学仪器有限公司[/size][/url])[/align][align=left][url=https://www.instrument.com.cn/application/Solution-947254.html][font='宋体'][size=16px]点击这[/size][/font] [font='宋体'][size=16px]里[/size][/font][/url][font='宋体'][size=16px][color=#000000]浏览[/color][/size][/font][font='宋体'][size=16px][color=#000000]或[/color][/size][/font][font='宋体'][size=16px][color=#000000]下载原[/color][/size][/font][font='宋体'][size=16px][color=#000000]文档,更多解决方案内容请浏览[/color][/size][/font][url=http://www.instrument.com.cn/application/][font='宋体'][size=16px][color=#0081d7]行业应用[/color][/size][/font][/url][font='宋体'][size=16px][color=#000000]栏目:[/color][/size][/font][/align][align=left][url=http://www.instrument.com.cn/application/][font='宋体'][color=#0081d7][back=#ffffff]http://www.instrument.com.cn/application/[/back][/color][/font][/url][font='宋体'][color=#000000]行业应用栏目简介:[/color][/font][font='宋体'][color=#000000] [/color][/font][font='宋体'][color=#000000] 【行业应用】[/color][/font][color=#333333]是仪器信息网[/color]专业的行业导购平台。汇聚了行业内国内外主流厂商的优质解决方案及相应的仪器设备。建立了兼顾国家相关规定和用户习惯的专业分类,涉及食品、药品、环境、石化等二十余个使用仪器相对集中的行业领域。并以样品和标准为主线,为用户查找仪器提供一个独特的维度,也为仪器产品提供一个全新的展示渠道。[/align]
【网络研讨会】生物技术药物评价及检测技术(举行时间:5月10-11日)报名链接:http://www.instrument.com.cn/webinar/meetings/BiologicalPharmaceutical/ 2016年底,“十三五”生物产业发展规划正式印发。规划显示,到2020年,生物产业规模达到8至10万亿元。规划提出在“十三五”期间,生物技术药物占比大幅提升,化学品生物制造的渗透率显著提高。同时,到2020年,预计生物医学工程产业年产值达6000亿元。 生物制药已然成为目前我国着力发展的战略新兴产业。2017年5月10日-11日,仪器信息网计划组织“生物技术药物评价及检测技术”网络研讨会。会议将邀请生物制药领域的专家及技术人员,为大家介绍生物技术药物评价及最新检测技术。欢迎大家报名参加。 会议日程: 5月10日 09:00-09:50 人血白蛋白的质量控制 赵璇(北京市药检所) 09:50-10:30 先进LC-MS方案进行生物类似药分析表征与比对研究 陈熙(Waters) 10:30-11:10 高分辨质谱仪在生物制药表征中的应用 孙佳楠(赛默飞) 11:10-11:50 SCIEX生物药完整分析创新解决方案 罗继(Sciex) 14:00-14:50 生物制品检测用酶的性质及使用注意事项 李素霞(华东理工大学) 14:50-15:30 待定 安捷伦 15:30-16:10 岛津在抗体类药物生物分析领域的创新技术与应用 张歆媛(岛津) 5月11日 09:30-10:20 中药中活性物质单克隆抗体的制备及其免疫检测应用 张浩(盘锦检测中心) 10:20-11:00 Testo 生命科学解决方案: 温湿度监测系统和验证服务 郭卫民(德图) 11:00-11:40 生物技术药物热稳定性评价-DSC技术 韩佩韦(马尔文)http://ng1.17img.cn/bbsfiles/images/2017/04/201704131517_01_2507958_3.jpg
国食药监注482号各省、自治区、直辖市食品药品监督管理局(药品监督管理局),总后卫生部药品监督管理局: 为加强药物临床试验生物样本分析实验室的管理,提高生物样本分析数据的质量和管理水平,根据《药品注册管理办法》、《药物临床试验质量管理规范》、《药物非临床研究质量管理规范》,参照国际规范,国家局组织制定了《药物临床试验生物样本分析实验室管理指南(试行)》,现予印发。请你局组织本行政区域内有关单位学习,参照执行。 附件:《药物临床试验生物样本分析实验室管理指南(试行)》起草说明 国家食品药品监督管理局 二O一一年十二月二日药物临床试验生物样本分析实验室管理指南(试行)第一章 总 则 第一条 为加强药物临床试验生物样本分析实验室的管理,提高生物样本分析数据的质量和管理水平。根据《药品注册管理办法》、《药物临床试验质量管理规范》、《药物非临床研究质量管理规范》,参照国际规范,制定本指南。 第二条 药物临床试验生物样本(以下简称生物样本)是指按照药物临床试验方案的要求、从临床试验受试者采集的需要进行分析的材料(如血浆、血清、尿液、粪便、组织和细胞等)。药物临床试验生物样本分析实验室(以下简称实验室)是指对生物样本中药物、药物代谢物及生物标志物等进行分析,为药品注册申请提供数据支持的机构。 第三条 凡为提交药品监督管理部门作为药品注册数据而进行生物样本分析的实验室,均须遵循本指南,并接受药品监督管理部门的监督检查。第二章 组织机构和人员 第四条 实验室应建立完善的组织管理体系,任命实验室负责人和项目负责人,并配备相应的实验人员。隶属于药物I期临床试验研究室(以下简称研究室)的实验室,应纳入研究室的质量保证体系;独立的实验室应建立质量保证部门,并任命质量保证部门负责人。 第五条 实验室负责人应具备相关专业本科以上学历,熟悉业务,能有效组织、指导和开展实验室业务工作。对分析工作的实施和结果负责。其职责包括: (一)全面负责实验室的建设,确保实验室具有满足工作要求的各项条件。 (二)组织制定和修改管理制度、技术规范和标准操作规程;定期审阅所有管理制度、技术规范和标准操作规程文件,确保所有文件适时更新。 (三)制定主计划表,掌握各项分析工作的进展。 (四)确保质量保证工作的开展。 (五)建立有效的沟通交流机制,以保证与申办者、药物临床试验机构及研究者之间可以及时、有效地沟通。 (六)建立完善的教育培训和考核制度。 (七)在每项实验开始前,指定项目负责人,试验过程中确需更换项目负责人时,应记录更换的原因和时间,并保留相关记录。 (八)审查、批准实验方案、标准操作规程、结果或报告。 (九)指定专人负责档案资料与生物样本的管理。 第六条 质量保证部门应配备与其开展的工作相适应的人员。质量保证部门负责人的职责为: (一)负责质量保证部门的工作安排和运行; (二)审核分析实验方案、实验记录、结果或报告; (三)根据每项工作的内容和持续时间制订稽查计划并实施稽查,详细记录稽查的内容、发现的问题、采取的措施等,并向实验室负责人和项目负责人报告; (四)检查实验室环境、设施、仪器设备和档案管理等; (五)参与标准操作规程的制订和审核,并保存标准操作规程的副本。 第七条 项目负责人具体负责某项临床试验生物样本的分析工作,具备相应专业本科或以上学历,两年以上生物样本分析工作经验,能够独立进行生物样本分析方法的建立和验证,并对所承担项目的分析方法、分析结果和分析报告负直接责任。项目负责人的职责包括: (一)制订该项目的实验方案; (二)全面负责该项目的运行管理、组织实施; (三)建立并验证分析方法,撰写验证分析报告; (四)确保所有参与该项目的实验人员明确各自所承担的工作,并掌握和执行相关的标准操作规程; (五)掌握工作进展,确保实验记录及时、完整、准确和清晰; (六)确保实验中偏离方案的情况及采取的措施均有详细记录; (七)整理、分析实验数据和结果,撰写分析报告; (八)及时处理质量保证部门的报告。 第八条 实验室工作人员应符合以下要求: (一)具备严谨的科学作风和良好的职业道德以及相应的学历,经过专业培训与考核,并保存个人的培训与考核记录,具备相应的经验和能力并取得上岗资格; (二)熟悉本指南要求,掌握并严格执行相关的标准操作规程; (三)及时、完整、准确和清晰地进行实验记录,对实验中发生的可能影响实验结果的任何情况应及时报告给项目负责人; (四)对涉及保密的技术资料、受试者信息等履行其保密责任; (五)根据工作岗位的需要着装,保持工作环境正常有序,遵守健康检查制度,确保实验样本不受污染。
中国生物技术药物产业现状上周,一份名为《在中国打造世界领先的创新型生物技术药物产业》的研究报告称,中国生物技术药物的市场总额约为180亿元,占全球生物技术药市场的2%,中国整体医药市场在全球医药市场中的比重则已达到7%;生物技术药在全球医药市场的比重已攀升至17%,然而,在中国,这一比重则一直停留在5%左右。 该报告由中国外商投资企业协会药品研制和开发行业委员会(RDPAC)与美国全球生物技术工业组织(BIO)共同发布。考虑到中国在该领域的勃勃雄心——在新近颁布的《生物产业规划》中,中国政府的目标是“到2015年,我国生物产业形成特色鲜明的产业发展能力,对经济社会发展的贡献作用显著增强,在全球产业竞争格局中占据有利位置。到2020年,生物产业发展成为国民经济的支柱产业”——报告中提示的现实令人尴尬。虽然报告明确称“中国仍有望打造世界级的创新型生物技术药物产业”,但是它给出的条件也是非常苛刻的。 BIO高级副总裁约瑟夫·戴梦德在报告发布会上表示,“生物技术药物产业的发展壮大需要有利的政策环境,需要同时从推动产业能力的提升和拉动市场需求两方面着手,缺一不可。”他比较了日美在此领域的经验教训,认为美国胜出的原因是“通过明确以创新为动力的生物经济发展目标,同时采取‘拉推并重’的政策,在几十年中成为全球最大的生物药市场及生物技术药物创新领域最为领先的国家”。 显然,中国还有很多艰苦的工作需要努力。报告首先将矛头指向了现行的监管制度和审批流程,认为它们的不足和缺陷“在一定程度上对患者及时获得安全有效的生物药造成障碍”。其中临床试验申请周期长、限制全球同步临床试验的政策等都拖慢了中国在生物医药上的脚步。 RDPAC执行总裁卓永清说,在中国生物技术药物平均需要19-22个月才能通过临床试验申请的审批,较之小分子化学药的10~18个月更漫长。而后者已经令人错愕不已了。 另外,他还指出,中国生物医药专利的保护范围较窄,致使对创新者的保护不足,令创新活动受到了损害,其长期影响将是重大的。在中国,生物医药分子专利申请保护的范围,通常是某个特定的蛋白质序列或和这个特定序列高度相似的一系列序列。因此,其他企业可以通过对专利保护的蛋白质序列稍作改动(而非真正创新活动),即可创建新的分子,而避免侵权责任。这在现实中已经发生。 尽管由于RDPAC的背景——它的会员主要是国际药业巨头——这种说法有瓜田李下之嫌,但是它也得到了本土先进企业的支持。毕竟,知识产权保护在创新中的地位无可置疑,不因利益不同而有所差异。事实上,当年由于缺乏强有力的知识产权保护和极具吸引力的经济奖励,中国小分子化学制药产业在研发投入尤其是创新性研发投入方面相当匮乏,导致中国虽有数千家企业化学仿制药厂在生产,利润却不及一个美国辉瑞。这是中国制药业惨痛的教训之一。 百济神州首席医学官陈之键指出:“政府应针对创新型生物药和生物类似物,分别建立严谨严格的、以大量科学数据为依据和基础的监管审批制度和严格有效的执行体系,覆盖全生产过程的监测系统,严格监管不良免疫反应,与国际接轨,遵循欧盟及WHO的全球准则,确保我国生物药品的高质量及安全性。” 报告还认为,中国需要革新的另一项内容是医保政策。目前,尚没有任何单克隆抗体药品进入《国家医保药品目录》。少数进入部分《省级医保药品目录》的单克隆抗体药品,主要针对住院治疗的病人,而且患者需要承担很高的自付比例。因此,中国患者实际使用创新型生物药的比例极低。以风湿性关节炎为例,只有约1%-2%的患者实际上接受了该类生物药的治疗。 之前3年,中国医保的覆盖面急速扩大,总人口的覆盖率达95%,已经成为全球最大的医保体系。这对于制药企业意味着几乎无限大的市场。然而,中国医保水平尚属“满足基本”型,高、精、尖医疗技术和药物势必被摒之门外。这让掌握这些技术和药物的国际药物巨头心焦难耐。使出浑身解数冲入这个围城是他们一致的梦想。这份报告正是这种心情的佐证。 固然,如果医保能够涵盖生物医药,自会给企业带来巨大利益,进而刺激他们的创新动力和能力。可问题是,中国医保筹资能力,在多大程度上可以容纳价格极其昂贵的生物医药?之前,中国社科院经济研究所公共政策研究中心刚给出一个测算,在现行制度下,在2020年之前,中国大部分城市医保基金都会陆续“穿底”,出现收不抵支。研究者认为,若放入医疗高端消费,会令这个日子来得更早些。 在此种情况下,商业保险也许是值得推荐的渠道。实际上,在全球范围内,很多患者依靠商业保险得以使用创新型生物药。只是在中国这一潜力还有待充分挖掘。一个利好是,政府有关部门已经在原则上承诺实行分级报销机制:政府着眼于基础医疗需求并拓展覆盖人群,而商业保险则作为重要补充手段,解决某些高成本的医疗支出。 一些药业巨头似乎正在接受这个事实。罗氏中国区总经理温陈佩茜指出:“对于很多患有严重疾病的患者而言,生物药是目前最有效的治疗方案,在兼顾中国国情的前提下,可利用政府、企业、患者等多方承担的共付机制,提高患者对创新药物的支付能力,加强药物的可及性。”
最近在做一些多肽类药物的生物分析,用的是液质联用,AB的4000,但是感觉方法总是不成熟,保留时间总是在漂,内标也不稳定,方法很难重现,样品前处理用的是固相萃取,有没有做过类似多肽化合物的朋友给点建议,怎样的色谱条件比较适合多肽类的检测和分析?
[align=center] [/align]由中国药理学会药物代谢专业委员会主办的“第十二届全国药物和化 学异物代谢学术会议”于 2018 年 10 月 12-14 日在河南省郑州市黄河迎宾馆盛大召开。会上,400余位专家学者就有关药物代谢与药物动力学研究现状、发展趋势、存在问题与对策进行学术交流和研讨。赛默飞市场经理范超在DMPK与新药成药性分会场给到场学者介绍 生物等效性评价 赛默飞整理解决方案,突出展示赛默飞领先技术是如何简化临床试验工作流程,诠释“新一代BE/DMPK 加速器”这一定位的。[align=center][img]http://img49.chem17.com/9/20181015/636752142915084132968.jpg[/img][/align][align=center]大会现场[/align][align=center][img]http://img47.chem17.com/9/20181015/636752143187600616425.jpg[/img][/align][align=center]赛默飞展位[/align][align=center][img]http://img50.chem17.com/9/20181015/636752143369587075898.jpg[/img][/align][align=center]赛默飞市场经理范超 报告现场[/align] 范超报告中提到:“有医无药医无用,有药无医药不灵”。药物自古以来便是医生治病救人的有力武器,每年都有新的药物被制药公司研发出来,但这些从实验室里创造出来的物质还不能称之为真正意义上的药物,在其正式上市前需经过严谨、科学的药物临床试验,以确保其安全性和有效性。然而未来药物分析中大分子及小分子等不同性质,不同属性的基质,为分析研究工作带来前所未有的挑战。[align=center][img]http://img47.chem17.com/9/20181015/636752143525812144171.jpg[/img][/align]而赛默飞生物分析解决方案——包括样品前处理产品、HPLC系统、质谱检测器,以及各类软件,为您提供最灵敏、最稳健、重现性的分析结果。针对目前中国市场如火如荼进行的仿制药质量和疗效一致性评价,众多的制药企业及技术外包部门都遇到种种问题,企业仍然为高昂的测试费用,生物等效性评价(BE)项目一次成功率低,非常耗时等问题所困扰。而赛默飞在2017年ASMS发布的高性价比的三重四极杆质谱TSQ Altis™ 及TSQ Quantis™ ,为仿制药生物等效性评价(BE)提供灵活性、稳定性及合规性的智能解决方案。[align=center][img]http://img47.chem17.com/9/20181015/636752143780058550530.jpg[/img][/align][align=center]全新一代三重四极杆TSQ Altis[/align] BE/DMPK的研究和申报是一项艰巨的任务,可能会面临很多的问题和困难,需要长期不懈的努力,本专题从样品前处理、小分子药物生物分析,并领先提出大分子药物生物分析的方法,及代谢物鉴定,为您整理了赛默飞新一代BE/DMPK相关解决方案。扫描下方二维码即可获取赛默飞全行业解决方案,或关注“赛默飞色谱与质谱中国”公众号,了解更多资讯[align=center][img]http://img49.chem17.com/9/20181015/636752144017147371797.jpg[/img][/align]
欢迎cuiyanhu担任药物分析-生物制品版主!我们希望有更多的热心用户能加入到版主队伍中来,也希望在职的版主能在版面中发现有能力的热心用户推荐给我们。论坛正在招募版主,有兴趣的用户请参见这个帖子:http://www.instrument.com.cn/bbs/shtml/20071101/1042199/
[font=Encryption][color=#898989]摘要:[/color][/font][font=Encryption][color=#666666] 近年来,基于电化学酶的生物传感器已成为一种简单、快速、超灵敏的检测药物和食品样品中不同化合物的装置.本文介绍了酶的分类、固定化和抑制信息等方面的研究进展,对电化学酶基生物传感器进行了详细的论述,总结并列出了一些用于食品和药物分析的电化学酶生物传感器研究.[/color][/font]
请教各位,1.用质谱做生物等效性实验,测定药物的血样浓度,每个样本需要进几针?2.实验是测定阿齐霉素含量,提取过程是血浆,加乙腈,加0.2mol碳酸钠,加 乙酸乙酯-异丙醇(95:5),上清液空气泵吹干,加流动相超声溶解,涡旋,离心.但用20000rpm,10分钟,仍有悬浮物,该如何处理 ?3.实验精密度差.我应在哪方面多注意?
药物代谢是研究药物在生物体内的吸收、分布、生物转化和排泄等过程的特点和规律的一门科学。药物经代谢后可能增强或者减弱药理作用,增加或减弱毒副作用,药物代谢对与指导临床安全有效的用药起到非常重要的作用,药物代谢越来越受到医药界的重视,下面介绍一些药物代谢研究的现状以及发展。
http://img3.17img.cn/bbs/upfile/images/20100518/201005181701392921.gif多肽蛋白等生物大分子药物分析色谱柱的选择讲座时间:2014年12月19日 10:00主讲人:金琦芸赛默飞世尔公司专业色谱耗材部产品市场经理,在赛默飞一直致力于色谱耗材方面的产品应用支持,在固相萃取,液相,气相色谱柱在制药、食品和环境中的应用,积累有丰富的经验。http://img3.17img.cn/bbs/upfile/images/20100518/201005181701392921.gif【简介】1、多肽蛋白等生物大分子药物分析色谱柱的选择2、生物大分子药物质量控制要求3、增强核技术色谱柱在多肽分离中的应用4、聚合物技术色谱柱在多肽蛋白分析中的应用 * 我们会在线上的听众中随机抽取5名幸运观众,赠送USB mini 办公/车载加湿器,报名后请记住讲座时间,别错过我们可爱的小礼品~!-------------------------------------------------------------------------------1、报名条件:只要您是仪器网注册用户均可报名参加。2、报名并参会用户有机会获得100元手机充值卡一张哦~3、报名截止时间:2014年12月19日 09:304、报名参会:http://www.instrument.com.cn/webinar/meeting/meetingInsidePage/12625、报名及参会咨询:QQ群—231246773
被称为“白色瘟疫”的结核病是经呼吸道传播的慢性传染病,主要发生在肺部,是一种国际性的重要传染病。近年来,由于人口的增长及流动性增加、结核杆菌耐多药性(MDR-TB)和广泛耐药(XDR-TB)的出现、HIV/AIDS的感染和传播等原因,使得已经十分严重的结核病更是“雪上加霜”,结核病已经重新成为威胁整个世界安全与健康最为严重的流行病之一。 张立新课题组在盖茨基金-全球抗结核联盟、Genzyme制药公司和中国科学院知识创新工程重要方向项目的支持下,对我国海洋微生物中具有抗结核分枝杆菌活性成分进行了系统的研究,发现了许多具有新作用机制的抗结核化合物。由于野生结核分枝杆菌毒株H37Rv生长缓慢,影响了高通量筛选的效率,课题组构建了针对对数生长期卡介苗(BCG,牛结核分枝杆菌的减毒株)的高通量筛选模型,可直接读取荧光判断细菌生长情况,大大缩短测试所需要的时间。 依托于实验室已经建立的菌株库和天然产物粗提物库,通过高通量筛选,研究人员获得一系列具有良好的抗结核分枝杆菌活性的粗提物,对这些活性菌株进行放大发酵、活性追踪分离,获得了一系列具有良好活性的成分。这些研究成果已申请专利,相关文章陆续发表在Organic Letters,Journal of Natural Products等国际天然产物杂志上。 其中,通过与澳大利亚昆士兰大学Robert Capon教授合作,从一株海洋真菌中发现了4个新的活性化合物,其中1个独特的二聚化合物具有最强的抗BCG活性最小抑菌浓度为6.25µg/mL,而对测试的其他微生物菌株的最小抑菌浓度都大于100µg/mL。其生物活性的选择性和由独特结构骨架带来潜在的全新作用机制备受关注,该项研究成果近期发表在Organic Letters(OL)杂志上(图1)。 课题组与美国Broad Institute合作研究建立了结核分枝杆菌全细胞筛选模型,从课题组的天然产物库中成功筛选和鉴定了两个小分子抑制剂,并通过化学生物学手段揭示其作用靶点与细胞壁形成相关,研究成果发表在ACS Chemical Biology杂志上(图2)。论文在线发表不足一月,已经进入该期刊Most viewed article。 结核分枝杆菌枝菌酸的生物合成途径一直是很重要的抗结核药物靶标,苯并咪唑化合物(左)的作用于结核分枝杆菌枝菌酸的生物合成途径,其靶点为枝菌酸的转运蛋白MmpL3(分枝杆菌膜蛋白3);硝基三唑化合物(右)的靶点为癸异戊烯磷酰基-β-D-核糖2'-差向异构酶(DprE1),抑制该酶的活性可以影响细胞壁阿拉伯聚糖的合成,从而促进细胞裂解和结核杆菌的死亡。 课题组的科研人员还在其他杂志上发表了具有新结构的抗结核化合物。课题组还受Natural Product Reports杂志邀请,对抗TB活性成分研究进行了总结和综述。http://www.cas.cn/ky/kyjz/201210/W020121018505338373571.jpghttp://www.cas.cn/ky/kyjz/201210/W020121018505338371569.jpg