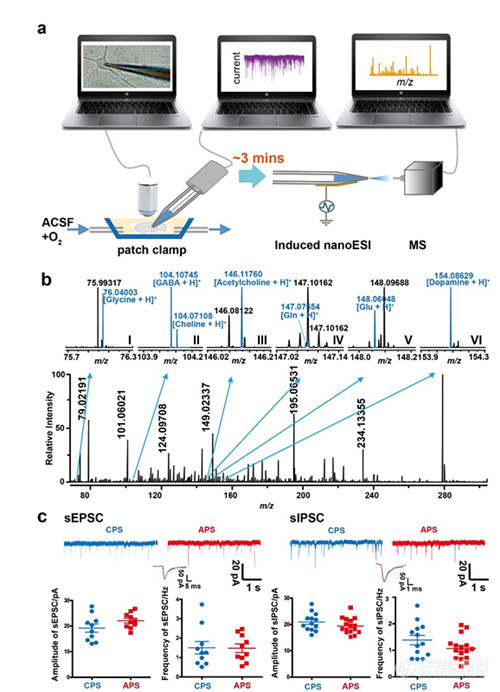
石墨烯 “新材料之 王”竟成为神经电生理研究新选择,为什么它拥有无限潜力?
“新材料之 王”是什么? 石墨是的一种同素异形体,质软,黑灰色,有油腻感。高定向热解石墨(highly oriented pyrolytic graphite)是指热解石墨,经高温处理使性能接近单晶石墨的一种新型石墨,简称HOPG。在2004年来自英国曼彻斯特大学的科学家们从高定向热解石墨中剥离出石墨片,然后将薄片的两面粘在一种特殊的胶带上,撕开胶带,把石墨片一分为二,不断重复操作,于是薄片越来越薄,最 后,他们得到了仅由一层碳原子构成的薄片,这就是石墨烯。(▲三层碳原子构成的石墨结构分子示意图)在分离出单层石墨烯之前,大多数物理学家认为,热力学涨落不允许任何二维晶体在有限温度下存在。所以,石墨烯的发现立即震撼了凝聚体物理学界。但是实际上石墨烯本来就存在于自然界,只是难以剥离出单层结构。石墨烯一层层叠起来就是石墨,厚1毫米的石墨大约包含300万层石墨烯。铅笔在纸上轻轻划过,留下的痕迹就可能是一层甚至几层石墨烯。(▲由石墨烯构成的铅笔芯,图片取自央广网科普|习主席访英为何青睐&ldquo 奇迹材料&rdquo 石墨烯?2015-10-23) 石墨烯结构特点碳原子有4个价电子,石墨烯内部碳原子的3个电子生成sp2键,即每个碳原子都贡献一个位于pz轨道上的未成键电子,近邻原子的pz轨道与平面成垂直方向可形成&pi 键,新形成的&pi 键呈半填满状态。形成的石墨烯为复式六角形晶格,每个元胞中有两个碳原子,每个原子与最近邻的 3个原子间形成3个&sigma 键,剩余的一个p电子垂直于石墨烯平面,与周围原子形成&pi 键。(▲石墨烯结构示意图,石墨烯的蜂窝状晶格包括两层互相透入的三角形晶格,每个子晶格A的格点都位于其他子晶格B确定的三角形中央,共同形成石墨烯的蜂窝状晶格)(▲石墨烯结构的波失空间,石墨烯的晶体结构与倒格子,所谓倒格子是与晶格空间相对应傅里叶变换出来的波矢空间,或称动量空间)(▲石墨烯能带结构图)我们可以看出在 K 和 K&rsquo 点附近,费米面附近的电子能量E与波矢 k成线性的关系,E= F|hk|v , 其中k为准粒子动量,Vf =106 m/s,为费米速度。色散关系是近似线性的,这等效于动量与能量的关系为线性,这也就表明电子的速度为常量,并不受动量与动能的影响。在这种情况下,薛定谔方程来描述粒子的运动已经无效了,我们需要运用引入了相对论效应的狄拉克方程来描述。关于石墨烯非常高的电子迁移率的原因也是由于狄拉克点的存在,由于量子隧穿效应的影响,电子有概率穿过高于自身能量的势场。石墨烯的优势有什么?由于存在这样的特殊结构,石墨烯具备了超高的载流子迁移性,也就具备了良好的导电性和极高的信噪比以及时间分辨率。所有性能都基于结构,所以,石墨烯同样还具备轻盈,高导热性,做同样的功所消耗电力少,化学反应性强,强度高,比表面积大,高弹性高硬度等特点,发热少等优点。这么多优点又如此应用广泛,难怪石墨烯被称为&ldquo 黑金&rdquo ,是&ldquo 新材料之 王&rdquo !2004年被发现,发现者2010年就获得了诺贝尔物理学奖,连我们的习大大都去参观了曼彻斯特大学的石墨烯研究所呢!在笔者看来最重要的一个特点是,单层的石墨烯近乎透明,对于应用场景的限制大大减少了。石墨烯如何制备?石墨烯之父采用的是机械剥离法,这个方法较为简便,将天然石墨块放在干净的二氧化硅SiO2上,上方用透明胶带反复剥离,从而得到石墨薄片。根据菲涅尔定律,在外部光源照射下,石墨烯与SiO2基底之间会因反射光强不同呈现光学反差,并且这种光学反差随着石墨样品厚度增加有着明显改变,借此办法来确定石墨烯是否为单层或多层。这个方法虽然简便,但不适合大规模生产。除此之外还有氧化还原法, 取向附生法, 碳化硅外延法, 赫默法以及化学气相沉积法(CVD)。CVD法简单说来就是用含碳有机气体为原料进行气相沉积制得石墨烯薄膜的方法,这也是目前科研机构制备石墨烯常用的方法。(▲化学气相沉积法CVD示意图)例如以铜Cu或镍Ni为基底,高温加热,并辅以甲烷作为碳源补充,使甲烷中的碳原子脱去氢,在基底上形成石墨烯。不同材质的基底对于碳原子溶解性不同,所以会产生&ldquo 石墨烯岛&rdquo 或&ldquo 石墨烯膜&rdquo ,通过控制气压高低可以获得单层石墨烯或多层石墨烯。 石墨烯的应用极高的信噪比和时间分辨率让石墨烯在生物电信号采集时具有极大的优势。目前的生物电传感器主要集中在膜片钳和微电极阵列,前者具备较高的空间分辨率,信噪比较好,但对生物体有损伤;后者没有损伤且可长时间记录生物体膜外信号,但是信噪比和空间分辨率相对较低。场效应晶体管是一种很好的代替微电极阵列的记录工具,利用场效应晶体管可以很好的记录小鼠大脑皮层或者海马区的神经电生理信号,也可以将其刺穿细胞膜来记录膜内电势差。这种技术信噪比较高,集成度也不错。石墨烯场效应晶体管和传统的场效应晶体管类似,但需要在石墨烯的表面做相应的修饰,使其能特异性识别某种分子或物质这样就既可以提高生物相容性和灵敏度,又能把石墨烯载流子迁移率高和载流子浓度高的特点发挥得淋漓尽致。上图为60通道石墨烯微电极阵列示意图,PI:1-&mu m-thick light-sensitive polyimide,即1微米厚光敏聚酰亚胺1,以此装置记录大鼠胚胎分离的神经细胞电生理活动。上图为石墨烯晶体管进行细胞电信号记录示意图,在柔性聚酰亚胺基底和透明基底(蓝宝石,玻璃,SiO2 /Si) 上制备了石墨烯液栅晶体管器件如上图所示,并用其记录小鼠初级海马神经元的神经信号2,因石墨烯材料透明的特点,同时结合倒置光学显微镜,观察细胞的光学特征。上图是石墨烯晶体管上培养的神经元细胞图,培养21天后的神经元进行免疫荧光染色2,DAPI(红色)和anti-Synapsin(绿色)染色,分别胞体和突触囊泡)机械剥离的石墨烯对心肌细胞电生理信号的记录3,A:在不同water gate potentias下记录的数据。蓝色、绿色和红色分别代表在 +0.05、+0.10 和 +0.15 V 下所记录。相应的灵敏度分别为 2020、398 和 2290 &mu S/V。B:所选栅极电位的代表性扩展峰值。蓝色类似于在石墨烯 FET 的 p 型器件极性处记录的结果,红色峰代表在n型器件极性处记录的结果,绿色峰代表在Gra-FET的狄拉克点附近记录的结果。上图为16通道石墨烯晶体管阵列记录HL-1细胞电生理信号4, 比例尺为100 &mu m。一个石墨烯场效应晶体管阵列中8个晶体管在数十秒(h)和数百秒(i)内同时记录电流的情况。图:细胞相容性测试,37摄氏度下,不同浓度纯石墨烯(上)和氧化石墨烯(下)处理Vero细胞后的存活率情况5。 石墨烯最 新应用研究近日,来自曼彻斯特大学的纳米医学实验室的研究者们利用利用石墨烯近乎透明的特点,监测脑缺血小鼠大脑皮层的电信号,并同时监测皮层血流灌注量变化情况,因为石墨烯近乎透明的性质,在激光成像下不会产生激光伪影(如下图所示)。(▲利用石墨烯透明的特点,监测脑缺血小鼠大脑皮层的电信号,并同时监测皮层血流灌注量变化情况,由RWD RFLSI Ⅲ激光散斑血流成像系统采集)总结石墨烯具备了许多神经电极活性材料的特性,如良好的相容性、化学稳定性、柔韧性、光学透明性和高导电性等,为更精 准的神经电生理研究提供了新的选择。识别下方二维码快来免费申请试用吧* 敬请期待下期内容,脑卒模型下的神经电生理相关特点。【参考文献】1:Du X, Wu L, Cheng J, Huang S, Cai Q, Jin Q, Zhao J. Graphene microelectrode arrays for neural activity detection. J Biol Phys. 2015 Sep 41(4):339-47.2. Veliev F, Han Z, Kalita D, Brianç on-Marjollet A, Bouchiat V, Delacour C. Recording Spikes Activity in Cultured Hippocampal Neurons Using Flexible or Transparent Graphene Transistors. Front Neurosci. 2017 11:466.3. Cohen-Karni T, Qing Q, Li Q, Fang Y, Lieber CM. Graphene and nanowire transistors for cellular interfaces and electrical recording. Nano Lett. 2010 Mar 10 10(3):1098-102.4. Hess LH, Jansen M, Maybeck V, Hauf MV, Seifert M, Stutzmann M, Sharp ID, Offenhä usser A, Garrido JA. Graphene transistor arrays for recording action potentials from electrogenic cells. Adv Mater. 2011 Nov 16 23(43):5045-9, 4968. 5. Sasidharan A, Panchakarla LS, Chandran P, Menon D, Nair S, Rao CN, Koyakutty M. Differential nano-bio interactions and toxicity effects of pristine versus functionalized graphene. Nanoscale. 2011 Jun 3(6):2461-4.