自身免疫性疾病药物研发趋热,全光谱流式助您进军千亿自免市场
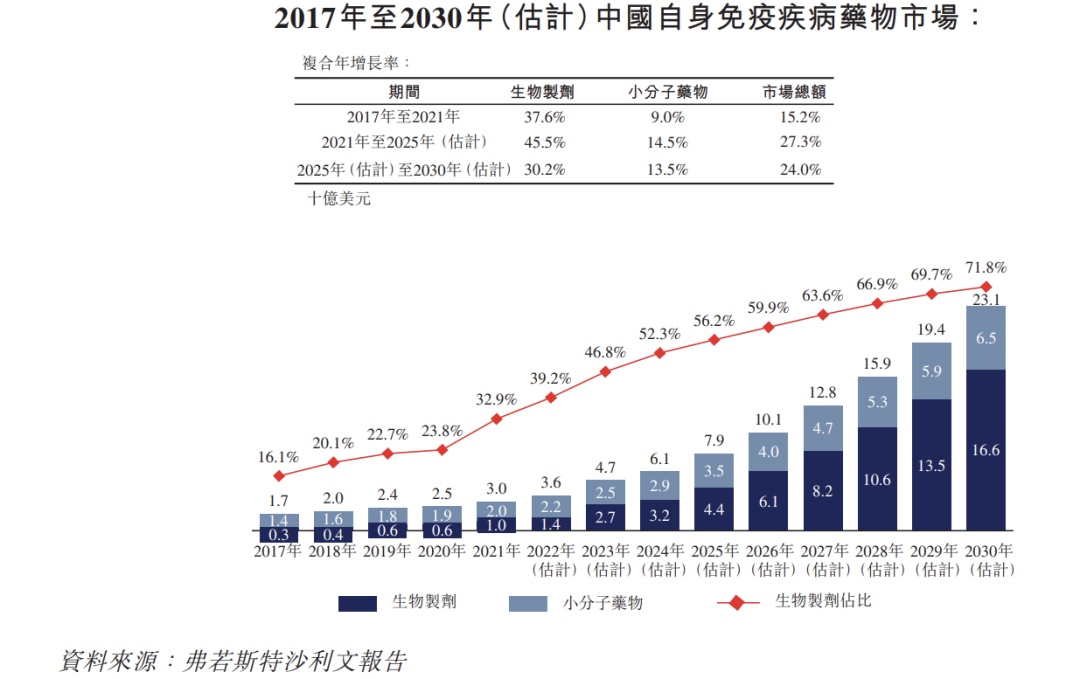
自身免疫性疾病药物市场2022年,全球TOP100畅销药销售收入合计4,868亿美元,其中共有18款自身免疫性疾病产品跻身TOP100榜单,总金额达861.7亿美元,自免药物市场已成长为仅次于肿瘤的第二大药物市场。自身免疫赛道呈现的市场前景,吸引着众多国内外药企纷纷抢滩布局。弗若斯特沙利文数据显示,全球自身免疫性疾病药物市场预计将由2021年的1,277亿美元,增长至2030年的1760亿美元,复合年增长率为3.6%。2021年,自身免疫性疾病生物制剂市场规模为891亿美元,预计到2030年将增至1421亿美元,分别占2021年及2030年全球自身免疫性疾病药物市场的69.8%及80.8%。相较而言,国内自免药物开发起步较晚,目前市场份额基本被头部跨国药企牢牢占据,但鉴于中国庞大的患者群体及自身免疫性疾病创新疗法的进步,中国自身免疫性疾病药物市场有望快速增长,由2017年的17亿美元增长至2021年的30亿美元,复合年增长率为15.2%,估计2030年将达到231亿美元,2021年至2030年复合年增长率为25.5%。其中生物药在中国自身免疫性疾病中的份额将由2021年的32.9%增加至2030年的71.8%。尽管国内目前还没有出现自免领域的巨头公司,不过,我们可以发现,国内药企在自免赛道的布局已经初见成效,银屑病、特应性皮炎、SLE等疾病领域近几年将有多款本土新药接踵而至。自身免疫性疾病与免疫细胞改变自身免疫性疾病(Autoimmune disease, AID)是免疫系统针对自身机体成分(如器官、组织或细胞等)发生免疫反应而引发的疾病。根据机体损伤的情况可分为系统性和器官特异性AID。前者主要是指弥漫性结缔组织病,包括系统性红斑狼疮(Systemic Lupus Erythematosus, SLE)、类风湿关节炎(Rheumatoid Arthritis, RA)、干燥综合征(Sjogren's Syndrome, SS)、系统性硬化症(Systemic Sclerosis, SSc)、多肌炎/皮肌炎等;后者可涉及到各种组织或器官的特异性损伤,如多发性硬化症(Multiple Sclerosis, MS)、自身免疫性肝病(Autoimmune Hepatitis, AIH)、1型糖尿病、自身免疫性甲状腺疾病、自身免疫性胰腺炎、炎症性肠病等。 自身免疫的发生是是多种免疫反应的共同结果,所以自免疾病的主要特征之一就是外周免疫细胞改变,即外周免疫细胞表现出与健康个体不同的细胞亚群分布和活化谱。由于免疫系统的复杂,免疫细胞的改变往往涉及多种不同的细胞亚群,包括T、B、NK、DC、巨噬细胞等(图1)。图1 - 自身免疫性疾病的免疫改变以T和B细胞为例,许多研究表明,与健康个体相比,患有自身免疫性疾病的患者表现出CD4+记忆T细胞和抗体分泌B细胞水平的升高。T细胞通过自身抗原识别、细胞因子产生和增强的细胞毒性在自身免疫性疾病的发病机制中起关键作用。显著的 CD4+ T 细胞亚群比例的增加,如 Th1、Th17、滤泡辅助细胞 (Tfh)、调节性 T 细胞 (Treg) 和 CD4+CD25-Foxp3+ T 细胞等,已被证实与RA,MS,pSS或SLE等疾病的异常免疫反应有关,这些改变可能参与了疾病的发病机制。近几十年来,产生IL-17的Th17细胞和FOXP3+ Tregs细胞已被强调为自身免疫性疾病的治疗靶点。自身反应性 B 细胞是适应性免疫的另一个主要组成部分,可产生病理性自身抗体,并通过 Ag 呈递和产生细胞因子从而激活 T 细胞。自身抗体的产生是各种自身免疫性疾病如RA、SLE等的特征性标志。由于B细胞在自身免疫中的重要作用,B细胞表面分子也成为各种自身免疫性疾病的潜在治疗靶点。近年来,抗B细胞抗原(抗CD20)在自免疾病如MS、RA等的治疗中取得了显著疗效,FDA批准的B细胞靶向治疗已经扩展到多种自身免疫性疾病,从器官特异性疾病,如天疱疮和MS,到系统性疾病,如ANCA相关血管炎、RA和SLE等。(表1)表1 - B细胞靶向疗法治疗自身免疫性疾病综上所述,鉴于免疫细胞在自身免疫性疾病中的重要性,详细而全面的了解免疫细胞的组成和炎症潜能对于自免疾病的分析至关重要。比如,免疫细胞活化或抑制性表面受体的表达比可用于某些自免疾病的鉴别诊断;CD19+ B细胞数量的改变,可作为使用利妥昔单抗治疗RA后疾病复发的监测指标。可见,无论是研发端的探索致病机制、寻找潜在治疗靶点、体外药物筛选测定,还是临床端对疾病的辅助诊断、制定个性化治疗方案、预测治疗效果等,深度的免疫分型都有着非常重要的意义。全光谱流式加速自身免疫性疾病研究进展全光谱流式分析技术可以为每个荧光基团生成不同的光谱指纹,从而能够分辨具有相似发射峰(高度重叠)的荧光染料。因此,全光谱流式技术允许在一个方案中包括尽可能多的感兴趣的标记,从而建立具有更多参数且更加灵活的检测方案。全光谱分析技术的出现推动了多色流式的迅速发展,里程碑事件就是Cytek️ 研究团队发表了40色人外周血中主要细胞亚群的深度免疫分型方案。方案不仅包括识别特定细胞亚群的标记,如CD4+ T细胞,CD8+ T细胞、调节性T细胞、NK细胞、单核细胞和树突状细胞,还纳入了许多功能性标记,如激活、分化及趋化因子受体标记等。文章发表后,此40色方案陆续被许多研究者借鉴并用于他们的相关研究中,这些研究覆盖如肿瘤、感染、自免等广泛领域。鉴于其对流式领域的突出贡献,该文章荣获了由国际先进细胞术协会(ISAC)颁发的, Cytometry Part A 2022年度最佳文章奖(图2a)。图2 – Cytek️ 40色深度免疫分型方案。(a)该研究工作荣获Cytometry Part A年度最佳文章奖,(b)40色方案用于儿童SLE的探索研究。自免疾病相关的研究,一直是全光谱流式比较热门的应用之一,早在2019年,美国斯坦福大学的研究团队究就发表了23色光谱流式方案在自身免疫性疾病应用的文章,详细内容可以参考我们早期的微信文章23色方案,探索自身免疫性疾病的潜在治疗靶标,及23色自身免疫性疾病方案T和B细胞亚群的设门。今年4月,来自荷兰的研究者的一篇关于儿童SLE的探索性研究,就使用了上述40色方案对各免疫细胞亚群进行深度分析(图2 b)。同样在今年,来自维也纳的研究团队发表了一篇名为“Advanced immunophenotyping: A powerful tool for immune profiling, drug screening, and a personalized treatment approach”的文章,在文章中,研究者通过系列实验,证实了他们基于Cytek全光谱流式细胞仪(3激光)开发的两个22色深度免疫分型方案,可作为自身免疫性疾病鉴别诊断、体外药物筛选、个性化治疗评估的有力工具。两个22色免疫方案,一个能够深入表征B细胞,单核细胞,DC和NK细胞,另一个能够表征T细胞及其效应/记忆亚群,以及不同的Th细胞亚群(图3)。方案中还包括了19个不同的激活和抑制标记。图3 - 3激光22色自免疾病T细胞分析方案随着对自身免疫性疾病研究的不断深入,全光谱分析技术在多个自免疾病(如SLE、RA、MS等)中的研究成果被越来越多发表或报道,为自免领域的科学家们探索自免疾病的致病机理、寻找潜在治疗靶点、评估药物疗效等,提供着必不可少的助力,现在,全光谱流式正在帮助科学家们加速从探索到发现的过程。CytekcFluor一站式试剂盒助力自身免疫性疾病治疗监测2022年12月,Cytek推出了cFluor人B细胞监测试剂盒。该试剂盒可用于Cytek全光谱流式系统上使用,对人全血和外周血单个核细胞中的B细胞精细亚群进行识别和计数。是评估B细胞缺陷、开发自免疾病药物、以及临床评价抗CD20治疗效果非常有用的工具。(图4)图4 - Cytek cFluor 人B细胞监测试剂盒试剂盒的详细信息及特点可点击下方微信链接进一步了解:cFluor人B细胞监测试剂盒助力自身免疫性疾病治疗监测参考材料:1.弗若斯特沙利文,中国生物类似药市场研究报告(下)。2.Preglej, Teresa, et al. "Advanced immunophenotyping: A powerful tool for immune profiling, drug screening, and a personalized treatment approach." Frontiers in Immunology 14 (2023).3.Wang L, Wang F S, Gershwin M E. Human autoimmune diseases: a comprehensive update[J]. Journal of internal medicine, 2015, 278(4): 369-395.4.Carvajal Alegria G, Gazeau P, Hillion S, et al. Could lymphocyte profiling be useful to diagnose systemic autoimmune diseases?[J]. Clinical reviews in allergy & immunology, 2017, 53: 219-236.5.Disanto G, Morahan JM, Barnett MH, Giovannoni G, Ramagopalan S V. The evidence for a role of B cells in multiple sclerosis. Neurology. (2012) 78:823–32. doi: 10.1212/WNL.0b013e318249f6f0.6.Leandro MJ, Cambridge G, Ehrenstein MR, Edwards JC. Reconstitution of peripheral blood b cells after depletion with rituximab in patients with rheumatoid arthritis. Arthritis Rheumatol (2006) 54(2):613–20. doi: 10.1002/art.21617. 7.Trouvin AP, Jacquot S, Grigioni S, Curis E, Dedreux I, Roucheux A, et al. Usefulness of monitoring of b cell depletion in rituximab-treated rheumatoid arthritis patients in order to predict clinical relapse: A prospective observational study. Clin Exp Immunol (2015) 180(1):11–8. doi: 10.1111/cei.12481. 8.Vancsa A, Szabo Z, Szamosi S, Bodnar N, Vegh E, Gergely L, et al. Longterm effects of rituximab on b cell counts and autoantibody production in rheumatoid arthritis: Use of high-sensitivity flow cytometry for more sensitive assessment of b cell depletion. J Rheumatol (2013) 40(5):565–71. doi: 10.3899/jrheum.111488.9.Barnas, Jennifer L., Richard John Looney, and Jennifer H. Anolik. "B cell targeted therapies in autoimmune disease." Current opinion in immunology 61 (2019): 92-99.10.Murphy K A, Bhamidipati K, Rubin S J, et al. Immunomodulatory receptors are differentially expressed in B and T cell subsets relevant to autoimmune disease. [J]. Clinical Immunology, 2019.11.Park, Lily M., Joanne Lannigan, and Maria C. Jaimes. "OMIP‐069: forty‐color full spectrum flow cytometry panel for deep immunophenotyping of major cell subsets in human peripheral blood." Cytometry Part A 97.10 (2020): 1044-1051.12Wahadat M J, van Tilburg S J, Mueller Y M, et al. Targeted multiomics in childhood-onset SLE reveal distinct biological phenotypes associated with disease activity: results from an explorative study[J]. Lupus Science & Medicine, 2023, 10(1): e000799.关于CytekAbout Cytek /Cytek Biosciences, Inc.(Nasdaq: CTKB)作为一家全球技术领先的生命科学技术公司,通过其受专利保护的全光谱分析(Full Spectrum Profiling&trade ,FSP&trade )技术,提供高分辨率、高参数和高灵敏度的新一代细胞分析工具。Cytek的创新技术通过检测荧光信号的完整光谱信息,以实现更高水平更高灵敏度的多参数检测。Cytek的FSP&trade 平台包括其核心仪器 —— Aurora和Northern Lights&trade 分析系统、Aurora CS分选系统,Amnis和Guava品牌下的流式细胞仪和成像产品,以及试剂、软件和服务,为客户提供全面和完整的解决方案。Cytek总部位于美国加利福尼亚州Fremont,在全球设有分部和分销渠道。更多的相关信息,请登录Cytek的官方网站:www.cytekbio.com和www.cytekbio.com.cn。注:Cytek, Tonbo Biosciences, cFluor, Full Spectrum Profiling&trade , FSP&trade 和Northern Lights&trade 是Cytek Biosciences, Inc. 的商标或注册商标。Cytek全光谱检测技术相关专利包括但不限于:US10739245B2,US11169076B2,US10788411B2。 /