加热蛋白溶菌酶能杀灭诺如病毒日本东京海洋大学的一个研究小组日前宣布,在实验中发现,加热处理鸡蛋蛋白含有的溶菌酶,能灭活诺如病毒。这是由于溶菌酶能破坏包裹诺如病毒基因的外壳。诺如病毒会引发急性肠胃炎和食物中毒。这种病毒具有强大的感染力,只要有10至100个病毒体进入人体,就会导致感染,目前还没有有效的抗病毒剂。研究小组利用实验鼠的诺如病毒替代人类诺如病毒进行了实验。他们将蛋白中含有的溶菌酶在100摄氏度下加热40分钟,使其变性。接下来,将含有1%加热处理过的溶菌酶的溶液与实验鼠诺如病毒混合在一起,并观察了1分钟之后的变化。溶菌酶是蛋白等含有的一种能水解致病菌中黏多糖的碱性酶。研究人员发现,诺如病毒基因量大幅减少,以致无法检出,并观察到病毒体出现膨胀。他们认为这是由于包裹病毒基因的外壳被破坏导致的。研究人员指出,实验鼠诺如病毒和人类诺如病毒从遗传学上来看非常类似,所以这种加热变性处理的蛋白溶菌酶对人类诺如病毒应该也有效果。他们希望将其制成消毒喷雾剂,在下一年度达到实用化。
我国已批准紧急使用的重组蛋白亚单位新冠病毒疫苗,I期、II期临床试验结果日前在国际医学期刊《柳叶刀传染病》发布。结果表明,疫苗安全性良好,接种3剂次25微克疫苗的97%入组者产生了可以阻断活病毒的中和抗体,中和抗体水平超过康复患者血清。该疫苗由中国科学院微生物研究所联合安徽智飞龙科马生物制药有限公司研发,今年3月10日经有关部门评估论证同意紧急使用。据介绍,疫苗在国内的两期临床试验共招募950名18岁至59岁的健康成年人,采用随机、双盲和安慰剂对照的试验方案。试验对疫苗的安全性和免疫原性进行评估,包括不良事件和严重不良事件、抗体滴度、中和抗体滴度以及血清阳转率。结果表明,没有疫苗相关的严重不良事件发生。接种2剂次疫苗后,76%的人可以产生中和抗体。接种3剂次疫苗后,97%的人可以产生中和抗体。目前,该疫苗正在乌兹别克斯坦、印尼、巴基斯坦和厄瓜多尔开展国际多中心III期临床试验,并于3月1日在乌兹别克斯坦获批注册使用。重组蛋白亚单位疫苗是通过基因工程的方式在工程细胞内表达纯化病原体抗原蛋白,然后制备成疫苗。有别于灭活疫苗和腺病毒载体疫苗,这是一种新技术路线研制的新冠病毒疫苗。截至目前,我国有4个新冠病毒疫苗附条件上市、1个新冠病毒疫苗获批紧急使用。
美国国家卫生研究院的科学家最近在感染HIV病毒患者的血液中,确认了新型的HI抑制蛋白。在实验室的研究中,这种名为CXCL4的蛋白质可与HIV直接结合,使其无法依附或进入人体细胞。新研究结果有望在未来艾滋病的治疗和疫苗研制中发挥作用。 美国科学家在近日出版的美国《国家科学院学报》上发表报告称,CXCL4隶属于名为趋化因子的分子家族,它能够帮助调节身体内部免疫细胞的运动。 20世纪90年代中期,科学家通过实验发现,4种趋化因子可发挥HIV抑制剂的功能。研究人员认为,这些趋化因子连同CXCL4或许能够调节患者体内的病毒复制水平,从而控制艾滋病的发展速度。 不过,CXCL4在多个方面与其他4种主要的HIV抑制趋化因子不同。其他趋化因子需通过与一至两种细胞受体相捆绑来抑制HIV感染,而CXCL4则可直接附着于病毒的外层表面之上;同时,CXCL4还能结合种类繁多的HIV菌株以阻止感染,而无需担心其对应的受体的特异性;最后,其他趋化因子主要由免疫细胞所制造,而CXCL4则由血小板所制成。 研究人员还将开展进一步研究,以便更好地了解CXCL4在艾滋病防护中发挥的作用,并确定趋化因子在人体内是否也能如在实验中一样具有防护效应。
功能性蛋白及一例分析自19世纪中叶荷兰化学家Gerardus Mul-der从动物组织和植物体中提取出蛋白质以来,人们发现了越来越多的蛋白质,据估计生物界中蛋白质的种类可达1010~1012之多;在这如此众多的蛋白质中,功能性蛋白发挥着极其重要的生理功能 。功能性蛋白也有人称其为活性蛋白。它们的特点是都有识别功能,能与其他分子特异性结合.完成各种复杂的生命活动:在结构上主要是一些球状蛋白质。1 功能性蛋白的种类按其作用方式不同可分为酶蛋白、运输蛋白、运动蛋白、免疫球蛋白、毒蛋白、激素蛋白(1)酶蛋白: 细胞的生长和繁殖、代谢物的合成和分解、能量的产生和利用,这些过程所需要的物质都是通过无数的生物化学反应来提供的.而这些反应又都是在一类特殊蛋白质—酶蛋白的催化下完成的。酶的催化效率极高,且具有高度的专一性,也正是这种高度的专一性使一种特定的酶只能作用于一种或少数几种结构相似的化合物,这就要求有各种不同的酶去作用于不同的化合物。在酶的作用下,生物细胞才得以合成各种复杂的化合物,也才能使各种大分子物质被分解、吸收和利用.且这些反应都要在适合于生物体本身的温度、压力和pH值等非常温和的条件下进行,能使生物细胞按照这种方式进行化学变化是蛋白质最重要的功能之一。常见的酶蛋白如淀粉酶使淀粉分解形成葡萄糖,蛋白酶、肽酶使蛋白质分解为氨基酸;溶菌酶使细菌细胞壁中的肤聚糖被破坏;凝血系统酶的有序作用使凝血过程得以有条不紊地进行.合成酶能合成多种体内所需要的大分子物质。应用举例:由于近年来鱼粉资源价格上涨,冷向军等人通过向鱼粉含量较低(10﹪)的饲料个添加蛋白酶AG使鱼的前肠蛋白酶有显著提高。同样有实验证明在玉米-豆粕型粮食中添加蛋白酶可以改善肉鸡的生长性能,提高蛋白质的消化率。(2)运输蛋白:有些蛋白质起载体的作用可以运输特定的物质到达必须的部位,使其完成特定的功能,这种蛋白质称为运输蛋白。如哺乳动物的血红蛋白能将氧从氧气充裕的肺内运送到各个组织中去:血清蛋白能与游离脂肪酶等多种物质结合,并将这些物质在脂肪组织与身体的其他部位间运送(最典型的β1-脂蛋白可随血流运输脂肪),铁传递蛋白能传递血液中的铁。无脊椎动物体内的血蓝蛋白,大豆根瘤中的豆血红蛋白也起着输送氧气的作用。另外还有一些能携带物质通过细胞膜进出细胞的蛋白质,如细菌过膜运输中的载体蛋白等,它们都属于运输蛋白。(3)运动蛋白:参与运动功能的蛋白质种类较多如脊椎动物中骨骼肌的主要成分就是肌动蛋白和肌球蛋白,肌肉的收缩就是靠着这两种互相联系的平行丝状蛋白相对滑动来完成的;细菌的运动器官——鞭毛也是由鞭毛蛋白组成的;绿藻的运动也离不开蛋白质;有丝分裂的完成,精子的运动等都与运动蛋白有关,所以绝大多数生物的运动和收缩过程都是运动蛋白参与的结果。应用举例:邱永忠等人在研究烟草花叶病毒(TMV)在植物细胞间的运动时发现用体外定位突变引起L株上,被点突变的DNA体外转录成RNA后感染感病烟草,结果定位突变的L株表型30kD蛋白基因四种位点不同的移码突变和一种基因中间大部分缺失的突变体均使病毒不能感染植株。这证明TMV 30kD蛋白与病毒运动有关,而与病毒复制无关。同时因为胞间连丝一般只能让小于1kD的分子通过,其通透范围远小于病毒颗粒,也小于折叠的病毒核酸分子,Wolf等实验证明正时因为30kD蛋白才使得植株分子半径扩散了三倍多。(4)免疫球蛋白:指具有抗体活性的动物蛋白。主要存在于血浆中,也见于其他体液、组织和一些分泌液中。脊椎动物的免疫系统能抵抗外来的入侵物质,如病毒、细菌以及其他机体的细胞,当外来的这些入侵物质(抗原)进入机体后就会激发机体的免疫系统而产生特异性的免疫球蛋白(抗体),通常每一种抗体对于相应的某一特定抗原具有高度的专一性,抗原与抗体结合形成抗原-抗体复合物.使入侵物质——抗原失活而排出体外,从而消除外来物质对机体的干扰。由此看来蛋白质不仅参与了高等动物的免疫反应,而且起着重要的作用,由于抗原和抗体结合的高度专一性,必然有数量众多的抗体作用于不同的抗原物质,据估计抗体的类型可能有10O万种,即免疫球蛋白可能有100万种之多。(5)毒蛋白:动物、植物和微生物都可以产生某些特殊的物质来防御敌害,这些物质中绝大多数是蛋白质类物质,由于它们对高等动物具有毒性,故称为毒蛋白。蝎类能产生毒性很强的蝎毒蛋白.用来攻击敌害,保护自己;蛇类产生的神经毒素和心赃毒素其主要成分也是小分子量的蛋白质;毒蘑菇中的相当一部分蘑菇毒素也是蛋白质;细菌产生的毒素,毒性极强的肉毒梭菌毒素(人的致死量小于19m)和破伤风痉挛毒素、白喉杆菌毒素等外毒素均是蛋白质。应用举例:王峰等人研究核糖体失活蛋白(RIPS)是一类能够抑制细胞核糖体合成蛋白质,从而导致宿主死亡的毒蛋白,广泛存在于植物、细菌中。发现其在在细胞内的转运途径研究很多,目前较为清楚的是逆向转运途径,其中以蓖麻毒素、志贺菌毒素、霍乱毒素为代表,大体过程为:内吞一内吞小体一高尔基体一内质网一胞液。(6)激素蛋白:是由特殊细胞所产生的一类物质,它们通过与靶细胞或系统内其它器官的相互作用来发挥其代谢上的功能,其实许多激素本身就是蛋白质,这样的蛋白质称为激素蛋白,它们在生物合成上具有重要的功能。如胰高血糖素、胰岛素、胃泌素、生长激素、促甲状腺激素、促肾上腺皮质激素和促脂解激素等均是蛋白
[b][font=宋体]整合蛋白和跨膜蛋白定义:[/font][/b][font=宋体] [/font][font=宋体]整合蛋白和跨膜蛋白是两类重要的蛋白质,它们在细胞分子水平上起着重要的作用。[/font][font=宋体] [/font][font=宋体]整合蛋白,也称为内在蛋白或跨膜蛋白,部分或全部镶嵌在细胞膜中或内外两侧,以非极性氨基酸与脂双分子层的非极性疏水区相互作用而结合在质膜上。它们是生物膜的基本结构成分,许多具重要生理功能的膜蛋白均属整合蛋白,如膜结合的酶类、载体蛋白、通道蛋白、膜受体等。[/font][font=宋体] [/font][font=宋体]跨膜蛋白,是可以跨越细胞膜的蛋白,它在细胞的信号传递系统中担当着重要的角色。跨膜蛋白在结构上可以分为单次跨膜、多次跨膜、多亚基跨膜等,它们具有能够跨越细胞膜的能力。[/font][font=宋体] [/font][b][font=宋体]整合蛋白和跨膜蛋白在位置、结构和功能上存在显著的差异[/font][/b][font=宋体] [/font][font=宋体]①位置:整合蛋白主要存在于细胞质内,细胞核或其他非细胞膜结构中,它们容易在细胞中自由移动。而跨膜蛋白则嵌入细胞膜中,一部分位于细胞膜的胞外侧,另一部分位于细胞膜的胞内侧,形成了一个穿过细胞膜的通道。[/font][font=宋体][font=宋体]②结构:整合蛋白的结构通常由两个独立的部分组成,一个是靠近细胞膜的膜结合区域([/font][font=Calibri]TM[/font][font=宋体]),另一个是靠近细胞骨架的非膜结合区域([/font][font=Calibri]N-TM[/font][font=宋体])。当接受到外界的信号时,整合蛋白的[/font][font=Calibri]TM[/font][font=宋体]区域会被激活,把来自外界的信号转化为细胞内可以识别的信号,直接参与细胞信号传导系统中。[/font][/font][font=宋体]③功能:整合蛋白主要是用来从外界传达信号到细胞内,充当细胞与外界信号的桥梁。而跨膜蛋白则在细胞的信号传递系统中担当着重要的角色。[/font][font=宋体]总的来说,整合蛋白和跨膜蛋白在位置、结构和功能上存在显著的差异,这些差异使得它们在生物体中扮演着不同的角色。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/resource/protein-review/transmembrane-proteins][b]跨膜蛋白表达与制备服务[/b][/url],制备流程图:基因合成[/font][font=宋体]→载体构建→细胞转化[/font][font=Calibri]/[/font][font=宋体]转染→蛋白表达→细胞收集→细胞破碎→膜脂提取→膜脂增溶→蛋白纯化→质量检测,同时义翘拥有[/font][/font][b][font=宋体]三大跨膜蛋白制备平台[/font][/b][font=宋体],可以为客户提供全面的多次跨膜蛋白产品和服务。同时,为基础研究和药物研发提供更加优质的原材料。[/font][font=宋体] [/font][b][font=宋体][font=Calibri]VLP[/font][font=宋体]技术平台[/font][/font][/b][font=宋体][font=宋体]正确折叠的膜蛋白在细胞膜上表达,类病毒颗粒[/font][font=Calibri]VLP[/font][font=宋体]通过出芽的方式包裹上携带有靶标蛋白的细胞膜,形成包膜的[/font][font=Calibri]VLP[/font][font=宋体]。它是由病毒的衣壳蛋白通过自组装而形成的纳米级颗粒(直径约[/font][font=Calibri]100[/font][font=宋体]~[/font][font=Calibri]300[/font][font=宋体]纳米),不含病毒核酸,不能进行自主复制,生产操作过程中较为安全。产生的[/font][font=Calibri]VLP[/font][font=宋体]蛋白可直接像可溶蛋白一样进行包被进行[/font][font=Calibri]ELISA[/font][font=宋体]检测。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州已成功开发[/font][font=Calibri]VLP[/font][font=宋体]技术平台,它可以将完整天然构象的膜蛋白展示在类病毒颗粒表面,这种方法不仅可以保留膜蛋白的完整结构,同时也能够真实地模拟其在细胞膜上的位置和构象。[/font][/font][font=宋体] [/font][b][font=宋体]去垢剂技术平台[/font][/b][font=宋体][font=宋体]由于存在疏水结构域,跨膜蛋白与膜的结合非常紧密,需要用去垢剂([/font][font=Calibri]detergent[/font][font=宋体])才能从膜上洗涤下来,[/font][font=Calibri]Detergent[/font][font=宋体]作为一种两亲性分子,疏水尾部包裹目的蛋白的疏水区域,亲水头部位于与溶液接触的界面。微团的形成是膜蛋白增溶的基础,当去垢剂浓度高于[/font][font=Calibri]CMC[/font][font=宋体]([/font][font=Calibri]Critical micelle concentration[/font][font=宋体],临界胶束浓度)时会形成微团,增溶后,去垢剂将蛋白周围的磷脂置换,从而实现收集目标膜蛋白的目的,后续再进行蛋白纯化,最终蛋白呈现在含有[/font][font=Calibri]Detergent[/font][font=宋体]的溶液中。义翘神州成功搭建了去垢剂技术平台,利用该平台可有效提高跨膜蛋白的产量和纯度。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]Nanodisc[/font][font=宋体]技术平台[/font][/font][/b][font=宋体][font=Calibri]Nanodisc[/font][font=宋体]结构稳定,与天然的生物膜非常相似,使得[/font][font=Calibri]Nanodisc[/font][font=宋体]能够很好地应用于膜蛋白的研究。目前[/font][font=Calibri]Nanodisc[/font][font=宋体]平台有[/font][font=Calibri]2[/font][font=宋体]种方式,一种是基于苯乙烯马来酸酐共聚物([/font][font=Calibri]SMA[/font][font=宋体])组装的[/font][font=Calibri]SMA-Nanodisc[/font][font=宋体]平台,如下图(左)所示,它可以直接从细胞膜上提取膜蛋白,使其变为可溶性蛋白,组装完成的蛋白样品很稳定,更能维持蛋白的天然构象。另一种是基于膜骨架蛋白([/font][font=Calibri]MSP[/font][font=宋体])的[/font][font=Calibri]MSP-Nanodisc[/font][font=宋体]平台(下图右),它需要先将膜蛋白利用去垢剂制备出来,然后再加入磷脂分子和[/font][font=Calibri]MSP[/font][font=宋体]进行组装。通过调整磷脂、[/font][font=Calibri]MSP[/font][font=宋体]和待组装膜蛋白三者的比例,可以使得待组装膜蛋白在[/font][font=Calibri]Nanodisc[/font][font=宋体]中呈不同聚集状态。义翘神州已成功搭建了[/font][font=Calibri]Nanodisc[/font][font=宋体]技术平台,利用跨膜蛋白与磷脂结合能够维持其良好活性的特性,制备出稳定的产品,满足动物免疫、抗体筛选、[/font][font=Calibri]cell-based assays[/font][font=宋体]等场景。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/transmembrane-proteins[/font][/font]
朊蛋白与免疫系统相互作用的新发现http://www.bioon.com/biology/UploadFiles/201112/2011123113381385.jpg 12月29日,据《每日科学》报道,痒病是一种神经退行性疾病,它可以作为其他由蛋白积累致组织畸形(蛋白质病)疾病的模型,如阿尔兹海默氏病和帕金森氏病。有关这些基因的许多问题仍然悬而未决。在一个新的博士论文研究中,发现了数个与阮蛋白(PrPSc,与疾病的发展有关)摄取相关的因子以及朊蛋白是如何与肠道内的免疫细胞相互作用。 羊瘙痒病属于一组被称为"传染性海绵状脑病(TSE)"的疾病,因为它们可以在动物个体之间传播,并导致大脑产生海绵状、退行性改变。这些疾病不仅折磨羊,还折磨牛(牛海绵状脑病,又称疯牛病,BSE)、鹿(鹿慢性消耗性疾病,又称疯鹿病,CWD)以及人类(克雅氏病CJD)。它们在一定程度上也可以在物种见传播,在20世纪90年代,超过200人经由食物感染而患上了克雅氏病。 传染性海绵状脑病(TSE),或者称阮病毒疾病,被认为是感染了一种能致病的蛋白质变体--朊蛋白,它是机体细胞的正常组成部分,在脑中含量最为丰富。一般而言,阮病毒疾病可能是传染的、遗传的或偶发/自发的。当正常的朊蛋白突变成致病的变种,疾病便发生了,变种朊蛋白在空间结构上与健康的朊蛋白不同。由于变种的朊蛋白具有不同的空间结构,机体细胞很难降解它,因此它就一直在积累。 因为朊蛋白(PrPSc)是在疾病早期在肠道系统的淋巴组织中被发现,推测它是经由肠胃道传染。在兽医学家Caroline Piercey Akesson博士研究杂交仪期间,研究了朊蛋白在肠道内的吸收,从而对疾病发展的早期阶段所发生的过程有了新的了解。与早先的推测相反,她通过免疫电镜证明阮蛋白不是直接从肠道转运到肠道相关的的淋巴组织。相反,她发现朊蛋白自由地穿过或穿进肠道淋巴组织之外的淋巴细胞。 树突状细胞据推测发挥着"看门人"的作用,它决定机体能容忍什么以及当面对外来物时该策划哪一种免疫防御反应。Akeeson的目标之一就是树突细胞与朊蛋白摄取之间的相互作用。首先,需要了解正常的羊肠道内树突状细胞的特点;其次,去调查哪一类型的细胞与阮病毒的摄取有关。 她的研究结果表明,不是树突状细胞,而是巨噬细胞负责朊蛋白的摄取。Akesson的研究揭示,朊蛋白利用了肠道中大分子物质摄取的正常生理通道,这可能对机体的免疫监视系统有显著影响。一个可能的后果就是免疫耐受被激活,从而阻碍了肠道对所吸收的朊蛋白的正常免疫反应。 今后的研究能够揭示免疫细胞是如何运输朊蛋白及机体是如何处理朊蛋白,这将具有非常重要的意义,不仅是为了提供更多的关于痒病的知识,还为研究人类和其他动物中神经退行性蛋白质病提供重要见解。 Caroline Piercey Akesson于12月20日在挪威兽医科学系进行了博士论文答辩,论文的题目是:研究阮病毒的摄取及其与羊肠道中免疫细胞的早期相互作用。
[font=宋体]跨膜蛋白是生物体内广泛存在的一类蛋白质,它们在细胞膜上以不同的方式与其相互作用,从而发挥各种生物学功能。根据不同的结构和功能,[/font][b][font=宋体]跨膜蛋白可以分为三种类型:通道型跨膜蛋白、受体型跨膜蛋白和泵型跨膜蛋白。[/font][/b][font=宋体] [/font][font=宋体][font=宋体]通道型跨膜蛋白是跨膜蛋白中最为简单的类型,它们主要的功能是在细胞膜上形成一些具有选择性通透性的孔道,使得离子和小分子物质能够通过。通道型跨膜蛋白具有多个跨膜域,通常由[/font] [font=宋体]α 螺旋和 β 折叠两种二级结构组成。α 螺旋通道如 [/font][font=Calibri]K+ [/font][font=宋体]通道能够容纳阳离子,β 折叠如离子泵[/font][font=Calibri]Na+/K+-ATPase [/font][font=宋体]能够承载各种离子。[/font][/font][font=宋体] [/font][font=宋体]受体型跨膜蛋白是一类比较复杂的蛋白质,它们能够接受信号分子的结合,从而调节细胞内的生物学路径。受体型跨膜蛋白通常由单个跨膜域和两个不同构的端基组成,其中一个端基是细胞外的受体结构域,能够特异性地与信号分子结合;另外一个端基是细胞内的调节结构域,能够将受体活性传递到细胞内部。受体型跨膜蛋白具有多种作用方式,如酪氨酸激酶受体,转录因子受体等。[/font][font=宋体] [/font][font=宋体][font=宋体]泵型跨膜蛋白是一类能够通过能量输入来驱动物质运输的蛋白质。它们能够将离子或者小分子物质从低浓度区域转运到高浓度区域,从而维持细胞内的化学平衡和稳态。泵型跨膜蛋白一般由多个跨膜域组成,并能借助外源性能量如[/font][font=Calibri]ATP[/font][font=宋体]进行运输。常见的泵型跨膜蛋白有[/font][font=Calibri]Na+/K+-ATPase, H+/K+-ATPase[/font][font=宋体]等。[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州提供跨膜蛋白制备平台,包括:[/font][font=Calibri]VLP[/font][font=宋体]技术平台[/font][font=Calibri]/[/font][font=宋体]去垢剂技术平台[/font][font=Calibri]/Nanodisc[/font][font=宋体]技术平台。[/font][/font][font=宋体][font=Calibri]VLP[/font][font=宋体]技术平台[/font][/font][/b][font=宋体][font=宋体]正确折叠的膜蛋白在细胞膜上表达,类病毒颗粒[/font][font=Calibri]VLP[/font][font=宋体]通过出芽的方式包裹上携带有靶标蛋白的细胞膜,形成包膜的[/font][font=Calibri]VLP[/font][font=宋体]。它是由病毒的衣壳蛋白通过自组装而形成的纳米级颗粒(直径约[/font][font=Calibri]100[/font][font=宋体]~[/font][font=Calibri]300[/font][font=宋体]纳米),不含病毒核酸,不能进行自主复制,生产操作过程中较为安全。产生的[/font][font=Calibri]VLP[/font][font=宋体]蛋白可直接像可溶蛋白一样进行包被进行[/font][font=Calibri]ELISA[/font][font=宋体]检测。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州已成功开发[/font][font=Calibri]VLP[/font][font=宋体]技术平台,它可以将完整天然构象的膜蛋白展示在类病毒颗粒表面,这种方法不仅可以保留膜蛋白的完整结构,同时也能够真实地模拟其在细胞膜上的位置和构象。[/font][/font][font=宋体][font=宋体]利用[/font][font=Calibri]VLP[/font][font=宋体]平台制备跨膜蛋白具有以下优势:[/font][/font][font=宋体]? 全长跨膜蛋白,保持完整的天然构象[/font][font=宋体][font=宋体]? 适用于动物免疫、[/font][font=Calibri]ELISA[/font][font=宋体]检测、[/font][font=Calibri]CAR[/font][font=宋体]阳性率检测、抗体筛选等。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州搭建了基于[/font][font=Calibri]HEK293[/font][font=宋体]表达系统的[/font][font=Calibri]VLP[/font][font=宋体]([/font][font=Calibri]virus-like particle[/font][font=宋体])技术平台,能够将目的膜蛋白完整展示在[/font][font=Calibri]VLP[/font][font=宋体]表面,使其能够像普通蛋白一样进行检测,义翘神州目前可以为客户提供膜蛋白定制服务,助力药物研发进程。[/font][/font][font=宋体] [/font][b][font=宋体]去垢剂技术平台[/font][/b][font=宋体][font=宋体]由于存在疏水结构域,跨膜蛋白与膜的结合非常紧密,需要用去垢剂([/font][font=Calibri]detergent[/font][font=宋体])才能从膜上洗涤下来,[/font][font=Calibri]Detergent[/font][font=宋体]作为一种两亲性分子,疏水尾部包裹目的蛋白的疏水区域,亲水头部位于与溶液接触的界面。微团的形成是膜蛋白增溶的基础,当去垢剂浓度高于[/font][font=Calibri]CMC[/font][font=宋体]([/font][font=Calibri]Critical micelle concentration[/font][font=宋体],临界胶束浓度)时会形成微团,增溶后,去垢剂将蛋白周围的磷脂置换,从而实现收集目标膜蛋白的目的,后续再进行蛋白纯化,最终蛋白呈现在含有[/font][font=Calibri]Detergent[/font][font=宋体]的溶液中。义翘神州成功搭建了去垢剂技术平台,利用该平台可有效提高跨膜蛋白的产量和纯度。[/font][/font][font=宋体]去垢剂技术平台的优势:[/font][font=宋体]? 可精确定量[/font][font=宋体]? 胶束为膜蛋白疏水基团提供保护并稳定构象[/font][font=宋体][font=宋体]? 适用于动物免疫、[/font][font=Calibri]ELISA[/font][font=宋体]检测、[/font][font=Calibri]SPR/BLI[/font][font=宋体]检测等[/font][/font][b][font=宋体] [/font][font=宋体][font=Calibri]Nanodisc[/font][font=宋体]技术平台[/font][/font][/b][font=宋体][font=Calibri]Nanodisc[/font][font=宋体]结构稳定,与天然的生物膜非常相似,使得[/font][font=Calibri]Nanodisc[/font][font=宋体]能够很好地应用于膜蛋白的研究。目前[/font][font=Calibri]Nanodisc[/font][font=宋体]平台有[/font][font=Calibri]2[/font][font=宋体]种方式,一种是基于苯乙烯马来酸酐共聚物([/font][font=Calibri]SMA[/font][font=宋体])组装的[/font][font=Calibri]SMA-Nanodisc[/font][font=宋体]平台,如下图(左)所示,它可以直接从细胞膜上提取膜蛋白,使其变为可溶性蛋白,组装完成的蛋白样品很稳定,更能维持蛋白的天然构象。另一种是基于膜骨架蛋白([/font][font=Calibri]MSP[/font][font=宋体])的[/font][font=Calibri]MSP-Nanodisc[/font][font=宋体]平台(下图右),它需要先将膜蛋白利用去垢剂制备出来,然后再加入磷脂分子和[/font][font=Calibri]MSP[/font][font=宋体]进行组装。通过调整磷脂、[/font][font=Calibri]MSP[/font][font=宋体]和待组装膜蛋白三者的比例,可以使得待组装膜蛋白在[/font][font=Calibri]Nanodisc[/font][font=宋体]中呈不同聚集状态。义翘神州已成功搭建了[/font][font=Calibri]Nanodisc[/font][font=宋体]技术平台,利用跨膜蛋白与磷脂结合能够维持其良好活性的特性,制备出稳定的产品,满足动物免疫、抗体筛选、[/font][font=Calibri]cell-based assays[/font][font=宋体]等场景。[/font][/font][font=宋体][font=Calibri]SMA-Nanodisc[/font][font=宋体]技术平台的优势:[/font][/font][font=宋体]? 可精确定量[/font][font=宋体][font=宋体]? [/font][font=Calibri]SMA[/font][font=宋体]共聚物包裹的膜蛋白稳定性更好,有助于更好地研究膜蛋白的结构和功能[/font][/font][font=宋体][font=宋体]? 适用于动物免疫、[/font][font=Calibri]ELISA[/font][font=宋体]检测、[/font][font=Calibri]SPR/BLI[/font][font=宋体]检测、[/font][font=Calibri]CAR[/font][font=宋体]阳性率检测及细胞实验等[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多[url=https://cn.sinobiological.com/resource/protein-review/transmembrane-proteins][b]跨膜蛋白[/b][/url]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/transmembrane-proteins[/font][/font][font=Calibri] [/font]
如果说一个人一次献血200ml,一亩转基因水稻产出的血清白蛋白量约等于300人献的血——转基因水稻胚乳可提取血清白蛋白——转基因水稻胚乳可提取血清白蛋白2012年09月01日 来源: 中国科技网 关注转基因 白蛋白供应紧张一直困扰着人类。我国每年需求150—160吨,全球每年需求量则高达500吨,由于血浆来源紧张,我国目前从血浆中提取量仅可供应1/3,其中2/3依赖进口。 2011年10月31日,武汉大学生命科学学院教授杨代常撰写的论文《利用转基因水稻规模化生产重组人血清白蛋白》在《美国科学院院报》发表,吸引了世界的目光。 文章用翔实的科学数据证明,植物来源的重组人血清白蛋白与临床使用的血浆来源血清白蛋白,无论是在生理生化性质,还是功能用途等方面,都具有高度的等同性。 为何这项研究引发种种关注?稻米血清白蛋白是否会危及生态及人身安全?其何时能用于临床治疗?……带着这些问题,记者采访了杨代常和他的团队。 “借腹生子”:从水稻胚乳中提取血清白蛋白 植物种子生物反应器,是将植物种子作为一个蛋白质“生产车间”,利用植物作为合成蛋白质的“机器”来合成人类所需的蛋白质。“通俗地解释,便是‘借腹生子’。”杨代常说。 国外从1989年已开始利用DNA重组技术生产血清白蛋白,但由于血清白蛋白产量低、纯化工艺复杂、生产成本远高于市场成本,始终无法进入市场。 杨代常带领研究团队,从水稻基因组数据入手,根据水稻种子储藏蛋白与血清白蛋白的生化性质差异,设计出从提取到纯化的一整套工艺方案,最大限度地提取血清白蛋白,最低限度去除种子的内源蛋白,成为一项原始创新的科研成果。 “具体来说,是由表达元件组成的载体,通过遗传工程整合到水稻基因组内,在种子特异性调控元件的指导下,水稻种子在成熟过程中也不断地合成和积累人血清白蛋白,然后通过规模化种植获得原料,再经过提取、纯化等步骤获得高纯度的血清白蛋白。”杨代常介绍,目前大约每亩水稻可以产生1.5—2公斤血清白蛋白,如果说一个人一次能献血200ml,一亩转基因水稻产出的血清白蛋白量约等于300人献血。 “天然屏蔽”:可杜绝肝炎、艾滋病毒等风险 植物源重组血清白蛋白优势明显,它来源于非动物,避免了各种病毒和病原菌的污染,并由于不受血浆供应限制,可无限量供应。但是转基因农业作物安全性向来争议不断,植物源血清白蛋白有望未来直接应用于人体中,有人担心会危及生态及人身安全。 对此,杨代常解释,首先,就人血清白蛋白本身安全性而言,血清白蛋白本就是人体的蛋白质,占血浆中蛋白的30%,是一种安全的蛋白质。目前,根据获取的数据,植物来源的人血清白蛋白从生物活性、分子结构和理化性质与血浆来源的人血清白蛋白完全一致,从水稻胚乳中提取的血清白蛋白可杜绝携带如肝炎病毒、艾滋病毒等风险。研究发现,人体对植物蛋白的耐受能力大于对细菌和酵母的耐受能力。从安全性考虑,已建立高纯度符合医药级别纯度的血清白蛋白。其次,就转基因生物安全而言,由于采取地理和时间双重隔离方法,要求比美国更为严格。第三,为杜绝进入食物链,在研究中采取了专用收割机、烘干机、稻米加工设备以及专用仓库等措施,建立了严格的监管规范,能做到可管可控和可追溯。 未来预期:进入临床需4至5年 从2005年始,杨代常自主研发的水稻胚乳细胞蛋白质高效表达技术平台,填补了国际上此项技术规模化生产的空白,已获美、日、欧盟以及我国的多项专利。 杨代常说,目前,植物源重组血清白蛋白的质量已达到非临床应用标准,可替代血源人血白蛋白用于细胞培养基添加剂,成为细胞培养中血浆来源的血清白蛋白的替代品;可减少培养基中胎牛血清的使用量;还可用于高纯试剂、细胞冷冻保护剂、医疗器械包埋剂、药物载体、化妆品组分、体外诊断等。 国外已在疫苗及生物医药产品的细胞培养的稳定剂上使用。我国按照国家药监局的要求,要通过临床研究后才能进入临床应用。 通过治疗大鼠肝硬化腹水对比,进行植物源重组血清白蛋白的药效研究,发现大鼠肝硬化腹水的治疗效果在降低腹围、增加尿量和尿蛋白量等指标优于血浆来源的血清白蛋白。 “植物源重组血清白蛋白正在进行临床前研究,已完成大部分的药学研究,预计在2013年上半年可望完成临床前研究;预计进入临床研究至少需要2年时间,进入临床应用至少需要4—5年或更长的时间,这取决于临床研究的结果与进度以及国家的法规。”杨代常说。 从实验室走向产业化 去年年初,杨代常带着多年的研发成果,入驻武汉东湖国家自主创新示范区光谷生物城,一年内实现了项目产业化。 “这一过程我们走得很艰难。”杨代常说,为了让投资者更有信心,他在商业模式上从长中短期产品计划入手,将技术做好做精。在科技部转基因重大专项、国家863计划和武汉东湖国家自主创新示范区光谷生物城的支持下,加速了项目产业化进程。 “我国生物产业要走在世界前列,在心理上要打破‘奴性’思维,在政策上要突破传统观念,要敢做别人不能做或不敢做的事情。”杨代常说,“现在一谈到转基因,很多人就‘谈虎色变’。实际上,理解上存在很多误区。转基因技术是通过遗传工程的手段,将人类需要的基因(一段DNA片段)导入到植物或任何一种生物的一项高科技技术,是人类由必然王国走向自由王国的必由之路。” 近日,杨代常的科研团队又传出喜讯,在水稻中“种”出了“人抗胰蛋白酶”。目前,重组抗胰蛋白酶与重组血清白蛋白一样,有效地避免人血液中病毒病原菌感染的风险,但需要进行一系列的免疫原性、急性、毒性等相关实验和临床研究后,方能应用于临床。 杨代常透露,未来,其团队研发重心将着重原创性技术研究,建立单克隆抗体的表达平台,使我国的单克隆抗体药物的价格降到5万元左右,重组血清白蛋白进入临床应用。(记者 马爱平) 《科技日报》(2012-09-01 三版)
[b][font=宋体][font=宋体]什么是重组蛋白疫苗[/font][font=Calibri]? [/font][/font][/b][font=宋体]即将某种病毒的目的抗原基因构建在表达载体上,将已构建的表达蛋白载体转化到细菌、酵母或哺乳动物或昆虫细胞中,在一定的诱导条件下,表达出大量的抗原蛋白,通过纯化后制备的疫苗。[/font][font=宋体] [/font][b][/b][font=宋体][font=宋体][b]重组蛋白疫苗的基本原理[/b]是将病毒表面的刺突蛋白或受体结合区([/font][font=Calibri]Receptor binding domain, RBD[/font][font=宋体])的一部分,与宿主细胞结合制成疫苗。通过结合重组蛋白和多种免疫素来增强免疫应答,促进抗体产生,从而诱导免疫系统产生高强度的识别位点,使人体具备更好的免疫抵抗力,并可迅速减轻症状,有效地预防和治疗传染病。[/font][/font][font=宋体] [/font][b][font=宋体]重组蛋白疫苗优势:[/font][/b][font=宋体]①不养活病毒,无需担心病毒外泄,对生产车间的生物安全等级要求低;[/font][font=宋体][font=宋体]②利用转基因技术生产病毒[/font][font=Calibri]S[/font][font=宋体]蛋白上的[/font][font=Calibri]RBD[/font][font=宋体]蛋白,能实现高产量、高纯度、低成本;[/font][/font][font=宋体][font=宋体]③重组蛋白疫苗只含[/font][font=Calibri]RBD[/font][font=宋体]蛋白,纯度高,安全性更好。[/font][/font][b][font=宋体] [/font][font=宋体]重组蛋白疫苗缺点:[/font][/b][font=宋体]①免疫原性较差:相比于一些其他类型的疫苗,重组蛋白疫苗的免疫原性可能较差。这意味着需要使用较高剂量的疫苗才能激发免疫反应,从而增加疫苗的成本和副作用的发生率。[/font][font=宋体]②需要辅助免疫刺激剂:重组蛋白疫苗通常需要添加辅助免疫刺激剂,如佐剂或载体,以增强免疫原性和免疫反应。这些辅助免疫刺激剂可能会增加疫苗的副作用和成本,并且有时可能会引起过敏反应。[/font][font=宋体]③需要多次接种:相对于一些其他类型的疫苗,重组蛋白疫苗需要进行多次接种,以达到充分的免疫效果。这可能会增加接种的难度和成本,并且需要较长时间才能建立起有效的免疫保护。[/font][font=宋体]④局部和全身反应:虽然重组蛋白疫苗的安全性较高,但含有佐剂的疫苗可能引起更多局部反应,如注射部位发红、肿胀,以及更多全身反应,如发热、寒战和身体疼痛。[/font][font=宋体] [/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/protein-production][b]重组蛋白生产[/b][/url]详情可参看:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font][b][font=宋体] [/font][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=宋体] [/font]
北京易斯威特生物医学科技有限公司产品介绍 铁蛋白(FER)检测试剂盒 (胶体金法)1.国内第一家免疫层析法检测FER的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的铁蛋白,适用于急性贫血,肝脏损伤等相关疾病的辅助诊断3.最快速准确的辅助诊断方法。4.血清铁蛋白是血液去铁蛋白和铁核心Fe3+形成的复合物。是检查体内铁缺乏的最灵敏的指标。血清铁蛋白测定在临床上常用于缺铁性贫血的诊断。简单 便捷 快速 灵敏 环保 肌红蛋白/肌酸激酶/心肌肌钙蛋白I,心梗三项检测试剂盒(胶体金法)1.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的肌红蛋白,肌酸激酶,心肌肌钙蛋白I检测,用于临床快速诊断急性心肌梗塞(AMI).2.最快速准确的辅助诊断方法。3.肌红蛋白:是心肌梗死的标志物,增高表示冠状动脉堵塞引起心肌严重缺血造成心肌梗死;4.肌钙蛋白:是一种心肌蛋白,升高见于心肌损伤,多见于心肌梗死,也见于心肌炎和心肺复苏后患者,特异性较高,阳性的话一般可确诊心肌损伤,阴性的话不能排除,因为肌钙蛋白的升高出现在心肌梗塞3-6小时之后,之前可能出现阴性。肌酸激酶敏感性较高,特异性较低,升高也出现在心梗3-8小时之后。5.肌酸激酶:主要存在于骨骼肌和心肌,在脑组织中也存在,是参与体内的能量代谢的一种酶。在临床上主要用于诊断心肌梗塞。心肌梗塞患者发病后2-4小时,血液中此酶活动即开始升高。比血清中谷草转酸酶和乳酸脱氢酶的活力变化都出现得早。 简单 便捷 快速 灵敏 环保 C反应蛋白(CRP)检测试剂盒(胶体金法)1.国内第一家免疫层析法检测CRP的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的C反应蛋白,适用于感染,炎性疾病,组织损伤,手术创伤及组织坏死等病变情况的辅助诊断3.最快速准确的辅助诊断方法。4.是一种能与肺炎球菌C多糖体反应形成复合物的急性时相反应蛋白。可用于细菌和病毒感染的鉴别诊断简单 便捷 快速 灵敏 环保
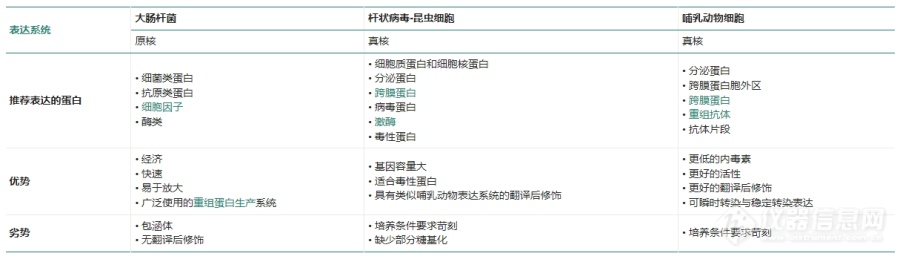
[font=宋体]蛋白表达系统指宿主、外源基因、载体和辅助成分组成的体系,通过这个体系可以实现外源基因顺利的实现在宿主中表达。[b]蛋白表达体系通常由以下几部分组成:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]宿主:用来表达的生物体,可以为细菌(大肠杆菌、枯草芽孢杆菌)、酵母、植物细胞、动物细胞等。由于各种宿主生物本身的特性多种多样,因此采用的表达体系也不相同[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]载体:载体的选择需要根据宿主而定,根据宿主不同,分为原核(大肠杆菌、枯草芽孢杆菌)表达载体、酵母表达载体、植物表达载体、哺乳动物表达载体、昆虫表达载体等。载体中还有外源基因片段,外源基因通过载体介导,可以在宿主中表达。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]辅助成分:有的表达系统中还包括了协助载体进入宿主的辅助成分,比如:昆虫[/font][font=Calibri]-[/font][font=宋体]杆状病毒表达系统中的杆状病毒。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]重组蛋白表达的三个主要系统是细菌表达系统(例如乳酸乳球菌和大肠杆菌)、酵母和杆状病毒以及哺乳动物细胞介导的蛋白表达。[/font] [/font][font=宋体] [/font][b][font=宋体]应用:[/font][/b][font=宋体] [/font][font=宋体]表达后的蛋白常应用于:[/font][font=宋体][font=Calibri]1[/font][font=宋体])作为抗原制备抗体;[/font][/font][font=宋体][font=Calibri]2[/font][font=宋体])参与细胞实验与动物实验;[/font][/font][font=宋体][font=Calibri]3[/font][font=宋体])测定蛋白酶活;[/font][/font][font=宋体][font=Calibri]4[/font][font=宋体])研究蛋白相互作用;[/font][/font][font=宋体][font=Calibri]5[/font][font=宋体])研究蛋白结晶结构;[/font][/font][font=宋体][font=Calibri]6[/font][font=宋体])免疫组化实验;[/font][/font][font=宋体][font=Calibri]7[/font][font=宋体])药物蛋白研究、生产等。[/font][/font][font=宋体] [/font][b][font=宋体]影响蛋白表达的因素有:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]蛋白本身的特性:蛋白分子量大小、蛋白来源[/font][font=Calibri]/[/font][font=宋体]物种、是否为毒性蛋白,蛋白翻译后修饰程度、蛋白自身结构的复杂程度[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]宿主的选择:宿主本身的特性、蛋白表达需求等都影响着蛋白表达[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]蛋白需求量:蛋白应用范围对应的需求量不同,所以要根据需求量确定表达系统[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]质粒载体的选择:载体是携带外源基因的工具,要根据系统选择合适的载体才能使蛋白更好的表达[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5.[/font][font=宋体]融合标签的选择:蛋白重组表达过程中采用亲和标签融合表达有两方面的作用:一方面是为了使蛋白纯化过程变得更加容易;另一方面是为了促进某些不溶性蛋白可溶[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6.[/font][font=宋体]蛋白表达系统的优化:重组蛋白的表达往往不像理论那样一帆风顺,在实际的表达过程中有可能产生各种各样的问题,因此表达系统的优化很重要。[/font][/font][font=宋体] [/font][b][font=宋体]如何选择合适的表达系统[/font][/b][font=宋体]没有一个表达系统是完美的,要针对每个重组蛋白来评估哪种系统最有效。每个蛋白表达系统的生产速度、成本、糖基化和折叠等特性都各不相同,且跨度很大。如下图:[/font][font=宋体] [/font][font=宋体][font=宋体]更多详情可以关注:义翘神州[url=https://cn.sinobiological.com/resource/protein-review/protein-production-systems][b]蛋白表达系统[/b][/url][/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production-systems[/font][/font]
perforin免疫蛋白的功能及微孔的形成 能够形成微孔的免疫蛋白“perforin”是消除被病毒感染的细胞及癌变细胞所必需的,由自然杀手及细胞毒性T-细胞释放。现在,一种“perforin”单聚物(小鼠perforin R213E)的结构已被确定。对该结构所做分析同时结合对低聚孔的一个冷电子显微镜重建结果表明,这个孔内的“perforin”单聚物与依赖于胆固醇的溶细胞素在结构上同源的单聚物相比采用一种“内面向外”的取向。这种新颖的适应性也许可解释“perforin”是怎样将支持细胞凋亡的蛋白酶(granzymes)送入目标细胞中的以及相关的互补免疫蛋白是怎样组装成微孔的。
[font=宋体][b]什么是重组蛋白?[/b][/font][font=宋体] [/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/protein-production][b]重组蛋白[/b][/url]的产生是应用了重组[/font][font=Calibri]DNA[/font][font=宋体]或重组[/font][font=Calibri]RNA[/font][font=宋体]的技术从而获得的蛋白质。体外重组蛋白的生产主要包括四大系统:原核蛋白表达,哺乳动物细胞蛋白表达,酵母蛋白表达及昆虫细胞蛋白表达。生产的蛋白在活性和应用方法方面均有所不同。根据自身的下游运用选择合适的蛋白表达系统,提高表达成功率。[/font][/font][font=宋体] [/font][font=宋体][b]融合蛋白和重组蛋白的区别[/b][/font][font=宋体][font=Calibri]1[/font][font=宋体]、重组蛋白[/font][/font][font=宋体]重组蛋白是指应用基因重组技术,获得连接有可以翻译成目的蛋白的基因片段的重组载体,之后将其转入可以表达目的蛋白的宿主细胞从而表达特定的重组蛋白分子。融合蛋白表达只是重组蛋白表达的一种策略,融合表达是一种方法。因为融合表达具有表达效率高、产物稳定而且水溶性好、易于鉴定和纯化等优点,现已被广泛采用。[/font][font=宋体][font=Calibri]2. [/font][font=宋体]融合蛋白[/font][/font][font=宋体][font=宋体]融合蛋白是指通过重组[/font][font=Calibri]DNA[/font][font=宋体]技术将你要表达的目的蛋白基因同表达载体上融合蛋白基因相连,这样表达出的蛋白质就会是同时具有目的基因蛋白和融合基因蛋白两个部分的重组蛋白。[/font][/font][font=宋体][font=宋体]融合蛋白与重组蛋白不是一个层次上对立的概念,融合蛋白表达只是重组蛋白表达的一种策略,融合表达是一种方法。因为融合表达具有表达效率高、产物稳定而且水溶性好、易于鉴定和纯化等优点,现已被广泛采用。融合蛋白又称标签([/font][font=Calibri]Tag[/font][font=宋体]),常用的[/font][font=Calibri]His[/font][font=宋体]、[/font][font=Calibri]GST[/font][font=宋体]等。[/font][/font][font=宋体] [/font][font=宋体]总结:在生物制药领域,重组蛋白具有较高的活性和纯度,更易吸收,安全性也更高的特点。重组蛋白的利用率也更高。[/font][font=宋体] [/font][font=宋体]为了生产重组蛋白,基因被分离并克隆到表达载体中。重组蛋白的生产需要蛋白表达系统、蛋白纯化系统和蛋白识别系统。[/font][font=宋体] [/font][font=宋体][b]获取重组蛋白的基本步骤:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]目标基因的扩增。[/font][/font][font=宋体][font=Calibri]2.[/font][font=宋体]插入克隆载体。[/font][/font][font=宋体][font=Calibri]3.[/font][font=宋体]亚克隆到表达载体中。[/font][/font][font=宋体][font=Calibri]4.[/font][font=宋体]转化到蛋白表达宿主中[/font][font=Calibri]([/font][font=宋体]细菌[/font][font=Calibri]([/font][font=宋体]大肠杆菌[/font][font=Calibri])[/font][font=宋体]、酵母细胞、哺乳动物细胞或杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞系统[/font][font=Calibri])[/font][font=宋体]。[/font][/font][font=宋体][font=Calibri]5.[/font][font=宋体]重组蛋白鉴定试验[/font][font=Calibri](Western blot[/font][font=宋体]或荧光[/font][font=Calibri])[/font][/font][font=宋体][font=Calibri]6.[/font][font=宋体]大规模生产。[/font][font=Calibri]([/font][font=宋体]大规模发酵[/font][font=Calibri])[/font][/font][font=宋体][font=Calibri]7.[/font][font=宋体]分离和纯化。[/font][/font][font=宋体] [/font][font=宋体]需要考虑多种因素:[/font][font=宋体][font=Calibri]1.[/font][font=宋体]选择哪个宿主系统?[/font][/font][font=宋体][font=Calibri]2.[/font][font=宋体]如何分离和纯化重组蛋白?[/font][/font][font=宋体] [/font][font=宋体]选择适当的表达宿主或使用正确的纯化方法并不容易,应考虑目标重组蛋白的性质。下面列出了一些重要因素:[/font][font=宋体] [/font][font=宋体]? 膜结合[/font][font=宋体]? 溶解度[/font][font=宋体]? 单或多结构域[/font][font=宋体][font=宋体]? 大小[/font][font=Calibri]([/font][font=宋体]分子量[/font][font=Calibri])[/font][/font][font=宋体]? 表达位置[/font][font=宋体] [/font][font=宋体][font=宋体]对于大多数没有足够经验来表达和分离重组蛋白的人来说,重组蛋白的生产是非常耗时的。许多生物公司为各种不同规模的重组蛋白表达提供良好的服务,例如义翘神州[/font][font=Calibri]([/font][font=宋体]参考重组蛋白生产的详细服务清单)[/font][/font][font=宋体] [/font][font=宋体]义翘神州提供重组蛋白和[url=https://cn.sinobiological.com/resource/protein-review/fusion-protein][b]融合蛋白[/b][/url]等相关信息,详情可以关注[/font][font=宋体][font=宋体]融合蛋白:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/fusion-protein[/font][/font][font=宋体] [/font][font=宋体][font=宋体]重组蛋白生产:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font]
[font=宋体]抗体,作为一类特殊的蛋白质,在免疫系统中发挥着至关重要的作用,它们能够特异性地识别并中和外来病原体,如细菌和病毒。而蛋白质,作为生命活动的基础分子,具有多种多样的功能,从酶催化到结构支撑,无所不包。抗体与蛋白的区别在于,抗体是一类具有特定功能的蛋白质,而蛋白质则是更广泛的一类生物分子。本文将深入探讨抗体与蛋白的具体区别,并详细解析抗体蛋白的结构与功能,为读者提供一个全面而深入的理解。[/font][font=宋体] [/font][b][font=宋体]抗体与蛋白的区别?[/font][/b][font=宋体] [/font][font=宋体]定义:[/font][font=宋体][font=宋体]抗体([/font][font=Calibri]antibody[/font][font=宋体])是指机体由于抗原的刺激而产生的具有保护作用的蛋白质。它(免疫球蛋白不仅仅只是抗体)是一种由浆细胞(效应[/font][font=Calibri]B[/font][font=宋体]细胞)分泌,被免疫系统用来鉴别与中和外来物质如细菌、病毒等的大型[/font][font=Calibri]Y[/font][font=宋体]形蛋白质,仅被发现存在于脊椎动物的血液等体液中,及其[/font][font=Calibri]B[/font][font=宋体]细胞的细胞膜表面。抗体能识别特定外来物的一个独特特征,该外来目标被称为抗原。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]抗体是一类能与抗原特异性结合的免疫球蛋白。抗体按其反应形式分为凝集素、沉降素、抗毒素、溶解素、调理素、中和抗体、补体结合抗体等。按抗体产生的来源分为正常抗体(天然抗体),如血型[/font][font=Calibri]ABO[/font][font=宋体]型中的抗[/font][font=Calibri]A[/font][font=宋体]和抗[/font][font=Calibri]B[/font][font=宋体]的抗体,和免疫抗体如抗微生物的抗体。按反应抗原的来源分为异种抗体,异嗜性抗体,同种抗体和自身抗体。按抗原反应的凝集状态分为完全抗体[/font][font=Calibri]IgM[/font][font=宋体]和不完全抗体[/font][font=Calibri]IgG[/font][font=宋体]等。抗体在医疗实践中应用甚为广泛。如用于疾病的预防、诊断和治疗方面都有一定的作用。临床上用丙种球蛋白预防病毒性肝炎、麻疹、风疹等,国际上用抗[/font][font=Calibri]Rh[/font][font=宋体]免疫球蛋白预防因[/font][font=Calibri]Rh[/font][font=宋体]血型不合引起的溶血症。诊断上如类风湿因子用于类风湿性关节炎,抗核抗体([/font][font=Calibri]ANA[/font][font=宋体])、抗[/font][font=Calibri]DNA[/font][font=宋体]抗体用于系统性红斑狼疮,抗精子抗体用于原发性不孕症的诊断等;治疗上如毒素中毒用抗毒治疗以及免疫缺陷性疾病的治疗等。[url=https://cn.sinobiological.com/resource/antibody-technical][b]抗体相关资源[/b][/url][/font][/font][font=宋体] [/font][font=宋体]蛋白:[/font][font=宋体][font=宋体]蛋白质是生命的物质基础,是有机大分子,是构成细胞的基本有机物,是生命活动的主要承担者。没有蛋白质就没有生命。氨基酸是蛋白质的基本组成单位。它是与生命及与各种形式的生命活动紧密联系在一起的物质。机体中的每一个细胞和所有重要组成部分都有蛋白质参与。蛋白质占人体重量的[/font][font=Calibri]16%~20%[/font][font=宋体],即一个[/font][font=Calibri]60kg[/font][font=宋体]重的成年人其体内约有蛋白质[/font][font=Calibri]9.6~12kg[/font][font=宋体]。人体内蛋白质的种类很多,性质、功能各异,但都是由[/font][font=Calibri]20[/font][font=宋体]多种氨基酸([/font][font=Calibri]Amino acid[/font][font=宋体])按不同比例组合而成的,并在体内不断进行代谢与更新。点击查看:[url=https://cn.sinobiological.com/resource/protein-review][b]蛋白相关资源[/b][/url][/font][/font][font=宋体] [/font][b][font=宋体]区别与联系:[/font][/b][font=宋体][font=宋体]蛋白质还是有一定的区别以及关联性的,虽然说抗体是蛋白质,但是蛋白质不一定是抗体。[/font] [font=宋体]主要是因为抗体是通过人体内的浆细胞所产生的,而且还可以喝相应的抗原特异性相互结合,这样在一定程度上就能发挥出蛋白质。[/font][/font][font=宋体] [/font][b][font=宋体]抗体[/font][font=宋体]蛋白[/font][font=宋体]结构[/font][font=宋体]解析[/font][font=宋体]:[/font][/b][font=宋体][font=宋体]抗体是一种免疫球蛋白,由[/font][font=Calibri]B[/font][font=宋体]淋巴细胞产生。抗体的单体是一个[/font][font=Calibri]Y[/font][font=宋体]形的分子,有[/font][font=Calibri]4[/font][font=宋体]条多肽链组成。其中包括两条相同的重链,以及两条相同的轻链,之间由双硫键连接在一起。每条重链[/font][font=Calibri]50kDa[/font][font=宋体],每条轻链[/font][font=Calibri]25kDa[/font][font=宋体],轻重链间存在二硫键链接。[/font][/font][font=宋体] [/font][font=宋体]轻链[/font][font=宋体][font=宋体]轻链包括可变区和恒定区,可变区约占轻链的[/font][font=Calibri]1/2[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体]重链[/font][font=宋体][font=宋体]重链包括可变区和恒定区。根据重链的不同,可以将抗体分为不同的种类,例如哺乳动物[/font] [font=Calibri]Ig [/font][font=宋体]的重链有α、δ、ε、γ和 μ 五种[/font][font=Calibri],[/font][font=宋体]相对应可以将哺乳动物[/font][font=Calibri]Ig[/font][font=宋体]分为 [/font][font=Calibri]IgA[/font][font=宋体]、[/font][font=Calibri]IgD[/font][font=宋体]、[/font][font=Calibri]IgE[/font][font=宋体]、[/font][font=Calibri]IgG [/font][font=宋体]和 [/font][font=Calibri]IgM [/font][font=宋体]五类。[/font][/font][font=宋体] [/font][font=宋体]可变区[/font][font=宋体][font=宋体]抗体分子的[/font][font=Calibri]N[/font][font=宋体]端存在一段氨基酸序列变化较大的区域,该区域称为可变区。可变区中存在可以与抗原特结合的部位,即抗原结合位点。一个抗体有两个抗原结合位点,可以同时结合两个抗原分子。在可变区中有三个区域的序列高度变化,成为高变区([/font][font=Calibri]hypervariable region[/font][font=宋体],[/font][font=Calibri]HVR[/font][font=宋体])又称为抗原互补决定区([/font][font=Calibri]complementarity determining region[/font][font=宋体],[/font][font=Calibri]CDR[/font][font=宋体])。可变区主要通过其[/font][font=Calibri]3[/font][font=宋体]个[/font][font=Calibri]CHR[/font][font=宋体]区形成[/font][font=Calibri]3[/font][font=宋体]个环状结构与抗原特异性结合。可变区中非[/font][font=Calibri]CDR[/font][font=宋体]部分成为骨架区([/font][font=Calibri]framework region[/font][font=宋体],[/font][font=Calibri]FR[/font][font=宋体]),其氨基酸组成和排列变化相对[/font][font=Calibri]CDR[/font][font=宋体]较少。[/font][/font][font=宋体] [/font][font=宋体]恒定区[/font][font=宋体][font=宋体]抗体分子[/font][font=Calibri]C[/font][font=宋体]端氨基酸序列相对稳定,该区域称为恒定区。同一种抗体的恒定区是相同的。抗体轻链的恒定区由一个[/font][font=Calibri]Ig[/font][font=宋体]结构域构成;重链的恒定区由[/font][font=Calibri]3-4[/font][font=宋体]个串联的[/font][font=Calibri]Ig[/font][font=宋体]结构域及一个用于增加灵活性的铰链区构成。[/font][font=Calibri]IgA[/font][font=宋体]、[/font][font=Calibri]IgE[/font][font=宋体]、[/font][font=Calibri]IgG[/font][font=宋体]有三个结构域([/font][font=Calibri]CH1[/font][font=宋体]、[/font][font=Calibri]CH2[/font][font=宋体]、[/font][font=Calibri]CH3[/font][font=宋体]),[/font][font=Calibri]IgD[/font][font=宋体]、[/font][font=Calibri]IgM[/font][font=宋体]有四个结构域([/font][font=Calibri]CH1[/font][font=宋体]、[/font][font=Calibri]CH2[/font][font=宋体]、[/font][font=Calibri]CH3[/font][font=宋体]、[/font][font=Calibri]CH4[/font][font=宋体])。不同种类抗体的铰链区存在一定的差异,[/font][font=Calibri]IgA[/font][font=宋体]的铰链区较短,[/font][font=Calibri]IgD [/font][font=宋体]的铰链区较长,[/font][font=Calibri]IgM [/font][font=宋体]和[/font][font=Calibri]IgE [/font][font=宋体]无铰链区。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Fab[/font][font=宋体]片段[/font][/font][font=宋体][font=Calibri]IgG[/font][font=宋体]分子在木瓜蛋白酶的作用下可以被降解为两个[/font][font=Calibri]Fab[/font][font=宋体]段及一个[/font][font=Calibri]Fc[/font][font=宋体]段。[/font][font=Calibri]Fab[/font][font=宋体]段由抗体轻链的可变区、轻链的恒定区、重链的可变区及重链恒定区构成。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]Fc[/font][font=宋体]段[/font][/font][font=宋体][font=Calibri]Fc[/font][font=宋体]段包含了所有抗体分子共有的蛋白质序列以及各个类别独有的决定簇。[/font][font=Calibri]Fc[/font][font=宋体]段有多种生物学活性,具有结合补体、结合[/font][font=Calibri]Fc[/font][font=宋体]受体、通过胎盘等作用。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多关于[url=https://cn.sinobiological.com/resource/antibody-technical/antibody-structure-function][b]抗体的结构和功能[/b][/url]详情:[/font][font=Calibri]https://cn.sinobiological.com/resource/antibody-technical/antibody-structure-function[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
乳清蛋白定义:一种存在于几乎所有哺乳动物乳汁中的蛋白质,由123个氨基酸残基组成,其氨基酸序列和立体结构均与溶菌酶同源,是乳糖合酶的一个亚基。 所属学科:生物化学与分子生物学(一级学科);氨基酸、多肽与蛋白质(二级学科) 乳清蛋白主要成分 β-乳球蛋白 具备最佳的氨基酸比例,支链氨基酸含量极高,对促进蛋白质合成和减少蛋白质分解起着重要的作用,有助于健身爱好者塑造优美体型。 α-乳白蛋白 是必需氨基酸和支链氨基酸的极好来源,也是唯一能与金属元素和钙元素结合的乳清蛋白成分。最近的研究更发现,它可能具有抗癌功能。此外乳白蛋白在氨基酸比例结构方面,以及在功能特性上与人乳都非常相似的。临床研究显示,富含α-乳白蛋白的婴儿配方奶粉是安全的。 免疫球蛋白 具有免疫活性,能够完整地进入近端小肠,起到保护小肠粘膜的功能。 乳铁蛋白 抗氧化,消灭或抑制细菌,促进正常细胞生长,提高免疫力。 作为乳清蛋白(优恩乳清蛋白)特有的一种蛋白质组分,乳铁蛋白可以为运动员带来几种重要的益处。牛奶乳铁蛋白在成年人体内是以完整蛋白质的形式被吸收的,其健康益处包括潜在抗菌活性和抗病毒特性,防止致病微生物在肠道内生长,刺激免疫系统和调节组织损伤造成的炎症。乳铁蛋白在铁和骨骼代谢方面的重要作用是运动员尤为关心的。 在乳清中发现的乳铁蛋白被证实对骨骼代谢也具有直接的益处。在细胞培养研究中,乳铁蛋白具有促进造骨细胞和软骨细胞增殖的功能,并能增加其生理含量,这一效果超过其他骨骼生长因子,如IGF-1和TGFb。乳铁蛋白在骨骼代谢中具有合成的作用对于骨骼健康和预防骨质疏松症具有重要意义。 并且,肌体内的氧气输送离不开铁。乳铁蛋白(铁传递蛋白的一种)的一个重要功能是使血液中的细胞结合铁。乳铁蛋白阻隔并溶解铁,从而控制肠道代谢中的可利用铁。因此,乳铁蛋白在维持血红细胞、血色素和氧气运输的健康调节方面也担当重要作用。
[font=宋体]重组蛋白的表达(尤其是使用细菌载体和宿主)是一项成熟的技术。难点在于如何将其以活化形式分离。[/font][font=宋体] [/font][font=宋体]重组蛋白的纯化是生物学研究中的重要技术。为了研究蛋白的特定功能和结构,研究人员必须将重组蛋白从生物体中分离并纯化。蛋白纯化方法主要利用不同重组蛋白之间的相似性和差异性。可以根据蛋白之间的相似性去除非蛋白物质,然后根据蛋白之间的差异分离纯化目标重组蛋白。[/font][font=宋体] [/font][font=宋体][font=宋体][url=https://cn.sinobiological.com/resource/protein-review/protein-tag][b]蛋白标签[/b][/url]是一种可以提高重组蛋白的溶解度、简化蛋白纯化的简单有效的工具,并通过简单的方法跟踪蛋白表达和纯化过程。此外,蛋白标签是追踪活细胞中蛋白和进程的一种有效工具,可以通过显微镜直接跟踪或者通过[/font][font=Calibri]Western blot[/font][font=宋体]、免疫沉淀或免疫染色间接进行跟踪。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]蛋白纯化的原理:[/b][/font][font=宋体]不同的重组蛋白具有不同的氨基酸序列和空间结构,导致其物理、化学和生物学特性存在差异。我们也可以根据目标蛋白与其他蛋白和裂解液的性质差异设计合理的蛋白纯化方案。[/font][font=宋体] [/font][font=宋体][font=宋体]大多数的纯化方案需要不止一步才能达到理想的纯度水平。该过程中的每一步都会造成一定的产品损失,假设每一步的获得率为[/font][font=Calibri]80%[/font][font=宋体]。因此,建议尽可能减少纯化步骤。起始原料的选择是纯化过程设计的关键。[/font][/font][font=宋体] [/font][font=宋体]在背景信息、检测方法和样品规格都已到位的情况下,可以考虑采用三阶段纯化策略。纯化分为捕获、中度纯化和精细纯化三个阶段,每个阶段都有特定的目标。捕获阶段的目标是分离、浓缩和稳定目标产物。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b][url=https://cn.sinobiological.com/resource/protein-review/protein-purification]蛋白纯化[/url]操作步骤:[/b][/font][font=宋体]理想情况下,最终的纯化过程包括样品制备,其中包括在需要时进行萃取和澄清,然后进行上述捕获、中度纯化和精细纯化三个阶段的纯化。步骤的数量始终取决于所需的纯度和蛋白的预期用途。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供不同表达系统的蛋白纯化服务,有细菌系统蛋白纯化、哺乳动物瞬时系统蛋白纯化、杆状病毒系统蛋白纯化。详情可以参看:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification[/font][/font]
[center]法研究发现一种病毒蛋白质可转变为宫颈癌"杀手"[/center]法国斯特拉斯堡路易• 巴斯德大学的研究人员日前发现,一种导致宫颈癌的蛋白质经过极其微小的变异,可以转而抑制这种癌症的扩散,这一成果将有助于科学家们研制治疗宫颈癌的新药。 路易• 巴斯德大学的科研人员在17日出版的英国《致癌基因》杂志电子版上报告说,全世界每年有50万妇女罹患宫颈癌,其中80%生活在发展中国家。这种病主要通过性行为传播,而导致它的罪魁祸首正是人乳头状瘤病毒(HPV)。 据介绍,HPV病毒会产生两种基因蛋白质,分别被命名为E6和E7,科研人员发现,E6导致癌细胞的增殖,但当它发生变异以后,却转而开始抑制肿瘤的生成。研究小组认为,虽然这种变异微不足道,但却能彻底改变E6的性质。 路易• 巴斯德大学表示,目前治疗宫颈癌的主要方法是接种疫苗,不过它的价格会令一些发展中国家的患者望而却步。此外,对于那些已经患病的女性来说,疫苗也无济于事,因此,他们希望利用这一发现,研究出能治疗宫颈癌的特效药。信息来源:中国医药123网
我们知道噬斑法和TCID50法检测的是感染性病毒的浓度,并不体现病毒的总浓度(总颗粒数)。现在有越来越多的研究显示,很多病毒在包装过程中由于缺失基因组,形成空心病毒。或者在合成过程中,基因的突变或者缺陷导致蛋白的突变,造成病毒没有感染性。而这些非感染性病毒的数量在总病毒数量中所占的比例意义重大,能影响体内和体外的研究结果。所以快速的病毒总浓度定量方法是非常必要的。流感疫苗的生产中,从鸡胚培养来源的流感疫苗在使用专门的试剂裂解后,收获免疫原蛋白HA。非传染性的流感病毒(被证实含有衣壳蛋白和部分的基因组)在裂解后同样能贡献免疫原蛋白HA。所以总病毒浓度的评估对流感疫苗的生产意义重大。此外,总病毒浓度的定量也有助于减毒疫苗的生产。减毒疫苗是复制缺陷的非感染性的但是能引发机体免疫反应的一种疫苗。减毒疫苗既然不能复制,所以就不会引起细胞病变反应,而CCID50法则以细胞病变反应为判断基准。在某种意义上来说,所有的减毒疫苗是由非感染的病毒颗粒构成,因此,采用总病毒浓度定量的方法是减毒疫苗唯一可靠的方法。在动物疾病的预防和治疗中,采用感染性方法测得病毒滴度来决定注射的剂量,往往忽视了非感染性病毒颗粒在动物免疫反应中的作用以及最终的药剂效果。比如噬斑法测得病毒滴度为1E6 pfu,但是总病毒浓度是1E8 vp/ml,在每一个感染颗粒中,有100个颗粒没有被计数,最终可能影响动物治疗结果。考虑到非感染性病毒颗粒的生物学作用以及在疫苗生产的作用,感染性病毒颗粒和总病毒颗粒的定量对于病毒疫苗的生产和研究都至关重要,而病毒计数仪在10min内能快速获得病毒总浓度,所以能广泛应用于在病毒的研究和生产中。
[font=宋体][font=宋体]跨膜蛋白具有多种生理功能,包括蛋白连接、识别、转运、锚定和转导等,其功能的异常与诸多疾病相关。膜蛋白是重要的药物靶点,据统计,约[/font][font=Calibri]50%[/font][font=宋体]药物的靶向分子为膜蛋白。然而,由于表达量低、体外不溶、纯化不稳定、难保持天然构象等问题的存在,限制了跨膜蛋白在药物开发方面的应用。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州聚焦于多次跨膜蛋白产品的开发,成功搭建了三大技术平台,为药物早期研发提供重要的原材料。目前产品包括四次跨膜蛋白[/font][font=Calibri]Claudin-6[/font][font=宋体]、[/font][font=Calibri]Claudin-9[/font][font=宋体]、[/font][font=Calibri]Claudin-18.1[/font][font=宋体]、[/font][font=Calibri]Claudin-18.2[/font][font=宋体],七次跨膜蛋白[/font][font=Calibri]GPRC5D[/font][font=宋体]、[/font][font=Calibri]CXCR4[/font][font=宋体]、[/font][font=Calibri]SSTR2[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][b]三大跨膜蛋白研发技术平台一览:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]VLP[/font][font=宋体]技术平台:[/font][font=Calibri]VLP[/font][font=宋体]技术平台能够将完整天然构象的膜蛋白展示在类病毒颗粒表面,产生非常适合免疫和抗体筛选的全长跨膜蛋白。[/font][/font][font=宋体][font=宋体]去垢剂技术平台:去垢剂技术平台利用传统的膜蛋白提取方法[/font][font=宋体]——去垢剂制备较纯的膜蛋白产品,满足药物早期筛选的需求。[/font][/font][font=宋体][font=Calibri]Nanodisc[/font][font=宋体]技术平台:[/font][font=Calibri]Nanodisc[/font][font=宋体]技术平台利用跨膜蛋白与磷脂结合能够维持其良好活性的特性,制备出稳定的产品,用于免疫和抗体筛选等场景。[/font][/font][font=宋体] [/font][font=宋体][b][font=宋体]下面是关于跨膜蛋白开发常见问题解答([/font][font=Calibri]FAQs[/font][font=宋体]):[/font][/b][/font][font=宋体] [/font][font=宋体]①如何选择膜蛋白开发平台?[/font][font=宋体]不同膜蛋白平台具有不同的优势和劣势,应根据下游应用、成本、周期等因素进行考量。[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]②[/font][font=Calibri]HPLC[/font][font=宋体]分析是否可以表征[/font][font=Calibri]VLP[/font][font=宋体]形式膜蛋白的纯度?[/font][/font][font=宋体][font=Calibri]HPLC[/font][font=宋体]方法可用于检测产品溶液中[/font][font=Calibri]VLP[/font][font=宋体]颗粒的大小和均一程度,而[/font][font=Calibri]VLP[/font][font=宋体]平台产生的蛋白除目标蛋白外还包括其他内源性的蛋白,故无法表征目标蛋白的纯度;由于[/font][font=Calibri]VLP[/font][font=宋体]产品为混合物,目前对[/font][font=Calibri]VLP[/font][font=宋体]产品的检测主要以活性检测为主,纯度仅作为一项参考指标。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体]③我想购买膜蛋白产品做免疫和抗体筛选,应该怎么挑选?[/font][font=宋体][font=宋体]目前,我们的[/font][font=Calibri]3[/font][font=宋体]个平台的产品各有特点,客户可以按照实际情况进行选择。[/font][font=Calibri]VLP[/font][font=宋体]平台产品是一个混合物,与细胞免疫相比靶标蛋白的丰度有所提高,在没有其他平台的产品时可以用于免疫和抗体筛选。由于[/font][font=Calibri]Detergent[/font][font=宋体]平台的产品存在去垢剂,因此,需要考虑去垢剂对于免疫动物的毒害和免疫过程中蛋白变性的风险。比较而言,[/font][font=Calibri]SMA-Nanodisc[/font][font=宋体]平台的产品既拥有较高的靶蛋白丰度,又能维持好的天然构象,特别推荐用于动物免疫和抗体筛选实验。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]更多[url=https://cn.sinobiological.com/services/platform/multi-pass-transmembrane-protein]跨膜蛋白[/url]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/platform/multi-pass-transmembrane-protein[/font][/font]
可选择性杀伤HIV感染细胞,为HIV药物生产提供新思路 经过多年的科技攻关,近日,香港中文大学教授邵鹏柱学科组与中科院昆明动物研究所研究员郑永唐学科组合作,从玉米中获得了一种能够选择性地杀伤艾滋病病毒(HIV)感染细胞的蛋白酶突变体。该研究成果为研发特异性靶向HIV感染细胞的新型抗HIV药物提供了新思路和新策略。 据悉,HIV存在潜藏机制可以长期潜伏在细胞中而逃逸宿主免疫系统的攻击,目前已上市的抗HIV药物均不能选择性地杀伤感染细胞而根除病毒。郑永唐认为,新的研究思路对开发新型抗HIV药物显得非常重要,研究具有选择性地杀伤HIV感染细胞而保护正常细胞不受伤害的抗艾滋病药物是极有前景的方向。 核糖体失活蛋白(RIPs)具有RNA N-糖苷酶活性,可以阻遏延长因子EF-1或EF-2与核糖体的结合,抑制蛋白质的生物合成。因此,RIPs具有很高的细胞毒性,常常被开发成为免疫毒素、抗病毒或抗肿瘤药物。RIP分为3类:I型、II型和III型。其中,III型RIP以玉米RIP为代表,先合成无活性的含有一段25氨基酸的内部失活结构域的前体蛋白,前体蛋白被切除该结构域后才成为有活性的核糖体失活蛋白。 在香港研究资助局、科技部“973”项目、国家重大科技专项、中科院等项目的资助下,邵鹏柱、郑永唐等对玉米RIP的内部失活结构域进行一系列的结构修饰和改造,获得了对HIV-1蛋白酶特异识别并激活的玉米RIP突变体。细胞水平实验的研究表明,突变体对未感染细胞毒性低,但突变体进入HIV-1感染细胞后则可被细胞内的HIV-1蛋白酶识别并切割去除失活结构域转变成为活性蛋白,从而选择性地杀伤HIV-1感染细胞。同时,通过增加突变体进入细胞的效率,对HIV-1感染细胞的杀伤力更强。突变体也可以被HIV-1蛋白酶耐药株的蛋白酶识别并激活,因此突变体对HIV-1蛋白酶耐药株感染细胞也有很好的选择杀伤性。 该研究成果已在国际学术期刊《核酸研究》(Nucleic Acids Research)上发表。
可选择性杀伤HIV感染细胞,为HIV药物生产提供新思路经过多年的科技攻关,近日,香港中文大学教授邵鹏柱学科组与中科院昆明动物研究所研究员郑永唐学科组合作,从玉米中获得了一种能够选择性地杀伤艾滋病病毒(HIV)感染细胞的蛋白酶突变体。该研究成果为研发特异性靶向HIV感染细胞的新型抗HIV药物提供了新思路和新策略。 据悉,HIV存在潜藏机制可以长期潜伏在细胞中而逃逸宿主免疫系统的攻击,目前已上市的抗HIV药物均不能选择性地杀伤感染细胞而根除病毒。郑永唐认为,新的研究思路对开发新型抗HIV药物显得非常重要,研究具有选择性地杀伤HIV感染细胞而保护正常细胞不受伤害的抗艾滋病药物是极有前景的方向。 核糖体失活蛋白(RIPs)具有RNA N-糖苷酶活性,可以阻遏延长因子EF-1或EF-2与核糖体的结合,抑制蛋白质的生物合成。因此,RIPs具有很高的细胞毒性,常常被开发成为免疫毒素、抗病毒或抗肿瘤药物。RIP分为3类:I型、II型和III型。其中,III型RIP以玉米RIP为代表,先合成无活性的含有一段25氨基酸的内部失活结构域的前体蛋白,前体蛋白被切除该结构域后才成为有活性的核糖体失活蛋白。 在香港研究资助局、科技部“973”项目、国家重大科技专项、中科院等项目的资助下,邵鹏柱、郑永唐等对玉米RIP的内部失活结构域进行一系列的结构修饰和改造,获得了对HIV-1蛋白酶特异识别并激活的玉米RIP突变体。细胞水平实验的研究表明,突变体对未感染细胞毒性低,但突变体进入HIV-1感染细胞后则可被细胞内的HIV-1蛋白酶识别并切割去除失活结构域转变成为活性蛋白,从而选择性地杀伤HIV-1感染细胞。同时,通过增加突变体进入细胞的效率,对HIV-1感染细胞的杀伤力更强。突变体也可以被HIV-1蛋白酶耐药株的蛋白酶识别并激活,因此突变体对HIV-1蛋白酶耐药株感染细胞也有很好的选择杀伤性。
经过多年的科技攻关,近日,香港中文大学教授邵鹏柱学科组与中科院昆明动物研究所研究员郑永唐学科组合作,从玉米中获得了一种能够选择性地杀伤艾滋病病毒(HIV)感染细胞的蛋白酶突变体。该研究成果为研发特异性靶向HIV感染细胞的新型抗HIV药物提供了新思路和新策略。据悉,HIV存在潜藏机制可以长期潜伏在细胞中而逃逸宿主免疫系统的攻击,目前已上市的抗HIV药物均不能选择性地杀伤感染细胞而根除病毒。郑永唐认为,新的研究思路对开发新型抗HIV药物显得非常重要,研究具有选择性地杀伤HIV感染细胞而保护正常细胞不受伤害的抗艾滋病药物是极有前景的方向。核糖体失活蛋白(RIPs)具有RNA N-糖苷酶活性,可以阻遏延长因子EF-1或EF-2与核糖体的结合,抑制蛋白质的生物合成。因此,RIPs具有很高的细胞毒性,常常被开发成为免疫毒素、抗病毒或抗肿瘤药物。RIP分为3类:I型、II型和III型。其中,III型RIP以玉米RIP为代表,先合成无活性的含有一段25氨基酸的内部失活结构域的前体蛋白,前体蛋白被切除该结构域后才成为有活性的核糖体失活蛋白。在香港研究资助局、科技部“973”项目、国家重大科技专项、中科院等项目的资助下,邵鹏柱、郑永唐等对玉米RIP的内部失活结构域进行一系列的结构修饰和改造,获得了对HIV-1蛋白酶特异识别并激活的玉米RIP突变体。细胞水平实验的研究表明,突变体对未感染细胞毒性低,但突变体进入HIV-1感染细胞后则可被细胞内的HIV-1蛋白酶识别并切割去除失活结构域转变成为活性蛋白,从而选择性地杀伤HIV-1感染细胞。同时,通过增加突变体进入细胞的效率,对HIV-1感染细胞的杀伤力更强。突变体也可以被HIV-1蛋白酶耐药株的蛋白酶识别并激活,因此突变体对HIV-1蛋白酶耐药株感染细胞也有很好的选择杀伤性。该研究成果已在国际学术期刊《核酸研究》(Nucleic Acids Research)上发表。(科学时报)
70kDa)中的七个得到了可溶性表达,而其它的融合标签(GST,MBP和hexahistidine)系统则只得到了四个可溶性表达的蛋白。表1. 用大量的目标蛋白评估NusA标签对提高融合蛋白可溶性的作用参考文献a目的蛋白数目目的插入序列种属目标蛋白大小范围NusA融合蛋白可溶性比例Shih等(2002)40酵母,哺乳动物,植物,昆虫9-10060Korf等(2005)75人6-12760bKohl等(2008)96人1-11844ca. Korf等和Kohl等的研究中包含了六组氨酸标签。b. 可溶性蛋白量大于等于10%即认为该融合蛋白可溶。c. 纯化后的融合蛋白如果在SDS-PAGE后考染在合适位置出现条带即认为可溶。Korf等的还发现对于定位于真核细胞细胞器,质膜或者骨架的蛋白,相对于其它标签系统来讲,NusA标签是最好的可溶性表达的选择。Kohl等(2008)也发现只要在20-25℃诱导表达,NusA标签能够大大提高难表达的蛋白比如膜蛋白的可溶性。与Korf等的研究结果一致,Kohl等也发现25℃诱导表达比30℃或37℃诱导表达可以纯化得到更多的NusA融合蛋白。切除NusA标签获得后保持活性且正确折叠的蛋白表2总结了16个采用NusA标签成功获得可溶性蛋白,在切除标签后这些蛋白仍有正确折叠结构和活性。大部分这种研究是是关于分子量小于或接近20kDa的目标蛋白。纯化后的目标蛋白产量范围在1.5-100mg/L。趋化因子和细胞因子可以得到高达30-100mg/L的产量。其它关于这些蛋白表达和纯化的有参考价值信息包括:■ 植物磷酸烯醇式丙酮酸—羧化酶激酶(Ermolova 2003)——目标蛋白切除标签后用BDA(蓝色葡聚糖)亲和层析树脂纯化。纯化后蛋白的催化活性比未切除标签的融合蛋白高50倍。■ Xklp3a,Tep3Ag和E8R(De Marco 2004)——用蛋白酶切割后,His-融合的TEV和NusA被Ni2+离子亲和色谱选择性去除。与Ni2+亲和结合的标签被紧密地结合在树脂上,在流出液中则可以得到纯化的目的蛋白。所有这三种蛋白在纯化后都正确折叠且均一分散在溶液中。纯化的膜结合蛋白E8R牛痘病毒蛋白在Tris缓冲液中除去NusA后出现了沉淀,然而加入0.02%的月桂酰基麦芽糖苷和150mM的氯化钠后,蛋白又重新变得可溶。■ 环麦芽糖糊精酶(Turner 2005)——这个蛋白属于α-淀粉酶家族。这个家族的蛋白通常在大肠杆菌中很难以活性形式表达出来。将其与肠激酶混合孵育24小时以上会使其活性逐渐增强,直到达到未经肠激酶处理过的融合蛋白的2倍以上,这也说明标签的存在降低了该酶的活性。可以用固化了Cu2+的亲和层析柱去除切除的融合标签。■ 八种人趋化因子(Magis-trelli 2005)——所有的蛋白都在OrigamiTM B菌株中表达提高它们在胞质中的二硫键形成率。在趋化因子编码序列的C端引入了AviTMTag(亲和素)生物素化序列。切割后的细胞趋化因子可以用单体的亲和素树脂亲和层析与切割下的NusA标签和蛋白酶混合物分离开。所有切割纯化后的蛋白在细胞趋化实验中都显示了活性,而没有一个融合蛋白有这样的活性。■ 蚯蚓血红蛋白(Karlsen 2005)——酶切后,用分子筛分离纯化蚯蚓血红蛋白,纯化后的蛋白通过圆二色谱检测得到的α-螺旋结构与模型预期结果一致,且纯化后的蛋白可以以单体的形式稳定保存。■ 人白介素-29(Li 2006)——用S-蛋白亲和层析比Ni2+亲和层析可以得到更纯的目的蛋白。将融合蛋白N端的NusA/His•Tag®/S•Tag™标签切掉后,用链亲和素琼脂去除生物素标记的凝血酶。用水疱性口膜炎病毒(VSV)处理固定的人羊膜上皮细胞(WISH 细胞)后,通过检测纯化的IL-29对细胞的保护效应来检测其抗病毒活性。■ 人干扰素-λ2(Li 2007)——酶切后,用Novagen提供的EKaptureTM琼脂除去重组的肠激酶。先用纯化后的干扰素-λ2处理WISH细胞,24小时后加入VSV病毒,可以观察到干扰素-λ2可以有效地保护细胞免于病毒介导的病变。表2. 切除NusA标签获得后保持活性且正确折叠的蛋白参考文献目的蛋白目的蛋白分子量(kDa)切割用蛋白酶融合蛋白亲和层析固定介质纯化后目的蛋白产量(mg/L)Ermolova等(2003)植物磷酸烯醇式丙酮酸羧化酶激酶32凝血酶Ni2+1.5De Marco等(2004)Xklp3ATep3AgE8R15NRa32bTEV酶TEV酶TEV酶Ni2+5.02.54.0Turner等(2005)环麦芽糖糊精酶69肠激酶Cu2+1.6Magistrelli等(2005)八种人趋化因子8-21Xa因子Ni2+30-100Karlsen等(2005)蚯蚓血红蛋白15TEV酶Ni2+NRaLi和He(2006)人白介素-2920凝血酶S-蛋白60Li和Huang(2007)人干扰素-λ220肠激酶Ni2+65a. 未报道b. 根据NCBI报道预测的全长蛋白分子量与NusA标签融合且具有活性的蛋白 与这些切除NusA标签后保持活性且正确折叠的蛋白不同,还有很多报道指出目的蛋白在“NusA-目的蛋白”的融合形式时具有很好的活性。比如单链(ScFv)催化活性抗体14D9(Zheng 2003),来自Aequorea victoria的绿色荧光蛋白(Nallamsetty 2006),人二氢叶酸还原酶(Nallamsetty 2006),来自Ensis directus蛏子的精氨酸酶激酶(Compaan 2003),来自B. thuringiensis的修饰δ-内毒素(Kumar 2005),人BCMA跨膜受体(Guan 2006),植物α-双加氧酶1(Liu 2006),以及来自Plasmodium falciparum的b-ketoacyl-acyl载体蛋白合成酶(Lack 2006)等,反映了各种不同背景的蛋白都显示出了与NusA标签融合后的活性。NusA标签提高蛋白可溶性的可能机制 Houry(1999)等揭示NusA蛋白是分子伴侣GroEL在体内的必须底物。而GroEL与其共作用因子GroES是大肠杆菌唯一的在所有生长条件下必需的分子伴侣系统。Douette等(2005)研究了融合蛋白NusA-UCP1(uncoupling protein 1)的可溶产量。UCP1是一种线粒体膜蛋白。这些作者发现16℃培养时,当GroEL共过表达的情况下,融合蛋白的可溶性有更大的提高。这个结果也表明NusA与分子伴侣途径相作用,从而阻止参与蛋白的聚集。总结 已有充分的证据证明NusA标签系统能显著提高多种不同来源蛋白的可溶性表达,而这些蛋白在单独表达时往往形成不可溶的包涵体。在一些研究报告中,用蛋白酶切除NusA标签能使目的蛋白仍保持正确折叠和生物学活性;相反,在另外许多报道中也指出当目的蛋白与NusA融合而非切除时,融合蛋白也同样具有活性。NusA标签系统的成功至少部分地是由于其与大肠杆菌分子伴侣系统相互作用的结果。
[font=宋体][font=宋体]义翘神州具有每年[/font][font=Calibri]1,000[/font][font=宋体]多种新蛋白的研发能力,依托先进的蛋白表达技术,在重组蛋白生产如跨膜蛋白、酶、激酶、病毒抗原等积累了丰富的经验。我们拥有多种重组蛋白表达系统,包括昆虫细胞、哺乳动物细胞和原核蛋白表达系统,为客户提供高品质、低成本的活性重组蛋白,满足您的不同需求。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供从基因合成、载体构建到蛋白质表达、纯化的一站式服务,可以根据客户需求,选用不同表达[/font][font=Calibri]/[/font][font=宋体]纯化标签、表达宿主等,真正为客户实现深度私人定制。多种纯化体系,为蛋白表达、纯化提供多种选择,帮助客户最大限度提高研究项目的成功率。‘’[/font][/font][font=宋体] [/font][font=宋体][b]重组蛋白表达服务的类型:[/b][/font][font=宋体] [/font][font=宋体][font=宋体]一、[/font][font=Calibri]VLP[/font][font=宋体]形式的膜蛋白表达服务[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州利用[/font][font=Calibri]HEK293[/font][font=宋体]表达系统构建了[/font][font=Calibri]VLP[/font][font=宋体]技术平台,为客户提供膜蛋白定制服务,助力药物研发。[/font][/font][font=宋体] [/font][font=宋体]优势:[/font][font=宋体]? 活性优,哺乳动物细胞表达,更接近真实构象[/font][font=宋体][font=宋体]? 多应用,免疫、[/font][font=Calibri]ELISA[/font][font=宋体]、[/font][font=Calibri]SPR/BLI[/font][font=宋体]、[/font][font=Calibri]PK/PD[/font][font=宋体]等[/font][/font][font=宋体] [/font][font=宋体]二、哺乳动物细胞瞬时表达服务[/font][font=宋体]义翘神州的哺乳动物瞬时表达系统提供灵活的定制服务,满足多样化需求。[/font][font=宋体] [/font][font=宋体]优势:[/font][font=宋体]? 高效表达载体[/font][font=宋体]? 高密度细胞培养[/font][font=宋体] [/font][font=宋体][font=宋体]三、杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞蛋白表达服务[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州在杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞蛋白表达方面具有丰富的经验,特别是病毒类蛋白、激酶等。[/font][/font][font=宋体] [/font][font=宋体]优势:[/font][font=宋体]? 高效表达胞内和胞外蛋白[/font][font=宋体]? 大规模蛋白表达生产能力[/font][font=宋体] [/font][font=宋体][font=宋体]四、原核([/font][font=Calibri]E.coil[/font][font=宋体])蛋白表达服务[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州[/font][font=宋体]“一站式”服务以及内毒素去除等附加服务,以满足不同的定制需求。[/font][/font][font=宋体] [/font][font=宋体]优势:[/font][font=宋体]? 多种表达载体和菌株[/font][font=宋体]? 丰富的包涵体纯化经验[/font][font=宋体] [/font][font=宋体]五、生产用稳定株构建服务[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供优质稳定细胞株构建服务,满足客户蛋白[/font][font=Calibri]/[/font][font=宋体]抗体生产、免疫治疗药物开发等诸多需求。[/font][/font][font=宋体] [/font][font=宋体]优势:[/font][font=宋体][font=宋体]? 稳定细胞株抗体产量可达[/font][font=Calibri]2-4 g/L[/font][/font][font=宋体][font=宋体]? 团队重组表达经验[/font][font=Calibri]15[/font][font=宋体]年以上[/font][/font][font=宋体] [/font][font=宋体]六、检测用细胞系构建服务[/font][font=宋体] [/font][font=宋体]义翘神州提供稳定表达特定基因的细胞株构建服务,可应用于多种研究领域。[/font][font=宋体] [/font][font=宋体]优势:[/font][font=宋体]? 快速交付,经验丰富[/font][font=宋体]? 应用场景广泛,满足多样化实验需求[/font][font=宋体] [/font][font=宋体]选择哪种[url=https://cn.sinobiological.com/services/recombinant-protein-expression-service][b]蛋白表达服务[/b][/url]取决于目的蛋白的来源、蛋白功能、产率、成本和纯化蛋白的用途等诸多因素,每个系统都有其优缺点,根据不同应用选择合适的表达系统对重组蛋白非常重要。下面是重组蛋白表达服务选择指南:[img=重组蛋白表达服务选择指南,690,198]https://ng1.17img.cn/bbsfiles/images/2023/11/202311031655095289_8336_5907840_3.png!w690x198.jpg[/img][/font][font=宋体][font=宋体]更多关于重组蛋白表达服务详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][/font][font=Calibri] [/font]
[font=宋体][font=宋体]蛋白过镍柱纯化的原理是利用[/font][font=Calibri]Ni[/font][font=宋体]柱中的氯化镍与有[/font][font=Calibri]HIs[/font][font=宋体](组蛋白)标签的蛋白特异性结合的能力,同时也能与咪唑结合。具体步骤如下:[/font][/font][font=宋体] [/font][font=宋体]①[/font][font=宋体][font=宋体]过柱子前可以选择[/font][font=Calibri]Ni[/font][font=宋体]柱重生,往柱子里倒氯化镍,一个柱长体积就行,然后平衡柱子,用你自己的[/font][font=Calibri]buffer[/font][font=宋体],给蛋白提供最适的环境。[/font][/font][font=宋体]②[/font][font=宋体][font=宋体]平衡[/font][font=Calibri]4[/font][font=宋体]个柱长后,蛋白上样,可以让他自己挂,这样挂柱子的效果好一些。如果流速太慢,可以加个恒流泵,但是一定不能太快,太快挂柱效果差。也可以选择循环挂柱,就是恒流泵的一头接你装蛋白的烧杯,从柱子中留下来的液体还用同一个烧杯接回去。[/font][/font][font=宋体]③[/font][font=宋体][font=宋体]挂完之后,按理想来讲,蛋白在[/font][font=Calibri]Ni[/font][font=宋体]柱中与[/font][font=Calibri]Ni[/font][font=宋体]就结合了,杂蛋白多数在烧杯里留下来了。肯定有少量杂蛋白也挂上了。这时候要梯度洗脱,拿咪唑和你的[/font][font=Calibri]buffer[/font][font=宋体]配,一般从[/font][font=Calibri]0[/font][font=宋体]、[/font][font=Calibri]20mM[/font][font=宋体]、[/font][font=Calibri]40mM......100mM[/font][font=宋体]这样洗脱。咪唑加入之后,会和蛋白争夺与[/font][font=Calibri]Ni[/font][font=宋体]的结合位点,杂蛋白、你的目的蛋白,会在不同的浓度被洗脱下来。[/font][/font][font=宋体]④[/font][font=宋体][font=宋体]洗完之后,可以用[/font][font=Calibri]200mM[/font][font=宋体]咪唑洗柱子,清理一切蛋白,然后平衡几次。是否选择重生你自己定咯[/font][font=Calibri]~[/font][font=宋体]然后放上[/font][font=Calibri]20%[/font][font=宋体]乙醇保存柱子就可以咯[/font][font=Calibri]~ [/font][font=宋体]过的蛋白用不同的管子收下,然后[/font][font=Calibri]SDS-page[/font][font=宋体]检测在哪个管子里。[/font][/font][font=宋体]以上步骤仅供参考,不同的实验条件可能方法会不同。具体可以查阅专业书籍或者咨询专业人士。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供不同表达系统的[url=https://cn.sinobiological.com/resource/protein-review/protein-purification][b]蛋白纯化服务[/b][/url],有细菌系统蛋白纯化、[url=https://cn.sinobiological.com/services/transient-protein-expression-service][b]哺乳动物瞬时系统蛋白纯化[/b][/url]、杆状病毒系统蛋白纯化等,具体重组蛋白纯化原理及操作步骤可以查看[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-purification[/font][/font][font=宋体][font=宋体]杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞蛋白表达服务:[/font][font=Calibri]https://cn.sinobiological.com/services/baculovirus-insect-protein-expression-service[/font][/font][font=宋体][font=宋体]原核([/font][font=Calibri]E. coli[/font][font=宋体])蛋白表达服务:[/font][font=Calibri]https://cn.sinobiological.com/services/e-coli-protein-expression-service[/font][/font]
铁蛋白,C反应蛋白,心肌三项检测试剂北京易斯威特生物医学科技有限公司产品介绍 铁蛋白(FER)检测试剂盒 (胶体金法)1.国内第一家免疫层析法检测FER的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的铁蛋白,适用于急性贫血,肝脏损伤等相关疾病的辅助诊断3.最快速准确的辅助诊断方法。4.血清铁蛋白是血液去铁蛋白和铁核心Fe3+形成的复合物。是检查体内铁缺乏的最灵敏的指标。血清铁蛋白测定在临床上常用于缺铁性贫血的诊断。简单 便捷 快速 灵敏 环保 肌红蛋白/肌酸激酶/心肌肌钙蛋白I,心梗三项检测试剂盒(胶体金法)1.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的肌红蛋白,肌酸激酶,心肌肌钙蛋白I检测,用于临床快速诊断急性心肌梗塞(AMI).2.最快速准确的辅助诊断方法。3.肌红蛋白:是心肌梗死的标志物,增高表示冠状动脉堵塞引起心肌严重缺血造成心肌梗死;4.肌钙蛋白:是一种心肌蛋白,升高见于心肌损伤,多见于心肌梗死,也见于心肌炎和心肺复苏后患者,特异性较高,阳性的话一般可确诊心肌损伤,阴性的话不能排除,因为肌钙蛋白的升高出现在心肌梗塞3-6小时之后,之前可能出现阴性。肌酸激酶敏感性较高,特异性较低,升高也出现在心梗3-8小时之后。5.肌酸激酶:主要存在于骨骼肌和心肌,在脑组织中也存在,是参与体内的能量代谢的一种酶。在临床上主要用于诊断心肌梗塞。心肌梗塞患者发病后2-4小时,血液中此酶活动即开始升高。比血清中谷草转酸酶和乳酸脱氢酶的活力变化都出现得早。 简单 便捷 快速 灵敏 环保 C反应蛋白(CRP)检测试剂盒(胶体金法)1.国内第一家免疫层析法检测CRP的产品。2.本产品应用世界上最先进的单克隆抗体技术结合胶体金(纳米金)免疫层析技术,以双抗体夹心法快速定性检测人血清,血浆中的C反应蛋白,适用于感染,炎性疾病,组织损伤,手术创伤及组织坏死等病变情况的辅助诊断3.最快速准确的辅助诊断方法。4.是一种能与肺炎球菌C多糖体反应形成复合物的急性时相反应蛋白。可用于细菌和病毒感染的鉴别诊断简单 便捷 快速 灵敏 环保
褚福亮,王福生, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室 北京市 100039项目负责人 王福生, 100039 ,北京市丰台路26号, 中国人民解放军第302医院全军艾滋病与病毒性肝炎重点实验室. fswang@public.bta.net.cn电话:010-66933332 传真:010-63831870收稿日期 2002-08-15 接受日期 2002-09-03摘要新近广泛应用蛋白质芯片(ProteinChipâ Array)系统成功鉴定出了一些重要疾病(如肿瘤和危害性较大的传染病)新的、特异性的生物标记(biomarkers),后者不仅在生物医学的基础方面具有重要的科学价值,而且在临床疾病的诊断、治疗和预防发挥重要的指导作用,显示了良好的发展前景.本文就表面增强的激光解析电离-飞行时间-质谱(SELDI-TOF-MS)相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.此外,我们就蛋白质谱分析技术在病毒性肝炎、肝硬化和肝癌等一系列肝病方面的应用策略和前景进行了分析.褚福亮,王福生. 蛋白质谱分析方法特点及其在蛋白组学研究领域中的应用.世界华人消化杂志 2002 10(12):1431-14350 引言人类基因组计划已经进入后基因组时代-即功能基因组时代[1],作为基因功能的直接体现者-蛋白质,及其之间的相互作用越来越引起基础和临床科学家们的关注[2-6] .因为要彻底了解生命的本质,只把基因测出来还是不够的,还必须要了解其在生物生长、发育、衰老和整个生命过程中的功能、不同蛋白质之间的相互作用以及他们与疾病发生、发展和转化的规律[7-14] .正因为如此,有关上述问题的蛋白质组学研究成了今天生命科学最重要的焦点之一[15] .为了阐明蛋白质在上述生命现象中的作用和相关机制,人们设计了许多新的方法技术,如:二维电泳、质谱分析、微距阵列、酵母双杂交和噬菌体展示等,这些方法在一些特定的情况下,虽然显示出了他们各自不同的优点,但是同样也存在着较大的局限性,难以开展大规模、超微量、高通量、全自动筛选蛋白质等方面的分析,因而设计更全面、同时研究多种蛋白质相互作用的技术,在功能基因组和蛋白组学的研究中建立一个更有效的技术平台,成为本领域中优先关注的问题[16] .近来,美国Ciphergen(赛弗吉)公司研制的ProteinChipâ Array的仪器,并建立了一种新的蛋白质飞行质谱-表面增强的激光解析离子化-飞行时间-质谱(surface-enhanced laser desorption/inionation-time of flight-mass spectra, SELDI-TOF-MS),已取得可喜的进展,筛选出了许多与疾病相关的新型生物标志,不仅为临床疾病的诊断和治疗等提供了新的选择,而且在基础科学、新药研制和疾病预防等方面具有广泛的应用前景[16-18] .本文就SELDI-TOF-MS相关的原理、特点、在临床和基础研究中的应用新进展和未来的发展趋势做一综述.1 ProteinChipâ Array系统和SELDI-TOF-MS的特点1.1 蛋白质芯片系统的组成和原理 蛋白质芯片系统由三部分组成:蛋白质芯片、芯片阅读器和芯片软件.供研究用芯片上有6-10芯池,不同的芯片表面上的化学物质不同,芯片表面分为两大类:一类为化学类表面,包括经典的色谱分析表面,如:结合普通蛋白质的正相表面,用于反相捕获的疏水表面,阴阳离子交换表面和捕获金属结合蛋白的静态金属亲合捕获表面;另一类称为生物类,特定的蛋白质共价结合于预先活化的表面阵列,可以用来研究传统的抗体一抗原反应,DNA和蛋白质作用,受体、配体作用和其他的一些分子之间的相互作用[19] . 根据检测目的不同,可以选用不同的芯片,或者自己设计芯片.将样本和对照点到芯池上以后,经过一段时间的结合反应,用缓冲液或水洗去一些不结合的非特异分子,再加上能量吸收分子(energy absorbing molelule,EAM)溶液,使样本固定在芯片表面.当溶液干燥后,一个含有分析物和大量能量吸收分子“晶体”就形成了.能量吸收分子对于电离来说非常重要.经过以上步骤,就可经把芯片放到芯片阅读器中进行质谱分析. 在阅读器的固定激光束下,芯片上、下移动,使样本上每一个特定点都被“读”到.激光束的每一次闪光释放的能量都聚集在该区一个非常小的点上(focused laser beam,聚焦激光束).这样,每个区都含有丰富的,可寻址(addressable)的位置.蛋白质芯片处理软件精确控制激光寻读过程.当样本受到激发,就开始电离和解除吸附.不同质量的带电离子在电场中飞行的时间长短不同,计算检测到的不同时间,就可以得出质量电荷比,把他输入电脑,形成图像[19].Ball et al [20]采用一种称为人工神经网络(artifical neural network,ANN)的算法处理出现的成千上万的峰,鉴定出三个分子量为13 454、13 457和14 278的生物标记分子,使疾病预测率达到97.1 %.1.2 ProteinChipâ Array芯片和SELDI-TOF-MS的特点 新型蛋白芯片与以往的蛋白芯片不同之处:SELDI-TOF-MS,他是在MALDI(matrix-assisted laser desorption/inionation)[21,22]基础上,改进后实行表面增强的飞行质谱.SELDI-TOF-MS优于MALDI-TOF表现为他不会破坏蛋白质,或使样本与可溶的基质共结晶来产生质谱信号.对SELDI-TOF来说,可以直接将血清、尿液、组织抽取物等不需处理直接点样检测[40] 由于一部分非特异结合的分析物被洗去,因而出现的质峰非常一致,有利于后期分析[23,24] . 与二维电泳相比:二维电泳分析蛋白质的分子量在30 KDa以上时电泳图谱较清楚,对在组织抽提物中占很大比例的低丰度的蛋白质不能被检出;其次,二维电泳胶上的蛋白质斑点很大一部分包含一种以上的蛋白质;而且,二维电泳耗时长,工作量大,对象染色转移等技术要求高,不能完全实现自动化.而SELDI-TOF在200 Da-500 KDa区间都可以给出很好的质谱,对一个样本的分析在几十分钟内就可以完成[19],处理的信息量远远大于二维电泳;对于低丰度物质,即使浓度仅attomole(10-18)的分子,只要与表面探针结合,就可以检测到,这也是二维电泳所不具备的[24,25] . 对于微距阵蛋白芯片来说,需要一种不破坏折叠的蛋白质构象的固定技术,再与另外的蛋白质反应,经检测莹光来观察蛋白质之间的作用[26] .而基于SELDI-TOF-MS的ProteinChip分析蛋白质不需溶解、不需染色、廉价、针对性强. 因而蛋白质芯片仪具有以下优势:(1)可直接使用粗样本,如:血清、尿液、细胞抽提物等[27] .(2)使大规模、超微量、高通量、全自动筛选蛋白质成为可能;(3)他不仅可发现一种蛋白质或生物标记分子,而且还可以发现不同的多种方式的组合蛋白质谱,可能与某种疾病有关[28] (4)推动基因组学发展,验证基因组学方面的变化,基于蛋白质特点发现新的基因.可以推测疾病状态下,基因启动何以与正常状态下不同,受到那些因素的影响,从而跟踪基因的变化[2,14,15] . 其存在的问题:对于不同的样本,根据检测的目标采取或者设计几种芯片,理论上可以把所有的相同性质蛋白质捕获,但是实际上仍有少量的分子没与表面探针结合.使用SELDI-TOF-MS,仅能给出蛋白质的分子量,不能给出C端、N端的序列,也没法知道蛋白质的构型,因此需要将蛋白质充分纯化后,用蛋白酶消化芯片上的蛋白质,分析肽段,再用生物信息学方法鉴定蛋白质序列[18,24] .另外,在国内,该芯片费用较高,分析质谱需要大量后续工作支持.
据美国物理学家组织网报道,北卡罗莱纳大学科学家的一项最新发现显示,细胞感染人类疱疹病毒(EBV)后,会产生小泡或被称为外体的液囊,从而改变细胞中所含的蛋白质和RNA(核糖核酸)。这种变质的外体一旦进入健康细胞,就能转变细胞的良性生长方式,使之变成不可控的致癌生长。这一发现刊登于美国《国家科学院院刊》网络版。EBV可能是世界上最成功的病毒,它无法被免疫系统彻底清除,几乎每个人终生都被它感染。它们不断进入唾液,在这里进行有效地传播。感染这种病毒很少致病,然而在几种主要的癌症中都发现了它的踪迹,包括淋巴瘤和鼻咽癌,它的蛋白质劫持了细胞生长调控机制,引发不可控的细胞生长,从而导致癌变。研究认为一种名为潜伏膜蛋白质1的蛋白质是EBV的致癌基因。通过外体,它们被传递给未受感染的细胞。研究人员还指出,EBV也彻底改变了外体的内含物,在细胞之间传递能激活癌症的蛋白质,这是值得注意的地方。这些发现表明,通过这种方式,病毒感染细胞能广泛影响并潜在控制全身其他细胞,引发它们的不可测生长。免疫系统不断地监视着外来病毒蛋白质,然而经外体携带的这些蛋白质可以不向免疫系统“报告”感染,并刺激癌细胞生长,由此容许了一种不可测的生长。该研究还显示,细胞能产生血管,这一被称为血管新生的过程很容易接受变质外体并引发潜在生长。北卡罗莱纳大学莱恩伯格综合癌症研究中心微生物与免疫学教授南希·瑞玻-特拉玻说:“外体就像特洛伊木马,EBV通过木马甚至能控制那些还没有感染的细胞。但重要的是,外体的产生可能为我们提供了一种新的治疗标靶,封锁它们就能控制癌症蔓延。”论文第一作者、瑞玻-特拉玻实验室博士后戴维·麦克表示,下一步研究是测定哪些蛋白质被选中进入外体,病毒如何控制了这些蛋白质,以及怎样才能遏制这一过程。
位于HIV病毒表面的糖蛋白gp120可让人体B免疫细胞失去活性,这是《自然—免疫学》Nature Immunology上一项研究给出的结论。这项发现解释了为什么HIV病人抗体反应比较弱。人们已经发现HIV能够引起CD4+辅助性T免疫细胞不断丧失,导致免疫系统功能受损、其他感染更容易乘机而入。但人们一直没有弄清为何在HIV感染早期,T细胞数量还处于相对正常时,人体就不产生有力的抗体反应了。Claudia Cicala与同事发现,HIV的gp120蛋白可通过宿主细胞表面受体α4β7直接作用于B细胞。通过α4β7将信号传递给B细胞,诱发一种免疫反应抑制分子和一种抑制受体的表达。这种由gp120引发的反应大大影响了B细胞活性并降低其产生病毒抗体的能力。
8.5,分子量3100Da,其中的2个Cys通过形成分子内二硫键使LfcinB一分子呈不完全的桶状,但研究表明,二硫键在抗菌过程中作用不大,被破坏后LfcinB的抗菌活性并不减弱。LfcinH来源于人乳铁蛋白的1-45位氨基酸,11与12位氨基酸残基之间的肽键断裂,两个肽片段靠二者间的二硫键连接成为一个分子。 LfcinB具有广谱抗菌活性,对革兰氏阳性菌和革兰氏阴性菌均有效,同时具有抗真菌、抗病毒、刺激细胞生长、参与免疫调节等多种生物学功能。 乳铁蛋白应用 乳铁蛋白出现在动物乳,特别是初乳中,为婴幼儿提供多种生物功能,尤其是调节免疫和对病原微生物的抵御功能。大量研究证明,出现在眼、呼吸道、消化道和生殖道中的乳铁蛋白为每天都有大量病原微生物入侵的黏膜系统,提供了第一道也是最重要的防线,因此乳铁蛋白的研究开发和应用,已经成为科学研究的焦点。 乳铁蛋白是从牛乳中提取的一种安全可靠的天然物质,其在食品方面的应用已得到许多国家和地区法律的承认。随着乳铁蛋白作用机制的不断阐明和开发应用范围的扩大,乳铁蛋白在疾病防治、营养补充、食品和药品防腐、化妆品等方面有广阔的应用前景。使用范围:婴儿配方奶粉,较大婴儿和幼儿配方奶粉最大使用量(g/kg): 30~100mg/100g