外泌体创新疗法:机遇、挑战和应对策略
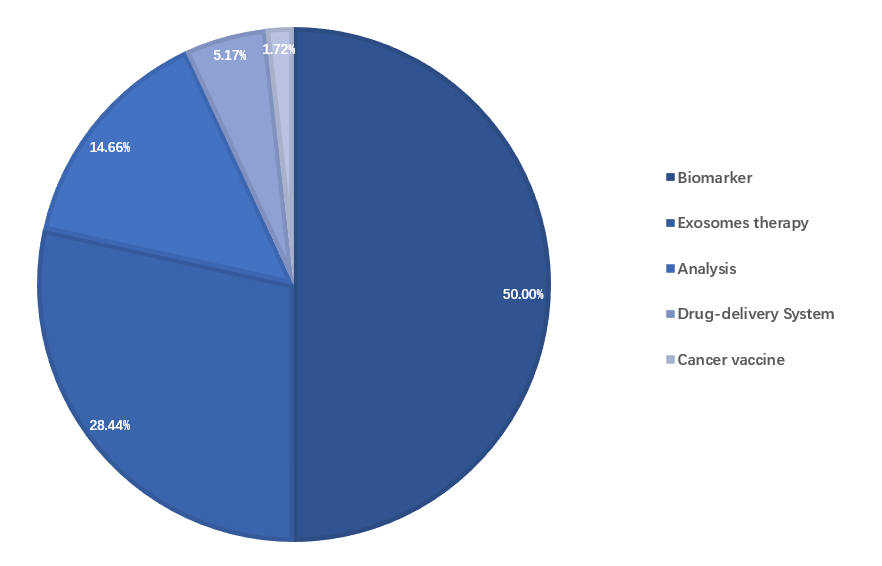
外泌体创新疗法:机遇、挑战和应对策略多宁生物科技外泌体是细胞外囊泡的一种亚型,后者是源自细胞的脂质双层闭合结构,几乎由所有类型的细胞分泌,包括外泌体(30-150 nm)、微泡(150 nm 至 1 μm)和凋亡小体(1-5 μm)。长期以来,这些囊泡被认为是一种装载细胞代谢废物的方式,负责运输细胞产生的废物。直到80年代,科研人员在研究绵羊网织红细胞的发育时,才初步确定了一些30-150 nm的囊泡的作用,并命名为外泌体。在电子显微镜下观察,外泌体的形状一般呈杯状或球状,其在细胞间保护和递送功能性大分子,包括核酸、蛋白质、脂质和碳水化合物,将它们的“货物”转移到受体细胞。基于外泌体的临床试验的分析(J. Rezaie, et al., 2022)基于多年的研究,行业已经认识到了外泌体在多种应用中的潜力。在目前的临床试验中,外泌体被用作生物标志物、无细胞疗法(外泌体疗法)、药物递送系统以及抗肿瘤疫苗等。其来源包括间充质细胞、T 细胞和树突状细胞以及其它工程细胞系。外泌体作为药物递送载体具有不可替代的优势,包括低免疫原性、优异的生物相容性和生物稳定性。除了使用未经任何基因/化学修饰的天然外泌体外,对于将有效载荷载入外泌体,主要有两种方式:在直接方法中,外泌体在制备和纯化后装载治疗药物(外源性加载),而在间接方法中,适当的细胞经过基因工程处理或与治疗药物共培养以产生工程外泌体(内源性加载)。将不同有效载荷加载到外泌体中的策略。A. 未经任何基因/化学修饰的天然外泌体。B. 通过亲代细胞工程(树突细胞、间充质干细胞、成纤维细胞和其它细胞)将货物装载到外泌体中。这种策略能够通过在外泌体生物发生之前简单地增加它们在亲代细胞细胞质中的浓度来加载核酸、蛋白质和/或小分子量药物,从而将所需分子包装到新形成的外泌体的腔中。C. 通过膜透化或加载策略将货物加载到外泌体(分离后)。这种策略能够通过被动或主动载荷装载方法装载核酸、蛋白质和/或小药物。然后细胞外环境中的外泌体可以被受体细胞吸收。(D. Ferreira, et al., 2022)对于外源性加载,行业已经探索了各种策略,以将药物加载到外泌体中,最大化其递送潜力,包括简单的孵育以及电转、超声处理、冻融等。研究之间通常存在一些差异,归因于不同的亲本细胞的生物学行为和试剂特性。此外,外泌体天生就装载有天然蛋白质和核酸,这大大降低了所需的载荷装载效率。实现最佳装载的正确方法,又在一定程度上取决于载荷分子,必须事先仔细选择,并且应该考虑负载能力、药物保留和对外泌体特性的潜在影响。直接加载策略的局限性限制了基于外泌体的疗法在临床试验中的使用。创建和使用合理且目的性设计、具有高度定义和可再现属性、同时具有一个已知作用机制的工程外泌体是天然源性外泌体的一个令人信服的替代选择,因为天然源性外泌体通常具有较高的异质性,且作用机制不明确,而工程外泌体对于重要新药物的开发来说,是更加可行的基础。但工程方法需要在维持理想的外泌体理化特性和提高装载效率方面实现一定的改进。而另一个挑战在于,大部分用于外泌体工程的方法都难以在稳定载入所需载荷以及表面修饰 vs. 保持外泌体生物相容性之间找到平衡。基于外泌体的治疗产品的cGMP生产流程(J. Rezaie, et al., 2022)在将基于外泌体的疗法扩展到工业规模生产并随后进入临床的另一个瓶颈是大规模临床级外泌体的产生。外泌体的产量高度依赖于其亲本细胞,受限于细胞分泌外泌体的能力不同以及大规模细胞培养的高难度和高成本。对于药用外泌体行业,扩大到工业水平仍处于起步阶段,最重要的是尽早决定能够生产所需数量并含有治疗性有效载荷的外泌体的方法。大规模外泌体分离方法的低效性是临床级外泌体开发的另一个障碍。不同细胞类型释放的外泌体的数量、物理化学特征和组成可能不同。目前,基于不同原理的技术已用于外泌体分离,包括差速/超速离心、过滤、尺寸排阻层析、基于免疫亲和捕获、聚合物沉淀等。尽管已经开发并优化了一些外泌体纯化方法,但仍然很难找到一种特定的方法解决所有相关的挑战,如分离效率低、样品损失、外泌体回收率和纯度低、以及批次间差异。相应地,全面表征外泌体也至关重要,特别是在大小、形态、浓度、外泌体标记物/内容物的存在以及污染物的去除方面。常用的外泌体分离方法及其优、缺点虽然仍存在挑战和限制,但各种制药公司和初创企业已经铺平了临床级外泌体疗法的发展之路。越来越多的公司专注于开发此类基于外泌体的疗法,以解决各种疗法的药物输送问题,包括小分子、RNA 疗法、蛋白质、病毒基因疗法,甚至成簇规律间隔的短回文重复序列 (CRISPR) 基因编辑工具。其中一些公司也在寻求更加创新的外泌体工程方法来设计基于外泌体的治疗药物,以增加载药量,提高靶向能力。递送 RNA、蛋白质和化学药物的传统方法已经显示出一些局限性,而外泌体作为药物递送载体具有免疫原性低、长期安全和无细胞毒性等巨大优势,在基于外泌体的药物在临床转化、大规模生产、稳定的制备、存储方案和质量控制方面仍存在必须克服的挑战。进一步开发细胞衍生的工程外泌体及其分离、纯化和药物装载技术将有助于克服这些缺点。工程外泌体在提高生产力方面具有显著的商业优势。此外,通过将特定的表面分子锚定在外泌体上,可以增加外泌体在靶细胞或目标疾病部位的局部浓度,从而降低毒性和不良反应,并最大限度地提高治疗效果。未来,行业将可能开发新型多功能化工程外泌体来改善医疗保健,因此,需要进一步的研究来探索外泌体介导疗法的新策略。参考文献:D. Ferreira, J.N.Moreira, L.R. Rodrigues, New advances in exosome-based targeted drug delivery systems. Critical Reviews in Oncology / Hematology, 2022,172:103628.J.Rezaie, M. Feghhi, T.Etemadi, A review on exosomes application in clinical trials: perspective, questions, and challenges. Cell Communication and Signaling, 2022: 20:145.S.Bashyal, C.Thapa, S.Lee, Recent progresses in exosome-based systems for targeted drug delivery to the brain. Journal of Controlled Release, 2022, 348:723-744.