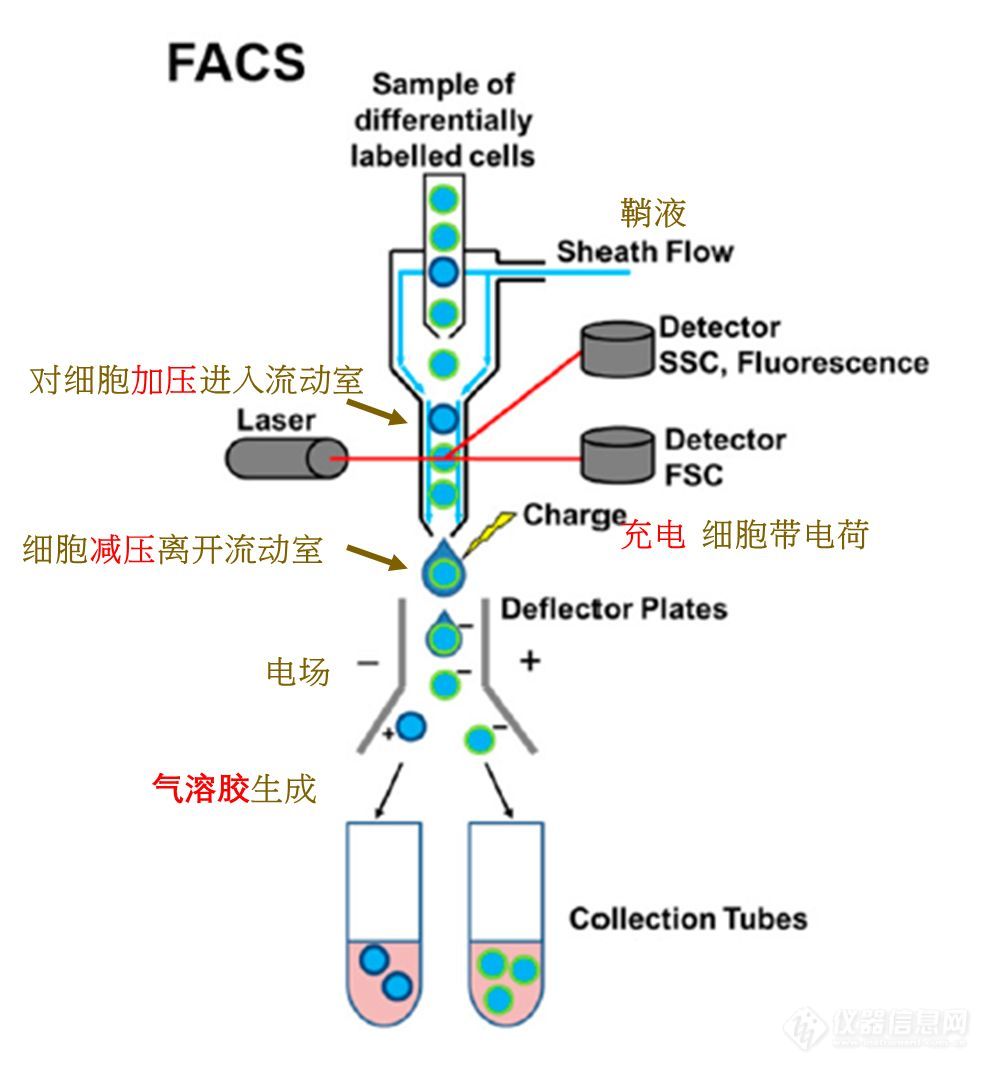
【视频回看】微流控芯片、拉曼SERS、流式细胞术、膜片钳?“花样”单细胞分析前沿技术都给你!
p style=" text-align: justify text-indent: 2em " 细胞是生物体和生命活动的基本单位,细胞分析对于细胞结构和功能的研究、生命活动规律和本质的探索、疾病的诊断与治疗、药物的筛选与设计等都具有十分重要的意义。作为细胞研究的“标配”,创新细胞分析技术在生命科学基础研究、生物制药、新型治疗方法中的应用与进展不可不知! /p p style=" text-align: justify text-indent: 2em " 仪器信息网举办的“细胞分析技术与应用”专题网络研讨会在6月5日成功召开,本次会议报告干货十足,诚意满满,对广大细胞分析领域用户的研究工作具有一定指导意义。错过了直播的小伙伴不要遗憾,部分专家的精彩报告视频回放即刻奉上! /p p style=" text-align: center " span style=" color: rgb(192, 0, 0) " strong 报告题目:《单细胞试剂盒分析》 /strong /span /p p span style=" color: rgb(192, 0, 0) " strong /strong /span /p p style=" text-align: center" img style=" max-width: 100% max-height: 100% width: 200px height: 212px " src=" https://img1.17img.cn/17img/images/201906/uepic/c6e217a3-3a1c-404e-ab9a-af4cc9876f3b.jpg" title=" 001.jpg" alt=" 001.jpg" width=" 200" height=" 212" border=" 0" vspace=" 0" / /p p style=" text-align: justify text-indent: 2em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 江德臣,南京大学化学化工学院及生命分析化学国家重点实验室教授,博士生导师,单细胞分析课题组组长,教育部青年长江学者,江苏省化学化工学会质谱专业委员会秘书长。研究兴趣为高内涵单细胞分析方法和装置的建立,及其在细胞信号传导机制研究中的应用。以第一/通讯作者在PNAS、JACS、Anal Chem 等期刊发表学术论文50余篇。 /span /p p style=" text-align: justify text-indent: 2em " 单细胞分析可以揭示细胞个体特征,以助于理解细胞自身的复杂性及彼此之间存在巨大差异,具有重要的生物学价值。在过去的六年中,江德臣教授所在实验室发展了基于微/纳试剂盒的单细胞分析策略,将宏观维度生物测量理论与方法引入单细胞分析中,建立了通用性强、通量高且可测量单细胞及单细胞器内生物分子活性的新型分析方法和装置。 span style=" color: rgb(192, 0, 0) " strong a href=" https://www.instrument.com.cn/webinar/video_105263.html" target=" _blank" ( span style=" color: rgb(0, 112, 192) " 点击查看视频回放 /span ) /a /strong /span /p p style=" text-align: center " span style=" color: rgb(192, 0, 0) " strong 报告题目:《微流控芯片单细胞分泌分析》 /strong /span /p p style=" text-align: center" img style=" max-width: 100% max-height: 100% width: 200px height: 239px " src=" https://img1.17img.cn/17img/images/201906/uepic/c6f4bf34-0adc-48e7-aa50-6026304a3bef.jpg" title=" 陆瑶.jpg" alt=" 陆瑶.jpg" width=" 200" height=" 239" border=" 0" vspace=" 0" / /p p style=" text-indent: 2em " span style=" text-align: justify font-family: 楷体, 楷体_GB2312, SimKai " 陆瑶,博士, 副研究员,中国科学院大连化学物理研究所单细胞分析研究组组长。研究相关工作发表于PNAS,Science Signaling等国际期刊,主要科研成果在美国两家公司获得应用,作为主要发明人参与开发的单细胞蛋白分析技术获国际发明专利授权,目前已应用于CAR-T肿瘤免疫治疗药品开发及临床测试,被美国著名科普杂志科学家(The Scientist)评选为2017年度十大医疗技术发明首位。现主要从事基于微流控芯片的单细胞分析技术开发及其在人类健康/疾病相关问题中的应用等研究。 /span br/ /p p style=" text-align: justify text-indent: 2em " 细胞是生命存在的基础,探索生命健康与疾病常需要以细胞研究为基础。由于细胞与细胞之间存在差异,群体细胞的研究结果只能得到一群细胞的平均值,这往往会掩盖个体差异信息。为更全面的了解细胞以服务人类健康、疾病研究,单细胞分析就变得尤为必要。在过去的几年中,陆瑶老师团队开发了一系列的基于抗体条形码微流控芯片的高通量、高内涵单细胞细胞分泌分析工具,大大加深了人们对细胞分泌异质性的认识,并尝试将其服务临床实现个体化、精准医疗。 span style=" color: rgb(0, 112, 192) font-size: 14px " strong span style=" color: rgb(0, 112, 192) " (含未公开发表内容,暂不提供回放视频) /span /strong /span /p p style=" text-align: center " strong span style=" color: rgb(192, 0, 0) " 报告题目:《拉曼单细胞流式分选技术及应用》 /span /strong /p p style=" text-align: center" img style=" max-width: 100% max-height: 100% width: 200px height: 240px " src=" https://img1.17img.cn/17img/images/201906/uepic/e7fe07cf-f676-4425-985b-a6b1b99d2bc7.jpg" title=" 马波.jpg" alt=" 马波.jpg" width=" 200" height=" 240" border=" 0" vspace=" 0" / /p p style=" text-indent: 2em " span style=" font-family: 楷体, 楷体_GB2312, SimKai text-indent: 2em text-align: justify " 马波,研究员,博士生导师,中科院青岛生物能源与过程研究所微流控系统团队负责人。自2003 年起致力于微流控芯片技术在分析化学和生命科学中的基础和应用研究。目前研究方向聚焦在:基于微流控技术的高通量单细胞分析技术和仪器研究,研制了首套拉曼单细胞流式细胞分选仪;用于临床、环境和食品安全的便携式微生物检测系统;工业酶、菌株和微藻的高通量筛选、选育和定向进化研究等。 /span /p p style=" text-align: justify text-indent: 2em " “单细胞拉曼图谱” 是特定细胞的“化学指纹”,蕴含着该特定细胞在特定生理状态下的丰富的生化信息,通过体现细胞化学组成及其变化,能够静态和动态地表征和监测该细胞的遗传背景、生理状态及所处微环境。与现有荧光细胞分选技术FACS相比,拉曼激活单细胞分选RACS 具有无损非标记的特点。因此,马波教授团队先后研发了单细胞拉曼光镊液滴分选、高通量流式拉曼单细胞分析与分选及单细胞测序等系列关键技术,并于新近推出了单细胞拉曼分选耦合测序的RACS-SEQ系统,同时提供适用于拉曼抗生素耐药性快检、单细胞测序的芯片和试剂盒。该仪器及试剂盒将为耐药性快速检测、合成生物学细胞工厂表型筛选、工业菌株和高通量酶定向进化和筛选等提供创新的系统解决方案。 strong span style=" font-size: 14px color: rgb(0, 112, 192) " (含未公开发表内容,暂不提供回放视频) /span /strong /p p style=" text-align: center " strong span style=" color: rgb(192, 0, 0) " 报告题目:《肿瘤靶向的拉曼SERS探针和拉曼微球的构建和应用》 /span /strong /p p strong span style=" color: rgb(192, 0, 0) " /span /strong /p p style=" text-align: center" img style=" max-width: 100% max-height: 100% width: 200px height: 242px " src=" https://img1.17img.cn/17img/images/201906/uepic/7c59cb63-76ee-4bdd-ba86-db17ae600e1e.jpg" title=" 汤新景.jpg" alt=" 汤新景.jpg" width=" 200" height=" 242" border=" 0" vspace=" 0" / /p p style=" text-align: justify text-indent: 2em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 汤新景,博士,北京大学药学院教授,长江学者奖励计划青年学者,国家优秀青年科学基金获得者,教育部跨世纪(新世纪)人才。近年来,在反义核酸药物及非编码RNA等功能核酸的定点修饰及其功能的精确光调控、新型荧光核酸探针和新型肿瘤靶向的光学纳米探针等方面开展了一系列的研究工作。 /span /p p style=" text-align: justify text-indent: 2em " 拉曼纳米探针基于其高的光谱分辨率和深的组织穿透性而被广泛应用于生物体系。目前大多数的拉曼纳米探针是利用增敏金属表面负载的染料分子,且拉曼信号位于1400-1700 cm-1 范围内。鉴于此,汤新景教授设计并构建了一系列基于生物体系拉曼信号静默区(1900-2500 cm-1)的拉曼报告基团的金纳米拉曼探针以及无需金属增敏的拉曼纳米微球。通过进一步的拉曼纳米探针表面的靶向修饰和功能化,实现对肿瘤细胞、组织以及活体小鼠的特异性拉曼光谱检测或拉曼成像。 a href=" https://www.instrument.com.cn/webinar/video_105271.html" target=" _blank" style=" text-decoration: underline color: rgb(0, 112, 192) " span style=" color: rgb(0, 112, 192) " strong (点击查看视频回放) /strong strong /strong /span /a /p p style=" text-align: center " span style=" color: rgb(192, 0, 0) " strong 报告题目:《肝细胞移植治疗肝衰竭的问题和策略》 /strong /span /p p style=" text-align: center" img style=" max-width: 100% max-height: 100% width: 200px height: 239px " src=" https://img1.17img.cn/17img/images/201906/uepic/bd1cd376-e0ab-4ac6-8ad6-43c62228704c.jpg" title=" 何志颖.jpg" alt=" 何志颖.jpg" width=" 200" height=" 239" border=" 0" vspace=" 0" / /p p style=" text-indent: 2em " span style=" font-family: 楷体, 楷体_GB2312, SimKai text-align: justify text-indent: 2em " 何志颖,研究员,博士生导师。同济大学附属东方医院再生医学研究所执行所长、课题组长,同济大学东方临床医学院生物技术教研室主任。入选上海市浦江人才计划等。现任中华医学会医学细胞生物学分会委员、中国整形美容协会干细胞研究与应用分会副秘书长等。科研上以干细胞与肝脏再生为研究方向,开展肝细胞移植基础和应用研究,致力肝脏疾病的细胞治疗。在Nature,Cell Stem Cell,Gastroenterology等期刊发表SCI论文37篇。 /span /p p style=" text-align: justify text-indent: 2em " 肝衰竭是多数肝脏疾病重症化的共同结局,肝细胞移植治疗肝衰竭成为新的希望。如何获得非供体来源的肝细胞、提高移植肝细胞在宿主肝脏中的植入和增殖效率及开展活体示踪评价细胞移植的安全性等,成为肝细胞移植应用于临床迫切需要解决的主要问题。何志颖老师在报告中分享了应用多能干细胞肝向诱导分化、肝向谱系重编程等方案,获得充足的非供体来源的肝系细胞;通过局部磁场干预促进移植肝细胞在受体肝脏的植入效率;通过基因修饰或在受体肝脏释放生长因子促进移植肝细胞的增殖能力,寻找特异标志物分选具有肝脏再殖能力的肝系细胞,实现了移植肝细胞在受体肝脏的有效再殖;最后,应用活体生物体内发光成像系统,何志颖教授对肝细胞移植后在体内的分布进行了动态观察,开展了肝细胞移植后在肝脏中归巢与再殖规律的研究。 a href=" https://www.instrument.com.cn/webinar/video_105264.html" target=" _blank" style=" color: rgb(0, 112, 192) text-decoration: underline " span style=" color: rgb(0, 112, 192) " strong (点击查看视频回放) /strong strong /strong /span /a /p p style=" text-align: center " span style=" color: rgb(192, 0, 0) " strong 报告题目《质谱对大脑代谢通路的解析——从单细胞分析到组织成像》 /strong /span /p p style=" text-align: center" img style=" max-width: 100% max-height: 100% width: 200px height: 239px " src=" https://img1.17img.cn/17img/images/201906/uepic/bf5f8e7b-bab1-45d3-9b30-42440313e939.jpg" title=" 黄光明.jpg" alt=" 黄光明.jpg" width=" 200" height=" 239" border=" 0" vspace=" 0" / /p p style=" text-align: justify text-indent: 2em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 黄光明,中国科学技术大学化学系教授,博士生导师。2001及2004年先后在北京师范大学获分析化学学士和硕士学位,2007年在清华大学获得博士学位。2012-今在中国科学技术大学化学系任教。于2013年入选中组部第四批“青年千人计划。美国质谱协会会员,中国质谱分析专业委员会委员。长期从事质谱分析及其化学、生命科学等领域的应用研究。目前主要承担国家自然科学基金青年及面上项目,中组部千人计划以及科技部重大研发计划子课题等课题。在Cell,PNAS,Angew. Chem. Int. Ed.,Anal. Chem.,Chem. Sci., Chem. Comm. 等国际期刊上发表论文50余篇,引用1200余次。于2018年获得中国质谱学会首届“质谱青年奖”。 /span /p p style=" text-align: justify text-indent: 2em " 针对单细胞分析中的一系列技术难题,黄光明教授通过兼容膜片钳技术实现了活体细胞原位取样,并结合毫秒级超快电泳分离技术,搭建了单细胞质谱分析平台。利用该平台实现了对脑切片组织样品上的单个神经元细胞研究,在脑内发现了一条新的谷氨酸合成通路,阐释了其促进学习记忆功能的分子机制,为在单细胞内开展代谢通道研究提供了新的研究平台。 a href=" https://www.instrument.com.cn/webinar/video_105270.html" target=" _blank" style=" color: rgb(0, 112, 192) text-decoration: underline " span style=" color: rgb(0, 112, 192) " strong (点击查看视频回放) /strong /span /a /p p style=" text-align: justify text-indent: 2em " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 虽然会议已经结束,但是精彩仍在继续,仪器信息网已经将部分报告老师的现场讲座视频上传到仪器信息网网络讲堂,想要重复学习或者错过参与会议直播的网友,可以点击报告视频精彩回放进行学习与分享。 /span span style=" font-family: 楷体, 楷体_GB2312, SimKai color: rgb(0, 0, 0) " 更多专家报告请点击查看: /span a href=" https://www.instrument.com.cn/news/20190612/486910.shtml" target=" _blank" style=" text-decoration: underline border: 1px solid rgb(0, 0, 0) " span style=" border: 1px solid rgb(0, 0, 0) " i strong span style=" border: 1px solid rgb(0, 0, 0) color: rgb(192, 0, 0) font-family: 楷体, 楷体_GB2312, SimKai " 【视频回看】单细胞原位、定量分析、无损分选,还有?“最夯”重器都在这儿! /span /strong /i i strong span style=" border: 1px solid rgb(0, 0, 0) color: rgb(192, 0, 0) font-family: 楷体, 楷体_GB2312, SimKai " /span /strong /i /span /a /p p style=" text-align: center " span style=" text-decoration: underline " & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp & nbsp /span br/ /p p style=" text-align: center " strong 关注 span style=" color: rgb(192, 0, 0) " 【3i生仪社】 /span 解锁生命科学新鲜资讯! /strong /p p strong /strong /p p style=" text-align: center " img style=" max-width:100% max-height:100% " src=" https://img1.17img.cn/17img/images/201906/uepic/bb3dca69-d424-4faa-b6d3-f9b9d6eee2d8.jpg" title=" 小icon.jpg" alt=" 小icon.jpg" / /p