显微镜界的“黑科技”:3D超分辨成像系统
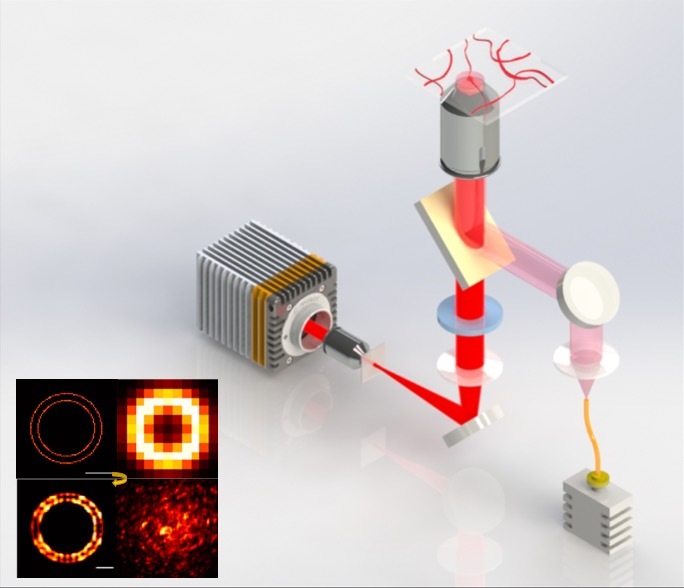
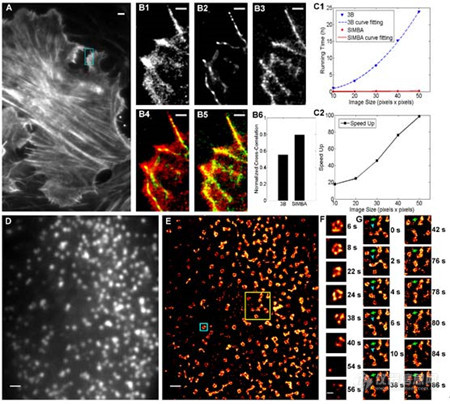
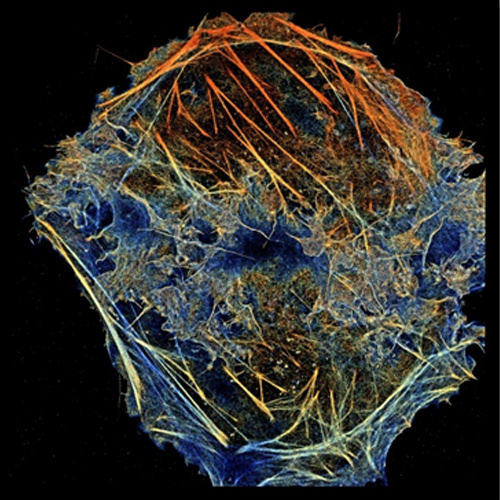
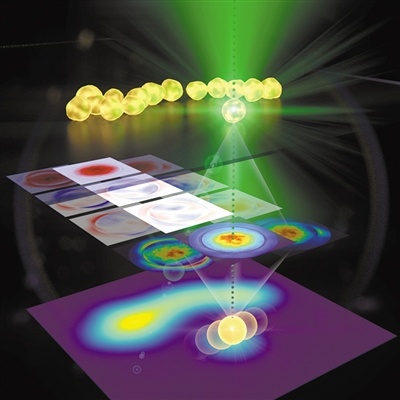
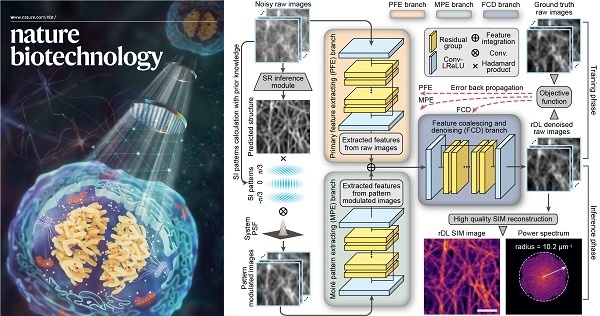
近, 法国abbelight公司研发的模块化多功能单分子定位显微 (SMLM)系统凭借其有的DAISY等技术在3D超分辨成像领域取得重大突破,在学术界引起了广泛的关注。该系统次实现在三维空间上的15 nm超3D定位;且因为模块化设计具有高兼容,仅需使用一个c-mount接口即可将客户的倒置荧光显微镜升成超分辨显微镜,是佳的超分辨搭建方案。 轴向延伸 定位Abbeligh公司系列超分辨模块采用了先进且特的双通路DAISY技术能够将以往定位不佳的Z轴精度提高到15 nm,真正实现三维空间上的15 nm超3D定位。同时此技术巧妙地结合DONALD和SAF技术的优势,有效解决采集过程中的热漂移和多色成像中不同波长激光位置不同等问题,大幅度提高了长时间和多色成像的度,并且还可实现多4色的同时3D成像。超大视野 图像采集在光路方面,SAFe light 能够实现在较低激光能量下对大视野图像的均匀照射。这使得abbelight能够在不增加采集时间的前提下,一次性采集200 × 200 μm2 范围内的图像,并且能够保证图像照射光的整体均一性。灵活兼容 轻松升abbelight具有高度兼容性,仅需使用一个c-mount接口即可将您的倒置荧光显微镜升成超分辨显微镜,并且基本不会破坏显微镜的原有功能,节约您的预算与空间。(除了模块外,abbelight也提供完整的超分辨系统)先进软件 功能强大abbelight 同时还是一台十分简便易用的设备,该设备的NEO软件简单、直观、优化良好,可提供全面的参数控制命令、实时3D漂移校正、实时3D重构图像、高速3D定位图像处理、空间分析和测量、分辨率计算等功能。初次应用 轻松上手对于超分辨中的光漂问题,abbelight的商业化成像液能够有效的降低成像过程中的光漂作用。对于初学者来说,abbelight 还提供全面的技术支持,帮助您快速的建立自己的超分辨观测方法,打开超分辨大门,助力科之路。【新发表文章】[1]. Belkahla, Hanen, et al. "Carbon dots, a powerful non-toxic support for bioimaging by fluorescence nanoscopy and eradication of bacteria by photothermia." Nanoscale Advances (2019).[2]. Jimenez, Angélique, Karoline Friedl, and Christophe Leterrier. "About samples, giving examples: Optimized Single Molecule Localization Microscopy." bioRxiv (2019): 568295.[3]. Cabriel, Clément, et al. "Combining 3D single molecule localization strategies for reproducible bioimaging." Nature communications 10.1 (2019): 1980.[4]. Capmany, Anahi, et al. "MYO1C stabilizes actin and facilitates the arrival of transport carriers at the Golgi complex." J Cell Sci 132.8 (2019): jcs225029.