国信证券-高速增长的中国抗肿瘤药行业-生命不息,追求不止-0902017【资料名称及年份】:国信证券-高速增长的中国抗肿瘤药行业-生命不息,追求不止-0902017【文件格式】:pdf【页数/文件数/大小】:53/1/1101K【数据来源】:国信证券上篇:高速增长的抗肿瘤药行业1、肿瘤与抗肿瘤药物概述(6)2、世界抗肿瘤药物市场的现状与发展(8)3、我国抗肿瘤药物市场处在高速增长期(12)4、国内抗肿瘤用药类别分析(18)5、本土企业享主流品种优势,面临多重机遇(20)6、行业风险分析(25)下篇:公司案例分析1、瑞士罗氏(26)2、恒瑞医药(29)3、海正药业(40)4、一致药业(46)5、兰生股份(47)6、先声药业(48)7、海南海药(49)8、华神集团(49)9、铭源医疗(50)这个内容较多就不贴出了~~下载地址:[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=171751]国信证券-高速增长的中国抗肿瘤药行业-生命不息,追求不止-0902017[/url]
[size=24px][b]课程详情[/b][/size]肿瘤的发生及发展机制是当前生命科学和基础医学的重要研究领域,对应的抗肿瘤药物和细胞治疗方法的研发也是行业研究热点。本次讲座将围绕肿瘤细胞和细胞治疗研究方法,介绍赛多利斯提供的活细胞水平检测方法及整体解决方案。[size=18px][b]讲师简介:[/b][/size]黄雯琪:黄雯琪,女,就职于赛多利斯公司生物分析部门,负责细胞检测产品线的应用支持、产品培训等业务,在细胞生物学检测技术及实验方法方面具有丰富的经验。[size=18px][b]相关领域:[/b][/size](生物产业)-(综合)[size=18px][b]相关仪器:[/b][/size](生命科学仪器及设备)-(细胞生物学仪器)-(高内涵细胞成像分析系统)点击链接立即报名:[url]https://www.instrument.com.cn/webinar/meeting_13888.html[/url]
[font=&][size=16px][color=#343a40] 肿瘤免疫治疗是一种利用人体免疫系统来战胜肿瘤的治疗方案。成功与否的关键就在于免疫系统能否被激活到足够去特异性地杀死肿瘤的程度。在临床实验前,人们需要借助体外实验先行评估治疗方案的效力。 Axion BioSystems公司革命性地推出了使用生物电感应技术的Maestro Z/ZHT平台,完美具备评估体外效力的必要条件。它能在免除标记物影响的同时,在长达几天的时间中,以非侵入的方式对细胞的健康和活动开展监测,并自动且实时地获得多至384个样本的完整实验信息。其秘诀就是通过埋设在微孔板底部的高灵敏度电极来进行生物电阻抗的测试。这种技术能够追踪微小的细胞变化,从而能够揭示出远低于其它技术最低检出限的生物学信息。[/color][/size][/font][font=&][size=16px][color=#343a40][b]--利用Maestro Z/ZHT评估T细胞对胶质母细胞瘤的杀伤效力(car T治疗):[/b][/color][/size][/font][font=&][size=16px][color=#343a40][b]人体免疫系统中的效应T细胞,对肿瘤细胞有着高特异性和与生俱来的细胞毒性,在未来的脑胶质瘤治疗中被人们寄予很高的期望。Maestro Z的阻抗测试有着高灵敏、无标记及无损的特点,能够实时监测肿瘤细胞的增殖和T细胞介导的细胞溶解等过程,在体外评估免疫治疗的效价方面有着突出的优势。美国乔治亚大学的科学家们借助Maestro Z平台,对不同条件活化后的T细胞,开展了恶性胶质母细胞瘤杀伤效力的对比评估。详情点击:[url=http://www.axionbio.cn/page_1.html]CAR-T治疗 (axionbio.cn)[/url][/b][/color][/size][/font][font=&][size=16px][color=#343a40][/color][/size][/font][font=&][size=16px][color=#343a40][b]--利用Maestro Z 评估药物对COVID-19病毒感染力的中和作用:[/b][/color][/size][/font][color=#343a40][b][font=&][size=16px]病毒学研究的重点就在于开发抗病毒药物用于预防和治疗病毒感染。其中的挑战在于筛选到能够选择性抑制病原体复制并对宿主没有损害的化合物。病毒导致的细胞病变效应(CPEs)常常和靶细胞在形态、胞间贴合度、附着力及活力等方面的变化相关联。研究者可在体外联合使用宿主细胞、病原体和药物来模拟三者在体内的互作,借助 Maestro Z 定量CPE引起的阻抗变化。轻松实现在筛选药效的同时,完成安全性的初步评沽。[b]详情点击:[/b][url=http://www.axionbio.cn/page_4.html]page_4 - (axionbio.cn)[/url][/size][/font][/b][/color][font=&][color=#343a40][b][font=&][/font][/b][/color][/font]
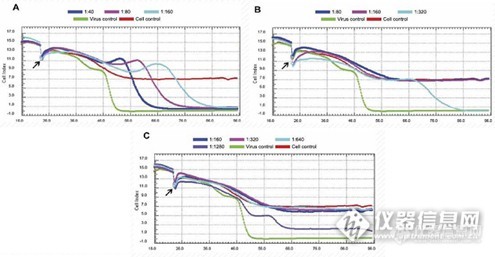
【线上讲座233期】实时细胞分析技术在肿瘤研究和病毒抗体疫苗检测中的应用 主讲人:周尧 活动时间:2013年10月9日-10月19日 热烈欢迎 周尧 老师光临生命科学仪器版面进行讲座!http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif引言实时无标记细胞分析技术(RTCA, Real Time cell Analysis)是艾森生物全球独有的专利核心技术,该技术采用特殊工艺,将微电极列阵整合在细胞培养板的每个细胞生长孔底部,用以构建实时、动态、定量跟踪细胞形态和增殖分化改变的细胞阻抗检测传感系统。该技术可广泛应用于生物活性因子测定、细胞增殖检测、大规模抗肿瘤药物筛选、细胞毒性检测等研究。http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif提要一、 实时细胞分析技术原理 1.传统终点检测与实时无标记动态检测 2. 实时细胞分析技术原理 3. 实时细胞分析技术优势二、 实时细胞分析技术平台产品简介三、 实时细胞分析技术在肿瘤、药物细胞毒性检测领域的应用 1.RTCA实时动态细胞毒性检测 2.肿瘤与微环境之间的相互作用RTCA实时动态检测 四、 实时细胞分析技术在病毒、细胞毒素、中和抗体及疫苗检测与评估领域的应用 1.RTCA实时动态检测病毒Cytopathic Eff ect效应 2.RTCA实时定量检测病毒侵染效力及评估中和抗体效价http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif提问时间:2013年10月09日--10月19日答疑时间: 2013年10月09日--10月19日特邀佳宾:生命科学仪器版面版主、专家以及同行们参与人员:仪器论坛全体注册用户活动细则:1、请大家就ATR技术知识的相关问题进行提问,直接回复本帖子即可,自即日起提问截至日期2013年10月19日2、凡积极参与且有自己的观点或言论的都有积分奖励(1-50分不等),提问的也有奖励在活动期间我们将评选出20名积极参与奖和5名精彩问答奖。3、提问格式:为了规范大家的提问格式,请按下面的规则来提问 :周尧老师您好!我有以下问题想请教,http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif说明:本讲座内容仅用于个人学习,请勿用于商业用途,由此引发的法律纠纷本人概不负责。虽然讲座的内容主要是对知识与经验的讲解、整理和总结,但是也凝聚着笔者大量心血,版权归tianzhen老师和仪器信息网所有。本讲座是根据笔者对资料的理解写的,理解片面、错误之处肯定是有,欢迎大家指正。http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647975_2685866_3.gif
【序号】:2【作者】:张雷郝纯毅李洁【题名】:北京大学肿瘤医院真实世界研究现状及伦理审查要点分析【期刊】:中国研究型医院. 【年、卷、期、起止页码】:2023,10(03)【全文链接】:https://kns.cnki.net/kcms2/article/abstract?v=3uoqIhG8C44YLTlOAiTRKu87-SJxoEJu6LL9TJzd50lxO_K65PufC5unjo06NdhQUnipF9gHud_3GjH0-dPqRApWSciG8hGC&uniplatform=NZKPT
[font=Calibri][size=10.5pt][font=宋体]仪器信息网于[/font]5[/size][/font][font=Calibri][size=10.5pt][font=宋体]月[/font]19[font=宋体]日组织召开[/font][b] “安捷伦免疫治疗与肿瘤免疫细胞分析”网络研讨会[/b][/size][/font][font=Calibri][size=10.5pt][font=宋体],特邀嘉宾[url=https://www.instrument.com.cn/webinar/meetings/News/expert?id=3142]David Ferrick(安捷伦)[/url][/font][font=宋体],带来报告[b]《[url=https://www.instrument.com.cn/webinar/meetings/News/expert?id=3142]调谐免疫细胞效力、命运和适应性的代谢驱动因素[/url]》[/b];[/font][/size][/font][font=宋体]欢迎感兴趣的你,报名参会![/font][url=https://www.instrument.com.cn/webinar/meetings/6604/][b][u][font='Times New Roman'][color=#0563c1]https://www.instrument.com.cn/webinar/meetings/immunotherapy/[/color][/font][/u][/b][/url]
美国杜克大学医学中心的研究人员设计出了一种新的肿瘤靶向疗法,试图通过附着在活体肿瘤RNA上的适配分子,直接将药物传送至肿瘤所在的位置,以达到治疗的效果。相关文章发表在11月29日《自然·化学生物学》杂志的在线版上。 适配分子是RNA中的一小部分,通常附着于蛋白质等特定的目标分子上。其简单易用,可轻易再生和修改,对抗体等其他介质的兼容性很强。值得注意的是,适配分子对免疫系统的侵害很小,这为其成为肿瘤诊断和治疗的重要候选途径增加了关键的筹码。 研究人员对患有肝癌的啮齿类动物体内的适配分子进行了筛选。这类肿瘤属于转移性肿瘤,通常由结肠癌瘤所致。他们从肿瘤中分离出特定的RNA,将其扩展化,并重新植入,以确定哪类分子与肿瘤的RNA附着最紧密。经过多次测试后,科学家找到了与肿瘤蛋白契合度最好的适配分子,其可附着在RNA内特定的解旋酶P68上。该解旋酶为结直肠瘤产生的核内蛋白。 研究人员表示:“十分重要的是,在甄选过程之前,研究人员并不需要对疾病中的蛋白质变化有深入的了解,这大大简化了分子探针的发展过程。被选定的适配分子可用于发掘之前并未与疾病相关联的蛋白质,这将对提高寻找有效肿瘤疗法的速率有所裨益。” 作为肝胆肿瘤领域的专家,布赖恩·克莱里博士也谈到,这种适配分子不仅能附在细胞培养状况下生成的P68蛋白上,还能直接附着于活体内的肿瘤,对于乳腺癌和肺部肿瘤等疾病也有良好的适用性。其下一步的研究方向是在需要时,适配分子如何能将具有杀死肿瘤功能的试剂准确传送至患处。
我国抗肿瘤药市场新霸继承中破局 文章来源:医药经济报 发布时间:2010-02-25 中国抗肿瘤药市场一直是商家觊觎的重点,一支又一支营销大军在这片市场上辛苦耕耘,他们在创新营销模式的同时收获着真金白银,但也遭到了不断的曝光与质疑,和其他领域的产品一样,风光依旧,但收获日渐减少。众多刚刚踏入抗肿瘤领域的产品频频遭遇“滑铁卢”,重拾昔日辉煌成为抗肿瘤产品营销人的一个梦。 笔者所在营销机构在调研与分析中国北方大部分市场后得出结论:中国抗肿瘤药市场仍有可为,肿瘤药市场产生新霸主并非幻想,实现这一点一方面需要继承,另一方面需要破局,完成以下四个过程。 破局:勤反省,除定势 抗肿瘤产业的破局需要一次彻底的破冰行动,从投资人到经理人,从策划人到市场人,都要从指导思想到行动进行一次彻底的反省运动,打破头脑中的定势思维,从市场与消费者的角度重新审视这个领域,基于目前新的市场形势结合企业与产品自身的特色思考营销。 首先,破思维局。抗肿瘤产品一定要开会,一定要讲课,一定是高价,一定是首次消费量大于回购量,这些定势的思维模式已经在肿瘤药市场营销人的心目中根深蒂固,于是所有的肿瘤企业都在抢新病人,都在讲转移与复发,都在谈放化疗,都在讲效果,就连没有任何医学常识的人也知道抗肿瘤产品要从这几个点抓起。这种思维决定了竞争的激烈性,大家都在这几只碗里抢饭吃,互相攻击,互相拆台,抢专家、抢病人、抢肿瘤医院的有利位置(认为只要在肿瘤医院门口占有一席之地就可以抢占先机),其理由无非是几只规模稍大的抗肿瘤产品销售企业都这么做,重量级不对等的较量由此引发。这种思维造成了整个行业的恶性竞争,此局不破,竞争将更为惨烈。 其次,破模式局。为了快速起动市场,后来企业从几家肿瘤药生产企业的“前辈”中挖人,但这些人只会照搬老东家的理论、模式、方法与专家,只会开会、讲课、咨询、回访,似乎离开了这几种已经成型的模式,抗肿瘤产品就再无生存之路,不开会就不会销售,没有回访就没有二次销售,没有新病人销售量就不会提高。因为肿瘤病人生存率低,必须不断充实数据库才有长远发展的后劲,忽略了现有数据库的利用率,忽略了现有生存消费者的影响力,忽略了口碑在消费者中的传播速度与影响,只顾埋头整理会议内容、收集消费者资料,机械地重复昨天的工作,以数字的增加证明工作业绩的存在,忘记了最本质的东西??销售。要知道,手中掌握的消费者资料只是目标人群,而将目标人群转化成为消费人群还需要做更多细致的工作。 再次,破策划局。抗肿瘤产品做得好,是因为策划到位。一提到策划,好多人想到的只是策划的最后阶段??表现:几篇排好版的文案,而文案不外乎《肿瘤病人有救了》、《肿瘤治疗新方法》,外加几则肿瘤病人的康复介绍,这些文案不过是衬托会议、招人的方法而已,完全没有放开策划思路、整合资源与营销模式。说到底,这样的策划在十几年前是有效的,现在却并不如人意,一味模仿《别让肿瘤把俺娘带走》、《为肿瘤病人盗仙草》的风格,一则消费者已经司空见惯,二则原有的市场环境已然不在,怎能引起消费者的共鸣? 最后,破行为局。产品销售需要销售氛围,某公司销售现场一家祖孙三代人下跪谢专家的场景让很多人感慨,更让很多人效仿,但并非所有人都是好演员,表演与做秀是需要水平的。目前,很多企业都请了托儿来冒充典型病例,这种伎俩被消费者识破后,专家的一个动作、一句话都会引来他们的质疑。销售现场虽然增加了欣赏类节目,但这种流程化作业对销售磁场的形成没有任何支持,如同欣赏春晚,一旦观众知道了节目安排,春晚也就失去了吸引力,所以春晚的保密工作十分重要。如果销售人员的行为对消费者而言已无任何悬念,不能给消费者带来惊奇,也就不会给企业带来惊喜,程序化之局不破,销售将走不出误区。
http://www.bioon.com/biology/UploadFiles/201208/2012080216013081.jpg癌症研究人员可以测定肿瘤细胞基因组的序列,扫描其异常的基因活性,剖析其突变的蛋白质和研究它们在实验室培养皿中的生长,但研究者一直无法跟踪细胞形成肿瘤的过程。现在三个独立研究小组在小鼠体内做到了这一点。他们的研究结果支持这样的观点:一小部分细胞驱动肿瘤的生长,而想要治愈癌症可能需要将这些所谓肿瘤干细胞清除。目前还无法确认,这些从脑瘤,肠癌和皮肤癌研究的结论是否适用于其他类型肿瘤,但是得克萨斯大学西南医学中心的路易斯·帕拉达认为,如果它们适用于其他肿瘤,"将深刻地改变目前的化疗疗效评价和临床疗法的制定标准"。 不仅是看某种疗法是否缩小肿瘤,研究人员将更关注是否杀死了正确的细胞。帕拉达和他的同事们想检测是否特异性标识健康成人神经干细胞的一个遗传标记,也可标识神经母细胞瘤中的癌症干细胞。他们发现,所有神经母细胞瘤样本中至少有几个标记细胞 - 大概是干细胞。未标记细胞可被标准化疗杀死,但肿瘤可迅速恢复。进一步的实验表明,未标记细胞起源于标记的细胞祖先。当研究者把化疗与抑制标记细胞的遗传手段相结合进行治疗时,帕拉达说,肿瘤显著缩小到"残留遗迹"的水平。在另一项研究中,荷兰乌得勒支Hubrecht研究所的干细胞生物学家们把注意力瞄着了肠道。利用药物驱动的荧光素标志物表达系统,他们在小鼠体内证实,多种不同类型的肿瘤细胞,其实是来源于同一干细胞的。而且,这些干细胞是肿瘤发展的驱动力。对皮肤癌的研究,Blanpain和他的小组标记单个肿瘤细胞,而不是特异地标记干细胞。他们发现,细胞表现出两种不同的分工模式:它们要么在慢慢耗尽前分裂出少数细胞,或者产生许多细胞。这再次证实,一类独特的细胞亚群是肿瘤生长的驱动力。研究者说,下一步的研究计划将是,搞清楚这些实验所跟踪的细胞如何与通过多年移植实验所确定的,假定的癌症干细胞相联系的。研究人员已经紧锣密鼓地在寻找杀死这些细胞的方法;现在他们有更多的工具来测试这样的策略是否会奏效。
中科院深圳先进技术研究院医工所医学成像研究中心张丽娟副研究员近期在非实性肺癌肿瘤负荷的定量研究方面取得进展,相关成果发表在Radiology杂志上。 倍增时间在判断肿瘤的性质及预后方面具有重要临床意义。不同于实性肿瘤,非实性肺癌在体积增加之前常存在一段不确定的“内生长”期,即肿瘤组织向肺泡内空间填充,组织学上表现为癌细胞沿肺泡表面的增殖,而肿瘤的径线并无改变。这种生长方式使得经典倍增时间计算方法不再适用,长期以来该疾病的临床诊疗也因此颇受困扰。 医学影像技术的发展使得使用计算机辅助断层成像在体估算肿瘤负荷成为可能。该研究联合应用医学病理及影像的方法,全面分析了非实型肺癌的内生长模式,并对其肿瘤负荷作了定量分析,首次发现肿瘤的影像密度值每增加100单位,肿瘤负荷约增加10%。 该研究为有非实性肺肿瘤的生长提供了有效的评估方法,对肺癌的诊疗有重要临床应用价值。同时,也为丰富肺癌的WHO分期提供了新的思路。http://www.cas.cn/ky/kyjz/201207/W020120711526142827307.jpg
20世纪基因组学研究取得的巨大成就为蛋白质组学的发展奠定了基础。蛋白质组学是从整体水平上分析生命体、组织或细胞的蛋白质组成及其活动规律的科学,以基因表达产物为研究对象,延伸了基因组学研究深度,更深层次地揭示了生命活动规律。蛋白质组学的研究内容主要包括蛋白质表达存在方式(修饰形式)的鉴定、结构与功能分析、蛋白质定位、蛋白质差异表达以及蛋白质间相互作用分析等[1]。目前蛋白质组学研究技术主要包括:二维电泳技术、蛋白质芯片技术、质谱技术等[2]。其中,二维电泳技术是早期蛋白质组学的重要技术之一,但是由于实验步骤多,耗时长,重复性差等特点,已经逐步被新型技术所取代。蛋白质芯片技术是将多种蛋白质纯品点于芯片表面,形成蛋白质矩阵进行免疫等标记反应,主要受限于很多蛋白质无法获得纯品而不能用于芯片制备。质谱技术由于灵敏度高、特异性强、分析范围宽等优点逐渐成为蛋白质组学的主要研究手段,可以对特定生命过程中的功能性蛋白质分子进行定性和定量检测,因此在基础科研和临床研究中得到了广泛的应用[3,4]。一、基于质谱的蛋白质组学技术1.基于质谱的蛋白质组学定性技术:蛋白质定性鉴定的基本原理在于:蛋白质组的基本序列已经通过基因组学信息获得,可以用来鉴定多肽的氨基酸序列,并且获得多肽与蛋白质的对应关系[1],即质谱提供的多肽碎片数据可以与蛋白质数据库自动匹配来确定多肽序列与蛋白质归属。基本技术策略分为:(1)自上而下(Top–down)策略[5],即完整蛋白质在质谱中进行分析,可以提供完整蛋白质的质量数,但是由于质谱仪受到质量分析范围的限制,此方法在常规实验室不易实现。(2)自下而上(Bottom–up)策略[6],即蛋白质被蛋白酶水解成多肽,然后对多肽进行质谱分析和碎裂。基于这条策略的大致步骤为:蛋白质样品首先经过酶解降解为多肽,然后对多肽进行色谱–质谱分离与鉴定,最后通过搜索引擎(MASCOT:http://www.matrixscience.com/server.html, SEQUEST:http://fields.scripps.edu/sequest等)在公共蛋白质组学数据库(SWISS–PORT: http://web.expasy.org/groups/swissprot, NCBI:http://www.ncbi.nlm.nih.gov/pubmed等)中自动完成质谱数据的解析,确定多肽序列与蛋白质种类。该技术灵敏度高,特异性好,仪器自动化程度高,可以鉴定出生物样品中成千上万种蛋白质,被认为是大规模、高通量蛋白质定性检测的首选方法。2.基于质谱的蛋白质组学相对定量技术:对于大多数生命科学和医学研究来说,仅完成样品中蛋白质组的定性研究是远远不够的,还需要对蛋白质组进行定量分析。由于组学的研究对象是多个蛋白质,单次检测很难实现所有蛋白质的绝对定量,因此蛋白质组学定量多为相对定量检测。蛋白质组学定量的质谱技术包括谱图计数、质谱峰强度定量、同位素定量技术等。其中使用同位素作为内标定量的方法是目前质谱定量的最佳手段,即对整体蛋白质组进行同位素标记,并使用每一种天然蛋白质与同位素蛋白质的比值进行相对定量分析。主要分为细胞层面标记和蛋白质层面标记两种技术路线:(1)细胞层面标记的细胞培养氨基酸稳定同位素标记(stable isotope labeling with amino acids in cell culture,SILAC)方法[7]:即在两种细胞样品中分别加入轻重同位素标记的培养基,经过传代培养后,两种细胞样品中的全部蛋白质中分别嵌合了轻重同位素,可以在质谱上根据同位素的不同质荷比直接判断样品来源并进行定量比对。(2)蛋白质层面标记:使用含有同位素的小分子与样品全部蛋白质直接标记,如同位素标记相对和绝对定量技术(isobaric tags for relative and absolute quantification,iTRAQ)[8]、同位素编码亲和标记(isotope–coded affinity tag,iCAT) [9]、18O标记[10]等方法,此类方法使用带有稳定同位素的小分子与特定氨基酸侧链反应,使得多个样品可以分别连接含有不同同位素个数(多至8个)的小分子,从而产生一级数据相同但是二级数据不同的质谱谱图,通过二级谱图强度比对进行多个样品的定量分析。3.基于质谱的目标蛋白质绝对定量技术:质谱技术对目标蛋白质的绝对定量检测主要通过质谱多反应监控技术与同位素多肽内标技术联用来实现[11]。该方法首先选定目标蛋白质的一个或多个多肽,合成序列相同但含有稳定同位素的多肽作为内标,定量加入样品中,通过监测特定多肽及其同位素多肽的质谱峰强度进行比对和计算获得目标蛋白质的定量值。质谱多反应监控技术通过进行母离子筛选与子离子筛选等二次选择过程,筛选出目标蛋白质,而非目标蛋白质由于无法通过筛选达到检测器,极大降低了噪音干扰。因此,此方法针对性强,本底噪音低,是目前质谱技术中定量能力最好的一种,可以控制变异系数小于15%,检测限低至纳克每毫升,适合血液、组织等临床样品的定量检测[11]。二、质谱技术发现肿瘤蛋白质标志物质谱技术作为一项强有力的研究工具在科学研究中发挥着巨大的作用,特别在肿瘤相关研究中,目前已经获得美国食品药品监督管理局(Food and Drug Administration,FDA)批准的肿瘤标志物包括多种蛋白质前列腺特异性抗原(prostate–specific antigen, PSA), 癌胚抗原(carcinoembryonic antigen CEA), 人类表皮生长因子受体2(human epidermal growth factor receptor 2,Her–2), 人绒毛膜促性腺激素(human chorionic gonadotropin, HCG), 糖类抗原CA125等,均揭示了蛋白质与肿瘤发生发展密切相关。这些已有成果极大促进了质谱技术在肿瘤蛋白质标志物研究中的应用,并取得了标志性进展。例如:美国约翰霍普金斯大学的Chan课题组发现了新型卵巢癌蛋白质标志物,他们使用表面增强激光解析电离质谱技术(surface enhanced laser desorption and ionization time–of–flight mass spectrometry, SELDI–TOF MS)技术对503个妇女的血清进行了蛋白质组学的分析[12],在随后的大量临床验证中最终确定CA125、β2微球蛋白,转铁蛋白,甲状腺运载蛋白和载脂蛋白A1的联合检测可以作为卵巢癌的新型临床诊断指标。2009年9月该试剂盒OVA1(商品名称:http://ova–1.com)获得了美国FDA的认证,进入临床使用,被认为是国际肿瘤蛋白质标志物研究的重要标志性成果。同时,肿瘤仍然是国际上致死率最高的疾病之一,缺乏早期检测技术和有效治疗方案,临床中还存在着大量问题需要解决,新型标志物的研发迫在眉睫。由于肿瘤蛋白质标志物研究的难度大,风险高,因此近十年来仅有几例试剂盒获得了美国FDA批准,进入临床使用。大量标志物研究还停留在论文研究水平,其中临床问题、研究思路和技术方案的选择直接关系到研究的成功与否。1.临床问题选择:在肿瘤蛋白质标志物研究中,临床问题的选择是研究核心。在肿瘤研究中,需要解决的临床问题往往包括肿瘤早期检测、肿瘤分期检测、治疗方案与药物选择、疗效评估等多个方面。研究者需要根据不同肿瘤的临床情况,具体分析并凝练不同肿瘤的主要临床问题。例如,对于病程发展快、五年存活率低、没有有效手术或化疗手段的肿瘤,早期诊断是研究重点,如胰腺癌、卵巢癌、肺癌等;对于病程发展慢、手术效果明显的肿瘤,肿瘤的愈后与复发是需要关注的问题,如前列腺癌、肠癌等;还有一些肿瘤有特殊的检测需求,如乳腺癌虽然有临床有效的雌激素受体(estrogen receptor,ER),孕激素受体(progesterone receptor,PR),HER2等基因标志物,可以进行药物靶点治疗,但是三阴性乳腺癌的检测还缺乏有效的标志物与治疗方案。因此,在肿瘤蛋白质标志物研究实验开展之前,明确临床问题,并以此确定临床样品入组标准,是研究成功的核心基础。2.研究思路设计:不同于基础科学实验,临床实验需要在大量样本中进行实验结果的验证,因此肿瘤蛋白质标志物研究往往包括新型标志物发现和验证两部分。标志物发现实验是在疾病组和对照组之间进行蛋白质组学分析,鉴定样本中的未知蛋白质组并进行相对定量比较,分析数据选择出在两组样本中差异最大的一个或几个蛋白质作为新型标志物的候选物。随后,标志物验证实验在大量未知样本中进行蛋白质候选物的定量检测,使用发现实验中建立的区分标准进行判读,计算检测灵敏性(sensitivity)和特异性(specificity)。有效的蛋白质标志物研究往往需要发现与验证的两步设计思路来相互保证。3.技术方案选择:根据蛋白质标志物研究的两步设计思路,发现实验中使用基于质谱的蛋白质组学定性技术与相对定量技术对样本中的大量未知蛋白质进行分析,获得标志物候选物名单。验证实验中根据已有名单,进行目标蛋白质(非蛋白质组学)的精确定量检测。这几种质谱技术的配合使用,可以满足不同实验情况和目的,最终实现新型蛋白质标志物的成功研发。三、展望质谱技术是现阶段蛋白质组学研究的核心技术,具有灵敏度高、特异性强、分析通量大等优势,特别是其与同位素内标的联合使用,大大提高了质谱定量能力,因此在多种肿瘤标志物研究中取得了突破性进展并被广泛应用。目前,大量肿瘤蛋白质标志物候选物已经通过使用质谱技术被从血液、组织、体液中筛选出来,预计在完成大规模临床验证后可以作为新型标志物在临床使用,促进肿瘤检测水平的发展。同时值得注意的是,质谱技术还不具备进行蛋白质组的绝对定量能力。相对于免疫等传统蛋白质检测技术,仪器昂贵,操作复杂,自动化程度低,这些因素决定了质谱目前适用于蛋白质的临床研究,但不适用于蛋白质的临床检验,这是质谱技术面临的重要挑战之一。参考文献[1]何华勤. 简明蛋白质组学[M]. 北京:中国林业出版社, 2011:1,76,85-95,119,125-138.[2]RuediA, MatthiasM. Mass spectrometry-based proteomics[J]. Nature, 2003, 422(13):198-207.[3]甄艳, 施季森. 质谱技术在蛋白质组学研究中的应用[J]. 南京林业大学学报:自然科学版, 2011, 35(1):103-108.[4]孙瑞祥, 付岩, 李德泉,等. 基于质谱技术的计算蛋白质组学研究[J]. 中国科学E辑信息科学, 2006, 36(2):222-234.[5]WhiteleggeJ,HalgandF,SoudaP, et al. Top-down mass spectrometry of integral membrane proteins [J]. Expert Review Proteomics, 2006, 3(6):585-596.[6]ChaitBT. Mass spectrometry:bottom-up or top-down? [J]. Science, 2006, 314(5796):65-66.[7]TranDT, AdhikariJ, FitzgeraldMC. StableIsotope Labeling with Amino Acids in Cell Culture (SILAC)-based strategy for proteome-wide thermodynamic analysis of protein-ligand binding interactions [J]. Mol Cell Proteomics, 2014,13(7):1800-1813.[8]DytfeldD, KandarpaM, StrahlerJR, et al. Proteomic Profiling of Multiple Myeloma (MM) Cells Using iTRAQ and Label-Free Quantitative Proteomics for the Prediction of Complete or near Complete Response (CR/nCR) In Frontline Treatment with Lenalidomide, Bortezomib, and Dexamethasone [J]. Blood, 2010, 116(21):271-272.[9]García-SantamarinaS, BoronatS, DomènechA, et al. Monitoring in vivo reversible cysteine oxidation in proteins using ICAT and mass spectrometry [J]. Nat Protoc,2014,9(5):1131-1145.[10]MirzaSP, GreeneAS, OlivierM. 18O labeling over a coffee break:a rapid strategy for quantitative proteomics [J]. J Proteome Res, 2008,7(7):3042-3048.[11]曹冬, 张养军, 钱小红. 基于生物质谱的蛋白质组学绝对定量方法研究进展[J]. 质谱学报, 2008, 29(3):185-190.[12]ZhangZ, BastRC, YuY,et al. Three biomarkers identified from serum proteomic analysis for the detection of early stage ovarian cancer[J]. Cancer Res,2004,64(16), 5882-5890.
最新发现与创新 中国科技网讯 对于恶性肿瘤患者而言,最可怕的莫过于肿瘤出现转移扩散,因为这意味着肿瘤病变已经发展到晚期,也是肿瘤治疗失败的重要原因之一。今天(7日)在第七届中国肿瘤学术大会上披露,国际权威学术杂志《抗癌研究》(Anticancer Research)刊发了英国卡迪夫大学关于中药抑制肿瘤转移的研究报告,在国际上引起广泛关注。 英国卡迪夫大学医学院研究证实,我国抗肿瘤创新中药养正消积胶囊可有效抑制肿瘤细胞侵袭转移。研究人员指出,在肿瘤细胞的侵袭转移过程中,磷酸肌醇 3-激酶/蛋白激酶 B(PI3K/AKT) 信号通路的过度激活起到了关键作用,养正消积胶囊可以显著干预 PI3K/AKT 通路,从而对乳腺癌、肠癌、前列腺癌、肺癌、胃癌和骨肉瘤等肿瘤细胞的黏附和迁移起到明显抑制作用,有效控制肿瘤的病变发展。 有关专家介绍,恶性肿瘤细胞非常容易从原发病灶上脱落,每克肿瘤组织每天可向血液中释放300—400万个肿瘤细胞,脱落的肿瘤细胞随血液或淋巴流布全身,一旦条件成熟就会迅速生长,形成转移性病灶。控制肿瘤细胞的侵袭扩散是避免肿瘤恶化、提高肿瘤治疗效果、改善患者生存质量及延长患者寿命的有效措施。 专家认为,这一研究结果对恶性肿瘤的临床治疗具有极高的指导意义,对于尚未出现转移病灶的早中期肿瘤患者,使用养正消积胶囊可以控制肿瘤转移扩散,从而增加手术、介入等治疗手段的成功几率。此外,对于已经发展为全身性病变的晚期肿瘤患者,养正消积胶囊还具有增效减毒作用,可增加化疗疗效,减轻化疗中出现的消化道反应及免疫、造血系统损害,改善患者临床症状,明显提高患者的生存质量,延长患者的生存时间,是辅助治疗恶性肿瘤的一种安全、可靠、疗效满意的治疗方法。(通讯员 杨叁平 李瑞) 《科技日报》(2012-9-8 一版)
[font=inherit]一、项目基本情况[/font]项目编号:XYTDZB-2024TP073项目名称:新疆医科大学附属肿瘤医院新增病理检测试剂采购项目采购方式:竞争性谈判预算金额:125.000000 万元(人民币)最高限价(如有):0.000000 万元(人民币)采购需求:新疆医科大学附属肿瘤医院新增病理检测试剂采购项目(具体采购需求详见谈判文件)合同履行期限:1年本项目( 不接受 )联合体投标。[font=inherit]二、申请人的资格要求:[/font]1.满足《中华人民共和国政府采购法》第二十二条规定;2.落实政府采购政策需满足的资格要求:《政府采购促进中小企业发展管理办法》;《关于政府采购支持监狱企业发展有关问题的通知》;《中国残疾人联合会关于促进残疾人就业政府采购政策的通知》;节能环保等。3.本项目的特定资格要求:3.1、供应商不得为“信用中国网站(www.creditchina.gov.cn)中列入失信被执行人和税收违法黑名单的供应商,不得为中国政府采购网(www.ccgp.gov.cn)政府采购严重违法失信行为记录名单中被财政部门禁止参加政府采购活动的供应商;3.2、法定代表人授权委托书或身份证明书:(1)原件,按采购文件规定的格式填写、签字和盖章; (2)附完整的法定代表人身份证复印件、被授权人身份证复印件,均加盖公章;(3)法定代表人前来投标时,需提供法定代表人身份证明书原件,附完整的法定代表人身份证复印件。3.3、单位负责人为同一人或者存在直接控股、管理关系的不同供应商,不得参加同一合同项下的政府采购活动;除单一来源采购项目外,为采购项目提供整体设计、规范编制或者项目管理、监理、检测等服务的供应商,不得再参加该采购项目的其他采购活动。3.4、投标产品属于医疗器械管理范围的:①生产企业参与须提供医疗器械生产许可证;代理商参与须提供医疗器械经营许可证;②提供所投产品的医疗器械注册证及注册表复印件,须加盖公章。3.5、所投产品为进口产品的须提供产品授权委托书。[font=inherit]三、获取采购文件[/font]时间:2024年03月12日 至 2024年03月18日,每天上午10:30至13:30,下午15:30至18:00。(北京时间,法定节假日除外)地点:乌鲁木齐市天山区时代广场A座25AF(24楼F室)方式:线下获取,持本人身份证原件及复印件、供应商法定代表人授权委托书原件、供应商营业执照复印件(以上资料均加盖单位公章)。售价:¥300.0 元(人民币)[font=inherit]四、响应文件提交[/font]截止时间:2024年03月22日 11点00分(北京时间)地点:新疆乌鲁木齐市天山区时代广场A座25AF(24楼F室)(如有变动另行通知)[font=inherit]五、开启[/font]时间:2024年03月22日 11点00分(北京时间)地点:新疆乌鲁木齐市天山区时代广场A座25AF(24楼F室)(如有变动另行通知)[font=inherit]六、公告期限[/font]自本公告发布之日起3个工作日。[font=inherit]七、其他补充事宜[/font]公告期限:5个工作日[font=inherit]八、凡对本次采购提出询问,请按以下方式联系。[/font]1.采购人信息名 称:新疆医科大学附属肿瘤医院地址:乌鲁木齐市联系方式:向老师 0991-78190552.采购代理机构信息名 称:新疆星耀天都项目管理有限责任公司地 址:乌鲁木齐市天山区时代广场A座25AF(24楼F室)联系方式:周佳颖、李卓 18082891232、147992675833.项目联系方式项目联系人:周佳颖、李卓电 话: 18082891232、14799267583
[b]摘要[/b]从首次感染部位向邻近基质的转移入侵是肿瘤发展过程中的关键步骤,研究成果较少。肿瘤入侵的原理以各种体外模型给出了实验性的表述;但是,体内的关键性步骤和机制仍然不清楚。这里,我们通过落射荧光成像和多光子显微镜建立了一个修正的皮肤折叠室模型来阐述关于HT-1080纤维肉瘤细胞的原位移植,生长和入侵。这种策略允许对作为独立细胞或者集体粘丝或者细胞团沿着富含胶原的细胞外基质和增补宿主组织包括纹状肌肉丝和淋巴管的肿瘤生长、肿瘤诱导血管形成和入侵进行重复成像。这个修正的窗口模型将适用于阐述肿瘤转移和入侵的机制,以及相关的实验性治疗。[b]材料与方法[/b]HT-1080双色纤维肉瘤细胞表达细胞质DsRed2和核组蛋白2B(H2B)-EGFP -EGFP (Yamamoto et al. 2004)培养在改良的鹰培养基(PAN Biotech GmbH, Aidenbach, Germany)中,补充10%的胎牛血清(Aurion, Wageningen, The Netherlands),盘尼西林和链霉素(都100ug/ml PAN)和潮霉素B(0.2mg/ml;Invitrogen, Carlsbad, CA, USA)在37%湿润的5%CO2的培养环境中。小鼠被用异氟烷麻醉并被稳定固定在37℃的温控平台上。使用一个落射多光子显微镜[color=red]([/color][color=red]TriM Scope, LaVision BioTec[/color][color=red])[/color],并配备了OPO装置(OPO APE, Berlin, Germany)用于1100nm波段的双光子激发,以及红外修正的20X/0.95N.A(Olympus)物镜。如果没有特定声明,EGFP,DsRed2和SHG的获取都是使用的832nm的激发光。由带通滤波器确定的检测光波段为400/40(蓝),535/50(绿),605/70(红),和710/75(红外)。以5um的步长对深达250um的成像深度进行顺序3D堆栈。通过向尾静脉注射4mg荧光葡聚糖对血管显影。在注射了淋巴归巢环肽LyP-1(100ug)之后活化的淋巴管被检测到。(Laakkonen et al. 2002)图像被使用ImageJ 1.40 g (W. Rasband, NIH), ImSpector 3.4 (LaVision Bio- Tec GmbH), and Photoshop CS 8.0.1 (Adobe Systems Inc.)重构和分析。以宽的平方X长Xπ/6计算肿瘤体积。有丝分裂和细胞凋亡的比例通过H2B-EGFP模式从每区域30到100个细胞中确定。[b]主要结果 [/b][img=,593,498]http://qd-china.com/uploads/bio-product/51.jpg[/img]Fig.1 在背侧皮肤褶皱室中HT-1080纤维肉瘤细胞的滴落和注射方法比较.6(c)、7(d)天后通过明场和落射荧光显微镜观察的细胞应用,生长位置(a,b)和宏观肿瘤形态。在建立的模型中,允许细胞悬浮液或者细胞球粘附到外科手术准备好的真皮组织表面上,获得了在真皮层与盖玻片(a.c)间的3D肿瘤生长。使用细针将细胞球注射进真皮中阻止盖玻片和真皮内产量增加间的反应(b,d)。标尺1mm(概图)和250um(细节)。 [img=,604,379]http://qd-china.com/uploads/bio-product/52.jpg[/img]Fig 2. 肿瘤生长阶段。 a 由落射荧光显微镜监测的移植瘤生长和入侵的时间进程。新生血管的插入,不存在(3天)和存在(7天)。标尺1mm。b 通过以day 1的体积进行归一化的肿瘤体积。mean+-SD(n=9)。c HT-1080移植肿瘤在6天的时候的肿瘤形态,血管化,分生和凋亡。使用多光子显微镜以激发波长1100nm(左)和832nm(右)获取的一个中央中流区域的3D重构。核形态包括了有丝分裂(白色箭头)和凋亡图(黑色箭头)。标尺50um。插图显示了前相(P)、中相(M)和后相(LA)以及凋亡图(A)。d 对时间依赖的分生和凋亡定量化。数据显示3个非依赖性肿瘤的10-25个独立区域的Mean±SEM。 [img=,617,642]http://qd-china.com/uploads/bio-product/53.jpg[/img]Fig 3. 近红外多光子显微镜显示环绕HT-1080双色肿瘤的肿瘤诱导产生血管及其结构。Z轴为一个6天大肿瘤的从肿瘤边缘(-50um)到肿瘤内部区域(-80um)(红色细胞质;黄色细胞核)。通过FITC-葡聚糖注射现实的密布血管(绿),先前存在的线形血管(绿色箭头)和不规则形状的新生血管(蓝色箭头)。胶原纤维(黑色箭头)和肌肉丝(白色箭头),通过二次谐波检测(灰度)。标尺50um。 [img=,583,768]http://qd-china.com/uploads/bio-product/54.jpg[/img]Fig 4. HT-1080双色细胞的原位入侵模型。a 注射后6天入侵类型的分类。缺少入侵(上,左)并且散布单个细胞(上,右;白色箭头),散射的或者紧密地丝状整体入侵(下图)。标尺250um。 b 45个连续的非依赖性肿瘤的按中所分入侵模式的频率。11天时,沿着纹状肌肉纤维集体入侵丝的定位。标尺100um。d 单一细胞侵入脂肪组织随后进行分散的,部分整体的入侵。对照-少量圆的脂肪细胞(星号)被HT-1080细胞包围。1100nm的激发光来检测遍布的血管(Alexa Fluor 660-dextran,红色),,肿瘤细胞质(绿色假彩),SHG(灰度);832nm用于肿瘤细胞核(白色)。标尺100um。[img]http://qd-china.com/uploads/bio-product/55.jpg[/img]Fig 5. HT-1080细胞沿淋巴管的入侵。a 由多光子显微镜对边缘而非肿瘤中心的活化淋巴管产生的单幅图片。用FITC连接的LyP-1缩氨酸来检测。深度已标明在图上(um)。b 3D堆栈投影表明淋巴管内(白色箭头)和外淋巴管入侵(黑色箭头)。标尺100um。
长期以来,手术、放疗、化疗三大疗法一直主宰着肿瘤治疗的统治地位。一方面,由于三大疗法本身技术的发展和完善,使得肿瘤治疗较过去有了可喜的进步,手术联合放化疗在很大程度上提高了肿瘤的治疗效果。另一方面是过度治疗事与愿违,对于晚期病人而言,其复发和转移的比例一直居高不下,治疗效果仍然不理想,五年生存率普遍较低。 六步自然疗法抗肿瘤新突破 21世纪,随着分子生物学和微生态学以及免疫学的发展,一种全新的抗肿瘤方法“六步综合疗法”应运而生,所谓“六步综合疗法”是将中药治疗、营养、体能锻炼等多种方法科学地运用到患者的综合治疗中,调整病人心理状态,提高免疫功能,以期达到提高生存率、延长生存期,改善生存质量,使肿瘤患者能最大限度地回归社会,像健康人一样生活和工作。 发酵中药为六步自然疗法第一步 发酵中药是国内首例通过仿生学手法和微生物发酵工艺研制而成的中药微生态制剂,圆了无痛苦消瘤的千年梦想。众所周知,中药在肿瘤的综合治疗中发挥着重要的作用。传统的中药生产工艺落后,不能在临床上起到作用。发酵中药它创造性地采用了人体仿生学手法,在体外模拟健康人的消化系统,中药成分经过生物转化,使大分子物质变成小分子物质,从而被人体吸收和利用,使药效提高4至28倍。 国际自然抗癌学会副会长史宗山教授认为:中药中的有效成份是其中的次生代谢物,是在随中药进入人体后,经过人体细胞代谢产生的物质而发挥治病作用。这些有效成分通过对致癌基因的抑制、抑癌基因的激活和生长调控基因的修复,来实现多靶点作用。发酵中药正是通过高科技生物转化后的有效成分,在细胞分子水平上调节了这些对肿瘤有影响的机制而发挥抗肿瘤、抗复发、抗转移功能。 发酵中药五大革命性突破 发酵中药抗肿瘤成功实现五大突破:1)首次把中药抗肿瘤活性成分从大分子转变成小分子,有效成分可迅速穿透毛细血管壁直达肿瘤病灶;2)首次激活传统中药未被开发的抗肿瘤活性物质-CSD因子,诱导肿瘤细胞分化凋亡;3)首次实现中药多靶点靶向识别、抑杀肿瘤细胞,抑制肿瘤新生血管形成,防止复发转移。4)中药无毒化,通过益生菌对中药有效成分的多次仿生分解及转化,彻底去除中药有毒成分,并大幅提高中药药效及吸收效果。5)口感良好,真正改变了中药良药苦口世界形象。
1. MSI1 在实体肿瘤中的研究进展1.1 胶质母细胞瘤脑癌一直是威胁人类生命的恶性肿瘤,而胶质母细胞瘤是最具破坏性的脑癌之一, 其中位生存期仅有 16 个月[7]。MSI1 在神经发育中起重要作用,MSI1 的高表达与胶质母细胞瘤的恶性进展呈正相关且预示着不良预后。研究发现,MSI1 通过增强血管细胞粘附因子-1(VCAM1)在修复同源重组、逃避凋亡和上调 DNA 损伤反应中的作用来调节辐射抗性,进而促进肿瘤细胞的迁移[8,9]。Aliaksandr[10]等人发现在胶质母细胞瘤中MSI1 直接调控 YTH-N6 甲基腺苷 RNA 结合蛋白-1(YTHDF1),而 YTHDF1 能调节肿瘤细胞的增殖、化疗耐药以及癌细胞样特性,MSI1 与 YTHDF1 呈正相关,且MSI1 与 YTHDF1 表达上调预示了患者的不良预后。另有研究发现在胶质母细胞瘤细胞中 MSI1 过度表达时,会增加巨噬细胞抑制因子 1(MIF1)的表达和分泌,由此导致巨噬细胞分化为 M2 表型,从而促进肿瘤的进展[11]。因此胶质母细胞瘤中对 MSI1 功能的进一步探索,可能为临床诊断和治疗提供新的思路。1.2 乳腺癌乳腺癌是女性癌症死亡的主要原因之一[12]。有研究通过免疫组化等方法分析 20 个乳腺癌细胞系和 140 个原发性乳腺肿瘤中 MSI1 的表达中发现,MSI1 正常人乳腺组织中表达极低,但在 68% 的原发肿瘤和 100% 的淋巴结转移中表达,MSI1 成为了乳腺癌患者生存率的负预后指标[13]。Yun[14]等人发现 MSI1 在侵袭性乳腺肿瘤中表达增高,证实了 MSI1 是乳腺癌转移的关键调节因子,MSI1 表达上调直接抑制了基质金属蛋白酶-9(MMP9)抑制剂 Timp3 的表达,导致 MMP9 的表达和活力增强,从而增强了乳腺癌细胞的侵袭能力,同时促进了乳腺肿瘤细胞的肺转移。Wang[15]等人还发现 MSI1 通过触发 Notch 和 Wnt 信号通路促进乳腺干细胞的增殖。研究者发现调节多种类型乳腺癌进展的潜在因子 miR-125b 能与 MSI1 的 3'UTR 结合,上调 miR-125b 表达能抑制肿瘤细胞中 MSI1 的表达。但 MSI1 作为 miR-125b 的潜在靶点,其分子机制仍需进一步研究[16]。如今 MSI1 在乳腺癌进展中的致癌作用已被证实,我们可以通过对乳腺癌中 MSI1 的表达及相关机制研究,为乳腺癌转移的治疗策略提供新的见解。1.3 宫颈癌宫颈癌是一种高发病率的恶性肿瘤,严重威胁女性的身体健康[17],尽管对于宫颈癌的预防已经突飞猛进,但是宫颈癌的治疗仍然是一大难题。癌细胞的永生化是宫颈癌进展的关键因素,早期有研究发现 MSI1 在宫颈癌组织中高表达,MSI1 可以与周期调节因子 P21、P27 和 P53 的 mRNA 3’UTR 结合并抑制其翻译过程,加速宫颈癌细胞的G0/G1-S 细胞周期转化,促进肿瘤细胞的增殖[18]。最新研究发现,宫颈癌细胞中 MSI1 过表达导致 AKT 信号的负调节因子 PTEN 以及 AKT 信号下游的凋亡因子 BAK 的表达均下调,从而使宫颈癌细胞凋亡受到抑制[19]。MSI1 参与肿瘤的进展,MSI1 通过激活宫颈癌中的 Wnt 信号通路促进上皮细胞间充质转化的进展,且 MSI1 高表达与患者的不良预后密切相关[20,21]。越来越多的研究表明,MSI1 可以作为宫颈癌的候选治疗靶点。1.4 结肠癌随着时代发展,人类生活方式、饮食习惯的改变,结肠癌的发病率呈上升趋势[22], 因此迫切需要一种生物标志物用于结肠癌的高精度早期筛查和治疗。有研究表明,MSI1 通过靶向细胞周期蛋白依赖性激酶(CDK)抑制剂 p21cip1 的负调节而改变细胞周期, 并抑制结肠癌细胞的细胞增殖、集落形成以及体内的肿瘤形成[23]。有报道称,癌基因Circ_KIAA1199 通过竞争性靶向 miR-34c-5p 激活 MSI1,驱动了结肠癌的恶性发展[24,25]。另有研究发现,在结直肠癌中 miR-137 作为肿瘤抑制性 miRNA 发挥作用,并对致癌基因 MSI1 产生负性调节,MSI1 表达下调抑制了结肠癌细胞生长和化疗耐药性[26]。Li[27]等人进一步研究发现,外泌体 circ_IFT80 能通过调节 miR-296-5p/MSI1 轴促进结肠癌细胞发生并降低肿瘤细胞的放射敏感性,这为结肠癌的治疗提供了新思路。化疗耐药仍然是癌症治疗中不可忽略的问题,研究指出 Circ0032833/miR-125-5p/MSI1 在FOLFOX 治疗中能调节 5-氟尿嘧啶和奥沙利铂敏感性[40],对结肠癌治疗难的问题提供了强有力的理论支持。1.5 肺癌肺癌是癌症死亡的主要原因之一,非小细胞肺癌(NSCLC)占肺癌的 85% 左右[28]。研究发现 NSCLC 中 MSI1 呈高表达状态,MSI1 参与了 NSCLC 细胞的发生发展[29]。Guo[30]等人研究了 MSI1 在 NSCLC 恶性肿瘤和化疗耐药中的作用,发现 miR-181a-5p能够抑制 MSI1 基因的 3'-UTR 活性,从而在 NSCLC 中发挥肿瘤抑制作用,同时MSI1 的表达水平与 Akt 信号通路的活性呈正相关,MSI1 通过激活 Akt 信号通路促进 NSCLC 的恶性增殖和耐药。晚期癌症患者 MSI1 表达水平较高的结果表明,MSI1 不仅在 NSCLC 的发病过程中发挥重要作用,而且在癌症的进展过程中也发挥了重要作用。因此 MSI1 除了作为癌症的生物标志物,还可能成为潜在的治疗靶点。
肿瘤是指体内细胞的异常增生,可以是良性的或恶性的。良性肿瘤(例如息肉)生长缓慢且通常局限在一个区域,不会侵犯周围组织或扩散到其他部位。恶性肿瘤(即癌症)具有侵袭性,可以快速生长并通过血液或淋巴系统扩散到其他身体部位,形成远处转移。癌症是一种严重威胁人类健康和生命的疾病,2020年全球有1 930万新增癌症病例和1 000万癌症死亡病例,且我国癌症发病率和死亡率均位居全球第一[1]。最常见的癌症类型是乳腺癌、肺癌、结直肠癌和前列腺癌。因此,寻找新的抗肿瘤药物,阐明抗肿瘤药物的分子机制,是解决当前临床肿瘤治疗难点的有效策略。中药具有多种有效成分,因其不良反应低、多靶点、多通路等优点,已成为抗肿瘤药物开发的重要来源和研究热点[2]。目前,常规的肿瘤症治疗方法为手术、放射治疗和化学治疗等,但这些方法往往伴随着较大的不良反应和毒性,而且对某些难治性或复发性肿瘤效果不佳[3]。因此,寻找有效、低毒的抗肿瘤药物是当前临床研究的重要方向。 苍术是一种常用的中药材,分为茅苍术Atractylodes lancea (Thunb.) DC.和北苍术A. chinensis (DC.) Koidz.,分别来源于菊科植物茅苍术或北苍术的干燥根茎。苍术具有燥湿健脾、祛风散寒的功效,在《神农本草经》中列为上品[4]。近年来,苍术在抗微生物、抗炎、抗肿瘤、免疫调节、调节消化系统、心血管系统和神经系统等方面的药理作用受到了广泛关注。苍术中含有挥发油、多糖、倍半萜类、聚乙炔类等[5]多种化学成分。其中一些成分已经被证实具有抑制或杀伤多种肿瘤细胞的能力,其作用机制涉及诱导凋亡、抑制增殖、迁移、侵袭和转移,以及调控免疫功能等方面[6]。然而,苍术中的抗肿瘤活性成分及其作用机制尚未完全明确,需要进一步深入地探索和验证。本文通过整理国内外研究文献,对苍术活性成分、苍术与其他药物联合抗肿瘤及其分子机制进行总结,探讨苍术在抗肿瘤方面的应用规律和思路,为苍术资源的开发利用以及抗肿瘤临床疗法的研究提供理论参考。 1 苍术主要化学成分 茅苍术与北苍术化学成分相似,药理作用也较为相似,目前已从苍术中分离出多种化学成分,主要含有包括萜类、聚乙烯炔类、有机酸类、糖苷类化合物等[7-8]。苍术主要抗肿瘤化学成分,见图1。茅苍术与北苍术中主要化学成分如表1所示。 图片 图片 2 苍术的抗肿瘤机制 苍术中含有苍术内酯Ⅰ、Ⅱ、Ⅲ、苍术酮、β-桉叶醇和苍术素等有效成分,这些成分不仅可以抗炎、抗氧化、抗菌、保肝、降血糖,还可以抗肿瘤[14-15]。近年来,苍术及其有效成分对肿瘤的抑制作用受到了广泛的关注。研究发现,苍术有效成分对多种肿瘤细胞都有抑制作用,可以通过多种途径和机制影响肿瘤细胞的生长、迁移、侵袭和血管生成,诱导肿瘤细胞的凋亡和自噬,调节肿瘤微环境和免疫系统。 2.1 抑制肿瘤细胞增殖 肿瘤是由于细胞增殖失控而形成的一种疾病[16]。细胞周期是细胞增殖的基本过程,由细胞周期蛋白(cyclin,CCN)和细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)复合物共同调控[17]。干预细胞周期是抑制肿瘤发展的有效策略之一[18]。Kotawong等[19]发现,苍术中的苍术素、苍术内酯I和β-桉叶醇等有效成分可以通过影响肿瘤细胞周期的不同阶段来抑制肿瘤细胞的增殖。这些成分可以通过抑制磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)、磷酸化蛋白激酶B(protein kinase B,AKT)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路来诱导肿瘤细胞在G1期停滞;Yu等[20]发现苍术内酯I通过上调周期蛋白依赖性激酶抑制剂1A(cyclin-dependent kinase inhibitor 1A,p21)和下调cyclinB1、CDK1和细胞分裂周期25C蛋白(cell division cyclin25,Cdc25c)等关键分子来抑制肿瘤细胞在G2/M期的进入,在动物模型中,苍术内酯I可以显著抑制膀胱癌的生长,且无明显不良反应。Zhang等[21]实验发现苍术内酯Ⅱ可以通过改变结直肠癌细胞内的蛋白表达从而抑制结直肠癌细胞的增殖和活性,并且还显著增强了结直肠癌细胞的化疗敏感性。Pongsakorn等[22]发现,苍术提取物可以通过抑制细胞外信号调节激酶信号级联(ERK-signaling cascade,ERK)信号通路来抑制胆管癌细胞的增殖。ERK信号通路是一种重要的细胞内信号转导机制,参与调节细胞生长、分化和凋亡等过程。苍术提取物可以下调ERK及其下游分子的表达,从而抑制胆管癌细胞的生长和增殖,不同类型的胆管癌细胞对苍术提取物的敏感度不同,其中人胆管HuCCT-1癌细胞最为敏感。 2.2 诱导肿瘤细胞凋亡 细胞凋亡是一种程序性细胞死亡形式,它通过限制细胞的增殖和分化来维持组织稳态或去除潜在的有害细胞[23]。目前已知的细胞凋亡途径主要有3种,即外源性途径(死亡受体介导)、内源性途径(线粒体介导)和内质网途径。其中,线粒体途径是最重要的一种,它涉及线粒体外膜透化(outer mitochondrial membrane,MOMP)、细胞色素C释放和半胱天冬酶(cysteine aspartic acid protease,Caspase)激活[24]。多项研究发现,苍术酮可以通过降低线粒体膜电位、提高活性氧水平、抑制B细胞淋巴瘤-2基因(B-cell lymphoma-2,Bcl-2)表达、促进BCL2-相关X蛋白(BCL2-associated X protein,Bax)裂解和Caspase-3表达[25],以及下调PI3K/AKT/mTOR信号通路来诱导肿瘤细胞凋亡[26]。Narahara等[27]研究表明,β-桉叶醇和苍术内酯Ⅲ[27]可以通过增加Caspase-3、Caspase-8、Caspase-9和Bax等凋亡相关蛋白的表达、下调Bcl-2表达、释放细胞色素C和降低线粒体膜电位来诱导胆管癌细胞凋亡。此外,Li等[28]使用β-桉叶醇处理的白血病HL60细胞,发现β-桉叶醇可以通过激活c-JunN端激酶(c-Jun N-terminal kinase,JNK)丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路来诱导白血病HL60细胞凋亡。Li等[29]研究发现,苍术素可以通过降低Bcl-2表达、激活p53肿瘤蛋白(p53 tumor protein,p53)、Bax和Caspase-3、-8、-9等凋亡因子来诱导人乳腺癌MCF-7细胞凋亡,并表现出浓度依赖的毒性效应。Li等[30]研究表明,苍术内酯I和苍术内酯Ⅱ[31]可以通过与对两面针激酶2(Janus kinase 2,JAK2)直接相互作用而负调节信号传导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)磷酸化,从而抑制其活化,进而导致糖酵解的抑制和结肠、直肠癌细胞凋亡的诱导。 2.3 抑制肿瘤细胞转移 肿瘤细胞转移是指肿瘤细胞通过血液循环从原发部位转移到其他部位的过程,这是癌症治疗的难点,也是癌症死亡的主要原因[32]。上皮间质转化(epithelial-mesenchymal transition,EMT)是一种与癌症发生相关的细胞程序,它使癌细胞具有移动性、侵袭性和抗凋亡能力,从而促进转移。苍术的一些活性成分具有抑制肿瘤细胞转移的潜在作用,其机制可能涉及对EMT的调控[33]。Acharya等[34]研究发现,β-桉叶醇可以改变EMT相关标志物的表达,从而抑制结肠癌细胞的增殖、迁移和侵袭。同时它还可以影响PI3K、AKT、p38丝氨酸/苏氨酸蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)信号通路,以及肺癌细胞中的活性氧水平,从而降低癌细胞的黏附和迁移能力[35]。麦静愔等[36]发现苍术酮可以通过抑制EMT过程等途径抑制肿瘤细胞的迁移和侵袭能力,此外,苍术酮还可以通过下调基质金属蛋白酶(matrix metalloproteinase,MMP)的表达从而抑制肿瘤细胞的迁移和侵袭能力。MMP是一类能够降解细胞外基质(extracellular matrix,ECM)的锌依赖性内肽酶,在癌症进展中的作用与它们参与ECM降解以及黏附和细胞骨架蛋白、生长因子、趋化因子的调节和加工有关[37]。且有动物实验表明,苍术酮可以明显抑制肝癌生长,没有明显的毒性。Zhong等[38]在观察了苍术多糖在U-2 OS人骨肉瘤细胞中对内皮细胞选择素(endothelial cell selectin,E-Selectin)和路易斯X三糖(Lewis-X Trisaccharide,LacCer Lex)的影响,发现苍术多糖可通过降低U-2 OS细胞上的E-Selectin抑制U-2 OS细胞对人脐静脉内皮细胞HUVECs的黏附、迁移和侵袭。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)在促进肿瘤转移中发挥重要作用,Zhang等[39]发现苍术内酯II可以有效抑制肿瘤细胞极化,从而抑制肺癌细胞在体内和体外的转移。铁死亡是一种新的细胞死亡模式,其特征是铁过载导致脂质过氧化而导致膜损伤,过度的铁死亡会影响肿瘤的转移,从而抑制肿瘤的进展[40]。He等[41]发现,苍术素可通过抑制谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)和铁蛋白轻链(ferritin light chain,FTL)的表达,以及上调酰基辅酶A合成酶长链家族成员4(acyl-CoA synthetase long-chain family member 4,ACSL4)和转铁蛋白受体(transferrin receptor,TFR1)的表达来诱导肝癌HCCM细胞的铁死亡。 2.4 诱导肿瘤细胞自噬 细胞自噬是一种分解代谢通路,能清除不必要的或功能失调的细胞成分并回收代谢底物[42]。目前已知有3种主要的细胞死亡方式:细胞凋亡(Ⅰ型)、自噬性细胞死亡(Ⅱ型)和坏死(Ⅲ型)。自噬性细胞死亡是指自噬过程中产生的自噬体过多或过大,导致细胞质溶解和细胞死亡。自噬体是由双层膜包裹的囊泡,内含被降解的细胞器和蛋白质。微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)是自噬体形成的关键标志物,它以微管相关蛋白1A/1B-轻链3(microtubule-associated protein 1 light chain 3,LC3-I)和微管相关蛋白1轻链3的脂化形式(lipidated form of microtubule-associated protein 1 light chain 3,LC3-Ⅱ)2种形式存在,LC3-Ⅰ转化为LC3-Ⅱ是自噬体形成的必要步骤[43-44]。Li等[29]使用苍术素处理乳腺癌MCF-7细胞时发现,苍术素可以增加了LC3Ⅰ向其脂化形式的LC3Ⅱ的转化,并增加了苄氯素1(beclin-1,BECN1)的表达,下调了人乳腺癌MCF-7细胞中的p62蛋白(p62 protein,p62)表达,改变凋亡和自噬相关生物标志物。Acharya等[45]研究发现,苍术素通过调节PI3K、AKT、mTOR、p38MAPK信号通路的活性,可以诱导胆管癌HuCCT-1细胞发生自噬,并抑制其生长、迁移和侵袭,SB202190(p38MAPK诱导剂)和3-MA(p38MAPK抑制剂)分别显著增加和降低苍术素诱导的自噬速率。 2.5 抑制肿瘤血管生成 血管生成本身不会导致恶性肿瘤的形成,但可以为肿瘤的生长和转移提供条件。肿瘤在发展到一定阶段后,需要依赖新生血管来满足其对氧气和营养的增加的需求,以及排除代谢废物,因此,抑制血管生成是一种有效的抗肿瘤策略[46]。血红素加氧酶1(heme oxygenase 1,HO-1)是一种在肿瘤组织中高表达的酶,它可以促进肿瘤的血管生成和抗氧化应激,为肿瘤细胞提供生存优势。因此,抑制HO-1的表达或活性是治疗肿瘤的另一种有效策略之一。Mathema等[47]研究发现,苍术素可以抑制胆管癌CL6肿瘤细胞的集落形成和伤口愈合能力,其机制与抑制HO-1的表达、下调信号转导及转录激活蛋白1/3(signal transducer and activator of transcription 1/3,STAT1/3)和核因子κB(nuclear factor kappa-B,NF-κB)的信号通路有关。β-桉叶醇也具有抑制胆管癌细胞中HO-1的表达的能力,其机制与浓度依赖性地抑制STAT1/3和NF-κB信号通路有关[48]。β-桉叶醇还可以通过抑制生长因子信号通路中的环磷腺苷效应元件结合蛋白(cyclic-AMP response binding protein,CREB)激活来阻断血管生成,从而抑制肿瘤的发展[49]。Tsuneki等[50]有动物实验表明,β-桉叶醇可以通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)来刺激大鼠嗜铬细胞瘤细胞中的神经突生长,且β-桉叶醇还表现出了体外和体内的抗血管生成活性,其阻断了由碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)或血管内皮生长因子(vascular endothelial growth factor,VEGF)诱导的人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)中CREB蛋白的磷酸化,从而抑制bFGF刺激的HUVEC迁移和HUVEC在基质胶中的管形成。同时,它还能显著降低小鼠皮下植入的Matrigel栓塞和小鼠佐剂诱导的肉芽肿中的血管生成[51]。 2.6 免疫调节作用 随着肿瘤的发生和发展,或在接受化疗、放疗等治疗的过程中,肿瘤患者机体免疫力的显著下降。因此,调节或刺激机体免疫能力,可能是一种有效的主动抗癌策略。免疫治疗作为一种新型的抗癌手段,已经引起了广泛的关注和研究[52]。巨噬细胞是机体内重要的免疫细胞,在机体免疫中发挥着重要的作用[53]。Qin等[54]从苍术中分离得到两种多糖成分:中性多糖和酸性多糖。研究表明,酸性多糖能够显著地刺激小鼠单核巨噬细胞白血病细胞(RAW264.7)细胞的增殖、吞噬能力、NO产生和细胞因子分泌,并且呈现出剂量相关性,而中性多糖则相对较弱。此外,中性多糖和酸性多糖均能够激活淋巴结Peyers patch细胞中的T细胞,并促进集落刺激因子的产生。而酸性多糖也表现出比中性多糖更好的肠道免疫调节活性。吲哚胺-2,3-二氧化酶(indoleamine 2,3-dioxygenase,IDO)是一种通过犬嘌呤途径氧化分解色氨酸的限速酶,是抗肿瘤免疫治疗中小分子药物开发的潜在目标。IDO可在肿瘤微环境中通过与许多肿瘤相关的自发炎症和T细胞激活而被诱导。Liu等[55]研究发现,苍术内酯Ⅰ可以通过下调Toll样受体4/髓样分化蛋白2复合物(toll-like receptor 4/myeloid differentiation 2 complex,TLR4/MD-2)的表达,抑制人卵巢癌细胞(EOCSKOV3)中髓样分化主要反应蛋白88(myeloid differentiation primary response protein 88,MyD88)、NF-κB、Akt和IDO1的信号通路的活化,从而减少白细胞介素-6(interleukin-6,IL-6)、转化生长因子-β1(transforming growth factor beta 1,TGF-β1)、VEGF和白细胞介素-17A(interleukin-17A,IL-17A)等促进肿瘤免疫逃逸的因子的分泌。同时,还可以降低调节性T细胞(Treg细胞)在肿瘤微环境中的比例,改善T淋巴细胞受到EOCSKOV3细胞上清液抑制而导致的增殖反应降低和抗肿瘤细胞毒性减弱。Liu等[56]研究发现,苍术内酯Ⅲ可以通过直接结合JAK3蛋白,从而抑制γ-干扰素(interferon gamma,IFN-γ)触发的JAK3/STAT3通路,从而达到抑制IDO激活的目的。 苍术抗肿瘤成分的潜在分子机制见图2。对苍术抗肿瘤有效成分及其抗肿瘤作用进行归纳总结,见表2。 图片 图片 3 联合用药 西医治疗肿瘤的常用手段有手术切除、药物化疗和高能射线放疗等,这些手段去除肿瘤西医的治疗方式更为直接,适合前期控制病情,化疗药物虽然能够杀死肿瘤细胞,但同时也伴有严重的副作用,影响患者的生活质量和治疗效果。中药具有不良反应小、安全性高的特点,因此中药与化疗药物的联合应用被广泛关注和探索[57]。 阿帕替尼是全球第一个在晚期胃癌被证实安全有效的小分子抗血管生成靶向药物,也是晚期胃癌标准化疗失败后,明显延长生存期的单药。Zhou等[58] 分析了不同苍术多糖提取方法的影响。比较了热水浸提法、超声浸提法和酶浸提法提取苍术多糖的得率、总糖含量、相对分子质量分布、单糖组成、并测定苍术多糖与阿帕替尼的协同活性。结果发现其中超声浸提法表现出最强的协同作用。这也与超声浸提的苍术多糖相对分子质量小、β-构型高、半乳糖含量高的事实相一致。Srijiwangsa等[59]发现,β-桉叶醇可以通过抑制胆管癌细胞和细胞裂解物中的NAD(P)H醌氧化还原酶1[NAD(P)H quinonedehydrogenase 1,NQO1]的活性和蛋白表达,增强氟尿嘧啶和多柔比星对细胞迁移的细胞毒性活性和抑制活性。Mai等[60]将不同浓度的苍术内酯I、硼替佐米以及硼替佐米+苍术内酯I作用于U266细胞结果研究发现,苍术内酯可以调节JAK2/STAT3通路上的IL-6、JAK2、STAT3等基因表达抑制U266肿瘤细胞的增殖和促进其凋亡并呈剂量依赖性,并能与硼替佐米产生协同作用,当苍术内酯I与硼替佐米联合使用时,可显著增强对U266细胞增殖的抑制作用。 紫杉醇是第一个获得批准的草药衍生化疗药物[61]。并且作为一种已知的Toll受体4配体(toll-like receptor 4 ligand,TLR4),可激活TLR4/MyD88依赖性途径,该通路介导了上皮性卵巢癌的化学耐药性和肿瘤进展。苍术内酯I是一种新型TLR4拮抗剂,通过干扰紫杉醇与人白细胞膜TLR4的结合,来抑制TLR4信号传导。Huang等[62]研究发现苍术内酯-I可以减弱紫杉醇诱导的IL-6、VEGF和存活蛋白的蛋白表达,并增强MyD88(+)EOC人卵巢癌细胞的早期凋亡和生长抑制;苍术内酯I被发现更加亲和人髓样分化蛋白2(myeloid differentiation 2,MD-2)的疏水囊,并通过对接模拟与紫杉醇的结合位点部分重叠,这表明苍术内酯-I可能阻断MyD88(+)EOC细胞中MD-2介导的TLR4/MyD88依赖性紫杉醇信号传导。因此,苍术内酯-I可以通过阻断MD-2介导的TLR4/MyD88信号传导,显著提高MyD88(+)EOC细胞对紫杉醇的反应。 结缔组织生长因子(connective Tissue Growth Factor,CTGF)是一种多功能信号调节剂,可通过调节细胞增殖、迁移、侵袭、耐药性和EMT来促进癌症的发生、进展和转移。CTGF还参与大多数节点的肿瘤微环境,包括血管生成、炎症和肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)激活[63]。Wang等[64]研究发现,苍术内酯-I可以下调三阴性乳腺癌细胞中CTGF的表达和分泌。除了通过CTGF抑制三阴性乳腺癌细胞迁移外,苍术内酯-I还下调了成纤维细胞中CTGF的表达,降低了乳腺癌细胞将成纤维细胞转化为CAFs的能力,从而增加了三阴性乳腺癌细胞对紫杉醇的敏感性。在小鼠肿瘤模型中,发现苍术内酯-I治疗可以增强紫杉醇对肿瘤的化疗作用,减少肿瘤向肺和肝的转移。在用苍术内酯-I与紫杉醇联合治疗的小鼠中,源自接种肿瘤的原代培养的成纤维细胞表达相对较低水平的CAFs标志物。 研究表明了苍术内酯-I可以通过阻断CTGF表达和成纤维细胞活化来使三阴性乳腺癌细胞对紫杉醇敏感,还可以通过阻断MD-2介导的TLR4/MyD88信号传导,显著提高肿瘤细胞对紫杉醇的反应并。这些机制有助于未来研究以确定苍术内酯I在临床环境中的价值。对苍术化学成分联合治疗归纳总结,见表3。 图片 4 结语与展望 苍术中含有多种抗肿瘤成分,其中多为倍半萜类成分,如苍术酮、苍术素和苍术内酯等,这些成分多是通过调控PI3K/Akt/mTOR通路来发挥抗肿瘤的作用,但作用靶点与方式却各不相同。例如苍术内酯主要通过降低Akt的磷酸化水平、上调Bax和Bad蛋白表达、增加脂质磷酸酶(PTEN)活性来抑制该通路进而诱导肿瘤细胞凋亡[20];β-桉叶醇能通过激活p27抑制cyclinD1和CDK4蛋白表达最终导致细胞周期停滞于G1期[19]。这些成分通过多途径、多靶点影响肿瘤细胞的生存、运动、代谢和迁移进而共同发挥抗肿瘤作用。正因为其作用机制的不同,使其各有效成分对不同肿瘤的作用具有一定特异性。因此苍术抗肿瘤活性成分联合化疗药物减副增效在科学研究及临床用药时可根据其作用机制进行选择。目前关于苍术化合物对肿瘤细胞的研究还存在一些不足之处,如缺乏对不同肿瘤细胞类型和不同剂量的系统比较、缺乏对苍术化合物与其他药物或放化疗的协同作用的评价,以及缺乏对苍术化合物在体内代谢和药效学的深入分析等。 因此,今后还需要加强对苍术化合物抗肿瘤作用的基础和临床研究。后续可以根据苍术有效成分的抗肿瘤作用机制,筛选出具有最强抗肿瘤活性和最低毒性的化合物,作为候选药物进行进一步的优化和改造,提高其药效和安全性;分析苍术中有效成分的药代动力学特征,研究其在体内的吸收、分布、代谢和排泄等过程,确定其最佳的给药途径、剂量和方案,减少其不良反应和药物相互作用;根据苍术中有效成分的药效学特征,研究其对不同类型、分期和分子标志物的肿瘤细胞的作用差异,确定其最适合的治疗对象和指标,提高其个体化和精准化的治疗效果;根据苍术有效成分的协同增效或拮抗作用,探索其与其他抗癌药物或放化疗的联合应用,实现其对肿瘤细胞的多靶点、多途径和多机制的综合干预,增强其抗肿瘤效能和克服肿瘤耐药性,以期为开发新型的抗肿瘤药物提供更多的选择和可能性。 苍术与化疗药物的联合应用被广泛关注和探索。作为苍术的主要成分,现有研究已表明倍半萜类具有显著的抗肿瘤活性,其与化疗药物的联合临床用药有着巨大的潜力。但倍半萜类化合物分子结构中含有多个疏水基团,导致它们的极性较低,难以与水分子形成氢键或静电相互作用,在水中的溶解度小、生物利用度低。随着现代药物研究技术的现代化和多学科的交叉融合,这些问题也可以通过引入基团、采用纳米技术制备纳米载体、采用共晶技术制备倍半萜类化合物的共晶体等方式来提高其水溶性,进而增强其生物利用度。这些技术在药物化学领域已比较成熟,也已逐步应用于临床药物的开发。例如,抗疟活性药物青蒿素同样具有水溶性差应用困难的问题,通过引入羧酸基团,显著提高了其水溶性和生物利用度[65-66]; 此外,共晶体可以改变倍半萜类化合物的晶型和晶格参数,从而降低其结晶度和熔点,增加其自由能和溶解度[67]。苍术内酯也可通过与尼可替尼(一种具有较高水溶性的抗肿瘤药物)制备共晶体,可以显著提高其水溶性。因此,苍术抗肿瘤有效成分和化疗药物的联合用药在临床环境中的开发和应用具有很高的研究价值。 苍术作为中医临床常用的化湿药。其药性辛、苦、温,归脾、胃、肝经,其苦温燥湿,可以去湿浊、辛温健脾以和脾胃,多用
肿瘤是指体内细胞的异常增生,可以是良性的或恶性的。良性肿瘤(例如息肉)生长缓慢且通常局限在一个区域,不会侵犯周围组织或扩散到其他部位。恶性肿瘤(即癌症)具有侵袭性,可以快速生长并通过血液或淋巴系统扩散到其他身体部位,形成远处转移。癌症是一种严重威胁人类健康和生命的疾病,2020年全球有1 930万新增癌症病例和1 000万癌症死亡病例,且我国癌症发病率和死亡率均位居全球第一[1]。最常见的癌症类型是乳腺癌、肺癌、结直肠癌和前列腺癌。因此,寻找新的抗肿瘤药物,阐明抗肿瘤药物的分子机制,是解决当前临床肿瘤治疗难点的有效策略。中药具有多种有效成分,因其不良反应低、多靶点、多通路等优点,已成为抗肿瘤药物开发的重要来源和研究热点[2]。目前,常规的肿瘤症治疗方法为手术、放射治疗和化学治疗等,但这些方法往往伴随着较大的不良反应和毒性,而且对某些难治性或复发性肿瘤效果不佳[3]。因此,寻找有效、低毒的抗肿瘤药物是当前临床研究的重要方向。 苍术是一种常用的中药材,分为茅苍术Atractylodes lancea (Thunb.) DC.和北苍术A. chinensis (DC.) Koidz.,分别来源于菊科植物茅苍术或北苍术的干燥根茎。苍术具有燥湿健脾、祛风散寒的功效,在《神农本草经》中列为上品[4]。近年来,苍术在抗微生物、抗炎、抗肿瘤、免疫调节、调节消化系统、心血管系统和神经系统等方面的药理作用受到了广泛关注。苍术中含有挥发油、多糖、倍半萜类、聚乙炔类等[5]多种化学成分。其中一些成分已经被证实具有抑制或杀伤多种肿瘤细胞的能力,其作用机制涉及诱导凋亡、抑制增殖、迁移、侵袭和转移,以及调控免疫功能等方面[6]。然而,苍术中的抗肿瘤活性成分及其作用机制尚未完全明确,需要进一步深入地探索和验证。本文通过整理国内外研究文献,对苍术活性成分、苍术与其他药物联合抗肿瘤及其分子机制进行总结,探讨苍术在抗肿瘤方面的应用规律和思路,为苍术资源的开发利用以及抗肿瘤临床疗法的研究提供理论参考。 1 苍术主要化学成分 茅苍术与北苍术化学成分相似,药理作用也较为相似,目前已从苍术中分离出多种化学成分,主要含有包括萜类、聚乙烯炔类、有机酸类、糖苷类化合物等[7-8]。苍术主要抗肿瘤化学成分,见图1。茅苍术与北苍术中主要化学成分如表1所示。 图片 图片 2 苍术的抗肿瘤机制 苍术中含有苍术内酯Ⅰ、Ⅱ、Ⅲ、苍术酮、β-桉叶醇和苍术素等有效成分,这些成分不仅可以抗炎、抗氧化、抗菌、保肝、降血糖,还可以抗肿瘤[14-15]。近年来,苍术及其有效成分对肿瘤的抑制作用受到了广泛的关注。研究发现,苍术有效成分对多种肿瘤细胞都有抑制作用,可以通过多种途径和机制影响肿瘤细胞的生长、迁移、侵袭和血管生成,诱导肿瘤细胞的凋亡和自噬,调节肿瘤微环境和免疫系统。 2.1 抑制肿瘤细胞增殖 肿瘤是由于细胞增殖失控而形成的一种疾病[16]。细胞周期是细胞增殖的基本过程,由细胞周期蛋白(cyclin,CCN)和细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)复合物共同调控[17]。干预细胞周期是抑制肿瘤发展的有效策略之一[18]。Kotawong等[19]发现,苍术中的苍术素、苍术内酯I和β-桉叶醇等有效成分可以通过影响肿瘤细胞周期的不同阶段来抑制肿瘤细胞的增殖。这些成分可以通过抑制磷脂酰肌醇-3-羟激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)、磷酸化蛋白激酶B(protein kinase B,AKT)和哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路来诱导肿瘤细胞在G1期停滞;Yu等[20]发现苍术内酯I通过上调周期蛋白依赖性激酶抑制剂1A(cyclin-dependent kinase inhibitor 1A,p21)和下调cyclinB1、CDK1和细胞分裂周期25C蛋白(cell division cyclin25,Cdc25c)等关键分子来抑制肿瘤细胞在G2/M期的进入,在动物模型中,苍术内酯I可以显著抑制膀胱癌的生长,且无明显不良反应。Zhang等[21]实验发现苍术内酯Ⅱ可以通过改变结直肠癌细胞内的蛋白表达从而抑制结直肠癌细胞的增殖和活性,并且还显著增强了结直肠癌细胞的化疗敏感性。Pongsakorn等[22]发现,苍术提取物可以通过抑制细胞外信号调节激酶信号级联(ERK-signaling cascade,ERK)信号通路来抑制胆管癌细胞的增殖。ERK信号通路是一种重要的细胞内信号转导机制,参与调节细胞生长、分化和凋亡等过程。苍术提取物可以下调ERK及其下游分子的表达,从而抑制胆管癌细胞的生长和增殖,不同类型的胆管癌细胞对苍术提取物的敏感度不同,其中人胆管HuCCT-1癌细胞最为敏感。 2.2 诱导肿瘤细胞凋亡 细胞凋亡是一种程序性细胞死亡形式,它通过限制细胞的增殖和分化来维持组织稳态或去除潜在的有害细胞[23]。目前已知的细胞凋亡途径主要有3种,即外源性途径(死亡受体介导)、内源性途径(线粒体介导)和内质网途径。其中,线粒体途径是最重要的一种,它涉及线粒体外膜透化(outer mitochondrial membrane,MOMP)、细胞色素C释放和半胱天冬酶(cysteine aspartic acid protease,Caspase)激活[24]。多项研究发现,苍术酮可以通过降低线粒体膜电位、提高活性氧水平、抑制B细胞淋巴瘤-2基因(B-cell lymphoma-2,Bcl-2)表达、促进BCL2-相关X蛋白(BCL2-associated X protein,Bax)裂解和Caspase-3表达[25],以及下调PI3K/AKT/mTOR信号通路来诱导肿瘤细胞凋亡[26]。Narahara等[27]研究表明,β-桉叶醇和苍术内酯Ⅲ[27]可以通过增加Caspase-3、Caspase-8、Caspase-9和Bax等凋亡相关蛋白的表达、下调Bcl-2表达、释放细胞色素C和降低线粒体膜电位来诱导胆管癌细胞凋亡。此外,Li等[28]使用β-桉叶醇处理的白血病HL60细胞,发现β-桉叶醇可以通过激活c-JunN端激酶(c-Jun N-terminal kinase,JNK)丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路来诱导白血病HL60细胞凋亡。Li等[29]研究发现,苍术素可以通过降低Bcl-2表达、激活p53肿瘤蛋白(p53 tumor protein,p53)、Bax和Caspase-3、-8、-9等凋亡因子来诱导人乳腺癌MCF-7细胞凋亡,并表现出浓度依赖的毒性效应。Li等[30]研究表明,苍术内酯I和苍术内酯Ⅱ[31]可以通过与对两面针激酶2(Janus kinase 2,JAK2)直接相互作用而负调节信号传导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)磷酸化,从而抑制其活化,进而导致糖酵解的抑制和结肠、直肠癌细胞凋亡的诱导。 2.3 抑制肿瘤细胞转移 肿瘤细胞转移是指肿瘤细胞通过血液循环从原发部位转移到其他部位的过程,这是癌症治疗的难点,也是癌症死亡的主要原因[32]。上皮间质转化(epithelial-mesenchymal transition,EMT)是一种与癌症发生相关的细胞程序,它使癌细胞具有移动性、侵袭性和抗凋亡能力,从而促进转移。苍术的一些活性成分具有抑制肿瘤细胞转移的潜在作用,其机制可能涉及对EMT的调控[33]。Acharya等[34]研究发现,β-桉叶醇可以改变EMT相关标志物的表达,从而抑制结肠癌细胞的增殖、迁移和侵袭。同时它还可以影响PI3K、AKT、p38丝氨酸/苏氨酸蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)信号通路,以及肺癌细胞中的活性氧水平,从而降低癌细胞的黏附和迁移能力[35]。麦静愔等[36]发现苍术酮可以通过抑制EMT过程等途径抑制肿瘤细胞的迁移和侵袭能力,此外,苍术酮还可以通过下调基质金属蛋白酶(matrix metalloproteinase,MMP)的表达从而抑制肿瘤细胞的迁移和侵袭能力。MMP是一类能够降解细胞外基质(extracellular matrix,ECM)的锌依赖性内肽酶,在癌症进展中的作用与它们参与ECM降解以及黏附和细胞骨架蛋白、生长因子、趋化因子的调节和加工有关[37]。且有动物实验表明,苍术酮可以明显抑制肝癌生长,没有明显的毒性。Zhong等[38]在观察了苍术多糖在U-2 OS人骨肉瘤细胞中对内皮细胞选择素(endothelial cell selectin,E-Selectin)和路易斯X三糖(Lewis-X Trisaccharide,LacCer Lex)的影响,发现苍术多糖可通过降低U-2 OS细胞上的E-Selectin抑制U-2 OS细胞对人脐静脉内皮细胞HUVECs的黏附、迁移和侵袭。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)在促进肿瘤转移中发挥重要作用,Zhang等[39]发现苍术内酯II可以有效抑制肿瘤细胞极化,从而抑制肺癌细胞在体内和体外的转移。铁死亡是一种新的细胞死亡模式,其特征是铁过载导致脂质过氧化而导致膜损伤,过度的铁死亡会影响肿瘤的转移,从而抑制肿瘤的进展[40]。He等[41]发现,苍术素可通过抑制谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)和铁蛋白轻链(ferritin light chain,FTL)的表达,以及上调酰基辅酶A合成酶长链家族成员4(acyl-CoA synthetase long-chain family member 4,ACSL4)和转铁蛋白受体(transferrin receptor,TFR1)的表达来诱导肝癌HCCM细胞的铁死亡。 2.4 诱导肿瘤细胞自噬 细胞自噬是一种分解代谢通路,能清除不必要的或功能失调的细胞成分并回收代谢底物[42]。目前已知有3种主要的细胞死亡方式:细胞凋亡(Ⅰ型)、自噬性细胞死亡(Ⅱ型)和坏死(Ⅲ型)。自噬性细胞死亡是指自噬过程中产生的自噬体过多或过大,导致细胞质溶解和细胞死亡。自噬体是由双层膜包裹的囊泡,内含被降解的细胞器和蛋白质。微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)是自噬体形成的关键标志物,它以微管相关蛋白1A/1B-轻链3(microtubule-associated protein 1 light chain 3,LC3-I)和微管相关蛋白1轻链3的脂化形式(lipidated form of microtubule-associated protein 1 light chain 3,LC3-Ⅱ)2种形式存在,LC3-Ⅰ转化为LC3-Ⅱ是自噬体形成的必要步骤[43-44]。Li等[29]使用苍术素处理乳腺癌MCF-7细胞时发现,苍术素可以增加了LC3Ⅰ向其脂化形式的LC3Ⅱ的转化,并增加了苄氯素1(beclin-1,BECN1)的表达,下调了人乳腺癌MCF-7细胞中的p62蛋白(p62 protein,p62)表达,改变凋亡和自噬相关生物标志物。Acharya等[45]研究发现,苍术素通过调节PI3K、AKT、mTOR、p38MAPK信号通路的活性,可以诱导胆管癌HuCCT-1细胞发生自噬,并抑制其生长、迁移和侵袭,SB202190(p38MAPK诱导剂)和3-MA(p38MAPK抑制剂)分别显著增加和降低苍术素诱导的自噬速率。 2.5 抑制肿瘤血管生成 血管生成本身不会导致恶性肿瘤的形成,但可以为肿瘤的生长和转移提供条件。肿瘤在发展到一定阶段后,需要依赖新生血管来满足其对氧气和营养的增加的需求,以及排除代谢废物,因此,抑制血管生成是一种有效的抗肿瘤策略[46]。血红素加氧酶1(heme oxygenase 1,HO-1)是一种在肿瘤组织中高表达的酶,它可以促进肿瘤的血管生成和抗氧化应激,为肿瘤细胞提供生存优势。因此,抑制HO-1的表达或活性是治疗肿瘤的另一种有效策略之一。Mathema等[47]研究发现,苍术素可以抑制胆管癌CL6肿瘤细胞的集落形成和伤口愈合能力,其机制与抑制HO-1的表达、下调信号转导及转录激活蛋白1/3(signal transducer and activator of transcription 1/3,STAT1/3)和核因子κB(nuclear factor kappa-B,NF-κB)的信号通路有关。β-桉叶醇也具有抑制胆管癌细胞中HO-1的表达的能力,其机制与浓度依赖性地抑制STAT1/3和NF-κB信号通路有关[48]。β-桉叶醇还可以通过抑制生长因子信号通路中的环磷腺苷效应元件结合蛋白(cyclic-AMP response binding protein,CREB)激活来阻断血管生成,从而抑制肿瘤的发展[49]。Tsuneki等[50]有动物实验表明,β-桉叶醇可以通过激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)来刺激大鼠嗜铬细胞瘤细胞中的神经突生长,且β-桉叶醇还表现出了体外和体内的抗血管生成活性,其阻断了由碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)或血管内皮生长因子(vascular endothelial growth factor,VEGF)诱导的人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)中CREB蛋白的磷酸化,从而抑制bFGF刺激的HUVEC迁移和HUVEC在基质胶中的管形成。同时,它还能显著降低小鼠皮下植入的Matrigel栓塞和小鼠佐剂诱导的肉芽肿中的血管生成[51]。 2.6 免疫调节作用 随着肿瘤的发生和发展,或在接受化疗、放疗等治疗的过程中,肿瘤患者机体免疫力的显著下降。因此,调节或刺激机体免疫能力,可能是一种有效的主动抗癌策略。免疫治疗作为一种新型的抗癌手段,已经引起了广泛的关注和研究[52]。巨噬细胞是机体内重要的免疫细胞,在机体免疫中发挥着重要的作用[53]。Qin等[54]从苍术中分离得到两种多糖成分:中性多糖和酸性多糖。研究表明,酸性多糖能够显著地刺激小鼠单核巨噬细胞白血病细胞(RAW264.7)细胞的增殖、吞噬能力、NO产生和细胞因子分泌,并且呈现出剂量相关性,而中性多糖则相对较弱。此外,中性多糖和酸性多糖均能够激活淋巴结Peyers patch细胞中的T细胞,并促进集落刺激因子的产生。而酸性多糖也表现出比中性多糖更好的肠道免疫调节活性。吲哚胺-2,3-二氧化酶(indoleamine 2,3-dioxygenase,IDO)是一种通过犬嘌呤途径氧化分解色氨酸的限速酶,是抗肿瘤免疫治疗中小分子药物开发的潜在目标。IDO可在肿瘤微环境中通过与许多肿瘤相关的自发炎症和T细胞激活而被诱导。Liu等[55]研究发现,苍术内酯Ⅰ可以通过下调Toll样受体4/髓样分化蛋白2复合物(toll-like receptor 4/myeloid differentiation 2 complex,TLR4/MD-2)的表达,抑制人卵巢癌细胞(EOCSKOV3)中髓样分化主要反应蛋白88(myeloid differentiation primary response protein 88,MyD88)、NF-κB、Akt和IDO1的信号通路的活化,从而减少白细胞介素-6(interleukin-6,IL-6)、转化生长因子-β1(transforming growth factor beta 1,TGF-β1)、VEGF和白细胞介素-17A(interleukin-17A,IL-17A)等促进肿瘤免疫逃逸的因子的分泌。同时,还可以降低调节性T细胞(Treg细胞)在肿瘤微环境中的比例,改善T淋巴细胞受到EOCSKOV3细胞上清液抑制而导致的增殖反应降低和抗肿瘤细胞毒性减弱。Liu等[56]研究发现,苍术内酯Ⅲ可以通过直接结合JAK3蛋白,从而抑制γ-干扰素(interferon gamma,IFN-γ)触发的JAK3/STAT3通路,从而达到抑制IDO激活的目的。 苍术抗肿瘤成分的潜在分子机制见图2。对苍术抗肿瘤有效成分及其抗肿瘤作用进行归纳总结,见表2。 图片 图片 3 联合用药 西医治疗肿瘤的常用手段有手术切除、药物化疗和高能射线放疗等,这些手段去除肿瘤西医的治疗方式更为直接,适合前期控制病情,化疗药物虽然能够杀死肿瘤细胞,但同时也伴有严重的副作用,影响患者的生活质量和治疗效果。中药具有不良反应小、安全性高的特点,因此中药与化疗药物的联合应用被广泛关注和探索[57]。 阿帕替尼是全球第一个在晚期胃癌被证实安全有效的小分子抗血管生成靶向药物,也是晚期胃癌标准化疗失败后,明显延长生存期的单药。Zhou等[58] 分析了不同苍术多糖提取方法的影响。比较了热水浸提法、超声浸提法和酶浸提法提取苍术多糖的得率、总糖含量、相对分子质量分布、单糖组成、并测定苍术多糖与阿帕替尼的协同活性。结果发现其中超声浸提法表现出最强的协同作用。这也与超声浸提的苍术多糖相对分子质量小、β-构型高、半乳糖含量高的事实相一致。Srijiwangsa等[59]发现,β-桉叶醇可以通过抑制胆管癌细胞和细胞裂解物中的NAD(P)H醌氧化还原酶1[NAD(P)H quinonedehydrogenase 1,NQO1]的活性和蛋白表达,增强氟尿嘧啶和多柔比星对细胞迁移的细胞毒性活性和抑制活性。Mai等[60]将不同浓度的苍术内酯I、硼替佐米以及硼替佐米+苍术内酯I作用于U266细胞结果研究发现,苍术内酯可以调节JAK2/STAT3通路上的IL-6、JAK2、STAT3等基因表达抑制U266肿瘤细胞的增殖和促进其凋亡并呈剂量依赖性,并能与硼替佐米产生协同作用,当苍术内酯I与硼替佐米联合使用时,可显著增强对U266细胞增殖的抑制作用。 紫杉醇是第一个获得批准的草药衍生化疗药物[61]。并且作为一种已知的Toll受体4配体(toll-like receptor 4 ligand,TLR4),可激活TLR4/MyD88依赖性途径,该通路介导了上皮性卵巢癌的化学耐药性和肿瘤进展。苍术内酯I是一种新型TLR4拮抗剂,通过干扰紫杉醇与人白细胞膜TLR4的结合,来抑制TLR4信号传导。Huang等[62]研究发现苍术内酯-I可以减弱紫杉醇诱导的IL-6、VEGF和存活蛋白的蛋白表达,并增强MyD88(+)EOC人卵巢癌细胞的早期凋亡和生长抑制;苍术内酯I被发现更加亲和人髓样分化蛋白2(myeloid differentiation 2,MD-2)的疏水囊,并通过对接模拟与紫杉醇的结合位点部分重叠,这表明苍术内酯-I可能阻断MyD88(+)EOC细胞中MD-2介导的TLR4/MyD88依赖性紫杉醇信号传导。因此,苍术内酯-I可以通过阻断MD-2介导的TLR4/MyD88信号传导,显著提高MyD88(+)EOC细胞对紫杉醇的反应。 结缔组织生长因子(connective Tissue Growth Factor,CTGF)是一种多功能信号调节剂,可通过调节细胞增殖、迁移、侵袭、耐药性和EMT来促进癌症的发生、进展和转移。CTGF还参与大多数节点的肿瘤微环境,包括血管生成、炎症和肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)激活[63]。Wang等[64]研究发现,苍术内酯-I可以下调三阴性乳腺癌细胞中CTGF的表达和分泌。除了通过CTGF抑制三阴性乳腺癌细胞迁移外,苍术内酯-I还下调了成纤维细胞中CTGF的表达,降低了乳腺癌细胞将成纤维细胞转化为CAFs的能力,从而增加了三阴性乳腺癌细胞对紫杉醇的敏感性。在小鼠肿瘤模型中,发现苍术内酯-I治疗可以增强紫杉醇对肿瘤的化疗作用,减少肿瘤向肺和肝的转移。在用苍术内酯-I与紫杉醇联合治疗的小鼠中,源自接种肿瘤的原代培养的成纤维细胞表达相对较低水平的CAFs标志物。 研究表明了苍术内酯-I可以通过阻断CTGF表达和成纤维细胞活化来使三阴性乳腺癌细胞对紫杉醇敏感,还可以通过阻断MD-2介导的TLR4/MyD88信号传导,显著提高肿瘤细胞对紫杉醇的反应并。这些机制有助于未来研究以确定苍术内酯I在临床环境中的价值。对苍术化学成分联合治疗归纳总结,见表3。 图片 4 结语与展望 苍术中含有多种抗肿瘤成分,其中多为倍半萜类成分,如苍术酮、苍术素和苍术内酯等,这些成分多是通过调控PI3K/Akt/mTOR通路来发挥抗肿瘤的作用,但作用靶点与方式却各不相同。例如苍术内酯主要通过降低Akt的磷酸化水平、上调Bax和Bad蛋白表达、增加脂质磷酸酶(PTEN)活性来抑制该通路进而诱导肿瘤细胞凋亡[20];β-桉叶醇能通过激活p27抑制cyclinD1和CDK4蛋白表达最终导致细胞周期停滞于G1期[19]。这些成分通过多途径、多靶点影响肿瘤细胞的生存、运动、代谢和迁移进而共同发挥抗肿瘤作用。正因为其作用机制的不同,使其各有效成分对不同肿瘤的作用具有一定特异性。因此苍术抗肿瘤活性成分联合化疗药物减副增效在科学研究及临床用药时可根据其作用机制进行选择。目前关于苍术化合物对肿瘤细胞的研究还存在一些不足之处,如缺乏对不同肿瘤细胞类型和不同剂量的系统比较、缺乏对苍术化合物与其他药物或放化疗的协同作用的评价,以及缺乏对苍术化合物在体内代谢和药效学的深入分析等。 因此,今后还需要加强对苍术化合物抗肿瘤作用的基础和临床研究。后续可以根据苍术有效成分的抗肿瘤作用机制,筛选出具有最强抗肿瘤活性和最低毒性的化合物,作为候选药物进行进一步的优化和改造,提高其药效和安全性;分析苍术中有效成分的药代动力学特征,研究其在体内的吸收、分布、代谢和排泄等过程,确定其最佳的给药途径、剂量和方案,减少其不良反应和药物相互作用;根据苍术中有效成分的药效学特征,研究其对不同类型、分期和分子标志物的肿瘤细胞的作用差异,确定其最适合的治疗对象和指标,提高其个体化和精准化的治疗效果;根据苍术有效成分的协同增效或拮抗作用,探索其与其他抗癌药物或放化疗的联合应用,实现其对肿瘤细胞的多靶点、多途径和多机制的综合干预,增强其抗肿瘤效能和克服肿瘤耐药性,以期为开发新型的抗肿瘤药物提供更多的选择和可能性。 苍术与化疗药物的联合应用被广泛关注和探索。作为苍术的主要成分,现有研究已表明倍半萜类具有显著的抗肿瘤活性,其与化疗药物的联合临床用药有着巨大的潜力。但倍半萜类化合物分子结构中含有多个疏水基团,导致它们的极性较低,难以与水分子形成氢键或静电相互作用,在水中的溶解度小、生物利用度低。随着现代药物研究技术的现代化和多学科的交叉融合,这些问题也可以通过引入基团、采用纳米技术制备纳米载体、采用共晶技术制备倍半萜类化合物的共晶体等方式来提高其水溶性,进而增强其生物利用度。这些技术在药物化学领域已比较成熟,也已逐步应用于临床药物的开发。例如,抗疟活性药物青蒿素同样具有水溶性差应用困难的问题,通过引入羧酸基团,显著提高了其水溶性和生物利用度[65-66]; 此外,共晶体可以改变倍半萜类化合物的晶型和晶格参数,从而降低其结晶度和熔点,增加其自由能和溶解度[67]。苍术内酯也可通过与尼可替尼(一种具有较高水溶性的抗肿瘤药物)制备共晶体,可以显著提高其水溶性。因此,苍术抗肿瘤有效成分和化疗药物的联合用药在临床环境中的开发和应用具有很高的研究价值。 苍术作为中医临床常用的化湿药。其药性辛、苦、温,归脾、胃、肝经,其苦温燥湿,可以去湿浊、辛温健脾以和脾胃,多用于湿
自噬促进肿瘤形成:一种新观点Tangdl2000点评 细胞自噬(autophagy)是一种基本的细胞应激调控机制,细胞可以通过自噬和溶酶体,消除、降解和消化受损、变性、衰老和失去功能的细胞、细胞器和变性蛋白质与核酸等生物大分子。为细胞的重建、再生和修复提供必须原料,实现细胞的再循环和再利用。它既是体内的“垃圾处理厂”,也是“废品回收站”;它既可以抵御病原体的入侵,又可保卫细胞免受细胞内毒物的损伤。 自噬与肿瘤关系密切,主要体现在两个方面:1)调控肿瘤发生,2)影响肿瘤治疗疗效。过去传统的观点是认为自噬抑制了肿瘤形成,主要证据有:1)很多人类肿瘤在遗传学上出现自噬基因的缺失;2)自噬基因敲除老鼠(例如Beclin1, UVRAG等)出现自发性肿瘤。但是,随着研究的深入,2010年12月13日,《Oncogene》杂志在线发表了杜克大学的一项研究成果,该研究表明自噬不但能够肿瘤形成,而且也能促进白血病肿瘤的形成,这无疑是对现有理论体系的补充和挑战。也再次提醒人们重视一些基本的自然规律,即事物具有双面性。同时我们也应该清楚的看到生物是多样性的,肿瘤也不例外,每种肿瘤的发生机制并不完全一样。 杜克大学的这项研究的主要发现有:利用一种条件性Atg3自噬基因敲除老鼠体内外证实了抑制自噬防治了BCR-Abl融合基因介导的白血病发生。BCR-Abl融合基因是人体细胞第9号染色体上的Abl原癌基因与第22号染色体上的Bcr基因相互易位形成的融合基因。可引起蛋白激酶持续性激活,使白细胞过分增殖而出现慢性粒细胞白血病。此外,作者发现抑制自噬后增加了细胞凋亡(apoptosis),包括p53磷酸化,上调p21和PUMA等促凋亡通路。 值得注意的事,近年来也出现了有关细胞凋亡促进肿瘤发生的研究报告。例如CD95促进了肝癌以及卵巢癌肿瘤的发生,PUMA促进了淋巴瘤的发生。这一系列研究清楚的表明自噬或者凋亡促进或者抑制肿瘤发生具有细胞和组织特异性。总之我们在关注这些基本细胞机制和通路的“主要角色”的同时,要注意其“次要角色”,关注“阴阳”。
对结构独特、活性显著的天然产物进行生物合成研究是从基因簇、生物合成途径及酶催化反应角度理解自然界“全合成”的生物-化学过程。中国科学院上海有机化学研究所生命有机化学国家重点实验室唐功利课题组多年来致力于复杂抗肿瘤天然产物的生物合成研究,经过几年的努力,该课题组最近在两个课题上均取得突破。 抗生素谷田霉素(Yatakemycin,YTM)可以抑制致病真菌,且对肿瘤细胞表现出极强的毒性(比抗肿瘤药物丝裂霉素的活性高约1000倍);该家族化合物属于DNA烷基化试剂,典型的结构特征是吡咯吲哚环上的环丙烷结构。为了阐明其独特的生物合成机制,课题组利用全基因组扫描技术定位其生物合成基因簇,通过基因敲除结合生物信息学分析确定了基因簇边界。在对突变株的发酵检测中成功分离鉴定了中间体YTM-T的结构,并结合体外生化实验揭示了一类同源于粪卟啉原III-氧化酶(Coproporphyrinogen III oxidase)的甲基化酶以自由基机理催化YTM-T发生C-甲基化(J. Am. Chem. Soc., 2012, 134, 8831-8840),这是此类蛋白催化自由基甲基化反应的首例报道。这一阶段性结果为下一步阐明YTM结构中最重要的环丙烷部分生物合成途径奠定了基础。 萘啶霉素(Naphthyridinomycin,NDM)、奎诺卡星(Quinocarcin,QNC)及Ecteinascidin 743 (ET-743)均属于四氢异喹啉生物碱家族化合物,它们都具有显著的抗肿瘤活性,其中ET-743已发展为第一例海洋天然产物来源的抗肿瘤新药。这三种化合物都具有一个独特的二碳单元结构,其生物合成来源问题一直没有得到解决。为了揭示这一谜团,唐功利课题组在克隆了NDM和QNC生物合成基因簇的基础上,通过前体喂养标记、体内相关基因敲除-回补以及体外酶催化反应等多种实验手段相结合的方式,阐明了二碳单元的独特生源合成机制:NapB/D及QncN/L在催化功能上均属于丙酮酸脱氢酶及转酮醇酶的复合体,它们负责催化二碳单元由酮糖转移至酰基承载蛋白(ACP)上,而后经过非核糖体蛋白合成(NRPS)途经进入到最终的化合物中。这一结果发表在《美国国家科学院院刊》(Proc. Natl. Acad. Sci. USA, 2012, 109, 8540-8545)上。这种将基础代谢中的酮糖直接转化为次级代谢所需要的二碳单元在非核糖体肽合成途经中是首次报道,该研究结果也有助于揭示海洋药物ET-743独特的二碳单元生物合成来源,为非核糖体聚肽类天然产物的组合生物合成带来新的前体单元。 上述研究工作得到国家自然科学基金委、科技部和中国科学院的资助。http://www.cas.cn/ky/kyjz/201207/W020120704343205531340.pngYTM合成机制http://www.cas.cn/ky/kyjz/201207/W020120704343205536236.gif四氢异喹啉生物碱化合物的独特生源合成机制

题目:基于仿生分子识别的肿瘤早期诊断与实时动态成像研究报告人:王雪梅东南大学生物电子学国家重点实验室http://ng1.17img.cn/bbsfiles/images/2012/11/201211051627_401550_1732407_3.jpg
各国争相发展的重点项目 iPS技术,即诱导性多能干细胞技术,是一种将成体成熟、分化的体细胞重编程获得类似胚胎干细胞的新兴技术。2007年11月美国和日本科学家分别独立宣布可将人类皮肤细胞转化为iPS细胞。这一发现被《自然》和《科学》杂志分别评为2007年第一和第二大科学进展。之后,iPS细胞研究迅猛发展,不同的国家和实验室纷纷报道了多种方法建立的iPS细胞系。就连世界第一只体细胞克隆动物多利羊的培育者伊恩·威尔莫特也宣布放弃人类胚胎干细胞克隆研究,转而进行 iPS 细胞研究,因为他认为这种细胞比胚胎干细胞更具潜在优势。 我国连续多年将干细胞研究列入“863”、“973”、国家自然基金重点项目。国务院2006年发布的《国家中长期科学和技术发展规划纲要(2006-2020年)》中,干细胞作为五项生物技术之一成为未来15年我国前沿技术的重点研究领域。 致瘤风险浮出水面 Yamanaka研究组在《自然·生物技术》上发表的文章显示,用iPS细胞诱导的神经干细胞,即使不含c-Myc(曾被认为是导致肿瘤的主要原因),在植入NOD/SCID免疫缺陷小鼠后仍有很强的致瘤性,甚至高于胚胎干细胞。 他们共研究了36个iPS细胞克隆,在诱导方式上,有些诱导剂配方中含有c-Myc基因,有些没有,因此具有较好的代表性。同时他们选择了3株胚胎干细胞作为对照。在45周的观察中,移植胚胎干细胞来源神经干细胞的34只小鼠有4只长出肿瘤。在100只移植胚胎成纤维细胞来源的iPS神经干细胞小鼠中34只发现肿瘤,概率和胚胎干细胞相当。在55只移植成人成纤维细胞来源的iPS神经干细胞小鼠中46只发现肿瘤,概率远高于胚胎干细胞。在36只移植肝细胞来源的iPS神经干细胞小鼠中10只发现肿瘤,概率高于胚胎干细胞。8只移植胃上皮细胞来源的iPS神经干细胞小鼠中未发现肿瘤。病理学检查证实肿瘤均为畸胎瘤,部分为恶性畸胎瘤。 研究还发现,以前认为致瘤性很强的c-Myc在去掉后并没有减少iPS神经干细胞的致瘤性,相反以前认为没有致瘤性的Nanog基因却可以明显增强iPS神经干细胞的致瘤性。 这次试验的另一个意外结果是并未发现在生成的肿瘤细胞中有c-Myc或其他基因的激活。以前的观点认为,转入的癌基因是iPS致瘤性的基础,只要在iPS细胞诱导成功后通过各种方法去除已完成使命的癌基因即可使iPS细胞免于致瘤性。这次试验的结果无疑给这些想法留下了阴影,而且使iPS致瘤的机制更加扑朔迷离。

[size=18px][b][font=宋体][color=red]2022[/color][/font][font=宋体][color=red]年6月24日9:00[/color][/font][/b][/size][font=宋体][size=17px][color=#656565],仪器信息网联合Cytiva将共同举办“2022转化医学系列讲座之肿瘤免疫学研究专场”,[/color][/size][/font][b][font=宋体][color=#00886f]与您共同探讨免疫学热门词汇调节性T细胞、TIL、TCR-T细胞及其相关免疫疗法的新进展和新技术[/color][/font][/b][font=宋体][size=17px][color=#18181b]。[/color][/size][/font][img]https://simg.instrument.com.cn/bbs/images/brow/em17.gif[/img][size=18px]亮点先览:[url=https://www.instrument.com.cn/webinar/meetings/transmed2022/][color=#ff0000]【点击报名参会】[/color][/url][/size][font=黑体, SimHei][color=#0070c0]1.重点介绍FOXP3+调节性T细胞功能可塑性及稳定性分子机制研究新进展,以及组织特异性Treg, 特别是自身免疫病,肥胖及衰老相关糖尿病以及肿瘤微环境中FOXP3+Treg功能与免疫疗法相关新进展[/color][/font][font=黑体, SimHei][color=#0070c0]2.通过研究免疫系统和肿瘤之间的相互作用,鉴定肿瘤特异的免疫细胞,尤其是识别肿瘤抗原的T细胞,以及肿瘤细胞抵抗免疫攻击的逃逸机制,从中发现新的治疗靶标,建立高效的肿瘤免疫治疗新方法[/color][/font][font=黑体, SimHei][color=#0070c0]3.肿瘤浸润淋巴细胞TIL疗法的进展与挑战[/color][/font][font=黑体, SimHei][color=#0070c0]4.Cytiva层析技术助力肿瘤免疫学研究[img=,690,1338]https://ng1.17img.cn/bbsfiles/images/2022/06/202206201552215665_2656_2507958_3.jpg!w690x1338.jpg[/img][/color][/font]
作者:丁香园网友Docofsoul《每日科学》2011年9月1日报道——由瑞士联邦理工学院(ETH)Yaakov Benenson教授与麻省理工Ron Weiss教授率领的研究小组成功地将生物“计算机”诊断网络导入人类细胞。该网络有识别某些肿瘤细胞的能力,利用五种肿瘤特异性分子因子的逻辑组合,进而触发肿瘤细胞毁灭过程。http://img1.jiansuo.net/cms/upload/userfiles/image/2011/09/04/1315042501_small.jpg细胞微机布线图:所有五种因子必须处于相应的正确状态,由此触发细胞死亡(图片来源:y Benenson Y. 教授 R. Weis教授)开发活体细胞内运作的生物电脑,是ETH苏黎世分院合成生物学教授Yaakov (Kobi) Benenson孜孜以求的目标,其职业生涯的大部分时间都倾注于此。他想建立既能侦测细胞生存状况、又能在细胞异常时对相应信息进行处理以提供合适的治疗响应的生物微机。目前,通过与麻省理工教授Ron Weiss以及团队成员(包括博士后学者Zhen Xie 与 Liliana Wroblewska、博士生Laura Prochazka)合作,他向这一目标迈出了重大一步。这一研究成果已发表于《Science》(见本文所附参考文献),论文介绍了一种多基因合成“电路”;此电路负责鉴别正常细胞与肿瘤细胞、继而进一步摧毁肿瘤细胞。其工作方式是:对细胞内五种肿瘤特异性分子因子及其出现频率进行抽样与综合;只有当所有这些因子在细胞内同时出现时,该电路才会作出正识别响应。这种方式使得侦测肿瘤的准确率非常高。研究者希望这一成果能够为高特异性抗癌治疗奠定基础。对肿瘤细胞的选择性破坏本研究对实验室培养的两种类型人类细胞进行了基因网络测试:海拉细胞(子宫颈癌细胞)与正常细胞。当基因生物微机被导入这两种不同的细胞类型时,只有海拉细胞被摧毁,而正常细胞则安然无恙。当然,取得这一结果需要做大量的基础工作。首先必须找出海拉细胞特有的分子组合。Benenson及其他小组成员在属于小RNA分子(MicroRNA或miRNA)这一类化合物的分子中找,终于确认其中一个miRNA组合(或者说“可识别属性”)只有海拉细胞才有,其它健康细胞类型内则不存在。发现这种可识别属性是一项颇具挑战性的任务。人体内既存在250种不同的健康细胞类型,此外也存在为数众多的肿瘤细胞的变异型(其中数百种可作实验室培养)。但miRNA多样性则更是不让须眉花样繁多,人类细胞中已得以描述的即达500到1000不同种类。Benenson指出:“每种健康或病损细胞类型都有其不同的miRNA分子处于开放或关闭状态。”可识别肿瘤属性中的五种因子确立一种miRNA“可识别属性”与发现一组症状以可靠诊断一种疾病有所不同。教授说:“一种症状,比如说发热吧,不可能由此概括出一种疾病。医生获得的信息越多,其诊断才越可靠。” 一年半前他从哈佛大学到ETH后,研究小组找到了几种因子,可由此可靠地将海拉细胞从所有其它健康细胞中鉴别出;结果表明,仅仅五种特定miRNA的组合(其中某些以高水平出现,某些则以极低水平出现)就足以将海拉细胞从其混迹的健康细胞中揪出来。与微机运作相似的网络Benenson介绍说:“这些miRNA因子在细胞内进行逻辑代数运算;该生物微机运用诸如‘与’与‘非’等逻辑操作将这些因子进行组合,并且,当全部因子的整体运算结果为逻辑‘真’值时,只产生所需要的结果——那就是细胞死亡。” 确实,研究者已经能够显示该网络在活体细胞内可以非常稳定地运作,可正确组合所有细胞内因子并给出正确的诊断。Benenson认为,这一成果代表该领域的一项重大成就。动物模型与基因疗法该研究小组想在下一步在合适的动物模型上测试该细胞计算方法,以期在未来创建诊断与治疗工具。这听起来可能象科幻小说,但Benenson相信其可行性;不过,仍有不少棘手的问题需要解决。比如,如何有效、安全地将外源基因导入细胞?这种DNA递送在目前情况下颇具挑战性。尤其是,该方法需要将外源基因暂时而不是永久导入细胞。现有的病毒导入法或化学导入法均未充分开发,需要进一步完善。Benenson说:“为人类提供一种功能完善的治疗方法还非常遥远。不过这一工作是重要的第一步,显示了单一细胞水平上这样一种选择性诊断方法具有可行性。”参考文献:1. Z. Xie, L. Wroblewska, L. Prochazka, R. Weiss, Y. Benenson. Multi-Input RNAi-Based Logic Circuit for Identification of Specific Cancer Cells. Science, 2011; 333 (6047): 1307 DOI: 10.1126/science.1205527
4月9日,沪上首台磁共振加速器在复旦大学附属肿瘤医院正式投入临床使用,这意味恶性肿瘤的精准放射治疗又新添了一把“利器”。该治疗系统治疗的肿瘤主要是头颈部肿瘤、乳腺癌、肝脏肿瘤、胰腺癌、胃、结直肠等,接下来,医院还将针对软组织肿瘤、食管癌、宫颈癌、前列腺癌等其它肿瘤开展治疗。此外,基于磁共振加速器的系列科学研究已经在持续开展中,包括基于MR-LINAC的一站式自适应放疗的临床应用、MR引导下直肠癌新辅助放化疗联合免疫治疗的前瞻性临床研究等。这是一种光子放疗新模式,其创新在于:加速器根据实时的核磁共振图像,精准区分患者肿瘤组织和周围器官,通过高精度放射线照射肿瘤组织,医生全程“透视”并追踪肿瘤形态变化、实时调整治疗策略。复旦大学附属肿瘤医院放射治疗中心主任章真教授说:“作为肿瘤治疗的主要手段之一,放射治疗也被誉为'隐形的手术刀’。其通过高能量的放射线照射肿瘤组织,实现杀灭肿瘤的效果。70%的肿瘤患者在整个治疗过程中需要接受放射治疗,放疗早已不是既往公众认知中的'姑息性疗法’。'精准放疗时代的到来,越来越多的新'武器’让放射治疗再上新台阶。”章真说,“将影像设备和加速器结合在一台设备上,让医生能够在放射治疗过程中可以实时观察肿瘤状态和周围组织的运动,无疑可以引导放射线更精准地照射肿瘤,最大程度上减少对正常组织的损伤,减少放射治疗的并发症。”据了解,此次投入临床使用的磁共振加速器,便是将磁共振和加速器融为一体。凭借高分辨率、无辐射的磁共振成像,实时显示患者肿瘤病灶的清晰边界,无疑为放射治疗医生增加了一双“透视眼”,能够全程监测肿瘤患者的病灶状态,进而引导放射线精准治疗。该中心副主任胡伟刚教授介绍,通过该设备的在线自适应放射治疗管理系统,医生还可以根据患者的实际情况,实时调整放射治疗计划,为患者提供个性化的精准放疗方案。[来源:复旦大学附属肿瘤医院][align=right][/align]
心室内血流动力学与心脏功能相关。对血液动力学量(例如速度、涡流和压力)的准确、无创和容易的评估可能是对心脏疾病的临床诊断和治疗的重要补充。然而,复杂的时变流动给现有的基于图像的无创血流动力学评估带来了许多挑战。发展可靠的技术和分析工具对于临床实践中血液动力学生物标记的应用是必不可少的。方法在这项研究中,一种时间分辨粒子跟踪方法,摇盒,被用来重建一个现实的左心室(LV)生物瓣膜硅胶模型的流动。基于获得的速度,使用基于泊松方程的压力解算器计算4D压力场。此外,通过4D速度场的固有正交分解(POD)进行了流动分析。结果作为摇箱子算法的结果,我们提取了:(1)粒子位置,(2)粒子轨迹,最后,(3)4D速度场。从后者,获得了在整个心动周期期间3D压力场的时间演变。所获得的沿底部至顶点提取的最大压力差约为2.7 mmHg,这与体内报道的结果非常一致。POD分析结果显示了脉动左心室流中不同尺度涡流的清晰图像,以及它们随时间变化的信息和相应的动能含量。为了重建LV流的95%的动能,只需要前六个POD模式,这导致了显著的数据减少。结论这项工作表明,摇盒技术是一种有前途的技术,准确重建左心室流场体外。速度测量的良好空间和时间分辨率使得能够对左心室中的压力场进行4D重建。POD分析的应用显示了其在降低高分辨率左心室流量测量的复杂性方面的潜力。对于未来的工作,图像分析、多模态血流评估和新的血流衍生生物标志物的开发可以受益于快速和数据减少的POD分析。[img]https://ng1.17img.cn/bbsfiles/images/2023/11/202311251056317459_4966_1602049_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2023/11/202311251056317459_4966_1602049_3.png[/img][img]https://ng1.17img.cn/bbsfiles/images/2023/11/202311251056321257_4148_1602049_3.png[/img]
[center]靶向药物治疗肿瘤效果明显 市场潜力巨大[/center]近日,由阿斯利康举办的我国首届CSCO靶向治疗知识竞赛在上海、北京、广州3个赛区正式拉开序幕,据阿斯利康公司透露,此次竞赛的目的在于将肿瘤靶向治疗这一先进的治疗方法更广泛、更正确地应用于肿瘤的临床治疗中,从而通过多学科、多途径的治疗,尽可能地提高疗效,改善患者的生活质量。 据了解,肿瘤的发病率不断上升,其中肺癌是目前全球死亡率最高的肿瘤疾病之一。而近年来,我国肺癌尤其是非小细胞肺癌的发病率呈逐年上升的趋势。与此同时,作为治疗晚期非小细胞肺癌最常用的一种手段,化疗的疗效却已经进入了一个瓶颈阶段。 据中山大学肿瘤医院副院长林桐榆教授介绍,临床经验证明,化疗对非小细胞肺癌治疗的有效率一般在30%~40%左右,如何进一步提高疗效,改善患者的生活质量,延长患者的生存时间备受关注。肿瘤靶向治疗作为21世纪肿瘤治疗的热点,其优势在于,它以癌细胞作为特异性靶点,能够准确地作用于肿瘤,因此不会或者很少伤害正常细胞,产生的不良反应相对较小,已被证实能在多种肿瘤的治疗包括非小细胞肺癌、淋巴瘤、头颈癌、乳腺癌、结直肠癌等多种肿瘤的治疗中起到很大的作用。信息来源:医药经济报
选择性杀伤肿瘤细胞而减轻对正常组织的损伤是目前治疗肿瘤策略所面临的重大挑战。研究表明,由于肿瘤细胞的快速增殖,实体瘤细胞通常处于氧气、葡萄糖或其他营养物质匮乏的状态。因此,靶向葡萄糖缺乏的肿瘤细胞可能会成为选择性杀伤肿瘤细胞的一个新策略。 牛蒡子苷元是临床常用传统中药牛蒡子的主要活性成分。现有研究表明,牛蒡子苷元具有抗肿瘤活性,能够在多种肿瘤模型中有效抑制肿瘤生长。中科院上海药物研究所俞强课题组对牛蒡子苷元的抗肿瘤机制进行了深入研究,发现在葡萄糖缺乏条件下,牛蒡子苷元通过抑制线粒体呼吸造成肿瘤细胞内ATP水平下降以及活性氧族水平升高,从而促使肿瘤细胞死亡。 研究同时还发现,牛蒡子苷元和糖酵解抑制剂2-脱氧-D-葡萄糖联合使用能够选择性杀伤肿瘤细胞,而对正常细胞的毒性较低。 该项研究成果为用中药治疗肿瘤提供了新的依据和策略。相关论文已在线发表于Biochemical Pharmacology杂志。 该研究工作得到了国家自然科学基金和国家重大科技专项的资助。 论文链接http://www.cas.cn/ky/kyjz/201208/W020120806465949579476.jpg中药牛蒡子治疗肿瘤的机理研究取得进展
恶性肿瘤是当前严重影响人类健康、威胁人类生命的主要疾病之一,其早期检测及诊断对于降低患者死亡率与改善治疗效果有重大意义。而在众多检测靶点中,对于癌变细胞DNA变化的检测,是最直接、可靠、早期的检测方式之一。 G-四链体是由富含鸟嘌呤的DNA序列形成的一种特殊二级结构,其形成、解聚以及不同结构之间的转变涉及到体内一系列与肿瘤发生发展密切相关的过程的调控。在科技部、国家自然科学基金委和中国科学院的支持下,中科院化学研究所分子动态与稳态结构国家重点实验室唐亚林研究员课题组多年来致力于菁染料超分子聚集体识别和标记肿瘤相关DNA结构的研究工作,在识别特定结构DNA G-四链体方面取得了系列进展(J. Phys. Chem. B., 2008, 112, 8783-8787; Chem. Comm., 2009, 1103-1105)。韦顿-赫德克大学的Hans J. Lipps教授和剑桥大学的Daniela Rhodes教授在其综述中评述了这一成果,“为进一步认识人体端粒序列中的G4结构提供了新的证据和方法”(Trends in Cell Biology, 2009, 19(8), 414-422)。 课题组研究人员将这一检测技术成功应用于实际生理条件,在溶液体系和界面体系实现了对特定DNA G-四链体结构的识别(Anal. Chem., 2010, DOI: 10.1021/ac1017716),在上述工作基础上,该课题组通过对染料分子的结构设计,实现了在分子水平上对平行/混合结构的DNA G-四链体的高特异性、高灵敏性识别。该成果发表在在国际核酸领域最重要期刊之一Nucleic Acids Research(2010, 38, 1022-1033)(IF 7.479)上,受到国内外同行的关注。 这一技术为特定DNA结构的识别与标记提供了新的思路,有望应用于临床肿瘤早期预警与诊断。目前课题组正在与医院合作,将这一技术用于临床样本的检测及相关试验,已取得进展。http://ng1.17img.cn/bbsfiles/images/2010/11/201011272158_262379_1606681_3.jpg菁染料聚集体在溶液和界面识别特定DNA G-四链体结构示意图
常吃这7类食物易患肿瘤第一种:过食温热性食物。 所谓的温热性食物,一是指直接感受到的温度过高、过烫的食品;一是指属于中医药性划分中的温热之性食物。因为过于辛热,容易损伤消化道黏膜上皮细胞,所以这类性质的食品最易诱发的是消化系统的肿瘤。过烫饮食是导致食道癌等消化道肿瘤发生的重要原因。饮食过热,会损伤、刺激食道黏膜上皮,长期刺激下将诱导组织恶变。第二种:酒。 酒为辛热之性,长期饮酒,是消化系统肿瘤发病最常见的因素。山东西南地区为食道癌的高发区,就与这一地区饮食中嗜热、嗜酒有关。其实,早在1964年,世界卫生组织就认为酒精饮料的过度消费与口腔癌、喉癌及食道癌有关。在分别对江苏启东县肝癌相对高发的通兴乡与相对低发的西宁乡进行的调查中发现:前者肝癌病死率是后者的2.5倍。而两乡只有一路之隔,自然环境基本相同,吸烟率也相当,所不同的是肝癌高发区的人们爱喝酒,低发区的人们则喜欢饮茶。第三种:煎炸、熏烤的食物。 同样属于中医热性食物的还有煎炸、熏烤的食物,这类食物因经过高温的油炸和烤制,亦随之变为热性食品。经研究证实,长期食用此类食品,易于导致胃癌、肠癌、肝癌等。第四种:咖啡。 就像中国人嗜茶一样,西方人多喜喝咖啡。美国学者在经过5年的流行病学调查后认为,咖啡因对胰腺癌和膀胱癌的形成有一定影响。经常饮咖啡的人比不饮咖啡的人患这两种癌的可能性大2~3倍。在胰腺癌患者中,至少一半是由于过多饮用咖啡引起的。第五种:咸味太过的食物。 除了食盐,咸味食物还包括咸菜、咸鱼、咸肉以及其他腌制食品等。根据相关研究显示,常食腌制食品者食管癌发病的危险性是不常食用者的2.79倍。嗜食咸味食物最容易导致的癌症是胃癌。嗜食咸鱼的日本渔民,胃癌、食道癌的发生较为普遍。嗜食咸鱼亦是致鼻咽癌的一个重要因素。马来西亚研究人员发现,沿海居民患鼻咽癌较多,原因与他们爱吃咸鱼有关。我国普查资料证明,在胃癌高发区,人均每天摄人食盐50克;而胃癌低发区,人均食盐摄入量仅为6克左右。 第六种:霉烂食物。 黄曲霉毒素已被公认为是最强烈的致癌物,而黄曲霉菌富含于霉烂的谷物、玉米、花生中,该菌在温暖、潮湿的环境下易于生长繁殖,研究发现其可诱发实验动物的多种肿瘤。这种因素是导致亚洲、非洲某些地区癌肿高发的重要原因。第七种:腌制食品。 亚硝酸盐也是公认的致癌物,蔬菜、鲜肉等腌制后会产生大量的亚硝酸盐。盐腌的干鱼中,发酵的腌菜、泡菜、酸菜中,隔夜的煮熟白菜、香肠、肉类中都含有亚硝基化合物,如果经常食用这些食物就有致癌的危险。