国家高性能医疗器械创新中心获批成立!医械研发大发展在即
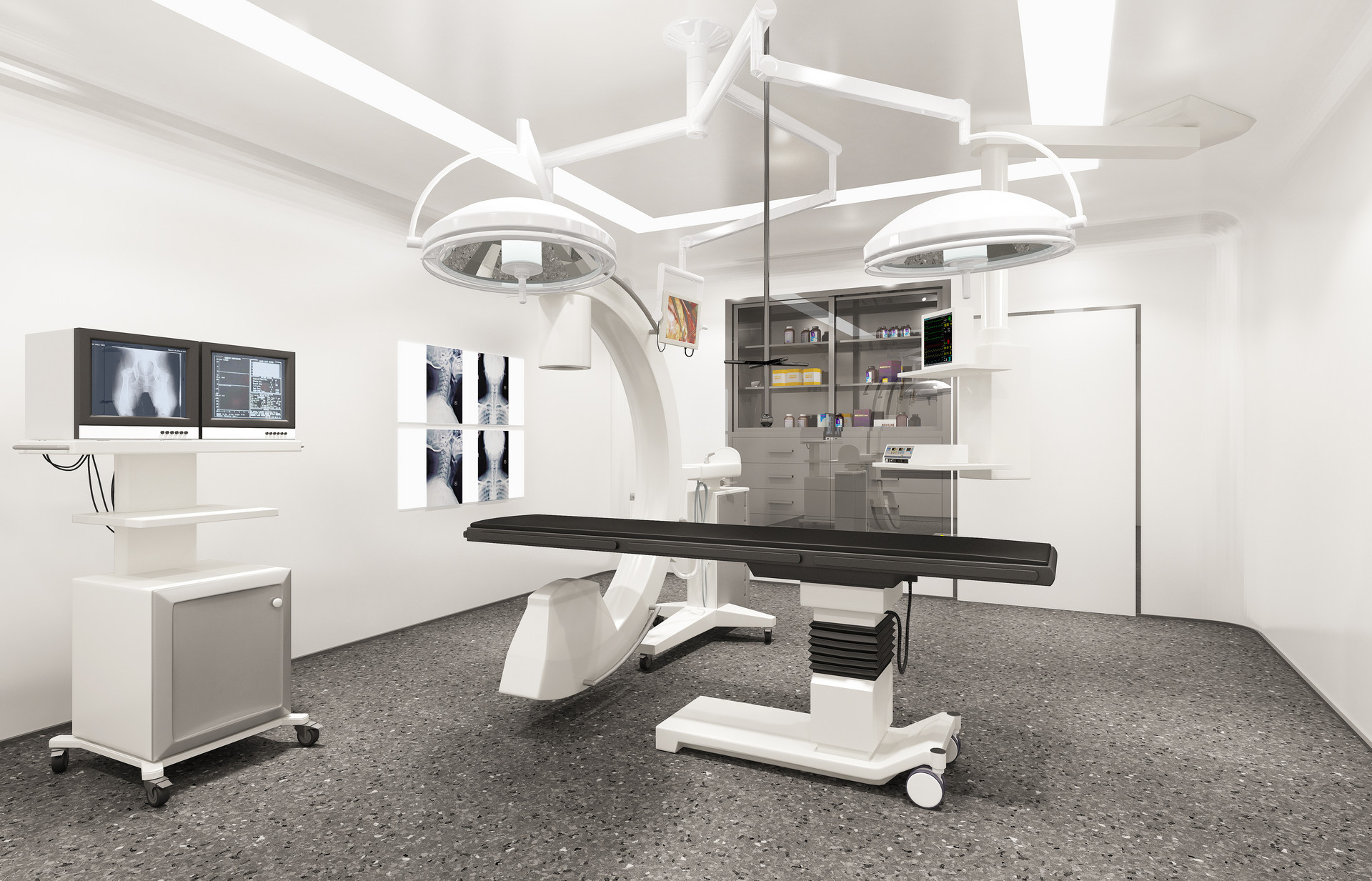
p style=" text-align: justify text-indent: 2em " 近日,工业和信息化部批复组建国家高性能医疗器械创新中心。 /p p style=" text-align: center " img style=" max-width: 100% max-height: 100% width: 476px height: 187px " src=" https://img1.17img.cn/17img/images/202005/uepic/a0e0ab07-2065-40c2-a04e-415736de4193.jpg" title=" 医疗器械.png" alt=" 医疗器械.png" width=" 476" height=" 187" / /p p style=" text-align: justify text-indent: 2em " 中国医疗器械行业将迎来大发展早已成为业界共识。相关统计显示,预计到2022年,中国医疗器械市场规模将超过9000亿元。新冠疫情再次强调了医疗器械的重要作用,同时也让我们认识到发展中的问题:比如高端医疗器械研发能力,核心零部件、关键材料亟待发展。近日,工业和信息化部批复组建国家高性能医疗器械创新中心。我国医疗器械创新研发大发展在即! /p p style=" text-align: justify text-indent: 2em " strong span style=" color: rgb(0, 112, 192) " 一、组建国家高性能医疗器械创新中心 /span /strong br/ /p p style=" text-align: justify text-indent: 2em " 高性能医疗器械技术门槛高、学科交叉多、附加价值高、发展前景广,在医学临床诊疗和健康保障中具有关键作用。当前,我国医疗器械创新发展在基础材料、核心器材与部件、高级工艺、智能系统等方面还面临发展瓶颈。国家高性能医疗器械创新中心依托深圳高性能医疗器械国家研究院有限公司组建,股东包括迈瑞生物、联影医疗、先健科技、中科院深圳先进技术研究院、哈尔滨工业大学等行业骨干单位。创新中心将围绕预防、诊断、治疗、康复等领域的高性能医疗器械需求,聚焦高端医学影像、体外诊断和生命体征监测、先进治疗、植介入器械、康复与健康信息等重点方向,着力打通原理和技术、关键材料、关键器件、系统和产品等研发和产业化链条,扎实推进医疗器械领域创新体系建设,提升我国高端医疗设备生产制造和整体产业水平。 br/ /p p style=" text-align: justify text-indent: 2em " strong span style=" color: rgb(0, 112, 192) " 二、深圳高性能医疗器械国家研究院有限公司的主要股东 /span /strong br/ /p p style=" text-align: justify text-indent: 2em " strong 1、迈瑞生物 /strong br/ /p p style=" text-align: justify text-indent: 2em " 迈瑞生物一直被称为医械行业的“华为”,不仅仅是因为迈瑞同华为一样具有广泛的市场影响力和稳定增长的营收能力,还因为迈瑞有着和华为一样强大的自主研发创新能力。自主研发创新能力是支撑迈瑞医疗保持较高增速的核心竞争力。数据显示,迈瑞医疗研发投入占比长期超过10%,在生命信息与支持、体外诊断与医学影像三大核心业务领域均已掌握核心技术。 br/ /p p style=" text-align: justify text-indent: 2em " strong 2、联影医疗 /strong br/ /p p style=" text-align: justify text-indent: 2em " 联影医疗是国产医疗器械独角兽公司,筹建于2010年10月,总部位于上海嘉定。几年时间通过资本推动+技术创新,迅速在影像行业构筑起全球竞争优势,成立了包括分子影像(MI)、计算机断层扫描(CT)、放疗(RT)、X射线、AI智能等多个产品事业部。联影医疗是国内唯一一家产品线覆盖全线高端医疗影像设备,并同时拥有全球领先的核心技术、雄厚资本实力及顶尖人才优势的集团,聚拢了一大批海外归来的励志投身于民族企业的全球业内顶级专家与学者、来自跨国企业的资深 高级管理人才 ,以及具有开发高端医疗设备产品实战经验的年轻技术骨干,形成了一支与它的目标相适应的规模宏大的海内外高素质人才队伍。& nbsp br/ /p p style=" text-align: justify text-indent: 2em " strong 3、先健科技 /strong br/ /p p style=" text-align: justify text-indent: 2em " 先健科技是业内领先的心血管微创介入医疗器械供应商,集研发、制造和销售于一体,其高品质的、具自主知识产权的创新型产品畅销全球100多个国家,分销商网络广泛覆盖欧洲、南美洲、亚洲、非洲等地,目前为全球第二大、金砖四国最大的先心病封堵器供应商及亚洲第二大大支架产品供应商。于1999年成立先健科技(深圳)有限公司,随后在香港、印度、荷兰、法国、俄罗斯、美国、北京、上海、广州、深圳成立了多个子公司和销售办事处。2011年11月,先健科技公司于香港联合交易所成功上市,目前市值近百亿港币。 br/ /p p style=" text-align: justify text-indent: 2em " strong 4、中科院深圳先进技术研究院 /strong br/ /p p style=" text-align: justify text-indent: 2em " 2006年2月,中国科学院、深圳市人民政府及香港中文大学友好协商,在深圳市共同建立中国科学院深圳先进技术研究院(以下简称“深圳先进院”),实行理事会管理,探索体制机制创新。经过十三年发展,深圳先进院目前已初步构建了以科研为主的集科研、教育、产业、资本为一体的微型协同创新生态系统,由九个研究平台(中国科学院香港中文大学深圳先进集成技术研究所、生物医学与健康工程研究所、先进计算与数字工程研究所、生物医药与技术研究所、广州中国科学院先进技术研究所、脑认知与脑疾病研究所、合成生物学研究所、先进材料科学与工程研究所(筹)、前瞻性科学与技术中心),国科大深圳先进技术学院,多个特色产业育成基地(深圳龙华、平湖及上海嘉定)、多支产业发展基金、多个具有独立法人资质的新型专业科研机构(深圳创新设计研究院、深圳北斗应用技术研究院、中科创客学院、济宁中科先进技术研究院、天津中科先进技术研究院、珠海中科先进技术研究院、苏州先进技术研究院、杭州先进技术研究院、武汉中科先进技术研究院、山东中科先进技术研究院)等组成。2018年,深圳先进院获批牵头建设深圳市两大重大科技基础设施:脑解析与脑模拟、合成生物研究,并于2019年在光明科学城破土动工;牵头建设的深圳先进电子材料国际创新研究院、深圳市合成生物学创新研究院、深港脑科学创新研究院三大基础研究机构均已在2019年正式揭牌成立。 br/ /p p style=" text-align: justify text-indent: 2em " strong 5、哈尔滨工业大学 /strong br/ /p p style=" text-align: justify text-indent: 2em " 哈尔滨工业大学被称为国内机器人的“人才摇篮”,是国内最早从事机器人研究的高校之一,1986年成立机器人研究所,建设有“机器人技术与系统”国家重点实验室、国家“863计划”智能机器人机构网点开放实验室、国家“863计划”成果产业化基地、中德空间机器人技术联合实验室,拥有“机器人基础理论与关键技术”国家自然科学基金委创新群体、“机器人机电一体化技术”和“纳米级精密定位及微纳操作技术与装备”2个教育部创新团队。在空间机器人、微纳机器人、医疗机器人、服务机器人、仿生机器人等方面的研究在国内国际上占有重要地位。 br/ /p p style=" text-align: justify text-indent: 2em " strong span style=" color: rgb(0, 112, 192) " 三、医疗器械行业大爆发在即 /span /strong br/ /p p style=" text-align: justify text-indent: 2em " 相关统计显示,2018年全球医疗器械市场规模为4278亿美元,预计到2024年规模将接近6000亿美元,2017-2024 年间复合增长率为 5.6%。中国成为继美国、西欧、日本之后的第四大医疗器械市场。中国医疗器械整体市场规模已由2014年的2556亿元增长至2018年的5304亿元,年均增速保持在20%左右,营业收入及净利润均保持高速增长态势,属于医疗器械行业发展黄金期,预计到2022年中国医疗器械市场规模将超过9000亿元!相比于全球医疗器械市场,近三年中国医疗器械市场的结构已趋向优化但结构依然严重不平衡,高端医疗市场将成为下一个发力点。 br/ /p p style=" text-align: center " br/ /p