无菌工艺保障技术研讨会,诚邀参与!
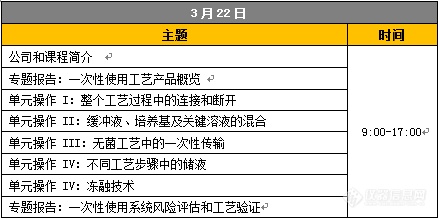
2016年6月22日 杭州站 杭州维景国际酒店 | 百合厅 杭州上城区平海路2号 近几年,“毒疫苗事件”、“注射剂不良反应事件”等问题药品的报道屡见不鲜,令人心惊,药品的安全问题已成为人类生命安全健康发展的重大事件。药品生产工艺中的无菌保证和风险控制,日益成为制药企业和法规机构关注的重点,如何才能生产出“安全药”、“放心药”值得所有制药人深思。 为了更好帮助制药企业深刻理解药品安全体系的重要性,建立稳定可靠的质量控制体系,始终如一的生产出“安全药”“放心药”,赛多利斯将携手业内资深专家,在杭州、成都、济南三大城市巡回举办“无菌工艺保障技术研讨会”。 研讨会期间,不仅有业内资深GMP认证专家分享在无菌药品GMP认证过程中的一些常见问题及相应的解决方案;还有欧洲资深技术专家分享无菌保证的关键工艺设备(过滤器)的质量保证体系、应用与合规性解读,并从风险控制和法规要求的角度对成功应用案例、完整性测试解决方案以及工艺验证进行剖析;更有国内知名制药企业生产质量专家的实战经验分享。研讨会主题:无菌药品GMP认证常见问题及分析解决全面的质量保证体系——从膜生产到终端过滤器基于PDA技术报告的无菌性法规要求眼用制剂生产的风险控制策略用于全面质量保证的完整性测试解决方案疫苗终端过滤及灌装工艺的安全保障无菌工艺中的过滤应用和成功案例符合法规要求的赛多利斯文件包如何考虑过滤工艺验证演讲嘉宾:吴军: 培训讲师, 国家CFDA高级研修学院韦志华: 质量保证部验证经理, 北京科兴生物制品有限公司万志强: 技术支持主管, 雅培眼力健(杭州)制药有限公司Petra Motzkau: 亚太区验证服务总监, 赛多利斯集团Dr. Christian Boecking: 亚太区验证项目高级经理, 赛多利斯集团Ulrich Br?utigam: 过滤技术产品亚太市场总监, 赛多利斯集团Dr. Magnus Stering: 完整性测试解决方案全球产品经理, 赛多利斯集团沈亮: 法规事务经理, 赛多利斯中国任雪芸: 中国区市场经理, 赛多利斯中国会议日程:2016年6月22日 杭州站 杭州维景国际酒店 | 百合厅 杭州上城区平海路2号立即在线报名:http://survey.sartorius.com.cn/jq/8578842.aspx赛多利斯将携最强无菌技术的劲爽踏夏而来,与您共同探讨分享最新的理念,最优的技术,最丰富的经验!盛夏时节,杭州首站开启,未完待续~七月成都站、济南站,我们同样衷心期待您的到来!活动咨询:更多活动信息,请咨询当地销售或市场部张女士 电话:021-68785302 E-mail:wenji.zhang(at)sartorius-stedim.com赛多利斯中国 电话:400.920.9889 / 800.820.9889传真:021.68782332邮箱:info.cn@sartorius.com官网:www.sartorius.com.cn 扫一扫,关注赛多利斯官方网站、微博和微信,了解最新资讯: