阿尔茨海默症诊断标尺-Beta淀粉样肽(A-Beta)纯度标准物质出炉!
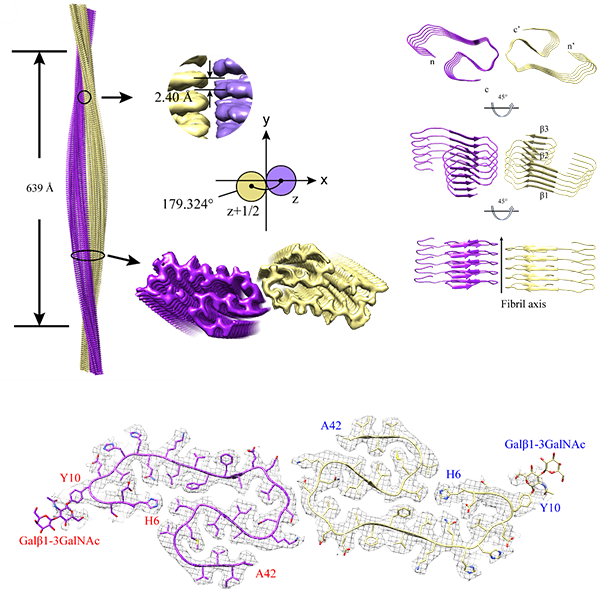
p style=" text-indent: 2em " 中国计量科学研究院李红梅、冯流星团队近期在Analytical& nbsp Chemistry,2020,doi.org/10.1021/acs.analchem.0c02381发文,介绍了基于同位素稀释质谱技术的阿尔茨海默症临床诊断标志物(Aβ)纯度标准物质研制方法。冯流星研究员为该论文的第一作者,李红梅研究员为共同通讯作者。 /p p style=" text-align: center margin-top: 10px " img style=" max-width:100% max-height:100% " src=" https://img1.17img.cn/17img/images/202010/uepic/3c6fdaac-2942-41af-8bf7-0a1235c51c2b.jpg" title=" 1-1.png" alt=" 1-1.png" / /p p style=" text-indent: 2em " 阿尔兹海默症(Alzheimer& #39 s disease,AD)是不可逆的神经退行性疾病,随着人口的老龄化,AD的发病率越来越高,其致病机理和临床治疗已引起了广泛关注。众多临床研究表明, 血液、脑脊液和脑组织内的β淀粉样多肽(β amyloid peptide ,Aβ)水平异常与AD的病程进展密切相关,Aβ已成为目前研究AD的重要生物标志物之一。然而,临床上由于缺乏Aβ检测的标准物质,导致不同测量系统对Aβ的检测结果偏差较大,难以对AD病的病程进行准确的判断。因此,研制绝对准确的Aβ的定量方法及相关标准物质,对AD的早期诊断及治疗药物研发具有重要意义。 /p p style=" text-indent: 2em " & nbsp 针对这一难题,李红梅团队研制了β淀粉样多肽(Aβ)纯品溶液标准物质(GBW09874-09875),采用基于氨基酸水解同位素稀释质谱法和硫元素同位素稀释质谱法的两种独立参考方法对Aβ纯度进行定值,量值准确可靠、不确定度评定合理。该标准物质为Aβ纯度标准物质,位于ISO17511溯源链的顶端,为AD症诊断中Aβ标志物检测参考方法的建立提供溯源源头。 /p p style=" text-align: center margin-top: 10px " img style=" max-width:100% max-height:100% " src=" https://img1.17img.cn/17img/images/202010/uepic/160d2075-9f54-41f7-8217-0ffea64861d7.jpg" title=" 1-2.png" alt=" 1-2.png" / /p p style=" text-align: center " span style=" color: rgb(255, 0, 0) " strong span style=" font-size: 14px " 基于ID-LC-MS和HPLC-ID-ICP-MS两种方法Aβ标准物质定值示意图 /span /strong /span /p p style=" text-align: justify text-indent: 2em " span style=" color: rgb(0, 0, 0) font-size: 16px " /span /p p strong span style=" color: rgb(127, 127, 127) " 学者简介: /span /strong /p p span style=" color: rgb(38, 38, 38) " 李红梅:研究员,中国计量科学研究院化学所所长。享受国务院政府特殊津贴,全国“三· 八”红旗手荣誉称号获得者 /span /p p span style=" color: rgb(38, 38, 38) " 冯流星:研究员,中国计量科学研究院化学所无机化学研究室主任 /span /p