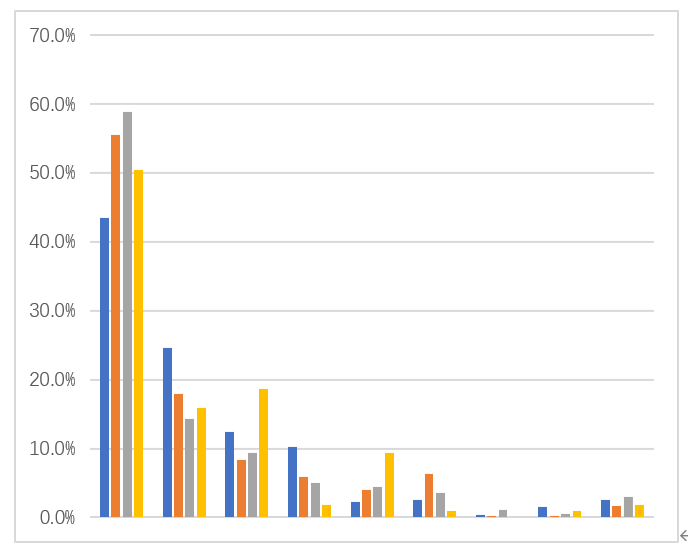
中国固相萃取仪市场研究报告(2017版)
p 固相萃取技术(SOILD PHASE EXTRACTION,简称SPE)于八十年代在国外兴起,它取代了传统的液-液萃取技术。目前,固相萃取技术在样品前处理中所起的作用也显得日益重要,已被广泛应用于医药、血液、检验检疫、环保、水质、食品领域中的样品前处理。同时,人们也开始使用固相萃取技术对复杂的生物样品基质进行纯化。此外,随着技术的成熟,全自动固相萃取仪的使用也越来越广泛。 /p p span style=" color: rgb(0, 176, 240) " strong 固相萃取技术现状 /strong /span /p p 固相萃取技术基本原理和液相色谱相同,但两者最终需要达到的目的不一样。固相萃取技术纯化的原理为:在萃取过程中,固定相对分析物的吸附力比溶解分离物的溶剂更大。当样品溶液通过吸附剂床时,分离物浓缩在其表面,其他样品成分通过吸附剂床。通过只吸附分离物而不吸附其他样品成分的吸附剂,可以得到高纯度和浓缩的分离物。 /p p 相比较高效液相色谱需要在短时间内将各化合物分离并保持好的峰形,固相萃取则是要从复杂的基液中分离出所需要的化合物并将其浓缩,以便进一步的分析。因此,一般固相萃取柱填料的粒径比高效液相色谱柱填料的粒径要大,而且固相萃取柱填料的形状是不规则的,这样可以增加接触样品的表面积。目前用的最广泛的是键合硅胶柱和聚合树脂柱。 /p p span style=" color: rgb(0, 176, 240) " strong 固相萃取仪市场及相关应用 /strong /span /p p 固相萃取技术已经越来越广泛地被应用在各种实验室。然而,大部分用户仍在用手动固相萃取。手动固相萃取一般是采用多个固相萃取柱(SPE小柱)一次同时进行多个样品萃取。这就要求操作人员必须全神贯注,否则容易发生添加顺序混乱,导致样品作废。其次,采用手动固相萃取容易造成样品回收率重现性较差。在固相萃取过程中,样品及洗脱液通过固相萃取柱的速度会直接影响最后的回收率及重现性。而在手工操作过程中,控制流速十分困难的。因此其重现性很难保证。此外,采用手动固相萃取所需时间较长。 /p p 自动固相萃取仪可以很好地弥补手动固相萃取仪的缺陷。首先,自动固相萃取仪严格按照系统设定程序进行,不会出现手工操作的错误。其次,自动固相萃取仪能够准确控制液体流速,保证实验结果的重现性。此外,自动固相萃取仪能够运行多个不同的程序,建立的方法便于推广及建立标准方法。因此,自动固相萃取仪不仅能够降低实验人员的劳动强度,提高效率,更重要的是能够保证结果的可靠性及重现性。目前国内许多实验室要求按照GLP标准进行管理,这就要求所有的原始实验数据都必须完整地保存,而自动固相萃取仪可以很好地保存已建立的方法及实验数据,从而方便了按照GLP标准的管理。 /p p 全自动固相萃取仪按处理样品量的不同可分为:小体积全自动固相萃取仪和大体积全自动固相萃取仪。小体积全自动固相萃取仪针对的样品主要为进样量在50ml以下的食品、药品、血液等 大体积全自动固相萃取仪主要为进样量在200ml量以上的水样。全自动固相萃取仪按萃取载体可分为:柱萃取全自动固相萃取仪和膜萃取全自动固相萃取仪,其中,膜萃取全自动固相萃取仪主要为大体积水样而设计的,膜萃取速度快是其优点,而且不容易堵塞,但是单个样品的处理成本较柱萃取高。 /p p 目前国内有10余家在做全自动固相萃取仪。据统计,全自动固相萃取仪国内年销售额在3~4亿元。从市场总体情况来看,整个固相萃取仪年销售量在***台左右(包括手动、半自动和全自动),其中全自动固相萃取仪的年销售量在***台左右。产值排名靠前的部分全自动固相萃取仪生产厂家主要有:北京普立泰科仪器有限公司、天津博纳艾杰尔科技有限公司(已被SCIEX公司收购)、上海屹尧仪器科技发展有限公司、济南海能仪器股份有限公司、美国Horizon Technology公司、吉尔森公司、Biotage AB、德国lctech公司、莱伯泰科有限公司和睿科仪器有限公司等。就国产技术方面来看,相比较进口品牌的全自动固相萃取仪,国产品牌全自动固相萃取仪近年来的发展速度较快,基本掌握了全自动固相萃取仪生产技术,但也存在一些差距。 strong ( span style=" color: rgb(0, 176, 240) " 不同品牌之间的技术和价格比较及市场占有率分布详见: /span /strong a href=" http://www.instrument.com.cn/survey/Report_Census.aspx?id=141" target=" _blank" title=" " style=" color: rgb(255, 0, 0) text-decoration: underline " span style=" color: rgb(255, 0, 0) " strong 中国固相萃取仪市场研究报告(2017版) /strong /span /a span style=" color: rgb(255, 0, 0) " strong ) /strong /span /p p span style=" color: rgb(0, 176, 240) " strong 受调研用户单位性质及应用领域分布 /strong /span /p p 《中国固相萃取仪市场研究报告(2017版)》得到了广大用户、企业以及业内专家的大力支持。其中,共有380余位来自食品、环境、制药、第三方检测、科研机构等领域的专家和实验室用户参与了此次固相萃取仪调研。根据统计,参与本次调研的用户当中,检测/质控人员所占比例最高,为67% 接下来为科研人员和单位管理人员,所占比例分别为24%和9%。 /p p 从参与本次抽样调研的固相萃取仪用户的分布领域来看,用户集中在食品/饮料、环保/水工业、农/林/牧/渔、制药/化妆品和医疗/卫生等领域,其中食品/饮料领域中固相萃取仪用户的比例最高,达到30%,其次是环保/水工业领域,所占比例为28%。食品/饮料、环保/水工业、农/林/牧/渔、制药/化妆品和医疗/卫生领域的用户合计占整个用户的比例为85%。 /p p span style=" color: rgb(0, 176, 240) " strong 受调查用户购买全自动固相萃取仪价格分布 /strong /span /p p style=" text-align: center " img src=" http://img1.17img.cn/17img/images/201710/insimg/83569614-c7ba-40d7-861f-7b5533f6c0d6.jpg" title=" QQ图片1.png" / /p p style=" text-align: center " strong 图4.2 受调查用户购买全自动固相萃取仪价格统计分布 /strong /p p style=" text-align: right " (数据来源:仪器信息网抽样调研) /p p 从图中可以看出,受调查用户购买的全自动固相萃取仪价格集中在10万-40万之间,其中全自动固相萃取仪采购价格在20万-30万之间的受调查用户,占到了总调查人数的20%。此外,6%的仪器用户全自动固相萃取仪的购买价格在60万以上。 /p p span style=" color: rgb(0, 176, 240) " strong 2016年全自动固相萃取仪采购招标情况分布 /strong /span /p p style=" text-align: center " img src=" http://img1.17img.cn/17img/images/201710/insimg/d80d51a1-e303-4061-8742-5a397bb3a96e.jpg" title=" QQ图片2.png" / /p p style=" text-align: center " strong 图4.3 2016年全自动固相萃取仪采购招标数量月分布(单位:台) /strong /p p style=" text-align: right " (数据来源:互联网) /p p strong 注:1、数据统计从2016年1月1日到2016年12月31日 2、采购数据来源于互联网公开发布的相关招中标信息。 /strong /p p 通过对互联网公开发布的2016年度全自动固相萃取仪的招投标信息进行梳理汇总发现,目前市场对全自动固相萃取仪的需求呈现周期性波动。但从整体趋势来看,产品需求成规律性变化趋势 strong ( span style=" color: rgb(0, 176, 240) " 具体变化规律及相关政策解读详见: /span /strong span style=" text-decoration: none " strong a href=" http://www.instrument.com.cn/survey/Report_Census.aspx?id=141" target=" _blank" title=" " span style=" text-decoration: none color: rgb(255, 0, 0) " 中国固相萃取仪市场研究报告(2017版) /span /a /strong /span strong ) /strong /p p span style=" color: rgb(0, 176, 240) " strong 2016年全自动固相萃取仪采购区域分布 /strong /span /p p style=" text-align: center " strong img src=" http://img1.17img.cn/17img/images/201710/insimg/e2c9a604-8755-4da3-8cc8-f5b683cfff77.jpg" title=" QQ图片20171025143337.png" / /strong /p p style=" text-align: center " strong 图4.5 2016年全自动固相萃取仪采购区域分布 /strong /p p style=" text-align: right " (数据来源:互联网) /p p 注:1、数据统计从2016年1月1日至2016年12月31日 2、采购数量来源于互联网公开发布的相关招中标信息,此处仅统计中标结果,废标和谈判中数据未列入 3、区域分布图通过第三方软件“地图慧”绘制所得。 /p p 2016年,通过公开招标采购全固相萃取仪的单位共涉及28个省份/直辖市。其中以西南、华南和华东地区较为密集。 strong ( /strong span style=" color: rgb(0, 176, 240) " strong 各省份全自动固相萃取仪具体需求状况及采购单位详情请见: /strong /span a href=" http://www.instrument.com.cn/survey/Report_Census.aspx?id=141" target=" _blank" title=" " style=" text-decoration: underline " span style=" color: rgb(255, 0, 0) " strong 中国固相萃取仪市场研究报告(2017版) /strong /span /a strong ) /strong 。 /p p style=" text-align: center " span style=" color: rgb(0, 176, 240) " strong 《中国固相萃取仪市场研究报告(2017版)》 /strong /span /p p strong 目录 /strong /p p strong 第1章、 固相萃取仪技术与市场概述. 9 /strong /p p 1.1 固相萃取仪技术与市场简介. 9 /p p 1.2全自动固相萃取仪市场部分主流仪器情况统计. 11 /p p 1.3 全自动固相萃取仪市场部分主流仪器价格区间统计. 12 /p p 1.4全自动固相萃取仪市场部分主流厂商情况分析. 13 /p p strong 第2章、 固相萃取仪技术现状及发展趋势. 15 /strong /p p 2.1固相萃取仪技术特点与优势. 15 /p p 2.2部分主流全自动固相萃取仪主要性能参数对比. 17 /p p 2.3 当前产品缺陷及用户关注点. 20 /p p strong 第3章、 固相萃取仪主要应用领域与目标用户分析. 22 /strong /p p 3.1 受调查用户所在单位性质统计. 22 /p p 3.2 受调查用户所在领域统计. 22 /p p 3.3 受调查用户固相萃取仪使用特点分析. 23 /p p 3.4全自动固相萃取仪主要应用领域分析. 24 /p p strong 第4章、 全自动固相萃取仪市场保有量/市场规模分析. 28 /strong /p p 4.1全自动固相萃取仪主流品牌占有率. 28 /p p 4.2受调查用户购买全自动固相萃取仪价格分析. 28 /p p 4.3全自动固相萃取仪市场容量/年销售量. 29 /p p 4.4 2016年全自动固相萃取仪采购招标情况分析. 31 /p p 4.5固相萃取仪部分主要用户单位分布情况. 33 /p p strong 第5章、 总结. 35 /strong /p p strong 附录:全自动固相萃取仪部分潜在用户单位列表. 37 /strong /p p br/ /p p style=" text-align: center " strong 更多报告内容请阅读: /strong /p p class=" f18" style=" margin: 0px padding: 0px font-size: 18px color: rgb(60, 84, 151) font-family: 宋体, & #39 Arial Narrow& #39 text-align: -webkit-center white-space: normal background-color: rgb(255, 255, 255) " a href=" http://www.instrument.com.cn/survey/Report_Census.aspx?id=141" target=" _blank" title=" " style=" color: rgb(255, 0, 0) text-decoration: underline " span style=" color: rgb(255, 0, 0) " strong 中国固相萃取仪市场研究报告(2017版) /strong /span /a /p p style=" text-align: center " strong & nbsp & nbsp 【咨询热线】:010-51654077-8042 /strong /p p 更多相关报告内容: /p p · 2016食品行业政策解读及相关分析仪器市场动态研究报告 /p p · 2016年制药行业市场发展及对仪器市场影响分析报告 /p p · 2016年分析仪器中标信息统计分析报告 /p p · 2016年中国环境监测市场分析及未来市场预测报告 /p p · 中国气质联用仪市场调研报告(2016版) /p p · 中国气相色谱仪市场调研报告(2016版) /p p · 中国在线挥发性有机物分析仪市场调研报告(2016版) /p p · 2016年第三季度分析仪器中标信息分析报告 /p p · 中国傅立叶变换中红外光谱仪市场调研报告(2016版) /p