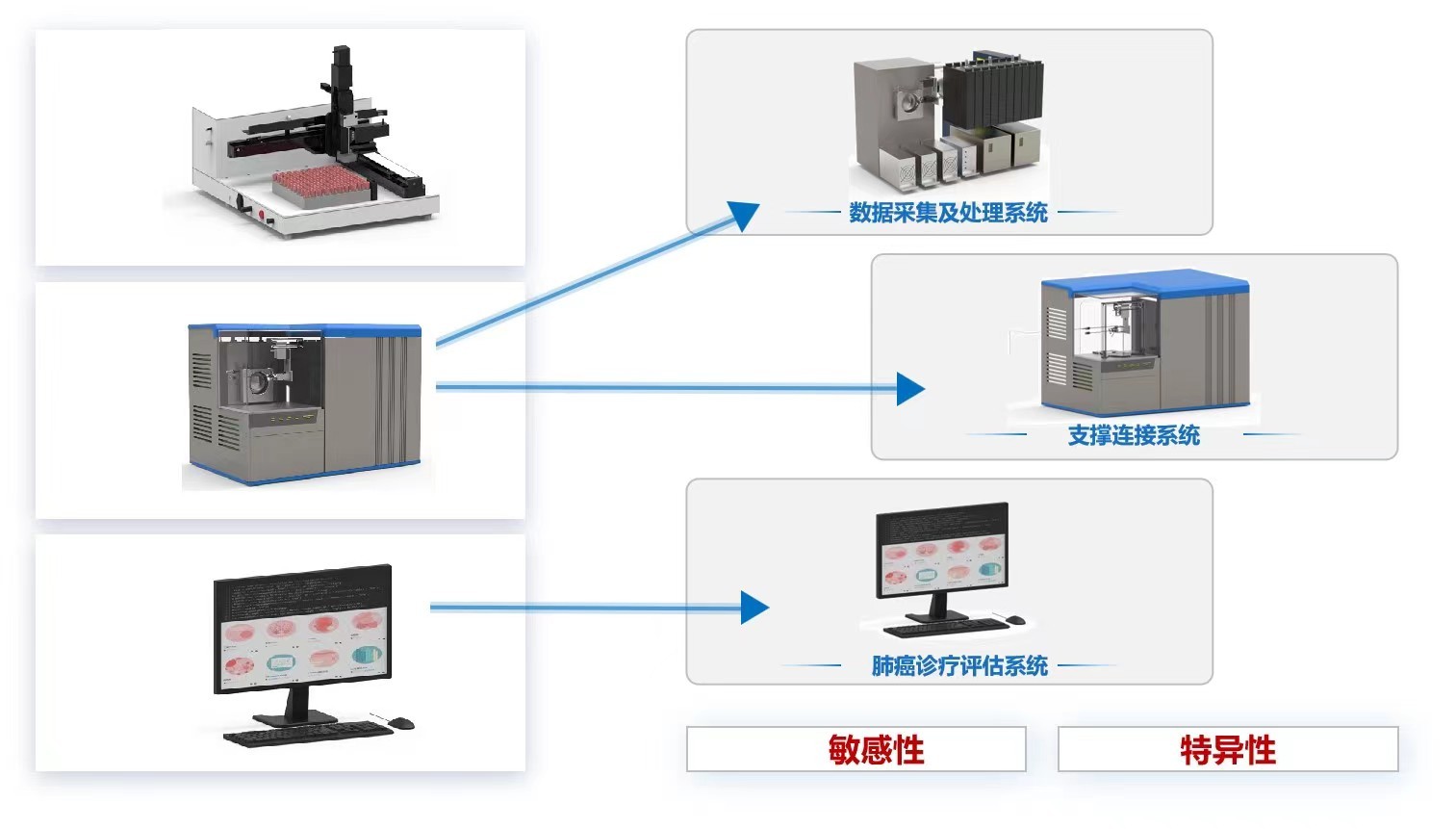
“数字诊疗装备研发”重点专项2017年度拟立项项目公示
p 《国务院关于改进加强中央财政科研项目和资金管理的若干意见》(国发[2014]11号)、《国务院关于深化中央财政科技计划(专项、基金等)管理改革方案的通知》(国发[2014]64号)、《科技部、财政部关于改革过渡期国家重点研发计划组织管理有关事项的通知》(国科发资[2015]423号)等文件要求,现将“干细胞及转化研究”、“数字诊疗装备研发”、“重大慢性非传染性疾病防控研究”、“生物医用材料研发与组织器官修复替代”和“生物安全关键技术研发”重点专项2017年度拟立项项目信息进行公示(详见附件)。 /p p 时间为2017年6月1日至2017年6月5日。对于公示内容有异议者,请于公示期内以传真、电子邮件等方式提交书面材料,逾期不予受理。个人提交的材料请署明真实姓名和联系方式,单位提交的材料请加盖所在单位公章。联系人和联系方式如下: /p p strong “数字诊疗装备研发”重点专项 /strong /p p 联 系 人:朱敏 /p p 联系电话:010-88225128 /p p 传 真:010-88225200 /p p 电子邮件:zhumin@cncbd.org.cn /p p style=" text-align: center " span style=" color: rgb(255, 0, 0) " strong 国家重点研发计划“数字诊疗装备研发”重点专项2017年度拟立项项目公示清单 /strong /span /p p style=" text-align: center" img src=" http://img1.17img.cn/17img/images/201706/insimg/569d5a47-f410-4683-ad24-edf7ab82fa01.jpg" style=" " title=" 1.jpg" / /p p style=" text-align: center" img src=" http://img1.17img.cn/17img/images/201706/insimg/bde2251d-7ac7-42a7-b1ab-ea1d5da9c6df.jpg" style=" " title=" 2.jpg" / /p p style=" text-align: center" img src=" http://img1.17img.cn/17img/images/201706/insimg/094b6eb0-17ee-4b81-8be1-a0ed9f9ab110.jpg" style=" " title=" 3.jpg" / /p p style=" text-align: center" img src=" http://img1.17img.cn/17img/images/201706/insimg/8d6d0985-2d37-40f9-8131-ca9e2270eeeb.jpg" style=" " title=" 4.jpg" / /p p style=" text-align: center" img src=" http://img1.17img.cn/17img/images/201706/insimg/e76b6fad-6f48-4891-ae9c-048fe1c51294.jpg" style=" " title=" 5.jpg" / /p p style=" text-align: center" img src=" http://img1.17img.cn/17img/images/201706/insimg/b22f26a5-e21e-4a51-bf93-9de8a4802b6b.jpg" style=" " title=" 6.jpg" / /p p 附件: a href=" http://img1.17img.cn/17img/files/201706/ueattachment/e711dc66-dded-4d48-bc29-2f34ba505538.xlsx" style=" line-height: 16px color: rgb(0, 176, 240) text-decoration: underline " span style=" color: rgb(0, 176, 240) " 国家重点研发计划“数字诊疗装备研发”重点专项2017年度拟立项项目公示清单.xlsx /span /a /p