【综述】蛋白质组学研究进展
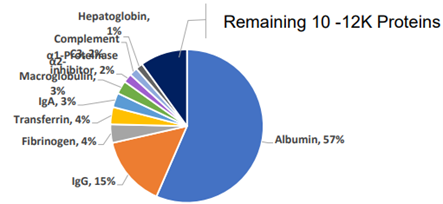
p style=" text-align: center " img src=" http://img1.17img.cn/17img/images/201601/insimg/4a14f65e-cb82-47d8-87d5-ea4b0d204756.jpg" title=" sss_56a5b6877c56c.jpg" / /p p 1、蛋白质组和基因组 br/ /p p 蛋白质组是指一种基因组所表达的全套蛋白质1,其英文为“proteome”。 有关蛋白质组的系统研究是蛋白质组学,英文为“proteomics”。基因组是生命体中全部基因的集合体,其英文为“genome”。有关基因组的系统研究是基因组学,其英文为“genomics”。 “proteome”和“proteomics”是由Marc Wilkins 及其同事于20世纪90年代初参照基因组和基因组学两个英文单词而创造出来的2。蛋白质组学是研发、利用、改进各种技术手段研究蛋白质组或在细胞某一生理通路中相关蛋白质集合的组成、结构、功能、代谢的一门新兴科学。 /p p 基因决定蛋白质的水平,然而,蛋白质的水平分为转录水平和表达水平,mRNA只包含前者,后者则是由mRNA被翻译所实现,而在翻译过程中通常伴随对蛋白质功能和活性起至关重要的修饰过程,如糖基化、泛素化等3。通过研究蛋白质组学,可以获取蛋白定位与修饰的定性信息和相关定量数据,丰富认知蛋白质表达水平和相关蛋白作用,对了解生命复杂活动有更深更全的认识。 /p p 2、蛋白质组的发展背景 /p p 自二十世纪九十年代以来,传统生物学得以突飞猛进地发展,并取得瞩目成就,其中三个重要点彪炳史册,也促使传统生物学获得质的转变。 /p p 第一 基因、表达序列标记(EST, expressed sequence tag)、蛋白质序列数据库的成长。细菌、酵母、线虫、果蝇的全部基因序列逐渐明了,甚至后来人类基因组计划也顺利告捷 其它的植物、动物、微生物也不断在探索。人们把已经掌握的基因分门别类地建立了序列数据库。 /p p 第二 生物信息学的发展。易获取的浏览型生物信息工具层出不穷,这种免费的网页式数据库可以让我们从其中获得所需的特殊的物质结构,如蛋白质结构中的结构域和模体等。 /p p 第三 寡核苷酸微阵列技术的发展。通过不同荧光标记的DNA样本同时与微阵列反应,形成不同荧光的现象,大幅提高Northern blot 的效率4。 /p p 3、蛋白质组学分类 /p p 蛋白质组学分类可有不同原则。 /p p 根据蛋白质来源可分为植物蛋白质组学、动物蛋白质组学、微生物蛋白质组学。植物蛋白质组学是以来源于植物或与植物相关蛋白质为研究对象,分析其在植物发生、生长、调节、凋谢等生命过程中的作用、功能、代谢、结构等的体系。同理,动物蛋白质组学是以来源于动物或与动物相关蛋白质为研究对象,最重要的一大内容就是研究人类相关蛋白质。微生物蛋白质组学是以来源于微生物或与微生物相关蛋白质为研究对象。 /p p 根据研究目的和阶段不同可分为结构蛋白质组学、表达蛋白质组学、功能蛋白质组学。结构蛋白质组学主要分析蛋白质大分子的多级结构形态,包括氨基酸顺序、二级结构、三级结构和四级结构 并着重于研究其共性结构特征和特殊功能基团 也是用于建立细胞内信号转导的网络图谱并解释某些特定蛋白表达对细胞产生特定的作用5。表达蛋白质组学是以经典蛋白质组技术如双向凝胶电泳和图像分析为方法着重于研究细胞内蛋白质表达过程及结果的体系3。功能蛋白质组学是以细胞内单一同种蛋白质功能体现、蛋白质之间、蛋白质与其他大分子之间相互作用关系为研究目的,研究和表述选定蛋白质,探明有关蛋白的修饰和信号转导通路,疾病机制或蛋白-药物作用关系3。 /p p 根据研究内容,还可分为组成性蛋白质组学、差异显示蛋白质组学、相互作用蛋白质组学。组成性蛋白质组学是鉴定某个体系的蛋白质并阐述其翻译后修饰的特性。差异显示蛋白质组学又名比较蛋白质组学,是对重要生命过程或人类重大疾病进行生理、病理体系或过程的蛋白质表达比较。相互作用蛋白质组学则是研究蛋白质间相互作用,绘制某体系蛋白质作用网络图谱8。 /p p 4、白质组学研究工具 /p p 蛋白质组学研究的重要工具主要有四个。 /p p 第一,蛋白质、表达序列标记(EST, expressed sequence tag)、基因序列数据库的建立与成熟 也可以说是生物信息学。因为蛋白质组学中所用的大多数技术所获得的数据通常都是高通量、高复杂度的,只有通过生物信息学分析才能对蛋白质的种类、结构和功能进行分析确定。 /p p 第二,质谱(MS)技术。其将样品分子离子化,根据离子间质荷比的差异分离并确定质量,实现高灵敏度、高特异性。首先,质谱技术能准确测量高达100kDa的完整大分子蛋白质,其准确度和特异度比SDS-PAGE还要高。其次,质谱技术也能准确测量从蛋白质分解下来的多肽。最后,它还可以测定多肽的氨基酸顺序,即多肽测序4。现有三条途径,一是肽链质量图谱,二是串联质谱途径,三是联合途径7。其中一种较理想的技术平台是表面增强激光解吸离子化飞行时间质谱(SEL-DI)技术,可分析疏水性蛋白质、pI过高或过低蛋白质、低分子量蛋白质(& lt 25 000)和未经处理的样品中许多被掩盖的低浓度蛋白质,短时间内即可获得蛋白质的分子量、PI、特殊修饰位点等参数8。 /p p 第三,能将MS数据与数据库中特异的蛋白质顺序匹配的软件。它是快速、特异地将第一和第二工具联系在一起的分析方式。 /p p 第四,蛋白分析分离方法。通过蛋白分析分离方法可以简化蛋白复合物,同时产生不同蛋白质差异比较方法。普通的蛋白质分析分离方法包括1D-SDS-PAGE、高效液相色谱法(HPLC)、毛细管电泳(CE)、等点聚焦电泳(IEF)等。其中二维凝胶电泳如2D-SDS-PAGE是目前蛋白质组学中分离单一蛋白质的广泛应用方法。当然,多维分析分离方法是最理想的分离蛋白质和多肽的方法,譬如,离子交换液相色谱与反相高效液相色谱串联形成的分离系统是分离多肽混合物的有力方法4。 /p p 5、白质组学的应用 /p p 蛋白质组学原则性应用包括四个方面4:组成性应用、蛋白质表达模型、蛋白质网络图谱、蛋白质修饰图谱。组成性应用是指运用质谱及其相关技术将目的蛋白质按相关标准定性或定量地纳入蛋白质数据库,在此过程中研发相应技术的应用。蛋白质表达模型是指研究在生理或病理状态目的蛋白质在细胞内定位并表达情况,同时研究细胞在暴露物理、化学、药物等因素下蛋白质表达状况。蛋白质网络图谱是研究两种或两种以上蛋白质在生物体内组成结构、表达功能、调节控制间作用情况。蛋白质修饰图谱是探明蛋白质的修饰定位及修饰后功能表现。 /p p 当然,蛋白质组学在生活中无处不在,疾病、食品、植物、药品等等。 /p p 蛋白质组学在疾病中应用方向主要是发现新的疾病标志物,以探明疾病发生机制、发展变化,为治疗途径提供思路。Brea等利用双向电泳串联质谱技术,差异比较心源性脑栓塞患者和粥样硬化血栓性梗死患者各12例的血清蛋白,发现触珠蛋白相关蛋白和淀粉样蛋白A等蛋白质在粥样硬化血栓性梗死患者血清中显著升高9。 /p p 蛋白质组学在食品中应用方向主要是检测食品中过敏源检测、鉴定食品成分等,也给食品科学研究提供了新的研究思路和技术3。李明云等优化了相应的试验条件,并将蛋白质组双向电泳相关技术引入大黄鱼肝脏蛋白质分析中,得到了较清晰的大黄鱼肝脏蛋白双向电泳图谱。 /p p 蛋白质组学在植物中应用方向主要是植物群体遗传、环境信号应答与适应机制、植物组织器官、植物亚细胞等7。其中,如果研究的植物是农作物如棉花、马铃薯、水稻等,就可以简单地视作蛋白质组学在农业中的运用了。Chang等对玉米强制缺氧和低氧研究,发现低氧处理的效应不仅是氧气含量过低诱导增加糖酵解酶,通过质谱鉴定了46个相关蛋白质10。 /p p 蛋白质组学在药品中应用方向主要是药物研发、药物作用机制、耐药机制、药物毒理学等。在对紫杉醇类药物抗癌作用研究中,Bauer等对乳腺癌复发患者进行紫杉醇类药物治疗后进行蛋白质组学分析,发现a-防卫素可作为预测该类药物治疗乳腺癌治疗作用的生物标记物11。 /p p 6、展望 /p p 蛋白质组学在短短30年间发展迅猛,渗入到生活的许多方面,也对保证人类生存质量和良性繁衍有重大作用。但其思路不开阔,技术高效性、灵敏性、特异性仍有待提高,应用普及度低,蛋白质分离、纯化技术研发,基因组学丰富度低是制约蛋白质组学及其相关技术发展的瓶颈。不过,相信随着物理技术和化学方法的不断发展,研究水平的深入,蛋白质组学会随着基因组学的发展得到更进一步地丰富。 /p p 参考文献: /p p 1.诗,吕建新主编《分子生物学检验技术》第2版 /p p 2.Pandey A, Mann M. Proteomics to study genes and genomics [J] Nature,2000,405(6788):837-846. /p p 3.尹稳、伏旭、李平《蛋白质组学的应用研究进展》 [J]. 生物技术通报 2014年第1期 /p p 4.aniel C. Liebler《Introduction to Proteomics》:1-13 /p p 5.英超,党源,李晓艳,等. 蛋白质组学及其技术发展 [J]. 生物技术通讯,2010,21(1):139-144. /p p 6.鑫《比较蛋白质组学研究与应用进展》[J]. 国际免疫学杂志 2006年5月第29卷第3期:156-159 /p p 7.宇,荆玉祥,沈世华《植物蛋白质组学研究进展》 [J] 植物生态学报,2004,28(1):114-125 /p p 8.ore LE,Pfeiffer R,Warner M,et al. Identification of biomarkers of arsenic exposure and metabolism in urine using SELDI technology . Biochem Mol Toxicol , 2005,19(3):176. /p p 9.rea D,Sobrino T,Blanco M, et al. Usefulness of haptog lob in and serum amyloid A proteins as biomarkers for atherothrombotic ischemic stroke diagnosis confirmation [J]. Atherosclerosis,2009,205:561-567. /p p 10.ng,W.W.,L.Huang,M.Shen,C.Webster,A.L.Burlingame& amp J.K.Roberts.2000.Patterns of protein synthesis and tolerance of anoxia in root tips of maize seedlings acclimated to a low oxygen environment,and identification of proteins by mass spectrometry.Plant Physiology,122:295~318. /p p 11.er JA,Chakravanhy AB,Rosenbluth JM,et al.Identification of markers of taxane sensitivity using proteomic and genomic analyses of breast tumors from patients receiving neo-adjuvant paclitaxel and radiation[J].Clin Cancer Res,2010,16(2):681-690. /p p br/ /p