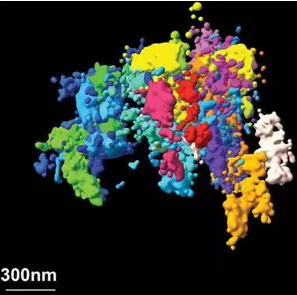
Nature评出需要关注的7大技术 生命科学仪器前景可期
p 7位专家预测了2019年将推动他们各自所在的领域向前发展的技术进展,包括高分辨率成像和从头构建基因组大小的DNA分子等。对生命科学技术来说,2019年看起来非常令人期待。而对于分析仪器来说,上榜的测序系统、显微镜和冷冻电镜亦是前景可期。 /p p style=" text-align: center " span style=" color: rgb(0, 112, 192) " strong 1.Sarah Teichmann:扩展单细胞生物学 /strong /span /p p Sarah Teichmann是英国韦尔科姆基金会桑格研究所细胞遗传学负责人。 /p p 在过去十年中,我们已观察到研究人员一次能够分析的单细胞数量大幅增加。这将继续增加下去,这主要归因于细胞捕获技术的改进、使用条形码对细胞进行标记的方法以及将现有技术结合在一起的更智能方法。 /p p 这种增加可能听起来很平凡,但是它允许我们进行不同类型的实验和在更高的分辨率下研究更复杂的样品。比如,研究人员将能够同时研究20或100个人的样本,而不是仅能分析一个人的样本。这意味着我们将能够更好地控制人群多样性。 /p p 我们还将能够分析更多的发育时间点、组织和个体,从而能够增加我们的分析的统计学意义。 我们的实验室刚刚参与了一项分析来自6个物种的25万个细胞的研究工作,结果表明负责先天免疫反应的基因快速地进化,而且在不同物种之间存在着较大的细胞间差异---这两种特征有助于免疫系统产生有效的和微调的反应。 /p p 我们还将看到我们在单细胞水平中同时观察不同基因组模式的能力取得进展。比如,我们将能够观察到称为染色质的蛋白-DNA复合物是开放的还是封闭的,而不是仅局限于RNA。这有助于了解细胞分化时的表观遗传状态,以及免疫系统和神经系统中的表观遗传记忆。 /p p 将单细胞基因组学与表型关联在一起---比如将蛋白表达或形态与给定细胞的转录组关联在一起---的方法也将取得进展。我们可能会在2019年看到更多的这类东西,无论是仅通过测序还是将成像和测序结合在一起。实际上,我们一直在见证这两种技术的趋同进化(convergent evolution):测序在分辨率上越来越高,成像越来越多样化。 /p p style=" text-align: center " strong span style=" color: rgb(0, 112, 192) " 2.Jin-Soo Kim:改进基因编辑器 /span /strong /p p Jin-Soo Kim是韩国首尔国立大学基础科学研究所基因组工程中心主任、化学教授。 /p p 蛋白质工程正在推动基因组工程的发展。第一代CRISPR基因编辑系统使用核酸酶Cas9,即一种在特定位点切割DNA的酶。 /p p CRISPR/Cas9仍然被广泛使用,但是许多经过基因改造的CRISPR系统正在用新的Cas9变体替代这种天然存在的核酸酶,比如xCas9和SpCas9-NG。这些变体扩大了靶向空间---能够进行编辑的基因组区域。有些变体还比第一代的Cas9更具特异性,从而能够最大限度地减少或避免脱靶效应。 /p p 去年,研究人员报道了将CRISPR基因组编辑用于临床治疗的新障碍。这些障碍包括p53基因的激活(与癌症风险有关) 出于意料之外的“ span style=" color: rgb(0, 112, 192) " strong 在靶 /strong /span (on-target)”效应,比如大片段DNA缺失 对CRISPR系统存在的免疫原性。 /p p 因此,想要让基因组编辑具有临床应用价值,就必须解决这些限制。其中的一些问题是由DNA双链断裂引起的。但是并非所有基因组编辑酶都会产生双链断裂---“碱基编辑器(base editor)”将单个DNA碱基直接转换为另一个碱基。因此,碱基编辑既比传统的基因组编辑更干净,也更有效。去年,瑞士研究人员在小鼠中利用碱基编辑器校正了一种导致苯丙酮尿症的基因突变。 /p p 但是,碱基编辑器在它们能够编辑的由前间隔序列邻近基序(protospacer adjacent motif, PAM)确定的序列上存在着限制。蛋白质工程可用于重新设计和改进现有的碱基编辑器,甚至可能构建出新的编辑器,比如与灭活的Cas9融合在一起的重组酶。与碱基编辑器一样,重组酶不会诱导双链断裂,但是能够在用户事先确定的位点上插入所需的序列。 /p p RNA引导的重组酶肯定会在新的维度上扩展基因组编辑。 基因编辑技术在临床上的常规使用可能还需要几年的时间。但是我们将在未来一两年内看到新一代的基因编辑工具:有很多研究人员对这项技术感兴趣,每天都在使用它。新问题层出不穷,但创新的解决方案也层出不穷。我期待着惊喜的出现。 /p p style=" text-align: center " strong span style=" color: rgb(0, 112, 192) " 3.庄小威(Xiaowei Zhuang):提高显微镜分辨率 /span /strong /p p 庄小威是美国哈佛大学化学与化学生物学教授 2019年突破奖获得者。 /p p 超分辨率显微镜的原理验证演示仅在10年或20年前发生,但是如今,这种技术相对来说比较普遍,可供生物学家使用---并且导致了大量的新知识。 /p p style=" text-align: center" img src=" https://img1.17img.cn/17img/images/201902/uepic/fb070d2b-6d5b-4f3c-9c61-b7a57acc444c.jpg" title=" 2019-02-18_215317.png" alt=" 2019-02-18_215317.png" / /p p style=" text-align: left " span style=" font-family: 楷体, 楷体_GB2312, SimKai " 图片来自Bogdan Bintu, The Xiaowei Zhuang Laboratory, The Alistair Boettiger Laboratory, Science 362, eaau1783 (2018)。 /span /p p 一个特别令人兴奋的研究领域是确定基因组的三维结构和组装。越来越明显的是,基因组的三维结构在调节基因表达中起着重要作用。 /p p 在过去的一年中,我们报道了对染色质(形成染色体)进行纳米级精度成像的研究工作,将它与数千个不同类型细胞的序列信息相关联在一起。这种空间分辨率要比我们之前的研究提高一到两个数量级,这就让我们能够观察到单个细胞将染色质组装成在不同细胞间差异很大的区域。我们还提供了关于这些区域如何形成的证据,这让我们更好地理解染色质调节的机制。 /p p 除了染色质之外,预计在超分辨率成像领域的空间分辨率会有很大改善。大多数实验的分辨率仅有几十纳米,但仍然无法与成像的分子相比,尤其是当我们想要分析分子间的相互作用时。不过,我们看到荧光分子和成像方法的改进显著地提高了分辨率,而且预计在1纳米分辨率下的成像将变得常见。 /p p 与此同时,时间分辨率将越来越好。目前,研究人员必须在空间分辨率和成像速度之间做出妥协。但是,通过更好的照明策略和更快的图像采集,这些限制是可能被克服的。成千上万的基因和其他类型的分子共同起作用来塑造细胞的行为。能够在基因组水平上同时观察这些分子发挥作用将为成像提供巨大的机会。 /p p style=" text-align: center " strong span style=" color: rgb(0, 112, 192) " 4.曾红葵(Hongkui Zeng):绘制大脑连接图谱 /span /strong /p p 曾红葵是美国艾伦脑科学研究所结构科学执行主任。 /p p 单个细胞和各种细胞类型之间的连接是如此复杂以至于在全局和群体水平上绘制它们之间的连接图谱已不再足以理解它们。因此,我们在单细胞水平下绘制基于细胞类型的连接图谱。 我们能够通过“顺行”和“逆行”追踪来实现这一目标。 /p p 这些追踪方法揭示了由特定细胞延伸出来的称为 span style=" color: rgb(0, 112, 192) " strong 轴突投射 /strong /span (axon projection)的结构。我们还使用更多的基于单神经元形态学的方法来观察单个神经元的轴突投射在哪里产生和终止。 /p p 电镜数据集的产生取得了很大的进展,这些数据集的覆盖范围比以前大得多。比如,在美国霍华德休斯医学研究所珍妮莉亚研究学院,研究人员正在努力绘制果蝇中的每个神经元和突触。 图像采集和样品处理的改进是这些进展取得的关键 因此,计算方面的改进也是如此。 /p p 在艾伦脑科学研究所,我们参与了借助机器学习算法构建小鼠大脑神经连接的虚拟图谱。 巨大的特异性编码在大脑的这些连接中。但是,如果不了解全局和局部水平下的特异性,那么我们理解行为或功能的能力基本上建立在一个 span style=" color: rgb(0, 112, 192) " strong 黑匣子 /strong /span ---我们缺乏理解神经元活动和行为的物理基础---的基础上。 span style=" color: rgb(0, 112, 192) " strong 连接组学 /strong /span (connectomics)将填补这方面缺失的真实信息。 /p p style=" text-align: center " strong span style=" color: rgb(0, 112, 192) " 5.Jef Boeke:推进合成基因组研究 /span /strong /p p 纽约大学朗格尼医学中心系统遗传学研究所主任。 /p p 当我意识到能够从头开始编写一个完整的基因组时,我想这将是一个从新的视角研究基因组功能的好机会。 /p p 从纯科学的角度来看,一些研究团队在合成简单的细菌和酵母基因组方面取得了进展。但是在合成完整基因组方面仍然存在着技术挑战,特别是哺乳动物基因组。 /p p 一项有助于降低DNA合成成本的技术将会有所帮助,但尚未投入市场。如今发生的大多数DNA合成都是基于一种称为 span style=" color: rgb(0, 112, 192) " strong 亚磷酰胺三酯 /strong /span 合成(phosphoramidite chemistry)的方法。由此产生的核酸聚合物在它们的最大长度和保真度方面都存在着限制。迄今为止,这种合成方法取得如此较好的作用,这本身就是一种奇迹。 /p p 许多公司和实验室正在寻求酶促DNA合成---这种方法有可能比化学合成更快、更准确和更便宜。迄今为止,还没有公司在商业上提供这样的酶。但去年10月,一家位于法国巴黎的名为DNA Script的公司宣布,它已经合成了长150个碱基的寡核苷酸,这几乎与化学DNA合成的实际长度限制相匹配。 /p p 我们都在等待着更多地了解这一点。 作为一个团队,我们还研究了如何组装较大的人类染色体DNA片段,而且我们能够使用这种方法构建出长1万个碱基或以上的DNA片段。如今我们将使用这种方法来分析已知在确定疾病易感性方面起着重要作用的大型基因组区域,或者导致其他表型特征出现的大型基因组区域。 /p p 我们能够在酵母细胞中快速合成这些基因组区域,因此我们应当能够构建出数十到数百种以前无法测试的基因组变体。通过使用它们,我们将能够检查在全基因组关联研究中涉及的在疾病易感性方面具有一定意义的数千个基因组位点。这种分析策略可能让我们最终能够确定这些基因组变体发挥的作用。 /p p style=" text-align: center " strong span style=" color: rgb(0, 112, 192) " 6.Venki Ramakrishnan:揭示分子结构 /span /strong /p p Venki Ramakrishnan是英国剑桥MRC分子生物学实验室结构生物学家。 /p p 理解结构是理解功能的关键步骤。 strong span style=" color: rgb(0, 112, 192) " 冷冻电镜 /span /strong (cryo-EM)技术让研究人员能够使用比以往更少和更低纯度的样品来解析出高分辨率结构。这意味着我们不仅能够观察到以前从未观察到的结构,而且我们还能够研究更具挑战性的问题,比如蛋白复合物的动态变化或生化途径中的不同状态。 /p p 就目前而言,cryo-EM作为一个领域所处的水平大致是晶体学在20世纪60年代或70年代时的水平。第一波技术已出现了,但是这个领域仍然在取得巨大的进展。下一代检测器,比如由英国科学与技术设施委员会设计工程师Nicola Guerrini和她的同事们开发出的检测器,将提供更好的信号并允许我们观察到更小的分子。 我们已观察到许多令人兴奋的结构。 /p p 英国MRC分子生物学实验室的神经科学家Michel Goedert和结构生物学家Sjors Scheres及其团队对一种称为tau的蛋白的细丝进行成像,意外地发现它在不同类型的痴呆症(包括阿尔茨海默病)中表现出明显不同的蛋白折叠。 第二个取得进展的领域是样品制备。 /p p 在cryo-EM中,溶液中的少量分子进入细金属丝网,多余的分子将被清除,并将剩下的薄薄的一层分子被冷冻。但是,空气-水界面处的分子可能发生变性或裂解。此外,撞击样品的电子可能让这些分子携带电荷,从而导致它们移动并变得模糊。许多人正在努力将这些影响降至最低,以便提供更能够进行准确测量的稳定样品。 /p p 有了这些进展,我们应该能够观察到细胞中及其表面发生的分子事件。我们或许能够观察DNA复制或剪接等过程中构象变化的复杂循环,从而了解整个分子过程。 /p p style=" text-align: center " strong span style=" color: rgb(0, 112, 192) " 7.Casey Greene:应用人工智能(artificial intelligence, AI)和深度学习 /span /strong /p p Casey Greene是宾夕法尼亚大学佩雷尔曼医学院系统药理学与转化疗法助理教授。他对于人工智能的应用发表了自己的意见。 /p p 生命科学家已熟练地使用深度学习软件和人工智能来构建预测模型,这些预测模型告诉我们很多东西,比如在哪里能够找到基因调控元件结合的基序。但是,如今,科学家们想要揭示更深层真相----比如,基因调控本身的细节以及为何某些遗传特征是重要的---的模型。 /p p 在接下来的一年里,我们最为兴奋的是计算方法,它们足够强大,可用于人们在发表论文时上传的大量随机基因组数据中。一种令人兴奋的技术就是 span style=" color: rgb(0, 112, 192) " strong 迁移学习 /strong /span (transfer learning)。 /p p 通过使用这种方法,用户能够使用仅与一种问题直接相关的数据集来了解该问题的广泛特征,然后利用这种算法了解到的信息来分析用户所关心的数据集。比如,在去年发表的一项研究中,科学家团队想要使用针对一种称为 span style=" color: rgb(0, 112, 192) " strong 抗中性粒细胞 /strong /span 胞质抗体相关性血管炎(anti-neutrophil cytoplasmic antibody-associated vasculitis)的罕见疾病的数据集来训练一种模型。但是没有足够的数据来做到这一点。 /p p 因此,他们利用来自1400多项其他研究的RNA测序数据来训练相关模型,并将这种模型应用于疾病治疗,从而揭示出与免疫和代谢功能相关的导致这种疾病症状的基因网络。希望不久之后,可以观察到更多的论文发表,在这些论文中,转移模型能够产生新的科学。 /p p 希望有朝一日,这些方法将不仅可以为特定情景和解答特定问题的答案提供预测模型,还可从生物学角度揭示发生了什么来产生我们所看到的数据。也希望在未来一年内,这些方面将会取得一定的进步,但这也将需要投入大量的技术和资源来协助进行模型解释。如果五年后在这方面取得成功,必定是令人激动的。 /p