随着公众对药物安全性的日益关注,控制药物中杂质已成为控制药品质量的关键因素之一,也是困扰着广大药物分析工作者的难题之一。由于药物杂质的来源广泛,已知的杂质可以通过现有的分析手段进行定性定量,未知的杂质则成为分析的难题,因此对于药品的杂质控制首要解决的问题就是将所有杂质进行完全分离。为了让广大药物分析工作者能实现有效地药品杂质控制,全国医药技术市场协会于2012年4月10日-13日在上海市举办“2012药物研究分析中新技术、新方法应用及杂质控制研讨会”。 制药企业和新药研究机构的研发人员,各级药品检验所(院)和口岸药品检验所人员,药品生产企业研发技术与质量管理负责人,新药研发CRO实验室人员及高管,各高等院校、科研院所等相关专业人员100多人参加了此次会议。 在此次会议上,多位行业知名专家钟大放(中科院药物研究所),王洪允(协和医院临床药理中心),胡昌勤(中国食品药品检定研究院),周立春(北京市药检所),王玉(江苏省检品检验所),张尊建(中国药科大学分析测试中心)分别讲解了当前药物分析领域中各种新技术、新方法,探讨分析新技术在药品研发及药品质量控制中的应用,特别是用于生物标志物、活性成份、药物代谢等高通量、定性、定量的各种分析技术,以及新版药典对药物分析方法新要求与国外药典比较等内容。 作为全球色谱消耗品领先的制造商,迪马科技一直致力于为食品、药品检测行业提供完善的技术服务,除与参会专家进行技术交流外,迪马科技技术应用工程师还与广大与会者共同分享了《Dikma 高效液相色谱柱技术应用于药品杂质控制分析》技术报告。 对于药品中杂质控制分析,首先要借助色谱柱进行良好的分离,迪马科技在此次技术报告中重点讲解了在杂质控制中色谱柱的分离性能所起关键作用及迪马科技多款液相色谱柱:Ø Diamonsil(钻石)—通用型反相色谱柱,超高的分离性能特别适合分析复杂的样品及杂质;Ø Spursil(思博尔)—通用型极性改性反相色谱柱,耐受100%水相-100%有机相,特别适用于强碱性化合物和极性化合物的分析;Ø Endeavorsil(奋进)—1.8 μm UHPLC专用色谱柱,超高的柱效满足您UHPLC分离杂质的需求;Ø Leapsil(飞跃)—2.7μm兼容UHPLC/HPLC色谱柱,低柱压设计,高选择性可在HPLC上拥有UHPLC色谱柱的分离能力;[font=Wing

药物杂质即影响药物纯度的物质。药品在临床使用中产生的不良反应除了与药品本身的药理活性有关外,有时与药品中存在的杂质也有很大关系[b][color=#ff0000]。杂质直接关系到药品的质量可控性与安全性[/color][/b],在药物的研究、生产、供应和临床使用等方面,规范地进行杂质的研究,并将其控制在一个安全、合理的限度范围之内,才能保证药物的有效性和安全性。[color=#ff0000][b]因此杂质的研究及检测技术是药品研发的一项重要内容[/b][/color]。 [color=#3366ff][b]2018年8月30日[/b][/color],仪器信息网网络讲堂栏目将为您呈现“化学药物杂质研究及检测技术”主题网络研讨会。届时将邀请业内专家及技术人员为大家介绍化学药物杂质研究的最新进展及检测技术。 [b]如果你是一个对知识渴望的化学药物研究者或从业人员,想了解药物杂质的最新研究进展;又或者是不安于现状的检验检测机构工作者,想要提高检测技术水平,那就千万不要错过这个难得的沟通交流机会,保证会让你有意想不到的收获哦~欢迎大家踊跃报名[/b]([b][url=https://www.instrument.com.cn/webinar/meetings/icd/]点击即可传送至免费报名处[/url],[color=#ff0000]报名截止日期8月29日[/color][/b])![url=https://www.instrument.com.cn/webinar/meetings/icd/][img=,690,636]https://ng1.17img.cn/bbsfiles/images/2018/08/201808281042237666_6386_3429861_3.jpg!w690x636.jpg[/img][/url][url=https://www.instrument.com.cn/webinar/meetings/icd/][img=,690,724]https://ng1.17img.cn/bbsfiles/images/2018/08/201808281042363056_2579_3429861_3.png!w690x724.jpg[/img][/url]
谁那里有2013年3月15日《药品研发注册杂质研究与控制专题研讨会》相关的PPT材料啊!急急急!!!谢谢!

药物分析技术与检测方法及质量控制专题研讨会资料2011年4月 北京主要内容:1.高效液相色谱-质谱联用技术在药物分析中的应用-2011.4.23-北京李晓东2.化学药物杂质研究的基本思路及案例分析-2011-4.26北京李眉3.溶出度及其评价--总后姜雄平2011.04.26 4.药品检验方法验证和稳定性研究要求探讨-2011.4.23-北京杨仲元5.药物分析技术现状与展望-2011.4.20-北京田颂九6.原料药残留溶剂试验的要求及常见问题分析-2011.4-北京周立春下载地址:http://www.yaojia.org/forum.php?mod=viewthread&tid=22243&fromuid=1023网络资源,仅供大家学习。http://ng1.17img.cn/bbsfiles/images/2011/05/201105211714_295316_2232707_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/05/201105211714_295318_2232707_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/05/201105211714_295319_2232707_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/05/201105211714_295317_2232707_3.jpg

为进一步提高医药从业人员业务水平和开展专业技术人才队伍建设,2011年11月22日-25日由全国医药技术市场协会举办的“药物分析方法的建立和验证研讨会”在北京成功召开。来自全国制药企业、新药研究机构等100余名QC和研发人员参加了此次研讨会。另外,此次技术研讨会还邀请了李晓东、田颂九、杨仲元、周立春等专家做了关于药物分析方法建立与验证的精彩报告。 作为全球色谱消耗品领先的制造商,迪马科技积极参与了此次技术研讨会,同时迪马科技全球研发总监李广庆博士也在会上与大家分享了精彩的技术报告《高效液相色谱技术在药物分析中的应用》。http://ng1.17img.cn/bbsfiles/images/2011/12/201112011726_334650_1987954_3.jpg 高效液相色谱技术在药物分析中的应用--李广庆博士 迪马科技全球研发总监 在此次研讨会上,迪马科技李博士为大家详细介绍了迪马科技六大色谱柱产品系列:Diamonsil钻石二代通用型反相色谱柱、1.8μm Endeavorsil UHPLC超高压液相色谱柱、2.7μm Leapsil HPLC/UHPLC兼容色谱柱、Bio-Bond 300 Å蛋白和多肽专用色谱柱、Inspire高性能宽pH反相色谱柱、Spursil极性改性色谱柱等,并且就迪马科技高效液相色谱柱超高的柱效和分辨率,超长使用寿命等技术特点及在药物分析中的实际应用案例进行了专业深入的讲解。技术报告会之后,参会技术人员对李博士深入浅出的技术报告做出了极高的评价,觉得从中收获很多,对于自己的实际分析工作有很大的帮助,希望下次有机会再聆听其余部分及样品前处理的内容。http://ng1.17img.cn/bbsfiles/images/2011/12/201112011727_334651_1987954_3.jpg 技术交流会现场 另外,此次技术研讨会还邀请了李晓东、田颂九、杨仲元、周立春等专家做了关于药物分析方法建立与验证的精彩报告。http://ng1.17img.cn/bbsfiles/images/2011/12/201112011728_334652_1987954_3.jpg高效液相色谱(HPLC)分析方法开发与验证--李晓东 中国食品药品检定研究院http://ng1.17img.cn/bbsfiles/images/2011/12/201112011729_334653_1987954_3.jpg现代色谱分析技术在药物分析中的应用--田颂九 中国药学会药物分析专业委员会名誉主任委员、研究员 如果您对李广庆博士《高效液相色谱技术在药物分析中的应用》的技术报告感兴趣,欢迎来电索取技术报告相关内容(021-60904761)。
如题,小弟就要去了,有没有同行一起交流下啊,有木有游玩计划啊,欢迎大家积极回帖报名,站短联系。 第二届国际药品快速检测技术研讨会暨第三届中美药品分析技术与检测方法研讨会会议名称:第二届国际药品快速检测技术研讨会暨第三届中美药品分析技术与检测方法研讨会会议简介:为加强国内外先进药品分析检测技术和快检技术的交流与合作,以提高检验检测能力和水平,提升快检技术研究和应用,促进药检事业的发展,更好、更全面地发挥技术支撑、技术保障和技术服务作用。本次会议重点就药品检验技术与方法、药品快检技术、药品标准物质、实验室质量管理4个重点领域进行研讨和交流。拟邀请来自WHO、美国FDA、欧洲EDQM等国内外著名专家做专题演讲。会场内同时设置来自国内外的展报展示发表。本届研讨会将邀请国内外多名中美知名药检专家报告,欢迎各有关单位参加交流和投稿。会议时间: 2011年11月15日~16日(星期二至星期三),14日全天报到。会议地点:杭州第一世界大酒店(杭州市萧山区风情大道2555号)会议主题:药品质量与公众健康会议形式:采用大会报告、分会交流、壁报展览的形式,为广大从业人员提供充分、详实的交流、合作平台。征文内容与要求:本次研讨会实行网上投稿。主要包括:1)药品检验技术与方法;2)药品快检技术;3)药品标准物质;4)实验室质量管理。欢迎广大从事药物分析、药品质量控制、药品监督管理及其他相关领域人员积极参会和投稿,所投稿件应为未公开发表的研究论文、专题报告、成果展示、综述及评述等。论文体例、格式请参考《药物分析杂志》。论文采用中英文撰写均可;摘要字数不超过1000字,可适当结合图表;研究论文全文不超过5000字。论文征稿截止日期为2011年10月5日,投稿请务必于2011年10月5日前登录(www.IFRDT.com),有关论文经专家审定后,可优先在《药物分析杂志》上发表。会议注册费:会议代表注册费1200元/人;交通、食宿费自理参会对象与报名方式:各省、市、自治区、直辖市药检所、口岸药检所人员,药品研发机构从事决策、科研、注册部门人员、高等院校,科研院所、药品生产企业及保健食品、食品、化妆品等相关领域的专业人员。国内外机构、企业、学者等。本次研讨会实行网上注册,请各位参会代表务必于2011年11月11日前登录 (www.IFRDT.com),填写相关注册信息。
[b]“药物晶型控制分析”主题网络研讨会(2020)[i][img]https://img1.17img.cn/ui/simg/instrument/child/webinar2020/images/icon_time@2x.png[/img]10月28日 09:00 - 10月28日 12:00 直播[url]https://m.instrument.com.cn/webinar/meetings/JX1028?from=timeline[/url][/i][/b]
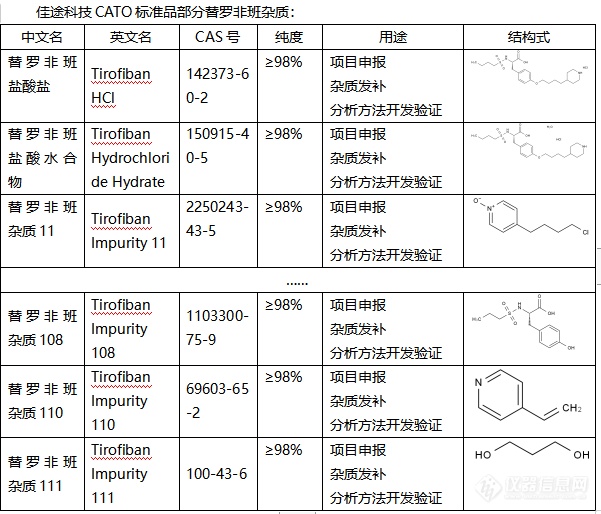
在当今的医疗领域,药物的质量控制至关重要,直接关系到患者的生命健康。替罗非班是一种广泛应用于心血管疾病治疗的药品,其质量控制尤为重要。而杂质分析作为药物质量控制的关键环节,能够准确评估药物的安全性和有效性。本文将重点探讨替罗非班杂质分析与CATO标准品应用研究的重要性。首先,杂质分析是确保药物质量的重要手段。在替罗非班的制备过程中,可能会产生一系列杂质,这些杂质的存在可能对药物的疗效和安全性产生不良影响。CATO标准品作为一种有效的分析工具,能够准确鉴定和量化替罗非班中的杂质,为药物的质量控制提供科学依据。其次,CATO标准品的应用有助于深入了解杂质的来源和性质。通过与标准品的比对分析,研究人员可以追溯杂质的产生途径,从而优化生产工艺,降低杂质的产生。此外,CATO标准品还可以用于评估杂质的毒性和风险,为药物的安全性评价提供有力支持。此外,CATO标准品在指导药物生产和改进方面也具有重要意义。通过对替罗非班中杂质的准确分析,生产商可以针对性地优化生产工艺、加强质量控制,从而提高药物的纯度和安全性。这不仅有助于保障患者的用药安全,还有助于提升企业的生产效益和市场竞争力。综上所述,替罗非班杂质分析与CATO标准品应用研究在药物质量控制中发挥着关键作用。通过深入研究替罗非班中的杂质,并借助CATO标准品这一强大工具,我们能够更好地了解杂质的来源、性质和影响,从而优化药物的生产工艺、提升药物的安全性和有效性。[img=,601,514]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021849065001_3752_6381568_3.png!w601x514.jpg[/img]欢迎有需要的各位联系

药物杂质是指无治疗作用或影响药物的稳定性以及疗效的物质。由于杂质检测和含量控制对药品质量控制以及安全用药密切相关,国家药品监督管理局(National Medical Products Administration, NMPA)对药物临床前研究中的杂质分析越来越重视。 化药中的杂质可分为有机杂质、无机杂质、残留溶剂。对于新药制剂来说:有活性组分的降解产物、活性组分与赋形剂和(或)内包装/密封系统的反应产物、遗传毒性杂质以及药包材杂质。关于杂质的分析方法,对于有机杂质的分析(起始物、副产物、中间体、降解产物等),使用色谱法分析居多;对于无机杂质(重金属,无机盐等),通常采用ICP/AA/[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICPMS[/color][/url]等仪器分析;对于残留溶剂杂质,则以GC分析为主。 贯穿于药品研发的整个过程的理念就是保证安全。选择合适的分析方法,准确地测定杂质的含量,综合毒理及临床研究的结果可以更好地研究药物杂质。基于此,[b]仪器信息网[/b]与[b]天津市分析测试协会[/b]拟于[b][color=#ff0000]2021年7月27日[/color][/b]联合举办[color=#ff0000][b][url=https://insevent.instrument.com.cn/t/Kk]“化学药物杂质研究及检测技术”主题网络研讨会[/url][/b][/color],旨在关注药物安全和药物杂质分析检测,为广大药学工作者和检测人员提供交流的空间。[url=https://insevent.instrument.com.cn/t/Kk][img=,690,483]https://ng1.17img.cn/bbsfiles/images/2021/07/202107231500576930_1336_2507958_3.png!w690x483.jpg[/img][/url][url=https://insevent.instrument.com.cn/t/Kk][size=18px][color=#ff0000][b]点击报名:https://insevent.instrument.com.cn/t/Kk[/b][/color][/size][/url]
随着新版《药品注册管理办法》的实施,对药品注册的相关技术提出了新的要求,特别是抗生素类高风险产品,目的是全面提升注册上市药品的质量和品质。 杂质研究是药物质量控制研究的重要项目。对抗生素而言,由于其多为半发酵、半合成产品,所含的杂质种类与杂质含量都比普通合成化学药物复杂;同时由于国内抗生素使用范围较广,面临的安全性问题更为突出,因此,杂质研究和杂质控制更是抗生素质量控制研究的关键项目。 对于仿制国内外已上市抗生素的品种,根据仿制药的基本技术要求,应选择被仿药物进行系统的质量对比研究,以保证其质量的一致性。 在杂质研究方面,根据相关技术要求,结合我国抗生素生产和研发的历史以及现实情况,提出如下要求:

药物杂质是指无治疗作用或影响药物的稳定性以及疗效的物质。由于杂质检测和含量控制对药品质量控制以及安全用药密切相关,国家药品监督管理局(National Medical Products Administration, NMPA)对药物临床前研究中的杂质分析越来越重视。 化药中的杂质可分为有机杂质、无机杂质、残留溶剂。对于新药制剂来说:有活性组分的降解产物、活性组分与赋形剂和(或)内包装/密封系统的反应产物、遗传毒性杂质以及药包材杂质。关于杂质的分析方法,对于有机杂质的分析(起始物、副产物、中间体、降解产物等),使用色谱法分析居多;对于无机杂质(重金属,无机盐等),通常采用ICP/AA/[url=https://insevent.instrument.com.cn/t/yp][color=#3333ff]ICPMS[/color][/url]等仪器分析;对于残留溶剂杂质,则以GC分析为主。 贯穿于药品研发的整个过程的理念就是保证安全。选择合适的分析方法,准确地测定杂质的含量,综合毒理及临床研究的结果可以更好地研究药物杂质。基于此,[b][color=#ff0000]仪器信息网[/color][/b]与[b][color=#ff0000]天津市分析测试协会[/color][/b]拟于[b][color=#ff0000]2021年7月27日[/color][/b]联合举办“[color=#ff0000]化学药物杂质研究及检测技术[/color]”主题网络研讨会,旨在关注药物安全和药物杂质分析检测,为广大药学工作者和检测人员提供交流的空间。[url=https://insevent.instrument.com.cn/t/Kk][img=,690,483]https://ng1.17img.cn/bbsfiles/images/2021/07/202107231627454035_7123_2507958_3.png!w690x483.jpg[/img][/url][b][size=18px][color=#ff0000][url=https://insevent.instrument.com.cn/t/Kk]点击参会:https://insevent.instrument.com.cn/t/Kk[/url][/color][/size][/b]

2012年8月由中国微生物学会生化过程模型化和控制专业委员会主办,上海市微生物协会、生物反应器工程国家重点实验室和国家生化工程技术研究中心(上海)共同承办了“2012年工业生物过程优化与控制研讨会”并获得圆满成功,会议邀请了包括邓子新院士在内的十三位国 内外专家进行了大会报告,参会代表247人,会议对促进我国生物过程研究领域的学术交流及 推进科研向产业化转化起到了积极作用。为继续充分发挥生化过程模型化和控制专业委员会在推进生物过程研究深入中的作用,经 讨论决定,定于 2014 年10 月17-18日在华东理工大学举办“2014 年工业生物过程优化与控制 研讨会”,请你单位积极选派人员参加。现将有关事项通知如下:一、会议宗旨与目的 本次研讨会聚焦在生物过程的前沿领域与工程学研究、建模与优化放大、装备仪表软硬件技术以及上述技术的工业应用等领域。会议将邀请菌种(细胞株)构建与筛选、细胞大规模培养、产品分离纯化、生物制造业废弃物治理等生物制造过程全产业链研究领域的科研和企业应 用人员,也将邀请有关生物过程装备及仪表研制人员,进行学术交流,以推进我国在该领域中 的发展与创新,加强科研与工业企业之间的交流沟通。本会议也将为科研及企业生产人员提供 学习和探索未来发展的机会。二、会议时间地点时间:2014 年 10 月 16 日注册,17-18 日两日学术会议及实验室参观地点:上海华东理工大学三、大会特邀报告人:会议将邀请国内外工业生物技术领域院士、著名科学家、产业协会专家领导作大会特邀报 告,初定如下:http://ng1.17img.cn/bbsfiles/images/2014/10/201410091118_517470_271_3.png四、会议主题及研讨内容 本次研讨会的主题为“工业生物过程的优化与控制”。研讨会一方面总结生物过程领域基础理论研究前沿和最新工业应用技术实践,另一方面立足我国工业生物技术发展的现实,关注工业生物过程设计、开发、优化中的焦点问题。作为会议特色将设企业专场,针对工业生物过 程全产业链的技术进行交流,促进产业进步。会议针对本领域发展方向、热点问题具体分为四大议题:(一) 工业生物过程中的建模分析与优化技术:1)生物过程复杂系统的生物学与工程学研究;2)系统生物学、代谢工程与生物过程研究的相关性;3)基于过程信息处理的生物过程研究与 方法;4)生物过程动力学研究与应用;5)生物过程的建模、优化与数学方法;6)微生物、 动植物细胞、治疗细胞、环境生物治理、生物信息等不同过程研究中的特征分析与模型化研究。(二) 工业生物过程中的装备及参数检测与控制:1)生物反应器放大技术与应用;2)各种新型生物反应器的研究与开发;3)工业生物过程在线检测与传感器技术;4)生物反应器流场特 性研究与应用;5)工业生物过程数据采集与处理软件包技术;6)发酵过程数据分析互联网技 术。(三) 工业生物过程全产业链关键平台技术:1)菌种与细胞高通量筛选技术及装置;2)过程优化与放大技术;3)新型产品分离技术;4)工业生物过程三废处理新技术与应用;5)发酵 罐控制系统的仪表与计算机软硬件技术。(四) 工业生物过程前沿技术研究:1)工业生物过程中的系统生物学研究与应用;2)工业生物过程研究中的环境组学研究与应用;3)细胞内快速反应动力学研究进展;4)代谢工程在工业 生物过程中的应用;5)其他工业生物技术的前沿研究与进展。五、论文征集及评奖本次大会将与《生物工程学报》(中国自然科学核心期刊,被美国医学索引MEDLINE、荷兰Elsevier 公司Scopus、美国剑桥科学文摘CSA(NS)等索引数据库收录)等合作,从投稿 论文中择优编纂为专刊。所有论文将编辑《论文集》,现征集与大会讨论内容相关的会议论文, 要求如下:1、未公开发表的论文,文责自负;2、格式要求:题目,三号宋体;作者及单位、E-mail 地址,五号楷体;正文:小四号宋体。采用 Office2007 以上版本软件排版。3、截止日期为 9 月 15 日。请发往 E-mail: ibcos2014@ecust.edu.cn优秀论文甄选及评奖:会议将组织 3-5 名专家对投稿论文进行甄选,除推荐在核心期刊《生物工程学报》发表外, 还将根据专家意见,由会议赞助方特设优秀论文评奖、优秀报告奖若干名,每篇论文奖金金额1000 元-5000 元。六、参会对象从事与大会研讨内容相关研究的科研单位、高等院校的科研人员;工业发酵生产企业的科 研、管理人员;生化过程模型化和控制专业委员会的委员、学术顾问等。七、会议注册费参会回执见附件,注册费用:科研单位院校代表:1200 元/人,学生代表:600 元/人,企 业代表:1500 元/人。(含专家费、会务费、论文集等),住宿根据代表回执选择进行统一安排, 费用自理。费用支付方式:1.银行汇款 2.现场缴费 3.信用卡授权支付。收款账号信息如下:收款人名称:华东理工大学 收款人帐号:033296-08017003862收款项目:华东理工大学工业生物过程优化与控制研讨会会议费收款人开户行名称:农行徐汇区漕溪支行 八、会议联系信息会务组邮箱: ibcos2014@ecust.edu.cn会议联系人:1. 夏建业 博士 手机:13761030390 Tel:021-64251946 Fax: 021-64253702 E-mail: jyxia@ecust.edu.cn2. 王涛 手机:13585732397 E-mail: 244495242@qq.com3. 鲁洪中 手机:18801610581 E-mail:luhongzhong2006@126.com会议用房价格表:http://ng1.17img.cn/bbsfiles/images/2014/10/201410091119_517471_271_3.png会议简要议程:http://ng1.17img.cn/bbsfiles/images/2014/10/201410091121_517473_271_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/10/201410091121_517474_271_3.png网上报名更多信息请点击梅特勒-托利多网站
[img]https://ng1.17img.cn/bbsfiles/images/2020/10/202010211614383403_5395_2507958_3.png!w690x151.jpg[/img][size=18px][b][color=#3333FF]内容简介:[/color][/b][/size]物质结晶时受各种因素影响,分子内或分子间键合方式发生改变,致使分子或原子的晶格空间排列不同,会形成不同的晶体结构。同一物质具有两种或两种以上的空间排列和晶胞参数,形成多种晶型的现象称为多晶现象(polymorphism)。不同晶型的同种药物在外观、溶解度、熔点、溶出度、生物有效性等方面会有或多或少的区别。这些差异会影响药物的稳定性、生物利用度以及疗效。在口服固体制剂中,这种由于药物晶型多样化带来的影响更为多见。药物多晶型现象是影响药品质量与临床疗效的重要因素之一,因此对存在多晶型的药物进行研发以及审评时,应对晶型分析予以特别的关注。[color=#000000]为加强药物晶型控制有关最新研究和技术交流,为来自企业、科研院所、高校与政府监管部门的相关用户搭建交流与沟通平台,仪器信息网将于[b]2020年10月28日[/b]举办“药物晶型控制分析”主题网络研讨会。[/color][size=18px][color=#3333FF][b]会议内容:[/b][/color][/size][url=https://www.instrument.com.cn/webinar/meetings/JX1028/][img]https://ng1.17img.cn/bbsfiles/images/2020/10/202010211644082784_1583_2507958_3.png!w690x395.jpg[/img][/url][img]https://ng1.17img.cn/bbsfiles/images/2020/10/202010211644261756_1050_2507958_3.png!w690x190.jpg[/img][size=18px][color=#3333FF][b]报名链接:[/b][/color][/size][url]https://www.instrument.com.cn/webinar/meetings/JX1028/[/url][size=18px][color=#3333FF][b]会议时间:2020年10月28日 上午09:00[/b][/color][/size][size=18px][color=#FF0000][b]欢迎报名参加![/b][/color][/size]
多肽作为药物,具有生理活性强、免疫原性低、疗效高等诸多优点,随着生物技术的不断发展,其在人类疾病治疗中的地位也日趋重要,目前已成为国际药学界研究的热点之一。 默克密理博在多肽合成领域已有30年的历史,其品牌Novabiochem?除了满足多肽合成客户对常规产品的需求外,还不断进行创新,每年都会发布最新的研发产品及应用,并且还可以提供个性化定制的高效解决方案。为了增进多肽合成领域的技术创新交流,默克密理博在Novabiochem? 创新30年之际,召开学术研讨会。会议邀请了从事多肽制药领域的多位专家和学者,议题包括:天然、非天然氨基酸及其类似物的合成新方法,多肽、蛋白质的合成新方法,多肽物质分离与分析方法推广应用,多肽合成中因素控制对质量的影响以及多肽纯化和分析的新技术等,针对以上议题,各位专家进行了深入的交流,得到了与会者的一致好评和巨大反响,会议取得了圆满的成功。http://blog.milliporechina.com/editor/upload/image/930F7A5B_BF1453AA.png
[img]https://ng1.17img.cn/bbsfiles/images/2020/10/202010211614383403_5395_2507958_3.png!w690x151.jpg[/img][size=18px][b][color=#3333FF]内容简介:[/color][/b][/size]物质结晶时受各种因素影响,分子内或分子间键合方式发生改变,致使分子或原子的晶格空间排列不同,会形成不同的晶体结构。同一物质具有两种或两种以上的空间排列和晶胞参数,形成多种晶型的现象称为多晶现象(polymorphism)。不同晶型的同种药物在外观、溶解度、熔点、溶出度、生物有效性等方面会有或多或少的区别。这些差异会影响药物的稳定性、生物利用度以及疗效。在口服固体制剂中,这种由于药物晶型多样化带来的影响更为多见。药物多晶型现象是影响药品质量与临床疗效的重要因素之一,因此对存在多晶型的药物进行研发以及审评时,应对晶型分析予以特别的关注。[color=#000000]为加强药物晶型控制有关最新研究和技术交流,为来自企业、科研院所、高校与政府监管部门的相关用户搭建交流与沟通平台,仪器信息网将于[b]2020年10月28日[/b]举办“药物晶型控制分析”主题网络研讨会。[/color][size=18px][color=#3333FF][b]会议内容:[/b][/color][/size][url=https://www.instrument.com.cn/webinar/meetings/JX1028/][img]https://ng1.17img.cn/bbsfiles/images/2020/10/202010211644082784_1583_2507958_3.png!w690x395.jpg[/img][/url][img]https://ng1.17img.cn/bbsfiles/images/2020/10/202010211644261756_1050_2507958_3.png!w690x190.jpg[/img][size=18px][color=#3333FF][b]报名链接:[/b][/color][/size][url]https://www.instrument.com.cn/webinar/meetings/JX1028/[/url][size=18px][color=#3333FF][b]会议时间:2020年10月28日 上午09:00[/b][/color][/size][size=18px][color=#FF0000][b]欢迎报名参加![/b][/color][/size]

[img]https://ng1.17img.cn/bbsfiles/images/2020/10/202010211614383403_5395_2507958_3.png!w690x151.jpg[/img][size=18px][b][color=#3333FF]内容简介:[/color][/b][/size]物质结晶时受各种因素影响,分子内或分子间键合方式发生改变,致使分子或原子的晶格空间排列不同,会形成不同的晶体结构。同一物质具有两种或两种以上的空间排列和晶胞参数,形成多种晶型的现象称为多晶现象(polymorphism)。不同晶型的同种药物在外观、溶解度、熔点、溶出度、生物有效性等方面会有或多或少的区别。这些差异会影响药物的稳定性、生物利用度以及疗效。在口服固体制剂中,这种由于药物晶型多样化带来的影响更为多见。药物多晶型现象是影响药品质量与临床疗效的重要因素之一,因此对存在多晶型的药物进行研发以及审评时,应对晶型分析予以特别的关注。[color=#000000]为加强药物晶型控制有关最新研究和技术交流,为来自企业、科研院所、高校与政府监管部门的相关用户搭建交流与沟通平台,仪器信息网将于[b]2020年10月28日[/b]举办“药物晶型控制分析”主题网络研讨会。[/color][size=18px][color=#3333FF][b]会议内容:[/b][/color][/size][url=https://www.instrument.com.cn/webinar/meetings/JX1028/][img]https://ng1.17img.cn/bbsfiles/images/2020/10/202010211644082784_1583_2507958_3.png!w690x395.jpg[/img][/url][img]https://ng1.17img.cn/bbsfiles/images/2020/10/202010211644261756_1050_2507958_3.png!w690x190.jpg[/img][size=18px][color=#3333FF][b]报名链接:[/b][/color][/size][url]https://www.instrument.com.cn/webinar/meetings/JX1028/[/url][size=18px][color=#3333FF][b]会议时间:2020年10月28日 上午09:00[/b][/color][/size][size=18px][color=#FF0000][b]欢迎报名参加![/b][/color][/size]
[color=#333333] 10月10日,由国际计量局、中国计量科学研究院(以下简称“中国计量院”)、中国食品药品检定研究院联合主办的第二届“蛋白和肽类药物及诊断试剂研发与质控(PPTD)”国际研讨会在四川成都开幕。市场监管总局副局长秦宜智(正部长级)出席并讲话,成都市副市长刘旭光致辞。开幕式由中国计量院党委书记段宇宁主持。[/color][color=#333333][/color][align=left] 市场监管总局副局长秦宜智讲话,秦宜智在讲话中指出,人民群众对美好生活的向往,最基本的需求是健康。研究掌握人类生命科学和生物医学客观规律,离不开对各种“量”的精准测量、获取和比对。希望研讨会聚焦计量、标准在质量与安全控制中的重要技术基础作用,通过知识共享和技术交流,着力提升生物医药产品研发、质控和科技创新能力。他表示,市场监管总局将牢固树立以人民为中心的发展理念,加强基础前沿和应用型计量测试技术研究,深化计量领域国际交流与合作,努力为服务人民群众生产生活提供有力的计量技术支撑。[/align][color=#333333][/color][align=left] 成都市副市长刘旭光致辞,刘旭光在致辞中介绍了目前成都加快建设生物医药产业功能区,打造国际知名、国内一流的医药健康研发创新中心、产业孵化中心和高端制造中心的情况。[/align][color=#333333][color=#333333] 蛋白质和肽类药物及诊断试剂的有效性评价和质量的精确控制是目前全球生物医药产业面临的巨大挑战,也是企业研发的重点和标准化工程化开发的前提。此次研讨会为期3天,以“测量与标准,质量与安全”为主题,聚焦计量、标准在质量与安全控制中的重要技术基础作用,旨在深化未来生物医药领域尤其是蛋白和肽类药物及诊断试剂研发与质控等细分专业的国际间交流,促进全球生物医药产业健康发展。[/color][/color][color=#333333][color=#333333][/color][/color][align=left] 国际计量局化学部主任Robert Wielgosz作大会报告。除大会报告外,与会代表还围绕药物表征与质量保证、体外诊断试剂研究和质量控制、标准、法规与计量等3个主题进行了分会场交流和讨论,以期进一步促进该领域学术交流和技术发展,提升研发水平和产品质量。[/align][color=#333333][color=#333333][/color][/color][align=left] 中科院大连化物所张玉奎院士作大会报告。国际计量局化学部主任 Robert Wielgosz、北京化工大学校长谭天伟院士、中科院大连化物所张玉奎院士、市场监管总局计量司司长谢军等来自国际计量局(BIPM)、国际检验医学溯源联合委员会(JCTLM)、国际临床化学联合会(IFCC)等国际组织,国内外计量技术机构、药品研发与管理机构、临床医学检验机构,有关科研院所和企业的专家学者,以及市场监管总局、四川省和成都市相关部门领导,共400余人出席研讨会。[/align]
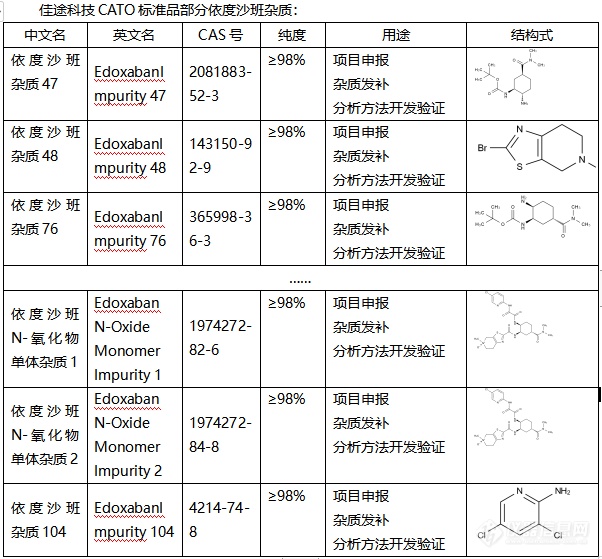
依度沙班,作为一种抗凝药物,被广泛应用于预防和治疗血栓形成。然而,与其他药物一样,依度沙班在生产过程中也可能产生杂质。这些杂质的存在可能会影响药物的安全性和有效性。为了确保依度沙班的质量,科学家们引入了CATO标准进行杂质分析。CATO标准是一种先进的分析方法,可以帮助研究人员准确地检测和衡量依度沙班中的杂质。通过对比和分析,我们可以清楚地了解杂质的种类、数量以及可能对药物产生的影响。这一标准的应用,不仅提高了依度沙班的生产质量,也为我们提供了一种有效的质量控制手段。在实际应用中,CATO标准品发挥着重要的作用。首先,它能够准确鉴定和量化依度沙班中的杂质,为药物的质量控制提供科学依据。其次,通过与标准品的比对分析,研究人员可以深入了解杂质的来源和性质,从而优化生产工艺,降低杂质的产生。此外,CATO标准品还可以用于评估杂质的毒性和风险,为药物的安全性评价提供有力支持。随着研究的深入,CATO标准在依度沙班杂质分析中的应用将不断优化和完善。通过科学的分析和严格的控制,我们能够确保依度沙班的安全性和有效性,为患者的健康提供更好的保障。同时,这也将推动药物生产的科技进步,造福更多患者。[img=,602,559]https://ng1.17img.cn/bbsfiles/images/2024/02/202402021907159831_6894_6381568_3.png!w602x559.jpg[/img]广州佳途科技股份有限公司是一家专业的CATO标准品生产厂家,目前公司库存有全套乐伐替尼杂质,能够提供相应的系列图谱和产品COA证书,并且支持买家溯源。

[align=center][url=https://www.instrument.com.cn/webinar/meetings/YLY/?bbs][img=,640,300]https://ng1.17img.cn/bbsfiles/images/2020/06/202006151341345729_7007_3295121_3.jpg!w640x300.jpg[/img][/url][/align]6月23日“2020药典之原料药物性检测新技术及应用”主题网络研讨会,深入剖析收录在药典中的物性检测新技术以及物性检测技术在原料药领域的前沿新应用。崔福德(沈阳药科大学 )《介绍国内外药典收载的原辅料粒度的测定方法》孙永达(深圳市思瑞爱斯制药工程有限公司)《药品原料微粉的物性检测及应用》杨腊虎(中国食品药品检定研究院 )《化学药原料中有关杂质检测》高原(北京理化分析测试中心)《颗粒材料物理性能检测技术在医药原辅料粒度分析中的应用》李忠红(江苏省食品药品监督检验研究院)《X-射线粉末衍射法在药品质量控制中的应用》杜世超(天津大学)《原料药晶体形态学指标表征与分析方法探讨》免费报名地址:[url]https://www.instrument.com.cn/webinar/meetings/YLY/?bbs[/url]
[size=16px][b]仪器信息网[/b]网络讲堂将于[/size][size=18px][color=#6666CC][b]2021年5月21日[/b][/color][/size][size=16px]召开[/size][b][size=18px] [color=#FF6666]“药物晶型控制分析”主题网络研讨会(2021)[/color][/size][/b][size=12px],携手该领域的专家和一线工作者带来精彩的分享。[/size][url=https://insevent.instrument.com.cn/t/Hw][size=18px][color=#000099][b]点击报名[/b][/color][/size][/url][size=12px](本次会议旨在为同行提供在线学习机会,实现教育资源共享,并搭建互动平台,增进学术交流,促成项目合作。)[/size][align=center]=======================================================================[/align][align=center][size=16px][url=https://insevent.instrument.com.cn/t/Hw][img=,911,199]https://img1.17img.cn/17img/images/202105/webinar/1ddceabf-8a7e-4048-b2c0-b6ce38fcda7a.jpg[/img][/url] [/size][/align][size=16px][/size][size=16px] 同种药物的不同晶型不仅可能会导致药物存在外观、溶解度、熔点、溶出度以及生物等效性等方面的差异,而且还将进一步影响药物的稳定性、生物利用度以及疗效。在口服固体制剂中,由于药物晶型多样化带来的影响更为多见。因此,药物晶型是仿制药一致性评价的控制指标之一。[/size][size=16px] 鉴于药物多晶型现象对药品质量和临床疗效有影响,因此对存在多晶型的药物进行研发以及审评时,应对晶型分析予以特别的关注。[b]仪器信息网[/b]与[b]天津市分析测试协会[/b]拟于2021年5月21日联合举办“药物晶型控制分析”2021主题网络研讨会,旨在关注药物晶型的分析检测,为广大药学工作者和检测人员提供一个交流的空间。[/size][size=16px]【报名链接】:[url=https://insevent.instrument.com.cn/t/Hw]点击打开链接[/url][/size][align=center][img=,305,305]https://ng1.17img.cn/bbsfiles/images/2021/05/202105191531305482_6617_2507958_3.png!w400x400.jpg[/img][/align][align=center]=======================================================================[/align][align=center] [img=,690,518]https://ng1.17img.cn/bbsfiles/images/2021/05/202105191602317139_3205_2507958_3.png!w690x518.jpg[/img][/align][align=center][size=16px][url=https://insevent.instrument.com.cn/t/Hw]点击打开链接[/url][/size][/align]
药品的化学, 制造和控制(CMC):法规,质量,科学之要求及其策略研讨会举办城市: 上海举办地点: 上海美丽园龙都大酒店举办时间: 2010-6-28 ~ 2010-6-29主办单位: 美国药学科学家学会,和中国药学会药剂学专业委员会联系人: 倪正杰电话: 021-51691228-801传真: 021-63018596Email: zhliaust@online.sh.cn[font=宋体]由美国药学科学家学会(AAPS)和中国药学会(CPA)药剂学专业委员会联合主办的药品的化学、制造和控制(CMC)系列研讨会将于2010年6月28-29日在上海美丽园龙都大酒店召开,上海市食品药品监督管理局为本次研讨会的支持单位。研发出优质安全有效的药品并顺利注册申报是一个复杂的多元过程。药品的化学、制造和控制, 即CMC, 是产品成功开发并注册上市的最关键要素之一。这需要 (1)对产品各种研发活动中所涉及到的许多高度专业化学科的知识及问题有足够的理解 (2) 对各种研发实验及结果进行有效地链接 (3) 对全球区域性法规及其变化和发展趋势有良好理解 (4) 研发, 法规事务和质量部门间的紧密合作以制订法规申报策略和对研发数据的申报适用性进行评价。本次研讨会的演讲专家来自美国、中国药品监管部门以及国际著名制药企业,针对这些议题,来自法规、注册,质量和产品研发方面的专家们将在会上与大家分享他们的知识, 经验, 观察,认识和前瞻性看法,并提升企业拓展国际市场的能力。在会上,您可与制药行业的专家以及监管部门的官员共同探讨如何提升贵公司的研发和创新能力。本次研讨会将围绕以下几个主题展开充分的讨论:▲政府监管的法规框架、要求及期望(FDA美国食品药品监督管理局,ICH人用药物注册国际协调会议,CFR美国联邦法规、指南,质量,科学和GMP,质量源于设计/ICH Q8药物开发, Q9风险管理, Q10质量体系等几个指南,问答式评审,批准后变更,电子申报等)▲临床研究申请/新药申报/仿制药申报/通用技术文件/药物主控文件等文件中的CMC部分的结构和内容▲针对临床研究申请,新药申报和仿制药申报制订CMC对策和文件创建质量,GMP及合规性(厂房设施,质量体系,检查,供应链等)▲科学,质量和CMC策略和文件创建方面的工业界的实践,认识和看法▲全球化协作、整合和一体化的机遇[font=宋体]会议注册费(含资料费、28日中餐、晚宴、29日中餐及茶歇)企业工作人员: 人民币1600元(5月15日前缴费,可享8折优惠)政府工作人员: 人民币800元学生: 人民币800元(须出示有效证件,否则按正式代表收取)[font=宋体]附录一: 大会组委会荣誉主席郑梁元教授, 中国药学会药剂学专业委员会荣誉主席衣承东博士 上海市食品药品监督管理局副局长成员邱怡虹,高级研究员兼CMC业务副总监, 雅培制药, 会议兼主席张华, 上海市食品药品监督管理局认证审评中心首席认证员, 会议兼主席余煊强博士,美国FDA药品评价中心仿制药评审部科学和化学副部长, 会议兼主席陈琦琬,辉瑞公司全球CMC执行总监,前美国FDA新药质量评审部副部长张强教授,中国药学会药剂学专业委员会主席高惠君,上海市食品药品安全研究中心附录二:委员会成员和演讲者邮箱地址o Hua Zhang张华: zhanghua@smda.gov.cn or hzhang66@hotmail.com +86‐21‐6386‐7850o Qiang Zhang张强: zqdodo@bjmu.edu.cno TBD (SFDA)待定:o Brenda Uratani: brenda.uratani@fda.hhs.govo Guohua Zhang张国华: gh_zhang@yahoo.como Lawrence Yu余煊强: lawrence.yu@fda.hhs.govo Chi‐wan Chen陈琦琬: chi‐wan.chen@pfizer.como Richard Poska: richard.poska@abbott.como Jim Li 李建明: landin37@yahoo.como John Z. Duan 段宗一John.Duan@fda.hhs.govo Chengyi Liang梁诚一: chengyi.liang@fda.hhs.govo Weiqin (Tony) Tong童卫勤: Tony.Tong@tevausa.como Steve Colgan: stephen.t.colgan@pfizer.como He (Jim) Huang黄河: jhuang@actavis.como Ganapathy Mohan: ganapathy_mohan@merck.como Zi‐Qiang Gu顾自强: ziqiang.gu@fda.hhs.govo Sharon Pichon (AAPS): PichonS@aaps.org (+1‐703‐248‐4780)o Huijun Gao高惠君 (SHFDA): gaohj@smda.gov.cn or gaohj_1@126.com (021‐64511851:M:13816240286)o Yihong Qiu邱怡虹: qiu.yihong@abbott.com (+1‐847‐938‐5220 M : 847‐508‐9847)[/font][/font][/font]

2011中国(重庆)科教仪器与技术装备展览会于2011年9月27日至29日在重庆国际会议展览中心隆重召开。以此为契机,重庆药学会主办了“重庆药学会药物分析技术研讨会”,来自重庆市各区县的药品检验所,医药研发机构等近100余名一线技术人员参加了本次会议。http://ng1.17img.cn/bbsfiles/images/2011/09/201109290952_320097_1987954_3.jpg“重庆药学会药物分析技术研讨会”技术报告现场 会议于下午两点正式开始,重庆药学会理事长、重庆医科大学邱宗荫教授的《药物分析中的质谱技术与方法》作为开题报告,与参会同仁共同分享其技术成果。http://ng1.17img.cn/bbsfiles/images/2011/09/201109290954_320098_1987954_3.jpg重庆医科大学邱宗荫教授作《药物分析中的质谱技术与方法》技术报告 迪马科技为大会带来了题为《HPLC 色谱柱技术及在药物分析中的应用》的技术报告,迪马行业技术应用工程师就Dikma Diamonsil(钻石)、Spursil(思博尔)、Endeavorsil(奋进) 、Leapsil(飞跃) 等系列高效液相色谱柱的技术特点及在药物分析中的实际应用案例进行了专业的深入讲解,接着就固相萃取技术在药物分析中的应用,也作了详细阐述。 报告会结束后,参会技术人员普遍反映迪马的色谱柱产品性能非常优越,或索取报告课件、或现场咨询、或互留联系方式,都希望能更深入地了解迪马产品和技术,随时沟通实验工作中遇到的问题,为药物分析工作带来更多益处。迪马科技也将继续走在色谱分析技术的前沿,为广大的分析工作者提供更加优质的服务。http://ng1.17img.cn/bbsfiles/images/2011/09/201109290954_320099_1987954_3.jpg参会者与迪马科技技术工程师沟通交流
关于召开国家自然科学基金委化学部药物分析发展战略研讨会的通知(第一轮)____________教授/博士:药物分析是分析化学的重要组成部分,生命科学和现代医药的发展, 向药物分析提出了更高、更严峻的挑战。为了我国药物分析学科更好的发展和进步,国家自然科学基金委员会化学部决定于2006年9月20日至22日在河北省保定市召开“药物分析发展战略研讨会”,特邀请您参加,并请做好发言准备(约15 min)。会议主要内容有:1.我国药物分析的现状和面临的挑战;2.药物分析的发展战略、前沿领域和新的生长点;3.药物分析人才的发现及培养。本次会议由中科院化学所和河北大学共同承办。会议地点:河北大学国际交流中心。研讨会的有关具体事项如下:1、参加会议人员的交通费用自理。会议期间的会务费和食宿费用由大会负责。每人只交参会认定费100元。2、请参会者提交研讨论文摘要,内容主要涉及药物分析的发展、研究成果及对药物分析的发展现状和趋势的研究和建议。论文采用word97/2000排版。以“.doc”文件保存。 内容排列如下:题目作者姓名作者单位、邮编、Email内容摘要论文每人A4纸1页,以5号宋体或Times New Roman体打出,论文集将在大会前统一排印。3、请将研讨论文摘要于2006年9月10日前寄“河北大学药学院杨更亮教授”(邮编:071002)或Email给yaoxueyuan@mail.hbu.edu.cn。因特殊原因无法到会者,不必提交论文。感谢您对基金工作的一贯支持!联 系 人: 1.国家自然科学基金委员会化学科学部:庄乾坤教授电话:010-62327075 传真:010-62327164通讯地址:北京海淀双清路83号,北京8610信箱 E-mail: zhuangqk@nsfc.gov.cn2.中国科学院化学研究所 杨更亮教授电话:010-82627290 或0312-5971108 传真:0312-5971107 通讯地址:北京中关村中国科学院化学研究所 100080; 或河北省保定市河北大学药学院,邮编 071002Email: yaoxueyuan@mail.hbu.edu.cn注:本次会议只发一轮通知,参会者请于2006年9月1日前返回会议回执作为参会认可,会议将根据回执做出安排。参会者如果直接到达保定不方便,可于9月20日下午三点在北京中关村北一街中国科学院化学所门前统一乘车前往保定。 国家自然科学基金委员会化学部 中国科学院化学研究所 河北大学药学院 2006.7.6

[font=微软雅黑][font=微软雅黑][img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241916186502_5355_2507958_3.jpg!w690x151.jpg[/img][/font][/font][font=微软雅黑][font=微软雅黑]抗体药物是现代生物医药产业的主力军[/font],目前占全球生物药物市场的50%,是生物医药产业增长最快的细分领域,预计到2025年全球抗体药物的年销售会超过3000亿美金;我国抗体药物产业起步晚,近两年在抗体药物研发方面速度加快,但在抗体结构设计、新药临床前研究与安全评价、工艺和质量稳定性等方面仍存在诸多挑战,这也意味着中国抗体药物产业有着巨大的发展空间,蕴含着丰富的机会。[/font][font=微软雅黑][font=微软雅黑]为促进我国抗体药物产业持续快速发展,仪器信息网将于[/font]2020年9月11日举办“抗体药物研发生产与质量控制”主题网络研讨会,会议将邀请多位业内专家做精彩报告,为广大用户搭建一个即时、高效的交流和学习的平台。[/font][font=微软雅黑][font=微软雅黑]会议时间:[/font]2020年9月10日-11日[/font][font=微软雅黑][font=微软雅黑]部分会议安排:[/font][/font][img=,690,223]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241916328553_299_2507958_3.jpg!w690x223.jpg[/img][font=微软雅黑] [/font][font=微软雅黑][font=微软雅黑]报名地址:[url=https://www.instrument.com.cn/webinar/meetings/Antibodydrugs]点击打开链接[/url][/font][/font][font=微软雅黑][font=微软雅黑]欢迎报名参加![/font][/font]

[font=微软雅黑] [img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241916523516_5735_2507958_3.jpg!w690x151.jpg[/img][/font][font=微软雅黑][font=微软雅黑]抗体药物是现代生物医药产业的主力军[/font],目前占全球生物药物市场的50%,是生物医药产业增长最快的细分领域,预计到2025年全球抗体药物的年销售会超过3000亿美金;我国抗体药物产业起步晚,近两年在抗体药物研发方面速度加快,但在抗体结构设计、新药临床前研究与安全评价、工艺和质量稳定性等方面仍存在诸多挑战,这也意味着中国抗体药物产业有着巨大的发展空间,蕴含着丰富的机会。[/font][font=微软雅黑][font=微软雅黑]为促进我国抗体药物产业持续快速发展,仪器信息网将于[/font]2020年9月11日举办“抗体药物研发生产与质量控制”主题网络研讨会,会议将邀请多位业内专家做精彩报告,为广大用户搭建一个即时、高效的交流和学习的平台。[/font][font=微软雅黑][font=微软雅黑]会议时间:[/font]2020年9月10日-11日[/font][font=微软雅黑][font=微软雅黑]部分会议安排:[/font][/font][img=,690,223]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241917081155_1274_2507958_3.jpg!w690x223.jpg[/img][font=微软雅黑] [/font][font=微软雅黑][font=微软雅黑]报名地址:[url=https://www.instrument.com.cn/webinar/meetings/Antibodydrugs]点击打开链接[/url][/font][/font][font=微软雅黑][font=微软雅黑]欢迎报名参加![/font][/font]
药物杂质研究的基本思路及案例分析
[size=6][b][color=#d40a00][size=4]土豆注:有谁了解会议来由背景的?有谁了解讨论议题所涉及的仪器和分析理念的?欢迎跟帖谈谈,积分奖励。[/size][/color]CPSA会议首次在中国召开 关注药物分析应用研究进展[/b][/size] [font=Arial][b]仪器信息网讯[/b] 2010年4月7日-9日,第一届化学和药物结构分析上海研讨会(CPSA Shanghai 2010,the 1st Annual Shanghai Symposium on Chemical and Pharmaceutical Structure Analysis)在上海锦江饭店顺利举行;来自国内外的100多位学者和专家到会;仪器信息网作为特邀媒体参加了此次研讨会。[/font][align=center][b][font=Arial][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20104/201041619948658.jpg[/img][/font][/b][/align][align=center][b][font=Arial]CPSA Shanghai 2010会议现场[/font][/b][/align] 一年一度的[font=Arial]CPSA[/font]会议起始于[font=Arial]1998[/font]年,通过制药工业有关问题的公开讨论,对其创新技术与工业实践进行回顾,分享他们各自的高新技术实践经验以及对当前学术发展前景的看法。本届上海研讨会主题为“分析性能研究进展:创新应用和新型工作流程”。[align=center][font=Arial][b][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20104/201041619948525.jpg[/img][/b][/font][/align][align=center][font=Arial][b]CPSA主席Mike S. Lee博士主持会议[/b][/font][/align][align=center][font=Arial][b][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20104/201041619948439.jpg[/img][/b][/font][/align][align=center][font=Arial][b]会议特别赞助商-安捷伦科技牟一萍女士出席会议[/b][/font][/align][b][color=#0000ff] 【大会报告之一】[/color][/b][align=center][b][font=Arial][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20104/201041619948907.jpg[/img][/font][/b][/align][align=center][b][font=Arial]Charles Tong博士(辉瑞Pfizer)[/font][/b][/align] [font=Arial] 报告题目:Challenges and Opportunities of Pharmaceutical Regulatory Environment for Analytical Sciences - An Industrial Perspective[/font] Charles Tong博士报告中提出了以下观点: (1)制药工业和监管机构面临的挑战与机遇并存; (2)质量源于设计(QbD)已经成为一个强大的系统开发方法,这种方法可以用来有效地解决这些问题,以保证药品的质量、安全性与有效性; (3)QbQ方法用于开发更可靠分析方法和有效控制系统的探讨;分析QbQ原理与ICH发布的Q8(制药开发)、Q9(质量风险管理)与Q10(制药质量体系)是一致的; (4)方法的性能要求是明确地基于产品CQAs。当在可操作方法设计区域内移动(MODR)时,对方法参数和方法结果(属性)之间关系的更好理解,可以促使监管制度变得具有灵活性; (5)符合分析对象简介(ATP)的众多方法应该是可以互换的; (6)为了对过程进行理解和控制,一些非常规的分析工具(例如:PAT-过程分析技术、成像、仿真)正普遍地被应用。[b][color=#0000ff] 【大会报告之二】[/color][/b][align=center][font=Arial][b][img]http://bimg.instrument.com.cn/lib/editor/UploadFile/20104/201041619948852.jpg[/img][/b][/font][/align][align=center][font=Arial][b]John Fjeldsted博士(安捷伦科技Agilent Technologies)[/b][/font][/align][font=Arial] [/font]

[font=微软雅黑] [/font][img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241918067440_5705_2507958_3.jpg!w690x151.jpg[/img][font=微软雅黑][font=微软雅黑]抗体药物是现代生物医药产业的主力军[/font],目前占全球生物药物市场的50%,是生物医药产业增长最快的细分领域,预计到2025年全球抗体药物的年销售会超过3000亿美金;我国抗体药物产业起步晚,近两年在抗体药物研发方面速度加快,但在抗体结构设计、新药临床前研究与安全评价、工艺和质量稳定性等方面仍存在诸多挑战,这也意味着中国抗体药物产业有着巨大的发展空间,蕴含着丰富的机会。[/font][font=微软雅黑][font=微软雅黑]为促进我国抗体药物产业持续快速发展,仪器信息网将于[/font]2020年9月11日举办“抗体药物研发生产与质量控制”主题网络研讨会,会议将邀请多位业内专家做精彩报告,为广大用户搭建一个即时、高效的交流和学习的平台。[/font][font=微软雅黑][font=微软雅黑]会议时间:[/font]2020年9月10日-11日[/font][font=微软雅黑][font=微软雅黑]部分会议安排:[/font][/font][img=,690,223]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241918209981_532_2507958_3.jpg!w690x223.jpg[/img][font=微软雅黑] [/font][font=微软雅黑][font=微软雅黑]报名地址:[url=https://www.instrument.com.cn/webinar/meetings/Antibodydrugs]点击打开链接[/url][/font][/font][font=微软雅黑][font=微软雅黑]欢迎报名参加![/font][/font]

[font=微软雅黑] [img=,690,151]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241917396416_6069_2507958_3.jpg!w690x151.jpg[/img][/font][font=微软雅黑][font=微软雅黑]抗体药物是现代生物医药产业的主力军[/font],目前占全球生物药物市场的50%,是生物医药产业增长最快的细分领域,预计到2025年全球抗体药物的年销售会超过3000亿美金;我国抗体药物产业起步晚,近两年在抗体药物研发方面速度加快,但在抗体结构设计、新药临床前研究与安全评价、工艺和质量稳定性等方面仍存在诸多挑战,这也意味着中国抗体药物产业有着巨大的发展空间,蕴含着丰富的机会。[/font][font=微软雅黑][font=微软雅黑]为促进我国抗体药物产业持续快速发展,仪器信息网将于[/font]2020年9月11日举办“抗体药物研发生产与质量控制”主题网络研讨会,会议将邀请多位业内专家做精彩报告,为广大用户搭建一个即时、高效的交流和学习的平台。[/font][font=微软雅黑][font=微软雅黑]会议时间:[/font]2020年9月10日-11日[/font][font=微软雅黑][font=微软雅黑]部分会议安排:[/font][/font][img=,690,223]https://ng1.17img.cn/bbsfiles/images/2020/08/202008241917536545_9998_2507958_3.jpg!w690x223.jpg[/img][font=微软雅黑] [/font][font=微软雅黑][font=微软雅黑]报名地址:[url=https://www.instrument.com.cn/webinar/meetings/Antibodydrugs]点击打开链接[/url][/font][/font][font=微软雅黑][font=微软雅黑]欢迎报名参加![/font][/font]
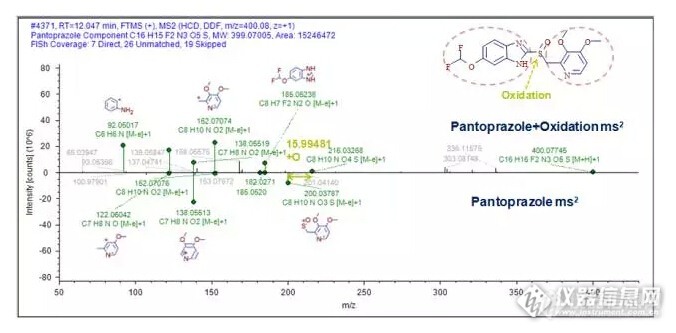
药物杂质是药物活性成分(原料药)或药物制剂中不希望存在的化学成分,会对用药的安全性和有效性带来隐患,因此杂质的检测是保证药物质量至关重要的部分,FDA、EMEA、PMDA、CFDA等各国药品监管部门制定了相应的指导原则对其进行严格管控。http://ng1.17img.cn/bbsfiles/images/2015/12/201512141737_577892_3005330_3.jpg 独有的四极杆静电场轨道阱Q Exactive™ Focus高分辨液质联用技术,凭其高灵敏度、高专属性和高准确性的分析能力,可对样品中药物杂质进行全面的信息采集。结合新一代的智能小分子化合物鉴定软件Compound Discoverer™,以高度灵活的自定义方式制定分析工作流程,对数据中的目标和非目标杂质进行提取、比对及鉴定,工作流程如下:http://ng1.17img.cn/bbsfiles/images/2015/12/201512141737_577893_3005330_3.jpg 通过软件对样品数据的分析和提取,在Compound Discoverer中可以直观、便捷的查看和筛选预期和未知的杂质分析结果,从结果界面中可获得不同条件下样品杂质的变化情况,获得所有杂质保留时间、一级质谱、同位素和二级质谱等丰富信息:http://ng1.17img.cn/bbsfiles/images/2015/12/201512141738_577894_3005330_3.jpg 在获得母药和杂质的一级和二级质谱信息后,软件将调用碎裂数据库(Fragmentation Library)快速的对泮托拉唑的碎片结构进行归属,该数据库几乎涵盖了所有已发表的文献,保证了碎片解析的准确性。在此研究结果之上,通过软件对杂质与母药二级质谱信息之间的比对,可进一步对杂质变化位点进行推测。在本例中,通过152、185等共有碎片和200、216等特征差异碎片的比对,推测出该杂质为泮托拉唑砜:http://ng1.17img.cn/bbsfiles/images/2015/12/201512141738_577895_3005330_3.jpg 基于新一代四极杆-静电场轨道阱质谱Q Exactive Focus和新一代小分子化合物分析软件Compound Discoverer,建立了药物杂质鉴定的新流程。无论是优质数据的有效获取,还是获取后对已知和未知杂质的分析鉴定,该工作流程都可以完美的实现。在本例中,共鉴定到泮托拉唑杂质15个,其中可能的降解杂质9个,可能的工艺杂质6个,为药物杂质的质量控制、安全性评估提供了富有价值的信息。(分享)