本人急需注射用头孢他啶(Ceftazidime)和注射用头孢米诺钠(Cefminox sodium)EP6.0的标准,复印件也行,谢谢!
作者:鲁瑞娟; 薛静; 曹晓云;天津市药品检验所; 中美天津史克制药有限公司; 天津市药品检验所 天津;摘要:目的:采用高效液相色谱法测定注射用头孢他啶的有关物质。方法:迪马钻石柱C18色谱柱(4.6 mm×150mm,5μm),流动相为三乙胺醋酸溶液-水-乙腈(12∶924∶70),用1 mol/L醋酸溶液调节pH值至5.0,检测波长为254 nm,以主成分自身对照外标法进行结果计算。结果:头孢他啶0~0.3μg范围内呈良好的线性关系,r=0.999 7,最低检出量为0.005μg。结论:本法检测注射用头孢他啶中有关物质的含量,简便、快速,结果准确。
【第十一届原创】HPLC法测定注射用头孢他啶聚合物含量1样品简介注射用头孢他啶,主要成份为头孢他啶,加适量碳酸钠做助溶剂。2.仪器设备、试剂与对照品2.1仪器设备:waters e2695高效液相色谱仪赛托利斯 CPA225D分析天平色谱柱:天津开发区色谱分析仪器有限公司葡聚糖G-10 凝胶色谱柱 400mm×14mm2.2试剂:硫酸铵(AR) 广州化学试剂厂磷酸二氢钠(AR) 广州化学试剂厂磷酸氢二钠(AR) 广州化学试剂厂碳酸钠(AR) 广州化学试剂厂2.3 对照品:头孢他啶(来源是齐鲁安替制药有限公司,批号为WST-C-8034EJ82JC,含量85.81%)蓝色葡聚糖2000(来源是Bei Jing Biodee Biotechnology Co.Ltd,批号为9004-54-01,含量100%)3.色谱条件流动相:以含3.5%硫酸铵的pH7.0的0.1mol/L磷酸盐缓冲液为流动相A,以水为流动相B,波长:254nm 流速:0.8ml/min 温度:室温洗脱方式:等度 进样体积:100ul4.样品制备4.1系统适用性溶液制备4.1.1 1.5mg/ml蓝色葡聚糖2000溶液制备:称取37.5mg蓝色葡聚糖2000至25ml容量瓶中,加水溶解并稀释至刻度,摇匀。4.1.2 系统适用性溶液制备:称取头孢他啶约0.2g 与碳酸钠20mg,置10ml量瓶中,用1.5mg/ml的蓝色葡聚糖2000溶液溶解并稀释至刻度,摇匀。4.2 对照溶液制备取头孢他啶对照品约12mg,精密称定,加水溶解并定量制成每1ml中约含0.1mg的溶液。4.3供试品溶液制备取本品,按标示量加水溶解并定量稀释制成每1ml中含20mg的溶液,照头孢他啶项下的方法测定,含头孢他啶聚合物的量不得过标示量的1.0%。4.4测定法4.4.1 量取100μl系统适用性溶液注入液相色谱仪,用流动相A进行测定,记录色谱图。高聚体的峰高与单体和高聚体之间的谷高比应大于1.5。4.4.2 量取1.5mg/ml蓝色葡聚糖2000溶液100μl注入液相色谱仪,分别以流动相A,B进行测定,记录色谱图。按蓝色葡聚糖2000峰计算理论板数均不低于500,拖尾因子均应小于2.0。在两种流动相系统中蓝色葡聚糖2000峰的保留时间比值应在0.93~1.07之间,对照溶液主峰与供试品溶液中聚合物峰与相应色谱系统中蓝色葡聚糖2000峰的保留时间的比值均应在0.93~1.07之间。4.4.3 另以流动相B为流动相,精密量取对照溶液100μl,连续进样5次,峰面积的相对标准偏差应不大于5.0%。5. 结果讨论系统适用性结果报告:流动相A中蓝色葡聚糖2000理论塔板数为1875,拖尾因子为0.93。流动相B中蓝色葡聚糖2000理论塔板数为1356,拖尾因子为0.79。在两种流动相中蓝色葡聚糖2000峰保留时间比值0.98,对照溶液主峰中聚合物峰与相应色谱系统中蓝色葡聚糖峰的保留时间比值为1.00,供试品溶液主峰中聚合物峰与相应色谱系统中蓝色葡聚糖峰的保留时间比值为1.00。系统适用性溶液以流动相A测定,记录图谱,高聚体的峰高与单体和高聚体之间的谷高比值为3.9。结果表明:葡聚糖G-10凝胶色谱柱能满足分析要求。[img]https://ng1.17img.cn/bbsfiles/images/2018/08/201808221931500102_136_3170710_3.jpeg[/img][img]https://ng1.17img.cn/bbsfiles/images/2018/08/201808221931501152_5601_3170710_3.jpeg[/img][img]https://ng1.17img.cn/bbsfiles/images/2018/08/201808221931503923_2007_3170710_3.jpeg[/img][img]https://ng1.17img.cn/bbsfiles/images/2018/08/201808221931506933_7008_3170710_3.jpeg[/img]
注射用头孢西丁钠生产工艺验证方案[~74687~]

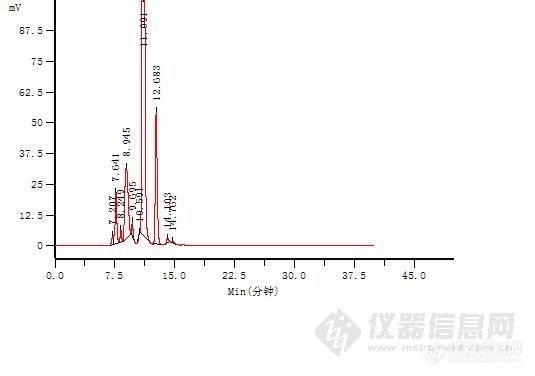
1、样品信息样品名称结构式分子式分子量CAS号贮藏条件注射用头孢拉定(Cefradine for Injection)http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647936_2891022_3.jpgC16H19N3O4S349.4038821-53-3密闭,在凉暗处保存2、色谱条件流动相:以含0.027mol/L辛磺酸钠的磷酸氢二钠溶液(磷酸调pH至8.0)-甲醇(75:25), 等度洗脱检测波长:206 nm柱温:30℃进样量:10μl流速:1.0 ml/min色谱柱:Durashell C18-AM,5μm,100Å,4.6×250mm3、测定结果3.1 样品测定结果样品测定图谱 http://ng1.17img.cn/bbsfiles/images/2014/06/201406251145_502961_801_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/06/201406251146_502962_801_3.png样品测定结果主峰名称保留时间(min)理论塔板数拖尾因子头孢拉定6.69595010.9393.2 不同批次色谱柱验证结果第1[/fon

1、样品信息样品名称结构式分子式分子量CAS号贮藏条件注射用头孢拉定(Cefradine for Injection)http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647829_2891022_3.jpgC16H19N3O4S349.4038821-53-3密闭,在凉暗处保存2、色谱条件流动相:以含0.027mol/L辛磺酸钠的磷酸氢二钠溶液(磷酸调pH至8.0)-甲醇(75:25), 等度洗脱检测波长:206 nm柱温:30℃进样量:10μl流速:1.0 ml/min色谱柱:Durashell C18-AM,5μm,100Å,4.6×250mm3、测定结果3.1 样品测定结果样品测定图谱 http://ng1.17img.cn/bbsfiles/images/2014/06/201406251145_502961_801_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/06/201406251146_502962_801_3.png样品测定结果主峰名称保留时间(min)理论塔板数拖尾因子头孢拉定6.69595010.9393.2 不同批次色谱柱验证结果
1、样品信息样品名称结构式分子式分子量CAS号贮藏条件注射用头孢拉定(Cefradine for Injection)http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647675_2891019_3.jpgC16H19N3O4S349.4038821-53-3密闭,在凉暗处保存2、色谱条件流动相:以含0.027mol/L辛磺酸钠的磷酸氢二钠溶液(磷酸调pH至8.0)-甲醇(75:25), 等度洗脱检测波长:206 nm柱温:30℃进样量:10μl流速:1.0 ml/min色谱柱:Durashell C18-AM,5μm,100Å,4.6×250mm3、测定结果3.1 样品测定结果样品测定图谱 http://ng1.17img.cn/bbsfiles/images/2014/06/201406251145_502961_801_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/06/201406251146_502962_801_3.png样品测定结果主峰名称保留时间(min)理论塔板数拖尾因子头孢拉定6.69595010.9393.2 不同批次色谱柱验证结果第1批次色谱柱测定图谱http://ng1.17img.cn/bbsfiles/images/2014/06/201406251146_502963_801
我在注射用头孢唑肟中N-甲基匹咯烷含量测定中发现,N-甲基匹咯烷峰前面有一未知峰干扰,降低柱温和流速不能增加分离度,相反增加流速、提高柱温对分离度有一定的帮助,但改善不明显,十分令我头疼。
用Sephadex G-10做头孢他啶,个别能分离,大多数不能分离,之所以这样,头孢他啶里有头孢他腚聚合物,但是我一直不没搞清楚这聚合物含量是多少呢,它分子结构是什么样呢?还有,我用的是G-10,10mmX300mm的柱子?望各位大虾多指教和发表言论![em09]
高效分子排阻色谱法测定注射用盐酸头孢替安高分子杂质头孢替安是杀菌性头孢菌素类广谱抗生素,头孢替安不但对革兰氏阳性菌有效,而且对革兰氏阴性菌。如流感嗜血杆菌,大肠杆菌、克雷白氏菌、奇异变形杆菌等的作用更强。对肠杆菌,枸橼酸杆菌、吲哚阳性变形杆菌等,也有抗菌作用头孢替安在肺中药物浓度较高,其它脏器和肌肉也有一定的浓度。临床应用于敏感菌所导致的感染,如肺炎、支气管炎、胆道感染、腹膜炎、尿路感染以及手术后或外伤引起的感染和败血症等。其基本结构同已上市的的头孢菌素类抗生素一样,头孢替安也会形成高分子聚合物,也会在临床使用中引发速发型过敏反应。对患者危害极大。已有的注射用盐酸头孢替安国家药品标准未将盐酸头孢替安高分子聚合物列为检定项目,国内的药学研究也未见头孢替安高分子聚合物的研究和报道。从临床用药安全性考虑,根据中国药典2010年版二部附录凝胶色谱原理。采用常用的葡聚糖凝胶G-10检测聚合物时由于头孢替安分子结构自身的原因,头孢替安不能完全缔合,因些我们采用高效分子排阻色谱法,以球状蛋白色谱用亲水硅胶为填充剂 TOSOH TSKgelG2000SW(7.5*300mm),测定注射用盐酸头孢替安高分子杂质1.仪器与试剂(1)仪器:岛津LC-10ATvp泵 岛津SPD-10AVP紫外可见光多波长检测器 浙大2010色谱数据工作站 色谱柱:TOSOH TSKgelG2000SW(7.5*300mm) (2)试剂: 乙腈 (色谱纯,天津市四友生物医学技术有限公司) 磷酸氢二钠(分析纯,北京化学试剂公司) 磷酸二氢钠(分析纯,北京化学试剂公司)双蒸水 (自制)2 色谱条件色谱柱:TOSOH TSKgelG2000SW(7.5*300mm)流动相:磷酸盐缓冲液(p H:6.8[/color
我按照药典规定的方法测定头孢他啶聚合物含量,可做了好多次也检测不出头孢他啶聚合物峰,这是怎么回事?望各位大虾指教!
那位同行做过头孢他啶的中间过程检测?主要是7-ACA残留检测和碘代物(7-AMCA)残留检测,碘代物的峰型怎么样?能否交流一下分析方法和分析结果?
头孢他啶[url=https://insevent.instrument.com.cn/t/Mp]气相[/url]残留溶剂有没有大神做过?有没有方法?
YBB 0005-2005 注射用无菌粉末用卤化丁基橡胶塞[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=36005]YBB 0005-2005 注射用无菌粉末用卤化丁基橡胶塞[/url]
【序号】:1【作者】:侯少瑞; 冯艳春; 胡昌勤;【题名】:近红外光谱法快速分析注射用头孢曲松钠及其水分的含量【期刊】:药物分析杂志 , 【年、卷、期】:2008年 06期 【全文链接】:http://epub.cnki.net/grid2008/detail.aspx?QueryID=211&CurRec=1【序号】:2【作者】:王学良; 胡昌勤; 杭太俊;【题名】:近红外漫反射光谱法测定注射用头孢他啶中头孢他啶、水分和助溶剂精氨酸的含量【期刊】:药物分析杂志 , 【年、卷、期】:2010年 09期 【全文链接】:http://epub.cnki.net/grid2008/detail.aspx?QueryID=74&CurRec=1谢谢 ~~
请问现在有注射用无菌粉末用卤化丁基橡胶塞(冻干用)了吗?现在我们用的标准是“YBB00052005 注射用无菌粉末用卤化丁基橡胶塞”,但里面是说明了此标准不适用于冻干橡胶塞,不过到现在都还没有找到冻干橡胶塞的标准。我查了下,在07年7月的时候有胶塞行业标准座谈会,说是“由中国医药包装协会牵头,上海食品药品包装材料测试所提供技术支持,部分胶塞厂家协助完成药用丁基橡胶塞协会标准的制订。标准制定分为产品标准和单项标准二部分:1、 产品标准包括:小容量注射液标准、冻干胶塞标准;2、 单项标准包括:外观及规格尺寸标准(含注射剂用丁基胶塞、输液用丁基胶塞、冻干用丁基胶塞、小容量注射液丁基胶塞);胶塞表面硅油含量均匀度标准;免洗胶塞标准等”那么现在标准出台了吗?座谈会见http://www.cnppa.org/index_newsInfo.jsp?id=264
请问那位有《YBB00042005注射用卤化丁基橡胶塞》的标准?谢谢![em0815][em0815]
药友制药紧急召回炎琥宁 10余名婴幼儿用后休克 中国消费者报http://i1.sinaimg.cn/cj/consume/puguangtai/20120914/1347578725_oozdma.jpg 图1为重庆药友制药有限公司生产的注射用炎琥宁。洪敬谱/摄 http://i2.sinaimg.cn/cj/consume/puguangtai/20120914/1347578725_aZmg7E.jpg 图2为幼儿正在医院抢救的情景。资料图片 本报合肥讯(记者洪敬谱)9月初,安徽省合肥市10余名婴幼儿因为感冒发烧在安徽医科大学第一附属医院(以下简称安医大第一医院)治疗后,普遍出现休克状况。经医院积极救治,这些孩子目前病情稳定。9月11日中午,合肥市药品不良反应监测中心致电本报记者称,目前正在对这些婴幼儿使用的注射用炎琥宁进行检测,会及时向本报公布检测结果。目前,重庆药友制药有限责任公司已将该省内使用的生产批号为12102863、规格为80mg的注射用炎琥宁全部召回。 9月9日晚上,合肥市民刁先生等10多位婴幼儿家长向本报记者反映称,自己的孩子在安医大第一医院看病输液,之后出现休克情况,家长们怀疑使用的药品存在安全问题。
谁做过注射用左卡呢汀?我们做有关物质时在主峰后面约2分多的位置上经常会有一个小峰,有它在有关物质就不合格。这个小峰时而出现,时而不出现。曾经做过原料、辅料的对比。辅料没有峰,同样的检测条件,原料也有一个类似的峰,但原料检验是合格的(用原料的质量标准检验)。恳请高人帮忙指导!
[center]FDA批准10年来首个新型静脉注射用抗高血压药[/center]The Medicines公司8月4日宣布,美国FDA已批准其静脉注射用制剂丁酸氯维地平(clevidipine butyrate,Cleviprex)注射用乳剂在不适用或不希望使用口服制剂的情况下用于高血压的治疗。本品是10年来美国FDA批准的首个新型静脉注射用抗高血压药。 本品作为1种新型静脉注射用抗高血压药,代表了当前高血压治疗中的一大进步,其可以在危重病护理中快速、精确地控制血压。来自急诊室、手术室和重症监护室的综合资料显示,本品将成为医生控制患者血压时的重要选择手段。 本品可迅速起效,可用于精确控制血压。与现有静脉注射用抗高血压药通过肾脏和(或)肝脏代谢不同,本品在血液和组织中代谢,不在体内产生蓄积。信息来源:中国医药123网

《中国药典》2015年版四部P491"甘油(供注射用)"有如下图片内容。我们生产的注射液使用甘油(供注射用)作为辅料,注射液为最终灭菌产品,请问作为辅料的甘油,是否还需要检验无菌?我的理解是,由于产品是最终灭菌产品,作为辅料,控制微生物限度和细菌内毒素是必要的,因此不需要无菌检验,但是,也有不同意见,说因为生产的注射液属于无菌制剂,且由于其生产过程无除菌工艺,因此,图中的“无菌(供无除菌工艺的无菌制剂用)”这一项应该进行检测。如此,我认为还是矛盾,如果无菌都检测,微生物限度还有必要测吗?另外,最终灭菌的产品,有必要对其辅料检测无菌吗?谢谢!
注射用无菌粉末需要测定渗透压吗?使用时是溶解在0.9%氯化钠或5%葡萄糖中,静脉滴注。 我是这么想的:药品溶解在0.9%氯化钠或5%葡萄糖,其渗透压应该是略微变大的吧,这样还有必要做这个实验吗? 我看了下2010药典,渗透压的标准是多少啊?注射用无菌粉末都没有表明渗透压范围啊?但是我找一些注射液的标准里面就有具体的渗透压范围。
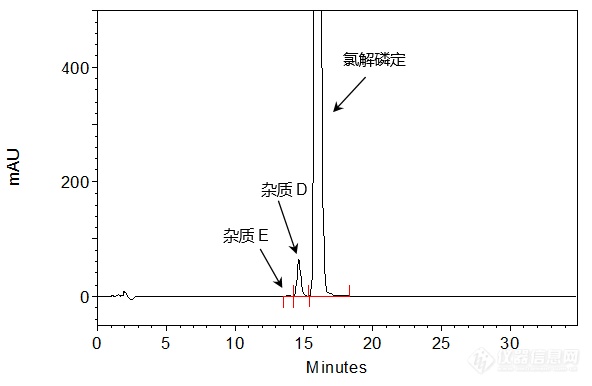
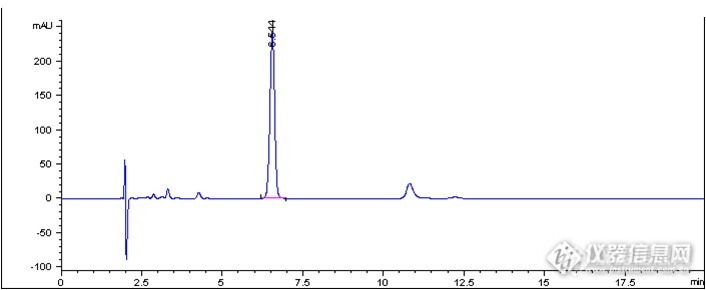
[align=center][b]注射用氯解磷定的有关物质分析[/b][/align]氯解磷定注射液是有机磷中毒解毒药,对急性有机磷杀虫剂抑制的胆碱酯酶活力有不同程度的复活作用,用于解救多种有机磷酸酯类杀虫剂的中毒。[align=center][img=,105,92]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656260751_676_2222981_3.gif!w105x92.jpg[/img][/align][align=center]氯解磷定[/align][align=center]2-Pyridinealdoxime methochloride[/align][align=center]C7H9ClN2OM.W.: 172.6[/align][align=center][/align]客户提供了注射用氯解磷定样品,希望本实验室依据客户指定色谱条件筛选合适的C[sub]18[/sub]色谱柱,以实现氯解磷定注射液样品的有关物质分析,满足氯解磷定主峰同相邻杂质峰以及各杂质峰间的基线分离要求。首先,尝试使用[b][color=red]中等极性的普适型色谱柱——[/color][color=red]CAPCELL PAK C[sub]18[/sub] MGII[/color][/b],依据客户所提供的色谱条件(流动相含十二烷基硫酸钠和二乙胺)对氯解磷定注射液样品进行分析。如图1,[color=#2E74B5]氯解磷定主峰保留时间为[/color][b][color=#2E74B5]16 min[/color][/b][color=#2E74B5],主峰与峰前杂质[/color][color=#2E74B5]D[/color][color=#2E74B5]之间分离度为[/color][b][color=#2E74B5]2.33[/color][/b][color=#2E74B5],杂质[/color][color=#2E74B5]D[/color][color=#2E74B5]与杂质[/color][color=#2E74B5]E[/color][color=#2E74B5]之间分离度为[/color][b][color=#2E74B5]1.64[/color][/b][color=#2E74B5],均能得到良好分离结果。通过对相对保留时间进行计算,所得结果满足客户[/color][color=#2E74B5]SOP[/color][color=#2E74B5]要求。[/color][color=#2E74B5][/color][align=center][img=,592,386]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656248670_1537_2222981_3.png!w592x386.jpg[/img][/align][align=center]图1 CAPCELL PAK C[sub]18[/sub] MGII分析所得色谱图[/align][align=center][/align][align=center][/align][align=center][/align][align=center][img=,587,389]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656253460_3177_2222981_3.png!w587x389.jpg[/img][/align][align=center]图2 CAPCELL PAK C[sub]18[/sub] MGII分析所得色谱图放大图[/align]注:峰上标数字由下至上依次为分离度、理论塔板数与保留时间。[img=,424,282]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656270060_717_2222981_3.png!w424x282.jpg[/img]就上述实验结果与客户沟通,客户反映希望使主峰的保留时间在20min左右。为满足客户需求,我们在上述实验条件基础上,将柱温由初始条件的40°C降至30°C进行分析,发现主峰保留时间为17 min左右;为进一步增强其保留,我们将色谱柱更换为[b][color=red]极性更高的[/color][color=red]CAPCELL PAK C[sub]18[/sub] AQ[/color][color=red]色谱柱[/color][/b],如图3,[color=#2E74B5]氯解磷定主峰保留明显增强,保留时间约[/color][b][color=#2E74B5]20 min[/color][/b][color=#2E74B5],主峰与峰前杂质[/color][color=#2E74B5]D[/color][color=#2E74B5]之间分离度为[/color][b][color=#2E74B5]2.88[/color][/b][color=#2E74B5],杂质[/color][color=#2E74B5]D[/color][color=#2E74B5]与杂质[/color][color=#2E74B5]E[/color][color=#2E74B5]之间分离度为[/color][b][color=#2E74B5]2.72[/color][/b][color=#2E74B5],能够得到良好的保留与分离结果。[/color][align=center][img=,599,388]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656255480_6169_2222981_3.png!w599x388.jpg[/img][/align][align=center]图3 CAPCELL PAK C[sub]18[/sub] AQ分析所得色谱图[/align][align=center][img=,597,361]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656258121_3421_2222981_3.png!w597x361.jpg[/img][/align][align=center]图4 CAPCELL PAK C[sub]18[/sub] AQ分析所得色谱图放大图[/align]注:峰上标数字由下至上依次为分离度、理论塔板数与保留时间。[img=,499,322]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656269602_541_2222981_3.png!w499x322.jpg[/img]综上实验结果,使用大曹色谱CAPCELL PAK系列色谱柱中的第一选择——中等极性的普适型色谱柱CAPCELL PAK C18 MGII和能在纯水条件下稳定使用的高极性色谱柱CAPCELL PAK C18 AQ进行分析,均能实现注射用氯解磷定的有关物质分析,并能满足氯解磷定主峰同其相邻杂质及各杂质峰间的基线分离要求,客户可根据实际需求进行选择。[align=right]三耀精细化工品销售(中国)有限公司[/align][align=right]技术开发部[/align][align=right]地址:北京经济技术开发区宏达南路5号[/align][align=right]宏达利德工业园1栋418室[/align][align=right]邮编:100176[/align]
用了很久的超纯水了,换了个单位,发现在配流动性时用注射用水,电导率和cot都合格,不知是否可以,个人认为还是用超纯水好,大家说说自己的看法
有关注射用水的条款讨论2007版GMP认证检查评定标准第*3402内容如下:注射用水的制备、储存和分配应能防止微生物的滋生和污染,储罐的通气口应安装不脱落纤维的疏水性除菌滤器,储存应采用80℃以上保温、65℃以上保温循环或4℃以下保温循环。生物制品生产用注射用水应在制备后6小时内使用;制备后4小时内灭菌72小时内使用。有人认为生物制品生产用注射用水只要满足:制备后6小时内使用;制备后4小时内灭菌72小时内使用。就可以了我认为生物制品生产用注射用水既要满足:储存应采用80℃以上保温、65℃以上保温循环或4℃以下保温循环;又要满足:在制备后6小时内使用;制备后4小时内灭菌72小时内使用。大家怎样理解啊?请参与!
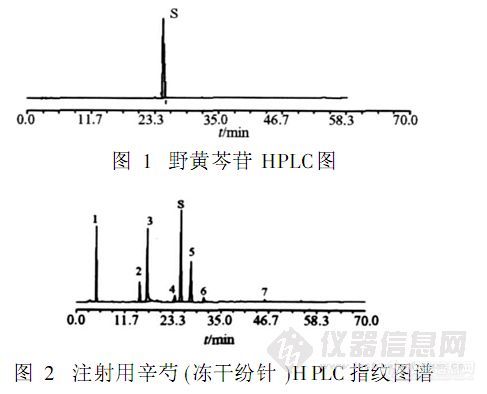
【作者中文名】苏红; 王爱民; 王永林; 兰燕宇; 何迅; 李勇军;【作者英文名】SU Hong; WANG Ai-min; WANG Yong-lin; LAN Yan-yu; HE Xun; LI Yong-jun(School of Pharmacy; Guiyang Medical College; Guiyang 550004; China);【作者单位】贵阳医学院药学院; 贵阳医学院药学院 贵州贵阳; 贵州贵阳;【摘要】目的:采用RP-HPLC建立注射用辛芍(冻干粉针)的指纹图谱测定方法。方法:采用Diamonsil C18色谱柱,80%乙腈-0.1%磷酸溶液为流动相进行梯度洗脱,流速1.0 mL.min-1,柱温40℃,检测波长为230 nm。结果:在相同色谱条件下获得药材、中间体和制剂的各色谱峰分离较好,建立了注射用辛芍的HPLC对照指纹图谱,标注了制剂中的8个共有指纹峰,制剂与药材、中间体的指纹图谱有良好的相关性,10批样品相似度大于0.97,达到指纹图谱的技术要求。结论:该方法准确、重复性好,可作为注射用辛芍(冻干粉针)质量控制的重要依据之一。http://ng1.17img.cn/bbsfiles/images/2012/08/201208131742_383598_2379123_3.jpg
请问有谁知道注射用无菌粉末怎样测定渗透压摩尔浓度?谢谢
最近做项目时接触到某注射用冻干粉针的组分问题,想请教大家一下。在做液相组分时,原料的某一个组分的检测结果是89.5%,而对其生产的注射用冻干粉针进行液相组分检测时,该组分的含量是87.7%。这个过程中原料和成品的组分含量是不是不应该相差这么大?会是什么原因导致有这样的差距呢?原料和成品的组分检测是由不同人在不同仪器不同色谱柱上完成的。请教大家~多多指教!
我现在有个产品“注射用左卡尼汀”色谱条件:反相C18,流动相:庚烷磺酸钠0.6g,水500ml,甲醇500ml,用1mol/L HCL调PH至2.3。检测波长:225nm现在想求各位大侠,该如何选择色谱柱?选择什么样的色谱柱?
如果非正常连续生产,车间注射用水不是采取保温或者循环处理的,只是在生产前进行一次各取样口的全检,然后如果结果合格,车间认为该系统注射用水无问题,如次日无生产安排,则放掉制好的注射用水,等待次日重新制水,如此是否可行?个人认为检验合格的注射用水是针对于当时制备的,如新制水应再进行取样检验,但是,注射用水也有其检验周期,我们定的是1周,所以,似乎也说的过去,不知大家是什么情况呢?欢迎讨论,谢谢![em61]