大洋网3月7日报道 根据卫生部通知要求,黑龙江省卫生厅3月6日晚连夜发出内部明传电报,要求全省各级各类医疗机构立即停止使用吉林一心制药股份有限公司生产的注射用泮托拉唑钠。据悉,3月6日卫生部收到国家食品药品监督管理局通报,经吉林省食品药品监食管理局抽检,吉林一心制药股份有限公司生产的注射用泮托拉唑钠(批号为0809022、0810011、0810012、0810021、0810022)可见异物,检查不合格。国家食品药品监督管理局已于 3 月 6 日下发通知要求停止销售和使用该药品。黑龙江省卫生厅接到卫生部办公厅紧急通知后,连夜发出内部明传电报,要求各级各类医疗机构立即停止使用并封存该批号的药品,并做好相关记录,保证信息完整,可追溯。一经发现与该批药品有关的不良事件,要全力做好医疗救治工作,有效保护好患者的生命安全,并按照规定立即报告同级卫生行政部门和药监部门。目前,黑龙江省医疗机构药品不良反应监测系统尚未接到该药品发生不良事件的报告。(来源:中国广播网)

10,抽取5个版友);中奖名单:大川之子,纵横四海(注册ID:chuangu120)牛一牛(注册ID:v2700892)吕梁山(注册ID:shih20j07)莫名其妙(注册ID:moyueqiu)翠湖园(注册ID:hhx050)http://ng1.17img.cn/bbsfiles/images/2017/03/201703011546_01_1610895_3.jpghttp://ng1.17img.cn/bbsfiles/images/2017/03/201703011546_02_1610895_3.jpg【注意事项】同样的答案,每人只能发一次PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。=======================================================================注射用泮托拉唑钠有关物质的测定方法:HPLC基质:药品应用编号:102964化合物:泮托拉唑钠固定相:Platisil ODS色谱柱/前处理小柱:Platisil ODS 5u 250 x 4.6 mm样品前处理:有关物质: 取本品,加溶剂(0.001 mol/L氢氧化钠溶液-乙腈=1:1)溶解并制成每1 ml中含泮托拉唑0.4 mg的溶液,做为供试品溶液;精密量取1 ml,置100 ml量瓶中,用上述溶液稀释至客户,摇匀,做为对照溶液。色谱条件:色谱柱:Platisil C18,250×4.6 mm,5 μm (Cat#:99503) 流动相:流动相A:0.01 mol/L磷酸氢二钾溶液(用磷酸调pH至7.0) 流动相B:乙腈 T A 0 90 30 60 45 15 流速: 1.0 mL/min 柱温: 30 ℃ 检测器:UV 289 nm 进样量:20 μL文章出处:天津迪马实验室关键字:泮托拉唑钠;有关物质;铂金;Platisil C18;HPLC谱图:http://www.dikma.com.cn/Public/Uploads/images/11(21).PNGhttp://www.dikma.com.cn/Public/Uploads/images/22(1).PNGhttp://www.dikma.com.cn/Public/Uploads/images/33.PNG

月旭Welchrom® C18测定注射用泮托拉唑钠有关物质通用名注射用泮托拉唑钠 英文名PANTOPRAZOLESODIUMFORINJECTION 拼音名ZHUSHEYONGPANTUOLAZUONA 药品类别抗酸药及抗溃疡病药泮托拉唑钠,Pantoprazole sodium,通常为一水物或倍半水物。 中文化学名:5-二氟甲氧基-2-亚硫酰基-1H-苯并咪唑钠盐 英文化学名:5-(Difluoromethoxy)-2-(((3,4-dimethoxy-2-pyridinyl)methyl) sulfinyl)-1H-benzimidazole sodium分子式:C16H14F2N3NaO4S 分子量:405.36 结构式:http://ng1.17img.cn/bbsfiles/images/2014/04/201404292140_497803_1621890_3.png色谱柱信息:Welchrom 4.6*250mm Pn:00310-02043Sn:w13211565Ln:w1811.06色谱条件: 参照中国药典2010年版二部504页收载内容:取本品,加溶剂〔0. 001mol/L氢氧化钠溶液-乙腈(1:1)〕溶解并稀释制成每lml中约含0.4mg的溶液,作为供试品溶液;精密量取lml,置100ml量瓶中,用上述溶剂稀释至刻度,摇匀,作为对照溶液。照高效液相色谱法(附录V D)测定。用十八烷基硅烷键合硅胶为填充剂;流动相A为0.01mol/L磷酸氢二钾溶液(用磷酸调节pH值至7.0),流动相B为乙腈,按下表进行梯度洗脱;检测波长为289nm;柱温为40°C。理论板数按泮托拉唑峰计算不低于2500。取对照溶液20μl注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%,再精密量取供试品溶液与对照溶液各20μl,分别注入液相色谱仪,记录色谱图。供试品溶液的色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积的0 . 3倍(0. 3%);各杂质峰面积的和不得大于对照溶液主峰面积的0.8倍(供注射用)(8%)或不得大于对照溶液主峰面积(供口服用)(1. 0%)。供试品溶液色谱图中任何小于对照溶液主峰面积0.05倍的峰可忽略不计。时间(分钟)流动相A(%)流动相B(%)09010306040451585本品参照中国药典方法,进行了专属性试验,以下简要列出高温、强光、强酸、强碱、氧化条件下破坏样品的杂质情况,其摸索破坏条件就不赘述了,大家都是个中高手哈。本品主峰保留时间约为24.4分钟,相关色谱图见下图:典型3D色谱图http://ng1.17img.cn/bbsfiles/images/2014/04/201404292152_497805_1621890_3.png从3D图可以看出最大吸收波长。中国药典选择289nm波长。下图为各破坏条件下色谱图:1.未破坏色谱图:http://ng1.17img.cn/bbsfiles/images/2014/04/201404292321_497808_1621890_3.png2.高温破坏:http://ng1.17img.cn/bbsfiles/images/2014/04/201404292323_497809_1621890_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/04/201404292327_497810_1621890_3.png3.强光破坏:http://ng1.17img.cn/bbsfiles/images/2014/04/201404292328_497811_1621890_3.png4.强酸破坏:http://ng1.17img.cn/bbsfiles/images/2014/04/201404292329_497812_1621890_3.png5.强碱破坏:http://ng1.17img.cn/bbsfiles/images/2014/04/201404292330_497813_1621890_3.png6.氧化破坏:http://ng1.17img.cn/bbsfiles/images/2014/04/201404292332_497815_1621890_3.png各个破坏条件关心的是杂质谱:主要情况如下:http://ng1.17img.cn/bbsfiles/images/2014/04/201404292341_497816_1621890_3.png各个破坏条件的物料平衡在此忽略。因为大家也知道,纯粹追求物料平衡也是瞎扯淡。在此就不必细说了。综上情况,用这款色谱柱还是能达到目的的。题外话:使用月薪的色谱柱,至少有两个好处:1.可以试用,减少开支;2.在追求利润最大化的世界,有个公司还是坚持用户至上的原则,还是不容易,我们应该支持的。
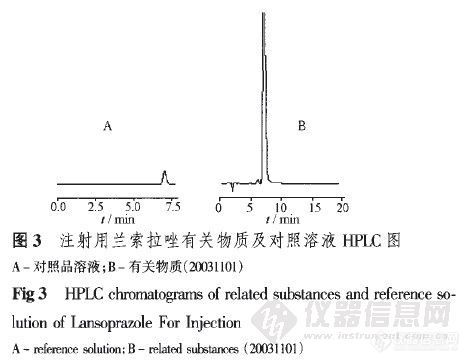
HPLC测定注射用兰索拉唑中兰索拉唑的含量和有关物质 杨艳,谢俊霞,李冰,孙英华,方金玲,刘艳,何仲贵”(沈阳药科大学药学院,沈阳110016)摘要:目的采用高效液相色谱法建立注射用兰索拉唑有关物质检查及其含量测定方法。方法Diamonsil—c18柱(4.6 l_mm×200 mm,5um),以甲醇.水一三乙胺.磷酸(640:360:5:1.5,pH为7.3)为流动相,检测波长为284Ⅲn。结果制剂中辅料对主药测定无干扰,兰索拉唑与有关物质完全分离。在10.0~400.0 mg·L一内峰面积与浓度呈良好的线性关系。精密度(RsD=0.13%)良好。平均回收率为99.6%。结论 本方法简便,迅速,准确,专属性强。关键词:高效液相色谱法;注射用兰索拉唑;含量测定;有关物质http://ng1.17img.cn/bbsfiles/images/2012/07/201207241917_379474_2355529_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/07/201207241917_379475_2355529_3.jpg
本人急需注射用头孢他啶(Ceftazidime)和注射用头孢米诺钠(Cefminox sodium)EP6.0的标准,复印件也行,谢谢!

1、样品信息样品名称结构式分子式分子量CAS号贮藏条件注射用头孢拉定(Cefradine for Injection)http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647936_2891022_3.jpgC16H19N3O4S349.4038821-53-3密闭,在凉暗处保存2、色谱条件流动相:以含0.027mol/L辛磺酸钠的磷酸氢二钠溶液(磷酸调pH至8.0)-甲醇(75:25), 等度洗脱检测波长:206 nm柱温:30℃进样量:10μl流速:1.0 ml/min色谱柱:Durashell C18-AM,5μm,100Å,4.6×250mm3、测定结果3.1 样品测定结果样品测定图谱 http://ng1.17img.cn/bbsfiles/images/2014/06/201406251145_502961_801_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/06/201406251146_502962_801_3.png样品测定结果主峰名称保留时间(min)理论塔板数拖尾因子头孢拉定6.69595010.9393.2 不同批次色谱柱验证结果第1[/fon

1、样品信息样品名称结构式分子式分子量CAS号贮藏条件注射用头孢拉定(Cefradine for Injection)http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647829_2891022_3.jpgC16H19N3O4S349.4038821-53-3密闭,在凉暗处保存2、色谱条件流动相:以含0.027mol/L辛磺酸钠的磷酸氢二钠溶液(磷酸调pH至8.0)-甲醇(75:25), 等度洗脱检测波长:206 nm柱温:30℃进样量:10μl流速:1.0 ml/min色谱柱:Durashell C18-AM,5μm,100Å,4.6×250mm3、测定结果3.1 样品测定结果样品测定图谱 http://ng1.17img.cn/bbsfiles/images/2014/06/201406251145_502961_801_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/06/201406251146_502962_801_3.png样品测定结果主峰名称保留时间(min)理论塔板数拖尾因子头孢拉定6.69595010.9393.2 不同批次色谱柱验证结果
注射用头孢西丁钠生产工艺验证方案[~74687~]
1、样品信息样品名称结构式分子式分子量CAS号贮藏条件注射用头孢拉定(Cefradine for Injection)http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647675_2891019_3.jpgC16H19N3O4S349.4038821-53-3密闭,在凉暗处保存2、色谱条件流动相:以含0.027mol/L辛磺酸钠的磷酸氢二钠溶液(磷酸调pH至8.0)-甲醇(75:25), 等度洗脱检测波长:206 nm柱温:30℃进样量:10μl流速:1.0 ml/min色谱柱:Durashell C18-AM,5μm,100Å,4.6×250mm3、测定结果3.1 样品测定结果样品测定图谱 http://ng1.17img.cn/bbsfiles/images/2014/06/201406251145_502961_801_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/06/201406251146_502962_801_3.png样品测定结果主峰名称保留时间(min)理论塔板数拖尾因子头孢拉定6.69595010.9393.2 不同批次色谱柱验证结果第1批次色谱柱测定图谱http://ng1.17img.cn/bbsfiles/images/2014/06/201406251146_502963_801
谁做过注射用左卡呢汀?我们做有关物质时在主峰后面约2分多的位置上经常会有一个小峰,有它在有关物质就不合格。这个小峰时而出现,时而不出现。曾经做过原料、辅料的对比。辅料没有峰,同样的检测条件,原料也有一个类似的峰,但原料检验是合格的(用原料的质量标准检验)。恳请高人帮忙指导!
我现在有个产品“注射用左卡尼汀”色谱条件:反相C18,流动相:庚烷磺酸钠0.6g,水500ml,甲醇500ml,用1mol/L HCL调PH至2.3。检测波长:225nm现在想求各位大侠,该如何选择色谱柱?选择什么样的色谱柱?
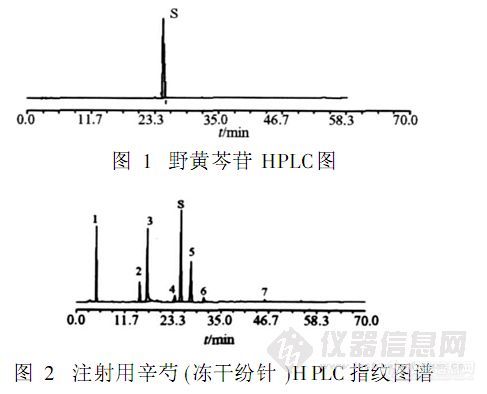
【作者中文名】苏红; 王爱民; 王永林; 兰燕宇; 何迅; 李勇军;【作者英文名】SU Hong; WANG Ai-min; WANG Yong-lin; LAN Yan-yu; HE Xun; LI Yong-jun(School of Pharmacy; Guiyang Medical College; Guiyang 550004; China);【作者单位】贵阳医学院药学院; 贵阳医学院药学院 贵州贵阳; 贵州贵阳;【摘要】目的:采用RP-HPLC建立注射用辛芍(冻干粉针)的指纹图谱测定方法。方法:采用Diamonsil C18色谱柱,80%乙腈-0.1%磷酸溶液为流动相进行梯度洗脱,流速1.0 mL.min-1,柱温40℃,检测波长为230 nm。结果:在相同色谱条件下获得药材、中间体和制剂的各色谱峰分离较好,建立了注射用辛芍的HPLC对照指纹图谱,标注了制剂中的8个共有指纹峰,制剂与药材、中间体的指纹图谱有良好的相关性,10批样品相似度大于0.97,达到指纹图谱的技术要求。结论:该方法准确、重复性好,可作为注射用辛芍(冻干粉针)质量控制的重要依据之一。http://ng1.17img.cn/bbsfiles/images/2012/08/201208131742_383598_2379123_3.jpg
http://simg.instrument.com.cn/bbs/images/default/emyc1007.gif这是很久以前做的一个方法,拿来参加原创大赛,支持液相色谱版。由于涉及公司产品,文中部分信息隐去,请见谅。--------------------------------------------------------------------------------------------------HPLC测定注射用帕米膦酸二钠中的亚磷酸含量 注射用帕米膦酸二钠的原料帕米膦酸二钠结构稳定,对光、热等均不敏感,正常的储存条件下不易产生降解产物。亚磷酸作为帕米膦酸二钠的合成原料,属于制剂中的有关物质。我们参考相关资料,对注射用帕米膦酸二钠中的亚磷酸含量测定进行了研究。测定法:“取本品,加水制成每1ml中含帕米膦酸二钠10mg的溶液,摇匀,滤过,作为供试品溶液;另取亚磷酸适量,精密称定,加水制成每1ml中约含0.05mg的溶液,作为对照品溶液。照高效液相色谱法测定,用阴离子色谱柱;以**溶液为流动相,示差检测器检测;柱温为35℃,流速为1.0ml/min。取对照品溶液和供试品溶液各50μl注入液相色谱仪,供试品溶液的色谱图中如出现与对照品溶液相应的杂质峰,其峰面积不得大于对照品溶液主峰面积(0.5%)”仪器与试药:LC-10A液相色谱仪配示差检测器,亚磷酸对照品购自SIGMA。线性:取亚磷酸对照品0.1020g,加水溶解并稀释至100ml,分别精密量取1,2,3,4,5ml,置100ml量瓶中,加水至刻度,摇匀,制备成约含亚磷酸10,20,30,40,50mg/L的标准曲线序列,依法测定:浓度mg/L峰面积10.20799120.401559730.60[font=Times
做注射用粉针剂装量时,去除标签有什么好方法?大多标签都贴得很严,尤其是胶很粘,不知各位有什么好办法去掉。
有关注射用水的条款讨论2007版GMP认证检查评定标准第*3402内容如下:注射用水的制备、储存和分配应能防止微生物的滋生和污染,储罐的通气口应安装不脱落纤维的疏水性除菌滤器,储存应采用80℃以上保温、65℃以上保温循环或4℃以下保温循环。生物制品生产用注射用水应在制备后6小时内使用;制备后4小时内灭菌72小时内使用。有人认为生物制品生产用注射用水只要满足:制备后6小时内使用;制备后4小时内灭菌72小时内使用。就可以了我认为生物制品生产用注射用水既要满足:储存应采用80℃以上保温、65℃以上保温循环或4℃以下保温循环;又要满足:在制备后6小时内使用;制备后4小时内灭菌72小时内使用。大家怎样理解啊?请参与!
我在注射用头孢唑肟中N-甲基匹咯烷含量测定中发现,N-甲基匹咯烷峰前面有一未知峰干扰,降低柱温和流速不能增加分离度,相反增加流速、提高柱温对分离度有一定的帮助,但改善不明显,十分令我头疼。

《中国药典》2015年版四部P491"甘油(供注射用)"有如下图片内容。我们生产的注射液使用甘油(供注射用)作为辅料,注射液为最终灭菌产品,请问作为辅料的甘油,是否还需要检验无菌?我的理解是,由于产品是最终灭菌产品,作为辅料,控制微生物限度和细菌内毒素是必要的,因此不需要无菌检验,但是,也有不同意见,说因为生产的注射液属于无菌制剂,且由于其生产过程无除菌工艺,因此,图中的“无菌(供无除菌工艺的无菌制剂用)”这一项应该进行检测。如此,我认为还是矛盾,如果无菌都检测,微生物限度还有必要测吗?另外,最终灭菌的产品,有必要对其辅料检测无菌吗?谢谢!
日前,国家食品药品监督管理局发布了第47期《药品不良反应信息通报》,提示警惕超剂量使用注射用阿莫西林钠可能增加肾损害风险。 阿莫西林为青霉素类抗生素,通过抑制细菌细胞壁合成,使细菌膨胀、裂解而发挥杀菌作用。注射用阿莫西林钠适用于敏感菌所致各种感染中病情较重需要住院治疗或不能口服的患者。 国家药品不良反应监测中心病例报告数据库数据显示,注射用阿莫西林钠严重病例报告中肾损害问题比较突出,主要表现为血尿、蛋白尿、急性肾功能衰竭、间质性肾炎等。在注射用阿莫西林钠肾损害的病例中,90%以上的病例属于超剂量用药。 国家食品药品监督管理局建议: 一、医务人员应严格按照药品说明书规定的用法用量给药,用药过程应该加强肾功能监测,避免单次剂量过大、浓度过高、滴速过快或长时间使用;对肾功能障碍患者、老年患者应注意调整用药剂量,对于未成年患者应按体重给药,并应告知监护人风险,加强随访和监测。 二、药品生产企业应对说明书相关内容进行修订,完善风险提示信息;加大药品不良反应监测力度,加强临床合理用药的宣传,确保产品的安全性信息及时传达给患者和医生;制定并实施有效的风险管理计划,保证用药安全。
最近做项目时接触到某注射用冻干粉针的组分问题,想请教大家一下。在做液相组分时,原料的某一个组分的检测结果是89.5%,而对其生产的注射用冻干粉针进行液相组分检测时,该组分的含量是87.7%。这个过程中原料和成品的组分含量是不是不应该相差这么大?会是什么原因导致有这样的差距呢?原料和成品的组分检测是由不同人在不同仪器不同色谱柱上完成的。请教大家~多多指教!
题目:注射用载雌二醇m PEG-PLA缓释微球的制备及体内外释放研究作者:李静期刊:山东大学,2012链接:http://www.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&QueryID=0&CurRec=1&dbname=CMFDTEMP&filename=1012462466.nh&urlid=&yx=
注射用无菌粉末需要测定渗透压吗?使用时是溶解在0.9%氯化钠或5%葡萄糖中,静脉滴注。 我是这么想的:药品溶解在0.9%氯化钠或5%葡萄糖,其渗透压应该是略微变大的吧,这样还有必要做这个实验吗? 我看了下2010药典,渗透压的标准是多少啊?注射用无菌粉末都没有表明渗透压范围啊?但是我找一些注射液的标准里面就有具体的渗透压范围。
药友制药紧急召回炎琥宁 10余名婴幼儿用后休克 中国消费者报http://i1.sinaimg.cn/cj/consume/puguangtai/20120914/1347578725_oozdma.jpg 图1为重庆药友制药有限公司生产的注射用炎琥宁。洪敬谱/摄 http://i2.sinaimg.cn/cj/consume/puguangtai/20120914/1347578725_aZmg7E.jpg 图2为幼儿正在医院抢救的情景。资料图片 本报合肥讯(记者洪敬谱)9月初,安徽省合肥市10余名婴幼儿因为感冒发烧在安徽医科大学第一附属医院(以下简称安医大第一医院)治疗后,普遍出现休克状况。经医院积极救治,这些孩子目前病情稳定。9月11日中午,合肥市药品不良反应监测中心致电本报记者称,目前正在对这些婴幼儿使用的注射用炎琥宁进行检测,会及时向本报公布检测结果。目前,重庆药友制药有限责任公司已将该省内使用的生产批号为12102863、规格为80mg的注射用炎琥宁全部召回。 9月9日晚上,合肥市民刁先生等10多位婴幼儿家长向本报记者反映称,自己的孩子在安医大第一医院看病输液,之后出现休克情况,家长们怀疑使用的药品存在安全问题。
用了很久的超纯水了,换了个单位,发现在配流动性时用注射用水,电导率和cot都合格,不知是否可以,个人认为还是用超纯水好,大家说说自己的看法
[center]FDA批准10年来首个新型静脉注射用抗高血压药[/center]The Medicines公司8月4日宣布,美国FDA已批准其静脉注射用制剂丁酸氯维地平(clevidipine butyrate,Cleviprex)注射用乳剂在不适用或不希望使用口服制剂的情况下用于高血压的治疗。本品是10年来美国FDA批准的首个新型静脉注射用抗高血压药。 本品作为1种新型静脉注射用抗高血压药,代表了当前高血压治疗中的一大进步,其可以在危重病护理中快速、精确地控制血压。来自急诊室、手术室和重症监护室的综合资料显示,本品将成为医生控制患者血压时的重要选择手段。 本品可迅速起效,可用于精确控制血压。与现有静脉注射用抗高血压药通过肾脏和(或)肝脏代谢不同,本品在血液和组织中代谢,不在体内产生蓄积。信息来源:中国医药123网
请问有谁知道注射用无菌粉末怎样测定渗透压摩尔浓度?谢谢
YBB 0005-2005 注射用无菌粉末用卤化丁基橡胶塞[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=36005]YBB 0005-2005 注射用无菌粉末用卤化丁基橡胶塞[/url]

作者:汪杰; 刘元瑞; 刘祖德;(武警部队药品检验所; 武警总医院 北京;)摘要:目的 建立顶空毛细管气相色谱法测定注射用氨苄西林钠中的有机溶剂残留量。方法 用DM-624毛细管气相色谱柱,顶空进样法,FID检测器,以甲醇为内标进行测定。结果 二氯甲烷、丙酮、异丙醇的线性范围分别为2.633-1 316.8μg·mL-1(r=0.999 8),1.569-784.4μg·mL-1(r=0.999 9),1.562-781.2μg·mL-1(r=0.999 9);二氯甲烷、丙酮、异丙醇的平均回收率分别为100.8%,98.3%,99.3%;RSD分别为2.0%,2.3%,1.6%(n=5)。结论 本方法简单、准确、灵敏度高、重现性好,适用于注射用氨苄西林钠中有机溶剂残留量的测定。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208271108_386366_1606903_3.jpg
注射用水与纯化水的水质区别 如将美国药典中纯化水与注射用水的水质标准作一比较,就可看出二者的主要区别。它们的理化指标相同,但注射用水对热原及微生物的要求高于纯化水。表1.1列出了美国药典中纯化水和注射用水热原和微生物的区别。 表1.1 美国药典中纯化水与注射用水热原和微生物的区别 种 类 项 目纯化水注射用水 微生物100CFU/mL 10CFU/100mL 热原 不指定 0.25EU/mL 生产方法 蒸馏 离子交换 反渗透 其他适当的方法蒸馏 反渗透 纯化水与注射用水二者的区别还在于制水工艺,纯化水的制备工艺可以有各种选择,但各国药典对注射用水的制备工艺均有限定条件,如美国药典明确规定注射用水的制备工艺只能是蒸馏及反渗透,中国药典则规定注射用水的生产工艺必须是蒸馏。这些是各国根据本国的实际情况用以保证注射用水质量的必要条件。
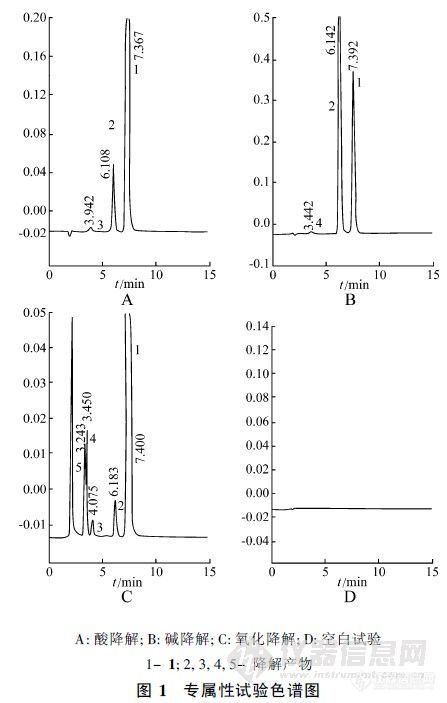
【作者】 王璐璐; 郑稳生; 谭小川; 张宇佳;【Author】 WANG Lu-Lu, ZHENG Wen-Sheng, TAN Xiao-Chuan, ZHANG Yu-Jia (Chinese Academy of Medical Sciences, Institute of Materia Medica, Beijing 100050)【机构】 中国医学科学院协和医科大学药物研究所; 中国医学科学院协和医科大学药物研究所 北京100050; 北京100050; 北京100050;【摘要】 采用 HPL C法测定注射用盐酸地尔硫的含量及有关物质。色谱柱为 Diamonsil C1 8( 15 0 mm× 4.6 m m,5μm ) ,0 .1m ol/ L醋酸钠缓冲液 ( p H6 .2 ) -甲醇 -乙腈 ( 5∶ 6∶ 6 )为流动相 ,检测波长为 2 40 nm。检测限为 0 .2 ng,线性范围为 6~ 14μg/ ml( r=0 .9998) ,RSD为 0 .11% ,平均回收率为 10 0 .2 % ,RSD为 0 .5 2 %。 更多还原【Abstract】 A HPLC method for the determination of diltiazem hydrochloride for injection and its related substances was presented. Diamonsil C18 column was used, with mobile phase of 0.1 mol/L sodium acetate buffer solution (pH6.2)-methanol-acetonitrile (5∶6∶6) and at detection wavelength of 236 nm. The detection limit was 0.2 ng. The linear range was 6~14 μg/ml, and average recovery was 100.2% with RSD of 0.52%. 更多还原【关键词】 注射用盐酸地尔硫; 有关物质; HPLC; 测定; 【Key words】 diltiazem hydrochloride for injection; related substance; HPLC; determination; http://ng1.17img.cn/bbsfiles/images/2012/08/201208201140_384595_2352694_3.jpg
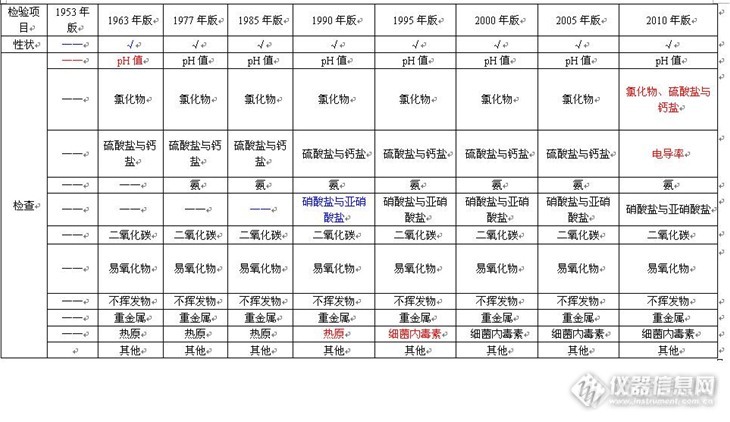
打过针的同学都知道,打点滴用的是生理盐水或者葡萄糖水。而屁股针或皮下针一般都是用的灭菌注射用水。药剂或者灭菌药粉用灭菌注射用水稀释或者溶解后,才能正常使用。不然,就有可能不治病,反致命!所谓灭菌注射用水,就是灭过菌的注射用水。因为注射用水一般是用蒸馏纯化水的方法得到的。学过物理的同学都知道,水在100℃的时候就会沸腾变成水蒸气,也就是说,这种蒸馏方式得到的注射用水,最高也就经受了100℃温度的洗礼。学过生物的同学还知道,100℃的温度,对于嗜热的细菌以及耐热的芽孢来说,完全就是泡一次澡而已。要想干掉这些致命的玩意儿,必须下狠招,也就是说,必须来上更猛烈的“暴风雨”!因此,利用高压灭菌锅,利用蒸汽的压力,可以产生115℃的温度,30分钟内杀灭其中的所有生灵(相对概念上的意义哦)!这样,才能保证我们用药的安全。中国药典中规定了灭菌注射用水的检验标准。只有检验合格的灭菌注射用水才是安全的。而灭菌注射用水的检验标准,随着时代的流逝,也经历了一些变化。具体见下表:http://ng1.17img.cn/bbsfiles/images/2013/12/201312272159_485078_1609327_3.jpg其演变的历程与注射用水的历程同步。主要为以下:1. 灭菌注射用水与注射用水相比较,检验项目的设置基本一致,但是限度更低,更为苛刻;2. 1953年版没有关于灭菌注射用水的描述,可能与当时的认识水平有关;3. 1953年的版本,对“形状”没有专门规定,而从1963年开始,有了专业而具体的规定;4. 1953年命名为为“酸碱度”的检验项目,1963年更名为pH值,使得测量更加科学与准确;5. 从1953年至2005年,一直沿用的是“氯化物、硫酸盐与钙盐”这个项目名称,2010年替换为电导率测量;6. 1953年为“铵盐”的检验项目,1963年改为“氨”的测定;7. 1985年之前,一直没有检验“硝酸盐与亚硝酸盐”,随着认识的提高,1985年版中国药典增加了该检验项目;8. 2010年版中国药典将以前的“二氧化碳”与“易氧化物”的检验项目,合并为“总有机碳”检验项目;9. 1953年至1990年,一直沿用的“热原”检验项目,在1995年更名为“细菌内毒素”;10. 从2005年版开始,增加了“微生物限度”检验项目。