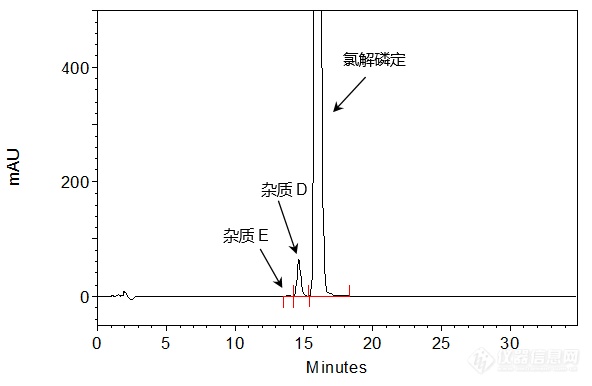
[align=center][b]注射用氯解磷定的有关物质分析[/b][/align]氯解磷定注射液是有机磷中毒解毒药,对急性有机磷杀虫剂抑制的胆碱酯酶活力有不同程度的复活作用,用于解救多种有机磷酸酯类杀虫剂的中毒。[align=center][img=,105,92]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656260751_676_2222981_3.gif!w105x92.jpg[/img][/align][align=center]氯解磷定[/align][align=center]2-Pyridinealdoxime methochloride[/align][align=center]C7H9ClN2OM.W.: 172.6[/align][align=center][/align]客户提供了注射用氯解磷定样品,希望本实验室依据客户指定色谱条件筛选合适的C[sub]18[/sub]色谱柱,以实现氯解磷定注射液样品的有关物质分析,满足氯解磷定主峰同相邻杂质峰以及各杂质峰间的基线分离要求。首先,尝试使用[b][color=red]中等极性的普适型色谱柱——[/color][color=red]CAPCELL PAK C[sub]18[/sub] MGII[/color][/b],依据客户所提供的色谱条件(流动相含十二烷基硫酸钠和二乙胺)对氯解磷定注射液样品进行分析。如图1,[color=#2E74B5]氯解磷定主峰保留时间为[/color][b][color=#2E74B5]16 min[/color][/b][color=#2E74B5],主峰与峰前杂质[/color][color=#2E74B5]D[/color][color=#2E74B5]之间分离度为[/color][b][color=#2E74B5]2.33[/color][/b][color=#2E74B5],杂质[/color][color=#2E74B5]D[/color][color=#2E74B5]与杂质[/color][color=#2E74B5]E[/color][color=#2E74B5]之间分离度为[/color][b][color=#2E74B5]1.64[/color][/b][color=#2E74B5],均能得到良好分离结果。通过对相对保留时间进行计算,所得结果满足客户[/color][color=#2E74B5]SOP[/color][color=#2E74B5]要求。[/color][color=#2E74B5][/color][align=center][img=,592,386]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656248670_1537_2222981_3.png!w592x386.jpg[/img][/align][align=center]图1 CAPCELL PAK C[sub]18[/sub] MGII分析所得色谱图[/align][align=center][/align][align=center][/align][align=center][/align][align=center][img=,587,389]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656253460_3177_2222981_3.png!w587x389.jpg[/img][/align][align=center]图2 CAPCELL PAK C[sub]18[/sub] MGII分析所得色谱图放大图[/align]注:峰上标数字由下至上依次为分离度、理论塔板数与保留时间。[img=,424,282]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656270060_717_2222981_3.png!w424x282.jpg[/img]就上述实验结果与客户沟通,客户反映希望使主峰的保留时间在20min左右。为满足客户需求,我们在上述实验条件基础上,将柱温由初始条件的40°C降至30°C进行分析,发现主峰保留时间为17 min左右;为进一步增强其保留,我们将色谱柱更换为[b][color=red]极性更高的[/color][color=red]CAPCELL PAK C[sub]18[/sub] AQ[/color][color=red]色谱柱[/color][/b],如图3,[color=#2E74B5]氯解磷定主峰保留明显增强,保留时间约[/color][b][color=#2E74B5]20 min[/color][/b][color=#2E74B5],主峰与峰前杂质[/color][color=#2E74B5]D[/color][color=#2E74B5]之间分离度为[/color][b][color=#2E74B5]2.88[/color][/b][color=#2E74B5],杂质[/color][color=#2E74B5]D[/color][color=#2E74B5]与杂质[/color][color=#2E74B5]E[/color][color=#2E74B5]之间分离度为[/color][b][color=#2E74B5]2.72[/color][/b][color=#2E74B5],能够得到良好的保留与分离结果。[/color][align=center][img=,599,388]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656255480_6169_2222981_3.png!w599x388.jpg[/img][/align][align=center]图3 CAPCELL PAK C[sub]18[/sub] AQ分析所得色谱图[/align][align=center][img=,597,361]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656258121_3421_2222981_3.png!w597x361.jpg[/img][/align][align=center]图4 CAPCELL PAK C[sub]18[/sub] AQ分析所得色谱图放大图[/align]注:峰上标数字由下至上依次为分离度、理论塔板数与保留时间。[img=,499,322]http://ng1.17img.cn/bbsfiles/images/2018/07/201807181656269602_541_2222981_3.png!w499x322.jpg[/img]综上实验结果,使用大曹色谱CAPCELL PAK系列色谱柱中的第一选择——中等极性的普适型色谱柱CAPCELL PAK C18 MGII和能在纯水条件下稳定使用的高极性色谱柱CAPCELL PAK C18 AQ进行分析,均能实现注射用氯解磷定的有关物质分析,并能满足氯解磷定主峰同其相邻杂质及各杂质峰间的基线分离要求,客户可根据实际需求进行选择。[align=right]三耀精细化工品销售(中国)有限公司[/align][align=right]技术开发部[/align][align=right]地址:北京经济技术开发区宏达南路5号[/align][align=right]宏达利德工业园1栋418室[/align][align=right]邮编:100176[/align]
本人急需注射用头孢他啶(Ceftazidime)和注射用头孢米诺钠(Cefminox sodium)EP6.0的标准,复印件也行,谢谢!
http://simg.instrument.com.cn/bbs/images/default/emyc1007.gif这是很久以前做的一个方法,拿来参加原创大赛,支持液相色谱版。由于涉及公司产品,文中部分信息隐去,请见谅。--------------------------------------------------------------------------------------------------HPLC测定注射用帕米膦酸二钠中的亚磷酸含量 注射用帕米膦酸二钠的原料帕米膦酸二钠结构稳定,对光、热等均不敏感,正常的储存条件下不易产生降解产物。亚磷酸作为帕米膦酸二钠的合成原料,属于制剂中的有关物质。我们参考相关资料,对注射用帕米膦酸二钠中的亚磷酸含量测定进行了研究。测定法:“取本品,加水制成每1ml中含帕米膦酸二钠10mg的溶液,摇匀,滤过,作为供试品溶液;另取亚磷酸适量,精密称定,加水制成每1ml中约含0.05mg的溶液,作为对照品溶液。照高效液相色谱法测定,用阴离子色谱柱;以**溶液为流动相,示差检测器检测;柱温为35℃,流速为1.0ml/min。取对照品溶液和供试品溶液各50μl注入液相色谱仪,供试品溶液的色谱图中如出现与对照品溶液相应的杂质峰,其峰面积不得大于对照品溶液主峰面积(0.5%)”仪器与试药:LC-10A液相色谱仪配示差检测器,亚磷酸对照品购自SIGMA。线性:取亚磷酸对照品0.1020g,加水溶解并稀释至100ml,分别精密量取1,2,3,4,5ml,置100ml量瓶中,加水至刻度,摇匀,制备成约含亚磷酸10,20,30,40,50mg/L的标准曲线序列,依法测定:浓度mg/L峰面积10.20799120.401559730.60[font=Times
注射用头孢西丁钠生产工艺验证方案[~74687~]
YBB 0005-2005 注射用无菌粉末用卤化丁基橡胶塞[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=36005]YBB 0005-2005 注射用无菌粉末用卤化丁基橡胶塞[/url]
[center]FDA批准10年来首个新型静脉注射用抗高血压药[/center]The Medicines公司8月4日宣布,美国FDA已批准其静脉注射用制剂丁酸氯维地平(clevidipine butyrate,Cleviprex)注射用乳剂在不适用或不希望使用口服制剂的情况下用于高血压的治疗。本品是10年来美国FDA批准的首个新型静脉注射用抗高血压药。 本品作为1种新型静脉注射用抗高血压药,代表了当前高血压治疗中的一大进步,其可以在危重病护理中快速、精确地控制血压。来自急诊室、手术室和重症监护室的综合资料显示,本品将成为医生控制患者血压时的重要选择手段。 本品可迅速起效,可用于精确控制血压。与现有静脉注射用抗高血压药通过肾脏和(或)肝脏代谢不同,本品在血液和组织中代谢,不在体内产生蓄积。信息来源:中国医药123网
注射用无菌粉末需要测定渗透压吗?使用时是溶解在0.9%氯化钠或5%葡萄糖中,静脉滴注。 我是这么想的:药品溶解在0.9%氯化钠或5%葡萄糖,其渗透压应该是略微变大的吧,这样还有必要做这个实验吗? 我看了下2010药典,渗透压的标准是多少啊?注射用无菌粉末都没有表明渗透压范围啊?但是我找一些注射液的标准里面就有具体的渗透压范围。
请问现在有注射用无菌粉末用卤化丁基橡胶塞(冻干用)了吗?现在我们用的标准是“YBB00052005 注射用无菌粉末用卤化丁基橡胶塞”,但里面是说明了此标准不适用于冻干橡胶塞,不过到现在都还没有找到冻干橡胶塞的标准。我查了下,在07年7月的时候有胶塞行业标准座谈会,说是“由中国医药包装协会牵头,上海食品药品包装材料测试所提供技术支持,部分胶塞厂家协助完成药用丁基橡胶塞协会标准的制订。标准制定分为产品标准和单项标准二部分:1、 产品标准包括:小容量注射液标准、冻干胶塞标准;2、 单项标准包括:外观及规格尺寸标准(含注射剂用丁基胶塞、输液用丁基胶塞、冻干用丁基胶塞、小容量注射液丁基胶塞);胶塞表面硅油含量均匀度标准;免洗胶塞标准等”那么现在标准出台了吗?座谈会见http://www.cnppa.org/index_newsInfo.jsp?id=264
用了很久的超纯水了,换了个单位,发现在配流动性时用注射用水,电导率和cot都合格,不知是否可以,个人认为还是用超纯水好,大家说说自己的看法
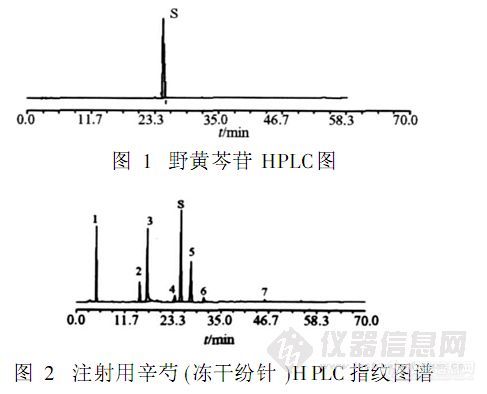
【作者中文名】苏红; 王爱民; 王永林; 兰燕宇; 何迅; 李勇军;【作者英文名】SU Hong; WANG Ai-min; WANG Yong-lin; LAN Yan-yu; HE Xun; LI Yong-jun(School of Pharmacy; Guiyang Medical College; Guiyang 550004; China);【作者单位】贵阳医学院药学院; 贵阳医学院药学院 贵州贵阳; 贵州贵阳;【摘要】目的:采用RP-HPLC建立注射用辛芍(冻干粉针)的指纹图谱测定方法。方法:采用Diamonsil C18色谱柱,80%乙腈-0.1%磷酸溶液为流动相进行梯度洗脱,流速1.0 mL.min-1,柱温40℃,检测波长为230 nm。结果:在相同色谱条件下获得药材、中间体和制剂的各色谱峰分离较好,建立了注射用辛芍的HPLC对照指纹图谱,标注了制剂中的8个共有指纹峰,制剂与药材、中间体的指纹图谱有良好的相关性,10批样品相似度大于0.97,达到指纹图谱的技术要求。结论:该方法准确、重复性好,可作为注射用辛芍(冻干粉针)质量控制的重要依据之一。http://ng1.17img.cn/bbsfiles/images/2012/08/201208131742_383598_2379123_3.jpg
请问那位有《YBB00042005注射用卤化丁基橡胶塞》的标准?谢谢![em0815][em0815]
药友制药紧急召回炎琥宁 10余名婴幼儿用后休克 中国消费者报http://i1.sinaimg.cn/cj/consume/puguangtai/20120914/1347578725_oozdma.jpg 图1为重庆药友制药有限公司生产的注射用炎琥宁。洪敬谱/摄 http://i2.sinaimg.cn/cj/consume/puguangtai/20120914/1347578725_aZmg7E.jpg 图2为幼儿正在医院抢救的情景。资料图片 本报合肥讯(记者洪敬谱)9月初,安徽省合肥市10余名婴幼儿因为感冒发烧在安徽医科大学第一附属医院(以下简称安医大第一医院)治疗后,普遍出现休克状况。经医院积极救治,这些孩子目前病情稳定。9月11日中午,合肥市药品不良反应监测中心致电本报记者称,目前正在对这些婴幼儿使用的注射用炎琥宁进行检测,会及时向本报公布检测结果。目前,重庆药友制药有限责任公司已将该省内使用的生产批号为12102863、规格为80mg的注射用炎琥宁全部召回。 9月9日晚上,合肥市民刁先生等10多位婴幼儿家长向本报记者反映称,自己的孩子在安医大第一医院看病输液,之后出现休克情况,家长们怀疑使用的药品存在安全问题。
作者:鲁瑞娟; 薛静; 曹晓云;天津市药品检验所; 中美天津史克制药有限公司; 天津市药品检验所 天津;摘要:目的:采用高效液相色谱法测定注射用头孢他啶的有关物质。方法:迪马钻石柱C18色谱柱(4.6 mm×150mm,5μm),流动相为三乙胺醋酸溶液-水-乙腈(12∶924∶70),用1 mol/L醋酸溶液调节pH值至5.0,检测波长为254 nm,以主成分自身对照外标法进行结果计算。结果:头孢他啶0~0.3μg范围内呈良好的线性关系,r=0.999 7,最低检出量为0.005μg。结论:本法检测注射用头孢他啶中有关物质的含量,简便、快速,结果准确。

1、样品信息样品名称结构式分子式分子量CAS号贮藏条件注射用头孢拉定(Cefradine for Injection)http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647936_2891022_3.jpgC16H19N3O4S349.4038821-53-3密闭,在凉暗处保存2、色谱条件流动相:以含0.027mol/L辛磺酸钠的磷酸氢二钠溶液(磷酸调pH至8.0)-甲醇(75:25), 等度洗脱检测波长:206 nm柱温:30℃进样量:10μl流速:1.0 ml/min色谱柱:Durashell C18-AM,5μm,100Å,4.6×250mm3、测定结果3.1 样品测定结果样品测定图谱 http://ng1.17img.cn/bbsfiles/images/2014/06/201406251145_502961_801_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/06/201406251146_502962_801_3.png样品测定结果主峰名称保留时间(min)理论塔板数拖尾因子头孢拉定6.69595010.9393.2 不同批次色谱柱验证结果第1[/fon

1、样品信息样品名称结构式分子式分子量CAS号贮藏条件注射用头孢拉定(Cefradine for Injection)http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647829_2891022_3.jpgC16H19N3O4S349.4038821-53-3密闭,在凉暗处保存2、色谱条件流动相:以含0.027mol/L辛磺酸钠的磷酸氢二钠溶液(磷酸调pH至8.0)-甲醇(75:25), 等度洗脱检测波长:206 nm柱温:30℃进样量:10μl流速:1.0 ml/min色谱柱:Durashell C18-AM,5μm,100Å,4.6×250mm3、测定结果3.1 样品测定结果样品测定图谱 http://ng1.17img.cn/bbsfiles/images/2014/06/201406251145_502961_801_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/06/201406251146_502962_801_3.png样品测定结果主峰名称保留时间(min)理论塔板数拖尾因子头孢拉定6.69595010.9393.2 不同批次色谱柱验证结果
http://simg.instrument.com.cn/bbs/images/default/emyc1007.gif支持分坛团队和化学药分析版。我公司产品注射用帕米膦酸二钠执行标准为《中国药典》2010年版二部。含量测定项下的内容为:“【含量测定】照离子色谱法(附录 V J)测定色谱条件与系统适用性试验用阴离子交换色谱柱;以3mmol/L草酸溶液为流动相,流速为每分钟1.2ml;检测器为电导检测器。理论板数按帕米瞵酸二钠峰计算不低于2000。”我们在检测中发现,含量测定色谱柱的理论塔板数下降较快。经研究,将流动相由“3mmol/L草酸溶液”改变为“**溶液”,可使柱效明显稳定。方法学验证结果显示,变更后的方法准确、可靠。可用于我公司产品注射用帕米膦酸二钠含量测定。1仪器与试药1.1仪器岛津LC-20A高效液相色谱仪,配CDD-10A VP电导检测器。所用仪器和量具均经校准或检定。1.2试药对照品帕米膦酸二钠(经160℃干燥至恒重,按干燥品计含量100.2%,按100%计。)。辅料、水为超纯水。2方法与结果2.1色谱条件色谱柱Dionex IonPac AS22阴离子交换色谱柱(4 mm ×250 mm),配保护柱(4 mm ×50 mm);流动相**溶液;检测器为电导检测器;柱温35℃;流速1.2ml/min。进样量为20μl。理论塔板数按帕米膦酸二钠峰计算应不低于2000。2.2溶液的制备2.2.1空白辅料储备液:取辅料适量,按处方配成溶液备用。2.2.2空白辅料溶液:取空白辅料储备液5ml置于50ml容量瓶中,加水定容至刻度。2.2.3对照品溶液:精密称取帕米膦酸二钠对照品约30mg,置于50ml容量瓶中,用水溶解并定容。2.2.4供试品溶液:精密称取帕米膦酸二钠对照品适量(根据不同验证项目,称取不同量),置于50ml容量瓶中,加水溶解后,加入5ml空白辅料储备液并用水定容。2.3专属性试验空白溶剂:水。取空白溶剂、空白辅料溶液、对照品溶液、供试品溶液,照2.1色谱条件,依法测定,记录色谱图。(附图略)结果显示,对照品溶液和供试品溶液的色谱图中帕米膦酸二钠峰与其他峰之间分离度良好,分离度大于1.5;空白溶剂及空白辅料溶液色谱图中在帕米膦酸二钠峰处无干扰峰。本方法有良好的专属性。2.4 线性关系及范围精密称取帕米膦酸二钠对照品14.58、24.28、30.58、36.13、45.80 mg,分别置50ml量瓶中,用水适量溶解后,加入5ml空白辅料储备液并用水定容,摇匀,制成每1ml中含帕米膦酸二钠0.2916、0.4856、0.6116、[/fon
有关注射用水的条款讨论2007版GMP认证检查评定标准第*3402内容如下:注射用水的制备、储存和分配应能防止微生物的滋生和污染,储罐的通气口应安装不脱落纤维的疏水性除菌滤器,储存应采用80℃以上保温、65℃以上保温循环或4℃以下保温循环。生物制品生产用注射用水应在制备后6小时内使用;制备后4小时内灭菌72小时内使用。有人认为生物制品生产用注射用水只要满足:制备后6小时内使用;制备后4小时内灭菌72小时内使用。就可以了我认为生物制品生产用注射用水既要满足:储存应采用80℃以上保温、65℃以上保温循环或4℃以下保温循环;又要满足:在制备后6小时内使用;制备后4小时内灭菌72小时内使用。大家怎样理解啊?请参与!
谁做过注射用左卡呢汀?我们做有关物质时在主峰后面约2分多的位置上经常会有一个小峰,有它在有关物质就不合格。这个小峰时而出现,时而不出现。曾经做过原料、辅料的对比。辅料没有峰,同样的检测条件,原料也有一个类似的峰,但原料检验是合格的(用原料的质量标准检验)。恳请高人帮忙指导!

《中国药典》2015年版四部P491"甘油(供注射用)"有如下图片内容。我们生产的注射液使用甘油(供注射用)作为辅料,注射液为最终灭菌产品,请问作为辅料的甘油,是否还需要检验无菌?我的理解是,由于产品是最终灭菌产品,作为辅料,控制微生物限度和细菌内毒素是必要的,因此不需要无菌检验,但是,也有不同意见,说因为生产的注射液属于无菌制剂,且由于其生产过程无除菌工艺,因此,图中的“无菌(供无除菌工艺的无菌制剂用)”这一项应该进行检测。如此,我认为还是矛盾,如果无菌都检测,微生物限度还有必要测吗?另外,最终灭菌的产品,有必要对其辅料检测无菌吗?谢谢!

作者:汪杰; 刘元瑞; 刘祖德;(武警部队药品检验所; 武警总医院 北京;)摘要:目的 建立顶空毛细管气相色谱法测定注射用氨苄西林钠中的有机溶剂残留量。方法 用DM-624毛细管气相色谱柱,顶空进样法,FID检测器,以甲醇为内标进行测定。结果 二氯甲烷、丙酮、异丙醇的线性范围分别为2.633-1 316.8μg·mL-1(r=0.999 8),1.569-784.4μg·mL-1(r=0.999 9),1.562-781.2μg·mL-1(r=0.999 9);二氯甲烷、丙酮、异丙醇的平均回收率分别为100.8%,98.3%,99.3%;RSD分别为2.0%,2.3%,1.6%(n=5)。结论 本方法简单、准确、灵敏度高、重现性好,适用于注射用氨苄西林钠中有机溶剂残留量的测定。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208271108_386366_1606903_3.jpg
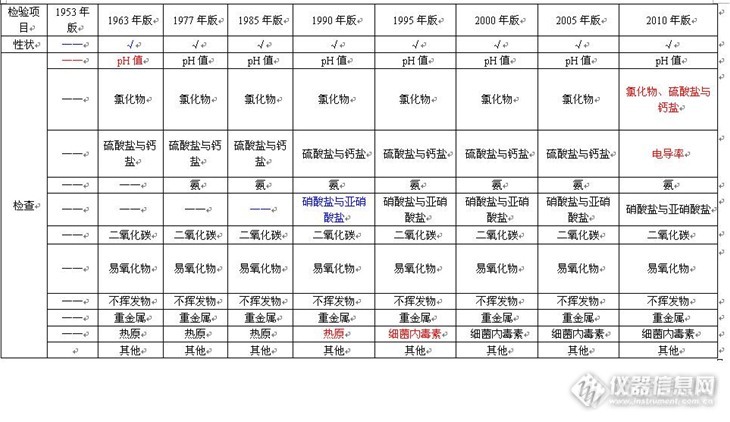
打过针的同学都知道,打点滴用的是生理盐水或者葡萄糖水。而屁股针或皮下针一般都是用的灭菌注射用水。药剂或者灭菌药粉用灭菌注射用水稀释或者溶解后,才能正常使用。不然,就有可能不治病,反致命!所谓灭菌注射用水,就是灭过菌的注射用水。因为注射用水一般是用蒸馏纯化水的方法得到的。学过物理的同学都知道,水在100℃的时候就会沸腾变成水蒸气,也就是说,这种蒸馏方式得到的注射用水,最高也就经受了100℃温度的洗礼。学过生物的同学还知道,100℃的温度,对于嗜热的细菌以及耐热的芽孢来说,完全就是泡一次澡而已。要想干掉这些致命的玩意儿,必须下狠招,也就是说,必须来上更猛烈的“暴风雨”!因此,利用高压灭菌锅,利用蒸汽的压力,可以产生115℃的温度,30分钟内杀灭其中的所有生灵(相对概念上的意义哦)!这样,才能保证我们用药的安全。中国药典中规定了灭菌注射用水的检验标准。只有检验合格的灭菌注射用水才是安全的。而灭菌注射用水的检验标准,随着时代的流逝,也经历了一些变化。具体见下表:http://ng1.17img.cn/bbsfiles/images/2013/12/201312272159_485078_1609327_3.jpg其演变的历程与注射用水的历程同步。主要为以下:1. 灭菌注射用水与注射用水相比较,检验项目的设置基本一致,但是限度更低,更为苛刻;2. 1953年版没有关于灭菌注射用水的描述,可能与当时的认识水平有关;3. 1953年的版本,对“形状”没有专门规定,而从1963年开始,有了专业而具体的规定;4. 1953年命名为为“酸碱度”的检验项目,1963年更名为pH值,使得测量更加科学与准确;5. 从1953年至2005年,一直沿用的是“氯化物、硫酸盐与钙盐”这个项目名称,2010年替换为电导率测量;6. 1953年为“铵盐”的检验项目,1963年改为“氨”的测定;7. 1985年之前,一直没有检验“硝酸盐与亚硝酸盐”,随着认识的提高,1985年版中国药典增加了该检验项目;8. 2010年版中国药典将以前的“二氧化碳”与“易氧化物”的检验项目,合并为“总有机碳”检验项目;9. 1953年至1990年,一直沿用的“热原”检验项目,在1995年更名为“细菌内毒素”;10. 从2005年版开始,增加了“微生物限度”检验项目。
日前,国家食品药品监督管理局发布了第47期《药品不良反应信息通报》,提示警惕超剂量使用注射用阿莫西林钠可能增加肾损害风险。 阿莫西林为青霉素类抗生素,通过抑制细菌细胞壁合成,使细菌膨胀、裂解而发挥杀菌作用。注射用阿莫西林钠适用于敏感菌所致各种感染中病情较重需要住院治疗或不能口服的患者。 国家药品不良反应监测中心病例报告数据库数据显示,注射用阿莫西林钠严重病例报告中肾损害问题比较突出,主要表现为血尿、蛋白尿、急性肾功能衰竭、间质性肾炎等。在注射用阿莫西林钠肾损害的病例中,90%以上的病例属于超剂量用药。 国家食品药品监督管理局建议: 一、医务人员应严格按照药品说明书规定的用法用量给药,用药过程应该加强肾功能监测,避免单次剂量过大、浓度过高、滴速过快或长时间使用;对肾功能障碍患者、老年患者应注意调整用药剂量,对于未成年患者应按体重给药,并应告知监护人风险,加强随访和监测。 二、药品生产企业应对说明书相关内容进行修订,完善风险提示信息;加大药品不良反应监测力度,加强临床合理用药的宣传,确保产品的安全性信息及时传达给患者和医生;制定并实施有效的风险管理计划,保证用药安全。
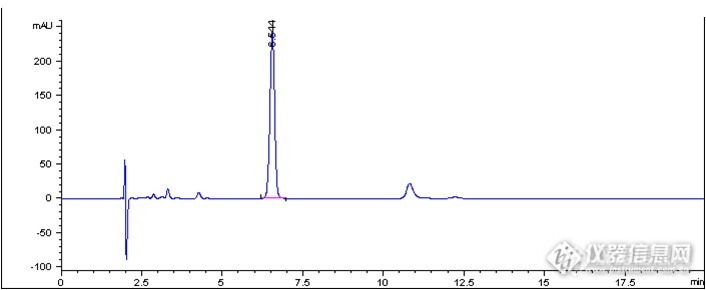
1、样品信息样品名称结构式分子式分子量CAS号贮藏条件注射用头孢拉定(Cefradine for Injection)http://ng1.17img.cn/bbsfiles/images/2017/01/201701191656_647675_2891019_3.jpgC16H19N3O4S349.4038821-53-3密闭,在凉暗处保存2、色谱条件流动相:以含0.027mol/L辛磺酸钠的磷酸氢二钠溶液(磷酸调pH至8.0)-甲醇(75:25), 等度洗脱检测波长:206 nm柱温:30℃进样量:10μl流速:1.0 ml/min色谱柱:Durashell C18-AM,5μm,100Å,4.6×250mm3、测定结果3.1 样品测定结果样品测定图谱 http://ng1.17img.cn/bbsfiles/images/2014/06/201406251145_502961_801_3.pnghttp://ng1.17img.cn/bbsfiles/images/2014/06/201406251146_502962_801_3.png样品测定结果主峰名称保留时间(min)理论塔板数拖尾因子头孢拉定6.69595010.9393.2 不同批次色谱柱验证结果第1批次色谱柱测定图谱http://ng1.17img.cn/bbsfiles/images/2014/06/201406251146_502963_801
[em09510]呵呵,再放个上过来,跟大家交流下。注射用水H2O【7732-18-5】定义肠外给药的制备,当水用于溶剂时(散装注射用水)用于溶解或稀释物质时或者制备肠外用药时(灭菌注射用水)。散装注射用水生产散装注射用水从符合由主管机关制定的食用级的水的规定或者仪器蒸馏得到的纯化水,在这些设备在与水接触的部分,都是中性玻璃,石英或合适的金属,设备装有装有一个有效的设施来防止液滴的夹带。该仪器的正确保养是必不可少的。第一部分蒸馏获得当仪器开始工作被摒弃馏分被收集。当生产和随后的储存中,适宜的测量方法被用于测量总的有足够的控制和监控的可行的有氧计数。适宜的警戒和行动限被设置用于防止不良趋势。在正常情况下,适宜的行动限是总的存活有氧计数(2.6.12)10个微生物每100ml当用薄膜漏斗测定时,使用琼脂培养基S,使用至少200ml的散装注射用水在30-35℃条件下接种培养5天。对于无菌处理,可能需要更加严格的警戒限。总的有机碳(2.2.44):最大0.5mg/ml。电导率.在下面的条件下测定离线或者在线电导率。设备电导池:-适宜材料的电极例如不锈钢电极;-电极常数:给定值2%范围内,测定使用经过认证的电导率小于1500μS• cm-1.的参比溶液。电导:分解0.1μS• cm-1在最低的范围内。系统校准(电导池和电导):-对一个或多个合适的认证标准溶液。-精确度:在3%所测电导率加0.1μS• cm-1范围内。电导校准:通过精密电阻或者等效设备,在断开电导池后,对所有用于电导测定和电池校准(在所标值0.1%范围内的准确度,可追溯至官方标准)。假如在线电导池不能被拆解,系统校准可以通过将校准电导池放在靠近被校准的池,在水流中校准。程序步骤一1.在没有温度补偿的情况下测定电导率,并记录温度。温度补偿测定可能在适宜的验证后进行。2.用表0169.-1,找出不大于但最接近测定温度温度值。相应的电导值是那个温度的限定。3.假如测得的电导率没有大于表0169.-1中的值,被测的水符合电导试验的要求。假如电导率高于表中标出的值,继续步骤2.表0169.-1-步骤一温度和电导率要求(非温度补偿电导率测定)温度(℃)电导率(μS• cm-1)00.650.8100.9151.0201.1251.3301.4351.5401.7451.8501.9552.1602.2652.4702.5752.7802.7852.7902.7952.91003.1步骤24.将足量的待测水(100ml或者更多)转移至适宜的容器中,搅拌,测试样品。如有必要,调节温度,当温度保持在25±1℃时,开始大力搅拌样品当定期观察电导率时。当电导率的变化(由于摄入大气中的二氧化碳)少于0.1μS• cm-1每5min,注意电导率。5.假如电导率没有大于2.1μS• cm-1,被测的水符合电导率实验要求。假如电导率大于2.1μS• cm-1,继续步骤3.步骤36.进行此试验约5min电导率测定根据步骤2下的步骤5中,当保存样品在25±1℃条件下。添加最近配制的饱和氯化钾溶液R至测试样品中(0.3ml每100ml的测试样品),测定pH(2.2.3)至最近0.1pH单位。7.使用表0169.-2测定在第6步中测定的pH下的电导率限定。假如按骤2第4步测得的电导率不大于测得的pH中的电导率要求。被测的水符合电导率实验要求。如果不管是测得的电导率大于这个值,或是pH超出5.0-7.0的范围。被测的水不符合电导率实验要求。表0169.-2pH电导率(μS• cm-1)5.04.75.14.15.23.65.33.35.43.05.52.85.62.65.72.55.82.45.92.46.02.46.12.46.22.56.32.46.42.36.52.26.62.16.72.66.83.16.93.87.04.6为了保证水的适宜质量,验证程序和进程中监测电导率和日常微生物监测被采用。散装注射用水被储存和分布在设计成防止微生物生长和任何污染的条件下。特征外观:无色透明液体。试验硝酸盐:最大0.2ppm。将5ml置于试管中浸入冰水浴中,加入4ml100g/l的氯化钾溶液R,0.1ml二苯胺溶液R,边摇边滴加,5ml的无氮硫酸R。转移试管至50℃的水浴中。15min后任何溶液中的蓝色都没有比在相同时间相同方式,用混合4.5ml的无硝酸盐水R和0.5ml硝酸盐标准溶液(2ppmNO3)R制备的参比溶液更浓。铝(2.4.17):最大10ppb,如果打算用于生产透析液。规定的溶液.在400ml的被测水中加入10mlpH6.0的醋酸缓冲液R和100ml的蒸馏水R。参比溶液.混合2ml的铝标准溶液(2ppmAι)R,10mlpH6.0的醋酸缓冲液R和98ml的蒸馏水R。空白溶液.混合10mlpH6.0的醋酸缓冲液R和100ml的蒸馏水R。重金属(2.4.8):最大0.1ppm。在水浴中用玻璃蒸发皿中加热200ml,直至体积减至20ml。12ml的浓缩液符合试验A限定。制备标准使用10ml的铅标准溶液(1ppmPb)R。细菌内毒素.(2.6.14):少于0.25IU/ml。
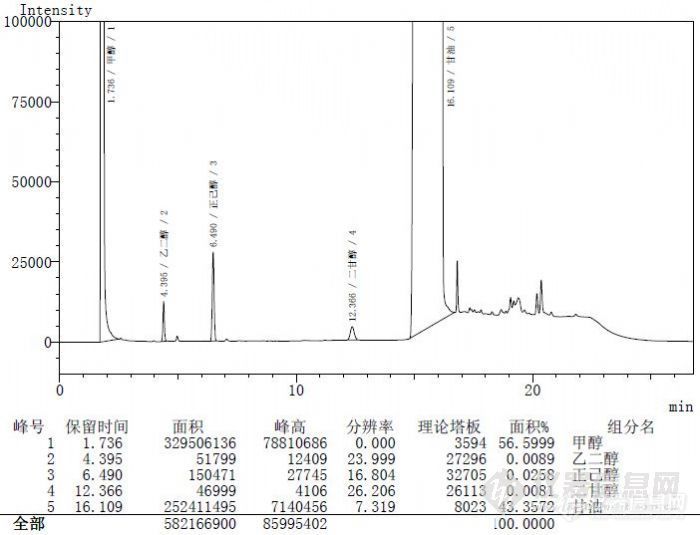
甘油(供注射用)方法: GC基质:药品应用编号:101921化合物:二甘醇;乙二醇;甘油;正己醇固定相:DM-624色谱柱/前处理小柱:DM-624 30m x 0.53mm x 3um商品编号:7751样品前处理:取本品约10g,精密称定,置于25ml量瓶中,精密加入内标溶液(每1ml中含有0.5mg正己醇的甲醇溶液)5ml,加甲醇溶解并稀释至刻度,作为供试品溶液色谱条件:照气象色谱法(附录V E)试验,用6%氰丙基苯基-94%二甲基聚硅氧烷为固定液(或极性相近)的毛细管柱,程序升温,起始温度为100℃,维持4min,以每分钟50℃的速率升温至120℃,维持10min,再以每分钟50℃的速率升温至220℃,维持6min;进样口温度为200℃;检测器温度为250℃。进样量:1μL作者:迪马科技文章出处:迪马科技关键字:《中国药典》2010版;二甘醇;乙二醇;甘油;正己醇摘要:甘油中有关物质检测http://ng1.17img.cn/bbsfiles/images/2012/07/201207191005_378591_2370618_3.jpg
请问有谁知道注射用无菌粉末怎样测定渗透压摩尔浓度?谢谢
如果非正常连续生产,车间注射用水不是采取保温或者循环处理的,只是在生产前进行一次各取样口的全检,然后如果结果合格,车间认为该系统注射用水无问题,如次日无生产安排,则放掉制好的注射用水,等待次日重新制水,如此是否可行?个人认为检验合格的注射用水是针对于当时制备的,如新制水应再进行取样检验,但是,注射用水也有其检验周期,我们定的是1周,所以,似乎也说的过去,不知大家是什么情况呢?欢迎讨论,谢谢![em61]
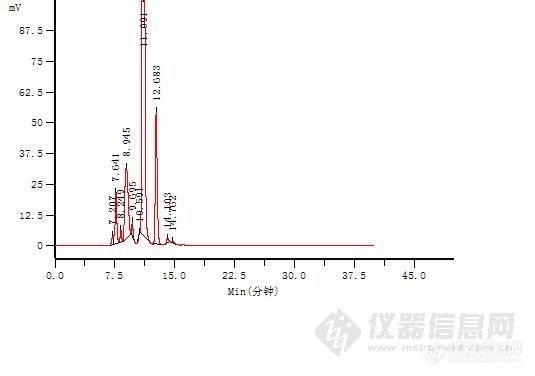
高效分子排阻色谱法测定注射用盐酸头孢替安高分子杂质头孢替安是杀菌性头孢菌素类广谱抗生素,头孢替安不但对革兰氏阳性菌有效,而且对革兰氏阴性菌。如流感嗜血杆菌,大肠杆菌、克雷白氏菌、奇异变形杆菌等的作用更强。对肠杆菌,枸橼酸杆菌、吲哚阳性变形杆菌等,也有抗菌作用头孢替安在肺中药物浓度较高,其它脏器和肌肉也有一定的浓度。临床应用于敏感菌所导致的感染,如肺炎、支气管炎、胆道感染、腹膜炎、尿路感染以及手术后或外伤引起的感染和败血症等。其基本结构同已上市的的头孢菌素类抗生素一样,头孢替安也会形成高分子聚合物,也会在临床使用中引发速发型过敏反应。对患者危害极大。已有的注射用盐酸头孢替安国家药品标准未将盐酸头孢替安高分子聚合物列为检定项目,国内的药学研究也未见头孢替安高分子聚合物的研究和报道。从临床用药安全性考虑,根据中国药典2010年版二部附录凝胶色谱原理。采用常用的葡聚糖凝胶G-10检测聚合物时由于头孢替安分子结构自身的原因,头孢替安不能完全缔合,因些我们采用高效分子排阻色谱法,以球状蛋白色谱用亲水硅胶为填充剂 TOSOH TSKgelG2000SW(7.5*300mm),测定注射用盐酸头孢替安高分子杂质1.仪器与试剂(1)仪器:岛津LC-10ATvp泵 岛津SPD-10AVP紫外可见光多波长检测器 浙大2010色谱数据工作站 色谱柱:TOSOH TSKgelG2000SW(7.5*300mm) (2)试剂: 乙腈 (色谱纯,天津市四友生物医学技术有限公司) 磷酸氢二钠(分析纯,北京化学试剂公司) 磷酸二氢钠(分析纯,北京化学试剂公司)双蒸水 (自制)2 色谱条件色谱柱:TOSOH TSKgelG2000SW(7.5*300mm)流动相:磷酸盐缓冲液(p H:6.8[/color
最近做项目时接触到某注射用冻干粉针的组分问题,想请教大家一下。在做液相组分时,原料的某一个组分的检测结果是89.5%,而对其生产的注射用冻干粉针进行液相组分检测时,该组分的含量是87.7%。这个过程中原料和成品的组分含量是不是不应该相差这么大?会是什么原因导致有这样的差距呢?原料和成品的组分检测是由不同人在不同仪器不同色谱柱上完成的。请教大家~多多指教!
我现在有个产品“注射用左卡尼汀”色谱条件:反相C18,流动相:庚烷磺酸钠0.6g,水500ml,甲醇500ml,用1mol/L HCL调PH至2.3。检测波长:225nm现在想求各位大侠,该如何选择色谱柱?选择什么样的色谱柱?