跪求! 复方氨基酸注射液(9AA)中的L-半胱氨酸盐酸盐的含量测定方法! 请高手赐教! 我用过了ACCQ-TAG法测了不行,有没有好点的方法
2010版药典中盐酸利多卡因注射液含测项下结果乘以1.156是什么意思,这个数据是根据什么公式得来的呢?
本人在此急求 中华人民共和国国家药品监督管理局标准(试行)中的关于"盐酸左氧氟沙星注射液"的标准,请大家帮忙!谢谢!
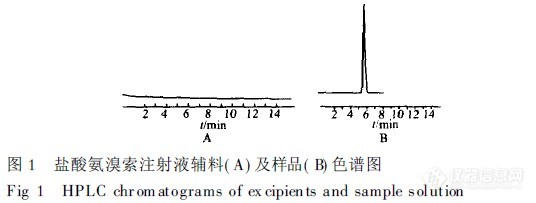
【作者】 黄淑霞; 刘金玲; 查文清; 张晓明;【机构】 深圳市南山医院; 深圳市南山医院 广东深圳518052; 广东深圳518052;【摘要】 目的:用HPLC法测定盐酸氨溴索注射液的含量。方法:采用Diamonsil-C18柱,室温下以0.04mol.L-1醋酸盐缓冲液-甲醇-乙腈(30∶40∶30)为流动相,检测波长为247nm。结果:盐酸氨溴索在5.0~100.8mg.L-1范围内呈良性线形关系,r=0.999 9,平均回收率为100.1%,RSD为0.7%。结论:该方法专属性强、简便、重现性好、结果准确可靠。 更多还原【关键词】 高效液相色谱法; 盐酸氨溴索注射液; 含量测定; http://ng1.17img.cn/bbsfiles/images/2012/08/201208131435_383503_2352694_3.jpg

作者:李昂; 胡翮; 郭丙炎;(湖南省湘潭市药品检验所;)摘要:目的用反相高效液相色谱(RP-HPLC)法测定盐酸丁卡因的含量。方法色谱柱为Diamonsil C18柱(150mm×4.6mm,5μm),流动相为水-甲醇-乙腈(45∶45∶10,v/v,含0.02%庚烷磺酸钠,0.34%磷酸二氢钾,三乙胺调pH至7.0),流速为1.0mL/min,检测波长为314nm,柱温为室温。结果盐酸丁卡因质量浓度在5.034~161.1μg/mL范围内与峰面积线性关系良好,回归方程为Y=5.6572×105X-9.2039×105(r=0.9999),平均回收率为100.76%,RSD为0.41%(n=6)。结论RP-HPLC法简便、可靠、准确,可作为盐酸丁卡因注射液的含量测定方法。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208271103_386360_1606903_3.jpg
[color=black]复方盐酸阿替卡因注射液为复方制剂,是盐酸阿替卡因与肾上腺素的灭菌水溶液,作为口腔用局部麻醉剂,适用于涉及切骨术及粘膜切开的外科手术过程。[/color][color=black] [/color][img=,156,99]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211036489419_4502_2297_3.jpg!w156x99.jpg[/img][align=center][/align][align=left][b][color=black]盐酸阿替卡因(Articaine hydrochloride M.W.:320.84)[/color][/b][/align][align=center][b][color=black] [/color][/b][/align][color=black]在现有国家药品标准(YBH17082004-2015Z)分析方法中,流动相添加了离子对试剂-庚烷磺酸钠,并在pH为2.0的强酸条件下进行相应分析,不利于色谱柱的使用寿命。大曹三耀实验室参考USP方法,以冰醋酸水溶液-乙腈作为流动相,选用CAPCELL PAK C18 MGII色谱柱,实现了复方盐酸阿替卡因注射液中盐酸阿替卡因的定量和有关物质的良好分析(复方盐酸阿替卡因注射液由客户提供)。[/color][color=black]CAPCELLPAK C18 MGII[/color][color=black]液相色谱柱,其采用高纯度硅胶作为基质,通过减少硅胶微细孔的数量来增大有效比表面积;并且采用新包被技术Ultimate Polymer Coating,实现了对硅醇基极大程度的封锁,兼具分离性能和普适性能,通用性非常好。[/color][align=left][b][color=#0070c0]实验方法[/color][/b][/align][align=left][img=,500,358]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211037456969_5082_2297_3.jpg!w730x523.jpg[/img][/align][align=left]图1[color=black]盐酸阿替卡因[/color]对照品及供试品溶液[/align][align=left][img=,500,248]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211038541919_2603_2297_3.jpg!w572x284.jpg[/img][/align][align=center][/align][align=center][/align][color=black]为进行有关物质分析,该实验将注射液样品以流动相稀释100倍,作为有关物质供试品溶液,再将该有关物质供试品溶液以流动相进一步稀释100倍,作为自身对照溶液。以冰醋酸水溶液-乙腈作为流动相,选用CAPCELL PAK C18 MGII色谱柱,通过调整流动相比例及柱温,最终在18%乙腈、柱温30℃条件下实现了盐酸阿替卡因供试品溶液及对照品的良好分析。[/color]如图2、3,使用CAPCELL PAK C18 MGII色谱柱进行分析,盐酸阿替卡因和有关物质均能得到良好分析结果,主峰与峰前杂质得到了良好分离,分离度为1.90(见表1)[img=,400,311]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211045536855_9516_2297_3.jpg!w574x447.jpg[/img][img=,400,295]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211045540875_8483_2297_3.jpg!w698x516.jpg[/img][align=left] 图2 [color=black]盐酸阿替卡因[/color]有关物质供试品溶液及空白 图3 自身对照溶液[/align][align=center][/align][align=left]表1 有关物质结果详表[/align][align=left][img=,600,323]https://ng1.17img.cn/bbsfiles/images/2019/03/201903211042513275_6690_2297_3.jpg!w786x424.jpg[/img][/align][align=center][/align]综上实验结果,使用CAPCELL PAK C18 MGII S5 4.6mm i.d.×250 mm色谱柱,以冰醋酸水溶液-乙腈为流动相体系,在30°C柱温条件下,能够实现复方盐酸阿替卡因注射液中盐酸阿替卡因的定量和有关物质的良好分析。[color=black] [/color]
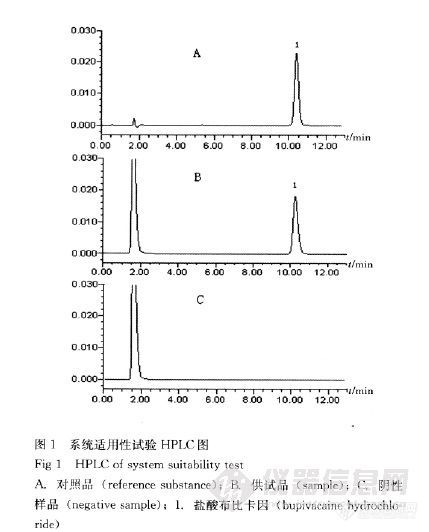
作者:兰文; 杨汉初; 黄莉;(湖南省药品检验所;)摘要:目的建立反相高效液相色谱法测定复方明矾布比卡因注射液的有关物质及盐酸布比卡因的含量。方法采用Diamonsil C18柱,以乙腈-磷酸盐缓冲液(取磷酸二氢钾1.94g,磷酸氢二钾2.48g,加水溶解并稀释至1 000mL,调节pH 6.8)(65∶35)为流动相;流速为1.0mL.min-1;有关物质检测波长为215nm,含量测定检测波长为263nm;柱温:30℃。结果在该色谱条件下,杂质峰与主峰均能有效分离,盐酸布比卡因在44.31~177.26μg.mL-1与峰面积线性关系良好(r2=0.999 7);平均回收率为99.7%(n=9),RSD=0.4%。结论本法简便、快速、准确,专属性好,可用于复方明矾布比卡因注射液的质量控制。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208061043_381724_1606903_3.jpg
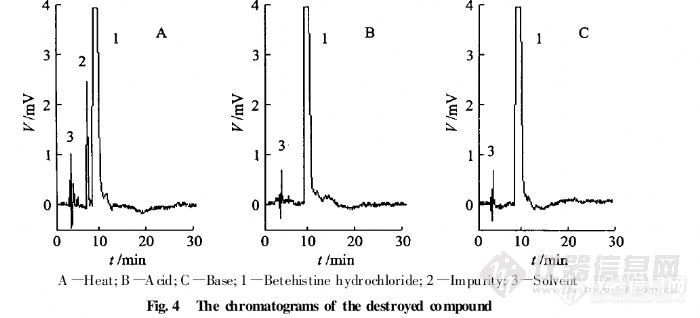
【作者】 陆榕; 孙进; 方金玲; 孙英华; 刘晓红; 何仲贵;【机构】 沈阳药科大学药学院; 沈阳药科大学药学院 辽宁沈阳110016; 辽宁沈阳110016;【摘要】 目的用离子对HPLC法测定盐酸倍他司汀注射液中药物及有关物质含量。方法色谱柱:Diamonsil C18柱(200 mm×4.6 mm,5μm);流动相:甲醇10 mmol.L-1醋酸钠溶液(含5 mmol.L-1庚烷磺酸钠,体积分数为0.2%的三乙胺,用冰醋酸调pH至3.3)(25∶75),检测波长:261 nm,流速:1.0 mL.min-1,柱温:室温。结果盐酸倍他司汀质量浓度在1~250 mg.L-1内线性关系良好(r=0.999 9),平均回收率为99.8%,RSD=1.0%。盐酸倍他司汀的理论塔板数大于2 000,盐酸倍他司汀与其主要杂质分离度不低于1.5。结论适用于盐酸倍他司汀注射液中药物与有关物质的含量测定。http://ng1.17img.cn/bbsfiles/images/2012/07/201207251621_379666_2379123_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/07/201207251623_379668_2379123_3.jpghttp://ng1.17img.cn/bbsfiles/images/2012/07/201207251623_379670_2379123_3.jpg
紫外分光光度法测定盐酸麻黄素注射液含量关键词: 麻黄素;可见和紫外分光光度法[摘要] 目的:探讨盐酸麻黄素注射液含量测定的新方法,以求更快速、准确地适应临床用药需要。方法:用不同厂家不同批号的盐酸麻黄素注射液做供试品,用标准麻黄素做对照品,用紫外分光光度计测出标准品的最大吸收度,求出浓度与吸收度关系,得其回归方程,测其回收率。求出含量与药典法进行比较。结果:在256±1 nm处有最大吸收,以256 nm为测定波长,盐酸麻黄素浓度与吸收度呈标准曲线线性范围0.2~1.2 mg/ml(r=0.999 9),平均回收率为(100.31±1.02)%,两种方法测定结果差异无显著性(P>0.05)。结论:紫外分光光度法,可以做为盐酸麻黄素注射液含量测定的新方法。[中国图书资料分类法分类号] R 974.3;O 657.32 [文献标识码] A[文章编号] 1000-2200(2000)05-0380-02 盐酸麻黄素是拟肾上腺素药,目前对该病及其制剂的含量测定方法有非水滴定法[1]、银量法[1]及中和法[2]。本文采用紫外分光光度法[1],测定盐酸麻黄素注射液的含量[3],并与1995年版药典的非水滴定法进行比较,兹作报道。1 材料与方法1.1 仪器 Du-640型紫外分光光度计(美国贝克曼公司)。1.2 试药 盐酸麻黄素对照品,盐酸麻黄素注射液(上海信谊制药厂,批号951201-1,951201-2;无锡市第七制药厂,批号960117-1,960117-2,960610;规格均为1 ml∶50 mg)。1.3 测定方法 (1)盐酸麻黄素紫外吸收光谱:取盐酸麻黄素对照品适量,用蒸馏水溶解并配制成0.6 mg/ml的溶液,以蒸馏水为空白,在230~300 nm波长之间扫描,在256±1 nm波长处有最大吸收,故采用256 nm为测定波长。(2)标准曲线的绘制:精密称取经105℃干燥至恒重的盐酸麻黄素对照品50 mg,置25 ml量瓶中,加水溶解并稀释至刻度,摇匀。精密量取该药液1.0、2.0、3.0、4.0、5.0、6.0 ml分别置10 ml量瓶中,加水稀释至刻度,摇匀,以水为空白,在256 nm处分别测定吸收度。结果表明,在0.2~1.2 mg/ml浓度范围内,浓度与吸收度呈良好的线性关系。得其回归方程为:A=0.8256 C+0.012 0(r=0.999 9,n=6)。(3)稳定性实验:取(2)项下的各溶液于配制后0、1、2、3、4、8、16、24 h分别测吸收度,结果几无变化。(4)回收率试验:精密称取经105℃干燥至恒重的盐酸麻黄素对照品约25 mg,置50 ml量瓶中,加水溶解并稀释至刻度,以水为空白,在256 nm波长处依法测定吸收度,求出回收率。(5)样品测定:取不同批号的盐酸麻黄素注射液,精密量取1 ml,分别置于100 ml量瓶中,加水稀释至刻度,摇匀,以水为空白,在256 nm处测吸收度,计算其含量,并将本法测定的结果与中国药典1995年版收载的非水滴定法测定的结果进行比较。1.4 统计学方法 采用配对t检验。2 结果 紫外分光光度法回收率试验结果见表1;与药典法测定样品中盐酸麻黄素注射液的含量结果比较见表2。表1 回收率试验结果(n=5) 编号 加入量(mg) 测得量(mg) 回收率(%) ±s(%) 1 26.40 26.42 100.08 2 24.80 25.20 101.61 3 25.20 25.08 99.52 100.31±1.02 4 24.30 24.57 101.11 5 25.00 24.81 99.24 表2 两种方法测定结果比较(ni=15;±s) 测定方法 标示量(%) ±sd td P 紫外分光光度法药典法 100.17±1.07100.18±0.48 0.01±0.80 0.02 >0.05 3 讨论 盐酸麻黄素注射液是卫生部规定的控制药品。为保证患者用药的准确有效,防止在生产这类药品过程中盐酸麻黄素原料的流失,对其含有盐酸麻黄素的药品进行快速、简便、准确的含量测定显得尤为重要。传统的本品测定方法,不但操作过程繁琐,消耗试药量大,且非水滴定法中的醋酸汞试剂对人体有害,污染环境。 麻黄素属β肾上腺素受体激动剂,可直接或间接激动肾上腺素受体。对心血管系统、支气管平滑肌、中枢神经系统都有较强的作用。在临床上应用较为广泛且剂量要求十分准确,所以对其含量的准确、快速测定更为重要。特别是临床上经常使用“盐酸麻黄素滴鼻剂”是医院自配药品,效期短,配制频繁,在其准确的基础上,快速测定及时保证药品的临床供应,并指导临床用药有一定的意义。 两种方法测定结果差异无显著性(P>0.05),表明紫外分光光度法可以做为盐酸麻黄素注射液的含量测定新方法。且本法操作简便、快速、准确,重复性好。作者简介:郗 颖(1967-),女,安徽灵璧县人,药剂师.[参考文献][1]中华人民共和国卫生部药典委员会.中国药典二部[M].广州:广东科学技术出版社,1995.18,693~694.[2]中华人民共和国卫生部药政局.中国医药制剂规范*西药制剂[M].北京:中国医药科学技术出版社,1996.166~167.[3]熊凤英,简 洁,周淑群.紫外分光光度法测定米非司酮血药浓度[J].中国医院药学杂志,1998,18(6)∶262.

盐酸多西环素注射液(IV)含量的测定实验部分:原理:精密量取处理好的样品及对照品,稀释后注入高效液相色谱系统,C18色谱柱分离,紫外检测器检测,外标法(保留时间定性、峰面积定量)计算,得出该样品中多西环素的含量。仪器及试剂仪器:安捷伦1100高效液相色谱仪,配置紫外检测器+等度泵+柱温箱+在线脱气机等电子天平(万分之一)试剂甲醇:色谱级 已睛:色谱级 草酸铵,二甲基甲酰胺,磷酸氢二铵,氨水,盐酸均为分析纯标准物质土霉素对照品(中国兽医药品监察所生产)土霉素(化学对照品)(中国食品药品检定研究所生产)美他环素(化学对照品)(中国食品药品检定研究所生产)-多西环素(化学对照品)(中国食品药品检定研究所生产)多西环素(化学对照品)(中国食品药品检定研究所生产)色谱条件:流动相:0.05mcl/l草酸铵溶液:二甲基甲酰胺:0.2mcl/l磷酸氢二铵溶液=65:30:5(ph=8.0)柱温:35℃ 检测波长:280nm流速:1.0ml/min进样量:20um对照品及样品的制备系统性试验:称取土霉素、美他霉素、-多西环素、多西环素对照品适量,加0.01mcl/l盐酸溶液溶解并稀释制成每1ml含土霉素、美他环素、多西环素及多西环素均加0.08mg的混合溶液。上机测定:理论塔板数n不低于1500,分离度R大于1.5样品的配制1.1盐酸多西环素注射液(IV)10ml:0.5g精密量取供试品1ml,置于50ml量瓶,加0.01mcl/l盐酸溶液溶解并稀释至刻度,摇匀。精密量取2ml,置于25ml量瓶中,加0.01 mcl/l盐酸溶液溶解并稀释至刻度,摇匀。1.2对照品溶液的制备(多西环素对照品含量为85.2%)精密称取多西环素对照品约25mg,置于25ml量瓶中,加入,加0.01 mcl/l盐酸溶液溶解并稀释至刻度,摇匀。精密量取2ml,置于25ml量瓶中,加0.01 mcl/l盐酸溶液溶解并稀释至刻度,摇匀色谱图系统性试验溶液色谱图 :http://ng1.17img.cn/bbsfiles/images/2015/09/201509281558_568305_2315779_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/09/201509281559_568307_2315779_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/09/201509281604_568308_2315779_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/09/201509281604_568309_2315779_3.png 图2标准品色谱图http://ng1.17img.cn/bbsfiles/images/2015/09/201509281607_568311_2315779_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/09/201509281607_568312_2315779_3.png 图3 被测样品色谱图计算及结果 样品中被测物含量计算公式:标示量%=http://bbs.instrument.com.cn/xheditor/xheditor_skin/blank.gifA—供试品中被测物峰面积值As—对照品中被测物峰面积值Ms—对照品的重量。单位为g.M—供试品的取样量。单位为mlCs—对照品的含量。85.2%。Ds—对照品的稀释倍数。D—供试品的稀释倍数。B—样品的标示量。经计算该兽药中多西环素含量为99.7%,含量合格,符合药典规定。 结论该方法对药典方法略作修改,得到不错的检测效果。由图1可以看出,该方法的系统实验,理论塔板数为1883,分离度为4.4,满足检测条件。
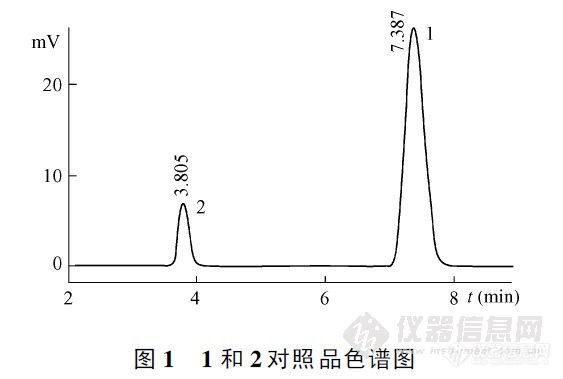
【作者】 李国栋; 张建明; 许付; 尤英微; 高申;【Author】 LI Guo Dong 1, ZHANG Jian Ming 2, XU Fu 1, YOU Ying Wei 1, GAO Shen 1 (1.Dept. of Pharmaceutics, Pharmaceutical College of Second Military Medical University, Shanghai 200433; 2.Shanghai Institute of Pharmaceutical Industry, Shanghai 200040)【机构】 第二军医大学药学院; 上海医药工业研究院; 第二军医大学药学院 上海200433; 上海200040; 上海200433; 药学专业2002届毕业生;【摘要】 建立了盐酸多巴酚丁胺葡萄糖注射液以及葡萄糖降解产物 5 -羟甲基糠醛含量的 HPL C测定法。用 DiamonsilC1 8色谱柱 ,以辛烷磺酸钠缓冲液 (p H 2 .5 ) -乙腈 -甲醇 (5 8∶ 2 8∶ 14)为流动相 ,检测波长为 2 78nm。盐酸多巴酚丁胺和 5 -羟甲基糠醛分别在 5 0~ 2 0 0 μg/ ml和 0 .2 5~ 3.5 μg/ ml范围内线性关系良好。盐酸多巴酚丁胺的方法平均回收率为 10 0 .0 % ,RSD为 1.0 %。日内和日间精密度小于 1.6 %。 更多还原【Abstract】 A HPLC method for the determination of dobutamine hydrochloride glucose injection and the related substance of glucose——5 hydroxymethyl furfuraldehyde was established. A Diamonsil C 18 column was used, with the mobile phase of sodium 1 octanesulfonate buffer solution(pH2.5) acetonitrile methanol(58∶28∶14). The detection wavelength was 278 nm. The calibration curves of dobutamine hydrochloride and 5 hydroxymethyl furfuraldehyde were linear in range of 50~200 μg/ml and 0.25~3.5 μg/ml, respectively... 更多还原【关键词】 盐酸多巴酚丁胺葡萄糖注射液; 5-羟甲基糠醛; HPLC; 测定; 【Key words】 dobutamine hydrochloride glucose injection; 5 hydroxymethyl furfuraldehyde; HPLC; determination; http://ng1.17img.cn/bbsfiles/images/2012/08/201208201145_384601_2352694_3.jpg
复方盐酸阿替卡因注射液为复方制剂,是盐酸阿替卡因与肾上腺素的灭菌水溶液,作为口腔用局部麻醉剂,适用于涉及切骨术及粘膜切开的外科手术过程。[img=,144,61]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191545418661_4518_2222981_3.jpg!w144x61.jpg[/img][color=black] [/color][color=#3e3e3e]肾上腺素 L(-)-Epinephrine M.W. : 183.2 [/color][b]在国家药品标准(YBH17082004-2015Z)[/b]中,在对复方盐酸阿替卡因注射液中肾上腺素进行分析时,使用[b]甲醇-水[/b]进行梯度洗脱,但由于[b]肾上腺素极性较强[/b],即使初始梯度为纯水相条件,肾上腺素仍紧邻死时间出峰,[b]保留不佳,易受到溶剂峰干扰,无法进行准确定量。[/b]我们分别尝试使用反相柱CAPCELL PAK C18 MGII加离子对试剂,以及直接使用离子交换色谱柱CAPCELL PAK SCX UG80两种方式,对复方盐酸阿替卡因注射液中肾上腺素和硫酸肾上腺素进行保留分析(复方盐酸阿替卡因注射液由客户提供)。CAPCELL PAK C18 MGII液相色谱柱,其采用高纯度硅胶作为基质,通过减少硅胶微细孔的数量来增大有效比表面积;并且采用新包被技术Ultimate Polymer Coating,实现了对硅醇基极大程度的封锁,兼具分离性能和普适性能,通用性非常好。CAPCELL PAK SCX UG80是强阳离子交换柱,使用高纯度硅胶,填料中金属杂质很少,使配位化合物的吸附得到了极大程度抑制,兼具聚合物和硅胶填料的优点。[b][color=#0070c0]实验方法[/color][color=#0070c0]方法一[/color][color=#0070c0]使用[/color][color=#0070c0]CAPCELL PAK C18MGII[/color][color=#0070c0]色谱柱[/color][color=#0070c0]+[/color][color=#0070c0]离子对试剂[/color][/b]如图1,对肾上腺素对照品溶液进行分析,肾上腺素主峰保留时间为5.69 min,拖尾因子为1.19,理论塔板数为12538。在相同色谱条件下,尝试对亚硫酸肾上腺素标准品及注射液中的亚硫酸肾上腺素进行分析。如图3,亚硫酸肾上腺素标准品溶液能够得到良好分析结果,注射液(客户提供的样品)中未明显见亚硫酸肾上腺素出峰,保留时间为3.55min,拖尾因子为1.14,理论塔板数为14955。[b][color=#0070c0]方法二[/color][color=#0070c0] CAPCELL PAK SCX UG80[/color][color=#0070c0]色谱柱[/color][/b][color=#000000]考虑到使用离子对试剂的流动相条件具有流动相配制麻烦、有损色谱柱寿命、平衡时间长等缺点,我们也尝试使用键合磺酸基团的强阳离子交换柱 ——CAPCELL PAK SCX UG80进行分析。[/color][color=#000000]如图4,在流动相中添加磷酸二氢铵,通过对盐浓度进行调整,在5 mmol/L磷酸二氢铵(磷酸调pH=2.5)条件下,亚硫酸肾上腺素保留时间为3.32 min,然而出现峰形拖尾现象,拖尾因子为2.0,不如CAPCELL PAK C18 MGII色谱柱添加离子对试剂所得分析结果好。[/color][align=center][/align][align=left][img=,400,284]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191547381421_926_2222981_3.jpg!w584x416.jpg[/img] [img=,400,276]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191548310561_8067_2222981_3.jpg!w572x395.jpg[/img][/align][align=left][img=,400,166]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191547576748_522_2222981_3.jpg!w612x254.jpg[/img] [img=,400,167]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191548525761_4184_2222981_3.jpg!w624x262.jpg[/img][/align][align=left]图1 MGII分析肾上腺素对照品溶液结果(离子对条件) 图2 MGII分析注射液结果(离子对条件)[/align][align=center][/align][img=,400,258]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191550354951_2539_2222981_3.jpg!w644x416.jpg[/img] [img=,400,250]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191555486850_3396_2222981_3.jpg!w644x403.jpg[/img][img=,400,147]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191551260881_9828_2222981_3.jpg!w696x256.jpg[/img] [img=,400,164]https://ng1.17img.cn/bbsfiles/images/2019/03/201903191556163846_9739_2222981_3.jpg!w632x260.jpg[/img][align=left]图3 MGII分析亚硫酸肾上腺素标准品和注射液结果(离子对条件) 图4 SCX UG80分析亚硫酸肾上腺素对照品溶液和供试品溶液[/align][align=left][/align][align=left]综上实验结果,使用中等极性色谱柱CAPCELL PAK C18 MGII S5 4.6 mm i.d. × 250 mm,在流动相中添加5 mM辛烷磺酸钠、30°C柱温条件下进行梯度洗脱,能够实现复方盐酸阿替卡因注射液中肾上腺素和亚硫酸肾上腺素的良好保留与分析。[/align][b][color=#0070c0][/color][/b][align=left][b][color=#0070c0] [/color][color=#0070c0] [/color][/b][/align]
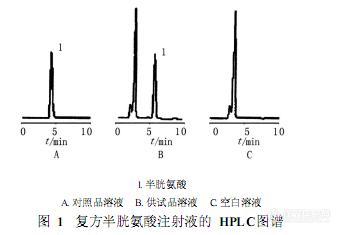
作者:靳文仙1,阎 卉2,刘 衡2,王春龙1, 2,赵广荣1(1 .天津大学化工学院 ,天津 300072; 2 .天津药物研究院 ,天津 300193)摘 要: 目的:建立以高效液相色谱法测定复方半胱氨酸注射液中半胱氨酸含量的方法。方法:采用迪马公司 C18钻石色谱柱 (250 mm × 4. 6 mm, 5μm) ,以磷酸二氢铵溶液 -甲醇 (95∶5, pH 5 . 0)为流动相 ,流速为 1 . 0 ml /min,进样量为 20μl,检测波长为 220 nm。结果:半胱氨酸在 240~560μg/ml ( r = 0 . 999 6)范围内线性关系良好 ,平均回收率为 99 . 32%(RS D = 1 . 06% , n = 9)结论:该方法操作简便快速 ,结果准确 ,可用于复方半胱氨酸注射液中半胱氨酸的含量测定。谱图:http://ng1.17img.cn/bbsfiles/images/2012/07/201207161420_377867_1606903_3.jpg
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=102822]高效液相色谱法测定复方半胱氨酸注射液中半胱氨酸的含量[/url]
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=102823]高效液相色谱法测定复方半胱氨酸注射液中半胱氨酸的含量[/url]
RT、硫酸鱼精蛋白注射液告急什么原因造成的???有知道的吗?
复方氨基酸注射液 含量测定 是用液相色谱吗?哪位大侠知道怎么弄的,指导我呀。谢啦! 我13914681818 wcj.yc@163.com
复方氨基酸注射液采用丁基胶塞密封,胶塞中的硫磺可能会浸出到注射液中,需要对药液中的硫磺含量进行测定。但是,方法学建立过程中,进行药液的加标回收率测定,发现其不合格,并且随氨基酸浓度升高,硫磺回收率降低。求助可能的原因,有哪位大神做过相关的实验吗?请不吝赐教,大谢
大家好,我不是做[url=https://insevent.instrument.com.cn/t/Wp][color=#3333ff]原子吸收光谱[/color][/url]的,但我现在在做一个注射液的砷盐限量检查,其中用到了湿法消解,由于是第一次接触,很多地方不明白,也不知道如何掌握尺度,需要向大家请教,在这里多谢了。我的检测方法是这样的:处方组成:黄芩,熊胆粉,山羊角,金银花,连翘。颜色为红棕色的澄明液体。取本品5ml,加数粒玻璃珠后加硝酸高氯酸混合液(4:1)15ml,放置5分钟后,小火缓慢加热,待作用缓和后取下放冷,沿瓶壁加硫酸5ml,升高温度至产生白烟,溶液应为无色澄明液体(必要时放冷后再加入硝酸高氯酸溶液,至有机质破坏完全,溶液澄明),放冷,加水煮沸至产生白烟为止,放冷,转移至50ml量瓶中,定容至刻度,摇匀,取4ml,加盐酸5ml和蒸馏水19ml,自“再加入碘化钾试液”起依法测定(中国药典2005年版附录IX J第一法),含砷盐不得过百万分之二。问题:1、 小火缓慢加热,待作用缓和后,小火如何控制,什么叫作用缓和,我看到论坛中的大部分方法都是这么描述的,但是我的注射液加热后就是冒红棕色的烟,反应并不剧烈,所以应该烧到什么程度,是到冒完红烟后冒白烟然后溶液变无色算消解好了么,还是烟的红色中夹杂白色但溶液仍为红色就可以了呢。2、加硫酸的目的是什么,至产生白烟,是开始产烟就取下,还是没白烟才取下,产烟是在瓶口还是在瓶内。3、加水的目的是什么,产烟的问题同上。4、我曾经这样做过:加硝酸和高氯酸后用电炉加热至溶液无色,加硫酸烧了约5分钟,加水至产生白烟,结果我的样品和标准砷斑均无颜色,也就是砷没了,这是怎么回事呢,砷在哪一步跑掉的呢。5、请大家帮我算一下限度是否是百万分之二,我不会算。请经验丰富的同仁们多多帮忙了。
喜炎平脉络宁注射液引起严重过敏2012年06月27日08:47新华网国家食品药品监督管理局26日发布通报,提示生产企业和医患人员关注喜炎平注射液和脉络宁注射液引起严重过敏反应的问题。据了解,喜炎平注射液的成分是穿心莲内酯磺化物,主要用于解热消炎。2011年,国家药品不良反应监测中心病例报告数据库有关喜炎平注射液的病例报告数共计1476例,其中涉及14岁以下儿童报告达1048例。主要不良反应表现为过敏样反应、过敏性休克、紫绀、呼吸困难等。脉络宁注射液是2009版国家基本药目录品种,其功能与主治为清热养阴、活血化瘀。用于血栓闭塞性脉管炎、动脉硬化性闭塞症、脑血栓形成及后遗症、静脉血栓形成等。2011年,国家药品不良反应监测中心病例报告数据库共收到有关脉络宁注射液药品不良反应病例报告1500例,其中严重病例报告189例。严重不良反应主要为呼吸系统损害、全身性损害和心血管系统损害等。国家食品药品监管局建议,由于这两种注射液易发生过敏反应,建议医护人员在用药前详细询问患者的过敏史,特殊人群和过敏体质者应慎重使用。使用时应严格按照说明书规定的用法用量给药,不得超剂量使用;谨慎联合用药。如确需联合使用其他药品时,应谨慎考虑与此两种药品的间隔时间以及药物相互作用等问题。对于药品生产企业,国家食品药品监管局建议,加强临床合理用药的宣传,确保产品的安全性信息及时传达给患者和医生;完善生产工艺、提高产品质量标准,开展相应安全性研究。(新华网)
我测的是注射液里的钠,钾,铯,可是注射液里有葡萄糖和枸橼酸,是不是必须硝化啊,硝化的方法在那里着找啊,我是新手,忘各位前辈指点指点。我在一些专利网上没有查到。
哪 位朋友有氨基酸注射液含量的液相检测方法,传过来学习一下。谢谢!
月桂酰精氨酸乙酯盐酸盐,请问有做过HPLC含量检测吗?求方法或者检测波长,谢谢!
注射液内含毛发异物 山东齐都药业身陷“质量门” 近日,国家食品药品监管总局(以下简称“药监总局”)发布公告指出,吉林省长春市一诊所发现山东齐都药业有限公司(以下简称“齐都药业”)生产的盐酸左氧氟沙星氯化钠注射液有类似毛发状异物。事发后,涉事产品被该公司业务员销毁,该公司生产管理体系存在缺陷。目前,山东省食品药品监督管理局已责令该企业停产整顿,并对涉事批次药品按劣药论处。 记者发现,其实早在2014年7月,该产品的说明书修订问题就曾被人投诉;而在此前的2014年5月,齐都药业生产的替硝唑片也曾被江苏省药监局部署采取查控措施,该公司为何频繁曝出药品质量问题?停产整顿 2月6日,药监总局发布《关于山东齐都药业有限公司产品质量问题的通告》称,该局2015年2月6日因产品质量问题约谈山东齐都药业有限公司,山东省、吉林省食品药品监管局参加了约谈。 经查,长春市一诊所发现山东齐都药业有限公司生产的盐酸左氧氟沙星氯化钠注射液有类似毛发状异物,事发后涉事产品被该公司业务员销毁,但有关证据证明涉事产品确实存在上述问题。2月7日,齐都药业在其官网发布关于产品质量问题的道歉信,承认上述事实,并承担全部责任。 药监总局在约谈中指出,山东齐都药业有限公司生产管理体系存在缺陷,必须立即开展自查,尽快找出药品生产质量管理体系中存在的问题,及时向监管部门提出整改报告。另外,山东齐都药业有限公司业务员销毁证据、掩盖事实的行为,严重违反《药品生产质量管理规范》诚实守信的基本要求,性质极其恶劣,总局已责成山东省食品药品监管局对该企业依法处理。 据记者了解,山东齐都药业有限公司生产的涉事盐酸左氧氟沙星氯化钠注射液批号为C13042201,总计21700瓶,2013年4月22日生产,有效期至2015年3月底。产品销往吉林8000瓶、河北10500瓶、黑龙江2300瓶、辽宁900瓶。药监总局已要求上述省食品药品监管部门关注产品的流通使用情况,采取有力措施监督企业召回产品;同时要求药品不良反应监测机构加强监测,发现不良反应事件及时报告并依法予以处置。 公开资料显示,齐都药业主要生产大容量注射剂、片剂、胶囊剂、冲洗剂、原料药等172个品种规格的产品。企业大输液产销量排名全国第三位,单体工厂全国第一位。 “事件发生后,公司主动采取召回措施,对该批次产品实施召回。组织专业人员对质量管理体系的各个环节进行自查,排查分析问题原因,并及时采取相应整改措施。还派出相关人员,就有关问题积极进行协调处理。”齐都药业在道歉信中表示。 2月16日,山东省药监局公开表示,药监总局通告山东齐都药业有限公司盐酸左氧氟沙星氯化钠注射液事件后,省局立即成立联合调查组对该企业进行了全面监督检查。一是监督企业全力召回所有涉事产品,截至2015年2月12日,该企业已完成召回工作,经终端使用单位确认,涉事批次药品已全部销售使用;二是监督山东齐都药业有限公司停产整顿,深入查找风险隐患和管理上存在的漏洞,确保类似问题不再发生,整改完成后由省局进行全面检查,符合相关要求后方可恢复生产;三是对涉事批次药品按劣药论处,依照有关法律法规严厉处理;四是监督企业质量保证体系运行和整改措施落实,并采取有效措施,确保药品生产质量安全。 3月5日,齐都药业办公室崔主任在电话里向本报记者表示,药监部门正在对“异物门”事件进行调查,还没有最终处理结论,该公司现在对此不便回应。屡现问题 据记者了解,左氧氟沙星是氧氟沙星的左旋体,属第三代喹诺酮类药物。左氧氟沙星注射剂是临床使用广泛的抗感染药,因其抗菌谱广、疗效好、使用方便等原因,在抗菌治疗领域发挥着重要作用。然而,随着药品的大量应用,其不良反应也日益突显。 2009年5月,国家药监总局第22期药品不良反应信息通报指出,左氧氟沙星注射剂严重病例报告突出,建议药品生产等加强临床合理使用抗菌药物的教育与宣传,充分告知医生和患者可能存在的潜在风险。 2012年12月31日,国家药监总局(国食药监注373号)通知:“决定对左氧氟沙星(包括盐酸左氧氟沙星、甲磺酸左氧氟沙星、乳酸左氧氟沙星)口服和注射剂说明书进行修订。药品生产企业要尽快修订说明书及标签的相关内容,按照有关规定进行备案。”新版说明书增加了相关警示语、不良反应警示语、不良反应等相关内容。 2013年8月2日,国家药监总局发布第56期通报指出,2012年,收到左氧氟沙星注射剂严重不良反应/事件病例报告1431例,占总例次的60.24%。要求生产企业修改完善药品说明书相关内容,保障公众用药安全。 2013年11月21日,药监总局第58期通报“及时修订氟喹诺酮类药品的产品说明书,更新相关的用药风险信息如不良反应、注意事项等,以有效的方式将氟喹诺酮类药品的风险告知医务人员和患者”。 据山东省田先生向记者反映,截至2014年7月,齐都药业药品“迪诺新”盐酸左氧氟沙星氯化钠注射液仍在使用2007年5月核准的说明书。 事实上,早在2014年5月,齐都药业生产替硝唑片就因说明书问题被江苏省药监局部署采取查控措施。 据无锡市锡山食品药品监督管理局官网信息显示,按照省局紧急通知要求,该局第一时间部署查控问题药品工作,督促辖区内相关经营企业及医疗机构开展排查,对库存的山东齐都药业有限公司生产的替硝唑片(批号:1312041,规格:0.5克),立即停止经营使用,并采取暂控等措施,同时要求上报库存产品数量以及举一反三检查相近批次的药品说明书情况。 经统计,锡山区涉及问题药品零售及使用单位2家,药品批发企业1家,涉及药品销售数量为300盒。2014年5月9日下午13时,辖区药品批发企业下发药品召回通知,开展涉及药品的召回工作。截至2014年5月12日下午16时,已召回110盒。据业内人士介绍,2013年10月16日,药监总局办公厅发布关于修订替硝唑口服片剂和胶囊剂说明书的通知。为保障公众用药安全,根据国家食品药品监督管理总局监测评价结果,决定对替硝唑口服片剂和胶囊剂说明书进行修订。要求生产企业在2013年12月15日前,依据《药品注册管理办法》等有关规定提出修订说明书的补充申请报备案。说明书的其他内容应当与原批准内容一致。补充申请批准之日起生产的药品,不得继续使用原药品说明书。 上述人士分析认为,无锡药监部门要求举一反三检查相近批次的药品说明书情况,这说明可能是齐都药业修订说明书的补充申请批准后,该批次替硝唑片继续使用了原药品说明书,从而导致被药监部门采取查控措施。 替硝唑片被药监部门采取暂控等措施的最终处理结果如何?(迪诺新)盐酸左氧氟沙星氯化钠注射液是什么时候开始按照药监总局要求修改产品说明书的?患者田先生的反映是否属实? 对此,崔主任仅向记者表示:“这件事情已经过去很久,没有什么新闻价值,你就不要关注了。”
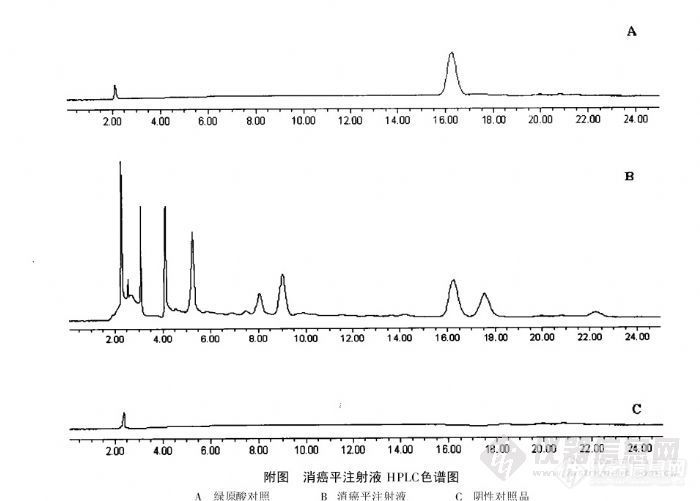
【作者】:王青【摘要】: 目的: 建立消癌平注射液中绿原酸含量测定的 HPLC法。方法: 采用 H PLC 法, 色 谱条件: D iamonsil C18色谱柱( 200mm @ 4. 6mm, 5Lm ); 以乙腈 - 0. 4% H 3PO4溶液 ( 13z 87) 为流动 相; 流 速为 1. 0m l# m in- 1, 用 二极管 阵列检 测器检 测, 检测波长 327nm, 柱温 30e 。结 果: 绿 原 酸 在 0. 00944Lg ~ 0. 08496Lg 内 呈 良 好 的 线 性 关 系 ( r = 0. 9996 ); 平 均 回 收 率 为99. 01% , RSD 为 1. 21% ( n= 5) 。结论: 本方法快速、简便, 结果准确、可靠, 可用于消癌平注射液中绿 原酸的含量测定。【作者单位】:湖南中医学院第二附属医院【关键词】: 消癌平注射液; 高效液相色谱法; 绿原酸http://ng1.17img.cn/bbsfiles/images/2012/07/201207311313_380834_1838299_3.jpg
在英国药典附录colour of solution中指描述了标准比色液的配制,但如果注射液正文中没有对颜色的描述,是否就表明对该品种的颜色不做要求呢?还是说没有描述就是要求澄清无色?药典的其他地方有没有溶液颜色的规定?请指点,谢谢!
[center]脑蛋白水解物注射液药品标准不完善[/center] 据国家药监局网站消息,为确保公众用药安全,国家药监局日前通知要求各地进一步加强对脑蛋白水解物注射液的监督检查。 通知称,在全国开展注射剂类药品生产工艺和处方核查工作中,发现脑蛋白水解物注射液品种在药品标准和执行工艺处方等方面存在着较为突出的问题,主要是企业选用猪脑原料的质量标准不完善;企业之间现行生产工艺差别较大;猪脑水解所用的蛋白酶种类、酶量及水解温度、时间等不一致,甚至有补加氨基酸的行为。针对上述突出问题,部分地区已采取了控制措施。 通知指出,一、要充分认识到脑蛋白水解物注射液在产品质量方面存在的安全风险,各地应在注射剂类药品生产工艺和处方核查工作的基础上,积极组织力量认真做好监督检查工作。要建议辖区内脑蛋白水解物注射液生产企业主动停止该品种的生产,并要求脑蛋白水解物注射液生产企业按相关技术要求,组织开展改进工艺和质量控制方法的研究工作,在相关工艺改进和质量标准未经批准前,暂不宜恢复生产。 二、对于生产企业认为其脑蛋白水解物注射液生产工艺合理、质量可控,继续进行生产的,所在地省级食品药品监督管理局应对其生产全过程予以跟踪检查,并对监督生产的产品进行现场抽样,由省级药品检验所检验。 凡生产企业存在未按批准变更生产处方工艺生产,或在制成品中补加氨基酸等违法违规行为,以及现场抽样检验不合格的,应依法予以严厉查处。 三、国家局将组织有关专家开展脑蛋白水解物注射液有效性、安全性评价工作,组织对脑蛋白水解物注射液生产工艺的改进、质量控制标准的提高工作,并在此基础上提出监管措施和改进意见。信息来源:中国新闻网
国家药品不良反应监测中心病例报告数据库共收到2011年有关盐酸氨溴索注射剂药品不良反应/事件病例报告2973例,其中严重病例报告169例,主要不良反应表现依次为:过敏样反应、呼吸困难、过敏性休克。分析显示,盐酸氨溴索注射剂在临床上存在不合理使用现象,其中在儿童病例中尤为突出。在169例严重病例中,有79例为儿童用药病例,且用药剂量超出剂量范围为51例,占全部严重病例的64.56%。盐酸氨溴索注射剂在临床上存在哪些不合理使用现象?如何做好盐酸氨溴索注射剂安全用药,保障公众用药安全?
想配制一个不含主药成分的注射液空白,看了下某注射液的辅料,为丙二醇,但没写浓度。有人告诉我大概就按照1%~10%的浓度配制这个辅料溶液就可以了,但我一估算,主药成分是10ml:0.1g,相当于1%的浓度。想不到名为辅料,这个浓度居然跟主药浓度相当甚至还超过啊,所以有点吃不准,特来请教各位老师,还望赐教。

[b] 几种不同方法定性测定中药注射液不同工序中的鞣质第一法:[/b]实验目的:建立XX注射液鞣质检测方法一、所用仪器和试剂1.1、电子分析天平:Mettler Toledo PL 4031.2、试剂及样品:氯化钠 批号20150127 天津市福晨化学试剂厂 三氯化铁 批号20160327 天津市福晨化学试剂厂 鸡蛋 样品:XX注射液 20170207 超滤前、后样品(未加吐温80)、加吐温80后样 20170209 超滤前、后样品(未加吐温80)、加吐温80后样品 20161035(成品二 、实验依据2.1、鸡蛋清法:取注射液1ml,加新配置的含1%鸡蛋清的生理氯化钠溶液5ml,放置10分钟,观察是否出现浑浊或沉淀。2.2、与三氯化铁反应:取注射液1ml,加1%三氯化铁溶液2滴,如为可水解鞣质,溶液变为蓝-深蓝色(沉淀),如为缩合鞣质,溶液将变为绿-绿黑色(沉淀)。三、实验过程:3.1、1%鸡蛋清氯化钠溶液配制:称取0.902g氯化钠置于烧杯在,加水适量使溶解并稀释至100m,制成0.9%的氯化钠溶液;取1ml鸡蛋清,并加入0.9%的氯化钠溶液稀释溶解为100ml,即得。3.2、1%三氯化铁溶液配制:称取氯化铁1.042g置于烧杯中,加水适量使溶解并稀释至100ml,摇匀,即得。3.3、分别量取20170207、20170209批次个样品1ml置于试管中(两管),一管中加入5ml1%鸡蛋清生理氯化钠溶液,另一管加入1%三氯化铁溶液1ml,摇匀,放置10min,观察。四、实验结果与讨论4.1、加入1% 鸡蛋清生理氯化钠溶液的各样品澄清,无浑浊或沉淀生成;4.2、加入1%氯化铁溶液的各样品,颜色变为深棕色,加吐温80样品与未加样品颜色相同,尤其20161035批成品颜色最深(棕黑色),提示样品中含有鞣质成分;4.3、可能样品中鞣质成分较少,试验未生成明显的鉴别颜色,不能区分水解鞣质或缩合鞣质。[img=,555,206]http://ng1.17img.cn/bbsfiles/images/2017/09/201709101037_01_2204446_3.png[/img] 图一 图二图一显橙黄色的溶液为未加试剂的空白样品,深棕色的为1%氯化铁后样品,从左至右依次为20170207超滤前、超滤后样品,20170209超滤前、超滤后样品,20170207加吐温80后样品,20170209加吐温80后样品图二为20161035(成品)从左至右依次为加1% 鸡蛋清生理氯化钠溶液、1%氯化铁溶液、空白溶液[b]第二法:[/b]一、实验依据:1.1、生物碱类-胺类反应量取供试品溶液,加入吡啶的稀溶液,如有鞣质,应产生白色沉淀。1.2、可水解鞣质和缩合鞣质的定性区别量取供试品溶液,加入0.1mol/L盐酸溶液共沸,如有水解鞣质,将被水解为酚酸,如有缩合鞣质,将生产暗红色的鞣红沉淀。二、仪器及主要试剂2.1、电子分析天平:Mettler Toledo PL403 2.2、试剂及样品2.2.1、试剂:盐酸、吡啶 AR 级2、样品:XX注射液 20170207 超滤前、后样品(未加吐温80)、加吐温80后样 20170209 超滤前、后样品(未加吐温80)、加吐温80后样品三、试验过程3.1、分别量取20170207、20170209批次各样品2ml置于试管中,加入吡啶的稀溶液数滴,未生成浑浊或白色沉淀。3.2、分别量取20170207、20170209批次各样品2ml置于试管中,加入0.1mol/L盐酸溶液2ml共沸,皆未生成浑浊或暗红色的鞣红沉淀。[b][/b]四、试验结果讨论4.1由试验推测XX注射液含微量的可水解鞣质。[img=,450,255]http://ng1.17img.cn/bbsfiles/images/2017/09/201709101048_01_2204446_3.png[/img] 图三4.2、图三为 20170207超滤前、超滤后样品,20170209超滤前、超滤后样品,20170207加吐温80后样品,20170209加吐温80后样品[b]第三法:一、实验依据[/b]1.1、量取供试品溶液,加入5%的硫酸溶液共沸,可水解鞣质无沉淀,缩合鞣质生成鞣红沉淀。1.2、量取供试品溶液,加入1%的香草醛-硫酸溶液共沸,可水解鞣质显无色,缩合鞣质生成棕色。[b]二、[/b]仪器、试剂及样品2.1、电子分析天平:Mettler Toledo PL403 中药-0342.2、试剂:硫酸 AR 批号 20170526 北京化工厂 香草醛 AR 批号 20150806 天津市光复科技发展有限公司2.3、样品:XX注射液 20170207 超滤前、后样品(未加吐温80)、加吐温80后样品 2 0170209 超滤前、后样品(未加吐温80)、加吐温80后样品三、试验过程3.1、配制5%的硫酸溶液、1%的香草醛-硫酸溶液3.2、分别量取20170207、20170209批次各样品2ml置于试管中,加入5%的硫酸溶液1ml,共沸,未生成沉淀,溶液颜色变为浅棕色。3.3、分别量取20170207、20170209批次各样品2ml置于试管中,加入1%的香草醛-硫酸溶液10滴,溶液变为棕色且有沉淀生成。四、结果分析由反应3.1得供试品中含微量缩合鞣质;由反应3.2得供试品含有一定的缩合鞣质。[img=,508,424]http://ng1.17img.cn/bbsfiles/images/2017/09/201709101100_01_2204446_3.png[/img]样品顺序从左至右为:20170207超滤前、超滤后样品,20170209超滤前、超滤后样品,20170207加吐温80后样品,20170209加吐温80后样品[b]第四法:[/b]一、实验依据参考:【1】雷其云、赵越平等,用薄层层析法检测鞣质.中国中药杂志,1997,22(5):287-289. 【2】龙云惠、黄兆龙等,用薄层层析法检测石榴皮的鞣质.红河学院学报,2005,3(6):25-26.二、仪器、试剂及样品2.1、电热鼓风干燥箱 型号WGL-125B 北京中仪泓瑞科技发展有限公司2.2、薄层色谱仪: CAMAGTLC VISUALIZER 厂家:Made inSwitzerland CatNo.022.9782.3、试剂:甲苯 AR500ml 20170216 北京化工厂乙酸乙酯AR 500ml 20130416北京化工厂甲酸乙酯 AR 500ml 20151207 天津市福晨化学试剂厂甲酸 AR 500ml 20141017 天津市福晨化学试剂厂三氯化铁AR 500g 20160327 天津市福晨化学试剂厂硫酸 AR 批号 20170526 北京化工厂香草醛 AR 批号 20150806 天津市光复科技发展有限公司2.4、样品:XX注射液 20170207 超滤前、后样品(未加吐温80)、加吐温80后样品20170209 超滤前、后样品(未加吐温80)、加吐温80后样品三、实验过程 3.1、预先将硅胶G板置于105℃烘箱中活化30min 预先配制展开剂Ⅰ:甲苯-乙酸乙酯-甲酸(80:50:8) 3.2、展开剂Ⅱ: 甲苯-甲酸乙酯-甲酸(1:5:1)分别置于展开缸中饱和。 3.3、分别取各样品2μl、5μl点样,分别置展开剂Ⅰ、Ⅱ中展开,取出,晾干,分别喷以1%氯化铁溶液、1%香草醛硫酸溶液,并分别置日光、254nm、366nm下检视。四、结果分析XX注射液20170207、20170209在展开剂Ⅰ、Ⅱ条件下展开后,分别喷以1%氯化铁溶液、1%香草醛硫酸溶液显色,日光下均未显明显的颜色斑点,可能含鞣质含量较低,在254nm\366nm下显示的荧光斑点需用对照品确认.[img=,581,327]http://ng1.17img.cn/bbsfiles/images/2017/09/201709101112_01_2204446_3.png[/img][img=,598,337]http://ng1.17img.cn/bbsfiles/images/2017/09/201709101113_01_2204446_3.png[/img]展开剂:甲苯-乙酸乙酯-甲酸(80:50:8)从左往右,样品分别为20170207超滤前2μl、超滤后2μl、超滤后5μl、加吐温80后2μl[img=,608,341]http://ng1.17img.cn/bbsfiles/images/2017/09/201709101115_01_2204446_3.png[/img][img=,602,346]http://ng1.17img.cn/bbsfiles/images/2017/09/201709101116_01_2204446_3.png[/img]总结与讨论: 上述四种不同测定方法对中药注射剂中的鞣质进行了定性测定,只测到了少量的水解鞣质和缩合鞣质,几种方法只能做定性测定,由于缺少对照品第四法还不能定量测定。[list=1][/list]