如何让脂溶性维生素与水溶性维生素互溶?
我们在实验中酶解的效果不好,明显有颗粒存在,维生素B6的测定值小于检出限了,但是百度到有说大米中富含维生素B6。有没有前辈做过大米中的水溶性维生素,特别是维生素B1、B2和B6这几个需要酶解的项目。请教大侠:1.需要将样品粉碎到一个什么样的粒度;2.按照标准操作酶解的效果怎样;3.大米中维生素B6在一个什么水平。
引言脂溶性维生素(FSV)包括维生素A、D、E、K及类胡萝卜素(例如β-胡萝卜素)。脂溶性维生素参与许多与重要生理功能相关的复杂代谢反应,例如视力(维生素A)、钙吸收(维生素D)、细胞膜的抗氧化(维生素E)、及血液凝固(维生素K)。1β-胡萝卜素是维生素A的前体,且在人体内具有100%维生素A活性。番茄红素不是人体的必需营养素,但它的抗氧化性能使它广受欢迎,越来越多地与其他成分一起被添加到某些膳食补充剂中。几种脂溶性维生素的化学结构如图1所示。http://file1.foodmate.net/file/upload/201311/26/14-43-24-13-510998.jpg维生素及营养补充剂是一个价值几十亿的市场。预计在未来的五到十年,这一市场仍将继续增长。2这是由于全世界的消费者越来越追求更好以及更健康的生活方式,以及越来越注重健康以及饮食习惯。然而,人们也越来越关注从营养补充剂以及营养强化食品中所摄取的脂溶性维生素的安全性问题,特别是维生素A及D,若过量食用,也会带来严重的健康风险。3由于在许多国家,许多针对营养强化食品及膳食补充剂中所添加微量元素的合规性的法律正在拟定或制定中,因此,市场上必然对能够快速、准确地分析不同产品中的脂溶性维生素含量的分析方法有更高的需求。目前,在进行FSV分离时,最常使用的是液相色谱(LC)方法,反向(RP)与正向(NP)方法均有。1,3-5虽然有AOAC法可用于对食品及营养补充剂当中的各种脂溶性维生素分别进行定性与定量分析,但却缺少一种可对维生素预混物中的脂溶性维生素以及类胡萝卜素同时进行分析的方法。3由于超高效合相色谱(UPC2™))分离速度快、经济耐用,因此可考虑将其用于对含有多种脂溶性维生素的药物制剂进行快速分析。6在本应用纪要中,我们阐述了一种单次进样方法,它可在四分钟时间内同时分离九种脂溶性维生素。优化后的方法在保留时间以及峰面积方面具有良好的重现性,且可用于进行高通量定量分析。
时下补充维生素成了日常保健的常见环节,但其实补充维生素不当容易中毒。维生素是人体必需的微量营养元素,但过多补充也是浪费,其中一些维生素补充过量易中毒。水溶性维生素如维生素B、C等,服用过量后可随尿液排出体外,毒性较小。而过量补充脂溶性的维生素,易引起中毒。脂溶性维生素包括维生素A、E、K、D等。其中滥用维生素E可引起高血压、乳腺肿瘤。大量服用维生素C可致泌尿系结石。服大量维C会破坏血清中及体内贮存的维生素B12。因此脂溶性维生素必须按照国家规定的量来补。
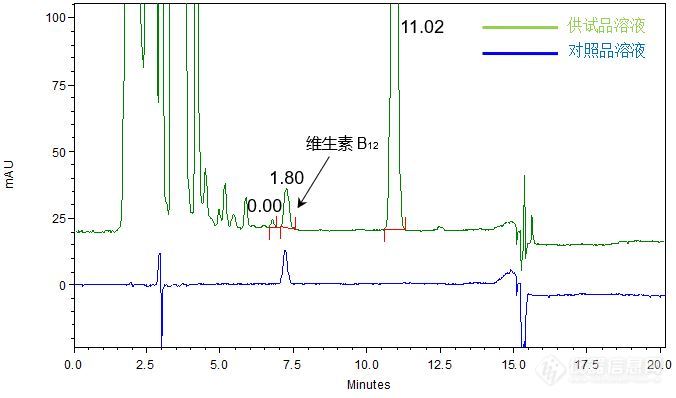
[align=center][b]注射用水溶性维生素的分析(3)[/b][/align][align=center][b]——维生素B12[/b][/align]客户提供了注射用水溶性维生素粉针剂及维生素B12对照品,要求本实验室依据客户所提供方法选择合适色谱柱,实现粉针剂供试品溶液中维生素B12主峰同其相邻杂质峰的良好分离,进而达到准确定量的目的。结合客户所提供的分析方法,由于[b]流动相为高水系条件[/b],我们直接尝试能够在100%的水系流动相下使用的[color=#ff0000][b]高极性AQ[/b][/color]色谱柱,分析对照品溶液及粉针剂供试品溶液。分析对照品溶液,维生素B12主峰保留时间为7.25 min,能够得到良好保留和峰形;分析供试品溶液,维生素B12主峰同其前后相邻杂质均能够得到良好分离,分离度分别为1. 80和11.02,满足方法中1.0的分离度要求(如图1)。[align=center][img=,676,398]http://ng1.17img.cn/bbsfiles/images/2018/01/201801161142145797_2257_2222981_3.jpg!w676x398.jpg[/img][/align][align=center]图1 CAPCELL PAK C18 AQ分析对照品及供试品溶液结果[/align][align=left]注:峰上所标数字为分离度,下同。[/align][align=left][img=,690,269]http://ng1.17img.cn/bbsfiles/images/2018/01/201801161142155690_3262_2222981_3.jpg!w690x269.jpg[/img][/align][align=left][/align][align=left]为使客户有更多的色谱柱选择,尝试使用中等极性的CAPCELL PAK C18 MGII色谱柱进行分析,也可实现供试品溶液中维生素B12及其前后杂质间的良好分离,分离度均在1.0以上,仍满足方法中1.0以上的分离度要求(见图2)。[/align][align=left][/align][align=center][img=,665,432]http://ng1.17img.cn/bbsfiles/images/2018/01/201801161143182281_3783_2222981_3.jpg!w665x432.jpg[/img][/align][align=center]图2 CAPCELL PAK C18 MGII分析对照品及供试品溶液结果[/align][align=left][/align][align=left][img=,690,266]http://ng1.17img.cn/bbsfiles/images/2018/01/201801161143186343_4699_2222981_3.jpg!w690x266.jpg[/img][/align][align=left][/align][align=left]综上实验结果,在客户提供的色谱条件下,使用[b]高极性色谱柱[color=#ff0000]CAPCELL PAK C[sub]18 [/sub]AQ S5[/color][/b] 4.6 mm i.d. × 250 mm(A6AD 04261)色谱柱及[b]中等极性色谱柱[color=#ff0000]CAPCELL PAK C[sub]18[/sub] MGII S5[/color][/b] 4.6 mm i.d. × 250 mm(A4AD 11407)均能满足注射用水溶性维生素中维生素B[sub]12[/sub]及其相邻杂质峰之间的分离要求。[/align]
最近,我在学习脂溶性维生素的测定,感觉不好测定,主要问题是2个。第一,前处理,比方说奶粉样品和肉样品,如何处理才好,2 如何用质谱测定,感觉基本没用文献资料,估计是不好测定,有做过的同志们,给点提示,谢谢
[color=#444444]想咨询一下各位大神:有测血清样品中脂溶性维生素(维生素A,D,E,K)浓度的嘛?从质谱扫分子量开始,就步步是坎坷,100ng/ml的对照品溶液扫不出来母离子,是样品不稳定还是什么原因呢,急求各位大神的指导。。。拜托拜托[/color]
各位专家好,有问题急需求教。测定水溶性维生素,流动相采用的是甲醇(A)与0.02mol/L磷酸二氢钾(B),初始配比是A:B=10:90,流速为1.0ml/min。开始做了一段时间,没出问题。可是近几天就出现柱压升高的问题,柱压升高经常导致漏液,实验就做不成。开始以为是样品处理不好导致,可现在是跑标准品也不行,只要一进样柱压升高很快,15cm的柱子柱压能升到200bar以上。到底是什么原因引起的呢?流动相都是过了0.45um的膜的,标品也是溶解后过了0.45um滤器后进样的。恳求各位专家指点!
复合维生素片中既有水溶性的也有脂溶性的怎么完全提起出来[color=#000000][url=http://www.so.com/s?q=%E7%BB%B4%E7%94%9F%E7%B4%A0A&ie=utf-8&src=internal_wenda_recommend_textn]维生素A[/url]、[url=http://www.so.com/s?q=%E7%BB%B4%E7%94%9F%E7%B4%A0D&ie=utf-8&src=internal_wenda_recommend_textn]维生素D[/url]、[url=http://www.so.com/s?q=%E7%BB%B4%E7%94%9F%E7%B4%A0E&ie=utf-8&src=internal_wenda_recommend_textn]维生素E[/url][/color]、维生素B1,[url=http://www.so.com/s?q=%E7%BB%B4%E7%94%9F%E7%B4%A0B2&ie=utf-8&src=internal_wenda_recommend_textn]维生素B2[/url]和维生素C
用了一个试剂盒是提取水溶性维生素的,提取液与血清1:1混合提取离心后上清直接进样,想知道这个提取液是什么?晃动后气泡出现在液面下部,加入提取液进入ep管时会呈圆珠状顺壁滑下,味道比异丙醇浅,不是异丙醇,请教各位老师!谢谢!
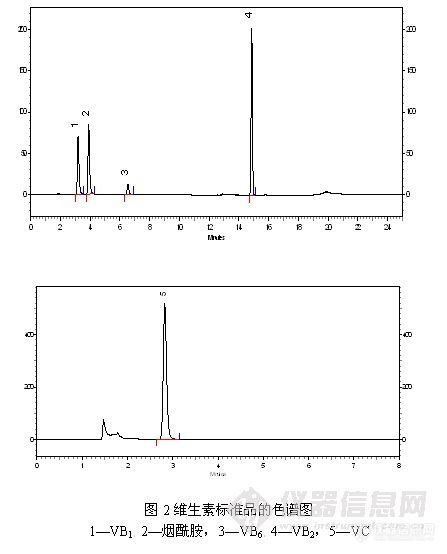
做水溶性维生素标准品,相同的标准品,第一天与第二天的谱图对比发现烟酸的峰面积变小了,同时多出来个未知峰。资料上说烟酸的性质很稳定的啊。如图,标样中有三个组分,第一个为烟酰胺、第二个未烟酸,第三个为维生素B6。标样配好后第一天做样出峰是正常的,第二天在做时烟酸的峰面积就变小了,同时维生素B6后面还多出了一个未知峰。[img=,690,329]http://ng1.17img.cn/bbsfiles/images/2018/03/201803130923380880_4604_2524385_3.png!w690x329.jpg[/img][img=,690,298]http://ng1.17img.cn/bbsfiles/images/2018/03/201803130924258860_4144_2524385_3.png!w690x298.jpg[/img]
求助:谁有最新的用高效液相测定水溶性维生素的检测方法?求分享http://simg.instrument.com.cn/bbs/images/default/em09511.gif
维生素是维持生物体正常机能的必不可少的一大类有机物质,虽然机体对这类物质的需求量很小,但却十分重要。其中水溶性维生素与人体的生长发育和健康密切相关,尤以维生素C和B族维生素为重。维生素常被作为营养强化食品的添加因子,广泛存在于谷类、果蔬、肉禽和蛋类等加工食品中,因此,维生素的检测对食品、饮料、医药和饲料领域都有非常重要的意义。水溶性维生素的测定方法主要包括微生物法、荧光法和高效液相色谱法等。其中微生物法实验周期长,荧光法也费时,且不能同时测定多种维生素。高效液相色谱法样品前处理简单,样品用量少,分离速度快,可同时测定多种水溶性维生素。1 仪器与试剂HITACHI L-2000高效液相色谱仪、配L-2400紫外检测器,各种试剂均为色谱纯或分析纯,实验用水为超纯水,维生素对照品均为Spluco标准品。样品为市售维生素片。2 样品处理取待测样品数片碾细混匀,精确称量0.1~3g至100mL棕色容量瓶中,测定VC用3%的偏磷酸溶液定容,其它加去离子水至刻度,超声波震荡助溶10min,过滤后取滤液经0.45μm微孔滤膜后进样。以上操作过程均在避光条件下进行。3 色谱条件色谱柱: ZORBAX SB-Aq柱(5μm,250×4.6mm);流速1.4mL/min;柱温:40℃;进样量:20μL;流动相:A:乙腈,B:1%的三氟乙酸溶液时间(min)A(%)B(%)[tr

水溶性维生素分离的难点:水溶性维生素都是极性很强且分子量较小的化合物,在常规C18 柱上保留较弱,需要在高水相条件下运行,对柱子的耐水性有极大考验。色谱条件:色谱柱规格:150 x 4.6 mm ID, 5 μm;流动相:甲醇/ 10 mM 磷酸缓冲液( pH 7.0)=3/97;流速:1.0 mL/min;柱温:室温;检测器:UV 254 nm;样品1. 抗坏血酸 2. 维生素B13 3. 吡哆胺 4. 吡哆醛 5. 吡哆醇 6. 烟酰胺 7. 维生素B1http://ng1.17img.cn/bbsfiles/images/2015/03/201503061450_537416_2452211_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/03/201503061450_537417_2452211_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/03/201503061450_537418_2452211_3.pnghttp://ng1.17img.cn/bbsfiles/images/2015/03/201503061450_537419_2452211_3.png总结:Spursil C18 色谱柱在该条件下表现出了极其优异的选择性和分离度。备注:以上谱图,仅表示在此条件下的分离情况,不代表所有应用哈~
请教:注射用水溶性维生素中关于烟酰胺、等5项的液相检测方法其标准为烟酰胺、盐酸吡哆辛、硝酸硫胺、泛酸钠、维生素C钠和核黄素磷酸钠 照高效液相色谱法(中国药典1995年版二部附录Ⅴ D)测定。 色谱条件与系统适用性试验 用氨基键合多孔硅胶为填料,以(0.02mol/L)磷酸二氢钾溶液-乙腈(27:73),用10%盐酸溶液调节pH为5.3的溶液为流动相,流速为1.5ml/min,检测波长:烟酰胺、盐酸吡哆辛、硝酸硫胺、泛酸钠、维生素C钠为214nm;核黄素磷酸钠用萤光检测λEX=445nm、λEM=520nm。各组分的分离度应符合要求。 对照品溶液的制备 (1)取烟酰胺对照品约150mg、硝酸硫胺对照品约12mg、盐酸吡哆辛对照品约18mg、泛酸钠对照品约62mg,分别精密称量置50ml量瓶中,加水溶解并稀释至刻度摇匀,精密量取2ml置50ml量瓶中,用流动相稀释至刻度,摇匀,即为对照品溶液(Ⅰ),此溶液置暗处充氮气于零下20℃可保存1个月。(2)取维生素C钠对照品约425mg、核黄素磷酸钠对照品约19mg,精密称定,置50ml量瓶中加水溶解并稀释至刻度摇匀,精密量取2ml置50ml量瓶中,用流动相稀释至刻度,摇匀即为对照品溶液(Ⅱ),此溶液必须临用新鲜配制,并于零下20℃保存,用前放置至室温。 等容混合对照品溶液(Ⅰ)和对照品溶液(Ⅱ)即为对照品溶液。 供试品溶液的制备 取装量差异项下的内容物约2瓶重量,精密称定,置100ml量瓶中,加水溶解并稀释至刻度,摇匀,精密量取15ml置200ml量瓶中,用流动相稀释至刻度。 测定法 取对照品溶液和供试品溶液各10μl,交替注入液相色谱仪,测定,用外标法计算各组分含量,即得。目前存在问题用紫外检测的分不开5种组分,大家有什么好办法,谢谢

10,抽取5个版友);中奖名单:999youran(注册ID:999youran)mengzhaocheng(注册ID:mengzhaocheng)m3071659(注册ID:m3071659)莫名其妙(注册ID:moyueqiu)dyd3183621(注册ID:dyd3183621)http://ng1.17img.cn/bbsfiles/images/2016/05/201605061502_592486_1610895_3.pnghttp://ng1.17img.cn/bbsfiles/images/2016/05/201605061502_592487_1610895_3.png积分奖励:所有回答正确的版友奖励10个积分(幸运奖获得者除外)。【注意事项】同样的答案,每人只能发一次PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。=======================================================================水溶性维生素方法:HPLC基质:标准溶液应用编号:101062化合物:吡哆胺;乳清酸;维生素C;吡哆醛;吡哆醇;烟酰胺固定相:Diamonsil C18(2)色谱柱/前处理小柱:Diamonsil C18(2) 5u 150 x 4.6mm色谱条件:流动相: 甲醇:10 mM HCOONH4(pH=3.0)= 5:95 流速: 1.0 mL/min 温度: 室温 检测器: UV 254 nm文章出处:AN: D1109关键字:水溶性维生素,HPLC,吡哆胺;乳清酸;维生素C;吡哆醛;吡哆醇;烟酰胺,Diamonsil C18(2),钻石二代谱图:http://ng1.17img.cn/bbsfiles/images/2016/05/201605061009_592439_1610895_3.jpg图例:1. 吡哆胺; 2. 乳清酸; 3. 维生素C; 4. 吡哆醛; 5. 吡哆醇; 6. 烟酰胺
[color=#444444]想咨询一下各位大神:质谱扫维生素A乙酸酯,维生素A棕榈酸酯,维生素K2,叶黄素等的时候,扫不到母离子或分子量有偏差,样品溶液中加酸加水也没有反应,换岛津的仪器扫出来离子对响应也很低,想求助各位是什么情况。。。样品不纯?方法不合适?质谱质量轴偏移?[/color]
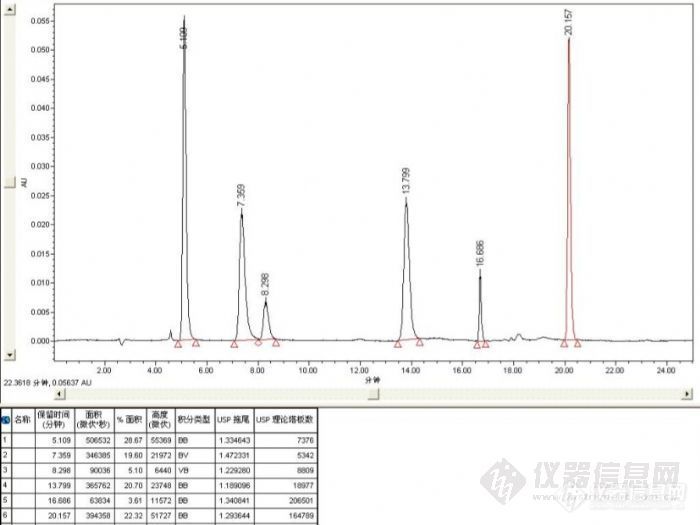
今天写这篇原创,意在抛砖引玉,希望大家更多的参与到原创大赛中。很多人不知道写什么,觉得没什么可写,其实你每天的工作都是不错的作品,关键是看我们如何来总结,如何来分享。说到水溶性维生素,我觉得现在的国家标准也挺多,但是大部分都是一个项目一个项目的做,比较麻烦,当然这个也跟样品有很大关系,很多样品都有维生素,而且样品成分复杂,比如奶粉就是个例子,含量不高,基质复杂。而保健食品比如口服液,含量高,基质简单,所以要做好这些项目,确实是门学问。我这里只是象征性的选了几个组分,对柱子进行测试比较。色谱方法:波长260nm流动相:乙腈+缓冲盐液 梯度洗脱按出峰顺序组分依次是烟酸、B1、B6、烟酰胺、叶酸、B2这个图是Topsil C18( 5um,4.6*250mm,由上海月旭提供)柱的图,杂质峰估计是我的标准溶液放置过久造成的,已经放了大半年了,呵呵http://ng1.17img.cn/bbsfiles/images/2011/07/201107011357_302575_1608710_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/07/201107011401_302577_1608710_3.jpg这个是supecol C18( 5um,4.6*250mm)进口色谱柱在同样的条件下检测的图,半年前的测试图,http://ng1.17img.cn/bbsfiles/images/2017/01/201701191653_630954_1608710_3.jpg在附上一张已经使用一年的色谱柱的色谱图,这个柱子是国外的填料,国内填装的,使用的这么久,峰已经变的有点宽了,柱效也明显降低了很多(见表中的理论塔板数)http://ng1.17img.cn/bbsfiles/images/2011/04/201104071431_287560_1608710_3.jpg总结:不同的色谱柱,峰的保留时间会有变化,国家标准有些方法是用离子对试剂,主要是考虑的实际样品比较复杂,样品测定是杂质的分离度不好就影响结果的准确性,都是用了离子对后峰的顺序也会发生改变,我们在做实际样品也要考虑很多因素,方法也就变的多样化。
同标题:哪位有:水溶性或者是蔬菜中 维生素的测定方法啊?谢谢拉
研究利用反相液相色谱法测定能量饮料中七种水溶性维生素 (VC、VPP、VB1、VB2、VB5、VB6、叶酸)的方法。样品利用Supelco C18 固相萃取柱(500mg/6ml)萃取后,直接注入高效液相色谱柱 Phenomenex C18(250mm × 4.6 mm,5μm), 采用等度洗脱,流动相为0.1 mol/L KH2PO4 (pH 7.0)- 甲醇( 90:10,V/V), 流速为 0.5ml/min。根据各个化合物的保留时间以及UV谱图与标准谱图的对比可以确认各化合物。该方法的检测限为0.05~0.2mg/L,平均回收率为94.71%~97.03%。
求SN/T 4258-2015出口食品中水溶性维生素的测定方法全文,请大神发予我,不胜感激!邮箱xueli-li@qq.com
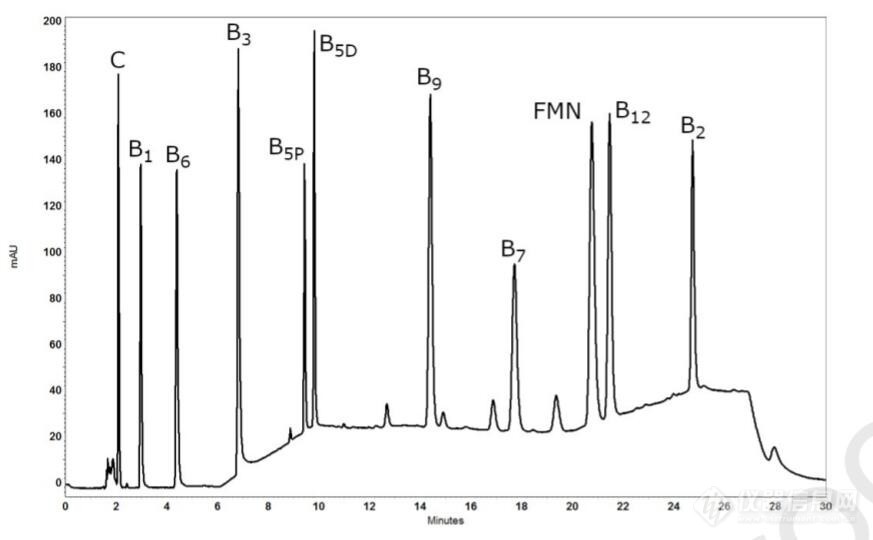
文献报道了一种同时分析11种水溶性维生素的[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]方法。柱子采用waters 的XSelect CSH C18柱,流动相为25mM磷酸二氢钠(ph调到4.0)水溶液和甲醇。梯度洗脱,一针30min,柱温40℃,进样量5微升。流速1.0ml/min。谱图如下,详细信息见[url]https://doi.org/10.1016/j.foodchem.2020.127768[/url][img=,690,426]https://ng1.17img.cn/bbsfiles/images/2022/09/202209161645569190_8147_2641053_3.jpg!w690x426.jpg[/img]
注射用水溶性维生素含量检测各位高人,请教一下:我所检测的样品含:烟酰胺,泛酸钠,VB1,VB2,VC,VB6,VB12,叶酸和生物素及对羟基苯甲酸甲酯用的液相,由于没有荧光检测器,核黄素磷酸钠就用其中核黄素就用了烟酰胺的方法,用紫外检测器检测,烟酰胺,泛酸钠,VB1,VB2,VC,VB6为一组,条件:30度,214nm;叶酸、生物素一组,条件:30度,200nm,对羟基苯甲酸甲酯和叶酸组条件一样,只是流动相乙腈比例较大;VB12 用的是梯度洗脱,40度,360nm。其中核黄素磷酸钠和生物素不好测,请问各位有没有更好的方法呢?补充:我用紫外扫描,发现核黄素磷酸钠在200nm出无吸收,但是VB1也无吸收,请问吸收度于出峰时间有事么关系呢,是否同一波长下吸收度大的出峰早,峰面积大呢?谢谢!
按国标方法标定维生素A、D、E的标准溶液时,标定结果总是不稳定,即使是新配的标准溶液也一样,大家有没有遇到同样的情况,请高手指点指点!
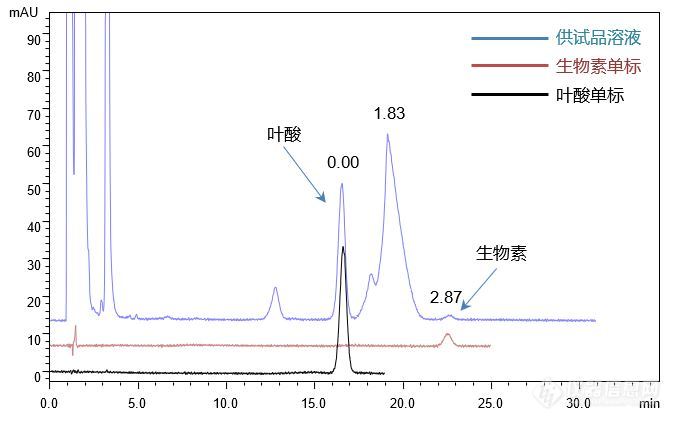
[align=center][b]注射用水溶性维生素的分析(2)[/b][/align][align=center][b]——叶酸,生物素[/b][/align]客户提供了注射用水溶性维生素粉针剂及对照品(叶酸,生物素),要求本实验室依据客户所提供方选择合适色谱柱,满足方法中对叶酸,生物素及其前后相邻杂质的分离要求,进而达到准确定量的目的。首先,依据客户提供的色谱条件我们尝试了使用中等极性色谱柱CAPCELL PAK C18 MGII S5 4.6 mm i.d. × 150 mm(A4AB 07251),分析对照品溶液与供试品溶液,结果如图1所示,对照品溶液中叶酸及生物素得到了良好的分离结果;在分析供试品溶液时,叶酸与其后杂质峰能够得到分离度为1.83的良好分离结果。[align=center][img=,673,421]http://ng1.17img.cn/bbsfiles/images/2018/01/201801110920_3890_2222981_3.jpg!w673x421.jpg[/img][/align][align=center]图1 CAPCELL PAK C[sub]18[/sub] MGII(150 mm)分析对照品及供试品溶液结果[/align]注*峰上所标数字为分离度,下同。[img=,673,298]http://ng1.17img.cn/bbsfiles/images/2018/01/201801110920_2922_2222981_3.jpg!w673x298.jpg[/img]为提高分离能力,使叶酸峰与其后杂质峰分的更远,我们尝试将色谱柱长度由150 mm换为250 mm,再一次分析供试品及对照品溶液,结果发现叶酸和生物素保留时间均明显延长,叶酸峰由16.97 min延长到29.03 min,此时叶酸峰与其后相邻杂质峰能够得到更好的分离,分离度为4.23,但同时也发现生物素峰被包于杂质峰中(如图2)。[align=center][img=,690,437]http://ng1.17img.cn/bbsfiles/images/2018/01/201801111011_6191_2222981_3.jpg!w690x437.jpg[/img][/align][align=center]图2 CAPCELL PAK C[sub]18[/sub] MGII(250 mm)分析对照品及供试品溶液结果[/align][align=left][img=,668,303]http://ng1.17img.cn/bbsfiles/images/2018/01/201801111011_2127_2222981_3.jpg!w668x303.jpg[/img][/align][align=left][/align][align=left]为使客户有更多色谱柱选择,本实验室也尝试了高碳载量的SUPERIOREX ODS色谱柱对对照品溶液及供试品溶液进行分析,同样能够得到待测组分与前后杂质峰的良好分离,分离度均在2.0以上;同时,我们也发现在分析供试品时,由于供试品中复杂基质的影响,叶酸峰会出现一定的拖尾现象(如图3)。[/align][align=left][/align][align=center][img=,619,394]http://ng1.17img.cn/bbsfiles/images/2018/01/201801111012_1478_2222981_3.jpg!w619x394.jpg[/img][/align][align=center] 图3 SUPERIOREX ODS分析对照品及供试品溶液结果[/align][align=center][/align][align=left][img=,687,297]http://ng1.17img.cn/bbsfiles/images/2018/01/201801111012_3462_2222981_3.jpg!w687x297.jpg[/img][/align][align=center][/align][align=left]我们也尝试使用可以在100%水系流动相下使用的高极性AQ色谱柱分析供试品溶液及对照品溶液,发现由于整体保留时间过长而使得生物素峰被包于杂质峰中,因此,我们尝试缩短整体保留时间,在药典规定范围内,提高流动相中有机相比例,将流动相比例由磷酸二氢钾缓冲溶液-乙腈(93:7)调整为(91:9),最终发现供试品中叶酸和生物素也能够与其相邻杂质峰取得良好分离结果,且分离度更佳(见图4)。[/align][align=left][/align][align=center][img=,655,416]http://ng1.17img.cn/bbsfiles/images/2018/01/201801111020_155_2222981_3.jpg!w655x416.jpg[/img][/align][align=center]图4 CAPCELL PAK C[sub]18 [/sub]AQ S3分析对照品及供试品溶液结果[/align][align=left][img=,661,296]http://ng1.17img.cn/bbsfiles/images/2018/01/201801111021_778_2222981_3.jpg!w661x296.jpg[/img][/align][align=left][/align][align=left]综上实验结果,使用中等极性的[b]CAPCELL PAK C[sub]18[/sub] MGII S5[/b] 4.6mm i.d. × 150 mm(A4AB 07251)和高碳载量的[b]SUPERIOREX ODS S5[/b] 4.6 mm i.d. × 150 mm(AZAB 12684)色谱柱,在客户原条件下,均能够实现叶酸、生物素及其相邻杂质间的良好分离;[/align][align=left]使用高极性[b]CAPCELL PAK C[sub]18[/sub] AQ S3[/b] 4.6 mmi.d. × 150 mm(A7AB 02100)色谱柱,在药典规定流动相可调整范围内,将流动相中磷酸盐缓冲液和乙腈比例调整为91 / 9(原条件为93 / 7),也可实现注射用水溶性维生素中叶酸和生物素及相邻杂质的良好分离。[/align]
在保健食品和营养补充品中添加维生素成分,已经广为人们熟悉和接受。近几年来,市面上越来越多的美容护肤品含有各种维生素,甚至推出了以维生素为主要成分的系列产品。 特别是维生素A和C,频繁地在不同品牌的产品中露面。大家对维生素在美容化妆品中担当的角色也许不甚明了。以下我们将细细讲述维生素与护肤的关系。 维生素概述 Vitamin,中文译作维生素,港台地区惯称维它命,是人体不可或缺的一种营养素。它由波兰科学家丰克命名,意为“维持生命的营养素”。维生素在人体内的含有量很小,但生理作用很大,绝对不能缺少。因为维生素往往作为体内一些重要酶的辅助成分,参与广泛的生化反应,决定了某些十分重要的代谢过程。它在人体内不能合成,或者不能足量合成,必须通过外界供给。一旦缺乏某种维生素,身体无一例外地发生相应的代谢障碍,并表现出临床症状。 根据维生素的溶解性能,可将维生素分为两大类:脂溶性维生素和水溶性维生素。脂溶性维生素包括维生素A、D、E和维生素K。水溶性维生素包括维生素C和B族维生素。因为皮肤外面有一层肉眼看不到的皮脂膜,对于外用的护肤产品,皮肤基本能吸收其中的脂溶性营养成分。而对于水溶性维生素,由于它对光和热具有不稳定性,因此在大多数情况下,添加到护肤产品中的水溶性维生素都经过改进处理,例如维生素C使用其衍生物,一方面能保持稳定性,另一方面也利于皮肤的吸收。 肌肤护理与维生素A 维生素A为淡黄色油溶液,或结晶与油的混合物。它只存在于动物性食品中;植物中的胡萝卜素被身体吸收后,可在体内转化为维生素A。维生素A对皮肤的表皮层有保护作用,并维持其机能处于正常状态。如果缺乏,会引起肌肤干燥、角质代谢失常,导致死皮细胞的堆积。具体来说,维生素A对皮肤具有以下的主要功效: 1. 胡萝卜素(维生素A的前体物质,在体内可转化为维生素A)在体内从不同环节对抗自由基对细胞的氧化损害,加强身体的抗氧化能力,减轻自由基的危害。 2. 有助保持皮肤柔软和丰满,改进皮肤的锁水功能。 3. 有较明显的抗角质化的效果,并能延缓皮肤老化,在皮肤细胞的分裂和发育方面有调节作用。 4. 有助对粉刺进行局部治疗,以及防止皮肤粗糙皲裂、冻疮和头屑等。 5. 有助于增强新陈代谢,使皮肤保持更年轻的状态。 基于维生素A的上述功能,它在滋润、调理和延缓衰老类的护肤产品中都被广泛采用。
有参加ACAS-PT09婴儿配方乳粉中水溶性维生素成分的能力验证的朋友吗,大家交流一下。
最近做食品中维生素B1的检测,依据GB5009.84-2016,高效液相,按要求配制的一系列浓度的标准液,竟然会有过载的现象,各个浓度峰面积也大概高了一倍,不知道是怎么回事,请有经验的专家帮忙解答就下3.3 标准品维生素B1 标准品:盐酸硫胺素(C12H17ClN4OSHCl)),CAS:67-03-8,纯度≥99.0%。3.4 标准溶液配制3.4.1 维生素B1 标准储备液(500μg/mL):准确称取经五氧化二磷或者氯化钙干燥24h的盐酸硫胺素标准品56.1mg(精确至0.1mg),相当于50mg硫胺素、用0.01mol/L盐酸溶液溶解并定容至100mL,摇匀。置于0℃~4℃冰箱中,保存期为3个月。3.4.2 维生素B1 标准中间液(10.0μg/mL):准确移取2.00 mL 标准储备液,用水稀释并定容至100mL,摇匀。临用前配制。3.4.3 维生素B1 标准系列工作液:吸取维生素B1 标准中间液0μL、50.0μL、100μL、200μL、400μL,800μL,1000μL,用水定容至10mL,标准系列工作液中维生素B1 的浓度分别为0μg/mL,0.0500μg/mL,0.100μg/mL,0.200μg/mL,0.400μg/mL,0.800μg/mL,1.00μg/mL。临用时配制。
维生素B1是维生素中发现最早的一种。由嘧啶环和噻唑环通过亚甲基结合而成的一种B族维生素。为白色结晶或结晶性粉末;有微弱的特臭,味苦,有引湿性,露置在空气中,易吸收水分。在碱性溶液中容易分解变质。酸碱度在3.5时可耐100℃高温,酸碱大于5时易失效。遇光和热效价下降。故应置于遮光,凉处保存,不宜久贮。 在酸性溶液中很稳定,在碱性溶液中不稳定,易被氧化和受热破坏。还原性物质亚硫酸盐、二氧化硫等能使维生素B1失活。(摘自百度百科) 购买回的维生素B1(盐酸硫胺)纯度标准物质(BW3600,中国计量科学研究所)给出的均匀性检验和稳定性考察的前处理条件是105℃干燥至恒重后称取一定量,加入盐酸水溶液溶解,过滤上机测定。而在GB/T 14700-2002《饲料中维生素B1的测定》标准(本法用的反相HPLC)中,标准储备液是称取一定量,用25%乙醇溶液超声溶解。在GB/T5009.84-2003《食品中硫胺素(维生素B1)的测定》标准中,称取经氯化钙干燥24h的一定量硫胺素,溶于0.01mol/L中。在中国兽药典、中国药典中,维生素B1用的是约0.1mol/L盐酸溶液溶解,而其中检验干燥失重时,用的也是105℃。 疑问:根据第一段说法,VB1并不耐热,为何要用105℃? GB/T 14700-2002中用乙醇溶液溶解,储备液能保证稳定,不选用盐酸溶液,是否更便于HPLC测试?
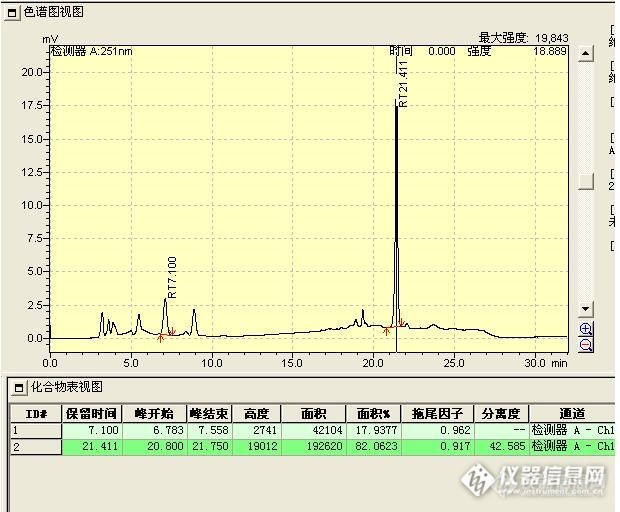
前段时间拿到一个饲料样品,要检测饲料中维生素A和维生素K3,看标准两者用的流动相都是甲醇-水,第一反映就是不是可以梯度洗脱同时测定两个成分,采用定时变换检测波长的方法实现检测。结果很失败,在此分享一下分析过程。 先看标准方法: GB/T 17817-2010 饲料中维生素A的测定 高效液相色谱法[img=,682,136]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292030_01_1638724_3.png[/img][img=,690,336]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292030_02_1638724_3.png[/img] GB/T 7294-2009 饲料添加剂亚硫酸氢钠甲萘醌(维生素K3)[img=,690,506]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292024_01_1638724_3.png[/img] GB/T 18872-2002 饲料中维生素K3的测定 高效液相色谱法 维生素K3的检测原理是在碱性条件下,水溶性的亚硫酸氢钠甲萘醌脱去亚硫酸氢钠生成脂溶性的甲萘醌,用三氯甲烷萃取,吸取适量经甲醇稀释后上机检测。[img=,680,508]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292025_01_1638724_3.png[/img]一、第一次实验:按标准维生素K3的提取过程太麻烦了,且三氯甲烷并不是随便可以买到,那能不能像维生素A一样直接甲醇提取后检测?1、查维生素K3(亚硫酸氢钠甲萘醌)理化特性:易溶于水和热乙醇,难溶于冰乙醇,不溶于苯和乙醚,水溶液PH4.7-7.常温下稳定,遇光易分解。看下面的结构式:[img=,247,199]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292009_01_1638724_3.png[/img]看性质肯定可以溶解在90%甲醇-水里,取亚硫酸氢钠甲萘醌适量,在棕色容量瓶中90%甲醇溶解后上机检测。2、结果出峰极快,受亚硫酸根强极性基团的影响,维生素K3在反相色谱上完全不保留且峰形很差,说明不能直接提取后上机检测,第一次以失败告终。[img]http://ng1.17img.cn/bbsfiles/images/2017/09/201709081927_01_1638724_3.jpg[/img]二、第二次实验:老实的按标准方法(GB/T 18872-2002 饲料中维生素K3的测定 高效液相色谱法)?显然不好,还是不能同时测定维生素A和维生素K3,能不能碱性条件下脱亚硫酸氢钠后纯甲醇提取后上机检测呢?1、由于维生素A的提取方法是65度纯甲醇超声提取30分钟,那么就先取适量维生素A和维生素K3置100mL棕色容量瓶中,由于手上没有氢氧化铵,所以加入5mL碳酸钠溶液代替,加入后超声振摇1min,即有白色沉淀析出(可能是碳酸钠与甲萘醌的混合物),立即加入80mL甲醇,65度超声提取30分钟,过滤取,取滤液稀释至合适浓度上机检测。2、结果几乎无甲萘醌峰出现,观察提取液的颜色,基本可以确定是甲萘醌都氧化成了[color=#cc0000]羟基苯醌[/color]。如下呈褐色的滤液。第二次失败。[img=,602,337]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292059_01_1638724_3.png[/img] 还有一个原因是用甲醇提取与用三氯甲烷提取有明显的区别,是甲醇与碳酸钠溶液是有一定互溶性的,而三氯甲烷与碳酸钠溶液不互溶。甲醇的碳酸钠溶液可能也会促进甲萘醌的破坏。三、第三次实验1、实验方法:维生素A与维生素K3分别按标准方法提取,再吸取甲萘醌的三氯甲烷溶液适量置提取好的维生素A提取液中,混匀,上机检测,梯度洗脱程序如下:[img=,509,384]http://ng1.17img.cn/bbsfiles/images/2017/09/201709292142_01_1638724_3.png[/img]2、结果甲萘醌与维生素A可以实现分离与同时检测,但每针的分析时间太长,与分别单独检测维生素A与维生素K3,每针分析时间只要10分钟相比,没有优势,如果还要同时分析维生素D与维生素E的话,分析时间就会更长,另外也有可能存在提取维生素A时有少量甲萘醌生成,造成结果偏高的误差。其它实验证明维生素A、D、E可能在98%甲醇下同时分析。至此,第三次实验也算失败。[img=,620,512]http://ng1.17img.cn/bbsfiles/images/2017/09/201709300842_01_1638724_3.jpg[/img] 维生素K3(7.1min)与维生素A(21.4min)同时检测图谱[img=,581,500]http://ng1.17img.cn/bbsfiles/images/2017/09/201709300842_02_1638724_3.jpg[/img] 维生素A样品图谱(98%甲醇等度洗脱)[img=,588,492]http://ng1.17img.cn/bbsfiles/images/2017/09/201709300842_03_1638724_3.jpg[/img] 维生素K3样品图谱(80%甲醇等度洗脱) 综上,本次最终还是选择按标准方法分别检测维生素A与维生素K3,在检测维生素K3由标准方法的旋转振荡器改为普通摇床振荡。这次的经验告诉我,要改进方法真的不容易,进行方法开发前一定要充分了解待测组分的理化性质,充分理解参考文献的检测原理与注意事项。看到亚硫酸根有没有人会考虑使用离子对试剂四丁基氢氧化铵和四丁基溴化铵的,估计也是不行的,碱性条件下会水解。