作者:李像题目:载抗肿瘤药物PLGA微球的研究期刊:华南理工大学年份:2010链接:http://www.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&QueryID=4&CurRec=68&dbname=CMFDLAST2011&filename=2010229180.nh&urlid=&yx=
题目:高分子载体材料在药用微球中的应用及进展作者:王建华黄永中期刊:《高分子通报》2011年 第7期 6 页 44-49页链接:http://www.cqvip.com/qk/95630x/201107/38410177.html
题目:壳聚糖载药微球的制备及应用研究进展作者:张丽宋益民张学成期刊:《海洋科学》2009年 第4期 6 页 81-85页链接:http://www.cqvip.com/qk/90010x/200904/29989731.html
作者:李近题目:可生物降解载药微球的制备和释药动力学的研究期刊:清华大学年份:2008链接:http://www.cnki.net/KCMS/detail/detail.aspx?dbcode=CDFD&QueryID=4&CurRec=59&dbname=CDFDLAST2010&filename=2009083645.nh&urlid=&yx=
各位高手: 本人急求药物分析化学、仪器分析视频课程下载资料。 我的邮箱wendingzi666@163.com 不胜感激
【序号】:8【作者】: 裴响林【题名】:甲壳素微球负载纳米钯催化剂的构建及应用【期刊】:武汉大学【年、卷、期、起止页码】:2018【全文链接】:[url]https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CDFD&dbname=CDFDLAST2020&filename=1018201070.nh&uniplatform=NZKPT&v=tR__wEIh_WPLpyzWa7tnEzHSv-xc-qcqK7orwtX7PDRKqA-7fF8VbBbIKTgRV3Re[/url]
[align=center][size=4]关于征求中药注射剂安全性再评价相关技术评价指导原则意见的函食药监安函[2010]20号[/size][/align][size=4]各省、自治区、直辖市食品药品监督管理局(药品监督管理局): 为进一步做好中药注射剂安全性再评价工作,国家局组织制定了《中药注射剂安全性再评价非临床研究技术原则》、《中药注射剂安全性再评价临床研究评价技术原则》、《中药注射剂安全性再评价生产工艺评价技术原则》、《中药注射剂安全性再评价质量可控性评价技术原则》、《企业对中药注射剂风险控制能力评价技术原则》、《中药注射剂安全性再评价风险效益评价技术原则》、《中药注射剂风险管理计划指导意见》,现征求你们意见。请组织本辖区药品研究、生产、使用单位进行讨论,提出修改意见,及时反馈我司。药品生产企业、研究单位、医疗机构等也可直接提出修改意见。 各省反馈意见的电子版及社会各界的意见,请发送到[/size][email=zhy@cdr.gov.cn][size=4]zhy@cdr.gov.cn[/size][/email][size=4]邮箱中。 征求意见时间截至2010年5月31日。[/size][size=4]1、这些指导原则对你个人有什么影响?[/size][size=4]2、它会对企业的生存空间产生影响吗?[/size][size=4]3、它仅是最终的药品使用者受惠,还是生产企业也是受惠者。[/size][size=4][/size]
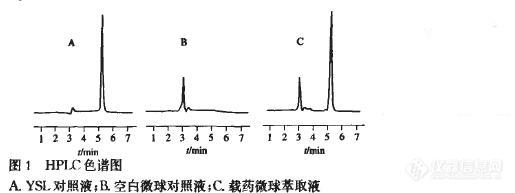
【作者】 丁燕飞; 冯秀珍; 陶昱斐; 肖昶昶; 姚瑶;【机构】 中南大学药学院; 中南大学药学院 湖南长沙410013; 湖南长沙410013; 2006届毕业生;【摘要】 目的:建立测定酪丝亮肽PLA/PLGA微球中药物含量及包封率的高效液相色谱(HPLC)法。方法:采用二氯甲烷破坏载药微球,水萃取后HPLC法进行测定。色谱柱采用Diamonsil C18(4.6mm×250mm,5μm)。流动相为0.02mol·L-1磷酸二氢钾-甲醇-乙腈(75∶15∶10),流速为1.0mL.min-1,柱温为30℃,检测波长220nm。结果:在此色谱条件下酪丝亮肽与辅料及溶剂峰均得到良好分离,在2.01~50.35mg·L-1范围内线性关系良好,r=0.9999(n=7),平均回收率为98.54%,RSD为0.81%;日内及日间精密度均小于3%(n=5)。结论:该方法准确可靠、简单快速,可用于酪丝亮肽PLA/PLGA微球药物含量及包封率的测定。 http://ng1.17img.cn/bbsfiles/images/2012/08/201208141949_383835_1609970_3.jpg
各位大侠有没有欧洲药典9.5版免费下载路径啊?求一个
[b][size=10.5pt][font=微软雅黑]药物载体控释系统:[/font][/size][size=10.5pt][font=微软雅黑]控制药物释放[/font][/size][/b][size=10.5pt][font=微软雅黑]是八十年代发展起来的一种新技术,是药物学发展的一个新领域。[/font][/size][b][size=10.5pt][font=微软雅黑]药物控制释放体系是将药物包埋于某种聚合物辅料中,由于不同辅料和制备工艺限制药物的溶出和扩散速度,通过聚合物的溶蚀和水解将药物缓慢、持续稳定地释放出并发挥作用。[/font][/size][/b][size=10.5pt][font=微软雅黑]设计药物缓释制剂的目的:[/font][/size][size=10.5pt][font=微软雅黑] 一是尽可能地延长药物的作用时间或达到所期望长的作用时间;[/font][/size][size=10.5pt][font=微软雅黑] 二是减小给药后即刻出现的局部组织或血药浓度过高和潜在的毒性。[/font][/size][size=10.5pt][font=微软雅黑]低分子量的药物由于相对分子质量小,易从人体中排泄出去,为了维持一定的血药浓度,往往采用多次给药的方法,这样易使药物在体内的浓度出现“峰谷”现象,当药物浓度处于“峰值”有可能引起毒副作用,处于“波谷”时有又可能低于有效浓度,从而影响疗效。[/font][/size][size=10.5pt][font=微软雅黑]因此,要使药物具有疗效,必须使血液中的药物浓度即血药浓度达到一定标准-最低有效浓度。正常的用药剂量应能使血药浓度维持在最低浓度与中毒极限浓度之间。[/font][/size]
做中药复方药动遇到一个问题,求大家指点迷津,已发表的文献报道单味药材中有效成分的药时曲线很标准,但我给大鼠灌胃复方后成分的药时曲线出现了明显的再吸收现象,请问这样正常吗?做了六只老鼠都是这个现象。
【序号】:1【作者】: 徐倩【题名】:复合载药微球壳聚糖温敏凝胶的初步研究【期刊】:天津医科大学 【年、卷、期、起止页码】:【全文链接】:https://kns.cnki.net/kcms/detail/detail.aspx?dbcode=CMFD&dbname=CMFD201401&filename=1013321952.nh&v=zX7bSMwyAnTsmeCq5gJVsAUcMKL9%25mmd2BSKgGny05LZcEi%25mmd2Fq2GOKzdg5p9UR8KPCW%25mmd2FDw
【序号】:1【作者】:吴明【题名】:基于光交联水凝胶微球载体的旁分泌系统构筑及其在皮肤创伤修复中的应用【期刊】:扬州大学【年、卷、期、起止页码】:2023【全文链接】:https://kns.cnki.net/kcms2/article/abstract?v=3uoqIhG8C475KOm_zrgu4sq25HxUBNNTmIbFx6y0bOQ0cH_CuEtpsD0Z_3vgFrsxp0TSLtcG08QFEvD6RohujprZLhKsreld&uniplatform=NZKPT
在帮millipore找微生物检测设备的市场和验证,各一个,地点上海。希望有意向的朋友与我联系。市场要求是微生物、药学等相关专业硕士,两三年的药企微生物QC或者研发经验。验证求微生物、药学等相关专业的本科及以上,药企或食品企业微生物实验室的QC,有IQOQ经验为佳。我的邮箱c605@topuc.com.详情邮件谈,在此不便透露。
不符合版规的版主请删现在换了笔记本,安装不了。之前的winlab32只能在win7 32位的系统使用。求下载,谢谢
题目:注射用载雌二醇m PEG-PLA缓释微球的制备及体内外释放研究作者:李静期刊:山东大学,2012链接:http://www.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&QueryID=0&CurRec=1&dbname=CMFDTEMP&filename=1012462466.nh&urlid=&yx=
求抗微生物药敏感试验方法 最好是国标最近打算开展抗生素对大肠杆菌 金黄色葡萄球菌药敏试验,验证细菌对药物是否敏感。虽然找了一些方便,但都来源于江湖,http://simg.instrument.com.cn/bbs/images/brow/em09507.gif没找到有标准文本的支持,请教各位!求抗微生物药敏感试验方法 最好是国标。http://simg.instrument.com.cn/bbs/images/brow/em09509.gifhttp://simg.instrument.com.cn/bbs/images/brow/emyc1010.gif
作者:贾文娟题目:药物缓释微球的制备、表征及性能研究期刊:四川大学年份:2007链接:http://www.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&QueryID=4&CurRec=37&dbname=CMFD9908&filename=2008027766.nh&urlid=&yx=
【序号】:2【作者】:杨菁【题名】:负载PRP壳聚糖-明胶微球可吸收多功能敷料的研究【期刊】:南方医科大学【年、卷、期、起止页码】:2021【全文链接】:https://kns.cnki.net/kcms2/article/abstract?v=6xaVI2TORM1lFU5KO0isN3C08SCef2O9Dlymk7cBog3nXTGlbBs0nRQzCYA3podiynoQGWGJ62WKWDFOf6ouBSqhHwnsEWMGNOmgZMyBm0NupAPAR_qvR_hcRGn4JzkvLq_XNAk-7jaw7QulJwo7xA==&uniplatform=NZKPT&language=CHS
[table=100%][tr][td]转自国家食品药品监督管理局网站。关于的函 [/td][/tr][tr][td]食药监安函[2010]20号 [/td][/tr][tr][td]2010年03月29日 发布 [/td][/tr][tr][td][/td][/tr][tr][td]各省、自治区、直辖市食品药品监督管理局(药品监督管理局): 为进一步做好中药注射剂安全性再评价工作,国家局组织制定了《中药注射剂安全性再评价非临床研究技术原则》、《中药注射剂安全性再评价临床研究评价技术原则》、《中药注射剂安全性再评价生产工艺评价技术原则》、《中药注射剂安全性再评价质量可控性评价技术原则》、《企业对中药注射剂风险控制能力评价技术原则》、《中药注射剂安全性再评价风险效益评价技术原则》、《中药注射剂风险管理计划指导意见》,现征求你们意见。请组织本辖区药品研究、生产、使用单位进行讨论,提出修改意见,及时反馈我司。药品生产企业、研究单位、医疗机构等也可直接提出修改意见。 各省反馈意见的电子版及社会各界的意见,请发送到[email]zhy@cdr.gov.cn[/email]邮箱中。 征求意见时间截至2010年5月31日。 附件:[url=http://www.sda.gov.cn/syjah1020/f1.rar]1.《中药注射剂安全性再评价非临床研究技术原则》[/url] [url=http://www.sda.gov.cn/syjah1020/f2.rar]2.《中药注射剂安全性再评价临床研究评价技术原则》[/url] [url=http://www.sda.gov.cn/syjah1020/f3.rar]3.《中药注射剂安全性再评价生产工艺评价技术原则》[/url] [url=http://www.sda.gov.cn/syjah1020/f4.rar]4.《中药注射剂安全性再评价质量可控性评价技术原则》[/url] [url=http://www.sda.gov.cn/syjah1020/f5.rar]5.《企业对中药注射剂风险控制能力评价技术原则》[/url] [url=http://www.sda.gov.cn/syjah1020/f6.rar]6.《中药注射剂安全性再评价风险效益评价技术原则》[/url] [url=http://www.sda.gov.cn/syjah1020/f7.rar]7.《中药注射剂风险管理计划指导意见》[/url] 国家食品药品监督管理局药品安全监管司 二○一○年三月二十九日[b][back=#d40a00][size=4]土豆注:文件也可以下载附件后观看,欢迎大家从自己的角度提出对修改意见稿的看法哦。[/size][/back][/b] [/td][/tr][tr][td][/td][/tr][/table]
各省、自治区、直辖市食品药品监督管理局(药品监督管理局),总后勤部卫生部药品监督管理局: 为加强药物I期临床试验的管理,提高临床试验生物样本分析实验室的分析质量,有效地保障受试者的权益与安全,确保所产生的数据和结果的可靠性、完整性和科学性,根据《药物临床试验质量管理规范》,我司组织起草了《药物Ⅰ期临床试验管理指导原则(征求意见稿)》、《药物临床试验生物样本分析实验室管理规定(征求意见稿)》。现公开征求意见,请于2011年4月30日前将修改意见反馈我司。(征求意见稿可在国家食品药品监督管理局网站下载) 联系人:蓝恭涛,唐慧鑫 电 话:010—88330742,0722 传 真:010—88363228 地 址:北京市西城区宣武门西大街26号院2号楼 邮 编:100053 E-mail:yjjdc@sda.gov.cn 附件:1.《药物Ⅰ期临床试验管理指导原则(征求意见稿)》 2.《药物临床试验生物样本分析实验室管理规定(征求意见稿)》 3.起草说明 国家食品药品监督管理局药品注册司 二○一一年三月十八日
求《微波消化在药品微量元素测定中的应用》选自《中国测试技术》谢谢!
更换了隔垫和衬管后,发现载气流量为0psi,分流比调整为50,也是没有流量,氦气瓶还有600psi,不知是什么问题...求大侠帮帮忙!
仿制药“紧箍咒”再袭药企洗牌在即监管政策环境不断趋紧的背景下,国内仿制药行业五六千家药企最大一轮“大淘沙”或许很快便将打响。 近日,有媒体援引内部人士消息称:“国家发改委和食品药品监督管理局(SFDA)等部门已形成定价和审批制度相结合的调控思路。除享受定价优待的五家首仿药企外,一段时间内不再开放其他仿制审批。” “目前一种可能的做法是,确定下来这五家企业后,将在三年内不再开放其它同质化的专利仿制审批。”记者从前述内部人士处得悉。 细化方案一经传出立即引发行业“蝴蝶效应”,各方讨论热烈。 据悉,此调控思路被广泛视为一年前发改委新版《药品价格管理办法(征求意见稿)》的细化落实版本。而二者最大的不同之处在于,此前征求意见稿中对专利保护到期后国内前三个仿制上市的药品进行定价支持,即首仿药物及二仿、三仿药品各一款。而据前述内部人士的消息,细化版调控思路则将同一品类的仿制药企控制在五家(首仿药企外,二仿、三仿每批两家),即实际意义的前五家仿制企业。无论是三家还是五家仿制药企名单,在目前同一品类几家甚至十数家企业抢食的现状下,大部分企业或将面临“无药可仿”的绝境。 海正药业(600267.SH)副总裁蒋灵向记者表示:“未来这个政策一旦严格执行,配合上新版GMP明年年底落地,相信严管之下会死掉一大批仿制药企业。而现在业内其实大家都还在观望,看有关监管部门对于执行方面的力度到底如何。” 行业清理 国家相关部门对于国内仿制药行业“大而不强”的现状一直在寻求调整之策,大型仿制药企业对此议题也多番疾呼,认为众多中小型仿制药企以价低冲击市场,造成“劣币驱逐良币”的市场怪象。 伴随此前发改委公开征求意见的新版《药品价格管理办法(征求意见稿)》,市场似乎看到了有关部门行业清理的正式决心。根据该征求意见稿相关内容显示,希望通过定价和审批制度相结合来调控仿制药过热。 征求意见稿中指出:“对在专利药品保护期结束后国内前三个仿制上市的药品,首仿药可在统一定价上浮30%基础内进行单独定价,二仿和三仿药定价则可为首仿药价格的90%和81%。”而在目前传出的这一细化版政策中,同一品类药品可批准的仿制药企业从3家扩大至5家,对于时间年限也确定在了3年,定价模式则未作改变。 如果政策最终得以推行,中小企业的淘汰潮或将很快到来。蒋灵告诉记者,现在国内仿制药行业几乎都是一个仿制药很多企业具有批文,而实际一个品类远不需要那么企业来做。 中国医药企业管理协会副会长王波曾向媒体指出,目前化学药批号已超过12万个,其中绝大多数都是仿制药。 “必须面对的现实是,不少中小企业具有批文并不意味着能够成功商业化,盲目介入反而会演变成以价格扰乱市场。 而这对重研发的大企业而言伤害很大,公司在设备和研发投入方面的偏重使其在成本方面不具备优势,最终会使其没有动力继续研发。”蒋灵表示。大企业的机会 医药行业投资人姜广策在其微博上指出:“这个新政进一步提升了医药行业的竞争门槛,对研发实力和企业公关能力提出了更高要求,此举将进一步推动医药行业洗牌。” 如若政策得以严格执行,其实际的洗牌力度或许远超过市场的想象。 “发达市场如美国,一共也就只有不到百家的仿制药企业。而现在国内有五六千家,很多地方是每个县都有自己的药厂,行业整体产能严重过剩。而实际上真正只要四五百家仿制药企业就完全能够支持国内的需求。”蒋灵强调,“这也直接造成了长期的资源严重浪费(生产资源和审批资源)和重复建设。而一旦这系列政策真正全面落实,将削去90%的企业。这也是符合国家近年主抓药品安全、产业升级的角度。” 另一家国内领先仿制药企业华海药业(600521.SH)董秘祝永华则告诉记者,兼并整合以及外资内资企业联姻将是未来两大趋势。“值得一提的是,此时收购中小企业,由于已不完全是此前的‘双向选择’,收购的价格甚至会更为低。” 过去一年内,大型外资药企如阿斯利康在国内专设仿制药业务模块,而辉瑞与海正、默沙东与先声药业先后成立的合资公司,仿制药便是其中重中之重。
农业部办公厅关于公开征求《农产品及食品中农药最大残留限量(征求意见稿)》意见的函发布单位:农产品质量安全监管局日期:2010-12-03 14:25关键词:农药残留 下载文件: 农药最大残留限量(征求意见稿)》.doc 农办质函69号 根据《食品安全法》及相关规定,我部组织制定了《农产品及食品中农药最大残留限量(征求意见稿)》,其中包括阿维菌素等82种农药在农产品和食品中的194个最大残留限量。现公开征求意见,请于2010年12月30日前将意见反馈我部农产品质量安全监管局。 联系人:单炜力 电话:010-59194253,59194105 传真:010-59194107 电子邮箱:nyclbz@agri.gov.cn。 附件:《农产品及食品中农药最大残留限量(征求意见稿)》 二〇一〇年十一月二十五日
作者:姜庆成题目:GM-1-PLGA微球的制备及其体外释药评价期刊:山东大学年份:2010链接:http://www.cnki.net/KCMS/detail/detail.aspx?dbcode=CMFD&QueryID=4&CurRec=134&dbname=CMFDLAST2010&filename=2010100056.nh&urlid=&yx=
各有关单位:由我会组织华南理工大学等单位编制的《有机污染场地土壤生物修复技术规范 微生物固定化生物炭载体》已完成征求意见稿,根据《中国环境科学学会标准管理办法(试行)》的有关规定,现公开征求意见。请填写意见反馈表,并于2024年2月29日前将有关意见反馈我会(电子文档请同时发送至联系人邮箱)。标准征求意见稿及其编制说明、意见反馈表可登录中国环境科学学会官网(http://www.chinacses.org)下载。联系人:华南理工大学生物科学与工程学院 浦跃武电 话:020-39380601 13318893784邮 箱:g96123@scut.edu.cn地 址:广州市番禺区广州大学城邮 编:510006联系人:中国环境科学学会 王光镇电 话:010-62213365邮 箱:wanggz@chinacses.org地 址:北京市海淀区红联南村54号邮 编:100082[url=http://file2.foodmate.net/wenku2024/wfx202401301630.zip]附件[/url]:1.《有机污染场地土壤生物修复技术规范 微生物固定化生物炭载体(征求意见稿)》2.《有机污染场地土壤生物修复技术规范 微生物固定化生物炭载体》编制说明3.意见反馈表
浮球开关是一种结构简单、使用方便、安全可靠的液位控制器件,它具有比一般机械开关体积小、速度快、作用寿命长,与电子开关相比,它又有抗负载冲击能力强的特点,其在造船、造纸、印刷、发电机设备、石油化工、食品工业、水处理、电工、染料工业、油压机械等方面都得到了广泛的应用。浮球液位开关工作原理是,利用浮球液位开关的磁性浮子随液位升或降,使传感器检测管内设定位置的干簧管芯片动作,发出接点开关转换信号。在密闭的非导磁性管内安装有一个或多个干簧管,然后将此管穿过一个或多个中空且内部有环形磁铁的浮球,液体的上升或下降将带动浮球一起上下移动,从而使该非导磁性管内的干簧管产生吸合或断开的动作,从而输出一个开关信号。开关一般在筒壁上都贴着水位线,我们把开关泡在在水槽中,慢慢下沉,使水面逐渐靠近标识线,最靠近时会听到微动开关动作的声音。需要注意的是:高加液位开关等的工作温度高,里边的水温也高 高温水的密度要小于室温水密度。因而室温水的动作线比开关标识线要低些的。液位低报警接在常闭上,液位高接常开。这类开关还是不难安装的。液位开关本身都会带两对以上的微动开关,分别输出两对常开两对常闭接点,在应用时通常是接通报警。浮球液位开关注意事项:浮球液位开关在我们安装前只需要重新标定水位线。无法对开关本身进行调整的。这时用万用表测开关状态,在水线附近会随水位高低通断,这说明没问题。只要保证安装过程中与热力设备的水位线一致就好了。
[*]对不起,您的声望小于5,您已经不能下载论坛中的资料! [*]请仔细阅读帮助文件? [url=javascript:history.back() ][color=#444444]返回上一级[/color][/url]怎么我的声望为0的?我要下载东西,怎么提高声望啊!
http://ng1.17img.cn/bbsfiles/images/2015/01/201501191607_532688_1610895_3.jpg各有关单位: 目前2015年版药典(二部)的编制工作已接近尾声,二部收载品种已基本确定,现将品种收载情况公布如下:1.2015年版药典(二部)拟新增品种493个,具体见附件1;2.2015年版药典(二部)未收载2010年版药典(二部)中的品种共24个,具体见附件2;3.2015年版药典(二部)采用药品名称与原药品名称不一致的品种共6个,具体见附件3。如有疑问,请及时来函(必要时附相关数据)与我委联系,来函请加盖公章。附件:1、http://www.chp.org.cn/export/system/modules/com.easen.cms.commons/resources/fileicons/xls.gif 2015年版药典二部拟新增品种名单2、http://www.chp.org.cn/export/system/modules/com.easen.cms.commons/resources/fileicons/xls.gif 2015年版药典(二部)未收载2010年版药典(二部)中的品种名单3、http://www.chp.org.cn/export/system/modules/com.easen.cms.commons/resources/fileicons/xls02.gif 2015年版药典(二部)采用药品名称与原药品名称对照国家药典委员会2015年1月14日