我用的是GB/T5009.159-2003(食品中还原型抗坏血酸的测定)。他的原理是在乙酸溶液中,抗坏血酸于固蓝b盐反应生成黄色衍生物,在最大吸收波长420nm处测定吸光度,与标准系列比较定量。这里他给出的计算公式是 C X= -------------- * 100 V1 m * ---- * 1000 V2式中X——试样中抗坏血酸的含量,单位为毫克每百毫克(毫升每百毫升)c——试样测定液中抗坏血酸的含量,单位为微克m——试样质量(体积)单位为克(ml)V2——试样处理液总体积,单位为毫升V1——测定时所取溶液体积,单位为毫升我所不明白的是式中m V1 V2所代表的具体意义,例如:取60g试样,加入60ml乙酸溶液。匀浆后取20g匀浆于100ml容量瓶,加5ml乙酸溶液,用水定容。过滤,取滤液2ml进行比色。最后测定出吸光度A。我如果要用上面的公式,应该如何计算?谢谢[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=170528]GB/T 5009.159-2003 食品中还原型抗坏血酸的测定[/url]

作者:刘忠; 张洪涛; 蔡俊安; 王粉;(河南百年康鑫药业有限公司;)摘要:目的建立测定肝康颗粒中甘草酸含量的高效液相色谱(HPLC)法。方法采用外标一点法,色谱柱为Diamonsil ODS1 C18柱(250mm×4.6mm,5μm),流动相为甲醇-0.2mol/L醋酸铵-冰醋酸(67∶33∶1),流速为1.0mL/min,检测波长250nm。结果甘草酸进样量在0.5102~4.0820μg范围内与峰面积线性关系良好,回归方程Y=6422.014X-412.836,r=0.9996(n=5),平均加样回收率为99.29%,RSD为1.22%(n=6)。结论HPLC法简便、准确,专属性强,测定结果重现性好,可用于肝康颗粒中甘草酸的定量分析。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208271038_386324_1606903_3.jpg
磷钼蓝分光光度法测定磷酸根含量的抗坏血酸可否用乙二胺四乙酸代替EDTA?
在做益康倍松乳膏的含量时,发现样品处理的时间对丙酸倍氯米松的含量有影响,但没有具体规律,很难确认它究竟是因为什么原因造成的。有人曾做过这方面的吗?希望做过这方面检验的人能尽快回答,谢谢!
[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定药品中抗坏血酸含量[align=center]黄选忠[/align][align=center](湖北兴山县疾病预防控制中心,湖北兴山 443711)[/align]摘要 [color=black]建立[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url][/color][font=times new roman][size=18px][color=black]-[/color][/size][/font][color=black]抑制电导检测法测定抗坏血酸含量的新方法。以SH-AC-3型阴离子交换柱为分离柱,以12.0 mmol/L NaHCO[/color][color=black]3[/color][color=black]溶液为淋洗液,流量为1.0 mL/min,柱温为30℃,采用等度洗脱的方式可将抗坏血酸与氟化物、氯化物、亚硝酸盐、溴化物、硝酸盐、磷酸盐和硫酸盐等常见阴离子完全分离,通过抑制电导检测,抗坏血酸的峰面积与其质量浓度在3.0~500.0mg/L范围内呈良好的线性关系,相关系数[/color][size=13px][color=black]r[/color][/size][color=black]为0.9993,方法应用于维生素C针剂和片剂中抗坏血酸的含量测定,加标回收率为95.1%~101.6%,5次平行测定结果的相对标准偏差(RSD)为1.55%~2.79%,抗坏血酸的最低检出限为2.7mg/L,方法回收率较高、重现性良好,操作简便快速,可用于维生素C针剂和片剂中抗坏血酸的含量测定。[/color]关键词 [url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法;[color=black]维生素C[/color];[color=black]含量测定[/color]中图分类号:O652.63 文献标识码: 文章编号: 抗坏血酸(AA,药品名为维生素C)是维持机体正常生理功能的重要的维生素之一,它广泛参与机体内多种氧化还原等复杂的代谢过程,具有重要的生理功能,包括促进胶原蛋白合成、加速伤口愈合、促进铁的吸收和叶酸的利用,增加造血功能等,在临床上主要用于治疗坏血病、特发性高铁血红蛋白血症、肝硬化、急性肝炎和化学中毒所至的肝损伤等,也可用于传染病及紫癜的辅助治疗,因此准确测定药品中抗坏血酸的含量对保障患者治疗效果具有重要意义。目前测定抗坏血酸的主要方法有碘量法[1]、分光光度法[2-3]、电化学法[4]、高效液相色普法[5-7]、[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法[8-10]等,其中,碘量法、分光光度法选择性差,电化学法、高效液相色普法需要专用仪器,[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]-电化学检测法[8]和[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]-间接荧光检测法[9]虽然有较高的检测灵敏度,但均需要专用检测器不便推广应用。[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]-电导检测法[10]线性范围为50~500mg/L,不适用于抗坏血酸含量在50mg/L以下的样品的检测。本实验研究用SH-AC-3型阴离子交换柱和CIC-100型色谱仪测定药品中抗坏血酸含量,结果表明,以SH-AC-3型阴离子交换柱为分离柱、12.0mmol/LNaHCO3溶液为淋洗液,流量为1.0ml/min,采用等度洗脱的方式可使抗坏血酸与氟化物、乙酸盐、氯化物、亚硝酸盐、溴化物、硝酸盐、磷酸盐、硫酸盐等常见阴离子和苯甲酸、草酸等完全分离,且抗坏血酸的峰面积与其质量浓度在3.0~500.0mg/L范围内呈良好的线性关系,相关系数r为0.9993,方法应用于维生素C针剂和片剂中等样品中抗坏血酸含量测定,加标回收率为95.1%~101.6%,5次平行测定的相对标准偏差(RSD)分别为1.55%~2.79%,按3倍信噪比(3N/b)计,抗坏血酸的最低检出限为2.7mg/L,方法适用于维生素C针剂和片剂中等样品中抗坏血酸含量测定。1 实验部分[color=black]1.1 [/color][color=black]主要仪器与试剂[/color][url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url]:CIC-100,青岛盛瀚色谱公司。抑制器:SHY-2型自再生抑制器,青岛盛瀚色谱公司。定量环体积:25μL;自动进样器:SHA—15型,青岛盛瀚色谱公司。电子天平:万分之一,BT214D型,北京赛多利斯仪器系统有限公司。电子天平:千分之一,JA2003型,上海菁海仪器有限公司[font=times new roman]。[/font]0.45μm滤膜过滤器:13 mm,青岛盛瀚色谱公司。抗坏血酸(C6H8O6):分析纯,国药集团化学试剂有限公司。抗坏血酸标准溶液:1000mg/L,称取0.1000g抗坏血酸,溶解于高纯水,定容至100ml。草酸(H2C2O42H2O):优级纯,国药集团化学试剂有限公司。草酸标准溶液:1000 mg/L,称取0.1401g草酸(H2C2O42H2O),用高纯水溶解,定容至100mL。磷酸二氢钾、溴化钾、 乙酸钠(CH3COONa3H2O):分析纯,国药集团化学试剂有限公司。H2PO4-标准溶液:1000 mg/L,称取磷酸二氢钾(105℃烘烤2h)0.1402g用高纯水溶解,定容至100mL。Br-标准溶液:1000 mg/L,准确称取溴化钾(105℃烘烤2h)0.1489g,高纯水溶解定容至100ml。乙酸盐(AC-)标准溶液:1000 mg/L,称取乙酸钠(CH3COONa3H2O)0.2305g用高纯水溶解定容至100ml。NO3-、F-、Cl-、SO42-、NO2-、苯甲酸标准溶液:均为1000 mg/L,编号分别为GBW(E)080223、GBW(E)080549、GBW(E)080268、GBW(E)080266、GBW(E)080264、GBW(E)100006,中国计量科学研究院。碳酸氢钠:分析纯,国药集团化学试剂有限公司。实验所用其它试剂均为AR级。实验用水为高纯水(电阻率为18.2ΜΩcm)。[color=black]1.2[/color][color=black] 仪器工作条件[/color]色谱分离柱:SH-AC-3型阴离子交换柱(250 mm×4.0 mm,青岛盛瀚色谱公司);保护柱:SH-AC-3型(50 [color=black]mm×4.0 mm,青岛盛瀚色谱公司);淋洗液:12.0mmol/LNaHCO[/color][color=black]3[/color][color=black]溶液,流量为1.0ml/min;柱箱温度:30℃;电流:75mA;检测器:电导检测器;自动进样器:全定量环取样,取样后清洗(每针之[/color]间),置换量70μL,取样量25μL,扎针深度4mm。1.3 实验方法[color=black]1.3.1[/color][color=black] 标准溶液配制[/color][color=black] [/color]抗坏血酸标准[color=black]应用液:临用前将[/color]抗坏血酸标准溶液稀释成含抗坏血酸为100.0mg/L[color=black](A液)备用[/color]。[color=black]取[/color]抗坏血酸标准[color=black]应用液(A液)0.30、0.50、1.00mL及[/color]抗坏血酸标准溶液原[color=black]液([/color]1000.0mg/L[color=black])0.30、0.50、1.0、2.0、3.0、4.0、5.0mL于10只10mL容量瓶中加纯水至刻度,混匀,配制成[/color]抗坏血酸的质量浓度为[color=black]3.0、5.0、10.0、30.0、50.0、100.0、200.0、300.0、400.0和500.0mg/L的系列标准工作溶液。[/color][color=black]1.3.2[/color][color=black]标准曲线绘制[/color][color=black] 取1.3.1制备的系列标准工作溶液,各管取1.5mL于样品瓶中,启动自动进样器进样,分别测定,以[/color]抗坏血酸的峰面积(y)为纵坐标,以色谱峰面积对应的抗坏血酸的质量浓度(x)为横坐标,绘制工作曲线。1.3.3 样品处理取维生素C片剂(标称值0.1g/片)10片[color=black]用高纯水充分搅拌溶解后,定容至1000[/color]ml,滤去不溶物,取滤液经0.45μm滤膜过滤后供测试[color=black]。[/color][color=black]吸取[/color]维生素C针剂(标称值0.5g/2ml)1.00ml[color=black]用高纯水定容至100[/color]ml,取该样液经0.45μm滤膜过滤后供测试。1.3.4样品测定取上述样品测试液经适当稀释后[color=black]于样品瓶中,[/color]启动自动进样器进样测定抗坏血酸的峰面积,以标准曲线法定量,同时进行加标回收试验。2 结果与讨论2.1 色谱条件的选择2.1.1 淋洗液的选择在碱性条件下,抗坏血酸易发生降解反应生成草酸,影响抗坏血酸的准确测定,文献[11]曾报道在15.0mmol/LNaHCO3溶液(pH[font=arial]≈[/font]8.3)中抗坏血酸在80min内未降解为草酸,为尽量减少抗坏血酸的降解反应,试验选择pH值较低的NaHCO3溶液为淋洗液,并对NaHCO3溶液浓度进行了选择试验,结果见表1,从表1可见,NaHCO3[align=center]表1 NaHCO3溶液浓度选择试验结果(柱温30℃,流量1.0 mL/min)[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=2,1][align=center]10.0mmol/L[/align][/td][td=2,1][align=center]12.mmol/L[/align][/td][td=2,1][align=center]15.0mmol/L[/align][/td][/tr][tr][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][/tr][tr][td][align=center]F-[/align][/td][td][align=center]5.702[/align][/td][td][align=center]3.96[/align][/td][td][align=center]5.463[/align][/td][td][align=center]3.72 [/align][/td][td][align=center]4.972 [/align][/td][td][align=center]3.28[/align][/td][/tr][tr][td][align=center]抗坏血酸[/align][/td][td][align=center]8.431[/align][/td][td][align=center]3.34[/align][/td][td][align=center]7.938[/align][/td][td][align=center]3.17[/align][/td][td][align=center]7.045[/align][/td][td][align=center]2.88 [/align][/td][/tr][tr][td][align=center]Cl- [/align][/td][td][align=center]10.908[/align][/td][td][align=center]/[/align][/td][td][align=center]10.176[/align][/td][td][align=center]/[/align][/td][td][align=center]8.932 [/align][/td][td][align=center]/[/align][/td][/tr][/table]溶液浓度在10.0mmol/L~15.0mmol/L时,抗坏血酸均能与氟化物和氯化物完全分离,氟化物峰分离度分别为3.96、3.72和3.28,抗坏血酸的峰分离度分别为3.34、3.17和2.88,完全满足相邻组分完全分离R≥1.5的要求[12],故本试验选择12.0mmol/L的NaHCO3溶液为淋洗液,在此淋洗条件下抗坏血酸与氟化物和氯化物等常见阴离子的分离色谱图见图1。[align=center]图1 抗坏血酸与氟化物和氯化物分离色谱图[/align]2.1.2 淋洗液流量的影响[color=black]考察了淋洗液流量分别为0.8、1.0、1.2 mL/min时各组分的分离情况,试验结果见表2,从表2可见,随着淋洗液流量的升高,[/color]各组分[color=black]的保留时间(T)逐渐缩短,[/color]氟化物的峰分离度(R)逐渐降低,抗坏血酸的峰分离度(R)变化较小。[color=black]在保证[/color]抗坏血酸[color=black]与其他离子良好分离的前提下,以使组分有较短的保留时间和较高的[/color]峰分离度、[color=black]系统有较低的压力,综合考虑,确定淋洗液流量为1.0mL/min。[/color][align=center]表2 淋洗液流量的影响(12.0mmol/LNaHCO3溶液)[/align][table][tr][td=1,2][align=center]组分[/align][/td][td=2,1][align=center]0.8ml/min[/align][/td][td=2,1][align=center]1.0ml/min[/align][/td][td=2,1][align=center]1.2ml/min[/align][/td][/tr][tr][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][td][align=center]T/min[/align][/td][td][align=center]R[/align][/td][/tr][tr][td][align=center]F-[/align][/td][td][align=center]6.746[/align][/td][td][align=center]3.70[/align][/td][td][align=center]5.480[/align][/td][td][align=center]3.72[/align][/td][td][align=center]4.635 [/align][/td][td][align=center]3.18[/align][/td][/tr][tr][td][align=center]抗坏血酸[/align][/td][td][align=center]9.775[/align][/td][td][align=center]3.19[/align][/td][td][align=center]7.950[/align][/td][td][align=center]3.18 [/align][/td][td][align=center]6.692 [/align][/td][td][align=center]3.15 [/align][/td][/tr][tr][td][align=center]Cl- [/align][/td][td][align=center]12.473[/align][/td][td][align=center]/[/align][/td][td][align=center]10.163[/align][/td][td][align=center]/[/align][/td][td][align=center]8.571 [/align][/td][td][align=center]/[/align][/td][/tr][/table]2.1.3 柱箱温度的选择试验了柱箱温度为25℃、30℃、35℃、40℃时各组分的分离效果,结果显示,随着柱温的升高,抗坏血酸的[color=black]保留时间稍微延长,峰面积逐渐降低,[/color]峰分离度也[color=black]逐渐降低[/color],分别为3.25、3.17、2.95和2.81,这与邻苯二甲酸根[13]、草酸[14]、对氨基苯黄酸和巴比妥酸的试验结果正好相反,这是否与温度较高时抗坏血酸稳定性降低加速其降解有关,则有待进一步研究。考虑到较高温度时抗坏血酸更容易发生降解反应,同时便于柱温的控制,本试验选择较低的柱箱温度为30℃。2.1.4 色谱柱的选择[color=black]以[/color]12.0mmol/L的NaHCO3溶液为淋洗液[color=black]、流量1.0 mL/min等度洗脱,考察了SH-AC-1型和SH-AC-3型阴离子交换柱对[/color]抗坏血酸与其他常见阴离子[color=black]的分离效果。结果表明,SH-AC-1型阴离子交换柱虽然能将[/color]抗坏血酸与氟化物、[color=black]氯化物等[/color]常见阴离子完全分离,但抗坏血酸的检测灵敏度明显偏低[color=black],[/color]试验选择SH-AC-3型阴离子交换柱为分离柱。2.2[size=12px][color=black] [/color][/size][color=black]共存物质的影响[/color][color=black] 分别取1.1所列各种标准溶液配制成含[/color]抗坏血酸[color=black]100mg/L,硝酸盐、亚硝酸盐各10mg/L,氯化物5mg/L,溴化物、苯甲酸、草酸各20mg/L,硫酸盐、乙酸盐、[/color]H2PO4-[color=black]各40mg/L,氟化物2mg/L的混合标准溶液,取1.5mL于样品瓶中,启动自动进样器进样测定,以考察[/color]抗坏血酸[color=black]与前述8种常见阴离子和2种有机酸的分离效果,[/color]结果表明,在本试验条件下,抗坏血酸[color=black]与前述8种常见阴离子和2种有机酸[/color]可以完全分离,但H2PO4-、硫酸盐和[color=black]草酸的保留时间分别长达55min、110min和152min多钟[/color],其余组分的色谱图见图2,从图2可知,[color=black]氟化物和乙酸盐[/color]的出峰顺序均在抗坏血酸之前[color=black],[/color]其余8种组分的出峰顺序均在抗坏血酸之后,其中[color=black]苯甲酸[/color]与[color=black]硝酸盐[/color]完全不能分离二者合并为一个峰,可见所考察的10种物质均不影响抗坏血酸的测定。[align=center]图2 抗坏血酸与常见阴[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]图[/align][color=black]2.3 [/color][color=black]线性方程、线性范围与检出限[/color]按照1.3.1配制标准系列,测定抗坏血酸的峰面积,[color=black]以[/color]抗坏血酸的峰面积(y)为纵坐标,以色谱峰面积对应的抗坏血酸的质量浓度(x)为横坐标绘制标准曲线,进行线性回归。测定仪器30min的基线噪声[15],以3倍基线噪声除以标准曲线的斜率(3N/b)计算抗坏血酸的最低检出限。其标准曲线的线性范围、线性方程、相关系数r(回归方程的截距、斜率和r均由仪器软件自动生成)、检出限如下:线性范围:3.0~500.0mg/L,线性方程:y=11820x-52060,相关系数r为0.9993,检出限为2.7mg/L。其中,50.0mg/L的抗坏血酸的色谱图见图3。[align=center]图3 50.0mg/L的抗坏血酸标准色谱图[/align][color=black]2.4[/color][color=black] 样品测定及加标回收试验[/color]按1.3.3、1.3.4的步骤操作,对维生素C针剂和片剂中抗坏血酸含量各平行测定5次,计算测定结果的相对标准偏差(RSD)。并在样中分别添加25.0、50.0、100.0mg/L的抗坏血酸测定方法的回收率,方法的加标回收率及测定结果的相对标准偏差(RSD)结果见表3。由表3可知,加标回收率在95.1%~101.6%,RSD为1.55%~2.79%,方法的回收率较高、重现性良好。其中维生素C针剂及加标样品色谱图见图4。[align=center]图4 维生素C针剂及加标样品色谱图[/align][align=center]表3 样品测定及加标回收试验结果[/align][table][tr][td][align=center]样品名称[/align][/td][td][align=center]样品中抗坏血酸含量[/align][/td][td][align=center][color=black]本底值/(mgL[/color][color=black]-1[/color][color=black])[/color][/align][/td][td][align=center]加入量/(mgL-1)[/align][/td][td][align=center][color=black]测得量/[/color][/align][align=center][color=black](mgL[/color][color=black]-1[/color][color=black])[/color][/align][/td][td][align=center][color=black]回收率[/color]/%[/align][/td][td][align=center]RSD/%[/align][/td][/tr][tr][td=1,2][align=center]维生素C针剂[/align][/td][td=1,2][align=center]0.498g/2ml[/align][/td][td][align=center]243.4、245.7、249.4、249.8、253.3[/align][/td][td][align=center]50.0[/align][/td][td][align=center]299.1[/align][/td][td][align=center][color=black]101.6[/color][/align][/td][td][align=center]1.55[/align][/td][/tr][tr][td][align=center]24.36、25.06、24.63、24.96、25.82[/align][/td][td][align=center]25.0[/align][/td][td][align=center]49.94[/align][/td][td][align=center][color=black]100.6[/color][/align][/td][td][align=center]2.21[/align][/td][/tr][tr][td=1,2][align=center]维生素C片剂[/align][/td][td=1,2][align=center]0.10g/片[/align][/td][td][align=center]103.0、102.7、99.91、98.33、96.53[/align][/td][td][align=center]100.0[/align][/td][td][align=center]195.2[/align][/td][td][align=center][color=black]95.1[/color][/align][/td][td][align=center]2.79[/align][/td][/tr][tr][td][align=center][color=black]24.91[/color][/align][/td][td][align=center]25.0[/align][/td][td][align=center]48.96[/align][/td][td][align=center][color=black]96.2[/color][/align][/td][td][align=center]/[/align][/td][/tr][/table]3 结语 建立了以SH-AC-3型阴离子交换柱为分离柱,以12.0 mmol/L NaHCO3溶液为淋洗液,流量为1.0 mL/min等度洗脱,[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]-抑制电导检测法测定抗坏血酸的新方法。方法应用于维生素C针剂和片剂中抗坏血酸含量测定,加标回收率为95.1%~101.6%,5次平行测定结果的相对标准偏差(RSD)小于3%,抗坏血酸的最低检出限为2.7mg/L,方法回收率较高、重现性良好,操作简便快速,可用于维生素C针剂和片剂等样品中抗坏血酸含量测定。参考文献1)武汉大学.分析化学实验[M].第三版.北京:高等教育出版社,1997:1672)陈燕清,曾桂生,倪永年.催化动力学光度法测定抗坏血酸的研究[J],食品科学,2009,30(8):2043)李冰冰,周晓光,朱泮民.紫外光度法测定药品中抗坏血酸的研究[J],光谱实验室,2005,22(1):1524)陈霖进,熊惠之,喻湘华,等.聚吡咯纳米管对抗坏血酸的电化学检测[J],武汉工程大学学报,2018,40 (2):1325)[url=https://s.wanfangdata.com.cn/paper?q=%E4%BD%9C%E8%80%85:%22%E5%88%98%E7%9C%9F%E7%9C%9F%22%22 \t %22https://d.wanfangdata.com.cn/periodical/_blank]刘真真[/url],[url=https://s.wanfangdata.com.cn/paper?q=%E4%BD%9C%E8%80%85:%22%E9%BD%90%E6%B2%9B%E6%B2%9B%22%22 \t %22https://d.wanfangdata.com.cn/periodical/_blank]齐沛沛[/url],[url=https://s.wanfangdata.com.cn/paper?q=%E4%BD%9C%E8%80%85:%22%E7%8E%8B%E6%96%B0%E5%85%A8%22%22 \t %22https://d.wanfangdata.com.cn/periodical/_blank]王新全[/url],等.[url=https://d.wanfangdata.com.cn/periodical/sp201611005%22 \t %22https://d.wanfangdata.com.cn/periodical/_blank]超高效液相色谱-四极杆-飞行时间质谱测定果蔬中维生素C[/url][J],[url=https://www.wanfangdata.com.cn/perio/detail.do?perio_id=sp%22 \t %22https://d.wanfangdata.com.cn/periodical/_blank]色谱[/url],2016,34(11):1048刘胜辉,藏小平.[url=https://d.wanfangdata.com.cn/periodical/sp201611005%22 \t %22https://d.wanfangdata.com.cn/periodical/_blank]高效液相色谱法测定水果中抗坏血酸[/url][J],生命科学仪器,2005,3(4):387)刘 慧,姜伟化,贺 霞,等.[url=https://d.wanfangdata.com.cn/periodical/sp201611005%22 \t %22https://d.wanfangdata.com.cn/periodical/_blank]离子交换色普法测定复方维生素咀嚼片中维生素C[/url]含量[J],中国新药杂志, 2013,22(8):971虞爱旭,曾文芳,王小芳,等.碳纳米管修饰安培检测抗坏血酸[J],中国卫生检验杂志,2007,17(11):19369)陈巧珍,胡克季,三浦恭之.间接荧光检测离子色普法分析维生素C亚硫酸根硫代硫酸根[J],[url=https://www.wanfangdata.com.cn/perio/detail.do?perio_id=sp%22 \t %22https://d.wanfangdata.com.cn/periodical/_blank]色谱[/url],1999, 17(5):4810)[color=#333333]丰 航,陈德妙,李 荣,等. [url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定葡维氨糖胶囊中盐酸氨基葡萄糖和维生素C的含量[J]. 西北药学杂志,2018,33(2):185[/color][color=#333333]11)[/color]杭义萍,卢祝靓子,杨春英[color=#444444].抗坏血酸存在下[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法直接测定尿液中草酸含量的研究[J].分析测试学 报,2014,33(11):1307[/color][color=#444444]12)[/color]许春向,邹学贤.现代卫生化学[M].北京:人民卫生出版社,2000:49113)李红江.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法测定实验室废水中邻苯二甲酸根[J],化学分析计量,2021,30(6):3114)张丽,黄选忠,杜宏山.[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法同时测定尿液中草酸和硫氰酸盐[J],化学分析计量,2021,30(2): 4615)JJG823-2014 中华人民共和国国家计量检定规程 [url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱仪[/color][/url][s][/s]
【作者】 蔡俊安(河南百年康鑫药业有限公司)【摘要】 目的采用高效液相色谱(HPLC)法测定三妙丸的盐酸小檗碱含量。方法采用Diamonsil ODS1 C18色谱柱(250 mm×4.6 mm,5μm),以50∶50的乙腈-0.1%磷酸溶液(每100mL加十二烷基磺酸钠0.1 g)为流动相,流速为1.0 mL/min,检测波长265 nm。结果盐酸小檗碱进样量在0.127~2.54μg范围内与峰面积线性关系良好,回归方程Y=418 567.505-92 087.201X,r=0.999 4。平均加样回收率为99.53%,RSD为0.48%(n=6)。结论该法简便、准确、专属、重复性好,为三妙丸的盐酸小檗碱含量分析提供了科学有效的方法。 【谱图】http://ng1.17img.cn/bbsfiles/images/2012/08/201208211757_385121_1609970_3.jpg
有没有朋友测过 肉制品中的山梨酸钾的含量与山梨酸的含量是不是一样的呀?
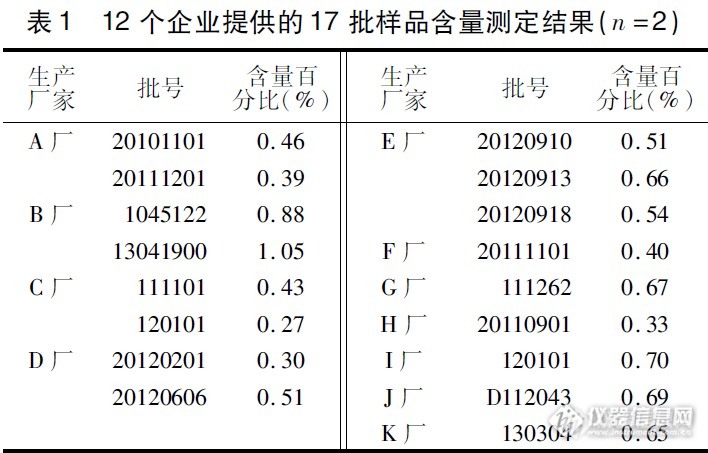
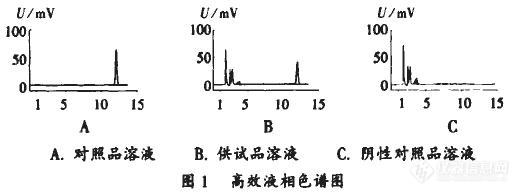
摘 要 目的:建立西黄丸中11-羰基-β-乙酰乳香酸的定性定量检验方法。方法:采用薄层色谱法和高效液相色谱法建立西黄丸中乳香类成分11-羰基-β-乙酰乳香酸的方法。结果:运用建立的薄层色谱法检测12个生产厂家提供的17批西黄丸,均含有11-羰基-β-乙酰乳香酸,但含量差别大,运用高效液相色谱法对其进行含量测定,其中11-羰基-β-乙酰乳香酸含量最低为0.27%,最高为1.05%。结论:建立薄层色谱法和高效液相色谱法可用于西黄丸中11-羰基-β-乙酰乳香酸的定性定量检验,可作为西黄丸现行法定检验标准中乳香显微鉴别的有益补充。西黄丸为一种纯中药制剂,属于临床急重症用药品种,由牛黄、麝香、乳香、没药四种中药材组成,具有抗菌消炎、抗病毒、抗结核、镇静止痛、止血消肿、抗癌以及增强机体抗病能力的作用,是经典抗癌药物。在临床中用于各种癌症的治疗及辅助治疗,能改善中晚期癌症患者的临床症状,提高患者生活质量。其中,乳香主要成分中以11-羰基-β-乙酰乳香酸含量最高。本文采用薄层色谱法和高效液相色谱法对西黄丸中11-羰基-β-乙酰乳香酸进行鉴别和含量测定,现报道如下。1仪器与试药CAMATS-4全自动点样仪;CAMAGREPRO-TAR3薄层扫描仪带照相系统;戴安Ulitimate 3000高效液相色谱仪(PDA检测器);XS-204电子天平(梅特勒-托利多仪器(上海)有限公司)。11-羰基-
糙米的抗性淀粉含量高,这种淀粉难以被胃液分解,能帮助控制餐后血糖水平,且在肠道菌群的作用下能生成丁酸,增强肠道免疫力。
糙米的抗性淀粉含量高,这种淀粉难以被胃液分解,能帮助控制餐后血糖水平,且在肠道菌群的作用下能生成丁酸,增强肠道免疫力。
总的氨基酸含量 游离氨基酸含量 氨基氮含量 总氮含量的区别?
师哥做的实验,测生物质厌氧发酵挥发性有机酸含量。采用GC-2014C[url=https://insevent.instrument.com.cn/t/Mp][color=#3333ff]气相色谱仪[/color][/url](日本岛津)分析,FID检测器,WondaCap FFAP色谱柱,梯度升温,载气为N2。这一批实验结果为何只有总酸含量,却没有具体酸含量。
药典上一些抗生素,有有关物的HPLC测定方法,但其含量用抗生素效价法测定,请问:可以用检有关物的方法来测定此抗生素的含量么?
如题:氨基酸态氮含量等同于氨基酸含量吗?
请教各位一下: 有谁做过氯乙酸含量的测定实验 我想问一下在测定二氯乙酸时,终点应如何判断?我是用HG/T 3271-2000中规定的方法进行的
苹果中抗氧化的多酚、绿原酸和黄酮类等植物化学物质含量丰富,升血糖的速度在水果中也不快。再加上价格平民,冬天值得推荐。
大蒜素含有的医疗活性成份包括含硫有机化合物、活性酶、微量元素硒等三类。 大蒜素其中含有1:大蒜辣素 2:大蒜烯 3:含硒有机化合物其中,大蒜烯,又名阿霍烯(二烯丙几硫代磺酸酯),有顺、反两种结构。实验证明该成分有强大的抗血小板凝聚作用。 请问各位老师,怎么样测定大蒜素中大蒜烯的含量????

作为中华民族的伟大创造之一,中药既可以治病,也可以养生。皮肤敏感的你,是否钟情于副作用小的中药护肤品呢?注重健康的你,也曾留恋于养生馆的中药保养吗?作为爱吃的你,肯定钟意于中药美食的扑鼻清香吧?日常生活中几乎每个人都会与中草药发生联系,做菜、泡茶、泡酒、足浴、美容等方面总会有中草药的影子。那么中药中的有效成分如何检测呢?就以半夏中琥珀酸含量测定为例。 半夏(学名:Pinellia ternata),又名地文、守田等,属天南星目。广泛分布于中国长江流域以及东北、华北等地区。药用植物,具有燥湿化痰,降逆止呕,生用消疖肿作用,兽医用以治锁喉癀。且研究表明,半夏中的琥珀酸有止咳平喘的作用,这与半夏的作用基本一致。我们根据中国药典的规定,采用电位滴定法对半夏中琥珀酸的含量进行了检测,结果如下:http://ng1.17img.cn/bbsfiles/images/2017/01/201701191701_669817_3134100_3.png1.参考文献《中华人民共和国药典》2015年版第一部。 http://ng1.17img.cn/bbsfiles/images/2017/10/2016083016063176_01_3134100_3.png 2.实验仪器与试剂 T860电位滴定仪,PH复合电极,无水乙醇,氢氧化钠溶液:c(NaOH)=0.1mol/L,滴定剂:c(HCl)=0.1mol/L,待测半夏样品3.实验步骤 电位滴定仪清洗完毕,精密称取样品粉末5g左右,至锥形瓶中,加乙醇50ml,加热回流1小时,同上操作,再重复提取2次,放冷,滤过,合并滤液,蒸干,残渣精密加入氢氧化钠滴定液(0.1mol/l)10ml,超声处理(功率500W频率40khz)30分钟,转移至100ml容量瓶中,加纯化水溶解至刻度,摇匀,精密量取40ml至滴定杯中,加水40ml,用盐酸滴定液(0.1mol/l)进行电位滴定至终点,并将滴定结果用空白实验校正。4.测试结果1)T860电位滴定仪参数设置:常量滴定 终点数:1结束体积:15.000ml终点突跃量:300.0添加最小体积:0.020ml 初次添加体积:0.050ml http://ng1.17img.cn/bbsfiles/images/2017/10/2016083016071206_01_3134100_3.png2)实验结果空白体积:3.575ml滴定剂浓度:c(NaOH)=0.100mol/L编号 m(g)V(ml)E’E(mv)琥珀酸含量(%)平均含量(%)样品15.021192.611600-61.90.28340.28402.592515-76.90.2890样品25.044172.586500-87.00.28942.620515-64.70.2794样品35.025622.624610-79.40.27932.609605-80.90.28373)曲线图谱 http://ng1.17img.cn/bbsfiles/images/2017/10/2016083016102712_01_3134100_3.png图一http://ng1.17img.cn/bbsfiles/images/2017/10/2016083016111018_01_3134100_3.png图二5.讨论 半夏中琥珀酸平均含量为0.28%,合格(中国药典规定不得少于0.25%)。采用电位滴定法测定半夏药材中琥珀酸含量简便、快捷,可以省时省力,
国标检测甘氨酸含量的原理是什么国标中,检测甘氨酸含量是用高氯酸标准溶液非水滴定的,用的是结晶紫指示剂,请问,原理是什么呢?国标中没有提到~~氮基乙酸含量的测定检测方法提要:试样以甲酸为助溶剂,以冰乙酸为溶剂,以结晶紫为指示剂,用高氯酸标准滴定溶液滴定,根据消耗高氯酸标准滴定溶液的体积,计算氨基乙酸的含量。
摘要:建立胡黄连中香草酸和桂皮酸的含量测定方法。方法用双波长扫描法测定胡黄连中香草酸和桂皮酸的含量。结果香草酸。桂皮酸斑点峰面积3Il内稳定,香草酸回收率为103.86%,RSD=1.33%,桂皮酸回收率为103.16%,RSD=1.28%。结论该方法稳定,可行。具有实用性。 关键词:胡黄连 薄层扫描法 香草酸 桂皮酸 胡黄连具有保肝利胆、抗炎、抗真菌等药理作用。胡黄连含胡黄连素、胡黄连苷(I II III)、D-甘露醇、香草酸、肉桂酸、胡黄连醇成分。香草酸和桂皮酸是其中的两种抗菌成分。我们对胡黄连中香草酸、桂皮酸含量建立了薄层扫描法,以达到控制胡黄连的质量,从而为临床疗效提供保证。 1 仪器与试剂 药材:胡黄连,太原市药材公司;仪器:日本岛津CS--9301PC薄层扫描仪;手提式荧光灯(上海固村电光仪器厂);对照品:香草酸对照品(中国药品生物制品检定所);桂皮酸对照品溶液(省药检所提供e=0.604mg/50ml);硅胶GF254(青岛海洋化工厂)所用试剂均为分析纯。 2 实验条件 2.l 薄层层析条件:分别以石油醚-氯仿-丙酮-冰醋酸(10:4.4:10.1);正己烷-乙醚-冰醋酸(5:5:0.1);正己烷-氯仿-乙醚-冰醋酸(5:3:2:0.1)以及氯仿:甲醇(2:1)展开,多次比较发现正己烷。氯仿-乙醚-冰醋酸(5:3:2:0.4)分离效果好。 2.2 测定波长及主要扫描参数,分别对香草酸,桂皮酸对照品斑点在200nm-370nm扫描,在290nm处有最大吸收,350nm处无吸收,固定350nm为参比波长,290nm为测定波长。
大家好: 本人是第三方环境检测机构,最近遇到客户有送废酸过来检测里面的重金属含量和酸含量。查了好多资料后也没有具体的检测标准方法。想请教一下各位老师,关于废酸有没有相关的检测标准或者技术规范,可以作为检测的依据?谢谢大家
茴香乙酸乙酯部位和正丁醇部位具有体外抗氧化活性。其中,乙酸乙酯部位清除 DPPH 自由基和 ABTS+自由基的能力(IC50 分别为(37.67±0.21)、(24.88±0.07)μg/mL)比正丁醇部位的清除能力(IC50 分别为(47.48±0.18)、(34.19±0.19)μg/mL)强,且具有显著性差异(p0.05),而正丁醇部位对铁离子的还原能力(TEAC 值为(569.9±0.69)μmol/g)比乙酸乙酯部位的还原能力(TEAC 值为(281.23±4.73)μmol/g)强,且具有显著性差异(p0.05)。乙酸乙酯部位清除 DPPH 和 ABTS 自由基的能力强可能与其总黄酮含量高有关,正丁醇部位还原铁离子的能力好与其总多酚含量高有关。
我们要使用马来酸二乙酯作为反应原材料,不知怎么验收,除了含量指标还有其他重要项目吗?主要是怎么做含量
有一样品,是有机物,混有乙酸(为杂质),或者是乙酸盐,请问用什么仪器可以测定乙酸的含量呢?
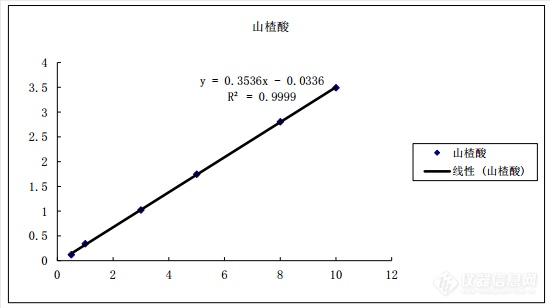
[align=center][b]山楂饮片中三萜酸含量的测定[/b][/align][b]摘要[/b]目的:测定市售山楂饮片中三萜酸和不同干燥方式处理后的山楂中三萜酸的含量。方法:通过实验研究测定不同炮制方式得到的市售山楂饮片中三萜酸的含量,比较数据后发现炒焦更有利于三萜酸的保留。实验通过设计五种不同干燥方式如晒干干燥、不同温度烘干、红外线干燥等对山楂干制过程中三萜酸含量的影响。结论:得到60℃烘干和晒干干燥是保证山楂中三萜酸含量最大值的理想的干燥方式,烘干干燥山楂时理想的干燥温度在60℃。[b][/b]关键词:山楂饮片;干燥方法;三萜酸[align=center][b]Determinationof triterpenoid acids’content in Hawthorn[/b][/align][b]Abstract[/b] Objectives:Thispaper reviews the lastest progress ondetermining the contentof marketing triterpenoid acids of Hawthorn slices and different drying methodsefforted on the Hawthorn slices. Methods:The content of triterpenoid acids inthe marketing Hawthorn pieces was determined by experimental study. Aftercomparing the data,it was found that the scorch was more conductive to theretention of triterpenoid acids. The effect of five different drying methods,suchas natural drying,drying at different temperatures and drying with infrared ray,onthe content of triterpenoid acid in dried hawthorn was studied. Results:Dryingand drying at 60 ℃ are twoideal drying methods to guarantee the maximum value of the triterpenoid acid inhawthorn. When heated and dried hawthorn,the ideal drying temperature is 60℃.Keywords: Hawthornslices triterpenoid acid drying method[b]1.前言[/b]山楂为蔷薇科山楂属植物山里红或大果山楂及野山楂的干燥成熟果实[sup][/sup]。其果实作为常用中药,干制后可入药,是中国特有的药果兼用树种[sup][/sup]。近年来科学研究山楂的主要药理功能为[color=#333333]具有降血脂、舒张血管降血压、强心等[/color],同时具有抗心律失常等疗效[sup][/sup]。现代临床科学和动物实验研究证实山楂有降低血清总胆固醇(游离胆固醇和胆固醇酯)、甘油三酯(Triglyceride,缩写TRIG)[sup][/sup]。山楂三萜酸主要成分有3种,分别为山楂酸、齐墩果酸和熊果酸。齐墩果酸和熊果酸是互为同分异构体的两种五环三萜类化合物[sup][/sup]。齐墩果酸临床上用于护肝降酶,治疗支气管炎、肺炎、急性扁桃体炎、急性肠胃炎、泌尿系统感染,齐墩果酸还用于治疗急性肝炎[sup] [/sup]。熊果酸具有可以迅速降低体内谷丙转氨酶、血清转氨酶[sup][/sup],在体内发挥消退黄疽、增加食欲和改善肝功能的作用,尤其在抗肿瘤,抗氧化,抗炎保肝,降血脂方面的作用疗效确切[sup][/sup]。[b]2 仪器与试药2.1仪器[/b]赛默飞3000高效液相制备色谱系统(含LPG-3400SD输液泵, VWD-3100紫外可见检测器,赛默飞变色龙色谱处理站); 70-1 型红外线干燥箱,功率为 0.5 kW,由龙口市电炉制造厂生产;光明FW-80高速全能粉碎机(北京永光医疗器械有限公司);HH-6数显恒温水浴箱;KQ-300VDE型三频数控超声波清洗器(昆山市, 江苏省镇淀山湖生产);红外线干燥箱71-1型(龙口市仪器有限公司)。[b]2.2试药[/b]山楂采收于山东省青州市王坟镇。色谱级甲醇(默克化学),分析级甲醇(天津富宇),其他试剂均为分析纯,蒸馏水为哇哈哈牌纯净水。山楂酸对照品(PRF7121942)购于成都普瑞法科技开发公司,齐墩果酸对照品(Q-003-110225)购于成都瑞芬思生物科技有限公司,熊果酸对照品(110742-200516)购于中国药品生物制品检定所。[b]3试验方法与结果3.1供试品制备[/b]取新鲜山楂,分为五组,干燥条件依次是晒干、40℃烘干、60℃烘干、80℃烘干、红外干燥。干燥后粉碎,经60目过筛,备用。[b]3.2色谱条件[/b]Acclaim120-C18柱(250mm×4.6mm,5μl)色谱柱;流动相:甲醇:乙腈:醋酸铵水溶液 ( 12:67:21);流速1ml /min;柱温 30℃;进样10[color=#333333]μl[/color];检测波长: 210nm[sup][/sup]。[b]3.3供试品溶液制备[/b]精密称取1.0g山楂粉末于锥形瓶,加25mL甲醇,盖紧瓶塞称重[sup][/sup];用超声波清洗器处理0.5h后,取出锥形瓶,冷却至室温,再次进行称重,用甲醇补足缺失的重量,摇匀,过滤[sup][/sup]。[b]3.4对照品溶液制备[/b]精密称定对照品山楂酸、齐墩果酸和熊果酸适量,分别置于容量瓶中,加甲醇溶解后加甲醇至刻度,摇匀,即得对照品浓度为:山楂酸0.0482mg/mL、齐墩果酸0.1756mg/mL、熊果酸0.1576mg/mL。[b]3.5方法学考察[/b]3.5.1标准曲线的绘制分别精密量取齐墩果酸与熊果酸标准溶液0.5,1.0,3.0,5.0,8.0,10.0,15.0mL (对照品浓度为:山楂酸0.0482mg/mL、齐墩果酸0.1756mg/mL、熊果酸0.1576mg/mL)进样5[color=#333333]μL[/color]测定,以峰面积Y对进样量X进行线性回归。标准曲线见图1、2、3。[align=center][img=,550,308]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191641568452_2649_3255306_3.png!w550x308.jpg[/img][/align][align=center]图1 山楂酸标准曲线图[/align][align=center][img=,569,196]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191642085402_8677_3255306_3.png!w569x196.jpg[/img][/align][align=center]图2 齐墩果酸标准曲线图[/align][align=center][img=,572,191]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191642191762_2396_3255306_3.png!w572x191.jpg[/img][/align][align=center]图3熊果酸标准曲线图[/align]得山楂酸、齐墩果酸和熊果酸回归曲线分别在0.5~15.0μL范围呈线性,结果见表1。[align=center][/align][align=center]表1三萜酸标准曲线[/align][align=center][img=,592,131]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191642527962_2765_3255306_3.png!w592x131.jpg[/img][/align]3.5.2精密度试验精密称取山楂粉末1.0g,按照“3.2供试品溶液制备”方法制备供试品溶液,依次在高效液相色谱仪自动进样,重复进样5次。测定峰面积,求得山楂酸、齐墩果酸和熊果酸的RSD值。考查结果见表2。[align=center]表2 精密度试验结果[/align][align=center][img=,450,253]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191643050842_6082_3255306_3.png!w450x253.jpg[/img][/align] 相对标准偏差(RSD)反映本实验分析测试结果的精密度,由表2数据可知山楂酸、齐墩果酸熊果酸的RSD均小于3%,表明[color=#333333]测量数据比较集中,表明仪器的精密度良好[/color]。3.5.3重复性试验精密称取山楂粉末5份各1.0g,按照“3.2供试品溶液制备”方法制备供试品溶液,连续进样。测定峰面积,计算3种三萜酸含量,得山楂酸、齐墩果酸和熊果酸的RSD值。考查结果见表3。[align=center]表3 重复性试验结果[/align][align=center][img=,506,252]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191643179680_8032_3255306_3.png!w506x252.jpg[/img][/align]表3数据表明,测得平均含量的山楂酸为0.0172%,齐墩果酸为0.0831%,熊果酸为0.4574%,3种三萜酸重复性试验的RSD分别为1.54%、1.42%、2.72%,均小于3%表明实验的重复性良好。3.5.4稳定性试验取供试品溶液,分别在0、2、4、6、8、12、24h进样,测定峰面积,计算山楂酸、齐墩果酸和熊果酸峰面积的RSD值,结果见表4。[align=center]表4 稳定性试验结果[/align][align=center][img=,524,253]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191643327435_9583_3255306_3.png!w524x253.jpg[/img][/align]表4数据表明,山楂酸的RSD为1.65%,齐墩果酸RSD为1.62%,熊果酸RSD为2.73%。表明供试液在24h内稳定。3.5.5加样回收试验取已知含量的山楂粉末0.5g,精密称定,加入与之含量相当的对照品,按照“3.2供试品溶液制备”方法制备供试品溶液,测定峰面积,计算山楂酸、齐墩果酸和熊果酸的平均回收率和RSD。考查结果见表5、6、7。[align=center]表5山楂酸回收试验结果[/align][align=center][img=,572,190]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191643511302_9239_3255306_3.png!w572x190.jpg[/img][/align][align=center]表6齐墩果酸回收试验结果[/align][align=center][img=,565,192]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191644064889_8635_3255306_3.png!w565x192.jpg[/img][/align][align=center]表7熊果酸回收试验结果[/align][align=center][img=,570,192]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191644200242_1531_3255306_3.png!w570x192.jpg[/img][/align] 由5、6、7可知,山楂酸平均回收率为102.1%,RSD为2.35%,齐墩果酸平均回收率为99.1%,RSD为2.32%,熊果酸平均回收率为100.5%,RSD为1.82%,表明方法准确度良好。[b]3.6样品测定[/b] 照“3.2”项下色谱条件测定市售山楂样品中山楂酸、齐墩果酸、熊果酸的含量。结果见表8、9、10。[align=center]表8 24批生山楂中三萜酸含量[/align][align=center][img=,372,485]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191644349002_5988_3255306_3.png!w372x485.jpg[/img][/align][align=center]表9 3批炒山楂中三萜酸含量[/align][align=center][img=,417,94]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191644487992_9492_3255306_3.png!w417x94.jpg[/img][/align][align=center]表10 8批焦山楂中三萜酸含量[/align][align=center][img=,420,208]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191645042202_1067_3255306_3.png!w420x208.jpg[/img][/align]表8数据表明,生山楂中山楂酸的含量在0.007%~0.025%,平均含量为0.014%;齐墩果酸的含量在0.067%~0.127%,平均含量为0.084%。熊果酸的含量在0.302%~0.615%,平均含量为0.416%。表9数据表明,炒山楂中山楂酸的含量在0.010%~0.016%,平均含量为0.012%。齐墩果酸的含量在0.065%~0.073%,平均含量在0.071%;熊果酸的含量在0.318%~0.365%,平均含量在0.348%。表10数据表明,焦山楂中山楂酸的含量在0.011%~0.029%,平均含量为0.021%;齐墩果酸的含量在0.071%~0.098%,平均含量在0.086%;熊果酸的含量在0.346%~0.464%,平均含量为0.415%。[align=center]表11不同干燥方式对山楂饮片中三萜酸含量的影响[/align][align=center][img=,338,121]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191645340376_1581_3255306_3.png!w338x121.jpg[/img][/align]4 讨论与小结实验比较了甲醇-磷酸水系统、乙腈-磷酸水系统、乙腈-醋酸铵水系统等,最终确定采用甲醇-乙腈-醋酸铵水系统为流动相,采用梯度洗脱测定3种三萜酸的含量。[align=center][img=,648,219]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191645456758_2764_3255306_3.png!w648x219.jpg[/img][/align][align=center]图5 3种三[color=#333333]萜酸结构式[/color][/align][color=#333333]山楂中[/color][color=#333333]3[/color][color=#333333]种三萜酸的保留时间不同是由于[/color][color=#333333]3[/color][color=#333333]种三萜酸的极性存在差异,山楂酸结构中比齐墩果酸和熊果酸多一个羟基,极性大所以保留时间短;而齐墩果酸和熊果酸结构类似,齐墩果酸和熊果酸吸光度和质量相差不大,极性相当,分离较为困难。[/color][align=center][img=,690,239]https://ng1.17img.cn/bbsfiles/images/2019/08/201908191646003843_4066_3255306_3.png!w690x239.jpg[/img][/align][align=center]图6 山楂样品三萜酸高效液相色谱图[/align][color=#333333] [/color]由表8~10可知,山楂酸、齐墩果酸、熊果酸3种三萜酸含量均呈现焦山楂>生山楂>炒山楂的趋势,其原因可能有①炒制时加热过程会对其成分产生一定的影响;②炒山楂、焦山楂样本量过少,使测定数据不准确;③一般炒山楂、焦山楂等炮制品均不采用质量较好的山楂,对测定结果有影响。在进一步的试验中,一方面扩大市售炒山楂、焦山楂的样本量,使其能更准确的代表市售饮片的质量情况;另一方面将自制若干批炒山楂和焦山楂,进行3种三萜酸的含量测定,考察炮制时的加热过程度化学成分的影响。表11数据表明,不同的干燥方式制成的山楂片中三萜酸的含量存在一定差异。而晒干干燥法制备的山楂饮片(0.552%)略高于40℃烘干(0.539%)而低于80℃烘干(0.561%),晒干是最省能源最环保的干燥方式,但受到天气影响较大,不适于饮片厂大规模生产加工,且晒干干燥所得山楂饮片断面略黄,外观稍差。60℃烘干干燥法制备的山楂饮片3种三萜酸总含量最高(0.588%),高于含量最低的红外干燥法制备的山楂饮片(0.475%)24%,表明60℃烘干法为最佳干燥方式。本实验只进行了一批山楂干燥方式的实验,尚需多批次实验以验证实验结果。[color=#333333] [/color][b]参考文献[/b] 《中华人民共和国药典》2015版,第一部:31 陈龙胜,吕 杨,许舒雯,忻 旸.山楂中三萜酸成分的研究.时珍国医国药,2008,19(12):2909-2910 张福元,王霁隐,王维思.HPLC法测定人血中维生素A.药物分析,1990,10(1):52. 熊全美,张焱,陈庆华,等.HPLC法检测维生素E微囊制剂含量及稳定性.中国医药工业杂志,1994,25(9):401. 谢莹,杭太俊,程赞,等.HPLC 法测定中药中齐墩果酸和熊果酸含量[J].中国中药杂志,2001,26( 9) :615- 617. 王延群.小小山楂作用大.中华养生保健,2014;01:301 白雪梅,付煜荣,田嘉铭.高效液相色谱法测定大山楂丸和山楂鲜果中齐墩果酸及熊果酸的含量[J].中国医院药学杂志,2006,26(8):981-982. 黄秋妹,李宗.HPLC 法测定山楂中熊果酸和齐墩果酸的含量[J].海峡药学,2007,19(3):43-45. 相延英,杨光.常用中药中齐墩果酸和熊果酸的含量测定[J].中国医院药学杂志,2004,24(5) :316-318. 文小静,张永利.熊果酸的提取工艺研究[J].实用药物与临床,2006,9(6) :342-343. 郝润喜,阎彩萍,孙晓飞,等.山楂中熊果酸高效液相色谱分析[J].药物分析杂志,1994,14(2) :30-31. 谢莹,杭太俊,程赞,等.HPLC 法测定中药中齐墩果酸和熊果酸含量[J].中国中药杂志,2001,26( 9) :615-617. 冯凤莲,张卉朱.山楂的研究进展[J].河北医科大学学报,1997,18(6) :383-385. 刘荣华,邵峰,邓雅琼,等.山楂化学成分研究进展[J].中药材,2008,31(7) :1100-1108. 罗玉梅,王贺0振.山楂的化学成分及药理研究进展[J].时珍国医国药,2004,15(1) :53-54 寇云云.山楂中三萜类化合物提取与成分分析[D].秦皇岛:河北科技师范学院,2012. 赵爱云,张立新,王能飞,等.山楂中熊果酸的提取工艺研究[J].食品工业科技,2006,27(11) :127-131. Liu J. Oleanolic acid andursolic acid: researchperspectives[J].Journalof Ethnopharmacolgy,2005,100(1-2):92-94. 李钐,王亚楠,万梓尤,等.山楂中熊果酸和齐墩果酸提取和纯化工艺的研究[J].食品科学,2007,28(7) :141-145. 黎海彬.山楂中熊果酸提取分离的工艺研究[J].食品科学,2009,30(16) :177-180.
请教各位大佬:测试工业乙酸乙酯时,滴定其酸度做出来乙酸的含量有时有达到0.1%,但在进样的谱图上却见不到乙酸峰,测试条件:柱温150,进样器250,TCD180,电流80
大黄酸含量测定方法一览[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=8736]大黄酸含量测定方法一览[/url]
我想测定乙酸乙酯含量 找不到测定方法 请帮助
有谁知道丙酮酸肌酸的含量测定方法?有谁知道丙酮酸肌酸的含量测定方法?有关资料说可以用高效液相色谱测定。也有说可以用酸碱滴定的方法测定。那位仁兄有关丙酮酸肌酸的含量测定方法,可以给我发一份吗?谢谢。附:丙酮酸肌酸分子式:C7H13N3O5 英文名:Creatine Pyruvate 分子量:219.20 外观:白色结晶粉末 丙酮酸肌酸是高能源性的物质之一,适当补充丙酮酸肌酸能够促进人体在运动的过程中能量的生成,以便延长机体运动时间,提高肌肉耐力速度和爆发力。并且能抑制肌肉中蛋白质的流失牞明显增加肌肉重量,促进脂肪代谢,减少体脂百分数,延缓疲劳。
糠氨基嘌呤的含量一般是怎么测定的?哪里可以测这个呢?