药品辅料干扰原料的测定主要有 1、辅料对原料有吸收,造成原料测定结果比理论值低。解决:更换辅料;减低辅料浓度和用量;变换分析方法和溶剂。判断方法:将辅料和已知重量对照品混合后分析,其结果和相同重量对照品分析结果比较,如果小于0.95。那该辅料就是对原料有吸收。2、辅料对原料干扰造成原料测定结果比理论值高。解决:紫外扫描看辅料和原料有没有在相同波长处有吸收;或作阴性干扰试验。
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=43700]药品GMP检查指南-原料药[/url]

2010版药品GMP指南(原料药)--SFDA正式版国家食品药品监督管理局药品认证管理中心编写转自网络http://www.yaojia.org/forum.php?mod=viewthread&tid=28036&fromuid=1023如果侵权,版主就删除吧。附件简介:1.2010版GMP实施指南-原料药;2.2011年8月第1版,中国医药科技出版社,pdf扫描版,共146M,386页。下载地址:http://115.com/file/aqk832tjhttp://ng1.17img.cn/bbsfiles/images/2011/09/201109222013_318731_2232707_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/09/201109222013_318732_2232707_3.jpghttp://ng1.17img.cn/bbsfiles/images/2011/09/201109222013_318733_2232707_3.jpg
分析原料药中溶剂残留,药品30度左右就分解了,是不是只能用顶空分析了?但是原料药分解产生的小分子和分析的残留物是同一种物质,该如何操作???
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=34465]药品GMP检查指南(原料药)[/url]有没有用都收藏起来吧,,也许你以后也能用的上。
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=14575]药品GMP检查指南(原料药)详细说明[/url]希望大家能够用的上,好的话,顶!!!!!!!!!![em17]
昨天,国家食品药品监督管理局在其官方网站上,曝光了一批生产企业通过违法给中药饮片染色达到增重目的。目前已对12家相关企业进行调查。涉嫌用化工色素金胺O进行染色、用铝盐和镁盐加重,并在药材中掺假等问题。评论:1、用化工原料染色,仅仅是为了加重?2、用铝盐和镁盐加重,会危害身体健康吗?3、保健药品好像片剂里面加人工合成色素是允许的,中药能加合成色素吗?4、中药很多都是胶囊,胶囊里的色素又是什么色素呢?5、金胺O,会不会是继铬之后又一轮新的打击项目,你了解金胺O的检测方法吗?赶快参与吧,又是药品的一个重磅炸弹!!!

[b][center]【第二届网络原创作品赛】药品(原料,成品、制剂)质量标准研究浅析[/center][/b][center][img]http://ng1.17img.cn/bbsfiles/images/2009/08/200908241737_167440_1600062_3.gif[/img][/center][center][img]http://ng1.17img.cn/bbsfiles/images/2009/08/200908241809_167443_1600062_3.jpg[/img][/center]从事药品研究的对于药品的质量标准制定是再熟悉不过了,文献报道的也非常多(这里主要是针对中药药品的质量标准制定)。有很多是来自国家课题,如对某些药品尚缺质量标准,有的是标准的提高(采用了更为先进的方法等),有的是对药品质量标准增加检测项,有的是来自国家药典委员会的研究项目等等。药品质量标准研究结构清晰,有章可循,从宏观上看是没有很大问题。但是在理清质量分析的基础上涉及到的具体方法研究和条件探索有的时候并不是一件容易的事。标准制定研究是一项细心的活,工作量大,有时由于时间的限制压力也很大,所以比较适合女孩子做。当然男孩子做,没问题,只要养成细心的习惯就好。质量标准制定,估计药厂里面做的不是很多(当然不排除),药厂做的是对原料、中间体和成品的检测(按照中国药典、部颁标准或企业标准)。质量标准研究做的比较多的是一些研究机构,如药检所,药物研究中心,药物检测中心或国家药监局、省药检所指定的事业单位或企业部门。好了,现在分别讨论对原料药、成品和制剂的有关质量研究发表下自己的看法和体会,以下内容仅代表自己的观点,如果有什么不对的地方,还请板油批评指出。[b]一、原料药的质量标准研究[/b]一种成药来自一味原料药的并不多,绝大多是复方,否则就没有处方保密问题了。现在以一味复方成品药为例来说明原料药的质量标准。首先了解该复方的处方组成(这不是废话嘛,呵呵,别急),如有A、B、C三味原料药组成。则需要对三味原料药进行质量标准的制定。三味药根据其入药成分的不同,分别采取不同的分析方法,不过其中原料的性状鉴别、显微鉴别是一样的。1、性状性状鉴别就是观察颜色,形状,味道情况,在没有标准之前,老药工就是根据这个方法进行辨别药材的好坏。2、鉴别显微鉴别就是取原料组织进行切片,经过适当的处理后,放在显微镜下观察,包括石细胞,鞘细胞,导管等分布情况,并最好附照片。对于一些比较特殊的药材或矿物要,可以根据其结构与特定试剂反应,有颜色反应或沉淀生产,如棕榈的鉴别。薄层鉴别是中药质量评价过程中主要的鉴别手段之一。对于中药的鉴别,采用薄层是最好的,采用对照药材,对照品和阴性比照,可以很清晰的辨别药材的真伪。薄层鉴别有其很多优点,如成本低,分析时间短,分离效果非常好,检测不受溶剂干扰和色谱直观性强等优点,用它来做定性鉴别是最好不过的。药典中大多数都是使用薄层鉴别。对于没有标准的药物,制定薄层鉴别,对于有些药物,特别是复方,条件摸索还有些难度。通常的筛选条件有:薄层板的选择,大多数用的是硅胶G板;点样量的考察,多了超载分不开,少了,点不清晰;展开剂的选择,这属于薄层鉴别最重要的部分了。选择展开是依据分析样品的性质决定,相似相容。黄酮类、生物碱类、酚酸类等都有比较成熟的条件。关于展开剂的选择,网上的资料也很多,关键是经验和实践。对于薄层色谱样品和对照品以及阴性样品的制备,和液相的处理方式差不多,但是没有液相的严格。一般包括超声萃取和加热回流,当然还有普通的水煎,对于特殊样品还可以采取SPE(固体萃取)或SFE(超临界流体萃取)等。如果没有标准参考,需要对处理方法进行考察,包括萃取溶剂的选择,萃取时间,加热温度,回流溶剂,回流时间,溶剂的浓度,方法之间选定指标进行比较。阴性样品是除掉要检测的药材或成分后,和样品处理方法一致制备而成的。所以点样的点应包括:3个批号的样品、对照品、对照药材、阴性对照样品。对于薄层色谱的操作方法参考《中国药典》2005年版(很快就是2010年版)附录ⅥB。
英文版的资料,有兴趣的朋友可以看看。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=42554]欧盟人用和兽用药品用起始原料API要求指南[/url]
大家好, 有人能帮助提供我原料药品心得安(盐酸普萘洛尔)的中控分析方法吗?恳请大家帮助。
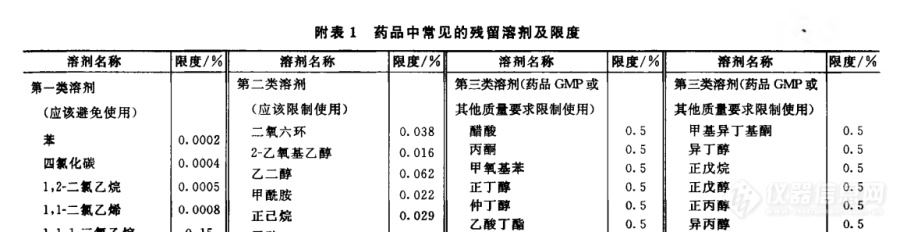
[img=,690,177]https://ng1.17img.cn/bbsfiles/images/2019/02/201902181740213114_5586_3373632_3.png!w690x177.jpg[/img]药典上说的溶剂残留的标准,指的是药品主成分的么,还是整个药品的,举例,比如说醋酸限度0.5%,那么这个0.5%是指谁的0.5%,现有1g某原料药,纯度是0.99g,那么这个醋酸的残留指的1g原料药中的0.5%,还是指有机溶剂残留量比上0.99小于0.5%呢,为什么这么问呢,因为原料药在中间产品阶段是液体,该液体里面有许多其他的杂质,这个环节有机溶剂残留也是0.5%的话,指的整个中间产品药液液体中么,还是药液中中间产品的(中间产品中可不纯,里面有很多杂质的),如果中间产品的话,通过方法我只能知道药液中主成分的量,无法知道整个药液中含有的不纯的中间产品质量
继银杏叶事件之后,国家食药监总局这次把“枪口”对准了生化药品的动物提取。 6月17日,国家食药监总局连发三文,披露对武汉华龙生物制药有限公司(以下简称华龙生物)的检查情况。相关文件显示,该局在5月份对华龙生物进行飞行检查发现,该公司未按药品标准规定生产小牛血去蛋白提取物注射液,违规从一家牛杂经销处直接外购其生产的小牛血浓缩液投料生产。国家食药监局勒令所有药品经营和使用单位立即停止销售和使用华龙生物生产的小牛血去蛋白提取物注射液,并收回华龙生物的药品GMP证书。 大部分产品已在销售 国家食药监管总局今年5月8日~12日对华龙生物进行飞行检查发现,其未按照药品标准规定生产小牛血去蛋白提取物注射液。按照批准的生产工艺,企业应当使用新鲜小牛血或小牛血清为原料,经过醇沉、离心、浓缩后制成小牛血浓缩液,再经过超滤或透析、灌装等步骤制成小牛血去蛋白提取物注射液。但华龙生物直接外购在未经许可场地生产的小牛血浓缩液投料生产。据了解,其小牛血浓缩液外购单位为沈阳市一家牛杂经销处。国家食药监总局检查发现,该经销处生产现场管理混乱,没有任何标识和记录,卫生环境差。 5月9日,华龙生物启动小牛血去蛋白提取物注射液的召回工作。该公司官网发布的《产品召回公告》显示,根据公司质量管理评审委员会检查、核实、评估,公司小牛血去蛋白提取物注射液生产过程中存在疑似不确定风险,为确保患者用药安全,现决定对公司小牛血去蛋白提取物注射液产品启动主动召回,按三级级别实施召回。华龙生物销售副总张少衡告诉记者,目前产品召回工作已经全部完成。产品按照三级级别召回,是最低级别的召回,该召回级别是由相关国家机构核定。“(产品)基本是无危险的,产品也未导致任何的不良反应。” 公司称,截至2015年6月13日,共召回226073支。但华龙生物在官网上公布的召回实施情况显示,其小牛血去蛋白提取物注射液产品几乎覆盖全国各地,其中绝大部分地区显示产品“已使用完”。 华龙生物市场部经理张建伟告诉记者,由于公司召回的小牛血去蛋白提取物注射液是自2014年初起的生产批次,至今已有一年半时间,所以确实大部分产品已经在市场上销售。 记者注意到,九州通旗下子公司辽宁九州通医药有限公司也是华龙生物小牛血去蛋白提取物注射液的采购厂商之一。九州通董秘办相关人士也告诉记者,“已使用完”表示公司已经销售。“目前辽宁公司已经按照销售流向下发了召回通知,我们对于这类生产企业召回药品的处理都有严格的处置管理规定,配合生产企业的召回。对于已经销售的产品如没使用,则召回后返回生产企业。” 北京鼎臣医药管理咨询中心负责人史立臣表示,目前暂时无法确定华龙生物生产的小牛血去蛋白提取物注射液是否会引发不良反应,但原材料不达标,生产产品肯定达不到标准要求。提取物监管越来越严 国家食药监总局要求湖北省食药监局收回华龙生物药品GMP证书,责令其停止生产,召回相关产品,并对发现的违法违规行为依法立案查处。张建伟告诉记者,目前华龙生物的GMP证书的确被暂时收回,目前公司也正在整改中,公司也正在等待复查结果。 值得注意的是,华龙生物背靠广信科教集团。据公司官网介绍,华龙生物先后获得“国家高新技术企业”、“生物生化药品全国三强单位”等称号。2014年2月,该公司顺利获得新版GMP认证证书。 史立臣认为,从此前银杏叶事件到现在的小牛血去蛋白提取物注射液,这表明国家对提取物的监管越来越严格。“以前无论是植物提取、动物提取还是矿物提取,国家的监管确实不够完善。现在国家对药品的质量,原材料等监控和处罚都越来越严。” 史立臣认为,生物制药企业从未经许可的生产单位提取产品,一方面是出于成本考虑,另一方面则是渠道少,量不够。由于国家此前在这一领域的标准缺失,有资质的生产单位少,“(制造企业)他们有可能自己到一些非法的屠宰场、加工点,或者找一些没有资质的中间生产商,做一些简单提取。”
[B][center]药品研发如何确定杂质限度[/center][/B][B]国家食品药品监督管理局药品审评中心 黄晓龙[/B] 在药品研发中,如何证实药品安全有效应该是研发人员始终关注的问题;而药品质量的稳定可控又是保证其安全有效的前提与基础。如果一个药品的质量不能达到稳定与可控,在使用时这一药品就不可能始终安全、有效,也就不能被批准上市。保证药品质量稳定可控,药品的纯度是一个重点。如何确定杂质的限度是药学研究人员与审评人员不能回避的关键问题,该限度的制订是否科学、合理,直接关系到药品的安全性与质量。药品在临床使用中产生的不良反应除与该药品本身的药理活性有关外,也有一部分与药品中所混入的其它杂质有关。例如,通过我国药学科技工作者数十年的努力,基本上确定青霉素等抗生素中的多聚物等高分子杂质是引起过敏的主要原因。所以在研发过程中一定要对药品中的杂质进行全面研究,并将杂质完全准确地控制在一个合理的范围之内。 尽管杂质限度的确定对于药品研发非常重要,但国内药品研发的现实情况并不令人乐观。从近几年的新药申报情况分析,在杂质的研究与限度确定方面存在着较多的问题,主要表现为:部分药品研究单位对杂质研究的重要性了解不深;标准中对杂质的控制不够全面与准确;制订杂质限度时考虑问题不够全面,很少考虑杂质对药品安全性的不良影响;即使在杂质的含量明显超出正常工艺所允许的范围时,也不注意对现有的处方与工艺进行必要的优化,以降低杂质的限度。◆杂质的分类 药品中的杂质一般分为三类:有机杂质、无机杂质及残留溶剂。 有机杂质是指在药品的生产与储存过程中产生的杂质,这些杂质可以是已知的、未知的、挥发性的或不挥发性的杂质,主要包括:降解产物、聚合物、原料药与辅料或内包材的反应产物、以及原料药制备过程中引入的起始原料、副产物、中间体、反应试剂、配位体与催化剂。由于这些杂质的化学结构与产品分子类似或具渊源关系,所以通常称之为有关物质。 无机杂质是指在药品的生产过程中产生的杂质,这些杂质通常是已知的,主要包括:反应试剂、配位体与催化剂、重金属或其它残留的金属、无机盐、过滤助剂、活性炭等其它物质。 残留溶剂是指在原料药及制剂的生产过程中使用的有机溶剂。 对于生产过程中引入的外来污染物,可通过“良好的生产规范”(GMP)来控制,故不属于本文所说的杂质范畴。原料药的不同晶型也不属于本文的讨论范畴。本文只谈有机杂质与无机杂质的限度确定。
为了加强对药品管理,世界卫生组织(WHO)和世界上许多国家的政府在法律上对药品都规定了明确的定义。我国对药品的含义是:用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症、用法、用量和注意事项的物质,包括中药材、中药饮片、中成药、化学原料药及其制剂、抗生素、生化药品、放射性药品、血清疫苗血液制品和诊断药品等。世界卫生组织对药品的含义是:任何生产、出售、推销或提供治疗、缓解、预防或诊断人和动物的疾病、身体异常或症状的;或者恢复、矫正或改变人或动物的器官功能的单一物质或混合物。美国对药品的含义是:(1)法定的《美国药典》、法定的《美国顺势疗法药典》(Homeopathic Pharmacopoeia of the United States)或法定的《国家处方集》(National Formulary)以及任何增补本所认可的任何物品; (2)用于诊断、治疗、缓解或预防人或其他动物疾病的物品;(3)影响人体或其他动物的结构和功能的物品(食品除外);(4)用作(1)、(2)、(3)项所规定的物品的成分之一,但不包括器械或其组成部分、零部件或附件。我国《药品管理法》中规定的药品仅指人用药;世界卫生组织、美国以及日本、英国、瑞典、新加坡等许多国药事法规中的药品均包括人用药和兽用药。
由国家食品药品监督管理局批准的原料药药品标准通常有【性状】、【鉴别】、【检查】、【含量测定】、【类别】、【贮藏】、【制剂】、【有效期】这些项目,其中【制剂】项下会有XX片、XX注射液等等,意思是否指批准的该原料药只能用于此项下指定的制剂?
2010版药品GMP指南系列下载,请进入http://www.instrument.com.cn/ilog/mfwang/下载。指南包括:厂房与设备、口服固体制剂、无菌药品、原料药、质量管理体系、质量控制实验室与物料管理。
国内药品注册流程 以往主要是做国际注册的,接触国内的比较少,第一次做国内注册,没想到比国外注册麻烦多了,远比我想象的复杂,考虑到以后俺还会重复这些工作,而且越往后大脑将越来越不好使,本着好记性不如烂笔头的原则,现在把整个程序记录下来,不仅可以与同行分享,也可以方便以后的工作。关于国内注册的法规或攻略、介绍其实已经很多了,看得我头晕,相信刚刚接触注册的同行跟我也是一样的,所以我这里只是将整个流程梳理一遍,目的是在大脑中首先形成一种思路,知道自己需要做哪些事情,然后再具体了解如何去做这些事情。 整个程序的大致流程是这样的:法规学习(药品注册管理办法→确定药品注册的分类→确定需要准备的资料项目)→资料的准备与收集→资料的装订与提交→等待评审一、法规学习 在做这些工作之前,首先你得看《药品注册管理办法》,这是做药品注册工作必看的法规文件,当然还有其它很多的法规文件,但是那么多内容不可能全都记住,可以重点关注相关的内容(比方说你要做补充申请,那就看与补充申请有关的,要做原料药注册,那就看与原料药注册申请有关的),其它暂时只需了解。 第二,管理办法最后面的几个附件你得仔细看了,还是同样的原则,内容太多只看相关的,看多了也记不住,从这些附件中可以确定你所要注册品种的分类,根据分类就能确定需要准备哪些资料了。 相关的法规性文件可以参考学习下面的帖子:http://bbs.instrument.com.cn/shtml/20081018/1537892/二、资料的准备与收集,这是整个程序的重点和难点。 为了清晰明了化,下面就举一个例子说明一下: 比方说阿司匹林原料药的注册。1、阿司匹林为化学原料药,我们需要学习《药品注册管理办法》附件2化学药品注册分类及申报资料要求,从中可以了解到,该药为注册分类的第6类。2、申请注册分类6的药品,按照《申报资料项目表》的要求需报送资料包括:(一)综述资料(1~6)(二)药学研究资料(7~15)(三)药理毒理研究资料(16~27)(四)临床试验资料(28~32) 从申报资料项目表里可以知道,对于阿司匹林原料药,因为已有临床试验的数据,无需做临床试验,因此阿司匹林原料药需要报送的资料项目是1~16和28项。2.1 1~6是综述资料,对于原料药,阿司匹林不需要准备第5项关于药品说明书的内容。这6项资料中,3和4的准备是难点,需要对整个项目有很详细的了解,对于第4项,还需要具有一定的药学药理毒理知识,并能对这些内容进行分析总结与评价。2.2 7~15是药学研究资料,包括了药品研发、生产、过程控制与检验、稳定性考察等的整个生命周期,这部分内容目前提倡用CTD格式来准备。这9项资料是整个申报资料的核心,其中关于杂质研究以及工艺的研究是重点和难点,杂质研究不彻底也是众多申报资料被退审的主要原因。关于CTD资料的准备,可以参见下面的帖子:http://bbs.instrument.com.cn/shtml/20130331/4648949/2.3 16和28项资料,通常用文献资料代替,这就需要有一定的查询文献资料的功底了。三、资料的装订与递交。 看似简单,但是在实际装订的时候会遇到很多细节方面的问题,俺可是在咨询了很多人之后才搞定的。1、提交资料的份数: 需要提交的份数为2+1套,也就是有1套中只需要有资料项目(一)综述资料;另外2套中均包括了资料项目中(一)(二)(三)(四)的完整部分,这2套中,至少有1套里面提供的所有资料均为原件。2、资料的装订与装袋:
为何日本的医药品令赴日游客趋之若鹜?答案很简单,日本的医药品既便宜还安全。以儿童退烧贴为例,国内一盒退烧贴动辄二三十元,里面的数量却仅三至四片。但是,日本的退烧贴不仅价格比国内便宜,而且12至16片的量足够秒杀国内退烧贴。中日药品价格的差距性显然打破了纯粹的民族主义色彩。中国医药品价格究竟有多高?两会期间,全国人大代表、广西花红药业董事长韦飞燕直指,中国90%以上的药品都有降价空间,价格砍掉50%不存问题。由于日本医药品管理实行分类限制政策,第一类必须有医生的处方才能购买,第二类则需要和药店专驻药剂师商量,第三类则可以任意购买。因此,即便国内高价医药品从而倒逼消费者去购买日本医药品,也因药品种类限制而无济于事。也正是医药行业的无可选择性,进而造成了比制造业更悲哀的画面。医药不分并非药价高的唯一理由 提及国内药品价格高,很多人会将矛头对准备受诟病的医药不分制度。的确,医药不分制度是医药腐败、药品价格层层加码的病源所在,但医药不分并非就是药价高高在上的唯一的理由。 日本从1991年开始施行医药分离(医师和药师的分离)后,日本药品价格增速成为全球主要药品市场中是增长率最低的国家之一。即便如此,也不尽然就是分离制度导致日本药品价格走低。换句话理解,医药分离并非就是医药价格降低的充分必要条件。日本医药分离并未杜绝医药行业的腐败现象。具体表现在,日本药企为达到增加销量的目的,主要通过向临床试验机构、临床医疗单位和各医学专业学会提供学术研究费用,举办各专业学科的最新医疗动态以及新药研发动向和研究成果说明会,并向讲师支付高额讲课费等形式,增强医药企业对医学研究和医疗机构的影响力。于是,在利益的驱使下,出现了医药权威人士跑场而言不由衷的褒奖药品现象。这与我国医生吃回扣现象并未有多大实质性区别。只不过,日本医药行业的潜规则似乎更隐蔽些。 而之所以日本药企的潜规则并未造成医药价格居高不下,更重要的原因在于,日本政府对药品价格采取了动态的监管方法。日本政府一旦发现其定价和市场销售价格之间存在较大的差别,日本政府将会在下次政府定价时加以调整。例如,与国外的药品价格水平比较,当国内销售价格高于国外销价的两倍或低于国外销价的一半时,将对国内销售价格进行调整。拉低药品价格离不开创新 其实,我国药企和医生之间的利益输送行为,说到底还是中国药品市场竞争激烈。我们以仿制药为例,仿制药顾名思义,是根据原研药复制具有相同生物等效功能的特殊药品。它与原研药的区别在于原研药被写上了专利保护。 但是,在仿制药政策上,日本政府和我国政府却有着迥异的区别。日本的做法是,给予首先仿制成功的药企一定的价格优惠,二仿则享受的优惠要差一些,以此类推,往往到了四仿五仿利润就低到几乎赚不到钱,如此一来,自然而然没人愿意去模仿了。而我国则因地方管理部门政绩冲动,政策相对被烙上浓重的地方保护主义色彩。这种地方保护主义色彩表现在,小药厂也能在保护伞下生存。这就是为何中国会出现一种原研药有上百家竞相模仿的怪现象。 贴着五花八门的仿制药品牌,在市场空间有限的背景下,如何销售出去?自然而然,在医药体制不分的制度下,贿赂医院、医生就成了销售的唯一途径。因此,政策迥异的结果就是无形中助长了我国医药行业的模仿能力,但却扼制了药品的创新能力。更甚的是,缺乏实力的制药厂要么弄虚作假,生产劣质的仿制药,要么沦为原料供应商。下 游的原料供应商不仅将原料供应给生产劣质的仿制药厂,而且还大量低价出口国外。中国已变成了印度制药企业的原料供应商就是例证。但是,原料生产的过程亦是伴随着污染的产生。如此一来,中国相当于不仅把环境污染留在了国内,把利润让给了国外,而且公众还要花高价买药品。与此同时,国内劣质的仿制药历经上市后,公众不仅花高价,而且还将承受着质量差所引发的副作用。
记者从全国整顿和规范市场经济秩序领导小组办公室了解到,随着食品药品生产新技术、新原料的广泛使用,中国食品药品安全面临新的课题。食品药品生产和消费水平不高以及这些新课题,将长期影响中国食品药品安全。 据了解,目前中国食品药品生产和消费总体水平不高,而新的安全课题又不断出现。一方面,中国生产力水平低,发展不平衡。农产品种植养殖以单个农户为主,滥用或不当使用化肥、农药、兽药和饲料添加剂等问题比较普遍。全国100多万家食品生产加工企业中,不足10人的小企业、小作坊占七成,相当一部分不具备生产合格产品的条件或不按标准生产加工。经销农产品和食品的集贸市场、企业、个体户,大多缺乏必要的设施和规范的管理。4500多家药品生产企业中,年销售收入不足亿元的超过85%,有的企业不严格执行生产规范,违规生产。 从消费角度来看,中国地区差异和城乡差异比较大,广大农民和城市低收入群体消费水平偏低,辨伪能力不强,安全和自我保护意识欠缺,容易成为假冒伪劣食品药品的受害者。 随着食品药品生产新技术、新原料的广泛使用,食品药品安全面临新的课题。一些新的食品原料和包装材料没有经过足够的、科学的跟踪测试,食品安全的可靠性大大降低。同时,制假售假手段花样翻新,有的甚至运用高科技造假,由于标准跟不上,检测成本高,监管和打击的难度增大,食品药品安全形势更加复杂。另外,随着经济社会发展和生活水平提高,人们对食品药品安全更加关注,以往一些习以为常的问题开始引起公众的关注。
一、注册分类 1.未在国内外上市销售的药品: (1)通过合成或者半合成的方法制得的原料药及其制剂; (2)天然物质中提取或者通过发酵提取的新的有效单体及其制剂; (3)用拆分或者合成等方法制得的已知药物中的光学异构体及其制剂; (4)由已上市销售的多组份药物制备为较少组份的药物; (5)新的复方制剂; (6)已在国内上市销售的制剂增加国内外均未批准的新适应症。 2.改变给药途径且尚未在国内外上市销售的制剂。 3.已在国外上市销售但尚未在国内上市销售的药品: (1)已在国外上市销售的制剂及其原料药,和/或改变该制剂的剂型,但不改变给药途径的制剂; (2)已在国外上市销售的复方制剂,和/或改变该制剂的剂型,但不改变给药途径的制剂; (3)改变给药途径并已在国外上市销售的制剂; (4)国内上市销售的制剂增加已在国外批准的新适应症。 4.改变已上市销售盐类药物的酸根、碱基(或者金属元素),但不改变其药理作用的原料药及其制剂。 5.改变国内已上市销售药品的剂型,但不改变给药途径的制剂。 6.已有国家药品标准的原料药或者制剂。 二、申报资料项目 (一)综述资料 1.药品名称。 2.证明性文件。 3.立题目的与依据。 4.对主要研究结果的总结及评价。 5.药品说明书、起草说明及相关参考文献。 6.包装、标签设计样稿。 (二)药学研究资料 7.药学研究资料综述。 8.原料药生产工艺的研究资料及文献资料;制剂处方及工艺的研究资料及文献资料。 9.确证化学结构或者组份的试验资料及文献资料。 10.质量研究工作的试验资料及文献资料。 11.药品标准及起草说明,并提供标准品或者对照品。 12.样品的检验报告书。 13.原料药、辅料的来源及质量标准、检验报告书。 14.药物稳定性研究的试验资料及文献资料。 15.直接接触药品的包装材料和容器的选择依据及质量标准。 (三)药理毒理研究资料 16.药理毒理研究资料综述。 17.主要药效学试验资料及文献资料。 18.一般药理学的试验资料及文献资料。 19.急性毒性试验资料及文献资料。 20.长期毒性试验资料及文献资料。 21.过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性等特殊安全性试验资料和文献资料。 22.复方制剂中多种成份药效、毒性、药代动力学相互影响的试验资料及文献资料。 23.致突变试验资料及文献资料。 24.生殖毒性试验资料及文献资料。 25.致癌试验资料及文献资料。 26.依赖性试验资料及文献资料。 27.非临床药代动力学试验资料及文献资料。
2011年12月6日,中国国家食品和药物监督管理局(SFDA)发布《已使用化妆品原料名称目录(第一批)》(征求意见稿)。 该第一批清单包含1710在中国化妆品产品中使用的成分,是2003年版本中所列成分数量的一半左右。国家食品药品监督管理局加强某些成分的使用限量和使用范围的限制。更多的IECIC批次将于今年晚些时候发布。 首批草案的公众评审的截止日期是2011年12月13日。 注:《化妆品卫生监督条例》第八条规定:“生产化妆品所需的原料、辅料以及直接接触化妆品的容器和包装材料必须符合国家卫生标准”。卫生部《中国已使用化妆品成分名单(2003年版)》整理了截止2000年底中国已使用化妆品成分3265种,其中一般化妆品原料2156种,特殊化妆品原料546种,天然化妆品原料(含中药)563种。
国家食药监管总局即日起至12月5号就《药品飞行检查办法(征求意见稿)》公开征求意见,药品飞行检查覆盖面大幅拓宽,药品监督管理将进一步规范和加强。此规定,将药品的飞行检查纳入整个药品监管的日常检查中,可以使我国的药品监管能力和水平进一步成熟、提高。 据中国之声《全国新闻联播》消息,国家食药监管总局即日起至12月5号就《药品飞行检查办法(征求意见稿)》公开征求意见, 药品飞行检查覆盖面大幅拓宽,药品监督管理将进一步规范和加强。 药品飞行检查 药品监管 药品质量 所谓“药品飞行检查”,是药品监督管理部门针对药品生产、经营等环节开展的不预先告知的突击检查或者暗访调查。在《药品飞行检查办法(征求意见稿)》之前,原国家食品药品监督管理局2006年《关于印发药品GMP飞行检查暂行规定的通知》是目前药监部门执法检查的主要依据。中国药学会医药政策研究中心执行主任宋瑞霖介绍,两者相比,征求意见稿的覆盖范围大大拓宽。 宋瑞霖:GMP是指导制药企业、保证药品质量的重要规范。我们从原料进料到生产全过程,GMP包括了最核心点,但它不是药品生产的全部。现在我们把GMP检查改成药品飞行检查,把它扩展到整个药品质量的控制体系中来了。 征求意见稿规定,被检查单位及有关人员应当及时按照检查组要求,提供真实、有效的记录、票据、凭证等相关材料,开放相关计算机管理系统,不得拒绝和隐瞒。不配合或者阻挠检查、拒绝提供或者提供虚假材料、故意隐瞒违法违规生产经营行为,其违法违规事实一经查实,按情节严重情形从重处罚。宋瑞霖表示,尽管相比当前的药品飞行检查规定,征求意见稿并没有作出大幅更改,但规范飞行检查、强化药品监管是大势所趋。 宋瑞霖:最大的区别是把药品的飞行检查纳入整个药品监管的日常检查中,我们的药品监管能力和水平进一步成熟、提高。
药品生产企业GMP工作手册 1、药品生产质量管理规范(98年版) 附录2、粉针剂实施《药品生产质量管理规范》指南3、粉针剂实施《药品生产质量管理规范》检查评审细则4、大容量注射剂实施《药品生产质量管理规范》指南5、大容量注射剂实施《药品生产质量管理规范》检查评审细则6、原料药实施《药品生产质量管理规范》指南7、原料药实施《药品生产质量管理规范》检查评审细则8、片剂、硬胶囊剂、颗粒剂实施《药品生产质量管理规范》指南9、片剂、硬胶囊剂、颗粒剂实施《药品生产质量管理规范》检查评审细则10、小容量注射剂实施《药品生产质量管理规范》指南11、小容量注射剂实施《药品生产质量管理规范》检查评审细则12、关于医药行业组织实施GMP认证工作有关问题的通知13、关于印发医药行业实施GMP“九五”计划和医药行业实施GSP“九五”计划的通知14、关于印发《药品生产企业(车间)实施GMP达标验收管理办法》的通知15、关于印发《药品生产企业(车间)实施GMP现场检查评审工作程序》的通知16、关于药品生产企业(车间)GMP达标验收工作有关规定的通知17、关于发布《医药工业洁净厂房设计规范》的通知 [img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=46811]药品生产企业GMP工作手册[/url]
答:医疗废物主要来自医疗机构产生的感染性、损伤性、病理性、化学系和药物性废物,属于HW01大类,而医药废物主要来自化学药品原料药制造、制剂、兽用药品制造、生物药品制造,属于HW02大类,废药物、药品指的是来自非特定行业销售售及使用过程中产生的失效、变质、不合格、淘汰、伪劣的化学药品和生物制品,比如药房的过期药物,属于HW03大类。
我国药品片剂中包装材料选择的原则西药的片剂是目前药类品种最多,销量最大的药品剂型之一。用于药品片剂的包装材料直接接触到药品,因此属一类药品包装。药品是一种特殊商品,其药效与质量直接关系到人的健康与安全,使用的包装材料与结构形式在必须确保药效的同时,还起着保证药品使用可靠性、方便性的作用,因此作为药品生产企业在选用包装材料时,要了解包装材料、容器的一些性质,特点、以便结合药品的某些特殊要求,合理、准确选择药用包装材料。药品片剂的塑料瓶包装 20世纪80年代,随着我国不断从国外引进先进的药用塑料瓶生产线,以"塑"代"玻"的序幕开始拉开,从此大容量的玻璃瓶、棕色瓶逐步退出药品片剂包装这一领域,取而代之的是药用塑料瓶,它主要是以无毒的高分子聚合物如PE、PP、PC、PET为主要原料,采用先进的塑料成型工艺和设备生产各种药用塑料瓶,主要盛装各类口服片剂、胶囊、胶丸等固体剂型与液体制剂的药物。 药用塑料瓶最大的特点是质量轻,不易碎、清洁、美观,药品生产企业不必清洗烘干可以直接使用。而它的一些技术指标及大量数据表明其耐化学性能、耐水蒸汽渗透性密封性能优良,它完全可以对所装药物在有效期内起到安全屏蔽保护作用。在使用材料的品种上有高密度聚乙烯瓶(HDPE)、聚丙烯瓶(PP)、聚碳酸酯瓶(PC)、聚酯瓶(PET),20世纪90年代初,国外开发了吹塑瓶体的新型材料聚萘二甲酸二乙酯(PEN)塑料瓶,其性质比PET更优,它强度高,耐热性能好、耐紫外线照射、对二氧化碳气体和氧气阻隔性能优良,耐化学药品性能好,比PET的用途更加广泛,PEN材料是近几年来国内外积极开发的新型聚酯树脂,也是药品塑料瓶包装的极好材料。选择瓶体原则 由于药用塑料瓶规格众多,小的十几毫升,大的上千毫升,有的无色,有的透明,颜色多样,形状各异,门类繁多。面对精彩纷呈的塑料瓶市场,作为药品生产企业在选用塑料瓶时主要把握好以下几点原则:一、选择塑料瓶主原料、助剂配方。固体用塑料瓶的产品标准,分别规定了适用的主原料,且必须符合无毒、无异味等要求,由于可供选用的主原料又有多种,这就需要对原料的综合性能加以选用,一般片剂选用高密度聚乙烯,聚丙烯瓶,如需要透明度可选用PET瓶,如药品需要阻隔性能更高,且阻光、不透明,则选用棕色PET瓶,阻隔性能更佳为PEN瓶。液体剂型药品一般选用聚丙烯瓶或聚酯瓶作为主原料。二、瓶体与盖的密封性、水蒸汽渗透性。密封性与水蒸气渗透性是药用塑料瓶的两个重要技术指标,它们对装药稳定性起着致关重要的影响。三、塑料瓶产品质量标准。从生产厂的产品质量标准中可以分析判断产品质量的优劣。药用塑料瓶企业均应制定严于国家标准、行业标准的企业标准。四、质量保证体系。对供应商进行审计己成为采购塑料瓶必不可少的重要环节。通过审计,可对生产厂的软、硬件设施,技术设备、质量综合水平作出全面正确评估。五、塑料瓶的装药稳定性与相容性。 选用塑料瓶,尤其是新药选用新型塑料瓶(或新材质、新工艺)应该先进行装药试验以考察装药稳定性和塑料瓶与药物间的相容性。药物、塑料瓶材质相互间的渗透、溶出、吸附、化学反应、变性必须通过科学检测才能判定。药品片剂的泡罩包装 药品的泡罩包装又称为水泡眼包装,与瓶装片剂药品相比,泡罩包装最大的优点是便于携带,而且可以减少药品的携带和服用过程中的污染。但是作为常期用药的患者,存在单次服用剂量较大,使得泡罩包装的单位成本明显高于瓶装药品,一些制药企业,通常把价格较高,技术含量高以及新品种的药物选用泡罩包装的居多。泡罩包装使用的材料主要是"PTP"药用铝箔及塑料硬片。药用铝箔是密封在塑料硬片上的封口材料,它以硬质工业用纯铝为基材,具有无毒、耐腐蚀、不渗透、阻热、防潮、阻光并可高温灭菌等特点。塑料硬片材料通常选用聚氯乙烯(PVC),聚偏二氯乙烯(PVDC)或复合材料。它们对水、汽、光具有较好的阻隔性能。
国家药监局印发粉状化妆品及其原料中石棉测定方法(暂定) 中国质量新闻网2009年4月20日消息 从国家食品药品监督管理局获悉,针对媒体对婴幼儿爽身粉中含有禁用物质石棉的报道和我国目前尚无化妆品及其原料中石棉测定方法的现状,国家食品药品监督管理局组织有关专家对含滑石粉的粉状化妆品及其原料中石棉测定方法进行了论证,并于日前印发了《粉状化妆品及其原料中石棉测定方法》(暂定),要求各省(区、市)卫生、食品药品监管部门(药品监督管理局)参照执行。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=145781]国家药监局印发粉状化妆品及其原料中石棉测定方法[/url]
我国拟建食品药品安全“黑名单” 中国政府法制信息网12日公布国家食品药品监管总局起草的《食品药品安全“黑名单”管理规定﹙征求意见稿﹚》。根据这一规定,我国拟建立食品药品安全“黑名单”,将因严重违反食品、药品、医疗器械、化妆品管理法律、法规、规章,受到行政处罚的生产经营者及责任人员等有关信息,通过政务网站公布,接受社会监督。 规定明确,食品生产者采购、使用不符合食品安全标准的食品原料、食品添加剂、食品相关产品,或在食品中添加药品,情节严重受到责令停产停业、吊销许可证行政处罚等食品、药品、医疗器械、化妆品生产经营行为,将被纳入“黑名单”范围。 规定要求,食品药品监督管理部门应当按照谁处罚谁公布的原则,作出行政处罚决定后十五个工作日内,将应当纳入食品药品安全“黑名单”的生产经营者、责任人员、涉案产品的相关信息在其政务网站上公布。公布的信息应包括:违法生产经营者和相关责任人的信息,以及涉案产品相关信息,包括产品名称、批次、标识、批准文号、生产许可证号等。 食品药品监督管理部门将纳入“黑名单”的生产经营者记入监管信用档案,并采取增加检查和抽验频次等措施,实施重点监管。纳入食品药品安全“黑名单”的生产经营者、责任人员,再次发生违法违规行为的,依法从重处罚。同时,食品药品安全“黑名单”纳入食品药品监管信用体系,按照国家有关规定进行管理。
2009年12月12日北京1、ICH 技术指导原则概述--国家食品药品监督管理局--丁建华2、陈镇生Q1A(R2)新原料药和制剂的稳定性指导原则3、陈镇生--分析方法的确证试验(Q2A )
国家食品药品监督管理局021201药品注册申请表原始编号:XXXXXXXXX受 理 号:XXXXXXXXX申请事项1.申请分类:○ 新药申请 ○已有国家标准药品的申请2.申报阶段:○ 临床试验 ○生产3.注册分类:○中药、天然药物____类 ○化学药品____类 ○治疗用生物制品____类 ○预防用生物制品____类 ○生物制品增加新适应证 ○其他:4.附加申请事项:□非处方药 □减或者免临床研究 □国际多中心临床研究 □其他:药品情况5.药品名称: 6.英文名/拉丁名:7.汉语拼音: 8.化学名:9.其他名称:10.商品名称:○不使用 ○使用,中文: 11.药品名称来源:○国家药品标准 ○国家药典委员会 ○文献 ○自拟12.制剂类型○非制剂:○原料药 ○中药材 ○中药饮片 ○有效成份 ○制剂中间体 ○有效部位 ○其他:○制剂:剂型: 属于:○《中国药典》剂型 ○新剂型,英文:规格: 13. 包装:直接接触药品的药包材: 包装规格:14.药品有效期: 个月15.处方内药物活性成份或者中药药味(均含处方量):16.处方内辅料(含处方量):17.制剂中化学原料药来源: 序号来源原料药名称批准文号(注册号或受理号)生产企业18.制剂中的中药材标准:○全部法定 ○含非法定者,药材名称: ○无19.药品标准依据:○采用国家标准 ○自拟标准来源: ○中国药典_______________________版 ○生物制品规程_________________版○局颁/部颁___________________第______册 标准号____________________ ○注册标准或注册证号: ○国外药典及版次: ○其他20.主要适应症或者功能主治: 适应症分类:适应症:21.给药途径及特殊用法:相关情况22.是否特殊管理药品:○否 ○是: □麻醉药品 □精神药品 □放射性药品23.专利: □有中国专利:□化合物专利 □工艺专利 □处方专利 □其他专利专利名称: 专利人: 专利到期日期: 本申请是否得到专利权人的实施许可:○是 ○否□有外国专利: 专利名称:专利权人:24.同品种药品保护:□药品行政保护 保护截止日期: □中药品种保护 保护截止日期: □已知有申请者 □新药过渡期 截止日期:□原新药保护 保护截止日期: 25.同品种新药监测期:○无 ○有,起始日期: 终止日期:26.本次申请为:○首次申请 ○再次申请,其首次申请:□曾经撤回,原因:□曾被退审(或者退回),日期: 原因:27.境外是否获准上市:○否 ○不详 ○是,国家(地区): 日期:申请人28.机构1(国内药品生产企业):○无 ○有 □本机构负责缴费 名 称: 组织机构代码: 《药品生产许可证》编号:法定代表人: 职位:注册地址: 邮政编码:生产地址: 邮政编码:注册申请负责人: 职位:电话(含区号及分机号): 传真:电子信箱: 注册地址所在省份:联系人: 手机号码: 电话:是否持有相应的《药品生产质量管理规范》认证证书:○持有 未持有,原因:○新开办企业 ○新建车间 ○新增剂型 ○新原料药 ○无需提供 ○正在改造29.机构2(新药证书申请人): ○无 ○有 □本机构负责缴费名 称:组织机构代码: 法定代表人: 职位:注册地址: 邮政编码:注册申请负责人: 职位:电话(含区号及分机号): 传真:电子信箱: 联系人: 电话: 手机号码:30.机构3(新药证书申请人):○无 ○有 □本机构负责缴费名 称:组织机构代码: 法定代表人: 职位:注册地址: 邮政编码:注册申请负责人: 职位:电话(含区号及分机号): 传真:电子信箱:联系人: 电话: 手机号码:31.机构4(新药证书申请人):○无 ○有 □本机构负责缴费名 称:组织机构代码: 法定代表人: 职位:注册地址: 邮政编码:注册申请负责人: 职位:电话(含区号及分机号): 传真:电子信箱:联系人: 电话: 手机号码:32.机构5(新药证书申请人):○无 ○有 □本机构负责缴费名 称:组织机构代码: 法定代表人: 职位:注册地址: 邮政编码:注册申请负责人: 职位:电话(含区号及分机号): 传真:电子信箱:联系人: 电话: 手机号码:33.其他新药证书申请人: ○无 ○有34. 指定联系机构: 机构_____为指定联系机构 邮政编码: 通讯地址: 对本项注册申请单独以该机构名义提交的文件是否能够代表全部申请机构 ○是 ○否 ○无相关受理号35.相关申请受理号:声 明36.我们保证:①本申请遵守《中华人民共和国药品管理法》、《中华人民共和国药品管理法实施条例》和《药品注册管理办法》等法律、法规和规章的规定;②申请表内容及所提交资料、样品均真实、来源合法,未侵犯他人的权益,其中试验研究的方法和数据均为本药品所采用的方法和由本药品得到的试验数据;③一并提交的电子文件与打印文件内容完全一致。如查有不实之处,我们承担由此导致的一切法律后果。37.其他特别申明事项:38.各申请机构名称、公章、法定代表人签名、签名日期:经审查,本表填写符合形式审查要求。审查机关审查机关: 审查人签名: 日期: 年 月 日
[font=仿宋_GB2312][size=21px][color=#6b6b6b]医疗废物主要来自医疗机构产生的感染性、损伤性、病理性、化学系和药物性废物,属于[/color][/size][/font][font=仿宋_GB2312][size=21px][color=#6b6b6b]HW01大类,而医药废物主要来自化学药品原料药制造、制剂、兽用药品制造、生物药品制造,属于HW02大类,废药物、药品指的是来自非特定行业销售售及使用过程中产生的失效、变质、不合格、淘汰、伪劣的化学药品和生物制品,比如药房的过期药物,属于HW03大类。[/color][/size][/font]