我自己翻了,希望能有更专业的帮忙翻译,我自己对照学习氧 氟 沙 星 片Yangfushaxing PianOfloxacin Tablets本品含氧氟沙星(C18H20FN3O4)应为标示量的90.0%~110.0%。【性状】 本品为类白色或微黄色片或薄膜衣片,除去包衣后显类白色至微黄色。【鉴别】 (1)在含量测定项下记录的色谱图中,供试品溶液主峰的保留时间应与对照品溶液主峰的保留时间一致。(2)取本品细粉适量,用0.1mol/L盐酸溶液溶解并稀释制成每1ml中含氧氟沙星6μg的溶液,滤过,滤液照紫外-可见分光光度法(附录Ⅳ A)测定,在294nm的波长处有最大吸收。【检查】 有关物质 取含量测定项下的供试品贮备液作为供试品溶液;精密量取适量,加0.1mol/L盐酸溶液稀释成每1ml中含6μg的溶液,作为对照溶液。照氧氟沙星有关物质项下的方法测定,供试品色谱图中如有杂质峰,单个杂质峰面积不得大于对照溶液主峰面积(0.5%),各杂质峰面积的和(任何小于对照溶液主峰面积的0.05倍的峰可忽略不计)不得大于对照溶液主峰面积的2倍(1.0%)。溶出度 取本品,照溶出度测定法(附录Ⅹ C 第一法),以盐酸溶液(9→1000)900ml为溶出介质,转速为每分钟50转,依法操作,经30分钟时,取溶液适量,滤过,精密量取续滤液2ml,置50ml量瓶中,加溶出介质稀释至刻度,摇匀,照紫外-可见分光光度法(附录Ⅳ A),在294nm的波长处测定吸收度;另取氧氟沙星对照品适量,精密称定,加溶出介质溶解并稀释成每1ml中约含4.5μg的溶液,同法测定,计算每片的溶出量。限度为标示量的80%,应符合规定。其他 应符合片剂项下有关的各项规定(附录Ⅰ A)。【含量测定】照高效液相色谱法(附录Ⅴ D)测定。色谱条件与系统适用性试验 用十八烷基硅烷键合硅胶为填充剂;以醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300使溶解,用磷酸调节pH值至2.2)-乙腈(85:15)为流动相;检测波长为294nm。取氧氟沙星适量,用0.1mol/L盐酸溶液溶解并稀释制成每1ml中约含1mg的溶液,置紫外光灯(254nm)下照射4小时以上,取10μl注入液相色谱仪,理论板数按氧氟沙星峰计算不低于5000,紧邻氧氟沙星峰前的杂质峰与氧氟沙星峰的分离度应符合要求。测定法 取本品10片,精密称定,研细,精密称取适量(约相当于氧氟沙星0.1g),置100ml量瓶中,加0.1mol/L盐酸溶液溶解并稀释至刻度,摇匀,滤过,取续滤液作为供试品贮备液,精密量取5ml,置50ml量瓶中,加0.1mol/L盐酸溶液至刻度,摇匀,精密量取10μl分别注入液相色谱仪,记录色谱图;另取氧氟沙星对照品适量,精密称定,用0.1mol/L盐酸溶液溶解并定量稀释制成每1ml中含氧氟沙星0.12mg的溶 液,同法测定,按外标法以峰面积计算,即得。【类别】 同氧氟沙星。【规格】 0.1g【贮藏】 遮光,密封保存。
本人在此急求 中华人民共和国国家药品监督管理局标准(试行)中的关于"盐酸左氧氟沙星注射液"的标准,请大家帮忙!谢谢!

10,抽取5个版友);幸运奖5名(2钻石币)夏天的雪(注册ID:bingwang228)吕梁山(注册ID:shih20j07)莫名其妙(注册ID:moyueqiu)zgx3025(注册ID:v2844608)馨语(注册ID:huangdm)http://ng1.17img.cn/bbsfiles/images/2016/11/201611231515_01_1610895_3.jpghttp://ng1.17img.cn/bbsfiles/images/2016/11/201611231515_02_1610895_3.jpg【注意事项】同样的答案,每人只能发一次PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。=======================================================================左氧氟沙星方法:HPLC基质:药品应用编号:101680化合物:左氧氟沙星固定相:Diamonsil C18(2)色谱柱/前处理小柱:Diamonsil C18(2) 5u 200 x 4.6mm样品前处理:样品制备 制备方法:准确量取0.2 ml样品,用0.1 mol/l盐酸溶液溶解稀释至5 ml,待测。色谱条件:分析条件 色谱柱:Diamonsil C18(2),200×4.6 mm,粒径 5m (Cat#:99602) 流动相:醋酸铵高氯酸钠溶液(醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节pH值至2.2)-乙腈(85∶15) 流速:1.0 mL/min 柱温: 30 ℃ 检测器:UV 294 nm 进样量:10 μL文章出处:迪马科技关键字:左氧氟沙星滴,Diamonsil C18(2),钻石二代,99602,2010药典谱图:http://www.dikma.com.cn/Public/Uploads/images/ZUO.GIF图例:1 左氧氟沙星
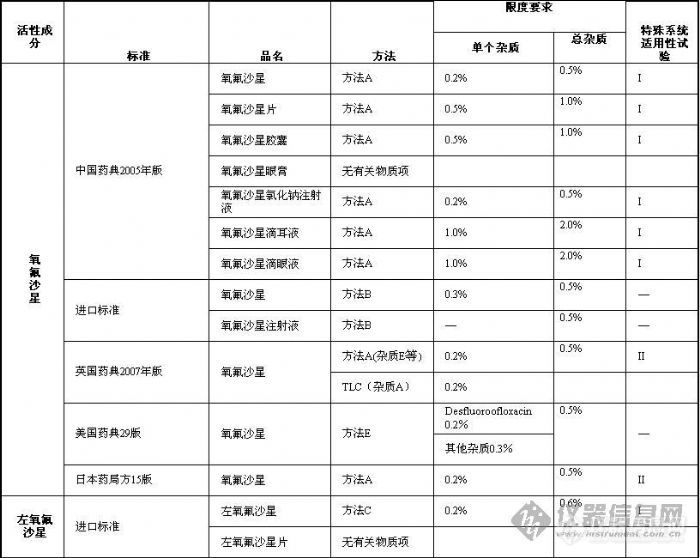
作者 张立雯 成海平 正文内容 【摘要】本文总结了国家标准中氧氟沙星、左氧氟沙星、盐酸左氧氟沙星、乳酸左氧氟沙星、甲磺酸左氧氟沙星系列药物的有关物质控制方法,分析了该类药物注册申报中有关物质控制存在的问题,希望能为研发者提供帮助。 【关键词】氧氟沙星、左氧氟沙星、有关物质一、概况 氧氟沙星(Ofloxacin)为合成的第三代广谱氟喹诺酮类抗菌药,对大多数革兰氏阳性菌和革兰氏阴性菌均有明显的抑制作用。临床上主要用于敏感菌所致的呼吸系统感染、泌尿生殖系统感染。氧氟沙星由日本第一制药株式会社研发,于1985年在日本、德国上市,制剂为口服片剂、注射剂等。目前国内已上市的氧氟沙星制剂有片剂、胶囊剂、颗粒剂、缓释制剂、小针、葡萄糖注射液和氯化钠注射液等。 左氧氟沙星(Levofloxacin)为氧氟沙星的左旋体,具有抗菌谱广、抗菌作用强的特点。日本第一制药株式会社于1993年在日本上市销售左氧氟沙星原料及片剂,并现已在英国、美国等多国上市。目前国内上市的左氧氟沙星制剂主要有片剂、小针、葡萄糖注射液和滴眼剂等。另外,国内已批准上市的左氧氟沙星还有其盐酸盐、乳酸盐和甲磺酸盐,三种加酸根的左氧氟沙星均有片剂、胶囊剂、注射制剂等多种剂型上市。二、国家标准中有关物质控制方法比较 氧氟沙星系列药物的有关物质测定国家标准大多采用HPLC法,列表比较见表1。 表1 氧氟沙星系列药物的有关物质测定方法与限度的比较 这些方法有很多相似的地方,如均采用ODS柱,色谱条件与含量测定色谱条件相同,按照主成分自身稀释对照法定量等。但也有一些不同的地方值得关注,作者从以下三个方面来对这些国家标准方法的不同之处进行比较。1、流动相 按照流动相的不同,作者将有关物质测定方法分为六种,具体如下: 方法A:醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节pH至 2.2)-乙腈(85∶15)为流动相,在294nm下检测; 方法B:略; 方法C:略; 方法D:己烷磺酸钠[取己烷磺酸钠0.98g,加磷酸盐缓冲溶液(取磷酸二氢钾6.8g,加水溶解并稀释至 1000ml,加0.05mol/L磷酸约500ml,使pH为2.4)]-甲醇(3∶1)为流动相,在293nm下检测; 方法E:磷酸缓冲溶液(溶解27.2磷酸二氢钾在1000ml水中,用磷酸调节pH至2.4)-乙腈(90∶10)为流动相,在294nm下检测; 方法F:己烷磺酸钠[取己烷磺酸钠0.98g,加磷酸盐缓冲溶液(取磷酸二氢钾6.8g,加水溶解并稀释至 1000ml,加0.05mol/L磷酸约500ml,使pH为2.4)]-甲醇(65∶35)为流动相,在230nm下检测。 六种流动相的共同特点是:组成均是酸性缓冲溶液加有机溶剂(甲醇或乙腈)。方法A、B、E未加表面活性剂,方法C、D加有表面活性剂己烷磺酸钠。除方法F在230nm下检测外,其他方法均在294或293nm下检测。2、主要杂质 英国药典收载了氧氟沙星杂质A、B、C、D、E、F共6个已知杂质,依次分别为去哌嗪环、去羧基、去氟、氟取代位置不同、去甲基以及氮氧化的化合物物。英国药典氧氟沙星原料药采用TLC法控制杂质A,采用HPLC法控制其他已知和未知杂质。美国药典重点关注了杂质desfluoroofloxacin,日本药局方重点关注了ofloxacin demethyl substance,均与英国药典的杂质E相同,是氧氟沙星的去甲基化合物,该化合物为氧氟沙星的主要降解产物,光照下极易产生。美国药典给出了desfluoroofloxacin的相应因子为1.13。中国药典没有明确已知杂质,但有关物质检查时采用以下光照降解法进行特殊系统适用性试验,光照试验中产生的杂质即为氧氟沙星、左氧氟沙星的主要杂质。 美国药典中desfluoroofloxacin按加校正因子的主成分自身稀释对照法定量,美国药典氧氟沙星其他杂质和其他国家标准中氧氟沙星或左氧氟沙星所有杂质按不加校正因子的主成分自身稀释对照法定量。有关物质限度的要求详见表1。3、特殊系统适用性试验 氧氟沙星、左氧氟沙星及其盐的含量测定和有关物质检查方法的系统适用性试验除通常的进样精密度、记录时间、理论塔板数等的要求外尚有一项较为特殊的系统适用性试验,其他标准方法采用I法,日本药局方采用II法,详述如下: 特殊系统适用性试验I(光照降解法):取供试品溶液于无色试管中,用日光灯(2500lux或3500lux)或紫外灯(254nm)照射1小时或3小时或4小时,取此液注入液相色谱仪,记录色谱图,相对保留时间约为主峰1.2处应能检测出色谱峰。 特殊系统适用性试验II(杂质对照品法):氧氟沙星和杂质E(ofloxacin impurity E CRS,英国药典)或氧氟沙星的去甲基物(ofloxacin demethyl substance)分离度不得低于2.0或2.5。 由于缺少杂质对照品,国内氧氟沙星系列药物的有关物质测定系统试验常常是采用光照降解法。也正是因为缺少杂质对照品,系统适用性试验才显得尤为重要,是考察系统分离能力的重要指标。 另外,左氧氟沙星及其盐的原料和制剂均需检查右旋异构体,方法基本相同,均是采用硫酸铜-L异亮氨酸溶液-甲醇或硫酸铜-D苯丙氨酸溶液-甲醇为手性流动相检测,限度要求不得过0.8%或1.0%。在此就不详加讨论。三、注册申报中存在问题与探讨1、不重视系统适用性试验 氧氟沙星系列药物的特殊系统适用性试验常常被忽视,其实却非常重要。若不做该项试验,就不能保证所采用的系统能将最难分离的相对保留时间1.2倍的色谱峰分离出来,就有可能得到错误的结果。 审评中曾发现申报盐酸左氧氟沙星注射液的某厂家自测盐酸左氧氟沙星含量较药检所检验结果高约5%(含量测定色谱条件与有关物质检查一致)。仔细审查其图谱,发现未按盐酸左氧氟沙星注射液的已有国家标准用光照降解法进行系统适用性试验,且色谱峰明显拖尾。其测定结果偏高很可能是紧随主峰之后的杂质峰包裹进了主峰。 申请人往往会留意进样精密度、理论塔板数这样的常规系统适用性试验,却常常忽略了光照降解系统适用性试验,此种现象在申报资料中占很大比例。究其原因,是试验人员没有理解到此项系统适用性试验的目的和重要性,希望提醒申请人提高对系统适用性试验的重视程度。2、没有杂质个数与含量的详细对比 申报资料中杂质对比研究通常的做法就是按照国家标准方法检验一下自制品和已上市对照药品,若都在标准规定范围内,就认为自制品与已上市药品质量相当。其实这样的做法是对杂质对比的目的和比什么不甚明了的表现。杂质对比一方面要了解自己的产品与已上市品杂质有哪些不同,另一方面要了解制剂过程中有没有新产生的杂质,若有新产生的杂质,应加以控制。所以比较就要落到列表对比杂质的个数与含量上,泛泛地比较杂质总量是不足以说明问题的。 例如,申报盐酸左氧氟沙星、乳酸左氧氟沙星的注射剂采用方法D测定的较为多见。在该色谱条件下,相对保留时间为0.23、0.43、1.2左右的杂质峰较常见,其中相对保留时间为1.2的色谱峰是稳定试验中含量有所增加的主要杂质。 另外,统计杂质的个数时要注意“忽略限度”。英国药典氧氟沙星有关物质项下明确规定:Disregard any peak with an area less than 0.1 times the area of the principal peak in the chromatogram obtained with reference solution (a),即忽略面积小于对照溶液主峰面积0.1倍的色谱峰(0.02%)。中国药典没有这么详细的规定,但从实际操作来看,为增强方法的严谨性和数据的可比性,建议申请人在统计杂质个数时应明确忽略限度。3、强力破坏试验降解程度不合适 有关物质检查方法学验证的重要项目就是通过强力破坏试验考察方法的专属性,但强力破坏试验破坏程度的掌握不尽合理。较容易出现的情况是破坏太轻微,酸、碱、氧化、光照破坏均几乎未产生可检测的杂质,这样就无法判断所采用的色谱条件分离能力是否符合要求,破坏试验失去意义。另一种极端是破坏过度,主峰降解了大半,产生大量重叠的杂质色谱峰,这样很难找到合适的色谱条件将所有的降解产物分离。个人认为,适度的破坏应是采用比贮藏中可能遇到的最强条件稍强烈的条件降解,产生比贮藏中可能产生的稍多杂质,若所选色谱条件能将这些杂质都分离,就是专属性符合要求的。 以上问题是氧氟沙星系列药物审评中经常遇到的问题,希望能为研发者提供帮助,共同努力提高我国仿制药的研发水平。 [img]http://ng1.17img.cn/bbsfiles/images/2009/07/200907202227_160694_1612824_3.jpg[/img][img]http://ng1.17img.cn/bbsfiles/images/2009/07/200907202231_160696_1612824_3.jpg[/img]
如题,俺第一次测盐酸左氧氟沙星,做有关物质时杂质A与左氧保留时间完全重叠,排除了乙酸铵、高氯酸钠等试剂滴原因,实在没辙咧,请教大虾帮忙。盐酸左氧氟沙星有关物质测定方法(来源:中国药典2010年版第一增补本): 有关物质 取本品,精密称定,加0.lmol/L盐酸溶液溶解并定量稀释制成每1ml中约含1.2mg的溶液,作为供试品溶液,精密量取适量,用0.1mol/L盐酸溶液定量稀释制成每1ml中含2.4ug的溶液,作为对照溶液。另精密称取杂质A对照品约18mg,置100ml量瓶中,加6mol/L氨溶液1ml与水适量使溶解,用水稀释至刻度,摇匀,精密量取2ml,置100ml量瓶中,用水稀释至刻度,摇匀,作为杂质A对照品溶液。照高效液相色谱法(附录V D)测定,用十八烷基硅烷键合硅胶为填充剂;以醋酸铵高氯酸钠溶液(取醋酸铵4.0g和高氯酸钠7.0g,加水1300ml使溶解,用磷酸调节pH值至2.2)-乙腈(85 :15)为流动相A,乙腈为流动相B;按下表进行线性梯度洗脱。柱温为40°C;流速为每分钟1ml。称取左氧氟沙星对照品、环丙沙星对照品和杂质E对照品各适量,加0.1mol/L盐酸溶液溶解并稀释制成每1ml中约含左氧氟沙星1.2mg、环丙沙星和杂质E各6ug的混合溶液,取10ul注人液相色谱仪,以294nm为检测波长,记录色谱图,左氧氟沙星峰的保留时间约为15分钟。左氧氟沙星峰与杂质E峰和左氧氟沙星峰与环丙沙星峰的分离度应分别大于2.0与2.5。量取对照溶液10ul注人液相色谱仪,以294mn为检测波长,调节检测灵敏度,使主成分色谱峰的峰高约为满量程的20%。精密量取供试品溶液、对照溶液和杂质A对照品溶液各10ul,分别注人液相色谱仪,以294nm和238nm为检测波长,记录色谱图。供试品溶液色谱图中如有杂质峰,杂质A(238nm检测)按外标法以峰面积计算,不得过0.3%。其他单个杂质(294nm检测)峰面积不得大于对照溶液主峰面积(0.2%),其他各杂质(294nm检测)峰面积的和不得大于对照溶液主峰面积的2.5倍(0.5%)。供试品溶液色谱图中任何小于对照溶液主峰面积0.1倍的峰可忽略不计。时间(分钟) 流动相A(%) 流动相B(%) 0 100 0 18 100 0 25 70 30 39 70 30 40 100 0 50 100 0
[font=宋体][font=宋体]检测农产品中的喹诺酮类药物对于第三方检测食品实验室而言是再熟悉不过的项目了,氧氟沙星作为常检项目之一,主要针对水产品、牛羊等畜肉,[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]法检测主要依据国家标准[/font][font=Calibri]GB 31658.17-2021[/font][font=宋体]和农业部[/font][font=Calibri]1077[/font][font=宋体]号公告[/font][font=Calibri]-1-2008[/font][font=宋体]。就这么一个常规项目,在前段时间出现诡异的污染现象。[/font][/font][font=宋体]当时在做一批的水产品检测时,发现[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]检测结果所有的样品中都有氧氟沙星检出,而且结果均超过了最大残留限值。当时首先考虑的是基质干扰,因为氧氟沙星常出现保留时间接近的干扰峰,查看相对离子丰度比发现确实是氧氟沙星。考虑到空白样品中也有氧氟沙星检出,可能是前处理过程中带入的污染。重新配置了内标工作溶液,并将这批样品换人重做后问题并没有得到解决,因此怀疑污染源在仪器端。[/font][font=宋体][font=宋体]我将第一次处理的样品换到另一台[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]上检测,结果也有氧氟沙星检出,检出值小于之前的结果。分析三次的测试结果发现:所有样品、溶剂空白、样品空白都有氧氟沙星检出,保留时间基本一致,同一台仪器的仪器不同样品之间的结果接近,同一样品不同仪器的检测结果不一致。怀疑污染是在进样过程中引入,连同容器一起更换了新的洗针溶液,充分灌注洗针液通道,多次运行清洗进样针、针密封清洗、注射器清洗程序。用之前的溶剂空白,连续进样[/font][font=Calibri]10[/font][font=宋体]次,测试结果显示,溶剂空白中不再有氧氟沙星检出。将之前换下的洗针溶液取样上机测试,发现两台仪器的弱洗溶液中都有氧氟沙星检出。将之前的水产样品上机测试,结果均未检出氧氟沙星。[/font][/font][font=宋体]在后续查找污染原因时发现,同时在配置洗针溶液时未规范佩戴手套与口罩,同时他最近在服用氧氟沙星片剂。当时配置的洗针液直接添加到仪器洗针液的容器中,剩余部分倒入了另一台仪器的洗针液容器中。[/font][font=宋体]这次污染事件提醒了我们,在使用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质联用[/color][/url]这类高灵敏度的仪器时,规范的实验操作的重要性。实验室防护品不仅保护我们的健康,也是实验结果准确的保障。不同仪器间,避免出现试剂混用的现象,这样当出现问题时,我们才能更准确的找到原因。[/font]
实验室采用3.4ml磷酸 三乙胺调pH=2.4可是这样的话,走混标工作液的时候,诺氟沙星和氧氟沙星是分不开的,怎么办?? 有谁知道?
左氧氟沙星和左氧氟沙星酯2个性质很近的物质如何使得他们有很好的分离度希望有做过的,知道的,懂得的,不吝赐教!十分感谢!
大家好: 我们的养殖场使用的氧氟沙星我们却在蛋中检测出诺氟沙星请大家分析一下原因,我们是用[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]检测的。谢谢!
近期在做左氧氟沙星残留溶剂的验证,残留溶剂中有DMF和DMSO,因为左氧氟沙星很难气化,觉得还是做顶空好,但是左氧氟样品只溶于碱性溶液,如N-甲基吡咯烷酮,或是氢氧化钠溶液中,在酸性溶液中可能也可以溶解,但是DMF在酸性或是碱性条件下就会水解,根本没法做。请教大家应该如何去检测左氧氟沙星里的DMF呢?
有做药物检测的老师吗,咨询一下鸡蛋中的氧氟沙星,经过长途运输,会不会分解,导致含量降低?
请教各位,在做盐酸左氧氟沙星有关物质时,系统的分离度老达不到要求,不知道 是怎么回事《按照2010年药典》柱子类型、流速、流动相比例、柱温等可以改的都试过了
昨天用Agilent1200测定盐酸左氧氟沙星胶囊的含量,自动进样,流动相是在线混合。一份对照连续进样5次,保留时间基本一致,但峰面积变化很大,RSD=6.25%,测定结果偏差很大,不能使用。是进样器出了问题,还是流动相混合有问题,或者别的什么原因?
求助:给位大侠,有没有做过氧氟沙星氯化钠注射液的??我一直弄不明白2010药典对杂质的计算,各位如果做过,麻烦发一张积分图谱,如果有数据报告最好,谢谢注:双波长的转换我会做,就是不知道哪个是我所需要的峰?
请教各位前辈:1.听说有个ZN1009-2004标准,能检测水产品中,哪位前辈有,能否给我邮一份?2.有其他能同时前处理和检测水产品中恩诺沙星、环丙沙星、诺氟沙星、氧氟沙星的方法吗?QQ:3733818E-mail:yardin@126.com谢了先!!
谁有盐酸左氧氟沙星的色谱图和检测方法
做盐酸左氧氟沙星检测分离时按照药典2010版分析时效果不好?有没有好的柱子或者方法?
氧氟沙星在畜牧业水产业有什么作用?最近有许多的检出,望老师不吝赐教
左氧氟沙星在做液相时不出峰是什么原因急,,急,,,急,,希望个位有人士帮帮忙。。 非常感谢。
得到几份液相色谱法分析资料,刚刚整理好想和大家分享!1. 液相色谱法测试血浆中的氧氟沙星2. 液相色谱法分析废液酸中的乙酸3. 液相色谱法分析食物中残留农药(氨基甲酸酯类)
一直就很头疼,一直也不爱做这个品种的检验,XXXX沙星。。。盐酸左氧氟沙星,氟罗沙星,乳酸环丙沙星,,,,太伤柱子,而且不能减进样量(药典规定)就算是新柱子也顶不了几次的进样。最后就是分叉,拖尾,处理回复起来比较困难。(多用非罗门柱)在这里还请老师们给出出主意,是否还有比较合适点的柱子,或好的办法。
请教牛奶中氟喹诺酮残留的样品前处理方法,是SPE提取,用的是lc/ms测定,主要是氧氟沙星,诺氟沙星,环丙沙星,恩诺沙星,洛美沙星!
前几天做了乳酸左氧氟沙星,做含量,流动相是0.05mol/L枸橼酸溶液-1mol/L醋酸铵溶液-乙腈(77:1:14),检测波长为293nm,流速为1.0ml/min,TC=40度 。结果峰拖尾很严重。后来重新调了方法,得到了不错的峰。就是想问问做过的人,你们当时做的怎么样,也是拖尾很严重吗?
跪求用高效液相色谱法测定人体血浆中左氧氟沙星的前处理(尽量详细),色谱条件(流动相比例,柱温,最低检测限等)。我已经按文献方法做了几个方法,但不太好,有峰干扰样品测定。
整理了几份液相色谱分析方法,想和大家分享!1. 液相色谱法测试血浆中的氧氟沙星2. [url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]法检测无机阴离子3. 液相色谱法分析废液酸中的乙酸
注射液内含毛发异物 山东齐都药业身陷“质量门” 近日,国家食品药品监管总局(以下简称“药监总局”)发布公告指出,吉林省长春市一诊所发现山东齐都药业有限公司(以下简称“齐都药业”)生产的盐酸左氧氟沙星氯化钠注射液有类似毛发状异物。事发后,涉事产品被该公司业务员销毁,该公司生产管理体系存在缺陷。目前,山东省食品药品监督管理局已责令该企业停产整顿,并对涉事批次药品按劣药论处。 记者发现,其实早在2014年7月,该产品的说明书修订问题就曾被人投诉;而在此前的2014年5月,齐都药业生产的替硝唑片也曾被江苏省药监局部署采取查控措施,该公司为何频繁曝出药品质量问题?停产整顿 2月6日,药监总局发布《关于山东齐都药业有限公司产品质量问题的通告》称,该局2015年2月6日因产品质量问题约谈山东齐都药业有限公司,山东省、吉林省食品药品监管局参加了约谈。 经查,长春市一诊所发现山东齐都药业有限公司生产的盐酸左氧氟沙星氯化钠注射液有类似毛发状异物,事发后涉事产品被该公司业务员销毁,但有关证据证明涉事产品确实存在上述问题。2月7日,齐都药业在其官网发布关于产品质量问题的道歉信,承认上述事实,并承担全部责任。 药监总局在约谈中指出,山东齐都药业有限公司生产管理体系存在缺陷,必须立即开展自查,尽快找出药品生产质量管理体系中存在的问题,及时向监管部门提出整改报告。另外,山东齐都药业有限公司业务员销毁证据、掩盖事实的行为,严重违反《药品生产质量管理规范》诚实守信的基本要求,性质极其恶劣,总局已责成山东省食品药品监管局对该企业依法处理。 据记者了解,山东齐都药业有限公司生产的涉事盐酸左氧氟沙星氯化钠注射液批号为C13042201,总计21700瓶,2013年4月22日生产,有效期至2015年3月底。产品销往吉林8000瓶、河北10500瓶、黑龙江2300瓶、辽宁900瓶。药监总局已要求上述省食品药品监管部门关注产品的流通使用情况,采取有力措施监督企业召回产品;同时要求药品不良反应监测机构加强监测,发现不良反应事件及时报告并依法予以处置。 公开资料显示,齐都药业主要生产大容量注射剂、片剂、胶囊剂、冲洗剂、原料药等172个品种规格的产品。企业大输液产销量排名全国第三位,单体工厂全国第一位。 “事件发生后,公司主动采取召回措施,对该批次产品实施召回。组织专业人员对质量管理体系的各个环节进行自查,排查分析问题原因,并及时采取相应整改措施。还派出相关人员,就有关问题积极进行协调处理。”齐都药业在道歉信中表示。 2月16日,山东省药监局公开表示,药监总局通告山东齐都药业有限公司盐酸左氧氟沙星氯化钠注射液事件后,省局立即成立联合调查组对该企业进行了全面监督检查。一是监督企业全力召回所有涉事产品,截至2015年2月12日,该企业已完成召回工作,经终端使用单位确认,涉事批次药品已全部销售使用;二是监督山东齐都药业有限公司停产整顿,深入查找风险隐患和管理上存在的漏洞,确保类似问题不再发生,整改完成后由省局进行全面检查,符合相关要求后方可恢复生产;三是对涉事批次药品按劣药论处,依照有关法律法规严厉处理;四是监督企业质量保证体系运行和整改措施落实,并采取有效措施,确保药品生产质量安全。 3月5日,齐都药业办公室崔主任在电话里向本报记者表示,药监部门正在对“异物门”事件进行调查,还没有最终处理结论,该公司现在对此不便回应。屡现问题 据记者了解,左氧氟沙星是氧氟沙星的左旋体,属第三代喹诺酮类药物。左氧氟沙星注射剂是临床使用广泛的抗感染药,因其抗菌谱广、疗效好、使用方便等原因,在抗菌治疗领域发挥着重要作用。然而,随着药品的大量应用,其不良反应也日益突显。 2009年5月,国家药监总局第22期药品不良反应信息通报指出,左氧氟沙星注射剂严重病例报告突出,建议药品生产等加强临床合理使用抗菌药物的教育与宣传,充分告知医生和患者可能存在的潜在风险。 2012年12月31日,国家药监总局(国食药监注373号)通知:“决定对左氧氟沙星(包括盐酸左氧氟沙星、甲磺酸左氧氟沙星、乳酸左氧氟沙星)口服和注射剂说明书进行修订。药品生产企业要尽快修订说明书及标签的相关内容,按照有关规定进行备案。”新版说明书增加了相关警示语、不良反应警示语、不良反应等相关内容。 2013年8月2日,国家药监总局发布第56期通报指出,2012年,收到左氧氟沙星注射剂严重不良反应/事件病例报告1431例,占总例次的60.24%。要求生产企业修改完善药品说明书相关内容,保障公众用药安全。 2013年11月21日,药监总局第58期通报“及时修订氟喹诺酮类药品的产品说明书,更新相关的用药风险信息如不良反应、注意事项等,以有效的方式将氟喹诺酮类药品的风险告知医务人员和患者”。 据山东省田先生向记者反映,截至2014年7月,齐都药业药品“迪诺新”盐酸左氧氟沙星氯化钠注射液仍在使用2007年5月核准的说明书。 事实上,早在2014年5月,齐都药业生产替硝唑片就因说明书问题被江苏省药监局部署采取查控措施。 据无锡市锡山食品药品监督管理局官网信息显示,按照省局紧急通知要求,该局第一时间部署查控问题药品工作,督促辖区内相关经营企业及医疗机构开展排查,对库存的山东齐都药业有限公司生产的替硝唑片(批号:1312041,规格:0.5克),立即停止经营使用,并采取暂控等措施,同时要求上报库存产品数量以及举一反三检查相近批次的药品说明书情况。 经统计,锡山区涉及问题药品零售及使用单位2家,药品批发企业1家,涉及药品销售数量为300盒。2014年5月9日下午13时,辖区药品批发企业下发药品召回通知,开展涉及药品的召回工作。截至2014年5月12日下午16时,已召回110盒。据业内人士介绍,2013年10月16日,药监总局办公厅发布关于修订替硝唑口服片剂和胶囊剂说明书的通知。为保障公众用药安全,根据国家食品药品监督管理总局监测评价结果,决定对替硝唑口服片剂和胶囊剂说明书进行修订。要求生产企业在2013年12月15日前,依据《药品注册管理办法》等有关规定提出修订说明书的补充申请报备案。说明书的其他内容应当与原批准内容一致。补充申请批准之日起生产的药品,不得继续使用原药品说明书。 上述人士分析认为,无锡药监部门要求举一反三检查相近批次的药品说明书情况,这说明可能是齐都药业修订说明书的补充申请批准后,该批次替硝唑片继续使用了原药品说明书,从而导致被药监部门采取查控措施。 替硝唑片被药监部门采取暂控等措施的最终处理结果如何?(迪诺新)盐酸左氧氟沙星氯化钠注射液是什么时候开始按照药监总局要求修改产品说明书的?患者田先生的反映是否属实? 对此,崔主任仅向记者表示:“这件事情已经过去很久,没有什么新闻价值,你就不要关注了。”
[color=#ff483f][size=4]2010年苏中片药检所实验室比对工作交流会在扬召开[/size][/color][size=3][font=宋体] 5月23日至25[/font][font=宋体]日,2010年苏中片药检所实验室药品比对工作交流会[/font][/size][font=宋体][size=3]议在扬州召开。省食品药品检验所副所长王玉出席会议并讲话。全[/size][/font][font=宋体][size=3]省各市级药检所负责人及苏中片药检所参加实验室比对的有关人员[/size][/font][font=宋体][size=3]共60多人参加会议。[/size][/font][size=3][font=宋体] [/font][font=宋体]会议通报了2010年苏中片南通所、泰州所、镇江所、扬州所实验[/font][/size][font=宋体][size=3]室比对情况,深入研讨了在机构改革分级管理和深化医药卫生体制改[/size][/font][font=宋体][size=3]革的形势下,市级药检所事业发展面临的新机遇、新挑战、新使命,[/size][/font][font=宋体][size=3]以及如何做好国家基本药物品种检验工作。会议期间,省食品药品检[/size][/font][font=宋体][size=3]验所专家就注射剂安全性检查、中药评价性抽验、左氧氟沙星制剂质[/size][/font][font=宋体][size=3]量分析等作了专题业务讲座。[/size][/font][size=3][font=宋体] [/font][font=宋体]会议认为,各市级药检所要以机构改革为契机,抢抓机遇,开拓[/font][/size][font=宋体][size=3]思路,扩大职能,提高可持续发展能力;要加强检验检测能力建设,[/size][/font][font=宋体][size=3]为食品药品监管工作提供有力的技术支撑;要加强沟通联系,相互协[/size][/font][font=宋体][size=3]作,为全省药检事业发展作出积极的贡献。[/size][/font][font=宋体][size=3][/size][/font][font=宋体][size=3]摘自《中国 扬州》[/size][/font]
我最近做沙星,空白样品添加诺氟沙星和环丙沙星出不来,氧氟沙星和恩诺沙星没问题。纯标品进样也没问题。各位大侠帮我分析分析可能哪里出了问题!! 现在我们实验室的室温挺低的也就有6-7度,会有影响吗?http://simg.instrument.com.cn/bbs/images/default/emyc1010.gif
为什么说做了食品中的沙门氏菌了,其所用的培养箱就不能再用来培养药品的无菌试验了,不明白为什么有这样的要求,难道培养了沙门氏菌,会污染药品的无菌试验?为什么呢?
甘肃骄阳采购招标代理有限责任公司受庆城县食品药品监督管理局的委托,对庆城县2016年食用农产品检测项目以公开招标的形式进行采购,评标委员会于2016年4月25日确定中标结果。现将结果公布如下:招标文件编号:GSJY-ZC2016142 2、招标内容: 庆城县食品药品监督管理局2016年食用农产品抽检定点委托检验机构采购,承担食用农产品合计288批次抽检任务。 3、招标公告日期:2016年4月5日 4、定标日期:2016年4月25日 5、中标供应商名称、制造商、中标金额及单价: 甘肃国信润达分析测试中心 成交金额:¥410200.00元 大写:人民币肆拾壹万零贰佰圆整。 食品品种 (三级) 食品细类(四级) 风险等级 抽检项目 计划批次 单价 畜禽肉 畜肉 高 喹诺酮类、硝基呋喃代谢物(AMOZ 、AOZ、 AHD、 SEM)、挥发性盐基氮 11 1600 禽肉 高 喹诺酮类、硝基呋喃代谢物(AMOZ 、AOZ、 AHD、 SEM)、挥发性盐基氮 11 1600 畜禽副 产品 畜内脏 高 喹诺酮类、硝基呋喃代谢物(AMOZ 、AOZ、 AHD、 SEM) 12 1600 禽内脏 高 喹诺酮类、硝基呋喃代谢物(AMOZ 、AOZ、 AHD、 SEM) 2 1600 淡水产品 淡水鱼 高 喹诺酮类[诺氟沙星(NOR)、环丙沙星(CIP)、恩诺沙星 (ENRO)、氧氟沙星(OFL)、沙拉沙星(SARA)、硝基呋喃代谢物(AMOZ 、AOZ、 AHD、 SEM) 12 1600 淡水虾 高 喹诺酮类、硝基呋喃代谢物(AMOZ 、AOZ、 AHD、 SEM) 11 1600 淡水蟹 高 喹诺酮类、硝基呋喃代谢物(AMOZ 、AOZ、 AHD、 SEM)、磺胺类(总量) 8 2100 海水产品 海水鱼 高 喹诺酮类、硝基呋喃代谢物(AMOZ 、AOZ、 AHD、 SEM) 0 1600 海水虾 高 喹诺酮类、硝基呋喃代谢物(AMOZ 、AOZ、 AHD、 SEM) 0 1600 贝类 新鲜贝类 高 喹诺酮类、硝基呋喃代谢物(AMOZ 、AOZ、 AHD、 SEM) 0 1600 软体动物 鱿鱼、章鱼、墨鱼、海参、海肠 高 铅、镉、甲基汞、无机砷 [align=cente