求助标准谱图,秋水仙碱。哪位大虾有电子版的红外光谱集啊?
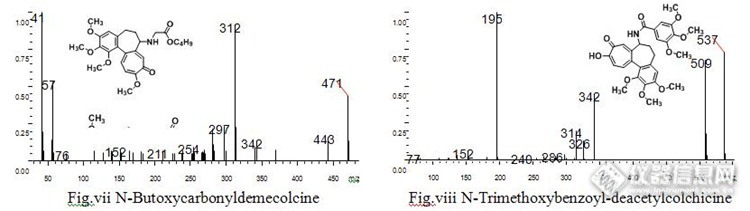
秋水仙碱类生物碱的质谱裂解规律探究摘要:采用气相色谱质谱(GC/MS)研究了八种秋水仙碱类生物碱化合物的质谱裂解途径和机理。发现部分碎片离子一致,其主要的裂解途径是通过四元环过渡态氢重排失去侧链生成离子m/z340,由于结构中的七元环上有羰基,而七元环相对来讲没有六元环稳定,所以其会进一步失去羰基的CO生成离子m/z 312,保持了较高的稳定性,所以在质谱图上表现出较高的丰度,同时化合物还通过失去甲氧基自由基及甲基自由基得到其他对应的碎片离子峰。关键词:秋水仙碱;裂解规律;气质联用;生物碱秋水仙碱类生物碱是一类很重要的有机化合物,秋水仙碱是1820年于百合科植物秋水仙中发现的一种重要的卓酚酮类生物碱(1)。由于秋水仙碱及其类似物的特殊生理活性和药用价值,它们一直受到广泛的关注。因其特殊的结构和强抗癌活性,近几年有关秋水仙碱作用机制的研究异常活跃。临床上常作为痛风性关节炎急性发作和某些癌症治疗的首选药(2-5)。当秋水仙碱的摄入量过多将会导致死亡,所以也受到司法鉴定的关注。同时秋水仙碱在生物学上更重要的用途是作为多倍体诱导剂诱导多倍体的发生(6-10)。目前关于秋水仙碱的检测方法已有较多报道(11-14)。色谱质谱法由于其特异性,具有较好的分离度以及较高的灵敏度且能提供更多的样品信息而被广泛应用,对于生物碱类化合物的质谱裂解规律及机理已有较多的文献报道(15-21)。而关于秋水仙碱类生物碱的质谱裂解机理和规律还未见相关报道,电子轰击离子源由于具有较高的电离能,能够获得更加丰富的质谱信息而被广泛应用,所以本文通过气相色谱质谱联用法对多种秋水仙碱类化合物在电子轰击离子源下的质谱裂解途径和规律做以阐释总结,旨在为此类化合物的组分鉴定,结构确认提供理论指导依据。1试验部分1.1 仪器与试剂GCMS-QP2010UItra(日本Shimadzu公司);Demecolcine、Deacetylcolchicine、2-Demethylthiodemecolcine、N-Butoxycarbonyldemecolcine、N-Deacetylisocolchicine、N-Acetylcolchamine、N-Trifluoroacetyldemecolcine标准品2.2 仪器条件1.2.1 色谱条件 色谱柱:Agilent DB-1MS弹性石英毛细管柱(30m*0.32mm*0.25um);载气:He(纯度99.999%);恒压模式:48.0kPa;初始温度100℃,以10℃/min的速率升至300℃恒温10min;分流进样,分流比10:1;进样量0.2ul,进样口温度300℃,接口温度300℃。1.2.2 质谱条件 离子化方式:EI(电子轰击离子源),离子化电压70ev,离子源温度250℃,离子扫描范围:m/z 32~600。1.2 实验方法称取0.25mg标准品用1ml甲苯溶解,分别进行GC/MS全扫描,获得八种化合物EI离子源下的质谱图。八种化合物及其对应的质谱图如下:http://ng1.17img.cn/bbsfiles/images/2015/08/201508211541_562003_2359621_3.jpghttp://ng1.17img.cn/bbsfiles/images/2015/08/201508211541_562004_2359621_3.jpghttp://ng1.17img.cn/bbsfiles/images/2015/08/201508211541_562005_2359621_3.jpghttp://ng1.17img.cn/bbsfiles/images/2015/08/201508211541_562006_2359621_3.jpg2 结果与讨论2.1 Deacetylcolchicine的质谱裂解途径去乙酰秋水仙碱Deacetylcolchicine的质谱图见图Fig.i,谱图中基峰为分子离子峰m/z 357,表明其分子结构具有较高的稳定性。谱图中有明显的m/z 340碎片离子,其生成是由于氨基具有较强的质子亲合能,β位的氢通过四元环过渡态重排到氨基上,然后脱去中性分子NH3,两个孤电子成对生成烯键得到碎片离子m/z 340。由于分子结构中具有环庚三烯酮结构,所以其可以发生进一步的裂解失去CO中性分子,而形成六元环稳定结构,得到碎片离子m/z 312,为奇电子离子,具有较高的丰度。由分子离子峰可直接失去CO中性分子得到碎片离子m/z 329,当苯环上的一对π电子被电离后,离子m/z 329可以发生α断裂,失去甲基自由基,得到离子m/z 314,该离子通过氢过渡态重排失去NH3得到离子m/z 297(其生成也有可能是m/z 312失去甲基自由基)。该离子失去中性分子CO后生成离子m/z 269,该离子再失去甲基自由基后得到碎片离子m/z 254,该离子可进一步失去甲基自由基生成离子m/z 239,后失去一分子CO得到离子m/z 211,再失去一分子CO得到离子m/z 183。游离基中心定域在氨基上,游离基中心孤电子强的配对倾向诱导发生α断裂失去氢自由基得到碎片离子m/z 328。由分子离子峰可以失去甲氧基得到碎片离子m/z 326,该离子进一步失去CO得到离子m/z 298具有较高的丰度,后失去甲基自由基生成离子m/z 281。可能的质谱裂解途径见Fig. 1http://ng1.17img.cn/bbsfiles/images/2015/08/201508211451_561952_2359621_3.jpg图1 Deacetylcolchicine的质谱裂解可能的质谱裂解途径Fig. 1 Possible cleavage pathways of Deacetylcolchicine2.2 N-Deacetylisocolchicine的质谱裂解途径去乙酰异秋水仙碱N-Deacetylisocolchicine的质谱图见图Fig.ii,其结构上与去乙酰秋水仙碱有细微的差异,仅是甲氧基取代基与羰基的位置发生了互换,其质谱图中基峰为分子离子峰m/z 357,分子离子峰失去甲基自由基,生成碎片离子m/z 342,该碎片离子失去中性分子CO后生成离子m/z 314,后通过四元环过渡态β位氢重排失去小分子NH3生成离子m/z 297,由分子离子失去中性分子CO后生成离子m/z 329,当游离基中心定域在氨基上自由基强烈的配对倾向诱导发生α断裂失去氢自由基生成碎片离子m/z 328。由分子离子还可直接失去甲氧基自由基生成碎片离子m/z 326,其可以失去CO得到离子m/z 298,具有较高丰度,分子内氢重排失去甲醛后生成离子m/z 268。当分子离子经过四元环过渡态氢重排后失去NH3可生成离子m/z340,该离子进一步裂解失去CO中性分子得到离子m/z 312,稳定的六元环结构提高了离子的稳定性,所以具有较高的丰度,该离子失去甲氧基后生成离子m/z 281,可进一步裂解得到离子m/z 266,或者通过氢重排失去甲醛生成离子m/z 282,可进一步裂解生成离子m/z 267。m/z 312亦可失去甲基自由基得到离子m/z
药品标准是药品检验必须遵循的法定依据,是药品生产的法定技术准绳,并对临床用药发挥重要的指导作用。国务院食品药品监督管理部门设置的药典委员会负责药品质量标准的制定和修订。1. 采用和执行药品质量标准的现状药品质量标准主要分为《中华人民共和国药典》及其增补本;国务院药品监督管理部门颁布的国家药品标准(包括国家食品药品监督管理局药品注册批件或修订件);卫生部药品标准;药品注册标准;国家食品药品监督管理局药品检验补充方法和检验项目批准件等;省级中药材标准;省级中药饮片炮制规范;医疗机构制剂标准等。按照《药品管理法》第六条的规定,我国市(地)以上药品检验所承担着对上市药品质量的监督抽验任务。以北京为例,中国药品生物制品检验所和北京市药品检验所主要承担着药品的注册检验、进口药品的检验、生物制品和全国评价性药品的检验;大量的上市后药品的监督抽验主要由各区县所负责。以下谈谈采用和执行药品质量标准的现状。1.1药品质量标准难求 无论是从版本上还是从分类上,现行的药品质量标准都是一个庞大的标准库。对于每年颁发的新药和仿制药品标准、试行标准等,有关部门只将标准发送到研制单位和当地省级食品药品监督管理部门和省级药品检验所,基层药检所很难得到。笔者所在的北京市区级中心药品检验所在日常工作中经常遇到查找和索取药品标准的情况。为了履行自己的检验职责,基层所要自己向相关单位索取药品标准。但是能否及时要到标准,要来的标准是否就是真实有效的,基层药检所本身由于自身权限的局限,已经无能为力了。这种局面的长期存在对公众的用药安全构成潜在的风险。1.2检验方法参差不齐目前,国内不同药品生产企业生产的同一种药品,执行不同的药品标准的现象比较普遍,甚至有同一生产企业生产的同一种药品仅因为规格不同,执行的药品标准也有不同。对于同一种药品,有时检验的项目和参数不同;有时项目一样,具体的检验方法又不同。例如常用的OTC药品—健胃消食类制剂,尽管《中国药典》收录有健胃消食片,可是由于规格的改变或者生产厂家的不同,可能具体执行的就是单页标准。又如常用的抗感冒药复方氨酚烷胺类制剂,不同厂家做含量测定时,有的采用的是传统的化学滴定,有的采用高效液相色谱法。这会导致同一个名称的上市药品其内在质量其实各异,对于患者来说,很难获得同一的疗效和安全保障。1.3标准针对性待商榷例如,(1)中成药中非法添加西药是近年来打击的重点。有关部门也专门汇编了部分厂家部分品种的补充检验方法,所用的仪器相当一部分是液相色谱-质谱联用设备。目前,在北京地区的18个区县所中没有一家有该设备。即使遇到患者举报有类似情况时,我们就无能为力了。唯一的办法就是交给省(直辖市)药检所来做。(2)地高辛片是《中国药典》收录的品种,其质量标准项下既采用高效液相色谱法测定了含量均匀度,同时又采用高效液相色谱法测定含量。又如在很多中成药质量标准中既用HPLC法测定了某种成分的含量,又用TLC法做鉴别。这些检验项目单个来看,都是无可厚非的。但联合起来看则有重复检验的嫌疑。为了节约检验成本,同时也为了尽可能地实现低碳和环保的目的,不必过分追求检验项目的多和全。(3)新版《中国药典》中微生物限度采用方法验证试验,这在基层药检所的实际工作中不太适用,开展起来很困难。到目前为止,每年很少有检品做该项检验。2.对策
新华网北京4月20日电(记者吕诺、吴晶)正在公开征求意见的新《药品注册管理办法》征求意见稿提出,国家食品药品监管局根据 申请人提供的研究数据,对药品的安全性、有效性和质量可控性进行系统评价,对上市价值和风险进行评估,在此基础上决定是否同意该药品上市。 国家食品药品监管局副局长吴浈20日对此评价说,评估是指药品监督管理部门站在公众利益的角度,综合技术审评、国家药品政策、环境保护、药物经济等,对一类药品或某种药品进行综合评价,以确定是否批准上市的行为。这种评估是根据需要,由有关专家、相关部门组成的评价委员会进行的。这一原则的设定,旨在为应对可能出现的非理性申报奠定法规基础。 吴浈说,我国现行的《药品注册管理办法》,存在审评审批权力配置不合理,标准不够完善,程序不够严密,过程不够透明,审评审批时限达不到要求等突出问题。征求意见稿在药品审评审批环节进行了多处修订,以期推动药品审评审批改革。 据吴浈介绍,征求意见稿调整和明确了监督管理部门的职责,强化了省级药监部门在对研制情况和申报资料真实性核查方面的责任;增加了省级药监局对申报资料进行初步审查,并提出审查意见的权利,以及组织实施仿制药、补充申请注册的批准生产前的现场生产检查工作的责任。国家食品药品监管局还将探索将部分审评或审批事项下放给省局的方法。 为加强对审评审批权力的约束,征求意见稿还提出实施公示制度,公示药品注册受理、核查、检验、审评、审批人员名单及相关信息,公示药品注册的检验、审评、审批进展情况,公示药品审评审批结果,接受社会监督。
11月22~23日,2012年全国药品快检工作会议在广州市召开,国家食品药品监管局孙咸泽副局长出席会议并讲话。 本次会议回顾总结了药品快检技术在我国研究和应用近十年来所取得的成绩,分析了药品监管和快检工作面临的新情况和新问题,深入讨论了推进药品快检技术的发展方向。 孙咸泽指出,《国家药品安全“十二五”规划》对加强我国药品医疗器械检验检测体系建设和能力建设,提出了明确要求。2012年8月,国家局发布了《加快推进药品快速检验技术研究与应用工作的指导意见》,结合当前药品监管特点,加快推进药品快速检验技术研究与应用。“十二五”期间,我国药品快检技术发展面临大好机遇。 孙咸泽要求,食品药品检验系统要结合贯彻十八大精神、“十二五”规划的实施,深入推进药品快检技术的发展。要逐步形成以中检院为牵头单位、全国食品药品检验系统共同参与的快检技术研发体系;要以科研工作为载体,建立起分工合作的快检技术研究体制和机制;要明确快检技术发展的重点方向,以实现对监管工作更大力度的技术支撑;要加强快检技术研究队伍的建设和人才培养,积极开展快检工作的国内国际交流。 土豆:看了以上新闻各位药学同行有啥想法呢,你看好药品快检吗?我就立刻想到,俺们的药品快检车没准要更新换代了,包括车里的仪器,毕竟是2004年还是03年配的,都快十年了。然后利用新配的仪器又可以搞点研究,发点论文啥的了。然后我又想到:貌似以前的快检装备对付假的化学药抗生素还行,但对于现在中成药里的一些指标成分还没法检测得出来,不过也没办法,连实验室方法有时候还未必奏效呢,怎么能指望快检方法呢。就暂时想到这么多了,欢迎各位发表看法哦。
昨天(27日),国家食品药品监督管理局副局长吴浈做客中国网。他表示,今年国家药监局将采取评审人员集体负责制以及审批责任追究制等办法完善药品审批制度,防止腐败。 “三制一化”防止腐败 由于郑筱萸案暴露出药品审批中的腐败,昨天吴浈表示,药品审批过程当中出现了一些腐败现象,应该要正视。虽然是少数人,但已让整个系统蒙羞。他说,今年国家药监局会加强药品审评审批的管理,在药品审评审批中实行“三制一化”。所谓“三制一化”,就是实行审评人员集体负责制,目的就是防止个别人滥用审评审批权力;实行审评审批责任追究制,强化对违法审批行为的责任追究;实行审评审批检验人员公示制,将药品审评审批置于社会监督之下。他说,目前国家药监局正在全力抓药品审批的信息平台建设,目的就是让审批能够公开透明。今后,国家药监局要逐步实行药品审批在网上进行受理。 驻厂监督员无权处罚企业 由于不久前媒体广泛报道了国家药监局将向药厂派驻驻厂监督员,吴浈说,今天第一批派驻监督员将在国家药监局培训。他强调,驻厂监督员不包揽企业的质量责任,企业永远是产品质量的第一责任人。同时,驻厂监督员无权直接处罚企业。 02年批号药品今年再注册 对于国家药监局日前提出的药品再注册,吴浈解释说,药品再注册是对药品批准证明文件有效期满后要求继续生产药品实施再审批过程。根据规定,药品批准文号的有效期都是5年。有效期满以后,都必须按照有关规定进行药品再注册。 目前再注册的范围是,2002年换发批准文号的品种以及2003年新批准上市的品种进行再注册,因为这些药有效期已满5年。并不是所有药品都要再注册。
1. 对于实验室领用后暂时不用的危险化学品应存放于固定存放点;2. 保证与禁忌物分开存放并保证与“避免接触的条件”不接触;3. 并做好防挥发、防泄露、防火等安全措施;4. 有毒的化学品,要由专人负责保管,对药品的使用及领取作详细记录;5. 使用腐蚀性化学品时要注意个人的防护;6. 禁止口尝、直接鼻嗅、手直接接触的方法鉴别化学药品或危险物质。7. 用移液管、吸管吸取有毒或腐蚀性液体时,严禁用嘴直接吸。8. 药品在器皿中加热时,必须放置平稳,瓶口或管口禁止对着人;在移动沸腾的液体时,应放置在隔热石棉网上,轻拿轻放。9. 不能把浓酸、浓碱气化剂和有机物质放在一起,否则会引起爆炸和燃烧。10. 使用易燃易爆化学品时,应在通风橱内进行,远离热源、火源,在使用过程中需要加热挥发,须采用水浴加热,严禁用明火,并在通风橱内进行(电源开关、电源插头等须在通风橱外)。11. 对于无标签或掉标签的药品需要经过鉴定,贴上标签后方可使用,无法鉴定的药品和试剂按危险物处理,严禁使用不明内容物的药品。12. 使用药品时,药品瓶应轻拿轻放,避免碰撞以致打碎药瓶。
中药的主要化学成分与药理中药的化学成分极为复杂。有些成分是一般高等植物普遍共存的,如糖类、油脂、脂类、蜡、酸、蛋白质、氨基酸、维生素、色素、树脂、无机盐类等;另一些则是存在于某些器官中比较特殊的的化合物,如生物碱类、黄酮类、强心甙、皂甙、挥发油、有机酸等,而且大多具有显著的生理活性。每一种中药往往含有多种化学成分,但并不是所有化学成分都能产生防治疾病的效用。通常将中药中含有的化学成分分为有效成分和无效成分。所谓有效成分是指具有医疗效用或生物活性的物质,如麻黄碱、小檗碱、黄芩素、薄荷醇等。有效成分都能用一定的分子式或结构式表示,并具有一定的熔点、沸点、旋光度、溶解度等理化常数,所以又称有效单体。如果尚未提纯成单体的化合物,一般称它为有效部分或有效部位。所谓无效成分是指与有效成分共存的其它化学成分,它们通常没有(或目前尚未发现有)生物活性和医疗作用,如糖类、酸、油脂、蛋白质、树脂、色素、无机盐等。但有效成分和无效成分的划分不是绝对的,许多过去认为无效的成分,随着医疗实践和中药研究的进展而发现是有效成分。中药中所含化学成分(有效成分)都具有一定的药理作用。一种中药往往含有多种成分,不同的有效成分往往具有不同的药理作用,但有些不同的有效成分有相似的作用。一味中药中所含有的多种有效成分,它们之间可以产生相互作用,如协同作用、制约作用、对抗作用等。在复方中,中药的化学成分和药理作用还可能有所变化。因此,对于中药的化学成分及药理作用,绝对不能孤立地去认识和研究。现将植物类中药中主要化学成分及药理作用简要介绍如下。§1生物碱 生物碱是一类含氮有机化合物,能与酸结合成盐。大多数生物碱都有复杂的环状结构,氮原子在环内,但亦有少数例外,如麻黄碱的氮原子则在侧链上而不在环内。生物碱具有光学活性、强烈的或特殊的生理作用。它们广泛存在于生物界(主要为植物界),种类繁多。目前生物碱结构已搞清楚的有几千种。化学结构类似的生物碱往往不仅存在科属上的亲缘关联,在药理效用上亦有一定关系。一、烃胺衍生物类生物碱 1. 苯乙胺类 主要包括肾上腺素类、麻黄碱类和南美仙人掌碱类等。肾上腺素类生物碱均来源于蛋白质降解物氨基酸中酪氨酸,在动物神经组织中可经多巴转变成多巴胺及去甲肾上腺素等神经递质,在肾上腺髓质中则可进一步转变成肾上腺素。在植物界虽未发现肾上腺素,但其它衍生物或中间体等是广泛存在的。如黧豆属植物常绿油麻藤等种子藜豆中含多巴,提取制品可用作多巴胺前体,治疗多巴胺不足所致的震颤麻痹症。马齿苋全草除含少量多巴外,还含多巴胺及去甲肾上腺素,故肌肉或宫腔注射可收缩血管及子宫,用于产后出血的止血。麦角及扁豆等因富含酪胺,不宜与单胺氧化酶制剂合用,否则后者可使酪胺不易被肝脏脱胺代谢,以致酪胺积蓄,取代去甲肾上腺素使之从神经末梢的囊泡中释放,可升高血压,导致高血压。枳实中含辛福林和N-甲基酪胺,具收缩血管、升压及强心作用。麻黄碱主要存在于麻黄茎枝的髓部,秋季含量最高,其它如浆果紫杉、心叶黄花稔、欧乌头、斑点亚洲罂粟等亦有存在。麻黄中主含L-麻黄碱,其次为D-伪麻黄碱。苯乙胺类生物碱的药理作用主要系直接或间接作用于肾上腺素能神经末梢效应器的肾上腺素受体,产生交感神经兴奋的各种生理作用,如皮肤、粘膜血管收缩及升压作用,用于某些出血、鼻粘膜肿胀、过敏性休克;兴奋心脏作用,用于心跳骤停;支气管松弛解痉作用,用于支气管哮喘以及中枢兴奋作用等。2. 季铵烃类 季铵烃类主要以胆碱及其衍生物广泛存在于生物界,在动物体中常最后形成乙酰胆碱,起着神经递质的重要作用;在植物体中则最后形成甜菜碱。中草药中的黄芪、枸杞、茵陈、金钱草、鸡骨草、连钱草、荠菜、茯苓等均含有这类生物碱。甜菜碱能参与供给甲基的脂肪代谢作用,胆碱则可与脂肪酸、磷酸形成易溶性的卵磷脂,参与脂肪转运,故二者均属于趋脂性药物,用以防治脂肪肝和脂肪在血管壁沉积引起的动脉粥样硬化等疾病。此外,捕蝇毒蕈中所含毒蕈碱,具类似乙酰胆碱结构,而较乙酰胆碱稳定,不易破坏,它可产生类似乙酰胆碱的副交感神经兴奋的呕吐、腹痛、腹泻、流涎、瞳孔缩小、循环抑制等症状,可用阿托品拮抗解毒。3. 秋水仙碱类秋水仙碱类系侧链胺基氮类生物碱,主要含于百合科植物如秋水仙、土贝母、嘉兰等的球茎及种子中。秋水仙碱类系植物激素,对植物细胞有丝分裂具抑制作用;在临床上对动物癌细胞分裂有显著抑制作用,可用于皮肤癌及白血病等,但对造血系统的抑制及肠胃等毒性反应亦较大。此外秋水仙碱类小剂量可促使皮质激素释放,有抗炎作用,可用于缓解急性痛风等。[/size
关于山西旺龙神农药业有限公司等七家企业产品检出苏丹红或松香酸的通告 在全国范围内组织对风湿关节炎片和跌打丸2个品种进行了专项监督抽验,分别从药品生产、经营和使用环节抽取了158批次跌打丸和155批次风湿关节炎片。经青岛市食品药品检验检测中心按照补充检验方法检验,发现标示为山西旺龙神农药业有限公司生产的2批跌打丸检出苏丹红I和苏丹红Ⅳ;标示为吉林省通药制药集团股份有限公司和吉林省华侨药业有限公司生产的共4批跌打丸检出松香酸。经青海省食品药品检验所按照补充检验方法检验,发现标示为长春银诺克药业有限公司、吉林省红石药业有限公司、吉林省跨海生化药业制造有限公司和沈阳东新药业有限公司生产的共12批风湿关节炎片检出松香酸(详情见附件)。苏丹红是化学染色剂,常被用于劣质血竭等药材的非法染色。毒理学研究表明,苏丹红对人体具有明显的毒性作用,在中药材、中药饮片和中成药中均不得检出。松香酸是松香的主要成分,松香常被用于乳香、没药、血竭等药材的掺假。目前松香酸对人体有害尚不确定,但在含乳香、没药、血竭的中成药中不得检出。近年来,食品药品监督管理部门在监督检查及抽验中发现,劣质血竭药材有用苏丹红非法染色、以次充好的现象,乳香、没药、血竭等含树脂类药材中有非法掺入松香、以假充真的现象。本次抽验发现的问题属于企业违法添加还是购进的中药饮片存在质量问题,当地食品药品监督管理部门正在调查当中。无论哪种情形,都说明企业质量管理存在严重缺陷,难以确保药品质量安全。检检出苏丹红和松香酸的药品名单跌打丸山西旺龙神农药业有限公司山西省侯马经济技术开发区文明路589号董 生20130102国家食品药品监督管理总局药品检验补充检验方法和检验项目批准件2014002检出苏丹红I、苏丹红Ⅳ青岛市食品药品检验检测中心20121004通药制药集团股份有限公司通化市修正路39号李志宝120402国家食品药品监督管理总局药品检验补充检验方法和检验项目批准件2014007检出松香酸120601120901吉林省华侨药业有限公司吉林省松原市青年大街2499号胥凤琴20120801风湿关节炎片长春银诺克药业有限公司长春九台经济开发区群英大路888号刘晓峰20120501国家食品药品监督管理总局药品检验补充检验方法和检验项目批准件2014007检出松香酸青海省食品药品检验所吉林省红石药业有限公司长春市绿园区翔龙路17号代振文20130901201309022013110120131201201401012014040
3月26日,中国食品药品检定研究院(以下简称中检院)发布《国家药品抽检年报(2023)》(以下简称《年报》)。《年报》显示,2023年国家药品抽检共完成132个品种18762批次制剂产品与中药饮片的抽检任务,样品来源涉及1114家药品生产、2528家经营企业和511家使用单位,由中检院等47个承检机构负责检验样品,检出136批次不符合规定产品。抽检结果显示,当前我国药品安全形势总体平稳可控,药品质量持续保持在较高水平。 药品抽检作为药品上市后监管的重要手段之一,是实现风险管理、科学管理、监管前置的重要技术支撑。2023年,国家药监局紧紧围绕药品监管实际需求,聚焦重点任务,完善运行机制,创新监管方式,采取“分散抽样、集中检验、探索研究、综合评价”的抽检模式,此外,通过优化抽检模式,进一步提升抽检服务监管的效能。 抽检制剂产品16604批次 2023年国家药品抽检共抽检制剂产品16604批次。经检验,16531批次产品符合规定,73批次产品不符合规定。 在化学药品方面,共抽检74个品种10893批次,经检验不符合规定44批次,不符合规定项目包括检查和含量测定。 在中成药方面,共抽检43个品种5584批次,涉及11个剂型。经检验,不符合规定29批次,不符合规定项目主要涉及鉴别和检查。 在生物制品方面,共抽检6个品种127批次。经检验,所检项目均符合规定,合格率为100%。 根据制剂产品抽检结果,《年报》对生产企业、经营企业加强管理进行了提示,并给予监管部门建议。《年报》建议监管部门严格审查企业批生产记录,核查原辅料投料量,推动质量标准提升 加强对生产企业的监督检查,督促其严格按照处方工艺投料,严格执行GMP规范,从而保证中成药的质量及疗效。 《年报》还显示,2023年国家药品抽检共抽检国家基本药物39个品种6140批次,不符合规定13批次,国家基本药物整体质量状况较好 共抽检国家集中采购中选品种20个品种3435批次,集中采购涉及样品均符合规定,国家药品集中采购中选品种整体质量状况较好 共抽检进口药品309批次,均符合规定。 2023年,国家药监局继续组织开展中药饮片专项抽检,共抽检9个中药饮片品种2158批次,不符合规定63批次 继续组织开展中药材质量监测,共监测9个品种251批次样品。抽检及监测结果显示,我国中药饮片总体质量状况良好,但中药饮片全产业链参与者应进一步增强质量意识和责任意识,中药饮片生产企业应提升全程质量控制意识。 充分利用探索性研究利器 在国家药品抽检过程中,探索性研究可为进一步提升药品质量水平、加强药品监管提供技术支持。在多年技术储备的基础上,2023年各药品检验机构充分利用探索性研究这一监管利器,全面考察药品质量的稳定性、现行标准的完善性,同时探寻可能存在的潜在风险,为提升药品质量标准、提高监督管理水平提供科学可靠的技术支撑。 2023年国家药品抽检探索性研究发现的主要问题有:中药制剂生产中使用伪品、中药材及饮片掺伪问题仍然存在 个别企业违法违规生产问题,如擅自改变生产工艺,低限或使用伪品、替代品投料,擅自改变或添加辅料、防腐剂、抑菌剂等 因原料药质量差异、生产工艺不稳定等原因,导致产品均一性较差 外源性有害物质超限,个别批次产品重金属、农药、真菌毒素残留量超限 包装材料相容性问题影响产品质量稳定性等。 据《年报》,对探索性研究中发现的有关生产工艺、处方、原辅料、包装材料、说明书等方面可能存在的一般性问题,药品监管部门通过“药品质量提示函”等形式反馈相关企业,提升企业的质量意识,加强企业主体责任的落实。相关企业主动采取修订内控标准、完善工艺、加强供应商审计、修订说明书等整改措施,提升产品质量水平 各省级药监局也通过多部门联席会、约谈企业、风险沟通、跟踪检查等方式,利用提示信息强化对企业的监督指导。通过寓服务于监管的风险提示,加深了监管部门、药检机构和企业之间的信任与理解,促进了持有人主体责任的落实,是主动排查、预防为主监管方式的有益探索。 记者获悉,对探索性研究发现的个别企业涉嫌存在的违法违规线索,监管部门在综合分析研判的基础上,及时对涉及企业开展了有针对性的有因检查,并根据检查结果及时采用有效的风险控制等措施。例如,今年1月,湖北省药监局根据2023年国家药品抽检探索性研究结果对武汉贝参药业股份有限公司某厂区进行了有因检查,发现该公司杏苏止咳糖浆生产质量管理存在严重缺陷2项、主要缺项3项、一般缺陷8项,不符合《药品生产质量管理规范》(2010年修订) 2月21日,湖北省药监局发布公告,依据相关法律法规,决定暂停该品种的生产、销售。 应用结果推动产业提质升级 2023年,国家药监局通过政策支持、开展专项风险监测、深入排查风险、公开信息等方式加强抽检工作,并积极运用抽检成果持续提升药品质量,推动产业提质升级,助力产业高质量发展。 为推动抽检工作更加科学,国家药监局持续加强抽检制度建设和顶层设计,于2023年印发《关于进一步做好地方药品抽检有关工作的通知》,对地方抽检工作提出更为明确且具体的要求,加强国家与地方抽检的衔接互补。同时,持续推进药品抽检制度体系优化创新,健全完善抽检工作机制和工作程序,加快推进修订《药品抽检探索性研究原则及程序》,规范指导探索性研究 修订《药品抽样原则及程序》,细化完善中药材和中药饮片取样,探索网抽购样方式方法。据悉,《药品抽检探索性研究原则及程序》即将于近日发布。 近年来,国家药品抽检每年设置不同专项,对重点品种进行专项研究。2023年,针对可能的风险点,国家药品抽检还设置溶剂残留研究、网络抽检等专项,潜在风险得到有效控制,其中溶剂残留研究的相关工作成果已被收入《国际药典》。 2023年,国家药监局依照“风险控制-依法处置-排查原因并整改-信息公开”的监管模式,确保风险关闭、警示用药安全,严厉打击了制售假劣药品的行为,发挥震慑不法企业、净化市场环境的作用。此外,国家药监局在2023年共发布药品补充检验方法4个,为打击隐蔽性极强的掺杂掺假等违法行为提供了监管利器,也为企业提供了保障药品质量安全的科学依据。 2023年,国家药监局共发布药品抽检通告7期,对全部不符合规定药品及涉及企业依法公开,震慑不法企业、警示安全用药。中检院在官方网站持续公开国家药品抽检的探索性研究结果,新发布39个品种的新建检验方法,累计发布新建检验方法601个。通过信息的共享利用,进一步促进药品上市许可持有人及相关生产经营企业的质量安全意识和主体责任自律意识,增强药品质量风险控制能力,促进产品研发创新升级。[size=14px][color=#707d8a][ 来源:中国食品药品网 ][/color][/size][size=14px][color=#707d8a][i]编辑:张圣斌[/i][/color][/size]
1.对物理、化学、生物中的易燃、易爆、强酸、强碱和剧毒等危险药品必须贮藏在危险化学药品专用室、柜内,并按各自的危险特性,分类存放,不得和普通试剂混存或随意乱放。2.危险化学药品室、柜,必须有专人管理。管理人员要有高度的责任感,懂得各种化学药品的危险特性,具有一定的防护知识,并实行双人双锁管理,实行双人领发、双人使用。3.危险化学药品室内严禁烟火,要配备相应的消防设施,如灭火器、消防桶、河沙等,学校主管领导和专管人员要定期检查,节假日安排值班时,要把危险化学药品室列为重点防范区。4.定期对危险化学药品的包装、标签、状态进行认真检查,并核对库存量,做到帐卡物相符。5.使用危险化学药品进行实验前,必须向学生提出遵守安全操作规程的要求。教师领用危险化学药品时,必须提前计算用量,必须办理领取手续,由专管人员和教师送取,不得让学生代为领取。6.对实验中危险品的遗弃及废液、废渣要及时收集,妥善处理,不得在实验室存留,更不可随意倒入下水道。7.危险化学药品的管理和使用方面如出现问题,除采取措施迅速排除外,必须及时向学校领导如实报告,并协助有关部门进行处理。
越来越多的事实证明,[U][B]单一依靠药品标准不足以作为药品质量合格的判断[/B][/U],[color=#DC143C]首先是因为国家药品标准只是作出判断的必要条件,而不是充分必要条件;其次作出判断往往是依据药品检验报告,但仅凭此而作出药品合格的结论也缺乏可靠性。[/color][color=#00008B][U][B]因此,药品生产企业应该对所生产的药品质量负责。[/B][/U][/color] 国家药品标准是作为衡量药品质量的尺度和判断是否违法的标准,但是越来越多的事实证明,单一依靠药品标准不足以作出以上判断,首先是因为国家药品标准只是作出判断的必要条件,而不是充分必要条件,其次作出判断往往是依据药品检验报告,但由于国家药品标准不可能将所有物质作出检验的规定,而只是保证药品安全、有效前提下,在必要、可能的范围进行选择的结果。所以,仅仅以药品检验报告为基础,作出药品合格的结论缺乏可靠性,已经有若干因药品质量发生的人身损害案件,但以执行的国家药品标准检验来看却是合格的。 [color=#DC143C][B]国家药品标准的定义究竟是什么?[/B][/color]在先的一些文章和教材、专著中多解释为药品生产、检验的法定依据,甚至还有解释为药品检验法定依据之说。尽管说法之多,但可能在作出这些解释时,并没有全面研究过国标以及药品标准在药品生产、经营、使用和管理中的作用。国家药品标准实际上应该是药品来源(如中药材)、药品生产(如中成药、生物制品)、药品检验、药品经营(如贮藏条件)、药品使用(如类别、功能主治、适应症、用法用量、注意事项、禁忌等)的规范。这些规范或来源于药品研究(如新药);或来源于对上市后药品的再评价;或来源于经验的总结(如中药)。依提出国家药品标准主体的不同,分为药品生产企业(新药)和国家药品监督管理部门,依权利的不同分为依申请(新药、仿制药、药品注册补充申请),依职权颁布(《中国药典》等),依强制程度不同分为国家药品标准和企业药品标准(部分项目高于国家药品标准,或者在国家药品标准基础上增加有关检测项目仅在本企业内部执行,或者和相对人约定执行的药品标准)。不言而喻,国家药品标准具有国家强制力,必须遵守和执行,而企业标准可以依约定在执行国家药品标准的基础上,由相对人遵守和执行。 制定国家药品标准的基础,是基于药品注册申请人的研究资料和国家对于药品上市的基本要求,或者是允许已上市药品继续生产、使用的基本规定。因此,凡是在研究申报资料基础上,生产工艺、原料、辅料、包装材料、关键人员等基础发生变化时,其药品标准相关项目则可能发生变化,此时,单以检验项目是否合格作为判断药品质量的依据时则可能出现误判。仅以检验结果作为药品质量评价指标则可能出现错误,换句话讲,检验合格不等于药品合格。因此,在一定意义上,国家药品标准是有限标准,有前提的标准。但是,检验不合格药品却是可以作出不合格的结论,检验的主要意义就在于此。要准确地评价药品质量,应该是结合标准的检验结果、GMP、GCP等规范执行情况的评价,才可能综合得出药品质量的正确结论,因此,应该对公布药品抽验合格率的必要性进行研究。 药品生产企业应该对所生产的药品质量负责,而不能仅仅是依国家药品标准检验合格作为上市的标准。长期以来,人们相信药品质量是生产出来的,而不是检验出来的,这种观点反映出对生产管理的重视。但更为全面的质量观点应该是药品质量始于药品的研究和生产设计,因为有缺陷的设计和研究,即使再规范的生产管理,仍然是有缺陷的药品,或称为不合格的药品,因此,引入了广义的合格药品应该是符合安全、有效要求的药品是合格药品的概念。在《民法通则》、《产品质量法》、《侵权责任法(草案)》等均将设计或者研究缺陷纳入产品缺陷范畴。因此,在修订《药品管理法》时应该将药品的设计缺陷作为研究的内容之一,比如隐瞒研究中的不利结果,违反科学研究规范,错误地得出或者捏造有利于上市的数据而获得药品上市许可,如果药品上市以后发生人身伤害事故,应当承担侵权责任,这种责任延续至药品上市以后药品生产者待遇履行药品的再评价义务,而药品的再评价包括了质量、安全性和有效性。当然要求药品生产企业履行这些义务,必须从法律上授予权利加以保证,解决目前药品生产企业难以收集医疗机构使用所生产品种的安全性和疗效的数据问题,而医疗机构必须履行提供相关资料的义务。
国家食药监管总局即日起至12月5号就《药品飞行检查办法(征求意见稿)》公开征求意见,药品飞行检查覆盖面大幅拓宽,药品监督管理将进一步规范和加强。此规定,将药品的飞行检查纳入整个药品监管的日常检查中,可以使我国的药品监管能力和水平进一步成熟、提高。 据中国之声《全国新闻联播》消息,国家食药监管总局即日起至12月5号就《药品飞行检查办法(征求意见稿)》公开征求意见, 药品飞行检查覆盖面大幅拓宽,药品监督管理将进一步规范和加强。 药品飞行检查 药品监管 药品质量 所谓“药品飞行检查”,是药品监督管理部门针对药品生产、经营等环节开展的不预先告知的突击检查或者暗访调查。在《药品飞行检查办法(征求意见稿)》之前,原国家食品药品监督管理局2006年《关于印发药品GMP飞行检查暂行规定的通知》是目前药监部门执法检查的主要依据。中国药学会医药政策研究中心执行主任宋瑞霖介绍,两者相比,征求意见稿的覆盖范围大大拓宽。 宋瑞霖:GMP是指导制药企业、保证药品质量的重要规范。我们从原料进料到生产全过程,GMP包括了最核心点,但它不是药品生产的全部。现在我们把GMP检查改成药品飞行检查,把它扩展到整个药品质量的控制体系中来了。 征求意见稿规定,被检查单位及有关人员应当及时按照检查组要求,提供真实、有效的记录、票据、凭证等相关材料,开放相关计算机管理系统,不得拒绝和隐瞒。不配合或者阻挠检查、拒绝提供或者提供虚假材料、故意隐瞒违法违规生产经营行为,其违法违规事实一经查实,按情节严重情形从重处罚。宋瑞霖表示,尽管相比当前的药品飞行检查规定,征求意见稿并没有作出大幅更改,但规范飞行检查、强化药品监管是大势所趋。 宋瑞霖:最大的区别是把药品的飞行检查纳入整个药品监管的日常检查中,我们的药品监管能力和水平进一步成熟、提高。
[font=SimSun, STSong, &]新鲜采摘的全株草药(药材)是否属于药品范畴?有依据吗?《药典》里面的基本上都是干品,没有鲜品的表述,那么鲜品到底属不属于药品呢?食品添加鲜品药材是否属于食品加药?[/font]
国家药监局发布通知,要求化妆品电子商务平台经营者于2019年5月同步上线化妆品消费提示语“国家药监局提示您:请正确认识化妆品功效,化妆品不能替代药品,不能治疗皮肤病等疾病”,提醒广大消费者防范化妆品消费风险。国家药监局要求,各省(区、市)药品监管部门要高度重视化妆品“线上净网线下清源”风险排查处置工作,明确专人负责,加强对风险排查处置工作进展情况的监督检查,有针对性地开展化妆品网络抽检,发现违法行为,依法予以查处。对未按照要求开展风险排查处置工作的化妆品网络销售者和化妆品电子商务平台经营者将作为重点监管对象,加大监督检查和抽检力度,必要时约谈其法定代表人或者主要负责人,对发现的违法行为,依法从严查处。同时,各省(区、市)药品监管部门要对风险排查处置工作进展情况进行总结和分析,梳理存在的问题并提出工作建议,填写风险排查处置工作表,并于2019年8月31日前将风险排查处置工作总结报国家药监局化妆品监管司。工作中如有重大事项,应当及时报告。
新修订的《药品注册管理办法》(以下简称新《办法》)将于2007年10月1日起施行。为做好新《办法》的贯彻实施,保证新旧《办法》的顺利过渡和衔接,国家食品药品监督管理局将有关事宜通知如下: 各省、自治区、直辖市食品药品监督管理局要认真学习宣传和贯彻新《办法》及其相关规定,统一思想,提高认识,落实药品注册监管措施,切实保证药品的安全、有效和质量可控,维护公众健康。 2007年10月1日前已经取得《药物临床试验批件》的品种,其临床试验按照原《药品注册管理办法》关于临床试验的要求和《药物临床试验批件》的内容进行。临床试验结束后按照新《办法》的规定申报生产。 2007年10月1日前受理的申请生产的治疗类大容量化药注射剂、中药注射剂、多组分生化注射剂等高风险品种,国家食品药品监督管理局药品审评中心已经完成技术审评送达药品注册司的,由药品注册司通知申请人申请生产现场检查,并告知国家食品药品监督管理局药品认证管理中心。申请人自收到生产现场检查通知之日起6个月内向国家食品药品监督管理局药品认证管理中心提出生产现场检查的申请,国家食品药品监督管理局药品认证管理中心在收到生产现场检查的申请后,组织对样品批量生产过程等进行现场检查,确认核定的生产工艺的可行性,同时抽取1批药品,送负责该药品标准复核的药品检验所检验。 2007年10月1日前受理的申请生产的治疗类大容量化药注射剂、中药注射剂、多组分生化注射剂等高风险品种,国家食品药品监督管理局药品审评中心尚未完成技术审评的,由国家食品药品监督管理局药品审评中心按照新《办法》的要求通知申请人申请生产现场检查。上述品种的检验费用由国家食品药品监督管理局统一支付。国家食品药品监督管理局根据生产现场检查和药品抽验结果决定是否发给药品批准文号。 生物制品注册申请的生产现场检查,由国家食品药品监督管理局组织对生产工艺的可行性进行核查。 2007年10月1日前受理的申请生产的对除治疗类大容量化药注射剂、中药注射剂、多组分生化注射剂和生物制品之外的其他注册申请,在通过技术审评后,发给药品批准文号,由各省(区、市)局组织开展生产现场检查和首批产品的抽验工作,检验合格后方可上市销售。首批产品的抽验可结合各省(区、市)年度药品抽验计划一并进行,具体工作程序和要求由各省(区、市)局自行制定。 2007年10月1日起,根据新《办法》获得生产批准的品种,其药品标准即为正式标准。此前已批准的药品试行标准,仍按照原《药品注册管理办法》关于药品试行标准转正的程序和要求,申报和办理药品试行标准转正。 按照药品管理的体外诊断试剂的注册,遵照国家食品药品监督管理局《体外诊断试剂注册管理办法(试行)》的规定和相关技术要求执行。 国家食品药品监督管理局已发布的药品注册各类规范性文件,新《办法》已有规定的,按照新的规定执行,其原规定同时废止;新《办法》没有规定的,其他规范性文件的相关规定继续有效。 对新《办法》实施中遇到的问题,请各地通过国家食品药品监督管理局网站《28号局令执行专栏》及时反馈。(2007.09.28)---转自国家食品药品监督管理局
[size=14px]1、没有合格供应商名录,耗品质量无保障。[/size][size=14px][/size][size=14px]2、剧毒药品未实现双人双锁和使用跟踪监督制度,有剧毒药品外泄风险。[/size][size=14px][/size][size=14px]3、易制毒药品未实现双人双锁,有易制毒药品外泄风险。[/size][size=14px][/size][size=14px]4、试剂药品无领用登陆记录,试剂药品管理不到位。[/size][size=14px][/size][size=14px]5、试剂贮存与操作间同室,对检验员健康有害。[/size][size=14px][/size][size=14px]6、试剂瓶标识信息不足,试剂过期失效不掌控。[/size][size=14px][/size][size=14px]7、标准试剂配制时未在恒温恒湿条件下进行,量具热涨冷缩,标准溶液无法配准。[/size][size=14px][/size][size=14px]8、批量采购或用量大试剂未再检验验证,试剂不合格会造成巨大损失。[/size][size=14px][/size][size=14px]9、耗材质量无风险分析评估,耗材质量不合格会造成巨大损失。[/size][size=14px][/size][size=14px]10、试剂没分类贮存,有交叉污染风险;试剂室或试剂柜无强排设施,对操作员健康有害。[/size]
[size=14px]1、没有合格供应商名录,耗品质量无保障。[/size][size=14px][/size][size=14px]2、剧毒药品未实现双人双锁和使用跟踪监督制度,有剧毒药品外泄风险。[/size][size=14px][/size][size=14px]3、易制毒药品未实现双人双锁,有易制毒药品外泄风险。[/size][size=14px][/size][size=14px]4、试剂药品无领用登陆记录,试剂药品管理不到位。[/size][size=14px][/size][size=14px]5、试剂贮存与操作间同室,对检验员健康有害。[/size][size=14px][/size][size=14px]6、试剂瓶标识信息不足,试剂过期失效不掌控。[/size][size=14px][/size][size=14px]7、标准试剂配制时未在恒温恒湿条件下进行,量具热涨冷缩,标准溶液无法配准。[/size][size=14px][/size][size=14px]8、批量采购或用量大试剂未再检验验证,试剂不合格会造成巨大损失。[/size][size=14px][/size][size=14px]9、耗材质量无风险分析评估,耗材质量不合格会造成巨大损失。[/size][size=14px][/size][size=14px]10、试剂没分类贮存,有交叉污染风险;试剂室或试剂柜无强排设施,对操作员健康有害。[/size]
1、没有合格供应商名录,耗品质量无保障。2、剧毒药品未实现双人双锁和使用跟踪监督制度,有剧毒药品外泄风险。3、易制毒药品未实现双人双锁,有易制毒药品外泄风险。4、试剂药品无领用登陆记录,试剂药品管理不到位。5、试剂贮存与操作间同室,对检验员健康有害。6、试剂瓶标识信息不足,试剂过期失效不掌控。7、标准试剂配制时未在恒温恒湿条件下进行,量具热涨冷缩,标准溶液无法配准。8、批量采购或用量大试剂未再检验验证,试剂不合格会造成巨大损失。9、耗材质量无风险分析评估,耗材质量不合格会造成巨大损失。10、试剂没分类贮存,有交叉污染风险;试剂室或试剂柜无强排设施,对操作员健康有害。
3月28日,国家食品药品监管总局和公安部联合召开新闻发布会,公布了2013年查处的食品药品违法犯罪案件中案情复杂、涉案金额较高、社会影响恶劣、具有警示作用的“食品药品十大典型案例”. 食品药品十大典型案例 河南民权“5.24”特大病死肉案 2013年9月,在公安部统一协调指挥下,河南、云南等地公安机关成功侦破特大生产、销售病死肉系列案件,抓获犯罪嫌疑人105名,查扣病死牛马肉80余吨,摧毁一跨7省区犯罪网络,查明2008年以来云南昭通、曲靖等地犯罪嫌疑人从当地农户收购病死、死因不明的牛、马、驴,屠宰加工、贩运到省内外农贸市场、熟食摊点等,案值9000余万元。 湖北武汉闵某某等生猪非法注射沙丁胺醇案 2013年6月,湖北武汉公安机关侦破一起特大给生猪注射沙丁胺醇案,一举打掉以闵某某为首的犯罪团伙,端掉6个“黑窝点”,查获有毒有害生猪525头及注射器、沙丁胺醇药水等作案工具,抓获涉案人员38人。经查,2012年下半年以来,闵某某犯罪团伙在武汉城乡结合部控制6个屠宰点屠宰生猪,并向生猪注射沙丁胺醇。该犯罪团伙直接经营其中一个窝点,并负责向另外5个无证屠宰点供应生猪,销售“沙丁胺醇”注射剂,按每头猪40元的标准收取“保护费”,案值3000余万元。 陕西西安李某等涉嫌生产、销售假牛肉案 2013年9月,根据群众举报线索,在食品药品监管部门配合下,陕西省西安市公安机关成功侦破一起特大生产、销售假牛肉案,抓获嫌疑人45名,捣毁“黑窝点”6个,当场收缴成品、半成品假牛肉17.5吨,案值6000余万元。 山东枣庄盖某等涉嫌生产、销售不符合安全标准的食品案 2013年6月,根据当地监管部门移送线索,山东省枣庄市公安机关成功侦破一起生产、销售不符合安全标准的食品案,抓获犯罪嫌疑人18人,现场查获未经检疫牛肉制品54吨,查明盖某等人通过非法渠道经由香港购入未经检疫的巴西牛肉制品,再通过物流公司运输至山东等多地,案值1400余万元。 辽宁本溪徐某等涉嫌生产、销售伪劣保健食品、药品案 2013年3月,在食品药品监管部门配合下,辽宁省本溪市公安机关成功侦破徐某等生产、销售伪劣保健食品、药品案件,抓获犯罪嫌疑人52名,缴获生产设备2套、原材料胶囊200余万板、包装物60余万套、生物降压素牌双参胶囊等20种伪劣保健食品、药品20余万盒,捣毁生产、加工、储存、销售黑窝点11处,案值2000余万元。 江苏沛县蒋某等涉嫌生产、销售伪劣保健食品案 2013年5月,根据群众举报,江苏沛县公安机关联合食品药品监管部门破获一起特大生产、销售伪劣深海鱼油案,打掉 “黑工厂”6家,抓获犯罪嫌疑人20余名,查扣假劣鱼油胶囊180万粒,查明犯罪嫌疑人蒋某从山东、江苏多家公司利用废弃深海鱼油下脚料生产伪劣鱼油250余吨,案值近1亿元。 广西柳州“5.17”生产、销售假药案 2013年5月,公安部会同国家食品药品监督管理总局统一协调指挥广西、安徽等地公安机关和食品药品监管部门,成功破获一特大生产、销售假劣人血白蛋白、人用狂犬疫苗等假药系列案,捣毁生产、销售假药黑窝点4处,抓获犯罪嫌疑人18名,案值2000余万元。 广东深圳“7.29”系列生产、销售假药案 2013年7月29日,根据前期主动梳理排查的线索,广东深圳公安机关、药监部门联合行动,捣毁销售假药窝点8个,破获案件6起,刑事拘留14人,缴获“易瑞沙”等抗癌类假药8600余盒,查明犯罪嫌疑人通过QQ视频通话的方式低价购入高价售出,通过物流寄递渠道销售假药,案值1600余万元。 湖南隆回孙某等涉嫌生产、销售假药案 2013年5月,根据食品药品监管部门移送案件,湖南省隆回县公安局成功破获孙某等生产、销售假药案,抓获犯罪嫌疑人34名,查缴假药生产线2条、制假设备6台,缴获假药6000余瓶及各类假药商标、包装盒2.8万余套,查明该团伙2007年以来生产加工“骨刺风湿宁胶囊”等假药销售至湖南、湖北、广东等16个省市区,案值1000余万元。 浙江丽水周某等涉嫌生产、销售假劣创可贴案 2013年2月,浙江省丽水市公安机关会同食品药品监管部门成功侦破周某等涉嫌生产、销售假劣创可贴案件,抓获犯罪嫌疑人13名,捣毁生产、销售假劣创可贴的“黑窝点”2个,查明销售假劣云南白药牌、邦迪牌、恒健牌创可贴7700余万片,案值1600余万元。
中国人寿总裁杨超委员说,必须加快建立我国食品药品安全责任保险制度,切实保护消费者权益。推行食品药品安全责任保险,保险公司在第一时间进行赔付,可以使受害人群及时得到赔偿获得救治;不仅有助事故企业维持正常经营,保险公司还会在投保期间对企业进行风险排查。应当争取通过立法形式,建立强制性的食品药品安全责任保险制度,利用财政、税收等手段,对参与责任保险的保险企业、投保企业和保险中介提供政策支持,降低其参与责任保险的成本。
此EXCEL表格是武汉市药品检验所周元姚所长编写的,收录了中国国内绝大多数药品(不包括中药)在中国药典、卫生部药品标准、进口药品注册标准、英国药典、美国药典、日本药局方的收载情况,对大家快速检索药品标准非常有帮助。目前更新到2004年,大家如果谁有时间及条件的话可在此基础上继续更新。[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=9138]国内外药品标准检索表[/url]
[font=&]1. 对于实验室领用后暂时不用的危险化学品应存放于固定存放点;[/font][font=&]2. 保证与禁忌物分开存放并保证与“避免接触的条件”不接触;[/font][font=&]3. 并做好防挥发、防泄露、防火等安全措施;[/font][font=&]4. 有毒的化学品,要由专人负责保管,对药品的使用及领取作详细记录;[/font][font=&]5. 使用腐蚀性化学品时要注意个人的防护;[/font][font=&]6. 禁止口尝、直接鼻嗅、手直接接触的方法鉴别化学药品或危险物质。[/font][font=&]7. 用移液管、吸管吸取有毒或腐蚀性液体时,严禁用嘴直接吸。[/font][font=&]8. 药品在器皿中加热时,必须放置平稳,瓶口或管口禁止对着人;在移动沸腾的液体时,应放置在隔热石棉网上,轻拿轻放。[/font][font=&]9. 不能把浓酸、浓碱气化剂和有机物质放在一起,否则会引起爆炸和燃烧。[/font][font=&]10. 使用易燃易爆化学品时,应在通风橱内进行,远离热源、火源,在使用过程中需要加热挥发,须采用水浴加热,严禁用明火,并在通风橱内进行(电源开关、电源插头等须在通风橱外)。[/font][font=&]11. 对于无标签或掉标签的药品需要经过鉴定,贴上标签后方可使用,无法鉴定的药品和试剂按危险物处理,严禁使用不明内容物的药品。[/font][font=&]12. 使用药品时,药品瓶应轻拿轻放,避免碰撞以致打碎药瓶。[/font]
包括俏妹牌减肥胶囊、欣力美牌减肥片在内的7种产品,近日在卫生部保健品专项抽查中被检测出含化学药品。目前,它们已被紧急叫停。据了解,此次被叫停的7种“保健品”多为减肥药品,分别被检测出含有西布曲明、酚酞、盐酸苯乙双胍、格列本脲、盐酸吡格列酮等化学成分。其中,西布曲明属于违禁成分,食用后对人体血压、肝功能方面副作用较大。国家食品药品监督管理局于2010年10月叫停了所有西布曲明制剂及原料药品,本次公布的假冒产品中,4种减肥药品均含有西布曲明。河南省药监局提醒消费者不要购买上述产品,一经发现违法产品,及时向当地食品药品监督管理部门举报。同时,消费者也可以登录国家食品药品监督管理局官方网站查询保健食品的许可信息。据了解,这七种“保健品”为:俏妹牌减肥胶囊(包装上或标有蔬果减肥或标有清脂三天瘦或标有靶向减肥丸或标有蜂蜜苹果醋瘦身胶囊)、辅美牌洋参芪杞胶囊(干细胞活胰肽)、唐乐胶囊、欣力美牌减肥片(包装上标有左旋肉碱嚼嚼瘦或者包装上为苹果醋减肥咀嚼片)、富昕康OB蛋白素胶囊、雪蓝奇减肥胶囊、肽盈美减肥胶囊。
SFDA发布内容:一、严格准入门槛,申报走势出现拐点 自2007年10月1日新修订的《药品注册管理办法》实施以来,我们围绕法规建设、审评审批、现场核查、注册检验、风险管理等方面加强药品注册全过程的监管,经过近两年的努力,工作取得一定成效,药品注册出现了可喜变化:申报数量大幅减少,申报质量不断提高,申报机构更加趋于理性,药品研发呈现新的局面。 [color=#DC143C]从2007年10月1日至2009年6月底,国家食品药品监督管理局共受理药品注册申请4403件,年申报数量减少2/3。其中,创新药84个、仿制药1682个。[/color] [color=#00008B]此外,新《药品注册管理办法》实施至今,同品种申报的比率也从2006年的1:6下降为今年的1:3,中药已经几乎没有重复申报现象。[/color] 从批准情况看,2009年1-6月国家食品药品监督管理局批准新药临床申请173件;新药生产申请238件,其中一类新药8件;仿制药申请1074件;进口药申请388件。 综上可见,药品注册申报总量减少,重复申报减少,质量明显提高,结构发生改变,这充分说明药品注册逐渐回归正常,药品研发日益符合国情,新的《药品注册管理办法》的实施导向正确,达到了预期目标。 二、集中技术力量,清理历史遗留问题 近年来,国家食品药品监督管理局不断深化审评审批制度改革,形成了完备的法律法规及部门规章构成的制度体系,设置了合理的审评程序,建立了权威的专家技术资源,实现了依法科学审评审批,彻底扭转药品审评审批工作的被动局面,从源头上提升了药品安全的保障水平。 为解决药品注册管理工作存在的突出问题,国家食品药品监督管理局按照国务院的部署积极稳妥地开展了药品研制环节的专项整治工作。[color=#DC143C]通过对3.3万个药品开展注册现场核查撤回了7999个药品注册申请;通过开展药品批准文号清查注销了4337个批准文号;通过开展过渡期品种集中审评处理了2.5万积压品种,其中不批准1.5万个品种(大多为化学药5/6类、中药8/9类),不批准率达61%,[/color]这些卓有成效的工作,较大程度上规范了药品注册秩序,净化了药品研发环境,卸下了历史包袱,也为新《药品注册管理办法》的实施扫清了障碍,奠定了基础。 三、采取多项政策措施,鼓励药品研发创新 为规范药品技术转让注册行为,保证药品安全、有效和质量可控,根据《药品注册管理办法》的有关规定,[U]近日,国家食品药品监督管理局发布实施了《药品技术转让注册册管理规定》。它是继《中药注册管理补充规定》、《药品注册现场核查管理规定》、《新药注册特殊审批管理规定》之后发布的第四个配套文件,自此,以《药品注册管理办法》为核心的我国药品注册管理法规体系初步形成,[/U]我国药品注册进入了一个鼓励创新、引导创新的时代。 鼓励创新、引导创新,这在多个法规文件中都有体现并且相互配合形成合力,首先,新修订的《药品注册管理办法》严格了新药证书的发放范围,进一步提高了新药证书的含金量。其次,在《新药注册特殊审批管理规定》中通过采取早期介入、优先审评、多渠道交流沟通、动态补充资料等措施鼓励、支持创新药物研发。第三,《药品注册现场核查管理规定》规定了严格的注册现场核查和检查要求,保证了申报资料的真实性,维护了注册审批的公正性和严肃性,使各项鼓励创新政策能够真正落到实处。第四,在《中药注册管理补充规定》中为鼓励中药新药在新功能主治领域的研发,还对“治疗尚无有效治疗手段的疾病的新药”增加内涵,将“主治病证未在国家批准的中成药【功能主治】中收载的新药”,纳入特殊审批的范围,充分发挥中药在疑难杂症和新出现疾病方面的治疗作用。并采取具体措施拓宽中药复方制剂的组方内涵,鼓励中药创新和发展。 《药品技术转让注册管理规定》出台后,对进一步鼓励创新,促进资源合理配置发挥重要作用。 一是有效控制批准文号数量。[U]技术转让批准后,原来已经取得的批准文号同时注销,避免了一家转多家,[/U]引导药品生产企业减少简单改变剂型和仿制药品的申报数量,从根本上解决低水平重复问题。 二是促进专业化程度提高。药品技术转让新政策的确立,有利于企业间或者企业内部改变产品结构,合理分配和调整生产资源,实现优势产品重组和重点发展,减少低水平重复和同质化。随着产品生产的专业化程度的提高,围绕产品专业化生产和监管水平将会得到促进,推进以产品为核心的CGMP实施,进一步保证产品质量。 三是利用技术手段,提高技术门槛,加强风险控制。《[U]规定》对新药技术转让和生产技术转让所要求的技术资料,基本参照仿制药的要求,作了大幅度增加,并强调了转让前后的技术比较。[/U]增加了技术审评程序,参照改变产地的基本技术特点,相对于仿制药品的审评提高了技术审评的可对比性和可评价性。对经审评需要进行临床试验或者生物等效性试验的,还要完成规定的试验,[U]彻底改变了过去新药技术转让无需进行技术审评和临床试验的状况,[/U]极大提高了技术要求。《规定》还设置了“不予批准情形”:对于经国家食品药品监督管理局确认存在安全性问题的药品,其技术转让注册申请不予受理,已经受理的不予批准,从而进一步加强了风险控制。 四是品种管理由“静态”转变为“动态”。据了解,[color=#00008B]目前许多药品生产企业超过一半以上的批准文号闲置,常年生产的品种占企业总批准文号的比例不到四分之一。一方面大量批准文号闲置,另一方面仍然有大量药品生产企业申请新注册批准文号。[/color]批准文号闲置造成的生产技术闲置不仅仅是社会资源的浪费,而且对药品生产监管、上市药品的再评价和不良反应监测都非常不利。高质量的药品监管必须建立在药品正常生产和正常销售使用的基础上,也即动态基础上。药品技术转让,特别是生产技术转让,可以使本企业不使用的药品生产技术转让到其他需要该品种的企业,有利于产品资源的优化组合,有利于医药行业的健康发展。 国家食品药品监督管理局出台这个规定,就是要让技术作为一种产品,在市场上有序流通起来,鼓励一些技术有条件向外部转让。允许新药、上市多年药品、进口药品在一定条件下进行技术转让,鼓励先进科研成果和成熟生产技术的应用和推广,让国外的先进生产技术落户国内;有利于发挥市场配置资源的作用,有利于产品和资源优势重组,做大做强医药产业。
为加强化妆品监管,切实保障公众健康安全,食品药品监管总局近期组织对部分化妆品开展监督抽检,发现标示为“纤回堂http://www.sda.gov.cn/directory/web/WS01/images/1413163233290.jpg强力特效祛斑套装”等8批产品不符合规定(见附件)。 食品药品监管总局要求,地方各级食品药品监管部门要切实加强生产经营监管,督促行政区域内化妆品生产经营者(含网售)立即对通报的不合格产品一律下架并停止销售。各地要加强对化妆品生产企业的检查,督促其查找原因,认真整改,消除风险,整改不到位的不得恢复生产,发现存在违法行为的,要依法严厉查处。各地要深查深究,追查制售假冒伪劣化妆品的黑窝点,严厉打击违法违规行为,涉嫌犯罪的,一律移交公安部门查处,切实保障消费者化妆品使用安全。 食品药品监管总局提醒广大消费者,应通过正规渠道购买化妆品,索取并保留相关单据。如发现被通报的不合格产品仍在销售的,请及时进行投诉举报。举报电话:12331。
[color=#888888][/color][align=center][color=#ffffff]危化品的检查、[/color][/align][color=#888888][b]1.[/b]对于实验室领用后暂时不用的危险化学品应存[b]放于固定存放点[/b];[/color][color=#888888][b]2.[/b]保证[b]与禁忌物分开[/b]存放并保证与“避免接触的条件”不接触;[/color][color=#888888][b]3.[/b]并做好[b]防挥发、防泄露、防火[/b]等安全措施;[/color][color=#888888][b]4.有毒的化学品,要由专人[/b]负责保管,对药品的使用及领取作详细记录;[/color][color=#888888][b]5.[/b]使用[b]腐蚀性化学品[/b]时要注意个人的防护;[/color][color=#888888][b]6.禁止口尝、直接鼻嗅、手直接接触[/b]的方法鉴别化学药品或危险物质。[/color][color=#888888][b]7.[/b]用移液管、吸管吸取有毒或腐蚀性液体时,[b]严禁用嘴直接吸[/b]。[/color][color=#888888][b]8.[/b]药品在器皿中加热时,必须[b]放置平稳,瓶口或管口禁止对着人[/b];在移动沸腾的液体时,应放置在隔热石棉网上,轻拿轻放。[/color][color=#888888][b]9.不能把浓酸、浓碱气化剂和有机物质放在一起[/b],否则会引起爆炸和燃烧。[/color][color=#888888][b]10.[/b]使用易燃易爆化学品时,应[b]在通风橱内进行,远离热源、火源[/b],在使用过程中需要加热挥发,须采用[b]水浴加热,严禁用明火[/b],并在通风橱内进行(电源开关、电源插头等须在通风橱外)。[/color][color=#888888][b]11.[/b]对于无标签或掉标签的药品需要经过鉴定,贴上标签后方可使用,[b]无法鉴定的药品和试剂按危险物处理,严禁使用不明内容物的药品。[/b][/color][color=#888888][b]12.[/b]使用药品时,药品瓶[b]应轻拿轻放,避免碰撞[/b]以致打碎药瓶。[/color][color=#888888][/color][color=#888888][/color]
近日,国家食品药品监督管理局发出通知,要求对未经注册,借虚假机构或盗用合法药品生产企业的名义,违法宣传销售具有治疗糖尿病等疾病药品特征的产品“蜂蚁健骨素”、“特供叁号”和“糖瑞平胰活胶囊”进行查处。 “蜂蚁健骨素”(麝香风湿胶囊)标示企业名称:浙江天一堂药业有限公司(该产品系盗用合法药品生产企业“浙江天一堂药业有限公司”及其产品的名义);“特供叁号”标示企业名称:中国人民解放军老干部局糖尿病中心 “糖瑞平胰活胶囊”标示企业名称:中国人民解放军总后勤部。 国家食品药品监督管理局要求各地依法加强药品市场监督检查,发现上述产品,依法严肃查处;涉嫌刑事犯罪的,按照“最高人民法院、最高人民检察院关于办理生产、销售假药、劣药刑事案件具体应用法律若干问题的解释”移送公安机关追究刑事责任。 国家食品药品监督管理局提醒消费者应通过正规渠道购买药品并在医师或药师的指导下使用。
2006年3月15日,国家食品药品监督管理局公布《药品说明书和标签管理规定》(以下简称24号令),此后,针对企业更换说明书和标签的实际情况,又陆续下发了相关配套文件,对24号令进行了更加具体明确的阐释,同时规定了过渡期政策。目前,24号令即将进入全面施行阶段,为了进一步加强24号令的实施及监督管理,保证药品生产、流通等各环节平稳、有序地完成标签和说明书的更换工作,日前,国家食品药品监督管理局印发《关于加强实施工作的通知》(以下简称《通知》),就相关事宜做出明确。 按照《关于〈药品说明书和标签管理规定〉有关事宜的公告》要求,自2007年6月1日起生产出厂(以生产日期为准)的所有药品,其说明书和标签都应当符合24号令的要求。由于技术原因,有的企业申报较晚,省级药品监管部门还未完成审核。鉴此特规定,药品生产企业已于2007年6月1日前向省级药品监管部门提出修改药品说明书和标签的补充申请,省级药品监管部门尚未完成审核的,各审核部门应当抓紧时间,集中审核,并于2007年7月1日以前审核完毕。[color=blue]药品生产企业于2007年6月1日前向省级药品监管部门提出修改药品说明书和标签的补充申请,2007年10月1日前其生产出厂的药品可以继续使用原标签和说明书。药品生产企业于2007年6月1日前未向省级药品监管部门提出修改药品说明书和标签补充申请的,自2007年6月1日起出厂的药品不得使用原标签和说明书。[/color] 地方各级药品监管部门在贯彻执行24号令的过程中,应当严格依法行政,引导和督促企业自觉遵守24号令,发现涉嫌违法的行为,应当及时与药品生产企业所在地省级药品监管部门沟通(属于进口药品的,应当及时与国家食品药品监督管理局沟通),以审核备案后的说明书和标签为依据,及时纠正违法行为。 按照《药品管理法》第五十四条的规定,药品包装必须按照规定印有或者贴有标签并附有说明书。24号令对药品包装标签做出进一步明确的规定,其中第三条有关药品说明书和标签应经核准的规定,第二十四条有关药品名称的规定,第二十七条有关药品商标的规定,目的是要加强药品说明书和标签的管理,重在强调药品说明书、通用名、商品名应当严格按照药品管理法律法规规定的程序进行审批,药品说明书和标签中的任何文字、标识等信息都不得扩大或者暗示药品疗效、误导消费者,并着力解决“一药多名”产生的负面影响。各级药品监管部门要依法加强对药品说明书和标签的审查和监督管理,药品说明书和标签未经药品监管部门审批,一律不得使用。对未经批准使用标签和说明书、擅自增加适应症或者功能主治等严重违反《行政许可法》、《药品管理法》、《药品管理法实施条例》及24号令规定的行为依法进行查处。(2007.06.01)
美国药品风险管理简介[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=167256]美国药品风险管理简介[/url]