帕潘立酮是一种用于治疗精神疾病的药物,主要用于治疗精神分裂症和双相障碍等病症。在药品生产过程中,可能会产生一些杂质,这些杂质可能源自原料药合成步骤中的副反应、储存条件不当或者是制剂过程中的污染等。帕潘立酮的杂质主要包括以下两种:1. 帕潘立酮杂质H 或称帕潘立酮Z-肟(Paliperidone Z-Oxime),CAS号为1388021-47-3,这是帕潘立酮的一个已知工艺杂质或降解产物,需要在质量控制过程中严格监控,确保药品符合安全和质量标准。2. 另一种提及的杂质是6'7'8'9-脱氢帕潘立酮盐酸盐(6,7,8,9-Dehydro Paliperidone Hydrochloride),这是一种帕潘立酮的代谢产物或降解产物,分子式为C23H23FN4O3.2 HCl,分子量为422.46,CAS号为170359-61-2。杂质的存在可能会影响药物的安全性和有效性,因此在药品生产和质控阶段,药企会通过严格的检测方法对杂质进行定量和定性分析,确保药品质量达标。对于患者而言,使用杂质含量低、纯度高的药品有助于减少不良反应的发生风险。[font=-apple-system, BlinkMacSystemFont, &][back=#fdfdfe]CATO标准品提供[font=-apple-system, BlinkMacSystemFont, &]帕潘立酮杂质的研究,需要采用先进的分离技术和检测手段来检测和鉴定杂质的种类和含量。同时,也需要加强生产过程中的管理和监督,确保产品质量和安全。[/font][/back][/font]
[center]专科药企猛攻儿童药品 儿童用药市场潜力巨大[/center] 随着医药产业细分化趋势的日益明显,儿童药市场巨大的潜力正吸引众多的医药企业在此精耕细作。 近日,山东淄博新达制药有限公司正式宣布将专注于儿童药领域发展。该公司负责人透露,目前医药竞争日趋激烈,正面临新一轮洗牌,对于一些中小型制药企业而言,必须明确自己的优势领域。这是继唐山太阳石药业后,又一家表示专注于儿童药物领域的国内制药企业。目前,新达制药已经开发出新达罗颗粒、普菲特颗粒剂等系列儿童用药品牌。 凯文金企业管理顾问有限公司总经理侯大昆分析认为,中国制药企业市场集中度日益提高,制药企业向规模化和专业化两大趋势发展明显。 据记者了解,近两年,越来越多的专科药企取得了不俗的业绩,比如在肝药领域精耕细作的正大天晴,在肿瘤药领域颇有建树的江苏恒瑞,在中枢神经领域有大作为的徐州恩华等,都是新一代药企崛起的标志性企业。 成新蓝海 据悉,近年来,血脂异常、高血压、肥胖症、糖尿病、冠心病等成年人常见病至今已从不少儿童身上被发现。感冒、发烧、食积、腹泻、盗汗等儿童常见多发病更是时时威胁儿童健康,就诊率也一直相对较高。再加上一些原本不易发生在儿童身上的疾病却快速进入人们视野,同时由于儿童免疫力低导致某些预防和治疗儿童传染病的药物,继续推动儿童用药市场向高速增长迈进。我国现有儿童3.6亿,可以预见,国内儿童用药市场潜力巨大。 新达制药市场部一位人士向记者透露,目前抗感染药、感冒和胃肠道用药在儿童药市场增长非常迅速,该公司专门开发的儿童装新达罗颗粒剂销量已突破3亿袋,成为公司主力品种。 资料显示,在0~14岁儿童患病率中,呼吸系统、传染病和消化系统疾病居前3位,因此,全身抗感染类药物约占40%,而在儿童医院略高,约占50%。这与儿童呼吸系统疾病多和感染性疾病有关,也与传统用药习惯有关。此外,临床的需求特征也致使用药市场扩容。 侯大昆透露,儿童药的畅销品种主要集中在上呼吸道感染的抗生素类药品和肠道用药,除了新达制药,山西亚宝、淅川制药等也销量不俗。 品种仍需开发 对于目前的儿童药市场,有专家指出,儿童药物与成人药相比剂量小,而且多为短期服用,利润自然偏低。专家还认为,由于儿童自身的生理特点,往往使得儿童药品的开发周期较长,因此很多企业不愿意生产。其次,在临床研究上,对于儿童病症、相应的服药剂量等,没有针对性的、可供查询的资料,更是研发一大难题。 由于很多儿童用药被成人药品所替代,导致成人药品挤占儿童用药市场。儿童用药作为专科药物,仅局限于儿童,并且患病多集中于呼吸和消化系统等领域,这些药物都是按季节生产的,企业生产时经常要换品种。在生产淡季,容易造成生产能力放空,这也是导致企业不愿意生产儿童用药的主要原因。 去年12月初,WHO针对市场缺少儿童用药的情况,发起了名为“量身定制儿童药物”的倡议。国内有关专家也呼吁,医药科研、生产企业以及医疗单位,应从儿童用药的安全有效性出发,尽量减少儿童使用成人药品的做法,开发适合儿童剂量的片剂、针剂、胶囊、口服药等制剂药品;从儿童的特点出发,注意到儿童器官稚嫩的特殊性,多推出一些适合儿童特点的滴剂、散剂、膜剂、栓剂、喷雾剂等剂型。 不过,新达制药负责人则认为,相对于市场而言,上述现状对于专门生产儿童药的企业可能是一种机会。企业只要选好品种,开发出适合儿童使用的常用药,就能挤占成人药在儿童市场的份额。 侯大昆分析,企业在选择儿童药品种时应该考虑儿童用药特征,开发一些更适合儿童使用的药物。新达罗颗粒在儿童用抗生素市场近两年销量猛增,是由于头孢克洛颗粒这类抗生素对常见致病菌有良好的疗效且安全性较高,因此其在儿科市场的处方量逐步扩大。 信息来源:医药经济报
如何判断药品过期? (1)查看有效期或批号。 凡经药政机关审核批准生产和销售的药物,在原包装瓶贴上,或盒子标签上都印有生产日期或批号,还有的印有 “有效期”。可根据这些资料来判断是否过期。识读有效期的方法如下: ①如批号为911001,即表示该药生产日期为1991年10月1日。说明书上可能还印有“有效期限三年”,则三年后过期,即1994年10月1日起失效。 ②如果批号为890101,而有效期标为910921,即表示该药于1989 年1月1日生产,1991年9月21日失效。 ③如果批号为9112,有效期为9302 ,则表示该药于1991年12月生产,1993年2月后失效。一般来说,注射剂和眼科及皮肤科的软膏,几乎都标明有效期,胶囊剂也有一些标有有效期,药片就较少有标的,中药及其成药则很少有标的。对于没标有效期的药,可按下法判断之。 (2)观察药品的色泽。 没有标明有效期的药品如过期失效,我们可以从外观上发现: ①药片变色。如白色药片变黄、变黑、变红或出现霉点、斑点,均显示已变质失效,不可再服。 ②冲剂、糖浆剂变味。冲剂和糖浆剂失效往往会出现异味(发酵味),有的也发霉。 ③无有效日期的注射药失效,一般都会发黄或颜色加深,有的变混浊,有的长出絮状物。 ④糖衣片失效,往往出现爆裂、异色斑块或斑点、自溶、变黑、发霉。 ⑤软膏失效,多再现药膏水化现象,或变稀、变色、变气味、软管内气体充盈而管体鼓胀。 ⑥粉剂药品失效,一般有变色或结块、有霉味,注射用粉剂在溶解后可见颜色发黄。 对于那些虽有有效期,但因保存环境不相宜而提前过期变质的药,也可按上法鉴别。 学会判断过期药品,免受过期药品给您带来的伤害。
化学药品研究资料及图谱真实性问题判定标准 原《药品注册管理办法》第九、十七、十九和四十七条等,以及现行《药品注册管理办法》第十三、二十三、二十四条等均对注册申报资料真实性有明确规定,要求申请人应当提供充分可靠的研究数据,证明药品的安全性、有效性和质量可控性,并对资料真实性负责。 在药品注册过程中,药品注册监督管理部门也应当加强对资料真实性的审查,以净化注册环境,维护好遵纪守法申请人的利益,切实保证公众的用药安全。同时,研究资料和图谱真实性判定是一个比较复杂的过程,在工作中需认真、细致、慎重,注意结合具体试验方法从多方面着手,根据掌握的数据、存在真实性疑问的研究内容、图谱的数量和相似程度进行判定。 一、申报资料内容和数据雷同,申报资料存在一图多用、数据造假等问题 1.不同品种的研究资料、数据相同或雷同 该项雷同是指同一单位不同品种,或不同单位同一品种/不同品种之间的研究资料的文字、实验数据、照片/图谱相同或有较明确证据的雷同,包括:研究资料中主要试验数据一致,TLC照片特征明显、可以确认相同,研究图谱雷同(如HPLC图谱峰形相似可以重叠并有多数峰或全部峰保留时间相同)等。 2.不同申请人申请原料药的合成工艺路线相同,且经试验摸索确定的工艺条件相同(只是投料量按比例放大/缩小的);不同申请人申请制剂的处方工艺类同,且经试验摸索确定的关键工艺参数完全相同。 3.同一品种HPLC/GC图谱各峰的保留时间、峰面积(和/或峰高)完全一致,或多个峰中仅个别峰有微小差别,或TLC照片完全一致,存在一图多用的问题(包括:同一时间点不同批号样品、不同时间点相同批号或不同批号样品等)。 该项问题是指同一品种存在较明确的一图多用(包括认为修改图谱和/或数据)的证据。对于TLC照片,主要通过斑点的形状、Rf值、原点和溶剂前沿特征、薄板边角特征和薄板斑点外其他区域显色情况等综合判定是否一致。对于HPLC/GC图谱,主要从保留时间、峰面积(和/或峰高)判定,其中保留时间相同,多个峰(半数以上)峰面积和/或峰高一致的情况在实际工作中不可能出现,可以判定系人为修改获得。 4.HPLC/GC图谱的峰形相似,各峰的保留时间完全一致或多数峰的保留时间完全一致,峰面积(峰高)不同或仅有少数峰的峰面积(峰高)相同(包括:同一时间点不同批号样品、不同时间点相同批号或不同批号样品等)。 该种现象在实际工作中也几乎不可能出现,可依据图谱及色谱峰的数量、保留时间相同峰的比例等进行判定。对于同时存在少数峰的峰面积和/或峰高,半峰宽、塔板数等一致的,是更充分的证据;对于试验日期相隔数日或数月仍出现上述问题的,也是较充分的证据。 判断时还应注意:对于HPLC图谱中容量因子小于3的色谱峰,出现个别色谱峰保留时间一致的概率可能较高;对于GC图谱,色谱峰保留时间一致的概率可能较HPLC图谱高;保留时间的有效位数和保留时间出现一致的概率有关,较少的有效位数出现保留时间一致的概率大。5.HPLC/GC图谱的峰形相似,各峰的峰面积(和/或峰高、峰宽)完全一致或多数峰的峰面积(和/或峰高、峰宽)一致,但各峰的保留时间不同(包括:同一时间点不同批号样品、不同时间点相同批号或不同批号样品等)。 该项问题主要依据色谱峰峰面积是否一致进行判定。此处“多数峰”可根据半数以上色谱峰峰面积一致判定。 6.HPLC图谱中仅显示一个峰,但多张图谱保留时间(和峰面积)完全一致(包括:同一时间点不同批号样品、不同时间点相同批号或不同批号样品等)。 该项问题主要依据多张图谱的单峰的保留时间(和峰面积)是否一致进行判定。对于研究资料中存在大量图谱的单峰的保留时间(和峰面积)一致,尤其是试验跨度较大、试验相隔较长时出现上述问题,均是较充分的证据。 7.HPLC色谱图采集时间与运行时间矛盾。 该项问题主要依据连续试验得到的图谱中的采集时间先于研究资料中
请问一下有没有做药品中的多环芳烃,或者这方面的标准,应该参考哪个标准去做搜刮了一下,似乎不是很常见,多环芳烃一般都是玩具啊,消费品这些的,作为环境控制的,为什么没有食品和药品的多环芳烃控制呢?
《药品注册现场核查要点及判定标准》课件-11-14版(幻灯片)药品注册现场核查工作方案1106 药品注册现场核查要点及判定标准发文报表7个(附表1药品注册撤回申请表,附表2药品注册申请撤回汇总报表,附表3药品注册自查报告表,附表4药品注册全面现场核查报告表,附表5药品注册全面现场核查汇总报表,附表6药品注册现场核查委托表,附表7药品注册现场核查委托报告表)[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=52224]都在这一个包里了[/url]

来源:国家食药监总局http://ng1.17img.cn/bbsfiles/images/2016/08/201608101404_604267_1610895_3.jpg近期,在国家药品抽验中发现,标示为湖北济安堂药业有限公司生产的蛇胆川贝液、吉林省鑫辉药业有限公司生产的跌打活血散和四川省通园制药有限公司生产的小儿咳喘灵颗粒多批次药品经检验不合格。现将相关情况通告如下:一、经湖北省食品药品监督检验研究院检验,发现标示为湖北济安堂药业有限公司生产的4批次蛇胆川贝液不合格,批号分别为140402A、141004B、141206B和150301A,不合格项目为鉴别。 经中国食品药品检定研究院检验,发现标示为吉林省鑫辉药业有限公司生产的3批次跌打活血散不合格,批号分别为16140702、16141001和16141002,不合格项目为装量差异。经山西省食品药品检验所检验,发现标示为四川省通园制药有限公司生产的3批次小儿咳喘灵颗粒不合格,批号分别为141003、141004和141209,不合格项目为性状。二、对上述不合格药品,吉林、湖北、四川省食品药品监督管理局已采取要求企业暂停生产销售、立即召回产品等措施。三、湖北济安堂药业有限公司、吉林省鑫辉药业有限公司和四川省通园制药有限公司同品种多批次产品不合格,反映该3家企业在生产质量管理方面存在问题。国家食品药品监督管理总局要求吉林、湖北、四川省食品药品监督管理局对上述企业依据《中华人民共和国药品管理法》等规定进行查处;并责令上述企业彻查药品质量问题原因,采取有针对性的措施进行整改,查清原因并整改到位前不得恢复生产;相关情况将及时向社会公开。特此通告。附件:10批次不合格药品名单http://ng1.17img.cn/bbsfiles/images/2016/08/201608101404_604266_1610895_3.jpg
原《药品注册管理办法》第九、十七、十九和四十七条等,以及现行《药品注册管理办法》第十三、二十三、二十四条等均对注册申报资料真实性有明确规定,要求申请人应当提供充分可靠的研究数据,证明药品的安全性、有效性和质量可控性,并对资料真实性负责。 在药品注册过程中,药品注册监督管理部门也应当加强对资料真实性的审查,以净化注册环境,维护好遵纪守法申请人的利益,切实保证公众的用药安全。同时,研究资料和图谱真实性判定是一个比较复杂的过程,在工作中需认真、细致、慎重,注意结合具体试验方法从多方面着手,根据掌握的数据、存在真实性疑问的研究内容、图谱的数量和相似程度进行判定。 一、申报资料内容和数据雷同,申报资料存在一图多用、数据造假等问题 1.不同品种的研究资料、数据相同或雷同 该项雷同是指同一单位不同品种,或不同单位同一品种/不同品种之间的研究资料的文字、实验数据、照片/图谱相同或有较明确证据的雷同,包括:研究资料中主要试验数据一致,TLC照片特征明显、可以确认相同,研究图谱雷同(如HPLC图谱峰形相似可以重叠并有多数峰或全部峰保留时间相同)等。 2.不同申请人申请原料药的合成工艺路线相同,且经试验摸索确定的工艺条件相同(只是投料量按比例放大/缩小的);不同申请人申请制剂的处方工艺类同,且经试验摸索确定的关键工艺参数完全相同。 3.同一品种HPLC/GC图谱各峰的保留时间、峰面积(和/或峰高)完全一致,或多个峰中仅个别峰有微小差别,或TLC照片完全一致,存在一图多用的问题(包括:同一时间点不同批号样品、不同时间点相同批号或不同批号样品等)。 该项问题是指同一品种存在较明确的一图多用(包括认为修改图谱和/或数据)的证据。对于TLC照片,主要通过斑点的形状、Rf值、原点和溶剂前沿特征、薄板边角特征和薄板斑点外其他区域显色情况等综合判定是否一致。对于HPLC/GC图谱,主要从保留时间、峰面积(和/或峰高)判定,其中保留时间相同,多个峰(半数以上)峰面积和/或峰高一致的情况在实际工作中不可能出现,可以判定系人为修改获得。 4.HPLC/GC图谱的峰形相似,各峰的保留时间完全一致或多数峰的保留时间完全一致,峰面积(峰高)不同或仅有少数峰的峰面积(峰高)相同(包括:同一时间点不同批号样品、不同时间点相同批号或不同批号样品等)。 该种现象在实际工作中也几乎不可能出现,可依据图谱及色谱峰的数量、保留时间相同峰的比例等进行判定。对于同时存在少数峰的峰面积和/或峰高,半峰宽、塔板数等一致的,是更充分的证据;对于试验日期相隔数日或数月仍出现上述问题的,也是较充分的证据。 判断时还应注意:对于HPLC图谱中容量因子小于3的色谱峰,出现个别色谱峰保留时间一致的概率可能较高;对于GC图谱,色谱峰保留时间一致的概率可能较HPLC图谱高;保留时间的有效位数和保留时间出现一致的概率有关,较少的有效位数出现保留时间一致的概率大。
大洋网3月7日报道 根据卫生部通知要求,黑龙江省卫生厅3月6日晚连夜发出内部明传电报,要求全省各级各类医疗机构立即停止使用吉林一心制药股份有限公司生产的注射用泮托拉唑钠。据悉,3月6日卫生部收到国家食品药品监督管理局通报,经吉林省食品药品监食管理局抽检,吉林一心制药股份有限公司生产的注射用泮托拉唑钠(批号为0809022、0810011、0810012、0810021、0810022)可见异物,检查不合格。国家食品药品监督管理局已于 3 月 6 日下发通知要求停止销售和使用该药品。黑龙江省卫生厅接到卫生部办公厅紧急通知后,连夜发出内部明传电报,要求各级各类医疗机构立即停止使用并封存该批号的药品,并做好相关记录,保证信息完整,可追溯。一经发现与该批药品有关的不良事件,要全力做好医疗救治工作,有效保护好患者的生命安全,并按照规定立即报告同级卫生行政部门和药监部门。目前,黑龙江省医疗机构药品不良反应监测系统尚未接到该药品发生不良事件的报告。(来源:中国广播网)
普通房间可以做药品室吗?除了易制毒易制爆
[b] 7日,国家药监局局长邵明立表明,为确保药品审评审批的公开透明,今后将会使整个过程网络化,接受申报者及社会各界的监督,并将审评人员公示,接受社会监督。邵明立同时透露,《药品注册管理办法》修订稿可能于10日上网公布。 [/b] 审评人员实行集体负责制 邵明立将这一公开透明的药品审评审批的办法归纳为“三制”,就是审评人员集体负责制,防止个别人滥用权力;实行责任追究制,强化对违法审批行为的责任追究;实行审评审批检验人员公示制,将药品审评审批置于社会监督之下。 邵明立说,国家的食品药品监管工作正在发生变化,同时自身队伍建设也暴露出一些问题,但药监局一直在努力,本来打算今年年中结束的食品药品专项整顿工作,将一直延续到年底。今年在年初,国家药监局已经委托各省药监局向当地的人大代表和政协委员汇报过专项整顿工作。 药管新规可能10日公示 昨日,邵明立看过本报《六问药品注册“漏洞”》一稿后表示,《药品注册管理办法》的修订工作正在进行中,可能于10日在网上公示。 据了解,现行的《药品注册管理办法》对涉及专利的药品注册工作作了一些规定,出发点是为了维护专利权人的利益,但由于药监局不掌握专利信息,难以判定专利是否侵权,对药品注册的正常工作形成了一定的干扰。 对此,邵明立表示,在新的办法里会考虑采取一定的措施,也会对鼓励创新药加以考虑。
药匙 是用于取用粉末状或小颗粒状的固体试剂的工具。大多数药匙只有一个勺,通常由金属、牛角或者塑料制成。有些药匙两头各有一个勺,一大一小,实验者可以根据用药量大小选择。注意事项:1.根据试剂用量不同,药匙应选用大小合适的。2.不能用药匙取用热药品,也不要接触酸、碱溶液。3.取用药品后,应及时用纸把药匙擦干净。4.药匙最好专匙专用,用玻璃棒制作的小玻璃勺子可长期存放于盛有固体试剂的小广口瓶中,无需每次洗涤。粉末状药品的取用,取用时可以用药匙(或者纸槽).操作要领是:“一斜、二送、三直立”.具体的操作是:先将试管倾斜,把盛药品的药匙(或者纸槽)小心地送入试管底部,再使试管直立起来。固体药品的取用原则: 1.“三不”原则,即“不闻、不摸、不尝”;具体说就是:不要去闻药品的气味,不能用手触摸药品,不能尝试药品的味道. 2.节约原则,即严格按照实验规定的用量取用药品;没有说明用量时,一般按最少量取用,固体只需盖满试管底部即可. 3.“三不一要”原则,即剩余药品的处理方法.具体是就是:既不能放回原瓶,也不能随意丢弃,更不能拿出实验室,要放入指定的容器内。液体药品的取用原则⒈识记化学实验室药品的一些图标。⒉药品取用的基本原则。⑴实验室取用药品要做到“三不”:不能用手接触药品;不要鼻孔凑到容器口去闻药品的气味;不能尝任何药品的味道。⑵取用药品注意节约:取用药品应严格按规定用量。若无说明,应取最少量,即:液体取1~2mL;固体只需盖满试管底部。⑶用剩的药品要做到“三不”:既不能放回原瓶,也不要随意丢弃,更不能拿出实验室,要放在指定的容器里。⒊固体药品的取用⑴取用固体药品的仪器:医学|教育网搜集整理一般用药匙;块状固体可用镊子夹取。⒋液体药品的取用⑴取用少量液体,可用胶头滴管。滴加到另一容器中的方法是将滴管悬空放在容器口正上方,滴管不要接触烧杯等容器壁,取液后的滴管不能倒放、乱放或平放。⑵从细口瓶倒出液体药品时,先把瓶塞倒放在桌面上,以免沾污瓶塞,污染药液;倾倒液体时,应使标签向着手心,以防瓶口残留的药液流下腐蚀标签;瓶口紧靠试管口或仪器口,以免药液流出。倒完药液后立即盖紧瓶塞,以免药液挥发或吸收杂质。⑶取用一定量的液体药品,常用量筒量取。量液时,量筒必须放平,倒入液体到接近要求的刻度,再用滴管逐滴滴入量筒至刻度线。读数时,视线与量筒内液体的凹液面最低处保持水平。液体药品的取用注意事项 :1、取用不定量(较多)液体——直接倾倒a. 瓶塞必须倒放在桌面上【防止药品腐蚀实验台或污染药品】;b. 直接倾倒时瓶口必须紧挨试管口,试管45度,并且缓缓地倒【防止药液损失】;c. 贴标签的一面必须朝向手心处【防止药液洒出腐蚀标签】;d. 倒完液体后,要立即盖紧瓶塞,并把瓶子放回原处,标签朝向外面【防止药品潮解、变质】。2、 取用少量的液体—使用胶头滴管a. 应在容器的正上方垂直滴入;胶头滴管不要接触容器壁【防止沾污试管或污染试剂】;b. 取液后的滴管,应保持橡胶胶帽在上,不要平放或倒置【防止液体倒流,沾污试剂或腐蚀橡胶胶帽】;c. 用过的试管要立即用清水冲洗干净;但滴瓶上的滴管不能用水冲洗,也不能交叉使用。3、取用一定量的液体—使用量筒a. 当向量筒中倾倒液体接近所需刻度时,停止倾倒,余下部分用胶头滴管滴加药液至所需刻度线;b. 读数时量筒必须放平稳,视线与量筒内液体的凹液面的最低处保持水平 .(注意:俯视则读数偏大,仰视则读数遍小。)
食品与药品有其各自的属性,与之对应在检验理念、思路、方式、标准的制定上都有各自的不同,不能将其二者简单等同,也不能合并同类项,简单归为同类检验。食品是可供人类食用或饮用的物质,包括加工食品,半成品和未加工食品,不包括烟草或只作药品用的物质。药品是用于预防、治疗、诊断人的疾病,有目的的调节人的生理机能并规定有适应证、用法和用量的物质。下面就其二者在检验方面的“和而不同”予以分析。一、食品、药品检验需同等资质,要求不同要开展食品、药品的相关检验检测必须要获得检验资质,药品检验需要获得“实验室资质认定”资质,才能开展药品检验;食品检验需要获得“食品检验机构资质认定”资质,才能开展食品检验工作,“实验室资质认定”包括24个要素,“食品检验机构资质认定”除了与“实验室资质认定”的条件一致外,还包括8个特殊要素。二、食品、药品检验同性质,针对方向不同食品、药品的检验都是围绕着检验检测工作开展的,但针对的侧重点不同,食品检验重点是安全性,主要是对人体有害的物质,比如重金属、防腐剂、添加剂、有毒有害物质进行检验,而药品检验除了安全性外还要兼顾有效性,要针对其有效物质进行检验,对其每一项或主要成分检验,尤其是针对有效成分的含量是否达标进行检验。简而言之,就是食品检验重点是针对安全性;药品检验重点是安全性兼顾有效性。三、食品、药品检验同需标准,标准适用范围不同食品检验与药品检验都必须按照检验标准进行检验,食品检验的标准是按食品的分类进行制定的,概括起来就是“一标多类”或是“多类一标”,比如重金属的食品检验标准适用于餐饮食品、农产品、海鲜产品等,即一个标准适用多类食品;而药品检验是按照《中国药典》进行检验,而《中国药典》是按照药品的名称进行标准编写的,完全实现“一品一标”,即一个药品名称对应一个标准。四、食品、药品检验的技术手段相同,“批检验”程度不同食品、药品检验都需要借助相关仪器设备,比如:高效液相色谱仪、[url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url]、紫外分光光度计等,食品检验标准多是“一标多类”,在检验过程中的前处理、检验条件是相同的,在相应的检验检测仪器设备上可以进行一次性检验,也就是说一个食品标准里涵盖的各类食品可以进行“批检验”,而药品检验标准是“一品一标”,每个品种项下的检验方法、条件都不相同,只有同品种药品才能实现“批检验”。五、食品、药品检验过程相同、检验分配方式不同食品、药品检验过程需要经过检品的前处理,然后借助相关仪器设备进行检验检测,但检验分配方式不同,食品检验一般是以检验项目为主,检验设置,任务分配上都是以“项目”导向,而药品检验恰恰相反是以“品种”检验为主,在检验设置、任务分配、实验流程以品种为导向,是完成一个品种的检验。
[color=#8645ba][b]一、食品、药品检验需同等资质,要求不同[/b][/color]要开展食品、药品的相关检验检测必须要获得检验资质,药品检验需要获得“实验室资质认定”资质,才能开展药品检验;食品检验需要获得“食品检验机构资质认定”资质,才能开展食品检验工作,“实验室资质认定”包括24个要素,“食品检验机构资质认定”除了与“实验室资质认定”的条件一致外,还包括8个特殊要素。[color=#8645ba][b]二、食品、药品检验同性质,针对方向不同[/b][/color]食品、药品的检验都是围绕着检验检测工作开展的,但针对的侧重点不同,食品检验重点是安全性,主要是对人体有害的物质,比如重金属、防腐剂、添加剂、有毒有害物质进行检验,而药品检验除了安全性外还要兼顾有效性,要针对其有效物质进行检验,对其每一项或主要成分检验,尤其是针对有效成分的含量是否达标进行检验。简而言之,就是食品检验重点是针对安全性;药品检验重点是安全性兼顾有效性。[color=#8645ba][b]三、食品、药品检验同需标准,标准适用范围不同[/b][/color]食品检验与药品检验都必须按照检验标准进行检验,食品检验的标准是按食品的分类进行制定的,概括起来就是“一标多类”或是“多类一标”,比如重金属的食品检验标准适用于餐饮食品、农产品、海鲜产品等,即一个标准适用多类食品;而药品检验是按照《中国药典》进行检验,而《中国药典》是按照药品的名称进行标准编写的,完全实现“一品一标”,即一个药品名称对应一个标准。[color=#8645ba][b]四、食品、药品检验的技术手段相同,“批检验”程度不同[/b][/color]食品、药品检验都需要借助相关仪器设备,比如:高效液相色谱仪、[url=https://insevent.instrument.com.cn/t/Mp]气相色谱仪[/url]、紫外风光光度计等,食品检验标准多是“一标多类”,在检验过程中的前处理、检验条件是相同的,在相应的检验检测仪器设备上可以进行一次性检验,也就是说一个食品标准里涵盖的各类食品可以进行“批检验”,而药品检验标准是“一品一标”,每个品种项下的检验方法、条件都不相同,只有同品种药品才能实现“批检验”。[color=#8645ba][b]五、食品、药品检验过程相同、检验分配方式不同[/b][/color]食品、药品检验过程需要经过检品的前处理,然后借助相关仪器设备进行检验检测,但检验分配方式不同,食品检验一般是以检验项目为主,检验设置,任务分配上都是以“项目”导向,而药品检验恰恰相反是以“品种”检验为主,在检验设置、任务分配、实验流程以品种为导向,是完成一个品种的检验。
工作中能接触到近红外,还是因为从事过一段药品抽检工作。在药品检测行业呆过的人都知道,有段年月近红外快检技术开展的轰轰烈烈,药品快检车四处可见。现在似乎已经过了那段“激情”岁月了,还是我已经远离药品抽检工作孤陋寡闻了?下面要说的话如有不妥欢迎提出讨论,我担心我说出来会被人呛死咧。 所以我得先声明:近红外技术是科学的技术、药品快检用的[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]也是不错的仪器。但是正如同样读兵法用的兵器也差不多,有的人打败仗有的人打胜仗,能怨兵法或者兵器不好吗? 刚加入药品抽检队伍的时候,正是药品快检车在我市配套启用的时候。那个时候药品快检这一项目开展的如火如荼,从最早的理化试验快检发展到仪器快检,宣称抽样人员从手摸眼看鼻闻的经验判定阶段飞跃到了仪器快速检测阶段。这其中的突出代表就是快检车上的[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url](牌子是布鲁克的),优点就在于无损检测、而且快速识别。 你想了,到人家卖药那,拿上1盒可疑药片或者胶囊、不用开封无须破坏包装,在车载近红外那扫描下,就可以信心满满地说:你这药,我们要抽回去再确定下。 当然,也有可能是面无表情地说:你这药,放回去(还能再卖),我再看看其他的。 不用破坏药品本身、甚至包装都不用打开,隔着透明的铝泡罩就可以扫描其中的药品,然后做出初步判定该药是否假劣。[align=left][b]你说神不神?——神![/b][/align][align=left][b]你说操作人拽不拽——拽![/b][/align][align=left][b]你说制假售假人员怕不怕?——怕![/b][/align] 可能这就是当初大力推进近红外快检的初衷吧,同时也是[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱[/color][/url]技术的特点,而且非常符合基层抽样人员的迫切需求。 毕竟你让成天疲于奔命抽样稽查啥都做的基层人员,到了药品经营场所还拿出坛坛罐罐称个样、加溶剂溶解、加点这个加点那个然后观察颜色啊分层啊,挺为难基层执法人员的。广大执法人员迫切需要一款神器,拿了药品一扫,滴一声就告诉你这药的真伪。 而[url=https://insevent.instrument.com.cn/t/1p][color=#3333ff]近红外光谱仪[/color][/url]貌似就是大家期盼的这款“神器”了,领导乐滋滋地告诉我第一年使用的时候抓了多少批不合格药品。再一脸沉痛地补充:你不知道当时多累,白天扫描晚药品上回去还要整理分析图谱。 所以一台快检车,上级给配置了许多快检试剂、快检设备,但最后都统统给近红外让路让位了,毕竟要求扫描图谱上传到总部(这代表工作量),毕竟这仪器看起来更高大上(对外行来说还是有一定威慑力的)。 我在用的那几年,很惭愧,没有一批不合格是近红外扫描出来的、或者说扫描的每一批药似乎都未发现异常。可能我水平低或者运气差吧。 那些制假售假分子是不是也与时俱进做了改良了?还是近红外对于那些纯淀粉做的假药效果明显,对于那些主药成分相同的的药也懵圈了?反正听总部说是希望做到一厂一品一模,思路大概是把全部合格的药品都建立了模型,那剩下的那些差异明显的自然就是非法生产的药品了。嗯,很有道理,不明觉厉。 不懂其他地方如何分配这块蛋糕的,我们这里是当地局管车和车载设备、当地检验所管使用和维护,需要用的时候当地局出车和司机、当地所出检测人员。这样的合作合用方式可想而知,用的人不管、管的人不用,最终就是设备总被雨打风吹去。 但我想还是有收获的,卖仪器的应该大赚了,制假药的门槛提高了,领导写这题材的论文得发表了职称上去了...
过期药品不能使用,这个常识大多数人都懂,而过期药品该如何处理,恐怕知道的人不多。昨日,郑州市民王先生拨打东方今报新闻热线称,在郑州市西郊一家属院的垃圾桶里,不知是谁丢弃了1000多盒过期药品。 成堆过期药品被丢垃圾箱 昨日上午11时30分许,东方今报记者来到位于郑上路西三环立交桥下西边路南一家属院,在一个垃圾箱旁,丢弃了两大麻袋药品。其中一个绿盒药品名叫“复方吉祥草含片”。上面显示的生产厂家是遵义一家药业公司,有效期至今年7月。还有南阳市药业公司出品的“首乌黑豆丸”,2011年9月到期。还有少量用透明塑料袋包装的散装中药。 记者数了一下,被丢弃的药品有6种,一共有1000多盒,都是些过期药品。 居民黄女士告诉记者,她前晚10点出门时还没发现有药品被丢在此,昨天上午8点下楼经过时,就发现了这些过期药品。 黄女士很担心,这么多药品胡乱扔在垃圾箱旁,如果有孩子捡去误食,该如何是好?而一旁的王先生则提出了不同看法:“过期药不扔垃圾箱,扔哪儿?” 在银行上班的张女士说,她前几天还将从家中清理出的过期药随手扔进了垃圾箱。 “药本来就是给人吃的,扔掉也不会有什么危害。”市民郝先生说。 “直接扔掉。”是记者在采访中听到的最多的答复,大多数市民都选择将废弃药品直接扔进垃圾箱。殊不知,这种处理方法具有很强的污染性。 过期药品污染环境 随后,东方今报记者将情况通过电话反映给郑州市食品药品监督管理局中原分局。 15分钟后,郑州市食品药品监督管理局中原分局副局长张松振赶到现场,查看丢弃药品,表示这些药品均为过期药品,但对其真伪难以辨别,过期药品不具有鉴定价值。 对于过期药品随意丢弃,张松振说,由于药品的种类繁多,化学成分也不一样,随意丢弃对环境的影响会有所不同。因此,对过期的药品,药监部门会在同一地方集中统一销毁。
化 学 药 品 的 管 理 2.1 药品的贮存 (1) 药品贮存不当,就会发生事故。 例如在实验室桌上放一个玻璃瓶,瓶后放了一瓶乙醚,阳光射在玻璃瓶上,如果正好聚焦於乙醚瓶,乙醚温度会骤升,瓶内产生高压,将塞子冲开,或瓶子炸裂,瓶中的乙醚蒸气被聚光点着,可能发生爆炸。 又如将活性碳放在硝酸旁边,不慎二个瓶子都破了,二者互相反应着火,引着其他药品,后果亦不堪设想。 贮存药物的原则 ①所有药品都有明显标签,标明药品名称、质量规格及来货日期;最好还有危险性质的明显标志。 标签日久会受腐蚀气体损坏,甚至全部剥落,如果不及时换新标签,就会变成无名物,有误用的危险。 注上来货日期,或制造日期,对於易变质物可以正确判定应否销毁。 ②分类存放,互相作用药品不能混放,必须隔离存放。易燃物、易爆物及强氧化剂只能少量存放。 ③贮存室或药柜必须保持整齐清洁。 ④经常检查药品瓶子或其他包装完整情况,标签是否完整,有无其他危险潜伏。 ⑤无名物、变质物要及时清理销毁。 (2)危险药物分类存放的原则及存放要求 ①易挥发药品:远离热源火源,于避光阴凉处保存,通风良好,不能装满。 这类药品多属一级易燃物、有毒液体。对这类药品贮存要加以特别注意,最好保存在防爆冰箱内,家庭冰箱指示灯、恒温控制开关、马达起动都可能打火,因此使用家庭冰箱时,不要联接内指示灯,并将冰箱放在宽阔通风良好处,这样冷冻机排出的热气便易於散开。 大量易燃物存放室应隔离建造,或在一楼,符合易燃物建筑标准。 存放易燃物的地方应挂有易燃物标志和不准吸烟的牌子。 存放易燃物室内应通风良好,但是室内不应有排风扇。 存放附近应有灭口器材及处理洒出药物的器材。 ②腐蚀性液体:放於底下,以免不慎跌下,洒出发生烫伤事故。 ③发生有毒气体或烟雾的药品:存於通风橱中。 ④剧毒药品:锁上。 ⑤致癌药品:有致癌药品的明显标志,锁上。 ⑥互相作用的药品:隔离存放。 ⑦特别保存的物品: 金属钠、钾等碱金属,贮於煤油中。黄磷,贮於水中。上述两种药物,很易混淆,要隔离贮存。苦味酸,湿保存,要时常检查是否放干了。镁、铝(粉末或条片),避潮保存,以免积聚易燃易炸氢气。吸潮物、易水解物,贮於干燥处,封口应严密。易氧化易分解物,存於阴凉暗处,用棕色瓶或瓶外包黑纸盛装。但双氧水不要用棕色瓶(有铁质促使分解)装,最好用塑胶瓶装外包黑纸。 ⑧放射性物品未经幅射物质管理部门批准,不得存放使用! 见表3-1 危险药品贮存要求一览表 (3) 不能混放的药品 凡能互相起化学作用的药品都要隔离,对那些互相反应产生危险物、有害气体、火焰或爆炸等危险的药品,尤其要特别注意。 下述几类是必须隔离的药品: ①氧化剂与还原剂及有机物等不能混放。 ②强酸尤其是硫酸忌与强氧化剂的盐类(如高猛酸钾、氯酸钾……等)混放;与酸类反应发生有害气体的盐类(如氰化钾、硫化钠、亚硝酸钠、氯化钠、亚硫酸钠等等),不能与酸混放。 ③易水解的药品(如醋酸酐、乙酰氯、二氯亚砜等等)忌水、酸及碱。 引发剂忌单体混放。潮湿保存。 ④卤素(氟、氯、溴、碘)忌氨、酸及有机物。 ⑤氨忌与卤素、汞,次氯酸、酸类及汞等接触。 ⑥许多有机物忌氧化剂、硫酸、硝酸及卤素。 ⑦两种药品互相反应,放出有害或剧毒气体。 见表3-2 不能混合的常用药品一览表 (4) 贮存药品辅助材料 下面介绍一些材料,有助於保护和隔离各类药品。 ①聚乙烯塑胶袋:封住瓶口,或装着整个药品,可以隔绝潮气,防止液体挥发,防溅出药品。例如在五氯化磷、三氯化铅,低温溶剂瓶的瓶口加聚乙烯袋封口。 ②蜡封:防潮、防氧化。例如用於金属氢化物瓶口加封。 ③塑胶盘:将药品放在塑胶盘上,即使瓶子漏了,也便於和其他药物隔离,亦便於清理。因此盛放强氧化剂及其他剧毒品比较好。例如水银,一旦瓶子破了,水银只溅於盘上,能立即处理。 ④有沙子的塑料盘:上放金属钾、钠等危险药物,强氧化剂、强腐蚀性液体和封管药品。 ⑤综色瓶盛放光敏性药品,或曝光下产生危险反应之药物。亦可用黑漆或黑纸封住。 ⑥聚乙烯塑胶瓶盛氢氧化钠溶液、强酸、双氧水等。 ⑦一些特别危险的药品,如雷酸等,按原包装保存。 2.2 化学危险品废物的处理 凡是具有毒性、腐蚀性、强氧化性、强还原性、自燃性、恶臭的物质及其溶液,以及易爆、易燃物质均为化学危险品。如在实验中经常接触和使用的碱金属、金属氢化物、有机金属化合物、毒性气体、氰化物、酰卤、重氮化合物、硝基化合物、N-亚硝胺、过氧化物、毒性有机膦化物、氯磺酸、发烟硫酸、汞、重金属盐皆属危险品之列。这些危险品一旦成为实验后的废物,必须及时妥善处理或销毁,以免造成意外事故。 实验室中常见危险品废物的销毁方法列于表3-3中。 2.3 实验废弃物的处理 废气处理 实验中经常会产生某些有毒的气体、液体和固体,需要及时排弃。如不经处理直接排出可能污染周围空气和水源,使环境污染,损害人体健康。因此对废液、废气和废渣要经过一定的处理后,才能排弃。 对产生少量有毒气体的实验应在通风橱内进行。通过排风设备将少量毒气排到室外(使排出气在外面大量空气中稀释),以免污染室内空气。产生毒气量大的实验必须备有吸收或处理装置。如NO2,SO2,Cl2,H2S,HF等可用导管通入碱液中使其大部分吸收后排出,CO可点燃转成CO2。 在反应、加热、蒸馏中,不能冷凝的气体,排入通风橱之前,要进行吸收或其他处理,以免污染空气。常用的吸收剂及处理方法如下: ①氢氧化钠稀溶液:处理卤素、酸气(如HCl,SO2,H2S,HCN等等)、甲醛、酰氯等等。 ②稀酸(H2SO4或HCl):处理氨气、胺类……等等。 ③浓硫酸:吸收有机物。 ④活性碳、分子筛等吸附剂:吸收气体、有机物气体。 ⑤水:吸收水溶性气体,如氯化氢、氨气等。为避免回吸,处理时用防止回吸的仪器。 ⑥氢气、一氧化碳、甲烷气:如果排出量大,应装上单向阀门,点火燃烧。但要注意,反应体系空气排净以后,再点火。最好,事先用氮气将空气赶走再反应。 ⑦较重的不溶於水挥发物:导入水底,使下沉。吸收瓶吸入后再处理。 ⑧汞蒸气及其它废气 长期吸入汞蒸气会造成慢性中毒,为了减少汞液面的蒸发,可在汞液面上覆盖化学液体;甘油效果最好,5%Na2S.9H2O溶液次之,水效果最差。 对于溅落的汞,应尽量拣拾起来,颗粒直径大于的汞可以用吸气球或真空泵抽吸的拣汞器拣起来。拣过汞的地点可以洒上多硫化钙、硫黄或漂白粉,或喷洒药品使汞生成不挥发的难溶盐,干后扫除。药品为: (a)20%三氯化铁溶液;(b)1%碘-1.5%碘化钾溶液,每平方米使用300-500ml。 对吸附在墙壁、地板及设备表面上的汞可以用加热薰碘法除去,按每平方米0.5g碘,加热薰蒸,或按每10m2,用0.02m2蒸发面积的碘片,下班前关闭门窗,任其自然升华,次日移去。 以上除汞方法中,三氯化铁及碘蒸气对金属有腐蚀作用,采用这两种方法时要注意对室内精密仪器的保护。 另外,也可用紫外灯除汞,紫外辐射激发产生的臭氧可使分散在物体表面和缝隙中的汞氧化为不溶性的氧化汞。紫外灯(市售品常为30W,220V的安装方法与一般荧光灯相同。高度2.5-3.0m每1m30.5-0.8W。可以利用无人的非工作时间辐照。 化验室的少量废气一般可由通风装置直接排至室外,排气管必须高于附近屋顶3m,毒性大的气体可参考工业废气处理办法用吸附、吸收、氧化、分解等方法处理后排放。
据我听说的,在工厂里生产食品的师傅基本不吃自己生产的东西?!为何,因卫生条件,怕吃出病来。现在,有病了谁还敢吃药?!皮革生产明胶竟然用在药品里,良心何在呀!这与制造假药有何区别?!N多知名药企都用过,何以见得影响之深远!
可以叫药品纯吗?是不是纯度很低?
关于山西旺龙神农药业有限公司等七家企业产品检出苏丹红或松香酸的通告 在全国范围内组织对风湿关节炎片和跌打丸2个品种进行了专项监督抽验,分别从药品生产、经营和使用环节抽取了158批次跌打丸和155批次风湿关节炎片。经青岛市食品药品检验检测中心按照补充检验方法检验,发现标示为山西旺龙神农药业有限公司生产的2批跌打丸检出苏丹红I和苏丹红Ⅳ;标示为吉林省通药制药集团股份有限公司和吉林省华侨药业有限公司生产的共4批跌打丸检出松香酸。经青海省食品药品检验所按照补充检验方法检验,发现标示为长春银诺克药业有限公司、吉林省红石药业有限公司、吉林省跨海生化药业制造有限公司和沈阳东新药业有限公司生产的共12批风湿关节炎片检出松香酸(详情见附件)。苏丹红是化学染色剂,常被用于劣质血竭等药材的非法染色。毒理学研究表明,苏丹红对人体具有明显的毒性作用,在中药材、中药饮片和中成药中均不得检出。松香酸是松香的主要成分,松香常被用于乳香、没药、血竭等药材的掺假。目前松香酸对人体有害尚不确定,但在含乳香、没药、血竭的中成药中不得检出。近年来,食品药品监督管理部门在监督检查及抽验中发现,劣质血竭药材有用苏丹红非法染色、以次充好的现象,乳香、没药、血竭等含树脂类药材中有非法掺入松香、以假充真的现象。本次抽验发现的问题属于企业违法添加还是购进的中药饮片存在质量问题,当地食品药品监督管理部门正在调查当中。无论哪种情形,都说明企业质量管理存在严重缺陷,难以确保药品质量安全。检检出苏丹红和松香酸的药品名单跌打丸山西旺龙神农药业有限公司山西省侯马经济技术开发区文明路589号董 生20130102国家食品药品监督管理总局药品检验补充检验方法和检验项目批准件2014002检出苏丹红I、苏丹红Ⅳ青岛市食品药品检验检测中心20121004通药制药集团股份有限公司通化市修正路39号李志宝120402国家食品药品监督管理总局药品检验补充检验方法和检验项目批准件2014007检出松香酸120601120901吉林省华侨药业有限公司吉林省松原市青年大街2499号胥凤琴20120801风湿关节炎片长春银诺克药业有限公司长春九台经济开发区群英大路888号刘晓峰20120501国家食品药品监督管理总局药品检验补充检验方法和检验项目批准件2014007检出松香酸青海省食品药品检验所吉林省红石药业有限公司长春市绿园区翔龙路17号代振文20130901201309022013110120131201201401012014040
2015年,“药改”最重要事儿莫过于改变药品定价规则——通过市场竞争,改变药品价格形成方式。沿着这个思路,一旦“医保支付价”、“二次议价”、“网售处方药放开”这些措施落地,政府对药品不合理管制将松动。药品价格改革目的是要取消药品价格天花板,制定合理的医保支付方式,通过市场行为,引导药品价格形成。但药品价格目前实质上受制于药品招标管制。在管制无法取消的情况下,多地公开“二次议价”将成为次优的解决方案。另外,医药电商网售处方药禁令一旦放开,药品获取渠道将更加多元化,多元化竞争后药品价格下降,医院利益受损,这将倒逼招标管制发生改变。医保支付价格:釜底抽薪,逼着医院主动降药价医保支付方式达到的效果很好理解:如果一家医院某药品以300元的价格卖给患者,医保支付价格为160元,医院就要自己承担140元的成本。140元的成本表面上看是患者的支出,但患者就医时已经报销了医保,这就意味着最后和医保结算的是医院。现在,多数医院都实行了总额预付医保支付方式改革,医院卖给患者的药品价格越高,医院就越亏,年终超过总额线的部分医院自己承担。这样的逻辑听起来似乎很顺,但不要忘记,医院并没有药品价格谈判的权力,政府集中招标后药品的价格多高,医院就只能卖多高。众所周知,在政府招标管制下,药品价格普遍偏高。医院在药品价格较高的情况下,需要支付超值的成本,如果无法降低药价,有可能将成本转嫁到患者身上。今后,医保支付方式是否有效,一是取决于支付价格的制定,二是取决于招标规则的形成。按照目前的试点,医保支付价格逃不了几种思路,一是平均价格、分段制定(比如重庆);二是唯低价是取(比如三明)。尽管重庆模式更加合理,但三明市低价思路可能更受主管部门欢迎。作为公立医院改革明星,该市一举一动都会备受卫生部门的支持与推崇。而且改革也离不开既往的思路——唯低价是取。另外,随着医保支付价格形成,谁来主管招标将有可能发生变化。由医保部门负责招标顺理成章,背负医保资金的压力,医保部门将做出最优选择(不管他们是否有能力达到)。不少地区已经将招标权力交给了医保部门,比如上海;而浙江也有意向把大病医保的药品品种交给人社部门。“二次议价”:曲线废止招标管制刚才已经提到,医保支付价格要想发挥作用,引导市场行为,形成药品价格,现有的药品招标规则就必须改变——最终的目的是医院可以参与谈判,决定药品价格的高低。公立医院药品招标采购中涉及到了敏感的“二次议价”。2014年6月发布的《关于完善公立医院药品集中采购工作的指导意见》已经修改了5次,里面提到“二次议价”、双信封制度、分类管理等,允许“在公立医院改革试点城市,允许以市为单位在省级药品集中采购平台上自行采购,如果试点城市成交价格低于省级中标价格。则全省医院要按试点城市成交价格采购,要及时总结地方经验做法,充实和完善药品采购政策”。目前,越来越多的城市开始试点“二次议价”,如三明市、绍兴市、宁波市、成都市。有业内人指出,“二次议价”是违法的,不但废除了集中招标定价的法律地位,还仍可能导致权力寻租。但根本的问题出在“第一次招标”不合法。众所周知,第一次招标(即政府药品集中招标采购)实际上是政府对招标的管制。整个过程招采脱离,谁也不知道谁的真实需求。企业在不了解市场需求的情况下,首先都会自动抬高价格,以防止采购数量少带来的损失。由于药品差价和回扣的原因,医生也自然喜欢价格高的药品。两者在自然需求下,不约而同都会影响药品价格,抬高价格。另外,为了进入目录,药企必须不惜代价公关政府,公关费用自然加到了药品当中。因此,要想降低药价、发现药品的内在价值,必须把招标采购权还给医院,取消政府对招标的管制,恢复买卖双方的自由,让市场决定药品的价格。从现实角度说,“二次议价”正在动摇政府招标管制的实际效果。今后药品价格采购思路无外乎两种:要么保留政府集中招标采购,实施“二次议价”;要么完全取消政府集中招标采购。假如取消政府集中招标采购,重庆、广东省第三方药品交易中心的模式或将成为借鉴。在此模式下,政府转变职能,不再参与医药采购过程,而以监管为主。不过,从2015年国家卫生计生工作来看,集中招标采购平台依然会保留。所以,“二次议价”将成为主流形式。网售处方药:关键时刻,需要市场临门一脚除了药品定价政策外,放开药品获取渠道也是倒逼药品政策管制的方式之一。2014年,《互联网食品药品经营监督管理办法》公开征求了意见。按照修订讨论稿,互联网药品交易服务资格证书B类牌照不再需审批,也不需备案;C类牌照不再需审批,有执业药师的药品零售企业到省局备案即可;A类牌照下放到省局审批。此外,国家将以正面清单形式逐步放开处方药网售(主要是慢性病处方药),允许委托第三方物流配送。目前,阿里、京东、一号店三大电商均拿到了互联网药品交易平台证书。从长远看,医药电商将得到实质性的政策支持,医保、处方等问题都将逐步得到解决。在医保方面,海宁市已经首先突破,老百姓大药房在线购药已经可以实现实时结算,并可保证医保资金的安全。处方不易外流的问题也会得到突破。按照公立医院改革的要求,医院不能靠药品赚钱,而是靠医疗服务。而商务部对药品流通领域的改革,也明确提到支持“患者凭处方到医疗机构或零售药店自主购药,发挥零售药店的作用”。这意味着,医药电商经营的药品将不仅仅OTC和保健品,老百姓获取药品的渠道会增加。在一些激励模式下(比如药店在线竞价),医药电商的药品价格会更便宜。所以,老百姓将有更多机会去社会药房购药,摈弃医院的贵药。对于医院来说,这近乎无情(药房收入大量减少),但却是倒逼改革的开始(包括药品采购)。众所周知,目前医院同品规药品之所以更贵,是因为政府集中招标采购价格高于市场价格;而且那些价格低廉、经典的老药也在医院消失了。总之,不管是医保支付价,还是网售处方药,都是在昭示一个新的时代:付费者以及用户终于在药价形成过程中开始扮演重要角色。这是个伟大的变化。
取消药品加成设立医事服务费“啊,挂号费改医事服务费了?”今天早上八点,不少来朝阳医院看病的患者都有些惊讶。从今天零时起,朝阳医院继友谊医院之后试点医药分开,即取消药品加成,取消挂号费、诊疗费,设立医事服务费。早上七点,记者在朝阳医院门诊楼大厅看到,宣传医药分开的横幅挂在墙上,咨询台前也特别增加了“医药分开”的专区,医院还派出了十多位工作人员在大厅中“执勤”,随时为患者解答疑问。因为是星期六,医院里的患者不是特别多。对于医事服务费,大多数患者对于普通号还是比较能接受,但对一些专家号来说还是有些不解。一位老大爷之前一直看专家号,在今天之前挂号费只有14元,而现在却需要100元。即使医保报销了40元,自己也要花60元。“我比以前多花了46元。”这位大爷掰着手指开始算账。“您看,现在药品降了15%,细算下来,您还是划算的。而且专家的时间释放出来后,可以看得更细致了。”听了工作人员的解释后,这位大爷频频点头
题外话:为啥说俺是找抽呢,本来今年已经脱离了抽检岗位回到了实验岗位,又鬼使神差地重回抽检部门,不是抽药品而是抽食品。你说俺这不是找抽是啥? 有位熟悉食品抽检的老师说过:食品抽检与药品抽检相比,完全是一个全新的、不同的体系。 接触后,体会开始慢慢深起来了。管中窥豹总结下,有讲的不对或者不到位的地方,欢迎各位拍砖指正。 最开始对两者的了解就是,药品抽检是不用购买样品滴,抽了就走,不用给钱滴;食品抽检时要购买样品滴,要以交钱购买样品的形式去抽。 接触后发现食品抽检比起药品抽检来说,起码有“许三多”、也许以后认识深刻了还有许多许多的“多”吧。 食品种类多。 药品也许做多做熟了,觉得无非就是三大类:化学药、中成药(含中药饮片)、抗生素。其他那些生物制剂疫苗的属于比较小众类就不算了。 食品分多少类,我的天:划分为粮食加工品、食用油、调味品、肉制品等33个大类,每个大类下面又有细类。——扶着我、我有点晕。 粗粗看完这33个大类,我才知道我以前对食品这个名词的理解有多肤浅,我才知道食品这门学科有多复杂。 抽检的时候首先你要知道你要抽的样品属于哪一类,不同的大类抽样方法和抽样数量都不同的。判断依据是根据QS号,QS号是《食品生产许可证》编号、由英文字母QS加12位阿拉伯数字组成。QS为英文"Quality safety"(质量安全)的缩写,编号前4位为受理机关编号,中间4位为产品类别编号,后4位为获证企业序号。所以看食品包装上的QS号中间4位数字,就可以知道该食品属于什么类别。遗憾的是现在又开始实行SC号了,QS号据说使用截止到2018年10月1日。这个SC号的规律(分类)我还没有完全弄清楚咧。 食品检验标准多 食品检验标准多接触过的应该都知道,一个食品的检测标准,往往是一个检测标准里某个项目又见另外一个标准、然后另外一个标准里的某一项目又见另外的一个标准。这样三级四级跳后,没被绕晕的人都算是转圈高手了。更不用说一个食品往往检测是这个标准、判定依据又是另外一个标准了。 当然这些似乎是检验部门的麻烦不是抽检部门的麻烦,麻烦在于抽检的时候,你要判断出一些具体信息。比如在抽饮料中的固体饮料时,要求“抽取时请确认冲调比例出现具体数值,如:每小袋冲水200mL、冲调比例为冲少量水的需由被抽样单位在备注栏签字确认冲水比例,否则不能计算限量”。这可好了,比如我抽豆浆精这个固体饮料,它的包装上只写冲调方法为取一袋加适量水...。蒙圈的我只好电询厂家:请问您这款产品到底是一袋加多少水?什么,你说喜欢喝浓点就加少点水反之就多加点水??不行,你一定要给我个准确加水量。 之所以出现这些要求并非我们无事找事,而是在这产品的检测标准中,对于某个项目的检测限量值,就是根据这个冲调量来计算的啊!! 又比如,抽取酒类中的配制酒时,必须要注明是“以蒸馏酒及食用酒精味酒基的配制酒”还是“以发酵酒为酒基的配制酒”。一般酒类的标签上基本不会注明此类信息,我能弱弱的表示:哥只懂这是38度的米香型酒耶... 据说这也是因为不同的配制酒,检测标准有所不同。 抽检程序复杂(多) 好怀念以前去药店或者药厂抽检的简单明快的操作啊。到了地方看好品种拿够数量,填写抽样单,封签好样品,完工走人。要是有空闲的话还可以跟被抽单位聊聊天、要是还有胆量的话还可以跟被抽单位喝喝茶。 食品抽检呢,到了地方先出示执法证(单位介绍信)、委托抽检函(书)并说明来意,询问对方的营业执照和生产(经营)许可证是否有且在有效期内,询问对方是否支持刷 卡购买和开发票,看好品种 拿够数量后,启动拍照模式。 营业执照和许可证来一张 样品正面背面来一张 被抽单位经手人签字时来一张 抽样人员与被抽单位经手人合影来一张 封签好的样品来一张 你以为这样就OK 了吗?抽样单里的各种信息都录入准确完整了吗?检验告知书写了吗?纪律反馈单呢?...呢? 难怪老师说:食品抽检,是一个完全不同的领域啊!
药品标准是药品检验必须遵循的法定依据,是药品生产的法定技术准绳,并对临床用药发挥重要的指导作用。国务院食品药品监督管理部门设置的药典委员会负责药品质量标准的制定和修订。1. 采用和执行药品质量标准的现状药品质量标准主要分为《中华人民共和国药典》及其增补本;国务院药品监督管理部门颁布的国家药品标准(包括国家食品药品监督管理局药品注册批件或修订件);卫生部药品标准;药品注册标准;国家食品药品监督管理局药品检验补充方法和检验项目批准件等;省级中药材标准;省级中药饮片炮制规范;医疗机构制剂标准等。按照《药品管理法》第六条的规定,我国市(地)以上药品检验所承担着对上市药品质量的监督抽验任务。以北京为例,中国药品生物制品检验所和北京市药品检验所主要承担着药品的注册检验、进口药品的检验、生物制品和全国评价性药品的检验;大量的上市后药品的监督抽验主要由各区县所负责。以下谈谈采用和执行药品质量标准的现状。1.1药品质量标准难求 无论是从版本上还是从分类上,现行的药品质量标准都是一个庞大的标准库。对于每年颁发的新药和仿制药品标准、试行标准等,有关部门只将标准发送到研制单位和当地省级食品药品监督管理部门和省级药品检验所,基层药检所很难得到。笔者所在的北京市区级中心药品检验所在日常工作中经常遇到查找和索取药品标准的情况。为了履行自己的检验职责,基层所要自己向相关单位索取药品标准。但是能否及时要到标准,要来的标准是否就是真实有效的,基层药检所本身由于自身权限的局限,已经无能为力了。这种局面的长期存在对公众的用药安全构成潜在的风险。1.2检验方法参差不齐目前,国内不同药品生产企业生产的同一种药品,执行不同的药品标准的现象比较普遍,甚至有同一生产企业生产的同一种药品仅因为规格不同,执行的药品标准也有不同。对于同一种药品,有时检验的项目和参数不同;有时项目一样,具体的检验方法又不同。例如常用的OTC药品—健胃消食类制剂,尽管《中国药典》收录有健胃消食片,可是由于规格的改变或者生产厂家的不同,可能具体执行的就是单页标准。又如常用的抗感冒药复方氨酚烷胺类制剂,不同厂家做含量测定时,有的采用的是传统的化学滴定,有的采用高效液相色谱法。这会导致同一个名称的上市药品其内在质量其实各异,对于患者来说,很难获得同一的疗效和安全保障。1.3标准针对性待商榷例如,(1)中成药中非法添加西药是近年来打击的重点。有关部门也专门汇编了部分厂家部分品种的补充检验方法,所用的仪器相当一部分是液相色谱-质谱联用设备。目前,在北京地区的18个区县所中没有一家有该设备。即使遇到患者举报有类似情况时,我们就无能为力了。唯一的办法就是交给省(直辖市)药检所来做。(2)地高辛片是《中国药典》收录的品种,其质量标准项下既采用高效液相色谱法测定了含量均匀度,同时又采用高效液相色谱法测定含量。又如在很多中成药质量标准中既用HPLC法测定了某种成分的含量,又用TLC法做鉴别。这些检验项目单个来看,都是无可厚非的。但联合起来看则有重复检验的嫌疑。为了节约检验成本,同时也为了尽可能地实现低碳和环保的目的,不必过分追求检验项目的多和全。(3)新版《中国药典》中微生物限度采用方法验证试验,这在基层药检所的实际工作中不太适用,开展起来很困难。到目前为止,每年很少有检品做该项检验。2.对策
主要是商品名的问题,上网查到有人说商品名是唯一的,但又有人说同一药品不同生产厂家,如【药品的商品名是指经国家药品监督管理部门批准的特定企业使用的该药品专用的商品名称,如对乙酰氨基酚是解热镇痛药,它的通用名是乙酰氨基酚,不同药厂生产的含有对乙酰氨基酚的复方制剂,其商品名有百服咛、泰诺林、必理通等。 】有没有老师指导一下这两者之间的关系,最好举例说明,特别是商品名,到底是不是唯一的?商标又如何?另外中成药能不能取商品名?
我们购买的实验药品大部分都没有保质期,也有一部分无生产日期,根本无法判断药品已经存放多久,多久是过期,国家有没有相关标准,大家有没有什么好的判断方法!
越来越多的事实证明,[U][B]单一依靠药品标准不足以作为药品质量合格的判断[/B][/U],[color=#DC143C]首先是因为国家药品标准只是作出判断的必要条件,而不是充分必要条件;其次作出判断往往是依据药品检验报告,但仅凭此而作出药品合格的结论也缺乏可靠性。[/color][color=#00008B][U][B]因此,药品生产企业应该对所生产的药品质量负责。[/B][/U][/color] 国家药品标准是作为衡量药品质量的尺度和判断是否违法的标准,但是越来越多的事实证明,单一依靠药品标准不足以作出以上判断,首先是因为国家药品标准只是作出判断的必要条件,而不是充分必要条件,其次作出判断往往是依据药品检验报告,但由于国家药品标准不可能将所有物质作出检验的规定,而只是保证药品安全、有效前提下,在必要、可能的范围进行选择的结果。所以,仅仅以药品检验报告为基础,作出药品合格的结论缺乏可靠性,已经有若干因药品质量发生的人身损害案件,但以执行的国家药品标准检验来看却是合格的。 [color=#DC143C][B]国家药品标准的定义究竟是什么?[/B][/color]在先的一些文章和教材、专著中多解释为药品生产、检验的法定依据,甚至还有解释为药品检验法定依据之说。尽管说法之多,但可能在作出这些解释时,并没有全面研究过国标以及药品标准在药品生产、经营、使用和管理中的作用。国家药品标准实际上应该是药品来源(如中药材)、药品生产(如中成药、生物制品)、药品检验、药品经营(如贮藏条件)、药品使用(如类别、功能主治、适应症、用法用量、注意事项、禁忌等)的规范。这些规范或来源于药品研究(如新药);或来源于对上市后药品的再评价;或来源于经验的总结(如中药)。依提出国家药品标准主体的不同,分为药品生产企业(新药)和国家药品监督管理部门,依权利的不同分为依申请(新药、仿制药、药品注册补充申请),依职权颁布(《中国药典》等),依强制程度不同分为国家药品标准和企业药品标准(部分项目高于国家药品标准,或者在国家药品标准基础上增加有关检测项目仅在本企业内部执行,或者和相对人约定执行的药品标准)。不言而喻,国家药品标准具有国家强制力,必须遵守和执行,而企业标准可以依约定在执行国家药品标准的基础上,由相对人遵守和执行。 制定国家药品标准的基础,是基于药品注册申请人的研究资料和国家对于药品上市的基本要求,或者是允许已上市药品继续生产、使用的基本规定。因此,凡是在研究申报资料基础上,生产工艺、原料、辅料、包装材料、关键人员等基础发生变化时,其药品标准相关项目则可能发生变化,此时,单以检验项目是否合格作为判断药品质量的依据时则可能出现误判。仅以检验结果作为药品质量评价指标则可能出现错误,换句话讲,检验合格不等于药品合格。因此,在一定意义上,国家药品标准是有限标准,有前提的标准。但是,检验不合格药品却是可以作出不合格的结论,检验的主要意义就在于此。要准确地评价药品质量,应该是结合标准的检验结果、GMP、GCP等规范执行情况的评价,才可能综合得出药品质量的正确结论,因此,应该对公布药品抽验合格率的必要性进行研究。 药品生产企业应该对所生产的药品质量负责,而不能仅仅是依国家药品标准检验合格作为上市的标准。长期以来,人们相信药品质量是生产出来的,而不是检验出来的,这种观点反映出对生产管理的重视。但更为全面的质量观点应该是药品质量始于药品的研究和生产设计,因为有缺陷的设计和研究,即使再规范的生产管理,仍然是有缺陷的药品,或称为不合格的药品,因此,引入了广义的合格药品应该是符合安全、有效要求的药品是合格药品的概念。在《民法通则》、《产品质量法》、《侵权责任法(草案)》等均将设计或者研究缺陷纳入产品缺陷范畴。因此,在修订《药品管理法》时应该将药品的设计缺陷作为研究的内容之一,比如隐瞒研究中的不利结果,违反科学研究规范,错误地得出或者捏造有利于上市的数据而获得药品上市许可,如果药品上市以后发生人身伤害事故,应当承担侵权责任,这种责任延续至药品上市以后药品生产者待遇履行药品的再评价义务,而药品的再评价包括了质量、安全性和有效性。当然要求药品生产企业履行这些义务,必须从法律上授予权利加以保证,解决目前药品生产企业难以收集医疗机构使用所生产品种的安全性和疗效的数据问题,而医疗机构必须履行提供相关资料的义务。
以前上学时老师要求称取药品时从试剂瓶中取出来后就不要往回放了,多的一点也要废弃,这样用减量法称取药品时是不是多的药品也不应该放回原试剂瓶而应该废弃呢?
以多举措推动药品审评能力提升2013年03月28日 来源: 中国科技网 作者: 吴红月 http://www.stdaily.com/stdaily/pic/attachement/jpg/site2/20130327/091364384375984_change_jw331_b.jpg 2012年新申报的ANDA申请共2095个(按受理号计,不包括辅料)。已有批准文号20个以上的药品,仍有1272个申请,占2012年全年ANDA申报量的60.7%;已有批准文号10个以上的ANDA申请仅占其总申报量的20.6%。此数据说明,仿制药重复研发、申报现象严重。 数据显示,2012年,国家药监局药品审评中心全年承办了新注册申请6919个(以受理号计),完成审评呈送国家局注册司审批4941个,其中建议批准3323个,建议不批准1618个。上述数字来自由国家食品药品监督管理局药品审评中心(以下简称药品审评中心)推出的《中国药品审评2012报告》(以下简称《报告》)。据了解,这是药品审评中心首次对外公布的年度药品审评情况。 自2012年以来,药品审评中心按照《国家药品食品安全“十二五”规划》和《生物产业发展规划》的要求,按照国家食品药品监督管理局的统一部署,不断完善制度,推出多项举措,开展基于科学和实证的技术审评工作,切实为保护和促进公众健康做出积极努力,获得医药工业界的一致好评。药品审评中心主任张培培日前在接受科技日报记者采访时指出,药品审评中心以“质量、效率、透明、清晰、一致和可预见”作为审评工作的原则,并将其作为评价审评决策质量的指标。 “与国际上各大药品审评机构的使命一样,我们首先要维护和促进公众健康。”她说,“我们的药品审评机构要成为值得信赖的、有国际水平的、公众健康的守护者。” 鼓励创新药与世界同步研发 作为我国承担药品上市前技术审评的机构,药品审评中心的主要职责为两大方面,一是负责药物(药品在上市前被称为药物)进行人体临床试验前的科学性审评,以保证临床试验的受试者是在有相应安全保障、人体研究符合伦理原则和科学标准等条件下进行;二是负责药品进入市场前的科学性审评,保证公众用药的安全、有效和产品质量的可控。 药品审评要对申请的药物是否具有临床治疗价值、患者的需求是否得到满足、公众能否用得上与用得起、药物的风险是否被充分认知、控制风险的手段是否可行、临床受试者是否得到充分的保护、药物的有效性是否确切、药物的质量是否具有控制手段等多种复杂的因素进行综合的分析评判。张培培表示,这种判断必须在患者获益和风险之间进行平衡。药品的最终审评结论以建议“准予”、“不准予”开展人体临床试验或上市并述及科学理由及法规依据。 《报告》显示,在创新药领域,药品审评中心鼓励以临床价值为导向的药物创新,鼓励创制对重大疾病具有较好治疗作用、具有自主知识产权的药物,鼓励儿童用药、罕见病药物的研发。创新药的审评任务被列为优先级任务,实行全程督导管理。如,针对国家重大专项品种的审评均实施优先审评,鼓励国内申请人开展全球同步研发。2012年完成审评的麦他替尼氨丁三醇片和海泽麦布片,通过进一步缩短审评时间,实现了国内与国外同步开展临床试验。 药品审评中心还按照药物研发规律,基于创新药物研发各个阶段的特点,建立创新药临床前药学评价模板和研发期间的年度报告制度,药学方面的技术要求与国际基本接轨,并使药学更新或变更的资料能够滚动提交。该项措施在2012年5月正式实施后,彻底转变了国内创新药的药学审评思路。 与此同时,药品审评中心发布《临床试验数据管理工作技术指南》,开通药物临床试验登记和信息公示平台。按照国际标准构建了我国药物临床试验的数据管理和数据标准化工作平台,制定实施《药品审评中心与申请人的沟通交流质量管理规范》,开通申报资料滚动提交的通道,以减少了既往只能以发补方式完善资料所带来的、不必要的排队时间。创新药临床试验申请的发补率由2011年的41.1%降低至2012年的33.9%。 通过上述制度和措施的实施,创新药临床申请的审评用时有了较为明显的改善,72%的创新药临床试验申请首轮审评结束用时在8个月以内,其中以6—7月占45%,5月以内占11%。 探索仿制药优先制度建立 尽管我国是发展中国家中少数达到药品消费能够自给自足的国家,但在一些治疗领域还存在临床无药可用或供应不足的窘境。仿制药的研发周期短、投入低,是现阶段快速填补临床用药空缺、降低患者经济负担的最有效途径。而尽快批准具有较高临床价值且临床亟须仿制药品上市,是社会、公众对药品审评的基本要求之一,也是药品审评服务于社会、公众的具体体现之一。 2012年药品审评中心在仿制药领域推陈出新,先后发布了《中国通用名药发展研究报告——市场准入制度研究(2012年)》,构建了优先审评仿制药的注册流程。 以替加环素、地西他滨和卡培他滨等品种为试点,药品审评中心把生产现场检查融入到审评过程中,派遣一线审评人员参加生产现场检查,实现“资料链接现场”的审评,增强审评人员对产品和生产工艺的理解,确保批准的产品具有高质量且可工业化生产。2012年,药品审评中心根据国家有关要求,进一步推动国际通用技术文档(简称CTD)格式申报,继续开展优先审评艾滋病治疗药物、抗耐药结核药物、氟利昂替代药物等;以及基于临床需求,关注具有较高临床价值的、临床需求尚未有效解决的品种,例如国外已经上市但国内尚未上市或者仅有原研产品上市的品种。 《报告》中的数据还表明,2012年以药物类型计,化药申请受理5944个,中药519个,生物制品456个,分别占比例为86%、7.5%和6.5%。以申请类型计,临床试验申请1269个,生产上市申请2516个,补充申请3134个,分别占有比例为18%、36%和46%。 药品重复申报依然严重 《报告》指出,在2012年的化药注册申请中,5及6类简单改剂型和仿制药申请占据了全部申请的36%,共计537个化合物。其中141个化合物已有国家批准文号50个以上,94个化合物国家批准文号100个以上。张培培认为,这一数据反映出仿制药申请重复开发、重复申报现象依然存在。 2012年,药品审评中心审结的化药、中药、生物制品分别为4199个、575个和381个;审结品种中化药、中药和生物制品各自批准率为62%、52%、86%,完成审评并提出批准或不批准结论建议的品种共计5155个,其中批准和不批准结论分别占68%和32%,总体不批准率已连续三年保持在30%左右。 之所以出现30%的不批准率,《报告》分析认为,我国已上市的药品文号有18万个,这些品种批准时间跨度很大,上市前研究基础也存在较大差异。有的早期批准上市的药品已被后期上市的疗效更确切、安全性更好的新药所取代。因此,对于此类变更补充申请,技术审评一般不予认可。张培培强调说,“这从一个角度反映了中心对审评高标准、严要求的原则和态度。” 原研药上市赶上国际市场步调 针对一些原研进口药品对于解决我国未被满足临床需求,提供最新治疗手段发挥重要作用的情况,药品审批中心对此一直关注对进口药品的审评,以确保我国公众尽快用到全球最新的药品,合理配置审评资源缩短具有重要临床价值进口药国内外上市时间的差距。如2012年批准进口上市的苹果酸舒尼替尼胶囊、替格瑞洛片,与美国FDA批准上市时间差仅为一年。 “每一个审评结论都是对这个机构能力提出的一次挑战,”张培培在详细解读《报告》的意义时表示,“我们清晰地认识到,药品审评中心目前的能力与所承担的责任是有距离的。基于现实,我们提出以受监督、可评估、能发展为推进机构发展的基本要求,借鉴国际法规科学的发展经验,着力提升科学审评的能力,加强专业化审评制度的建设,切实保障公众用药安全,维护和促进公众健康。”(记者 吴红月) 《科技日报》(2013-03-28 九版)
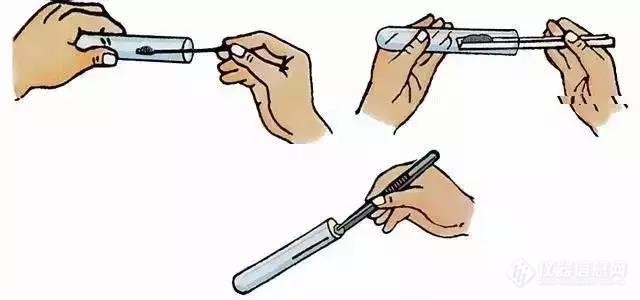
[align=center][b]实验室固液体药品取用原则及注意事项![/b][/align]来源:[font=-apple-system, BlinkMacSystemFont, &][size=0px][color=#333333] [/color][/size][/font][font=-apple-system, BlinkMacSystemFont, &][size=15px][color=#333333]分析圈[/color][/size][/font][color=#333333][/color][font=微软雅黑][color=#666666] 在实验过程中取用固体样品和液体样品是我们常做的事,所以掌握药品及试剂的取用、称量和溶解就是非常必要的。[/color][/font] [color=#021eaa][b]固体药品的取用原则[/b][/color] 1.“三不”原则,即“不闻、不摸、不尝” 具体说就是:不要去闻药品的气味,不能用手触摸药品,不能尝试药品的味道。 2.节约原则,即严格按照实验规定的用量取用药品 如果没有说明用量,一般按最少量(1~2mL)取用液体,固体只需盖满试管底部即可。最大量,液体不超过容器容积的1/3,固体不超过1/2。 3.“三不一要”原则,即实验用剩的药品不能因为要 “节约”而放回原试剂瓶,这样做会污染试剂瓶中未使用的药品。因此,用剩的药品既不能放回原试剂瓶,也不能随意丢弃,更不能带出实验室,要放在指定的容器中。 4.固体颗粒的取用(一横二放三慢竖),一般用药匙 块状固体可用镊子夹取。 先把容器横放,用镊子夹取块状药品或金属颗粒放在容器口,再把容器慢慢地竖立起来,使块状药品或金属颗粒缓缓地沿容器壁滑到容器底部,以免打破容器. 5.粉末状药品的取用,取用时可以用药匙(或者纸槽)。操作要领是:“一斜、二送、三直立”。具体的操作是:先将试管倾斜,把盛药品的药匙(或者纸槽)小心地送入试管底部,再使试管直立起来。 注:使用后的药匙或镊子应立即用干净的纸擦干净。[img=,640,300]https://ng1.17img.cn/bbsfiles/images/2021/10/202110021448492320_7528_1626275_3.jpg!w640x300.jpg[/img][color=#021eaa][b]液体药品的取用原则[/b][/color] 液体药品的取用:“多倒少滴” 取用不定量(较多)液体—直接倾倒(一倒二向三挨四靠) a. 瓶塞必须倒放在桌面上【防止药品腐蚀实验台或污染药品】 b. 直接倾倒时瓶口必须紧挨试管口,试管45度,并且缓缓地倒【防止药液损失】 c. 贴标签的一面必须朝向手心处【防止药液洒出腐蚀标签】 d. 倒完液体后,要立即盖紧瓶塞,并把瓶子放回原处,标签朝向外面【防止药品潮解、变质】。[align=left][size=15px][img=,640,440]https://ng1.17img.cn/bbsfiles/images/2021/10/202110021450178101_8936_1626275_3.jpg!w640x440.jpg[/img][/size][/align][align=left][size=15px][/size]取用少量的液体—使用胶头滴管 a. 应在容器的正上方垂直滴入 胶头滴管不要接触容器壁【防止沾污试管或污染试剂】 b. 取液后的滴管,应保持橡胶胶帽在上,不要平放或倒置【防止液体倒流,沾污试剂或腐蚀橡胶胶帽】 c. 用过的试管要立即用清水冲洗干净 但滴瓶上的滴管不能用水冲洗,也不能交叉使用。[img=,300,220]https://ng1.17img.cn/bbsfiles/images/2021/10/202110021451382570_3592_1626275_3.jpg!w300x220.jpg[/img][/align][align=left][size=15px][/size]取用一定量的液体—使用量筒 a. 当向量筒中倾倒液体接近所需刻度时,停止倾倒,余下部分用胶头滴管滴加药液至所需刻度线 b. 读数时量筒必须放平稳,视线与量筒内液体的凹液面的最低处保持水平。(注意:俯视则读数偏大,仰视则读数遍小。)[img=,392,220]https://ng1.17img.cn/bbsfiles/images/2021/10/202110021453027619_847_1626275_3.jpg!w392x220.jpg[/img][/align]