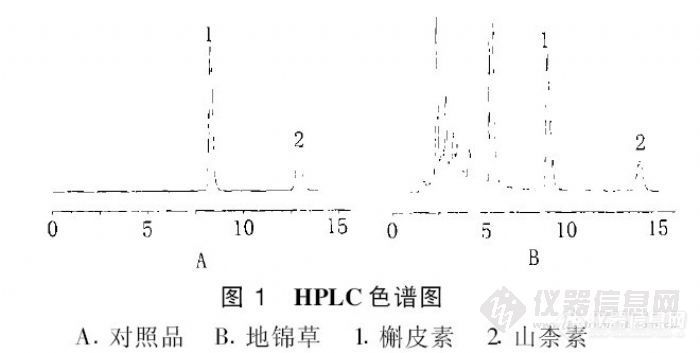
HPLC测定地锦草中槲皮素、山柰素的含量 雷 鹏 刘 韶 李新中 徐平声 (中南大学湘雅医院药剂科, 长沙410008)摘要 采用高效液相法测定地锦草中槲皮素、山柰素含量, 色谱柱: D iamonsil C18 ( 4. 6 @ 250 mm ); 流动相: 甲醇-01 025%磷酸( 60B40); 流速: 1 m l/m in; 柱温: 35e ; 检测波长: 360 nm。槲皮素在01 147~ 0. 735 Lg范围内线性关系良好, 平均回收率为981 15%; 出柰素在01042~ 0. 210 Lg 范围内线性关系良好, 平均回收率为971 24%。该方法简便可行、重复性好, 可作为地锦草质量评价的方法。关键词 地锦草; 高效液相色谱法; 槲皮素; 山柰素http://ng1.17img.cn/bbsfiles/images/2012/07/201207242110_379513_2432394_3.jpg
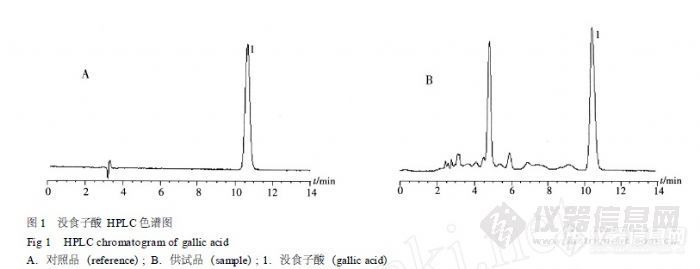
作者:黄彩虹; 雷鹏; 甘莲莲; 黄义; 李新中;(中南大学湘雅医院药剂科; 中南大学药学院;)摘要:目的建立高效液相色谱法测定地锦草中没食子酸的含量。方法Diamonsil C18色谱柱(4.6 mm×250 mm,5μm);流动相:甲醇-0.01%磷酸(10∶90);检测波长:273 nm;柱温:30℃;流速:1 mL.min-1,进样量:5μL。结果没食子酸在0.018 2~0.182 4μg线性关系良好,回归方程为Y=2 969.4X-4.252,r=0.999 9。平均加样回收率为98.36%,RSD为2.83%。结论本方法简便、快速、重复性好,可用于测定地锦草中没食子酸的含量。谱图:http://ng1.17img.cn/bbsfiles/images/2012/08/201208061108_381762_1606903_3.jpg

药物名称:地锦草。货号:99601。今日抽奖结果:[align=center][img=,690,288]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101629219147_3505_708_3.png!w690x288.jpg[/img][/align][align=center][img=,690,302]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101629271026_7345_708_3.png!w690x302.jpg[/img][/align][align=center][img=,690,321]https://ng1.17img.cn/bbsfiles/images/2019/10/201910101629324986_5388_708_3.png!w690x321.jpg[/img][/align][align=center]=================================[color=#ff0000]活动规格[/color]====================================[/align][align=left][color=#ff0000]【活动时间】:每个工作日10:00-15:00【活动内容】:根据迪马产品资料:《药物检测应用文集》,每日会出一个化药或中药名称标题,版友根据标题找出相应迪马产品,将从回答正确者中利用抽奖软件抽取以下奖项。[/color][/align][align=left][color=#ff0000]【活动奖励】:一等奖:3个钻石(2人),二等奖:2个钻石币(3人),三等奖:1个钻石币(5个人)。[/color][/align][align=left][color=#ff0000]【注意事项】:一定要在迪马产品资料《药物检测应用文集》中找出相应迪马产品。[/color][/align][color=#ff0000][/color]
云南白药最近修改了药品说明书,明确配方中含“草乌”成分。草乌又称断肠草,主要作用成分为乌头碱,有剧毒。早在2013年2月,云南白药就在香港被检出含有未标注的毒性成分乌头类生物碱(草乌的主要成分),香港卫生署及澳门卫生局随即对云南白药发出禁售及回收命令。 由于云南白药被列为国家保密品种,根据国家保密法律法规有关规定,凡列入国家保密的品种,其说明书、标签可不列成分项目。因此,对于白药的配方,云南白药一直讳莫如深。而此次是云南白药首次修改药品说明书并承认含草乌的说明。 在市场议论纷纷之时,今日(4月8日)云南白药发布公告表示,根据国家药监局《关于修订含毒性中药饮片中成药品种说明书的通知》的要求,公司相关药品说明书的修改工作于2013年12月底全部完成。 同时,云南白药还出具了两份此前对于云南白药安全性的说明,在2013年2月6日,云南白药就乌头碱类物质进行了说明,并出具数据:“在2010年至2012年间,共生产销售云南白药(4g/瓶)1亿瓶、云南白药胶囊(0.25g/粒)17亿粒,公司通过主动开展不良反应监测工作,三年间共监测到涉及云南白药和云南白药胶囊的各类不良反应共计28例,主要表现为皮肤过敏、发痒等;未监测到严重不良反应,产品的有效性和安全性毋庸置疑。” 另一方面,就公众广泛关注的2013年2月香港卫生署下架部分白药药品事宜,在上市公司配合香港卫生署要求补充完善相关产品注册程序后,香港卫生署已同意恢复上架,并于2013年11月起在香港全面恢复正常销售。云南白药还重申,云南白药产品安全有效。
[center]欧盟重新修订草本药品GMP指南 提高草本药物入市门槛[/center] 中国医药保健品进出口商会消息,日前,欧盟正式公布了经过修订的欧盟人用药品与兽药GMP指南的附录7部分。此部分针对草本药品,内容涉及原则、厂房与设备、文件和质量控制等方面,尤其对于起始物料的控制、贮存和加工过程有了明确规定。修订版本将从2009年9月1日开始实施。医保商会的专家认为,此次对草本药品GMP进行的修订,意味着欧盟进一步提高了草本药品的入市门槛。 据了解,在修订版本的原则部分,此次清晰地定义了草本药品制造过程中的起始物料可以是药用植物、草本物质或草本制剂。在对厂房与设备的规定中,强调草本物质应当储存在隔离区域,以防止虫咬、发酵、霉变及交叉污染等,并对清洁度、湿度、温度、避光保护、可监控等提出了要求;在生产区域里,强调对除尘系统、专用厂房等方面的要求;用于制造过程的设备、过滤材料等,要求一定要相容于提取溶剂,以防止任何物质释放到溶剂中,或有任何物质吸附到设备或过滤材料上,从而影响产品质量。 对文件系统的规定,要求有起始物料的详细说明,包括供应商的审计记录,供应商是否符合良好种植和采集规范等;在规格标准方面,要记录各种名称、来源细节、干燥系统、辨别实验、水分规定、微生物污染、有毒金属及类似污染物、活性成分含量分析、外源物质测定等等;在工艺指令方面,要求记录所有操作过程,容器检查情况、过滤筛分方法等,制剂厂家要记录溶剂、时间、温度等详细内容以及详细的浓缩步骤和使用的方法。 对于质量控制方面的规定,主要是针对取样的要求,如人员的专业性、对照样品的有关规定等。 医保商会的专家认为,随着欧盟植物药市场需求的不断扩大,相关的市场监管也会越来越严格,中国企业要想进入该市场,就必须随时注意了解相关信息,并严格按照其要求去规范生产和管理,尤其在相关标准方面要早动手,早做准备。
我们是用草酸酸化提取出土霉素。怎样测定药品中草酸残余量呢?我用的是高效液相色谱。用的是反向离子柱。
为保证药品的安全、有效和质量可控,规范药品注册行为,根据《中华人民共和国药品管理法》、《中华人民共和国行政许可法》、《中华人民共和国药品管理法实施条例》等法律、行政法规,以及国务院有关要求,国家食品药品监督管理总局起草了《药品注册管理办法(修改草案)》。为提高规章质量,现将其全文公布,征求社会各界意见。有关单位和社会各界人士可以在2014年3月23日前,通过四种方式提出意见:1.登录中国政府法制信息网(网址:http://www.chinalaw.gov.cn),进入首页左侧的“部门规章草案意见征集系统”提出意见。2.通过信函方式将意见寄至:北京市西城区宣武门西大街26号院2号楼(邮编100053)国家食品药品监督管理总局法制司,并在信封上注明“《药品注册管理办法》征求意见”字样。3.通过传真方式将意见传至:010-63098758。4.通过电子邮件方式将意见发送至:xuxy@sda.gov.cn。
食品药品胶体金分析仪是一种先进的科学仪器,主要用于检测食品和药品中的胶体金含量。胶体金是一种微小颗粒的金纳米材料,其在食品和药品中的含量是一个关键的指标,对产品的质量和安全性具有决定性的影响。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/04/202404261526428439_4734_6238082_3.jpg!w690x690.jpg[/img] 该分析仪的工作原理基于胶体溶液中纳米颗粒的光学性质,通过测量光的散射强度来得到颗粒的浓度信息。当光与金纳米颗粒相互作用时,根据散射光的洛仑兹-米耳斯理论,可以得到散射强度与颗粒的浓度之间的关系。因此,胶体金分析仪可以精确、高效地测量食品和药品中的胶体金含量。 此外,食品药品胶体金分析仪还有便携式及台式两种款式,利用免疫层析胶体金原理及干式化学原理,可以对畜禽产品中瘦肉精、抗生素残留,水产品中非法化学品、抗生素药物残留、罂壳成分等进行快速检测。这种分析仪现已广泛应用于各级食药环侦快检实验室,成为实验室常规检测的有益补充。 使用食品药品胶体金分析仪时,用户需要按照以下步骤操作:首先,根据实际需求,准备好需要检测的样品和相应的试剂 其次,将准备好的样品和试剂分别装载到胶体金免疫层析分析仪的样品槽和试剂槽中 然后,启动仪器,仪器会自动进行样品混合和分析 最后,观察屏幕上显示的结果,并根据仪器提供的标准曲线,确定目标物质的浓度。 总的来说,食品药品胶体金分析仪为食品和药品行业的质量控制和安全监测提供了强有力的支持,是一种具有广泛应用前景的科学仪器。
本人在深圳一个普通公司的检测中心(非官方组织),打算组织一次草根比对,涉及检测项目为药品细菌数、化妆品菌落总数、医疗器械生物负载、无菌检查中的一种或多种。1、样品为安瓿瓶或塑料袋装。2、收取的费用仅为快递费(样品快递到付)。3、开展的时间初步定为12月初。4、样品含菌种类可能较少、偏简单。5、出具的报告为加盖本中心检测报告专用章(电子扫描版)。现调查下:有多少实验室愿意参加?参加什么项目?
7月26日,国家药典委公示了[b]5个中药标准草案[/b]:[b]黄芪[i][/i]、红参、甘草、人参、西洋参[/b]国家药品标准标准草案。[i][b]涉及的5个药材和饮片品种主要修订内容如下:[/b][/i][b]黄 芪:[/b]拟删除五氯硝基苯农药测定检查项。拟新增赫曲霉毒素A的检查项。[b]红 参:[/b]1. 拟删除红参农药残留检查项中六氯苯、七氯、氯丹的检测指标,统一执行通则0212药材和饮片检定通则项下禁用农药残留要求。2. 农药残留检测项名称修订为“五氯硝基苯”。[b]甘 草:[/b]拟删除五氯硝基苯农药测定检查项。[b]人 参:[/b]1. 拟删除人参农药残留检查项中六氯苯、七氯、氯丹的检测指标,统一执行通则0212药材和饮片检定通则项下禁用农药残留要求。2. 农药残留检测项名称修订为“五氯硝基苯”。[b]西洋参:[/b]1. 拟删除西洋参农药残留检查项中六氯苯、七氯、氯丹的检测指标,统一执行通则0212药材和饮片检定通则项下禁用农药残留要求。2. 农药残留检测项名称修订为“五氯硝基苯”。
为确保标准的科学性、合理性和适用性,我委现将国家药品标准草案公示稿(2024年8月第2批)进行公示,征求社会各界意见,其中中药配方颗粒标准27个、通则6个(详见我委网站)。请认真研核,若有异议,请及时来函提交反馈意见,并附相关说明、实验数据和联系方式。相关单位来函需加盖公章,个人来函需本人签名,同时将电子版发送至指定邮箱。公示期满未回复意见即视为对公示标准草案无异议。[img=,690,1315]https://ng1.17img.cn/bbsfiles/images/2024/08/202408191904053340_6267_6561489_3.png[/img][img=,690,1320]https://ng1.17img.cn/bbsfiles/images/2024/08/202408191904058017_99_6561489_3.png[/img]
当前,随着医药产业的快速发展,我国药品标准的提升也在加速推进,制药企业应对此给予足够的重视,将其作为一种提升企业竞争实力、塑造品牌的有利手段。日前,在2007中国(海口)国际医药高峰论坛上,国家药典委员会副秘书长周福成对制药企业透露了这一信息。 产业进,标准升 周福成表示,当前我国的药品标准正在与医药产业一同发展,企业应更加重视药品标准。随着我国药品注册管理办法的再次修订,3月6日,国家药典委员会也发布了《关于为进一步修订完善国家药品标准征集意见的函》(国药典化发[2007]45号)。这个函就是国家药典委员会结合新版中国药典和药典增补本的编制工作,就现行国家药品标准中仍存在的各种问题,向各药品生产企业、检验机构及相关单位收集相关品种的国家药品标准的相关信息或有关资料,对国家药品标准进一步修订。 周福成认为,药品标准与产业发展密切相关。因为药品标准是技术监督的核心,而药品技术监督是行政市场监管的重要依据。随着科学技术的发展,人们对药品内在的认识也不断加深,对药品的安全要求也就越来越高,相应地必然带来药品标准的提升,而药品标准的提升又会带来产业的整体提升。如在鱼腥草注射液的研究中,技术人员发现较易出现致敏性的不良反应是一种辅料“吐温80”所致,作为一种助溶剂,今后需要考虑使用更加安全的替代品,同时,也需要考虑在药品标准中添加对致敏辅料的限量指标监测。此外,在日趋紧密的药品国际贸易中,我国标准应与国际尽快接轨,避免成为产业发展障碍。而面向未来,还需发展绿色药品标准,加强环境保护和技术人员保护。 重安全,促发展 周福成透露,国家药典委员会正在从以下几个方面抓紧药品标准完善工作。首先,起草注射剂型的安全性标准,主要考虑生物安全性,已经初步定下在药典委员会下设注射剂专项委员会,加深对相关药品标准的研究。周福成还提醒企业,按照修订中的新《药品注册管理办法》,企业药品注册标准获批即自动成为国家标准,药品标准也将成为药企的新竞争力手段,企业可以在自己注册的产品中自主增加更高技术要求的检验项目。比如天津天士力就考虑在新提交的药品标准中引入指纹图谱的项目。此外,企业可随时提出申请修改标准,经审批通过的会在药典增补本标准中列入。这一点对于企业走名牌战略,凭借技术创造领先优势将会有很大的促进作用,甚至有望在未来逐步建立起国家药品标准的竞争机制。 此外,周福成还透露,根据《药品管理法》,我国有关中药提取物的标准、辅料标准、民族药标准、濒危物种入药的替换品等软课题,药典委员会都在研究和准备中,会在今后陆续推出。另据周福成介绍,准备已久的《中药标准薄层彩色图谱》、《中药材红外图谱集》已经进入最后编订阶段,这两本标准已经受到了国际同行的高度关注。
食品药品胶体金分析仪是一种先进的科学仪器,主要用于检测食品和药品中的胶体金含量。胶体金是一种微小颗粒的金纳米材料,具有广泛的应用价值。该分析仪通过采用高精度的技术和方法,能够准确测量食品和药品中的胶体金含量,为生产厂商和消费者提供关键的信息和保障。食品药品胶体金分析仪在功能构成上非常全面,主要包括分光光度模块、新型农残检测模块、胶体金检测模块、荧光检测模块、数字化管理模块等,可以快速检测200多种食品安全项目,如兽药残留、农药残留、非法添加剂、细菌数值等指标。 在使用上,该分析仪操作简便。操作人员只需将待测样品放入仪器中,按照指示进行相应操作即可。在仪器运行一段时间后,可以观察屏幕上显示的结果,根据仪器提供的标准曲线,确定目标物质的浓度。同时,该分析仪通常具有连接电脑的功能,可以方便地导出数据进行进一步的分析和处理。 食品药品胶体金分析仪是一款功能强大、操作简便的仪器,为食品和药品行业的质量控制和安全监测提供了强有力的支持。如需了解更多有关食品药品胶体金分析仪的信息,建议查阅相关文献或咨询专业机构。
常用药品禁贮存通则里有药品禁忌物料表,看列酸类像盐酸硫酸磷酸乙酸等是可以放-起贮存的呀,对不对的呀
打算建立10个左右的药物+主要代谢物联合检测方法,但是我不太清楚是不是这样:1. 先用单个药品标准谱进质谱摸离子对、DP、CE2. 摸[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]条件的时候再把药物混合起来进样?直接换各种梯度条件?我担心的是,一下子10个药物去摸条件的话很难一下子摸到合适的[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相[/color][/url]条件,有点浪费? 还是说摸条件也是先单个药品进样,看一下在什么条件下出峰,并且调整峰形、出峰时间?但是这样的话会不会到时候梯度又不好设置?谢谢大家!!
药匙 是用于取用粉末状或小颗粒状的固体试剂的工具。大多数药匙只有一个勺,通常由金属、牛角或者塑料制成。有些药匙两头各有一个勺,一大一小,实验者可以根据用药量大小选择。注意事项:1.根据试剂用量不同,药匙应选用大小合适的。2.不能用药匙取用热药品,也不要接触酸、碱溶液。3.取用药品后,应及时用纸把药匙擦干净。4.药匙最好专匙专用,用玻璃棒制作的小玻璃勺子可长期存放于盛有固体试剂的小广口瓶中,无需每次洗涤。粉末状药品的取用,取用时可以用药匙(或者纸槽).操作要领是:“一斜、二送、三直立”.具体的操作是:先将试管倾斜,把盛药品的药匙(或者纸槽)小心地送入试管底部,再使试管直立起来。固体药品的取用原则: 1.“三不”原则,即“不闻、不摸、不尝”;具体说就是:不要去闻药品的气味,不能用手触摸药品,不能尝试药品的味道. 2.节约原则,即严格按照实验规定的用量取用药品;没有说明用量时,一般按最少量取用,固体只需盖满试管底部即可. 3.“三不一要”原则,即剩余药品的处理方法.具体是就是:既不能放回原瓶,也不能随意丢弃,更不能拿出实验室,要放入指定的容器内。液体药品的取用原则⒈识记化学实验室药品的一些图标。⒉药品取用的基本原则。⑴实验室取用药品要做到“三不”:不能用手接触药品;不要鼻孔凑到容器口去闻药品的气味;不能尝任何药品的味道。⑵取用药品注意节约:取用药品应严格按规定用量。若无说明,应取最少量,即:液体取1~2mL;固体只需盖满试管底部。⑶用剩的药品要做到“三不”:既不能放回原瓶,也不要随意丢弃,更不能拿出实验室,要放在指定的容器里。⒊固体药品的取用⑴取用固体药品的仪器:医学|教育网搜集整理一般用药匙;块状固体可用镊子夹取。⒋液体药品的取用⑴取用少量液体,可用胶头滴管。滴加到另一容器中的方法是将滴管悬空放在容器口正上方,滴管不要接触烧杯等容器壁,取液后的滴管不能倒放、乱放或平放。⑵从细口瓶倒出液体药品时,先把瓶塞倒放在桌面上,以免沾污瓶塞,污染药液;倾倒液体时,应使标签向着手心,以防瓶口残留的药液流下腐蚀标签;瓶口紧靠试管口或仪器口,以免药液流出。倒完药液后立即盖紧瓶塞,以免药液挥发或吸收杂质。⑶取用一定量的液体药品,常用量筒量取。量液时,量筒必须放平,倒入液体到接近要求的刻度,再用滴管逐滴滴入量筒至刻度线。读数时,视线与量筒内液体的凹液面最低处保持水平。液体药品的取用注意事项 :1、取用不定量(较多)液体——直接倾倒a. 瓶塞必须倒放在桌面上【防止药品腐蚀实验台或污染药品】;b. 直接倾倒时瓶口必须紧挨试管口,试管45度,并且缓缓地倒【防止药液损失】;c. 贴标签的一面必须朝向手心处【防止药液洒出腐蚀标签】;d. 倒完液体后,要立即盖紧瓶塞,并把瓶子放回原处,标签朝向外面【防止药品潮解、变质】。2、 取用少量的液体—使用胶头滴管a. 应在容器的正上方垂直滴入;胶头滴管不要接触容器壁【防止沾污试管或污染试剂】;b. 取液后的滴管,应保持橡胶胶帽在上,不要平放或倒置【防止液体倒流,沾污试剂或腐蚀橡胶胶帽】;c. 用过的试管要立即用清水冲洗干净;但滴瓶上的滴管不能用水冲洗,也不能交叉使用。3、取用一定量的液体—使用量筒a. 当向量筒中倾倒液体接近所需刻度时,停止倾倒,余下部分用胶头滴管滴加药液至所需刻度线;b. 读数时量筒必须放平稳,视线与量筒内液体的凹液面的最低处保持水平 .(注意:俯视则读数偏大,仰视则读数遍小。)
[font=SimSun, STSong, &]新鲜采摘的全株草药(药材)是否属于药品范畴?有依据吗?《药典》里面的基本上都是干品,没有鲜品的表述,那么鲜品到底属不属于药品呢?食品添加鲜品药材是否属于食品加药?[/font]
(首先申明,论文没有公开发表,只是本科答辩论文,现在发布上来参与原创,就算凑个数。)GSP中药品购进管理的思考学生:尚诚 指导老师: 罗玉臻 摘要:GSP是药品经营企业确保其合法、安全经营药品的重要保障,而药品购进管理又是保证药品经营质量的入口关,如何做到药品购进管理的规范和高效,本文围绕药品购进的规范性要求,结合实践重点阐述了药品购进中存在的常见问题及企业通常采取的措施,并对信息化管理技术在药品购进管理中的应用提出了自己的建议。关键词:GSP 药品购进 管理 思考 Reasoning of GSP in the management of leechdom stockAbstract: GSP is an important protection for pharmacy enterprises in order to keep their legal and safe running, in the meantime, the management of leechdom stock is the first step to ensure leechdom qualities. For the sake of meeting the criterion of management of leechdom stock and improve its efficiency, the article shows the existing problems and the general measures of the management of leechdom stock based on the main practice according to the standardization demands of leechdom stock, and set forths the author's advice of applicatoin of Information technology in the management of leechdom stock. Keywords: GSP leechdom stock management reasonGSP是英文Good Supply Practice 的缩写,意即良好的供应规范,一般称为药品经营质量管理规范。GSP 是控制医药商品流通环节所有可能发生质量事故的因素,从而防止质量事故发生的一整套管理程序。医药商品在其生产、经营和销售的全过程中,由于内外因素作用,随时都有可能发生质量问题,必须在所有这些环节上采取严格措施,才能从根本上保证医药商品质量。GSP的主要内容是: 药品批发商必须具备良好的仓库和设施,保证药品在流通过程中不受一切潜在危害的影响;药品批发从业人员应具有较高的从业水平,各部门人员权责明确; 质量部门与业务部门必须分别设立,各自对经理负责,其负责人不得相互兼任;企业质量负责人必须是药师,有较高专业技术水平和丰富的实践经验,在企业内部有较高的质量监督权和控制权;企业对货物出入库和贮存要实行严格管理,建立双人核对制度等。1 GSP 中购进环节质量管理的重要意义 保证药品购进的合法性和质量,从而保证售出药品的质量和药学服务的质量;保证药品购进渠道的合法性和质量;保证交易主体和客体的合法性。 2 GSP中药品购进管理的具体要求2.1企业进货应确定进货企业的法定资格及质量信誉,企业购进的药品应为合法企业所生产或经营的药品;企业进货应审核所购入药品的合法性,应对与本企业进行业务联系的供货单位销售人员,进行合法资格的验证,应按购货合同中质量条款执行。 2.2 企业购进的药品除国家未规定的以外,应有法定的批准文号和生产批号; 企业购进进口药品应有符合规定的,加盖了供货单位质量管理机构原印章的《进口药品注册证》和《进口药品检验报告书》复印件;企业购进的药品包装和标识应符合有关规定和储运要求; 企业购进的中药应标明产地; 购入特殊管理的药品,应严格按照国家有关管理规定进行。 [font=Tim
药品注册,是国家食品药品监督管理局依照《药品管理法》的规定,根据药品注册申请人的申请,对拟上市销售药品的安全性、有效性、质量可控性等进行审查,并决定是否同意其申请的审批过程。在药品研制、生产、流通、使用的全过程监管中,药品注册管理是从源头上对药品安全性和有效性实施监管的重要手段,其根本目的是通过科学评价,保证上市药品安全有效,保障和促进公众健康。 1 2010年药品注册管理的重要举措 2010年,药品注册管理工作继续践行科学监管理念,紧紧围绕“质量和效率”这个中心,以风险效益评估和风险管理为核心,坚持“规范审批、公开透明、鼓励创新”的原则,全面推进体制机制改革和法制建设,强化学药品物研究全程监管,进一步推进审评审批公开公平,提高审评审批效率,较好地履行了《药品管理法》赋予的职责。 1.1 完善药品注册管理法规体系 一是发布了《药物临床试验伦理审查工作指导原则》,规范和指导伦理委员会的药物临床试验伦理审查工作,加强药物临床试验的质量管理和对受试者的保护,提高药物临床试验伦理审查工作质量。继续开展《药用原辅材料登记备案管理规定》、《药品标准管理办法》、《药物临床试验生物样本分析实验室管理规定》、《药物Ⅰ期临床试验管理指导原则》、《药物临床试验中严重不良事件报告与监测管理规定》及天然药物注册技术要求等法规和规范性文件的研究起草工作。
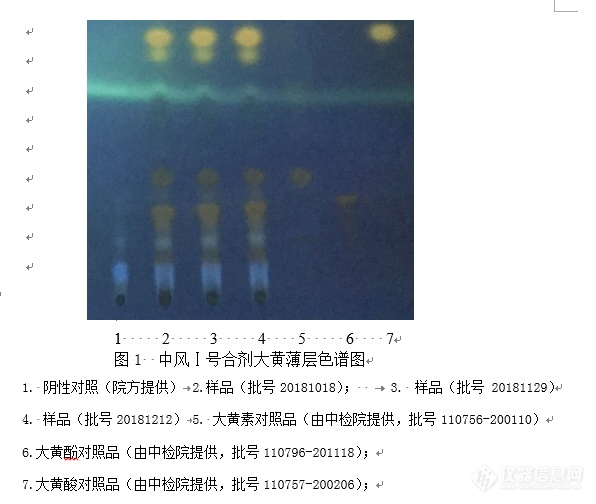
[align=center][b]中风Ⅰ号合剂[/b][/align][align=center][b]医院制剂用药品的原料(药材)和成品的质量标准草案[/b][/align][b]一. 医院制剂用药品的原料(药材)的质量标准草案:[/b](1)大黄:本品为蓼科植物掌叶大黄Rheumpalmatuml.、唐古特大黄Rheumtanguticum.Maxim.exBalf. 或药用大黄RheumoffcihaleBaill. 的干燥根和根茎。秋末茎叶枯萎或次春发芽前采挖,除去细根,刮去外皮,切瓣或段,绳穿成串干燥或直接干燥。应符合中华人民共和国药典2015年版一部23页大黄项下的有关规定。(2)钩藤:为茜草科植物钩藤 [i]Unacaria rhynchophylla[/i](Miq.)Miq.ex Havil.、大叶钩藤[i] Uncaria macrophylla[/i] Wall.、毛钩藤[i]Uncaria hirsuta[/i] Havil.、华钩藤 [i]Uncaria sinensis[/i](Oliv.)Havil.或无柄果钩藤[i]Uncaria sessilifructus[/i] Roxb.的干燥带钩茎枝。秋、冬二季采收,去叶,切段,晒干。主产于[color=#333333]浙江、福建、广东、广西[/color][color=#333333]等省。[/color]应符合中华人民共和国药典2015年版一部257页钩藤项下的有关规定。(3)白芍:为毛莨科植物芍药Paeonia lactiflora PalL.的干燥根。夏、秋二季采挖,洗净,除去头尾和细根,置沸水中煮后除去外皮或去皮后再煮,晒干。主产于[color=#333333]浙江、安徽、四川等省。[/color]应符合中华人民共和国药典2015年版一部105页白芍项下的有关规定。 (4)夏枯草:为唇形科植物夏枯草Prunella vulgarisL.的干燥果穗。夏季果穗呈棕红色时采收,除去杂质,晒干。主产于[color=#333333]江苏、安徽、浙江、河南[/color]等省。应符合中华人民共和国药典2015年版一部280页夏枯草项下的有关规定。(5)浙贝母:为百合科植物浙贝母Fritillariathunbergii Miq.的干燥鱗茎。初夏植株枯萎时采挖,洗净。大小分开,大者除去芯芽,习称“大贝”;小者不去芯芽,习称“珠贝”。分别撞擦,除去外皮,拌以锻过的贝壳粉,吸去擦出的浆汁,干燥;或取鱗茎,大小分开,洗净,除去芯芽,趁鲜切成厚片,洗净,干燥,习称“浙贝片”。主产于[color=#333333]浙江、江苏、湖南[/color]等省。应符合中华人民共和国药典2015年版一部292页浙贝母项下的有关规定。(6)地龙:为钜蚓科动物参环毛蚓Pheretima aspergillum(E.Perrier)、通俗环毛蚓Pheretima vu1garis Chen、威廉环毛蚓Pheretima guillelmi(Michaelsen)或栉盲环毛蚓Pheretima pectinifera Michaelsen的干燥体。前一种习称“广地龙”,后三种习称“沪地龙”。广地龙春季至秋季捕捉,沪地龙夏季捕捉,及时剖开腹部,除去内脏和泥沙,洗净,晒干或低温干燥。[color=#333333]广地龙[/color][i]主产于[/i]广东、海南、广西、福建等省。沪[i]地龙主产于[/i]上海、浙江等省。应符合中华人民共和国药典2015年版一部122页地龙项下的有关规定。(7)石决明:为鲍科动物杂色鲍Haliotis diversicolor Reeve、皱纹盘鲍Haliotis discus hannai Ino、羊鲍Haliotis ovinaGmelin、澳洲鲍Haliotis ruber(Leach)、耳鲍Haliotis asinina Linnaeus或白鲍Haliotislaevigata(Donovan)的贝壳。夏、秋二季捕捞,去肉,洗净,干燥。主产于[color=#333333]浙江、福建、台湾、广东、海南、广西[/color]等省。应符合中华人民共和国药典2015年版一部91页石决明项下的有关规定。(8)鲜竹沥:为禾木科植物粉绿竹Phyllostachys glaucaMcClure、净竹Phyllostachysnuda McClure及同属数种植物的鲜杆经加热后自然沥出的液体,煮沸后,加适量防腐剂制得。主产于四川、江西等省。应符合中华人民共和国卫生部药品标准中药材第一册99页鲜竹沥项下的有关规定。[b]二.医院制剂用药品的成品的质量标准草案:[/b][align=center][b]中风Ⅰ号合剂[/b][/align][align=center][/align][b]【处方】 [/b]大黄60g 钩藤120g 白芍100g 夏枯草150g浙贝母90g 地龙100g 石决明240g 鲜竹沥100ml[b]【制法】 [/b]以上八味药材,除鲜竹沥,其余七味用水浸渍30分钟,煎煮两次,第一次1.5小时,第二次1小时,合并煎液,滤过,滤液静置24小时,取上清液浓缩至约800ml,加入鲜竹沥、甜菊苷、对羟基苯甲酸乙酯和苯甲酸,搅匀,过滤,滤液加水使成1000ml,灌装,灭菌,即得。[b]【性状】 [/b]本品为棕褐色液体,味微苦、甜。[b]【鉴别】 [/b](1)取本品20ml,加盐酸2ml,水浴加热30分钟,放冷,用乙醚振摇提取3次,每次25ml,合并乙醚液,挥干,残渣加甲醇1ml使溶解,作为供试品溶液。取大黄素对照品、大黄酚对照品及大黄酸对照品,加甲醇分别制成每1ml含0.2mg的溶液,作为对照品溶液。照薄层色谱法(中华人民共和国药典2015年版四部 通则0502)试验,吸取上述两种溶液各5μl,分别点于同一硅胶G薄层板上,以石油醚(30〜 60°C)-甲酸乙酯-甲酸(15:5:1)的上层溶液为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的荧光斑点。(2)取本品20ml,用乙醚振摇提取2次,每次20ml,弃去乙醚液,水液用水饱和的正丁醇振摇提取2 次,每次20ml,合并正丁醇液,用水20ml洗涤1次,取正丁醇液,蒸干,残渣加甲醇2ml使溶解,作为供试品溶液。另取芍药苷对照品,加甲醇制成每1ml含2mg的溶液,作为对照品溶液。照薄层色谱法(中华人民共和国药典2015年版四部 通则0502)试验,吸取上述两种溶液各5μl,分别点于同一硅胶G薄层板上,以三氯甲烷-乙酸乙酯-甲醇-甲酸(8:1:2:0.1)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸溶液,在105℃加热至斑点显色清晰。供试品色谱中,在与对照品色谱相应的位置上,显相同颜色的斑点。[b]【检查】 相对密度[/b] 应不低于1.02(中华人民共和国药典2015年版四部通则0601)。[b] pH值[/b] 应为4.0~6.0(中华人民共和国药典2015年版四部 通则0631)[b] 其他 [/b]应符合合剂项下有关的各项规定(中华人民共和国药典2015年版四部 通则0181)。[b]【含量测定】 [/b]照高效液相色谱法(中华人民共和国药典2015年版四部通则0512)测定[b]色谱条件与系统适应性试验[/b] 以十八烷基硅烷键合硅胶为填充剂,以乙腈-0.1%磷酸(14:86)为流动相,检测波长为230nm。理论塔板数按芍药苷峰计算应不低于3000。[b]对照品溶液的制备 [/b]精密称取芍药苷对照品适量,精密称定,加流动相制成每1ml含芍药苷80μg的对照品溶液,即得。[b]供试品溶液的制备[/b] 精密吸取样品1ml,置25ml量瓶中,用流动相稀释并定容至刻度,即为供试品溶液。[b]测定法[/b] 分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。本品含芍药苷(C[sub]23[/sub]H[sub]28[/sub]O[sub]11[/sub])不得少于0.35mg/ml。[b]【功能与主治】 [/b]平肝熄风、化痰通腑。用于各类急性期中风,半身不遂,肢体麻木,口眼喎斜,舌强语蹇。[b]【用法与用量】 [/b]口服,一日2次,一次50ml。或遵守医嘱。[b]【规 格】 [/b] 100ml/瓶。[b]【贮 藏】 [/b] 密封。[b]【有效期】 [/b]2年。[align=center][b]中风Ⅰ号合剂[/b][/align][align=center][b]医院制剂用药品的原料(药材)和成品的[/b][/align][align=center][b]质量标准草案起草说明[/b][/align][b]一.医院制剂用药品的原料(药材)的质量标准草案起草说明:[/b](1)大黄:同正文。 (2)钩藤:同正文。 (3)白芍:同正文。(4)夏枯草:同正文。 (5)浙贝母:同正文。 (6)地龙:同正文。(7)石决明:同正文。 (8)鲜竹沥:同正文。[b]二.临床用药品成品的质量标准草案起草说明:【名称】 [/b]中风Ⅰ号合剂 ZhongfengYihao Heji[b]【处方】[/b] 同正文。[b]【制法】 [/b]同正文。[b]【性状】 [/b]同正文。[b]【鉴别】 [/b]处方由8味中药材组成。本标准建立2项薄层色谱鉴别方中2味药材:大黄、白芍。【鉴别】(1)、(2)均试验了三批样品,并分别与对应的阴性样品进行了比较,均无干扰,且薄层色谱斑点清晰,表明方法可行。[b](1)系方中大黄的定性鉴别。[/b]以大黄素、大黄酚、大黄酸对照品鉴别方中大黄,通过阴性对照试验及三批样品的实验观察,阴性无干扰,专属性强,故选大黄素、大黄酚及大黄酸对照品作为鉴别指标,列入正文(见图1)。[img=,596,504]https://ng1.17img.cn/bbsfiles/images/2019/07/201907010912419216_3978_2166779_3.png!w596x504.jpg[/img][b](2)系方中白芍的定性鉴别。[/b]以芍药苷对照品鉴别方中白芍,通过阴性对照试验及三批样品的实验观察,阴性无干扰,专属性强,故选芍药苷对照品作为鉴别指标,列入正文(见图2)。[img=,690,649]https://ng1.17img.cn/bbsfiles/images/2019/07/201907010913524007_844_2166779_3.png!w690x649.jpg[/img][b]【含量测定】[/b]白芍为方中主药,据《本草拾遗》记载,具有[color=#333333]养血柔肝,缓中止痛,敛阴收汗[/color]的作用。本文采用HPLC法测定中风I号合剂中白芍所含有的芍药苷,在测定波长下,阴性无干扰,方法快捷,简便。因此,本文采用HPLC法测定芍药苷的含量,以达到控制中风I号合剂质量的目的。[b](一)方法[/b]照高效液相色谱法(中华人民共和国药典2015年版四部 0512)测定[b]色谱条件与系统适应性试验[/b] 以十八烷基硅烷键合硅胶为填充剂,以乙腈-0.1%磷酸(14:86)为流动相,检测波长为230nm。理论塔板数按芍药苷峰计算应不低于3000。[b]对照品溶液的制备[/b] 精密称取芍药苷对照品适量,精密称定,加流动相制成每1ml含芍药苷80μg的对照品溶液,即得。[b]供试品溶液的制备[/b] 精密吸取样品1ml,置25 ml量瓶中,用流动相稀释并定容至刻度,摇匀,即为供试品溶液。[b]测定法[/b] 分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。本品含芍药苷([color=#333333]C[sub]23[/sub]H[sub]28[/sub]O[sub]11[/sub][/color])的量不得少于0.35mg/ml。[b](二)方法学考察1 仪器与试药[/b]戴安U3000高效液相色谱仪;梅特勒XS205DU电子天平;艾科浦超纯水器。中风I号合剂由福建省南平市人民医院制剂室提供。芍药苷对照品(批号110736-201842,含量97.4%)购自中国食品药品生物检定研究院。乙腈为色谱纯;水为超纯水。[b]2 方法与结果2.1 色谱条件[/b]色谱柱:Welch Ultimate XB-C18(4.6mm×250mm,5μm);流动相:乙腈-0.1%磷酸(14:86)检测波长:230nm;流速:1.0mlmin[sup]-1[/sup];柱温:30 ℃;进样量:10μl理论塔板数:按芍药苷峰计算应不低于3000。[b]2.2 提取方法的选择 [/b]在供试品溶液的制备中,进行了直接稀释法、超声法的对比研究,结果两者无显著性差别,从操作简便快捷的角度选择直接稀释法,结果见表2。 表2 芍药苷不同提取方法含量测定结果比较 [table=594][tr][td] [align=center]提取方法[/align] [/td][td] [align=center]芍药苷含量(mg/ml)[/align] [/td][td] [align=center]平均含量(mg/ml)[/align] [/td][/tr][tr][td=1,2] [align=center]稀释法[/align] [/td][td] [align=center]0.6890[/align] [/td][td=1,2] [align=center]0.69[/align] [/td][/tr][tr][td] [align=center]0.6888[/align] [/td][/tr][tr][td=1,2] [align=center]超声法[/align] [/td][td] [align=center]0.6892[/align] [/td][td=1,2] [align=center]0.69[/align] [/td][/tr][tr][td] [align=center]0.6890[/align] [/td][/tr][/table][b]2.3 溶液的制备[/b]2.3.1对照品储备液的制备 精密称取芍药苷对照品10mg,置10ml量瓶中,用甲醇溶解并稀释至刻度,制得对照品储备液(0.974g/L芍药苷)。2.3.2 供试品溶液的制备 精密吸取样品1ml,置25ml量瓶中,用流动相稀释并定容至刻度,摇匀,即为供试品溶液。2.3.3 阴性对照溶液的制备 按处方比例制备不含芍药苷的阴性样品,同2.3.2制备方法制备阴性对照溶液。[b]2.4 线性关系考察[/b]将芍药苷对照品储备液逐步稀释,得到浓度分别为4.87,9.74,24.35,48.70,73.05,97.40μg/ml六个浓度的系列标准溶液,进样测定,结果见表3 [table][tr][td=3,1] [align=center]表3 芍药苷线性关系测定结果[/align] [/td][/tr][tr][td] [align=center]进样体积(μl)[/align] [/td][td] [align=center]芍药苷浓度(μg/ml)[/align] [/td][td] [align=center]峰面积(mAU*min)[/align] [/td][/tr][tr][td] [align=center]10[/align] [/td][td] [align=center]4.87[/align] [/td][td] [align=center]1.105[/align] [/td][/tr][tr][td] [align=center]10[/align] [/td][td] [align=center]9.74[/align] [/td][td] [align=center]2.252[/align] [/td][/tr][tr][td] [align=center]10[/align] [/td][td] [align=center]24.35[/align] [/td][td] [align=center]5.853[/align] [/td][/tr][tr][td] [align=center]10[/align] [/td][td] [align=center]48.70[/align] [/td][td] [align=center]11.909[/align] [/td][/tr][tr][td] [align=center]10[/align] [/td][td] [align=center]73.05[/align] [/td][td] [align=center]17.511[/align] [/td][/tr][tr][td] [align=center]10[/align] [/td][td] [align=center]97.40[/align] [/td][td] [align=center]23.240[/align] [/td][/tr][/table]以峰面积(Y)为纵坐标,以芍药苷浓度(X)为横坐标绘制标准曲线。结果表明,芍药苷在4.87~97.40μg/ml的范围内线性关系良好(见图3)[img=,611,350]https://ng1.17img.cn/bbsfiles/images/2019/07/201907010916394318_5586_2166779_3.png!w611x350.jpg[/img][img=,650,539]https://ng1.17img.cn/bbsfiles/images/2019/07/201907010916445229_4881_2166779_3.png!w650x539.jpg[/img][img=,631,383]https://ng1.17img.cn/bbsfiles/images/2019/07/201907010916515496_9756_2166779_3.png!w631x383.jpg[/img][img=,618,717]https://ng1.17img.cn/bbsfiles/images/2019/07/201907010916572812_7861_2166779_3.png!w618x717.jpg[/img][img=,646,703]https://ng1.17img.cn/bbsfiles/images/2019/07/201907010917032958_603_2166779_3.png!w646x703.jpg[/img][b]【功能与主治】 [/b] 同正文。[b]【用法与用量】 [/b] 同正文。[b]【规 格】 [/b] 同正文。[b] 【贮 藏】 [/b]同正文。[b]【有效期】 [/b]同正文。
[color=#00008B][B]几年来国内在食品药品行业内出现的问题层出不穷,食品以奶粉为典型,药品以中药注射液为头等,透露了我国对食品、药品检测及监管的漏洞。以下对几年来发生的药品事件做个回顾:[/B][/color][color=#00008B][B]国内医药事件:[/B][/color][color=#DC143C]1、安徽华源生物药业有限公司生产的克林霉素磷酸酯葡萄糖注射液(欣弗)(时间为2006年)[/color]国家食品药品监督管理局2006年8月10日召开新闻发布会,通报了对安徽华源生物药业有限公司生产的克林霉素磷酸酯葡萄糖注射液(欣弗)引发的药品不良事件调查进展:国家食品药品监督管理局会同安徽省食品药品监督管理局对安徽华源生物药业有限公司进行现场检查,经对2006年6月至7月份所生产的克林霉素磷酸酯葡萄糖注射液的生产过程核查,初步分析认定,企业未按批准的生产工艺进行生产,生产记录不完整,这有可能是导致药品集中出现不良事件的原因。药品检验工作正按程序进行。对不良事件的报告病例与药品之间的关联性评价工作正加紧进行。经查,安徽华源生物药业有限公司自2006年6月份以来共生产该产品3701120瓶,销售出3186192瓶,流向全国26个省份。除未售出的已被封存外,截至到8月9日13点,企业已收回755053瓶,收回途中有185528瓶,异地查封161217瓶待收回,合计1586498瓶。目前流向市场的涉及药品已得到控制。[color=#DC143C]2、国家药监局:7类鱼腥草注射液被暂停(时间为2006年)[/color]鉴于鱼腥草注射液、新鱼腥草素钠氯化钠注射液、新鱼腥草素钠注射液、注射用新鱼腥草素钠、复方蒲公英注射液、炎毒清注射液、鱼金注射液等7类含鱼腥草或新鱼腥草素钠的注射液在临床应用中出现严重不良反应,国家食品药品监督管理局1日发布通告,决定从即日起在全国范围内暂停使用,同时暂停受理和审批相关各类注册申请。不过自2007年10月到2008年,广东博罗先锋药业、江西保利制药等七家公司已分批被同意恢复鱼腥草注射液(2ml)的肌内注射使用,但对占鱼腥草注射液95%市场份额的静脉滴注用注射液还在进行再评价工作。 由于存在比较严重的不良反应,2006年6月1日,国家食品药品监督局曾发布了《关于暂停使用和审批鱼腥草注射液等7个注射剂的通告》。“鱼腥草叫停事件”一度引起空前关注。[color=#DC143C]3、广东佰易事件(时间为2007年)[/color]广东佰易药业有限公司人狂犬病免疫球蛋白等7个品种22个药品的批准文号,日前被国家食品药品监管局注销。广东佰易药业有限公司已经被依法吊销《药品生产许可证》,根据《药品注册管理办法》的有关规定,该公司所持有的人狂犬病免疫球蛋白、人血白蛋白、人免疫球蛋白、静脉注射用人免疫球蛋白、人乙型肝炎免疫球蛋白、组织胺人免疫球蛋白、静脉注射用人免疫球蛋白等药品的批准文号自行废止。广东佰易药业有限公司在生产静脉注射用人免疫球蛋白产品过程中,存在严重违规行为。临床应用中发现,该企业的部分产品导致用药者出现丙肝抗体阳性。据了解,除广东佰易药业有限公司之外,1年来,齐齐哈尔第二制药有限公司、福建省天神药业有限公司、河南省许昌华仁制药有限公司,以及保定三九济世生物药业有限公司抗肿瘤药品车间等,因严重违法生产受到严厉制裁,被吊销《药品生产许可证》。[color=#DC143C]4、茵栀黄注射液事件(时间为2008年)[/color]2008年10月19日,卫生部通报了陕西省延安市志丹县医院因使用山西太行药业股份有限公司生产的茵栀黄注射液(批号为071001)后,有4名新生儿发生不良反应,其中1名出生9天的新生儿于10月11日死亡。卫生部要求各地立即停止该批号茵栀黄注射液的临床使用。山西太行药业20日就此发布公告称已主动召回该批次产品,并暂停其他所有批次同型号产品的使用。12月29日,山西省食品药品监督管理局公布,山西太行药业有限公司生产的茵栀黄注射液经国家和省药品检验机构检验后,符合国家药品标准。如此快速的解决了药品不良反应事故,比较少见。而太行药业也有惊无险,其产品依然广泛使用并受好评。[color=#DC143C]5、刺五加事件(时间为2008年)[/color] 2008年10月6日,国家食品药品监督管理局接到云南省食品药品监督管理局报告,云南省红河州6名患者使用了标示为黑龙江省完达山制药厂(2008年1月更名为黑龙江完达山药业公司)生产的两批刺五加注射液(批号: 200712272 1、200712151 1,规格:100ml/瓶)出现严重不良反应,其中有3例死亡。10月7日,国家食品药品监督管理局同卫生部组成联合调查组,在云南、黑龙江两省地方政府及相关部门的配合下,对事件原因展开调查。经查,这是一起由药品污染引起的严重不良事件。完达山药业公司生产的刺五加注射液部分药品在流通环节被雨水浸泡,使药品受到细菌污染,后被更换包装标签并销售。[color=#DC143C]6、江西博雅生物制药公司静脉注射用人免疫球蛋白事件(时间为2008年)[/color]2008年6月1日,江西省食品药品监督管理局向媒体通报,该局5月28日接到报告,5月22日至28日,先后有6名在南昌大学第二附属医院就诊的患者,在使用标识为江西博雅生物制药公司生产的批号为20070514、规格为5%2.5g的静脉注射用人免疫球蛋白(PH4)(液体)发生死亡。[color=#DC143C]5、复方丹参滴丸事件(时间为2009年)[/color]最近有专家在接受相关媒体采访时披露,国内治疗心脑血管疾病用药最广泛的一种中成药叫复方丹参滴丸,存在严重副作用,并且不良反应率达到3.11%,并且通过长期的试验,国家食品药品监督管理局新闻发言人颜江瑛昨日对此作出上述回应。 国家食品药品监督管理局会考虑药品的风险和效益,所以该药品在市场上进行销售和使用时都已要求进行皮试。如果上市药品出现不良反应,将会对上市的药品进行几个方面的处理,一是修改药品说明书;二是生产工艺也许有问题,让它调整和修改生产工艺;三是暂停销售和使用;四是测试,这是我们在药品出现问题后的几种处理方式。 国家食品药品监督管理局透露复方丹参滴丸是根据复方丹参滴丸片进行改剂申报的,无论是改剂型仿制药还是创新药,都是按照注册管理相应申报资料的要求研制单位进行研究的。 [color=#DC143C]6、哈药集团"双黄连"致死事件(时间为2009年)[/color]今年2月11日,卫生部、国家食品药品监督管理局接到报告,青海省大通县3名患者使用标识为黑龙江乌苏里江制药有限公司佳木斯分公司生产的双黄连注射液发生不良反应,并有1例死亡。2月12日,卫生部、国家食品药品监督管理局联合发出紧急通知,要求立即暂停使用和销售该企业生产的双黄连注射液。国家食品药品监督管理局已宣布该厂生产的双黄连注射液经过国家标准的检查,产品质量没有问题,而之前黑龙江和青海药监所也分别作出了产品质量合格的结论。导致此次事件发生的原因是一些医生所开出的联合处方,没有注意到说明书中不能与某些药物混用的提示,违反用药规律,混乱用药,造成了患者死亡。[color=#DC143C]7、清开灵注射液出现不良反应(时间为2009年)[/color]根据国家药品不良反应监测中心通报,近年来陆续收到清开灵注射剂的严重不良反应/事件的报告,其中以全身性损害、呼吸系统损害为主,另外还出现皮肤及其附件、神经系统、心血管系统等的损害。对清开灵注射剂死亡病例报告的分析显示,81%的患者存在合并用药(联合用药)情况,8%存在多种药物混合静脉滴注的情况。而除药品因素外,不排除原患疾病进展、合并用药、过敏体质、救治不及时或不当等因素。此外,死亡病例中,27%的患者为14岁以下儿童。不合理用药、临床使用不规范,是造成中药注射剂不良事件的主要原因,不能归咎于中药注射剂本身的安全性。========================================================================================================================================[color=#00008B][B]国外医药事件(时间为2006年)[/B][/color][color=#DC143C]1、博士伦事件[/color]发生在新加坡的“博士伦事件”(2006年初,新加坡有7名市民患上由真菌引发的角膜炎,患者均戴过隐形眼镜。自去年5月以来,当地共发现19人受影响,其中18人曾使用博士伦公司生产的多功能隐形眼镜护理药水。——记者注)同样让中国公众紧张了一下。很快,北京、广州、杭州、南京、成都等地暂停销售美国工厂生产的进口润明水凝护理液。6月9日,博士伦公司证实,该公司生产的润明水凝护理液配方确实存在问题,可能导致眼角膜真菌感染。
因广告内容严重误导消费者,天津市食品药品监督管理局近日发出通知,决定对“鸿茅药酒”“蛤蚧大补胶囊”等14种药品和2种医疗器械实施暂停销售的行政强制措施,并将上述品种列为重点抽样品种。 天津市食品药品监督管理局介绍,这些药品和医疗器械广告内容中存在含有表示功效的断言和保证、利用患者名义和形象为产品功效作证明、扩大产品适应症或适用范围、绝对化夸大疗效等欺骗和严重误导消费者的情形。 天津市食品药品监督管理局表示,为保障人民群众用药安全有效,保护消费者的合法权益,暂停这些药品、医疗器械在全市范围的销售,各执法单位将加大对违法广告涉及企业的监督检查频次,同时,违法广告品种的生产企业应在违法广告的原发布媒体上发布更正启事以消除不良影响。 这14种药品分别是厦门中药厂有限公司生产的福寿胶囊、通化久铭药业有限公司生产的甘露消渴胶囊(糖康一号)、内蒙古鸿茅药业有限责任公司生产的鸿茅药酒、乌兰浩特中蒙制药有限公司生产的珍珠通络丸(蒙古红药)、哈尔滨华雨制药集团有限公司生产的木竭胶囊、通化神龙药业股份有限公司生产的脑心安、吉林省辉南辉发制药有限公司生产的耳聋左慈丸、吉林九鑫制药股份有限公司生产的偏瘫复原丸、辽源誉隆亚东药业有限责任公司生产的复方脑蛋白水解物片、河南辅仁堂制药有限公司生产的复方杜仲胶囊、武汉健民大鹏药业有限公司生产的蛤蚧大补胶囊、广州陈李济药厂有限公司生产的舒筋腱腰丸、长春人民药业集团有限公司生产的固本强身胶囊和通化茂祥制药有限公司生产的益肾康胶囊(耙齿菌)。 暂停销售的2种医疗器械分别是河南凌云医药科技有限公司生产的腰枕治疗仪(曲度腰枕)和天水魏氏药业有限公司生产的魏氏磁疗骨痛帖。
关于化学药品标准提高品种所需样品 及资料报送要求的通知 各有关生产企业: 为切实做好国家化学药品标准提高工作,我委已安排并计划在近期内陆续安排系列化学药品标准的提高任务,其中2010年和2011年度化学药品标准提高的品种名单已在国家药典委员会外网公示(含起草单位和复核单位),请各生产企业(含进口药品生产企业)密切关注相关信息并积极配合此项工作,及时向起草单位提供相应品种的样品和资料(具体要求见附件)。国家药品标准草案的起草和复核等相关单位负责生产工艺等相关内容的保密工作。 鉴于药品生产工艺等有关内容及该工艺下生产的样品是质量标准起草工作的重要依据,为鼓励更多的企业参与到此项工作中,我委拟在外网公示某化学药品标准草案征求社会意见的同时公示提供资料和样品或以其他方式积极参加国家化学药品标准提高工作的企业名单;对不提供样品及相应生产工艺等资料的企业,将不再考虑其修改标准的意见。 附件:关于生产企业提供国家药品标准提高品种有关资料及样品的要求
食品药品胶体金分析仪具有多重优势,使其在食品安全和质量检测领域占据重要地位。以下是该分析仪的主要优势: 高灵敏度与准确性:食品药品胶体金分析仪采用表面增强技术,能够提供极高的检测灵敏度,能够准确检测到低浓度的胶体金。这使得分析仪在食品安全检测中能够精确捕捉微小但可能具有重大影响的污染物,从而确保食品的安全性和合规性。 快速检测:该分析仪的分析过程通常快速简便,可以在几分钟内得出结果,无需繁琐的样品前处理。这种快速检测能力使得分析仪在应对突发食品安全事件或大量样品检测时具有显著优势,能够迅速作出反应并提供及时的数据支持。 多功能性:食品药品胶体金分析仪具有广泛的应用范围,可以检测多种类型的食品和药品样品,如饮料、食品添加剂、药物制剂等。同时,它还可以检测兽药残留、农药残留、非法添加剂、细菌数值等多种食品安全指标,为食品安全监管提供了全面的解决方案。 智能化与便捷性:分析仪通常配备液晶触摸屏显示和智能操作系统,使得操作更加简便直观。此外,一些高级型号还具有自动保存检测结果、数据管理和传输等功能,方便用户进行数据分析和追溯。 高可靠性与稳定性:食品药品胶体金分析仪采用先进的检测技术和高质量的组件,确保了其在长期使用中的稳定性和可靠性。这使得分析仪能够持续提供准确、可靠的数据,为食品安全监管提供有力支持。 综上所述,食品药品胶体金分析仪以其高灵敏度、快速检测、多功能性、智能化和可靠性等优势,在食品安全和质量检测领域发挥着重要作用。它为食品生产厂商、监管部门和消费者提供了强大的技术保障,有助于确保食品的安全和质量。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/04/202404231527520748_5003_4214615_3.jpg!w690x690.jpg[/img]
越来越多的事实证明,[U][B]单一依靠药品标准不足以作为药品质量合格的判断[/B][/U],[color=#DC143C]首先是因为国家药品标准只是作出判断的必要条件,而不是充分必要条件;其次作出判断往往是依据药品检验报告,但仅凭此而作出药品合格的结论也缺乏可靠性。[/color][color=#00008B][U][B]因此,药品生产企业应该对所生产的药品质量负责。[/B][/U][/color] 国家药品标准是作为衡量药品质量的尺度和判断是否违法的标准,但是越来越多的事实证明,单一依靠药品标准不足以作出以上判断,首先是因为国家药品标准只是作出判断的必要条件,而不是充分必要条件,其次作出判断往往是依据药品检验报告,但由于国家药品标准不可能将所有物质作出检验的规定,而只是保证药品安全、有效前提下,在必要、可能的范围进行选择的结果。所以,仅仅以药品检验报告为基础,作出药品合格的结论缺乏可靠性,已经有若干因药品质量发生的人身损害案件,但以执行的国家药品标准检验来看却是合格的。 [color=#DC143C][B]国家药品标准的定义究竟是什么?[/B][/color]在先的一些文章和教材、专著中多解释为药品生产、检验的法定依据,甚至还有解释为药品检验法定依据之说。尽管说法之多,但可能在作出这些解释时,并没有全面研究过国标以及药品标准在药品生产、经营、使用和管理中的作用。国家药品标准实际上应该是药品来源(如中药材)、药品生产(如中成药、生物制品)、药品检验、药品经营(如贮藏条件)、药品使用(如类别、功能主治、适应症、用法用量、注意事项、禁忌等)的规范。这些规范或来源于药品研究(如新药);或来源于对上市后药品的再评价;或来源于经验的总结(如中药)。依提出国家药品标准主体的不同,分为药品生产企业(新药)和国家药品监督管理部门,依权利的不同分为依申请(新药、仿制药、药品注册补充申请),依职权颁布(《中国药典》等),依强制程度不同分为国家药品标准和企业药品标准(部分项目高于国家药品标准,或者在国家药品标准基础上增加有关检测项目仅在本企业内部执行,或者和相对人约定执行的药品标准)。不言而喻,国家药品标准具有国家强制力,必须遵守和执行,而企业标准可以依约定在执行国家药品标准的基础上,由相对人遵守和执行。 制定国家药品标准的基础,是基于药品注册申请人的研究资料和国家对于药品上市的基本要求,或者是允许已上市药品继续生产、使用的基本规定。因此,凡是在研究申报资料基础上,生产工艺、原料、辅料、包装材料、关键人员等基础发生变化时,其药品标准相关项目则可能发生变化,此时,单以检验项目是否合格作为判断药品质量的依据时则可能出现误判。仅以检验结果作为药品质量评价指标则可能出现错误,换句话讲,检验合格不等于药品合格。因此,在一定意义上,国家药品标准是有限标准,有前提的标准。但是,检验不合格药品却是可以作出不合格的结论,检验的主要意义就在于此。要准确地评价药品质量,应该是结合标准的检验结果、GMP、GCP等规范执行情况的评价,才可能综合得出药品质量的正确结论,因此,应该对公布药品抽验合格率的必要性进行研究。 药品生产企业应该对所生产的药品质量负责,而不能仅仅是依国家药品标准检验合格作为上市的标准。长期以来,人们相信药品质量是生产出来的,而不是检验出来的,这种观点反映出对生产管理的重视。但更为全面的质量观点应该是药品质量始于药品的研究和生产设计,因为有缺陷的设计和研究,即使再规范的生产管理,仍然是有缺陷的药品,或称为不合格的药品,因此,引入了广义的合格药品应该是符合安全、有效要求的药品是合格药品的概念。在《民法通则》、《产品质量法》、《侵权责任法(草案)》等均将设计或者研究缺陷纳入产品缺陷范畴。因此,在修订《药品管理法》时应该将药品的设计缺陷作为研究的内容之一,比如隐瞒研究中的不利结果,违反科学研究规范,错误地得出或者捏造有利于上市的数据而获得药品上市许可,如果药品上市以后发生人身伤害事故,应当承担侵权责任,这种责任延续至药品上市以后药品生产者待遇履行药品的再评价义务,而药品的再评价包括了质量、安全性和有效性。当然要求药品生产企业履行这些义务,必须从法律上授予权利加以保证,解决目前药品生产企业难以收集医疗机构使用所生产品种的安全性和疗效的数据问题,而医疗机构必须履行提供相关资料的义务。
食品药品胶体金分析仪是一种先进的科学仪器,专门用于检测食品和药品中的胶体金含量。该分析仪通过高精度的技术和方法,能够准确测量食品和药品中的胶体金含量,为生产厂商和消费者提供关键的信息和保障。 胶体金分析仪的工作原理基于胶体溶液中纳米颗粒的光学性质,通过测量光的散射强度来得到颗粒的浓度信息。当光与金纳米颗粒相互作用时,根据散射光的洛仑兹-米耳斯理论,可以得到散射强度与颗粒的浓度之间的关系。仪器中的光源会照射到样品中的金纳米颗粒上,部分光会被颗粒散射并检测到。然后,光学传感器,如光电二极管或光散射仪,会测量散射光的强度,并将其转化为电信号。最后,分析仪会处理这些电信号,进而计算出颗粒的浓度。 这种分析仪具有多种功能模块,如分光光度模块、新型农残检测模块、胶体金检测模块、荧光检测模块以及数字化管理模块等,可以快速检测200多种食品安全项目,包括兽药残留、农药残留、非法添加剂、细菌数值等指标。此外,它还具有15.6英寸液晶触摸屏显,搭配运行安卓智能操作系统,使得操作更为方便且性能更强。 食品药品胶体金分析仪在多个领域都有广泛的应用,如食药监局、卫生部门、高教院校、科研院所、农业农村局、食品深加工企业及检验检疫部门等。其高灵敏度、高准确度和高效率的特点,使得它成为食品安全和质量检测的重要工具。 总的来说,食品药品胶体金分析仪是一款集多功能于一体的先进检测设备,为食品和药品行业的质量控制和安全监测提供了强有力的支持。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2024/04/202404231526532789_7703_4214615_3.jpg!w690x690.jpg[/img]
日前,为加强药品、医疗器械、保健食品广告监督管理,整治违法发布广告行为,进一步规范广告发布秩序,国家食品药品监督管理局发布了2011年第2期违法药品、医疗器械、保健品广告公告汇总。 根据《药品广告审查办法》、《医疗器械广告审查办法》和《保健食品广告审查暂行规定》的有关规定,国家食品药品监督管理局对近期各省(区、市)食品药品监督管理部门违法广告监测情况进行了汇总,公告曝光了北京长城制药厂生产的药品“利脑心片”、西安大唐制药集团有限公司生产的药品“醒脾开胃颗粒”、云南通用善美制药有限责任公司生产的药品“溶栓脑通胶囊”、呼伦贝尔松鹿制药有限公司生产的药品“舒筋丸”、内蒙古乌兰浩特中蒙制药有限公司生产的药品“抗骨质增生丸”、贵州飞云岭药业股份有限公司生产的药品“隔山消积颗粒”、广西平南制药厂生产的药品“前列清茶”、保健食品“智灵牌冬虫夏草胶丸”(卫食健字第040号)等8个违法发布广告的药品、保健食品。 本期公告汇总期间,各省(区、市)食品药品监督管理部门以发布违法广告公告等方式,通报并移送同级工商行政管理部门查处的违法药品广告 15182次、违法医疗器械广告449 次、违法保健食品广告 793次。对未经审批擅自发布、严重篡改审批内容进行违法宣传的广告,各省(区、市)食品药品监督管理部门共撤销和收回药品广告批准文号4个、保健食品广告批准文号22个。对违法广告涉及产品采取了252 次暂停销售的行政强制措施。 国家食品药品监督管理局提醒广大消费者,要在医生或药师的指导下购买药品;保健食品没有治疗作用,不能代替药品,请谨慎购买。 【相关链接】 关于发布2011年第2期违法药品医疗器械保健食品广告公告汇总的通知
关于“已有国家标准”这个词汇,其实SFDA无意中闹了点笑话。SFDA的“已有国家标准”想要说的意思其实是:“建国以来卫生部和之后的药监局批准过并公布了标准的国产品种”以及“1998年药监局成立之后批准过的进口品种”,可是,确实很难用一个简单的词概括上述范围,于是,SFDA在缺乏对相关法规研究的情况下,就使用了“已有国家标准”这个词——这是不妥当的。首先,我们不妨来说说,什么是“标准”,“标准”这个词,所对应的英文即是“specification”,ICH的相关指南中已经明确的定义了,观其精髓,在于:由生产商提出并验证;由药监管理机构批准;是批准产品的必要条件。由这个定义可知,药品的“标准”其实相当于中国质监管理中的所谓“企业标准”。——我们知道,按现代的工业生产质量控制和监督的理念,任何产品都是要有 “标准”,所谓的“合格产品”也就是符合“标准”要求的产品,“不合格产品”则是不符合“标准”规定的产品,没有“标准”则无从谈质量监督,更无从谈责任和管理,是以任何产品都必须有标准。然而,标准在国内是分不同等级的,通常来说即“国家标准”、“地方标准”、“行业标准”、以及“企业标准”。具体法规可研读《中华人民共和国标准化法》和《中华人民共和国标准化法实施条例》,为了节省大家的时间,我简单概括整理一下,如下:国家标准和行业标准理论上有“强制性”和“推荐性”之分(我们常见到的“GB/T”打头的标准代号,其中的“GB”就是“国家标准”的代号,“T”就是 “推荐”的代号),但是,法规又说了:“可能危及人体健康和人身、财产安全的工业产品,必须符合保障人体健康和人身、财产安全的国家标准、行业标准。” (见:《中华人民共和国产品质量法(2000年修正)》)——你想想,所有工业产品中,不可能“危及健康和人身、财产安全的”还真没有几件,绝大多数产品细究起来,都是“可能危及人体健康和人身、财产安全”的,——也就是说,管你是什么产品,实际操作中您也别看啥推荐不推荐,统统的去按照国标和行标办事准没错,否则难免自误。注意:按《标准化法》的规定,药品的国家和行业标准,是强制标准。在没有国家标准的情况下,各省\自治区\直辖市可以就工业产品的“安全、卫生要求”方面制定地方标准,该标准在当地是强制性的,例如北京质监部门制定的《奥运会食品安全执行标准和适用原则》就属于“地方标准”。——一旦有相应国家标准出台,则地方标准自动废止。若是没有相应国家标准和行业标准的产品,企业必须提交自己制定的“企业标准”,而有国标和行标的话,国家鼓励企业制定比国家标准和行业标准更高的企业标准,在企业内部施行。必须注意的是这段法规,“工程建设、药品、食品卫生、兽药、环境保护的国家标准,分别由国务院工程建设主管部门、卫生主管部门、农业主管部门、环境保护主管部门组织草拟、审批;其编号、发布办法由国务院标准化行政主管部门会同国务院有关行政主管部门制定。”也就是说,我们制药行业的标准制定、标准出版、产品生产、质量监督都是独立的,不是由质监部门而是由药监部门来负责。但在根源上,所谓国家标准的定义还是按照《标准化法实施条例》所述的“由国务院标准化行政主管部门编制计划,组织草拟,统一审批、编号、发布的标准”,这才是“已有国家标准”的真正含义,由此可见,SFDA的05版《药品注册管理办法》所说的“已有国家标准”药品,其实和《标准化法》中“国家标准”的概念不一致的。例如,SFDA认为98年后批准进口的药品也属于“已有国家标准”,这是法理的错误,所谓的进口药品,所提交的仅仅是“进口标准”,也就是相当于“企业标准”,作为区区一介外企,其提交的进口标准,怎能认为是“国家标准”?前面说过,必须是“由国务院标准化行政主管部门编制起草审批”的标准,才能是“国家标准”。而且,根据《标准出版发行管理办法》国家标准是必须要出版公布的,但我们知道,大家是无法从正规渠道搞到进口药品的标准的,这些进口标准是不出版不公开的,它们其实只是“企业标准”而已,作为企业标准,由于其涉及企业的商业秘密,企业在提交时就有权要求保密。——搞清楚了这一点,我们就能更清楚的明了为什么《药品注册管理办法》的“已有国家标准”的提法不合适。
我国拟建食品药品安全“黑名单” 中国政府法制信息网12日公布国家食品药品监管总局起草的《食品药品安全“黑名单”管理规定﹙征求意见稿﹚》。根据这一规定,我国拟建立食品药品安全“黑名单”,将因严重违反食品、药品、医疗器械、化妆品管理法律、法规、规章,受到行政处罚的生产经营者及责任人员等有关信息,通过政务网站公布,接受社会监督。 规定明确,食品生产者采购、使用不符合食品安全标准的食品原料、食品添加剂、食品相关产品,或在食品中添加药品,情节严重受到责令停产停业、吊销许可证行政处罚等食品、药品、医疗器械、化妆品生产经营行为,将被纳入“黑名单”范围。 规定要求,食品药品监督管理部门应当按照谁处罚谁公布的原则,作出行政处罚决定后十五个工作日内,将应当纳入食品药品安全“黑名单”的生产经营者、责任人员、涉案产品的相关信息在其政务网站上公布。公布的信息应包括:违法生产经营者和相关责任人的信息,以及涉案产品相关信息,包括产品名称、批次、标识、批准文号、生产许可证号等。 食品药品监督管理部门将纳入“黑名单”的生产经营者记入监管信用档案,并采取增加检查和抽验频次等措施,实施重点监管。纳入食品药品安全“黑名单”的生产经营者、责任人员,再次发生违法违规行为的,依法从重处罚。同时,食品药品安全“黑名单”纳入食品药品监管信用体系,按照国家有关规定进行管理。
包括俏妹牌减肥胶囊、欣力美牌减肥片在内的7种产品,近日在卫生部保健品专项抽查中被检测出含化学药品。目前,它们已被紧急叫停。据了解,此次被叫停的7种“保健品”多为减肥药品,分别被检测出含有西布曲明、酚酞、盐酸苯乙双胍、格列本脲、盐酸吡格列酮等化学成分。其中,西布曲明属于违禁成分,食用后对人体血压、肝功能方面副作用较大。国家食品药品监督管理局于2010年10月叫停了所有西布曲明制剂及原料药品,本次公布的假冒产品中,4种减肥药品均含有西布曲明。河南省药监局提醒消费者不要购买上述产品,一经发现违法产品,及时向当地食品药品监督管理部门举报。同时,消费者也可以登录国家食品药品监督管理局官方网站查询保健食品的许可信息。据了解,这七种“保健品”为:俏妹牌减肥胶囊(包装上或标有蔬果减肥或标有清脂三天瘦或标有靶向减肥丸或标有蜂蜜苹果醋瘦身胶囊)、辅美牌洋参芪杞胶囊(干细胞活胰肽)、唐乐胶囊、欣力美牌减肥片(包装上标有左旋肉碱嚼嚼瘦或者包装上为苹果醋减肥咀嚼片)、富昕康OB蛋白素胶囊、雪蓝奇减肥胶囊、肽盈美减肥胶囊。