远志系陕西道地药材,是“秦药”大宗道地药材品种之一[1]。《中国药典》2020年版所收载的远志为远志科(Polygalaceae)植物远志Polygala tenuifolia Willd.或卵叶远志P. sbirica L.的干燥根[2],具有镇静安神、祛痰开窍、解毒消肿等功效[3]。现代研究表明,远志的主要活性成分有皂苷类、寡糖酯类、酮类等,具有抗记忆障碍、保护中枢神经系统、抗抑郁、抗心肌缺血和抗肿瘤等作用[4]。目前,关于远志的研究多集中于含量研究[5]、活性测定[6]、遗传多样性分析等[7]。随着分子生药学的发展,对药用植物相关活性成分生物合成途径相关调控基因、转录因子的挖掘已成为研究热点,基因组学、转录组学等技术在远志上的成功应用,也为远志基因家族的筛选、鉴定与分析提供了技术支撑和数据基础[8]。 碱性亮氨酸拉链(bZIP)基因家族作为真核生物中转录网络的重要开关,是植物中最大的转录因子家族之一。bZIP结构域由两个区域组成,即DNA结合基本区和亮氨酸拉链区[9]。bZIP基因家族成员通过差异基因网络或生物过程,在调节植物发育、生长以及盐胁迫响应等方面发挥着重要作用[10]。研究表明,拟南芥Arabidopsis thaliana L.、番茄Solanum lycopersicum L.、黄瓜Cucumis sativus L.、李子Prunus salicina L.和蓖麻Ricinus communisL.等多种植物中的bZIP参与调控组织分化、细胞生长、糖代谢、生物和非生物胁迫等多个生物学过程[11-12]。bZIP基因家族成员还参与多种药用植物次生代谢产物合成调控,如丹参Salvia miltiorrhiza Bunge.的SmbZIP1基因可抑制丹参酮的积累,大豆Glycine max (Linn.) Merr.的GmbZIP123基因则参与大豆种子脂质积累的调控[13]。同时,bZIP表达受外源激素和胁迫诱导,壳聚糖处理葡萄Vitis vinifera L.12 h下,其VvLysM8和VvLysM9基因表达量显著提高[14],糜子Panicum miliaceum L.中的PmbZIP97不仅受到脱落酸(abscisic acid,ABA)、盐和干旱胁迫强烈诱导且参与调控萌发后的根系生长[15]。 本实验利用远志三代转录组数据,以bZIP基因家族为研究对象,对其基因家族进行成员鉴定和生物信息学分析,并确定其在远志中的结构特点与进化特征,进一步通过实时荧光定量分析其在不同组织、不同处理条件下的表达模式,为后续深入研究bZIP的生物学功能奠定基础,同时为bZIP家族可能参与远志次生代谢成分生物合成途径研究提供思路。 1 材料及仪器1.1 材料2021年10月于陕西中医药大学药用植物园(陕西咸阳)采集3年生远志Polygala tenuifolia Willd.及其成熟种子,经陕西中医药大学杨新杰副教授鉴定。选取5株三年生长势均匀的远志植株,将根、茎、叶等量混合后进行全长转录组测序分析。1.2 试剂及仪器ABA、壳聚糖(chitosan,CHT)均购自上海源叶生物科技有限公司,Trizol总RNA提取试剂盒、dd H2O均购自生工生物工程(上海)股份有限公司,TB Green® Premix ExTaqTM Ⅱ (TliRNaseH Plus)、PrimeScriptTM Ⅱ 1st strand cDNA Synthesis Kit购自TaKaRa公司(日本),所用引物由武汉金开瑞生物公司合成。StepOnePlusTM Real-Time PCR(qPCR)仪(美国Applied Biosystems公司),NanoDropTM 2000分光光度计(美国Thermo-fisher公司),K5800自动检测超微量分光光度计(凯奥公司),?80 ℃超低温冰箱(中科美菱公司)。 2 方法2.1 样品的处理选择大小均一,颗粒饱满的远志种子,用自来水冲洗1 d,10%双氧水消毒,播种于装有泥炭土的花盆中,在光周期16/8 h,光照强度9 000 Lx条件培养[16]。选取长势均一的2月幼苗,喷200 μmol/L ABA、200 μmol/L CTS,干旱(10% PEG 6000)、盐(100 mmol/L NaCl)20 mL,以无菌水作为对照组;以0 h为空白对照,重复3次,6、12、24和48 h取样处理(3株),于?80 ℃冰箱储存,采用PacBio Seque Ⅲ进行上机测序,获得远志全长转录组学文库[17]。2.2 远志bZIP家族基因鉴定及理化性质分析基于远志转录组数据库,筛选出注释结果为bZIP的序列,将序列gene id对应的fasta结果输入editseq软件,进一步获得具有完整开放阅读框(open reading frame,ORF)的基因,通过NCBI中的BlastX进行比对与鉴定。Protparam分析目标蛋白的理化性质,ProtScale预测不同氨基酸中的蛋白亲疏水性[18]。2.3 远志bZIP家族基因二级结构、信号肽、跨膜结构及亚细胞定位分析用ExPASy分析基因编码蛋白质的结构域,CDD验证;ProtParam和SOPMA分析远志bZIP转录因子的二级结构;SignalP-5.0和TMHMM预测信号肽和跨膜区域;WoLF PSORT预测亚细胞定位[19]。2.4 远志bZIP家族基因进化树构建从Tair网站下载拟南芥蛋白序列,通过MEGA软件对远志、拟南芥bZIP氨基酸序列进行多序列比对,利用MEGA的最大自然法构建系统发育树,重复次数设置为1 000次[20]。2.5 远志bZIP家族基因密码子偏好性分析及蛋白互作预测分析采用CodonW、CUSP和Chips分析密码子偏好性。蛋白互作预测分析利用STRING进行,并以拟南芥筛选其同源基因后,通过Cytoscape 3.9.0软件作图。2.6 远志bZIP家族基因蛋白特征、保守基序分析及不同组织表达量热图通过chiplot分析bZIP蛋白的结构域,MEME获得bZIP蛋白的保守氨基酸基序,并用TBtools进行可视化,Weblogo分析蛋白序列位点。利用诺禾云平台将转录组数据库中27个PtbZIP基因在远志根、茎、叶3个部位的差异表达数据进行层级聚类分析。2.7 远志bZIP家族基因表达模式验证与分析Trizol法提取各样品总RNA,凝胶电泳检测后测定总RNA浓度。使用Prime Script TM II 1st strand cDNA Synthesis Kit合成cDNA,检测浓度后于?20 ℃保存备用。设计荧光定量引物,并送生工生物工程(上海)股份有限公司合成。以甘油醛-3-磷酸脱氢酶(F:5’-ACAGCAACGTGCTTCTCACC-3’,R:5’-CCCTTCATCCACCACCGACTA-3’)为内参基因,验证PtbZIP26(F:5’-GCACTGATGG- GAAGGCTGAA-3’,R:5’-GATTGCCCAACAC- TTGAGGG-3’)、PtbZIP27(F:5’-GTCGGATGGT- AGTGAACGGG-3’,R:5’-CACCATTTCCCGAAC- CCTGA-3’)在不同部位样本中的表达量。选择表达量较高的PtbZIP26进行不同激素、胁迫处理下的表达量分析。qRT-PCR反应体系为TB Green Premix Ex Taq Ⅱ(2×)5.0 μL;上下游引物各0.4 μL;50×ROX Reference Dye 0.2 μL,cDNA 1.0 μL;ddH2O 3.0 μL。PCR反应程序参照TB Green Premix Ex Taq Ⅱ试剂说明书进行,每个反应重复3次。基因相对表达量采用2?ΔΔCt法计算,SPSS 27.0统计分析。 3 结果与分析3.1 远志bZIP基因家族成员的鉴定和蛋白理化性质分析基于远志全长转录组数据库,共筛选得到63个注释为bZIP基因的序列ID,进一步分析后获得39个包含完整ORF的序列。整理ORF差异位点并合并重复,最终得到27个全长bZIP转录因子,编号PtbZIP1~PtbZIP27(表1)。该转录因子的氨基酸个数143~846,相对分子质量介于16 201.52~92 932.3,等电点4.59~9.69。除PtbZIP1和PtbZIP22的不稳定指数小于40,系稳定蛋白质外,其余PtbZIP均为不稳定蛋白。bZIP基因家族脂肪系数介于48.31~92.66,所有bZIP蛋白的平均亲水性数值是负值,为亲水性蛋白。图片3.2 远志bZIP基因家族成员的二级结构、信号肽、跨膜结构及亚细胞定位分析二级结构分析结果(表2)表明,远志bZIP家族蛋白均具有α螺旋、延伸链、β转角和无规卷曲,主要由α螺旋和无规卷曲构成,延伸链和β-折叠所占比例较小,散布于整个蛋白中。SignalP-5.0和TMHMM在线分析结果一致,所有远志bZIP蛋白信号肽分值都低于0.5,说明其均无信号肽,不属于分泌蛋白。跨膜结构域分析则显示,仅PtbZIP9和PtbZIP13有跨膜结构域。亚细胞定位结果表明,远志bZIP家族成员主要定位在细胞核。图片3.3 远志bZIP基因家族成员系统进化分析利用MEGA7.0构建远志与拟南芥bZIP转录因子家族系统进化树。结果表明,27个PtbZIP蛋白分为A、B、C、D、F、G、I、S 8个组,没有bZIP蛋白分到E和K组中。其中G是最大的1个亚组,含有PtbZIP家族成员共8个,占总数的29.63%;A、F、I和S组均含3个PtbZIP家族成员,B组含2个PtbZIP家族成员,C组含1个PtbZIP家族成员,D组含4个PtbZIP家族成员(图1)。图片3.4 远志bZIP基因家族成员蛋白结构域分析BRLZ、MFMR和DOG1为bZIP蛋白中的常见结构域,BRLZ参与调控果生炭疽菌的营养生长,MFMR涉及蛋白与蛋白之间的相互作用,DOG1则与种子休眠相关[21-22]。远志bZIP的结构域分析结果表明:10个蛋白存在BRLZ结构域,9个蛋白存在MFMR结构,6个蛋白存在DOG1结构域(图2)。PtbZIP3和PtbZIP13含有大小相近的CCDC 158 superfamily,PtbZIP26、PtbZIP21和PtbZIP5则均含有BRLZ、MFMR及homeobox结构,结合进化树结果可知PtbZIP3和PtbZIP13聚在一起,PtbZIP26、PtbZIP21和PtbZIP5三者亲缘关系较近。图片3.5 远志bZIP基因家族成员保守基序分析利用MEME对远志27个bZIP蛋白序列进行保守基序分析的结果显示,不同bZIP转录因子基因包含的保守元件数量及种类存在差异,其中bZIP14基因包含的保守元件数量最少(2个),bZIP18/25基因包含的保守元件数量最多(11个),说明bZIP成员具有功能冗余现象,也具有功能差异性(图3)。图片bZIP蛋白结合位点序列分析结果表明,bZIP转录因子的每个重复结构域约为65 aa,均含有1个保守的bZIP结构域,其中N端一般具有高度保守的N-X7-R蛋白基序和碱性亮氨酸区域(图4)。图片3.6 远志bZIP基因家族成员密码子偏好性分析密码子可用来推断基因组内部或基因组之间的进化关系,而不同种类或同一种类的基因对密码子使用有不同的偏好模式[23]。由bZIP基因家族中的27条核苷酸序列中密码子GC的总含量(GC)以及同义密码子第1位(GC1s)、第2位(GC2s)、第3位的(GC3s)的GC含量分析结果可知:27条PtbZIP基因序列的GC1s、GC2s和GC3s的均值分别为52.24%、44.90%和40.93%,不同位置的GC含量存在差异;它们的GC平均值为46.11%,小于50%,表明其更偏向于A或U结尾的密码子[24](表3)。图片有效密码子(effective number of codon,ENC)反映了密码子偏离随机选择的结果,它是对同义密码子非均衡使用偏好程度的一个重要指标[25],ENC数值一般在20~61范围内,当ENC>35则表示密码子偏好性较弱。密码子适应指数(codon adaption index,CAI)是指编码该蛋白的所有密码子相对于这条基因都使用最优密码子的情况下的适应系数[24]。由表3可知,远志bZIP家族成员的ENC数值为43.088~57.195个,平均值为51.13个,密码子偏好性较弱。CBI值较低说明其外源基因在目的宿主中表达较弱。CAI值较低,则说明其适应性较弱。3.7 远志bZIP基因家族成员蛋白互作网络分析为深入了解远志bZIP蛋白的潜在功能和家族成员之间的相互作用,利用STRING软件,基于拟南芥数据库,对远志的27个bZIPs蛋白进行了互作网络分析。由图5可知,调控网络中共有27个节点(代表bZIPs蛋白),104条边(代表蛋白质之间的相互作用),表明远志的bZIPs蛋白存在多种互作现象,且26个bZIPs成员之间存在潜在的互作关系,为进一步验证远志bZIP的功能提供了重要依据。图片3.8 远志bZIP基因家族成员不同组织表达量热图和验证根据远志转录组数据,对27个PtbZIP基因在远志根、茎、叶中的FPKM差异表达数据进行了双向聚类分析。通过表达量热图分析可知,绝大部分基因的表达不恒定,在不同组织具有相对较高的表达量,根、茎和叶中表达量较高的基因数分别为23、2和2。PtbZIP4/15在叶中的表达量最高,茎和根次之;PtbZIP8/24在茎中的表达量最高,叶和根次之;剩下23个除PtbZIP1/17的表达量为根>叶>茎,其余表达模式为根>茎>叶(图6-A)。基于RT-qPCR验证转录组数据结果显示,PtbZIP26、PtbZIP27在根中的表达量最高,茎、叶次之,与转录组结果一致(图6-B)。图片3.9 PtbZIP26不同处理下的表达模式为了探究bZIP家族基因在远志不同处理条件下的表达模式,以PtbZIP26为代表,对其进行了激素和干旱、盐胁迫处理条件下的表达模式分析。结果发现,以0 h为空白对照(CK),PtbZIP26的表达量在ABA处理6 h内迅速上升,在24 h达到峰值;CTS处理分别持续上调至峰值为CK的5.3倍(24 h)后逐渐下调(图7-A)。PEG处理6 h迅速下降后又随着处理时间增加缓慢恢复上调,NaCl处理6 h后上调明显(图7-B)。 图片4 讨论bZIP基因家族在植物中广泛分布,参与植物的多个生长过程,如生长发育、应激反应以及次生代谢物的生物合成[26]。现阶段,bZIP基因家族已在多个物种有过相关的鉴定和研究,使得对bZIP的生物功能了解更透彻。本实验基于远志三代全长转录组数据库,找到39个bZIP isoforms,通过完整开放阅读框与BlastX分析找出具有完整ORF的基因,去除重复的isoforms,筛选并鉴定得到27个PtbZIP基因家族成员。理化性质分析显示,27个成员均为亲水性蛋白,且除PtbZIP1和PtbZIP22外均为不稳定蛋白;理论等电点小于7的蛋白有16个,属酸性蛋白,其余均为碱性蛋白。PtbZIP蛋白信号肽分值都低于0.5,说明其均无信号肽,信号肽是分泌蛋白的决定因子,推测PtbZIP蛋白不属于分泌蛋白。亚细胞定位结果显示,远志bZIP蛋白主要定位于细胞核,这与转录因子主要在细胞核中发挥作用一致。PtbZIP家族成员的蛋白二级结构也有明显的特点,主要有α-螺旋、无规卷曲。系统进化分析显示,27个PtbZIP蛋白分为A、B、C、D、F、G、I、S 8个组,其中含有8个PtbZIP家族成员的G亚组系最大亚组。PtbZIP11/18/25与拟南芥At1g32150.1、At2g35530.1高度同源,且包含的保守元件数量最多,推测PtbZIP11/18/25可能在远志干旱应答的分子机制中起重要作用[27]。研究表明,A类别的大多数功能信息提示在ABA或应激信号中的作用,PtbZIP6/12/16被分在A组,推测该基因可能参与到远志ABA信号转导途径[28]。S类别是拟南芥最大的bZIP类别之一,在胁迫处理后也被转录激活或在花的特定部分特异表达。研究证实,拟南芥bZIP家族中的S类别的基因在响应干旱有重要作用,本研究中共有3个PtbZIP基因被分到S类别下,其中PtbZIP15在叶中表达量高,PtbZIP24在茎中表达量高,可能参与调控远志对干旱的响应。同时,27个PtbZIP基因家族成员的蛋白二级结构预测结果十分相似,但序列间同源性相对较低,表明PtbZIP基因可能在远志生长发育方面发挥广泛的生物功能。表达模式分析发现,大部分PtbZIP在根中表达最高,qPCR结果验证与转录组数据一致,推测它们主要在远志地下部分发挥作用。植物中转录因子的表达与激素密切相关,研究发现葡萄VvLysM8和VvLysM9在壳聚糖处理12 h、脱落酸处理3 h时相对表达量最高[14]。马铃薯StHXK家族基因在ABA诱导下表达均显著上调,且在10%PEG胁迫处理下也呈不同程度的上调表达[29]。陆地棉GhKIN基因家族的鉴定和分析发现,干旱和盐胁迫处理后GhKIN14和GhKIN27表达出现下调,而GhKIN18等在一定时间点表现为表达上调[30]。本研究选择一个在根中高表达的PtbZIP26基因,通过不同激素、胁迫处理探讨了其是否受到相关激素和胁迫调控,结表明激素处理(ABA和CTS)远志幼苗后,PtbZIP26表达水平显著提高;同时,盐胁迫和干旱胁迫处理也可诱导PtbZIP26基因的表达发生改变且随胁迫时间的变化呈现出差异性,说明PtbZIP26可能通过不同信号通路参与远志应对逆境胁迫的表达,具体作用机制有待深入研究。本实验基于远志三代转录组数据,以远志bZIP基因家族为研究对象,对其家族成员进行鉴定和生物信息学预测分析,明确了相关结构特点与进化特征,进一步通过qPCR分析其在不同组织、不同处理下的表达模式,为探究PtbZIP参与生长发育、代谢过程及非生物胁迫的调控机制提供参考依据,为后期的基因功能研究奠定了基础。
[b][font=宋体]前言[/font][/b][font=宋体]杆状病毒载体表达系统([/font][font=Calibri]Baculovirus [/font][font=宋体][font=Calibri]e[/font][/font][font=Calibri]xpression [/font][font=宋体][font=Calibri]vector system, BEVS[/font][font=宋体])自[/font][font=Calibri]1983[/font][font=宋体]年问世以来,已广泛应用于疫苗生产、基因治疗等领域。目前已有多种[/font][font=Calibri]BEVS[/font][font=宋体]衍生产品获批使用,如[/font][font=Calibri]HPV[/font][font=宋体]疫苗、流感疫苗和几款兽用疫苗等。[/font][font=Calibri]BEVS[/font][font=宋体]具有安全性高、操作简单、可以无血清培养等优点,但同时也面临表达不稳定和蛋白质糖基化水平低等挑战。本文总结了[/font][font=Calibri]BEVS[/font][font=宋体]的优势和局限性。[/font][/font][font=Calibri] [/font][b][font=宋体]杆状病毒载体表达系统的优势[/font][font=Calibri] [/font][/b][font=宋体][font=Calibri]1[/font][font=宋体]、安全性高:杆状病毒仅感染昆虫细胞,不感染其他脊椎动物,对人类健康没有不良影响。[/font][/font][font=宋体][font=Calibri]2[/font][font=宋体]、高效的蛋白质表达:[/font][font=Calibri]BEVS[/font][font=宋体]能够表达复杂或难以表达的蛋白质,例如各种酶类、寄生虫蛋白、糖蛋白等,并且能进行正确的蛋白质折叠和翻译后修饰。[/font][/font][font=宋体][font=Calibri]3[/font][font=宋体]、易于大规模生产:昆虫细胞可以在无血清的培养基中生长,并且易于扩大生产规模。此外,[/font][font=Calibri]BEVS[/font][font=宋体]不需要处理活病毒或潜在危险的病原体,降低了生产成本。[/font][/font][font=宋体][font=Calibri]4[/font][font=宋体]、应用广泛:广泛用于功能、晶体学和药物发现研究。[/font][/font][font=Calibri] [/font][b][font=宋体]杆状病毒载体表达系统的局限性:[/font][/b][font=Calibri] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、表达不稳定:由于病毒的细胞毒性作用导致宿主细胞裂解,这可能影响最终的产物产量和蛋白质的稳定性。[/font][/font][font=宋体][font=Calibri]2[/font][font=宋体]、糖基化水平较低:昆虫细胞所产生的异源蛋白质的[/font][font=Calibri]N-[/font][font=宋体]糖基化图谱与哺乳动物细胞产生的不同,这可能影响蛋白质的稳定性、生物活性或免疫原性。[/font][/font][font=宋体][font=Calibri]3[/font][font=宋体]、潜在的免疫反应:[/font][font=Calibri]BEVS[/font][font=宋体]诱导的免疫反应可能产生炎症细胞因子和趋化因子,并激活补体途径,这也可能对蛋白质表达产生负面影响。[/font][/font][font=宋体][font=Calibri]4[/font][font=宋体]、基因组不稳定性:杆状病毒基因组可能存在不稳定性,影响长期表达和生产稳定性。[/font][/font][font=Calibri] [/font][font=宋体][font=宋体]尽管存在一些挑战,但[/font][font=Calibri]BEVS[/font][font=宋体]平台近年来已经得到了显著改进,包括病毒载体的优化、病毒基因组的修饰和宿主细胞的广泛应用,这些分子进步有助于增强[/font][font=Calibri]BEVS[/font][font=宋体]平台的多样性和应用潜力。[/font][/font][font=Calibri] [/font][font=宋体]义翘神州提供[/font][url=https://www.sinobiological.com/services/baculovirus-insect-protein-expression-service][u][font=宋体][color=#0026e5][font=宋体]杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫蛋白表达的一站式服务[/font][/color][/font][/u][/url][font=宋体][font=宋体]。凭借优化的表达载体和更高滴度的病毒包装技术,义翘神州在杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞蛋白表达方面具有丰富的经验,特别是针对序列较长的蛋白、病毒类蛋白、激酶、胞内蛋白以及膜蛋白等。[/font][/font][font=Calibri] [/font][font=宋体]参考文献:[/font][font=Calibri]Hong M, Li T, Xue W, et al. Genetic engineering of baculovirus-insect cell system to improve protein production. Front Bioeng Biotechnol. 2022 10:994743. Published 2022 Sep 20. doi:10.3389/fbioe.2022.994743[/font][font=Calibri] [/font]
[font=宋体]蛋白表达是指用模式生物如细菌、酵母、动物细胞或者植物细胞表达外源基因蛋白的一种分子生物学技术。蛋白表达系统是指由宿主、外源基因、载体和辅助成分组成的体系,通过这个体系可以实现外源基因在宿主中表达的目的。[/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、宿主。表达蛋白的生物体。可以为细菌、酵母、植物细胞、动物细胞等。由于各种生物的特性不同,适合表达蛋白的种类也不相同。[/font][/font][font=宋体][font=Calibri]2[/font][font=宋体]、载体。载体的种类与宿主相匹配。根据宿主不同,分为原核(细菌)表达载体、酵母表达载体、植物表达载体、哺乳动物表达载体、昆虫表达载体等。载体中含有外源基因片段。通过载体介导,外源基因可以在宿主中表达。[/font][/font][font=宋体][font=Calibri]3[/font][font=宋体]、辅助成分。有的表达系统中还包括了协助载体进入宿主的辅助成分。比如昆虫[/font][font=Calibri]-[/font][font=宋体]杆状病毒表达体系中的杆状病毒。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]一、大肠杆菌表达系统[/b][/font][font=宋体] [/font][font=宋体][font=宋体]在各种表达系统中,最早被采用进行研究的是大肠杆菌表达系统,也是目前掌握最为成熟的表达系统。大肠杆菌表达系统以其细胞繁殖快速产量高、[/font][font=Calibri]IPTG[/font][font=宋体]诱导表达相对简便等优点成为生产重组蛋白的最常用的系统。目前最常用的大肠杆菌表达系统为[/font][font=Calibri]BL21-PET[/font][font=宋体]表达系统,此系统目前已经商业化,并且普遍应用于各大实验室和生物技术公司。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]对于表达不同的蛋白,需要采用不同的载体。目前已知的大肠杆菌的表达载体可分为非融合型表达载体和融合型表达载体两种。非融合表达是将外源基因插到表达载体强启动子和有效核糖体结合位点序列下游,以外源基因[/font][font=Calibri]mRNA[/font][font=宋体]的[/font][font=Calibri]AUG[/font][font=宋体]为起始翻译,表达产物在序列上与天然的目的蛋白一致。融合表达是将目的蛋白或多肽与另一个蛋白质或多肽片段的[/font][font=Calibri]DNA[/font][font=宋体]序列融合并在菌体内表达。融合型表达的载体包括分泌表达载体、带纯化标签的表达载体、表面呈现表达载体、带伴侣的表达载体。[/font][/font][font=宋体] [/font][font=宋体]优点:遗传背景清楚;繁殖快、成本低、抗污染能力强;表达量高、表达产物分离纯化相对简单、稳定性好;商品化的载体和菌株种类非常齐全、适用范围广等。[/font][font=宋体] [/font][font=宋体]缺点:[/font][font=宋体][font=宋体]① 没有真核转录后加工的功能,不能进行[/font][font=Calibri]mRNA[/font][font=宋体]的剪接,所以只能表达[/font][font=Calibri]cDNA[/font][font=宋体]而不能表达真核的基因组基因;[/font][/font][font=宋体]② 没有真核翻译后加工的功能,表达产生的蛋白质,不能进行糖基化、磷酸化等修饰,难以形成正确的二硫键配对和空间构像折叠,因而产生的蛋白质常没有足够的生物学活性;[/font][font=宋体][font=宋体]③ 表达的蛋白质经常是不溶的,会在细菌内聚集成包涵体,尤其当表达目的蛋白量超过细菌体总蛋白量[/font][font=Calibri]10%[/font][font=宋体]时,就很容易形成包涵体。生成包涵体的原因可能有是蛋白质合成快速太快,多肽链相互缠绕,缺乏使多肽链正确折叠的因素,导致疏水基因外露等。细菌裂解后,包涵体的离心后的沉淀中,虽然有利于目的蛋白的初步纯化,但无生物活性的不溶性蛋白,要经过复性,使其重新散开、重新折叠成具有天然蛋白构象和良好生物活性的蛋白质,常常是一件很困难的事情。也可以设计载体使大肠杆菌分泌表达出可溶性目的蛋白,但表达量往往不高。[/font][/font][font=宋体][font=宋体]④ 可能会产生一些致热源[/font][font=Calibri]([/font][font=宋体]内毒素[/font][font=Calibri])[/font][font=宋体],并且大肠杆菌本身含有内毒素和有毒蛋白,可能混杂在终产物里。[/font][/font][font=宋体] [/font][font=宋体][b]二、酵母表达系统[/b][/font][font=宋体] [/font][font=宋体]酵母表达系统作为一种后起的外源蛋白表达系统,由于兼具原核以及真核表达系统的优点,正在基因工程领域中得到日益广泛的应用,应用此系统可高水平表达蛋白,且具有翻译后修饰功能,故被认可为一种表达大规模蛋白的强有力的工具。[/font][font=宋体] [/font][font=宋体][font=宋体]常用的酵母表达系统有酿酒酵母表达系统和甲醇营养型酵母表达系统。甲醇酵母表达系统是目前应用最广泛的酵母表达系统。目前甲醇酵母主要有汉森酵母属[/font][font=Calibri](Hansenula)[/font][font=宋体],毕赤酵母属[/font][font=Calibri](Pichia)[/font][font=宋体],球拟酵母属[/font][font=Calibri](Torulopsis)[/font][font=宋体]等,并以毕赤酵母属应用最多。[/font][/font][font=宋体] [/font][font=宋体]优点[/font][font=宋体][font=Calibri]1. [/font][font=宋体]生长方面:酵母是一种单细胞低等真核生物,培养条件普通,生长繁殖快速,能够耐受较高的流体静压,用于表达基因工程产品时有效降低了生产成本。毕赤酵母具有强烈的好氧生长偏爱性,可进行细胞高密度培养,利于大规模工业化生产。[/font][/font][font=宋体][font=Calibri]2. [/font][font=宋体]安全性方面:酿酒酵母被认为是安全无毒的,有着数十年的大规模发酵研究基础。[/font][/font][font=宋体][font=Calibri]3. [/font][font=宋体]分子生物学操作方面:酿酒酵母在重组[/font][font=Calibri]DNA[/font][font=宋体]中的广泛研究也是基于其己被人们掌握的大量分子生物学及生理学信息。外源基因一般和表达载体一起整合到了酵母染色体上,随染色体一起复制和遗传,不会发生外源基因的丢失现象。[/font][/font][font=宋体][font=Calibri]4. [/font][font=宋体]蛋白表达方面:可以进行蛋白的糖基化,而且还能分泌重组蛋白。[/font][/font][font=宋体][font=Calibri]5. [/font][font=宋体]蛋白分泌方面:由于毕赤酵母自身分泌到培养基中的蛋白很少,因此纯化方便。[/font][/font][font=宋体] [/font][font=宋体]缺点[/font][font=宋体][font=Calibri]1. [/font][font=宋体]克隆基因的表达量低,发酵时间长,不正确的蛋白糖基化及抗细胞分裂。[/font][/font][font=宋体][font=Calibri]2. [/font][font=宋体]培养上清多糖浓度高,不利于纯化。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]目前大肠杆菌蛋白表达系统是用最广泛,也是最经济实惠的蛋白表达系统。[/font][font=Calibri]E. coli[/font][font=宋体]具有遗传背景清楚、细胞增殖快、表达量高、稳定性好和抗污染能力强等特点,适用于多种属蛋白的表达,尤其对小分子蛋白的生产具有极大的优势,但也存在一些问题,如易形成包涵体和含有内毒素等。义翘神州提供从密码子优化到重组蛋白表达[/font][font=Calibri]/[/font][font=宋体]纯化的一站式服务以及内毒素去除等附加服务,以满足不同的定制需求。我们拥有丰富的[/font][font=Calibri]E. coli [/font][font=宋体]可溶性蛋白表达[/font][font=Calibri]/[/font][font=宋体]纯化及蛋白复性经验,拥有多种[/font][font=Calibri]E. coli[/font][font=宋体]细胞株和表达载体,可为客户提供优质的[url=https://cn.sinobiological.com/services/e-coli-protein-expression-service][b]原核蛋白表达服务[/b][/url]。更多关于[/font][font=宋体]大肠杆菌蛋白表达平台[/font][font=宋体]详情可以关注:[/font][/font][url=https://cn.sinobiological.com/services/platform/e-coli-protein-expression][u][font=宋体][color=#0000ff][font=Calibri]https://cn.sinobiological.com/services/platform/e-coli-protein-expression[/font][/color][/font][/u][/url][font=宋体] [/font]
随着制药企业对生物治疗药物的日益重视,在药物研究中使用LCMS定量分析蛋白和多肽药物已经引起越来越多研究者的兴趣。艾塞那肽是一种治疗性多肽,目前已被批准用于治疗I型和II型糖尿病。艾塞那肽可增强胰腺β细胞分泌葡萄糖依赖性胰岛素,以调节糖代谢和胰岛素分泌。近年来,血浆中艾塞那肽的浓度测定主要通过配体实验来完成,例如利用酶标免疫测定法进行艾塞那肽的 药代动力学研究。但是,由于某些具有相似理化性质的化合物的存在,致使酶标免疫测定法缺乏足够的特异 性和选择性,导致采用该方法分析将面临一定的风险。基于以上原因,采用AB SCIEX QTRAP® 5500系统的 MRM3模式确保分析血浆中多肽药物时能够达到更高的选择性。实验方法样品制备:提取人血浆中的艾塞那肽,用氮气吹干,复溶。在所有的操作步骤中,pH值及有机相都要严格控制。串联质谱技术在药物高通量筛选和生物分析中的应用液相色谱条件:UHPLC采用ShimadzuUFLC LC-20ACXR;反相色谱柱为C-18 2.0 x30mm,5μ;流速为 0.6mL/min;进样体积为5 μL;流动相A为含0.1%甲酸的水溶液,流动相B为含0.1%甲酸的甲醇溶液;梯度5分钟,流动相B浓度从2%升至95%。质谱条件:使用AB SCIEXQTRAP® 5500系统中的MRM3扫描模式进行LC/MS分析。开启离子阱的动态填充时间(DFT)功能,在10,000Da/s的扫描速度下进行MS3扫描。总周期时间为0.17s。采用质荷比 838→396→202进行MRM3分析。QTRAP® 5500系统进行MRM3分析原理展示在图2中。图1. 艾塞那肽结构。艾塞那肽是由39个氨基酸组成的多肽(MW =4186.6 Da),是糖代谢和胰岛素分泌的调节剂。图2. MRM3定量分析工作原理。首先在Q1四极杆中选择母离子,然后在Q2碰撞池中碎裂,其子离子在线性离子阱中富集并分离,接着通过激发产生第二级碎片,然后将第二级产物离子扫描至检测器。实验结果在增强全扫描模式(EMS)下,选择多电荷母离子5+838.3作为前体离子(母离子,图3,上左图)。当前体离子碎裂后,选择m/z 396.
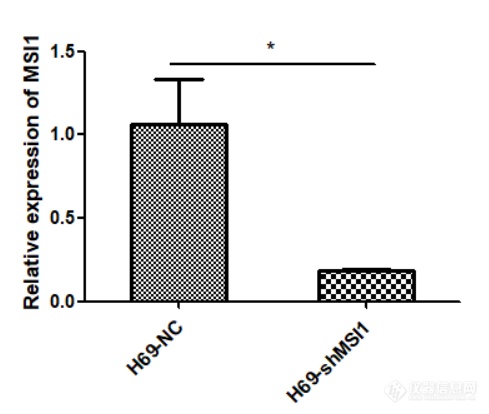
MSI1在人小细胞肺癌细胞系中的表达及MSI1低表达细胞模型的构建实验方法与步骤 细胞的复苏 1.复苏前的准备:打开水浴锅,设置温度37℃;紫外线将超净台消毒30 min;配置完全培养基。 2.将要复苏的H69、H446细胞从液氮取出,用一次性PE手套包裹冻存管,迅速放入水浴锅中震荡,使其快速融化。 3.在15 mL离心管中加入5 mL完全培养基及融化的细胞悬液,900 r/min离心8分钟,弃去上清,得到细胞沉淀。 4.在25 cm2的培养瓶中加入5 mL完全培养基,并用1 mL培养基将沉淀的细胞重悬并加入准备好的培养瓶中,放入CO2恒温培养箱中继续培养。 细胞的传代 1.选取在悬浮培养瓶中生长至90%的H69细胞,用移液枪将细胞悬液移入15 mL离心管中,选取在贴壁培养瓶中生长至90%的H446细胞,用PBS溶液将细胞吹至漂浮,并移入15 mL离心管中,两种细胞均900 r/min离心8分钟,弃掉上清。 2.分别在3个25 cm2培养瓶中加入5 mL完全培养基,在细胞沉淀中加入3 mL培养基并充分吹打混匀,将3 mL细胞悬液平均放入3个培养瓶中并混匀,放入培养箱中继续培养。 MSI1低表达细胞模型的构建1.从-80℃冰箱取出慢病毒载体冰上融化,将慢病毒用空白培养基稀释为滴度2×108,充分混匀,准备好病毒感染增强液。2.将25 cm2悬浮培养瓶中H69细胞移入15 mL离心管中并用移液枪充分吹打混匀,取其中500 μL放入细胞计数仪中计数,取出1.2×106个细胞置入新的离心管中,加入空白培养基至6 mL。3.在12孔板中以MOI=10的病毒滴度进行感染,培养16 h。4.16 h后将细胞悬液离心,换成不加双抗的完全培养基继续培养,72 h后观察荧光。5.待细胞生长至状态良好,加入1 μg/mL嘌呤霉素筛选至90%以上细胞均产生荧光。荧光实时定量PCR(Q-PCR)检测MSI1在mRNA水平的表达 总RNA的提取分别将细胞离心,PBS缓冲液清洗2次,900 r/min离心8 min,得到细胞沉淀。分别加入1 mL Trizol,用移液枪吸打至细胞完全破裂,加入200 μL氯仿,震荡30 s,室温静置10 min,以有效分离无机相和有机相,随后4℃,12,000 g/min离心15 min。将上清移至高压过的1.5 mL离心管中,加入与上清等体积的异丙醇,轻柔颠倒震荡数次,室温静置10 min,随后4℃,12,000 g/min离心10 min。弃去上清,加入75%无水乙醇,4℃,12,000 g/min离心5 min。弃去上清,沉淀置于冰上自然干燥,但不可完全干燥。用30 μL DEPC水溶解总RNA。用NanoDrop One超微量分光光度计进行定量和纯度检测,用1%琼脂糖凝胶电泳进行完整性检测。 cDNA的合成逆转录体系试剂名称使用量模板RNAMonScriptTM 5*RT111 All-in-One MixMonScriptTM dsDNaseNuclease-Free Water1 μg4 μL1 μLup to 20 μL将混合液轻柔吹打混匀,瞬时离心,37℃ 2 min,55℃ 15 min,85℃ 5 min,得到cDNA。 Q-PCR检测MSI1 mRNA的表达GAPDH引物序列:Forward primer:Reverse primer:5’-GGTCGGAGTCAACGGATTTG-3’5’-ATGAGCCCCAGCCTTCTCCAT-3’MSI1引物序列:Forward primer:Reverse primer:5’-GAACCATCCCGTCCTGTATCA-3’5’-GAAACCATGAAGCCCCAACC-3’Q- PCR反应体系:Q-PCR反应体系试剂名称使用量cDNAForward primerReverse primerMonAmpTM Chemhs qPCR MixLow ROXNuclease-Free Water50 ng0.2 μL0.2 μL5 μL0.1μLup to 10 μLQ-PCR反应程序: Q-PCR反应程序反应步骤反应温度反应时间循环次数预变性95℃10 min1变性95℃10 s40退火55-65℃10 s延伸72℃30 s溶解曲线溶解曲线按仪器默认溶解曲线 结果采用t检验,用Graphpad prism5计算MSI1在mRNA水平的表达量。 Western blot检测MSI1在蛋白水平的表达总蛋白的提取将对数生长期的H69-NC、H69-shMSI1细胞移入15 mL离心管中,900 r/min离心8 min,并用PBS溶液洗涤2次,以去除培养基中血清影响。分别加入含PMSF的蛋白裂解液100 μL,与细胞充分混匀。4℃裂解1小时后,4℃,12000 g/min离心15 min,将上清移至新的离心管中,得到细胞总蛋白。 BCA法测定蛋白浓度 将Solution A和Solution B以50:1的体积比配置BCA工作液,充分混匀。将2 mg/mL蛋白标准品等比稀释,最小浓度为125 μg/mL,并分别与配置好的200 μL BCA工作液混匀,铺入96孔板中。37℃孵育30 min,测定波长562 nm处OD(光密度值)值,并绘制蛋白标准曲线。取适量H69-NC、H69-shMSI1细胞总蛋白,20:1稀释后,与200 μL BCA工作液混合均匀。37℃孵育30 min,用酶标仪测定波长562 nm处OD值,根据标准曲线计算出样品中的蛋白浓度。Western blot检测MSI1蛋白的表达 分别收集对数生长期的H69-NC、H69-shMSI1细胞总蛋白,加入相应体积4×SDS Loading Buffer,沸水浴煮5 min,分别取40 μg细胞总蛋白,在提前配制的10% SDS-PAGE分离胶电泳。电泳结束后,将蛋白转至PVDF膜上。用含5%脱脂牛奶的封闭液 37℃封闭1.5 h。弃去封闭液,用TBST缓冲液洗3次,每次10 min,加入MSI1兔单克隆抗体(1:1000),并以GAPDH为内参,加入GAPDH鼠单克隆抗体(1:5000);4℃孵育过夜,次日用TBST缓冲液洗膜3次,每次10 min。在敷有MSI1抗体的膜上加入辣根酶标记山羊抗兔IgG(1:5000),在敷有GAPDH抗体的膜上加入辣根酶标记山羊抗鼠IgG(1:5000),37℃敷育1 h,TBST 缓冲液洗膜3次,每次10 min。用增敏化学发光底物试剂检测,暗室曝光显影。在GAPDH表达量相同的情况下比较MSI1的表达情况。多次重复,应用ImageJ计算出各个蛋白条带的灰度对比,结果采用t检验,并应用Graphpad prism5作出柱状图。 MSI1在人小细胞肺癌细胞系中高表达 提取人正常肺上皮细胞BEAS-2B、小细胞肺癌细胞H446、H69的RNA,利用Q-PCR检测MSI1在正常肺上皮及小细胞肺癌细胞系中的表达情况,结果如图2-1显示,MSI1在小细胞肺癌细胞系H446、H69中的表达远远高于正常肺上皮细胞。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201428158_6718_5389809_3.png1 MSI1 mRNA在小细胞肺癌细胞系中的表达(**代表与正常肺上皮细胞相比,小细胞肺癌细胞MSI1表达量增高具有统计学意义,P0.01)。 MSI1低表达细胞模型的构建本实验选取人小细胞肺癌细胞系H69细胞,使用慢病毒感染技术敲低MSI1的表达,同时设置对照组除外病毒本身对细胞产生的影响,待细胞状态良好使用嘌呤霉素筛选,然后在荧光显微镜下观察如图2-2,可见H69-NC、H69-shMSI1细胞均产生绿色荧光,表明人小细胞肺癌H69细胞慢病毒感染成功。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201428036_9359_5389809_3.png MSI1低表达细胞模型的构建。应用shMSI1慢病毒载体感染H69细胞,利用嘌呤霉素筛选,并在荧光显微镜下观察。 荧光实时定量PCR(Q-PCR)检测MSI1的mRNA表达水平提取对数生长期的H69-NC、H69-shMSI1细胞的RNA,并测量RNA浓度及完整性,用1%琼脂糖凝胶电泳检测完整性可见,RNA有三条带,从上到下依次为28S rRNA、18S rRNA和5S rRNA,且28S rRNA的亮度是18S rRNA的两倍。用NanoDrop One超微量分光光度计测定人总RNA的A260/A280的值为2.00左右,A260/A230的值为2.30左右,说明提取的RNA质量和完整性很好,可以用于后续试验。利用Q-PCR技术检测各细胞内MSI1 mRNA相对表达量,结果如图2-3所示,与对照组相比,H69-shMSI1组MSI1 mRNA表达量明显降低(P0.01),抑制率约为75%。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201434330_8277_5389809_3.png MSI1在RNA水平的表达(***代表与对照组相比,H69-shMSI1组MSI1 mRNA表达量下降具有统计学意义,P0.001)。 Western blot检测MSI1蛋白表达水平将BSA标准品(2 mg/mL)进行等比稀释,最低浓度为125 ug/mL,并应用BCA蛋白质浓度测定试剂盒测定在波长562 nm下的OD值,以OD值为纵坐标,对应蛋白质浓度(μg/mL)为横坐标,绘制标准蛋白曲线如图2-4所示。https://ng1.17img.cn/bbsfiles/images/2022/10/202210102201435248_4142_5389809_3.png图2-4 标准蛋白曲线分别提取H69-NC、H69-shMSI1细胞的总蛋白质,利用Western blot技术检测各细胞内MSI1蛋白的表达情况。结果如图2-5所示,与对照组相比,MSI1蛋白表达在H69-shMSI1细胞中明显降低。表明MSI1低表达细胞模型构建成功。ahttps://ng1.17img.cn/bbsfiles/images/2022/10/202210102201437240_855_5389809_3.pngbhttps://ng1.17img.cn/bbsfiles/images/2022/10/202210102201434999_3303_5389809_3.png图2-5 MSI1蛋白水平表达:(a)MSI1蛋白表达条带;(b)MSI1蛋白的相对表达量。(*表示与对照组相比,H69-shMSI1组MSI1蛋白表达下降具有统计学意义,P0.05)。首先验证MSI1在小细胞肺癌细胞系中的表达情况,利用Q-PCR技术检测在RNA水平,MSI1在肺正常上皮细胞及小细胞肺癌细胞系中的表达,结果显示,MSI1在小细胞肺癌细胞中的表达明显高于正常肺上皮细胞。随后以人经典型小细胞肺癌细胞系H69细胞为研究对象,构建MSI1低表达细胞模型,应用shMSI1慢病毒载体感染H69亲本细胞,同时设置对照组除外病毒本身对细胞产生的影响,利用Q-PCR及Western blot验证MSI1在RNA及蛋白水平的表达,结果显示,H69-shMSI1组MSI1的mRNA及蛋白的表达明显降低。表明MSI1低表达细胞模型构建成功,可以用于后续实验。
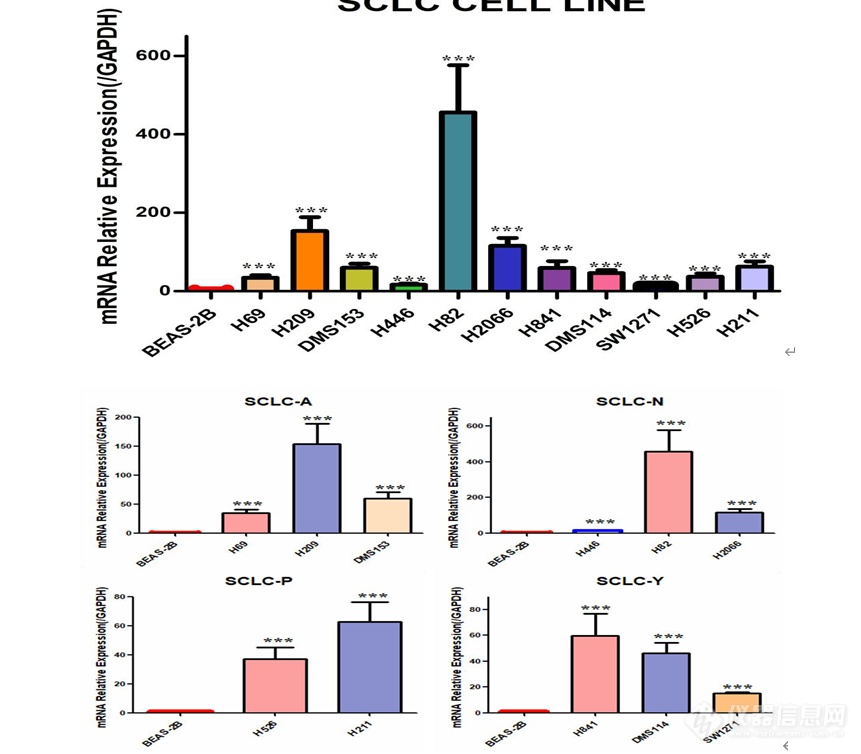
[font='times new roman'][color=#000007]MSI1[/color][/font][font='times new roman'][color=#000007] [/color][/font][color=#000007]在人小细胞肺癌细胞系中的表达及[/color][color=#000007] [/color][font='times new roman'][color=#000007]MSI1[/color][/font][font='times new roman'][color=#000007] [/color][/font][color=#000007]低表达[/color][color=#000000]细胞模型的构建[/color]MSI1 在人小细胞肺癌细胞系中高表达提取人正常肺上皮细胞 BEAS-2B,SCLC-A 型 H69、H209、DMS153 细胞,SCLC-N 型 H446、H82、H2066 细胞,SCLC-P 型 H526、H211 细胞,SCLC-Y 型 H841、DMS114、SW1271 细胞的 RNA,利用 q-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url] 检测 MSI1 在正常肺上皮及小细胞肺癌细胞系中的表达情况,结果如图 2-1 显示,MSI1 在小细胞肺癌细胞系中的表达远远高于正常肺上皮细胞,综合分析,选取了 H69、H82、H526 及 SW1271 细胞用于后续实验。 [img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232326443512_4838_5389809_3.png[/img]图 小细胞肺癌细胞系中 MSI1 mRNA 的表达(***P0.001)MSI1 低表达细胞模型的构建本实验选取人小细胞肺癌细胞系 H69、H82、H526、SW1271 细胞,使用慢病毒感染技术敲低 MSI1 的表达,同时设置对照组除外病毒本身对细胞产生的影响,待细胞状态良好使用嘌呤霉素筛选, 然后在荧光显微镜下观察如图 , 可见 H69-NC 、H69-shMSI1-1、H69-shMSI1-2、H82-NC、H82-shMSI1-1、H82-shMSI1-2、H526-NC、H526-shMSI1-1、H526-shMSI1-2、SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2细胞均产生绿色荧光,表明人小细胞肺癌细胞慢病毒感染成功。 [img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232326451025_2121_5389809_3.png[/img]图 慢病毒感染后 4X 荧光显微镜下图片(H69、H82、H526、SW1271 明场及荧光照片) 敲低 MSI1 后转录和蛋白水平验证分别提取对数生长期的 H69-NC 、H69-shMSI1-1 、H69-shMSI1-2 、H82-NC 、H82-shMSI1-1、H82-shMSI1-2、H526-NC、H526-shMSI1-1、H526-shMSI1-2、SW1271-NC、SW1271-shMSI1-1、SW1271-shMSI1-2 细胞的 RNA 和蛋白,利用 q-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url] 技术分别检测各细胞 MSI1 mRNA 相对表达量,结果如图 所示,与对照组相比,H69-shMSI1-1、 H69-shMSI1-2 、 H82-shMSI1-1 、 H82-shMSI1-2 、 H526-shMSI1-1 、 H526-shMSI1-2 、SW1271-shMSI1-1、SW1271-shMSI1-2 组 MSI1 mRNA 表达量明显降低(P0.01), 抑制率约为 75%。利用 Western blot 技术检测各细胞内 MSI1 蛋白的表达情况。结果如图 2-3 所示,与对照组相比,MSI1 蛋白表达在 H69-shMSI1-1、H69-shMSI1-2、H82-shMSI1-1、H82-shMSI1-2、H526-shMSI1-1、H526-shMSI1-2、SW1271-shMSI1-1、SW1271-shMSI1-2 细胞中明显降低。表明 MSI1 低表达细胞模型构建成功。[img]https://ng1.17img.cn/bbsfiles/images/2022/11/202211232326454704_2148_5389809_3.png[/img]图 敲低 MSI1 在转录水平和蛋白水平的验证(***P0.001)
最近2个月都在做原核表达,刚开始什么都不会,连SDS-PAGE都跑成模糊的一片,其中的辛酸只有自己知道,现在实验慢慢上正轨了,自己也积累了一些经验。很怀恋之前探索的那段时光,现在把我做蛋白表达的过程和一些问题写出来,希望能够帮助开始做蛋白表达的人少走一些弯路。1、表达载体的构建构建表达载体是比较简单的,不过也是需要对你的蛋白还有所用的载体有一个详细的认识,对于比较大的蛋白最好选用能够助溶的标签,但是也不是固定的,比如我的蛋白有65-70KD,我也用的也是HIS,上清也是有少量表达。最关键的我觉得是ORF框不要发生移码突变,比较保险的做法可以先做电子克隆预测,推荐accelrys gene,功能很强大,非常好用。转化我是分两步走的,连接产物先转化DH5α再提质粒转化BL21,虽然比较繁琐但是比较保险,一般不会出现什么问题。构建载体没有出现什么大问题,所以也没有什么经验跟你们探讨,我从引物合成到测序完成,边做边玩2周搞定。2、原核表达原核表达遇到的问题就很多了,先贴张最开始跑的图(我都不好意思拿出来),所以说开始实验做得不好没有关系,没有人天生就会,都要靠后天慢慢学习。现在开始正题,开始,图方便,晚上接菌(接的很少,5μl接到10ml中),第二天加1mM IPTG 37 °诱导3小时,SDS-PAGE图如下:(3#和5#菌是我两个测序正确的单菌落,I是有加IPTG诱导) http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1375685677_small.jpg实验组和对照组蛋白表达没有差异。后来拿过夜的菌液去测OD,呵呵,2点多,果断重新接菌,我一般按照1:100(园子的以前的大神说的)取过夜的菌液加到新的LB-KANA培养基,一般摇个3小时,OD=0.8,再去跑SDS-PAGE,图如下:(我的目的蛋白是65KD,红色的marker是70KD) http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1375685678_small.jpg 结果显然意见,信心十足往下做,这一次还是图方便,一般接菌时为了能快点让菌的OD达到0.8,我把转数提高到了220rpm,我比较懒,既然是已经调了220rpm了,诱导的时候也就索性还是220rpm,还是37°3h。这次我还顺便做了IPTG梯度,单位是mM,SDS-PAGE图如下: http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1375685680_small.jpg结果很郁闷,之前虽然目的蛋白也是很少,但是至少还是和上面的条带差不多大,但是这次,小的可怜(红色箭头标出)0.2mM的IPTG还不足以诱导蛋白表达,但是IPTG的浓度对蛋白表达也没上面影响。什么原因,什么原因呢,隐约记得上次蛋白量比较多好像是160rpm摇的,马上换转数,SDS-PAGE图如下: http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1375685681_small.jpg蛋白大小又回到原来大小了,原来转数真的影响表达啊,没有加IPTG的菌体自身蛋白比较多,说明IPTG对菌体还是有影响的,IPTG的浓度真的没有多大关系,这次0.2mM的也诱导出来了。蛋白怎么表达这么少呢,是不是诱导时间太少,我又做了6h诱导时间,结果目的蛋白没有多大变化,反而菌体蛋白增加了。那低温诱导过夜呢,试试看,我做了2个温度,16和25,均诱导过夜,160rpm,SDS-PAGE如下: http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1375685683_small.jpg很开心,还是先验证是目的蛋白再往下做,本来想做质谱,偏偏实验室的质谱坏了,刚好在园里看到有我这个目的蛋白的鼠单抗,哈哈,老天对我真好,果断试用,WB图如下: http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1375685685_small.jpg 接下来看看蛋白在上清还是沉淀表达,我是按照分子克隆指南上面的做法,100ml菌液16度和25度(感觉上次16和25差不多,所以还是做2个温度)过夜诱导,加4ml的结合缓冲液后,加溶菌酶到终浓度为1mg/ml,4°摇床20min,加tritonX-100至终浓度为1%,4°摇床20min,5000g离心20min,沉淀和上清分别上样,图如下: http://img.dxycdn.com/trademd/upload/userfiles/image/2013/08/A1375685687_small.jpg虽然上清只有一点,但是我已经很开心,今天时间比较晚,没有超声,明天超声后再去跑,感觉应该上清的目的蛋白会更多一点。等我图片出来马上跟大家分享哈。
pET 是目前应用最为广泛的原核表达系统,已经成功地在大肠杆菌中表达了各种各样的异源蛋白。经pET系统过与使用过和正在使用这个系统的科学家的交流,我们发现了一些在使用pET系统的过程中以及原核表达中的一些常见问题。在此,我们选取了其中一些比较有代表性的问题,附上我们的建议改进方案,并期待和你一起分享成功的喜悦。1.目的蛋白总是以不可溶的形式出现真是令人烦恼在大肠杆菌中表达的异源蛋白经常发生错误的折叠,并聚集成为包涵体。经过诱导,目的蛋白通常可达细胞总蛋白的50%以上。虽然有一定比例的蛋白以可溶的单体形式存在,而多达95%(甚至更多)的蛋白则在包涵体中。实践中,有很多实验室采取降低诱导温度,例如25–30°C(Burtonetal.(1991)Prot.Exp.Purif.2,432-441),或降低IPTG浓度(0.01–0.1mM)并延长诱导时间,还有采用特别的培养基(BlackwellandHorgan(1991)FEBSLett.295,10-12)等方法获得更多的可溶蛋白。随着越来越多的蛋白折叠途径被阐明,相信会出现更多有效的增加可溶性目的蛋白的实验方法。然而,让目的蛋白以包涵体形式聚集也并非总是坏事。不溶态在某些情况下非常有利:a.形成包涵体是目的蛋白表达量很高的表现。b.作为初步分离,将目的蛋白的包涵体纯化出来非常简便。用核酸酶处理,并经简单洗涤,通常可以获得纯度达75–95%的目的蛋白。c.存在于包涵体中的目的蛋白通常可以免于蛋白酶的水解破坏作用。纯化的包涵体可以用多种方法重新溶解,以便进一步进行纯化和重折叠操作。如果目的蛋白是用于制备抗原,经PBS悬浮和适当的佐剂乳化处理后,就可以直接用于注射了(参见Fischeretal1992)Science257,1392-1395)。如果目的蛋白融合了His?Tag(r)序列,则可以在变性条件下用His?Bind(r)树脂亲和纯化。经纯化的蛋白用变性条件从树脂洗脱,再行重折叠。溶解和重折叠常常要用到离液剂、助溶剂和去污剂等(MarstonandHartley1990)Meth.Enzymol.182,264-276)。研究者采用下述方法加强蛋白重折叠的效果,并在很多蛋白上取得了好结果,可以尝试以下:当蛋白还结合在树脂上时,使用6M–0M梯度盐酸胍、1mM还原型及0.2mM氧化型谷胱甘肽处理,继而用咪唑正常洗脱。有些实验室在透析去除变性剂的过程中加入底物或类似物,也有帮助酶折叠的效果(Zhietal.(1992)Prot.Sci1,522-529;Tayloretal.(1992)Prot.Engin5,455-459)。2.是否所有的位点特异性蛋白酶都有一样的酶切特性,而仅仅只是识别位点有所不同呢?位点特异性蛋白酶(例如凝血酶、肠激酶和Xa因子)通常被用来切割融合蛋白。这些酶的活性和第二点酶切倾向性很不相同。凝血酶在这三种中是特异性活性最高的,能够有效切质量比仅为1:2000的蛋白。Xa因子似乎对于切点周围的序列很敏感,经常会出现特异性位点切割不理想却发生别的位点被切割的情况。肠激酶的专一性是上述三种中最好的,但由于切割效率低(通常要求质量比达到1:10)而显得比较昂贵。另一个需要考虑的问题是:切割完成之后,是否需要去除蛋白酶。在质量比比较高的酶切反应进行完后,通常要通过色谱法处理。比较方便可行的方法是采用生物素化凝血酶(货号69672)结合链亲和素琼脂糖(货号69203)一起使用。尽管没有一种蛋白酶完美无缺,凝血酶还算的上是活性高、专一性好的典型。3.必须去除融合多肽或蛋白才能使目的蛋白获得活性吗?大多数情况下目的蛋白带有His?Tag,S?Tag?,11个氨基酸的T7?Tag?或HSV?Tag?等小肽时仍能表现出完全的活性。这些肽段相对都较为亲水,而理论上这样不会干扰蛋白的三维结构。我们建议首先测试蛋白活性,再看是否一定要去除前导序列才能适合特定的应用要求。4.如果目的蛋白包含信号序列,它会不会被运至细胞周质并以可溶、活性形式存在?抑或目的蛋白甚至可以被分泌到生长培养基中?N-端如果带有ompT或pelB这样的前导序列是使目的蛋白进入细胞周质的必要非充分条件。如果在生长培养基中发现目的蛋白的话,多半是因为细胞壁收到破坏,而并不代表蛋白是被分泌到培养基里的(StaderandSilhavy(1990)Meth.Enzymol.185,166-187)。穿过大肠杆菌内膜的机制还不甚了了(综述见Wickneretal.(1991)Ann.Rev.Biochem.60,101-124)。已经清楚了蛋白的成熟区对转运也有影响。虽然根据紧跟在信号肽序列后的目的蛋白序列可以对其输出的可能作个大概判断;但是由于蛋白的输出效率依赖于目的蛋白的特性,还是不能仅仅根据其序列来预测输出的实际情况(BoydandBeckwith(1990)Cell62,1031-1033;YamaneandMizushima(1988)J.Biol.Chem.263,19690-19696)。因此,实验中,在细胞质中发现目的蛋白(仍然带着未被切除的信号序列)或在细胞周质中有被部分加工的蛋白,在细胞周质及其它区域发现经过其它加工的蛋白,都不足为奇。某些情况下,降低诱导时的培养温度至25–30°C,可能提高输出蛋白的比率。5.如果我的蛋白大于100kd或含有多个亚基,还能用细菌表达吗?在细菌中已经非常成功底表达了很多大蛋白(Aukhiletal.1993)J.Biol.Chem.268,2542-2553)。多亚基复合物则可以通过分别表达各亚基,然后在有尿素的溶液中,将各组分以适当比例混和,再透析去除变性剂(Youngetal.(1994)Cell76,39-50;Garboczietal.(1992)Proc.Natl.Acad.Sci.USA89,3429-3433)。但是,自从Novagen的pETDuet和pACYDuet多表达载体被开发出来后,同时表达2-8个蛋白(亚基)变得十分容易了。6.我的基因对大肠杆菌有毒吗?某个蛋白不是所谓“毒素”并不意味它就不会杀死大肠杆菌或显著降低其生长水平。虽然有些种类的蛋白由于显而易见的原因很容易被认为是毒素(例如,可以与DNA或干扰电子转移);而其它的蛋白(例如一些重组抗体)有毒则并不明显或不易预期。如果试图在一个有“渗漏”表达的系统中克隆和表达蛋白而遭遇失败,基本可以认为目的蛋白对大肠杆菌有毒性。因此,对于一种新的基因的研究,基本的原则之一即是尝试多种pET载体/宿主菌组合,以期掌握最佳表达途径。7. 如果IPTG诱导后细胞停止了生长,是不是表示细胞死了?T7 RNA聚合酶非常活跃,T7转录和翻译信号极强,因此,一旦诱导,细胞的主要生理活动都向着目的蛋白表达的方面转化。在通常情况下,细胞将停止生长,形成克隆的能力大大降低,但并未死亡。菌落形成试验可以用来检测表达系统的性能。也有一些例外情况,例如特别的目的基因以及一些极为严紧的载体/宿主菌组合 (比如含有pLysE的宿主菌)等,这时在诱导后菌落还是会继续生长。8. E. coli会去除成熟蛋白N-端的甲硫氨酸吗?这种加工对目的蛋白的稳定性有何影响?N-端fMet是否被去除受倒数第二个氨基酸影响。这个加工过程由甲硫氨酸氨基肽酶催化,并受以下关系支配:去除的困难程度随倒数第二位氨基酸的支链大小的增加而降低(Hirel et al (1989)Proc. Natl. Acad. Sci. USA 86, 8247-8251; Lathrop, B.K. et al. (1992) Prot. Exp. Purif.3, 512-517)。上述研究者在实验中发现以下氨基酸种类出现在倒数第二的位置上时,此加工过程极少发生或根本没有发生:His, Gln, Glu, Phe, Met, Lys, Tyr, Trp, Arg。而当倒数第二位上是其它种类的氨基酸时,加工过程发生的可能从16%到97%,Tobias等人(Science 254, 1374-1377,1991) 确定了在大肠杆菌中蛋白氨基末端氨基酸与其稳定性之间的关系,也即“N-端原则”。具他们报导:如果下列氨基酸位于氨基端时蛋白的半衰期仅为2分钟:Arg, Lys, Phe, Leu, Trp和Tyr。相反,其它氨基酸位于氨基端时可以使受检蛋白的半衰期长达1
龙永图言论考验公共表达环境17日,南京“对话中国”高层论坛上,龙永图在谈到中国房地产问题说道,“中国的老百姓没有改变观念,每个人都想买房,其实这种观念是非常错误的,大部分中国人应该解决租房问题。”龙永图并不新鲜的租房论引起了论坛的轩然大波,网友纷纷质疑其身在福中不知民生的冷漠,甚至各种讥讽和责骂也接踵而来。(6月18日中新网)龙永图的说法并非是空穴来风:美国三成人群买房,六成人群租房,实际拥有住房的人并不多。虽然,中国的国情与美国不同,但是在城市建设普遍适用的规律面前,同类现象还是具有借鉴的意义的。同时,龙永图的言论也并非是石破惊天:在其之前,早有吴敬琏等学者普及过“人人有房住”的双重理解。按理说,如此有理有据的论调,如此“步人后尘”的观点应该失去引起舆论关注的热度,可奇怪的是,龙永图的表达还是造成了网民的激愤。 与龙永图的理性表达不同,网友的意见更像是打抱不平的“哄客”:他们在揶揄龙永图的冷漠:自己处于良好的住房环境中,竟然好意思劝大家不买房,他为什么不租房?他们在怀疑龙永图的立场:那个曾经为民争利的龙永图终于变得庸俗了。总而言之,在面对龙永图与己不同的观点时,网友们已经接受其举重若轻的洒脱,已经站在道德的制高点上对其进行回击。在他们看来,这种回击是一种维护,是对龙永图的一种警告。 从网友的激动中,我们可以发现一个值得警惕的问题:公共领域的表达问题。从本质上说,网友的判断并不是事实判断,他们根本就不去探究和思考龙永图的质疑是否有其逻辑上的合理性,有其充分的事实依据。他们的判断是带有感情色彩的价值判断,他们思考的是龙永图道德的问题,质疑的是龙永图表达的莽撞,似乎这种违背“民意”的表达应该闭嘴。显然,这种态度是与公共领域的理性交往是相违背的,在公共领域中,表达应当是自由的,只有自由的表达才能促成公共领域的理性和包容。而一旦人们的价值判断充满偏见或者趋于一律,那么舆论的压力和群体的压力就会让一些人丧失发言的勇气或热情。其结果可能是表面的步调一致,但真正的问题可能被掩藏,真相也可能在沉默中被装扮。此时,表面的整齐划一有什么意义呢?真相不会因为被装扮就成为任人打扮的小姑娘,它的本来面目总会被人们知晓。而问题也不会在掩藏中自然地解决,在发展到一定程度,它总会通过激烈的方式表达出来。可以说,失去自由发言的公共领域是名不副实的,所谓公共就是指向公众。 因此,在龙永图引起的争论中,需要对网友的过激意见进行重视和引导。龙永图的遭遇反映了舆论领袖与公众之间的断裂。从某种意义上说,一些类似的事件正是检验公共领域成色的“试纸”,通过这些具有代表性的事件,我们可以发现,在价值判断中多元观点的缺失,可以发现,在公共表达中宽容环境的缺少。而一个和谐的社会是需要多元价值观和宽容表达环境的。没有了这些要件的保证,和而不同就无法实现。
[font=宋体]在现代生命科学研究中,[url=https://cn.sinobiological.com/resource/protein-review/protein-production][b]重组蛋白表达技术[/b][/url]扮演着至关重要的角色。通过将外源基因导入宿主细胞,并使其表达特定蛋白,我们能够获取大量高纯度的重组蛋白,为疾病治疗、药物研发和生物工程等领域提供了强有力的支持。本文将介绍重组蛋白表达的原理、表达系统、生产步骤以及应用前景。[/font][font=宋体][b]一、重组蛋白表达的原理[/b][/font][font=宋体][font=宋体]重组蛋白表达是利用[/font][font=Calibri]DNA[/font][font=宋体]重组技术,将目标基因(外源基因)导入宿主细胞中,并通过宿主细胞的生物机制使其表达出特定蛋白。其主要步骤包括:[/font][/font][font=宋体][font=宋体]基因克隆:将目标基因经过[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]扩增后,与表达载体连接,形成重组质粒。[/font][/font][font=宋体]转染或转化:将重组质粒导入宿主细胞中,可以使用化学方法、电穿孔或者嗜热菌等方式进行转染或转化。[/font][font=宋体]表达蛋白:重组质粒进入宿主细胞后,融合到宿主细胞的染色体中,随后遵循细胞的转录和翻译机制,表达出目标蛋白。[/font][font=宋体] [/font][b][font=宋体]二、常见的重组蛋白表达系统[/font][/b][font=宋体]大肠杆菌表达系统:大肠杆菌是常用的重组蛋白表达宿主细胞之一。其优点在于生长快速、易于培养,并且能够产生大量的蛋白。此外,大肠杆菌的遗传工具和代谢途径也被广泛研究,提供了便利。[/font][font=宋体]酵母表达系统:酵母表达系统包括酿酒酵母和毕赤酵母。这些酵母细胞具有真核细胞的特点,能够进行正确的蛋白折叠和修饰。同时,酵母细胞也可以进行大规模培养和高表达,适用于一些复杂蛋白的表达。[/font][font=宋体]昆虫细胞表达系统:昆虫细胞表达系统常用于大规模蛋白表达。昆虫细胞具有真核细胞的优势,能够对蛋白进行正确的折叠和修饰,适合于表达大量需求复杂结构的重组蛋白。[/font][font=宋体]哺乳动物细胞表达系统:哺乳动物细胞的表达系统可用于高效表达复杂蛋白和进行蛋白质研究。哺乳动物细胞具有真核细胞特点,能够进行正确的蛋白质修饰和折叠,并且在一些特殊情况下需要考虑到人类蛋白的免疫原性。[/font][font=宋体] [/font][font=宋体][b]三、重组蛋白生产步骤[/b][/font][font=宋体] [/font][font=宋体]细胞中有两个蛋白生产阶段:转录和翻译,被称为分子生物学的中心法则。换言之,转录和翻译步骤属于重组蛋白表达步骤。[/font][font=宋体] [/font][font=宋体]为了生产重组蛋白,基因被分离并克隆到表达载体中。重组蛋白的生产需要蛋白表达系统、蛋白纯化系统和蛋白识别系统。[/font][font=宋体] [/font][font=宋体][b]获取重组蛋白的基本步骤:[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]目标基因的扩增。[/font][/font][font=宋体][font=Calibri]2.[/font][font=宋体]插入克隆载体。[/font][/font][font=宋体][font=Calibri]3.[/font][font=宋体]亚克隆到表达载体中。[/font][/font][font=宋体][font=Calibri]4.[/font][font=宋体]转化到蛋白表达宿主中[/font][font=Calibri]([/font][font=宋体]细菌[/font][font=Calibri]([/font][font=宋体]大肠杆菌[/font][font=Calibri])[/font][font=宋体]、酵母细胞、哺乳动物细胞或杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞系统[/font][font=Calibri])[/font][font=宋体]。[/font][/font][font=宋体][font=Calibri]5.[/font][font=宋体]重组蛋白鉴定试验[/font][font=Calibri](Western blot[/font][font=宋体]或荧光[/font][font=Calibri])[/font][/font][font=宋体][font=Calibri]6.[/font][font=宋体]大规模生产。[/font][font=Calibri]([/font][font=宋体]大规模发酵[/font][font=Calibri])[/font][/font][font=宋体][font=Calibri]7.[/font][font=宋体]分离和纯化。[/font][/font][font=宋体] [/font][font=宋体]需要考虑多种因素:[/font][font=宋体][font=Calibri]1.[/font][font=宋体]选择哪个宿主系统?[/font][/font][font=宋体][font=Calibri]2.[/font][font=宋体]如何分离和纯化重组蛋白?[/font][/font][font=宋体] [/font][font=宋体]选择适当的表达宿主或使用正确的纯化方法并不容易,应考虑目标重组蛋白的性质。下面列出了一些重要因素:[/font][font=宋体] [/font][font=宋体]? 膜结合[/font][font=宋体]? 溶解度[/font][font=宋体]? 单或多结构域[/font][font=宋体][font=宋体]? 大小[/font][font=Calibri]([/font][font=宋体]分子量[/font][font=Calibri])[/font][/font][font=宋体]? 表达位置[/font][font=宋体] [/font][font=宋体][font=宋体]对于大多数没有足够经验来表达和分离重组蛋白的人来说,重组蛋白的生产是非常耗时的。许多生物公司为各种不同规模的重组蛋白表达提供良好的服务:[/font][font=Calibri]https://cn.sinobiological.com/services/recombinant-protein-expression-service[/font][font=宋体],例如义翘神州[/font][/font][font=宋体] [/font][font=宋体][b]四、重组蛋白表达技术的应用前景[/b][/font][font=宋体]药物研发:重组蛋白表达技术被广泛应用于药物研发领域,用于生产重组蛋白药物。这些药物包括多肽类、蛋白类和抗体类药物,如生长因子、抗体药物和血液制剂等。通过重组蛋白表达技术,我们可以获得高效纯度的药物,满足临床上的需求。[/font][font=宋体]生物工程:重组蛋白表达技术被广泛应用于生物工程领域,用于生产特定的蛋白产品。这些产品可以应用于食品、化妆品、工业发酵等领域,如酶制剂、生物染料和生物材料等。[/font][font=宋体]疾病治疗:通过重组蛋白表达技术,我们能够合成特定的蛋白,用于疾病的治疗和诊断。例如,利用重组抗体技术,可以开发出用于癌症治疗和免疫治疗的抗体药物。[/font][font=宋体] [/font][font=宋体][font=宋体]详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/resource/protein-review/protein-production[/font][/font]
[font=宋体][font=宋体]无细胞蛋白表达系统([/font][font=Calibri]Cell-Free Protein Expression System[/font][font=宋体])是一种基于原核和真核细胞提取物构建的体外蛋白表达系统。它具有许多优点,例如可以在短时间内生产大量的蛋白质,同时避免了细胞内的复杂调控机制和翻译后修饰等繁琐过程。因此,无细胞蛋白表达系统在生物制药、生物材料、生物燃料等领域具有广泛的应用前景。本文将详细介绍无细胞蛋白表达系统的优缺点。[/font][/font][font=宋体][b]一、无细胞蛋白表达系统的优点[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]高效性:无细胞蛋白表达系统具有高表达效率的优点,这是由于体外体系中不存在靶蛋白累积所需的细胞分裂和细胞复杂代谢反应。此外,由于无细胞蛋白表达系统不受到细胞毒性和免疫反应的限制,可以实现大规模的蛋白质表达。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]灵活性:无细胞蛋白表达系统可以使用一系列不同的原核和真核细胞提取物作为反应体系,例如[/font][font=Calibri]E.coli[/font][font=宋体]、小麦胚芽和人类细胞等。这意味着可以根据不同的实验目的和需求进行合理的选择,以适应多样化的研究需要。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]易操作性:无细胞蛋白表达系统非常容易操作。与传统的细胞表达系统相比,无细胞蛋白表达系统不需要细胞培养、生长和繁殖。此外,无细胞蛋白表达系统可以快速进行,通常只需要数小时至几天即可完成目标蛋白的表达。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]简单纯化:由于无细胞蛋白表达系统可以避免有机溶剂和离子交换剂等复杂的步骤,从而使目标蛋白的纯化工作更加简便和迅速。例如,可以使用亲和柱、凝胶过滤和电泳分析等方法来快速分离和纯化蛋白质。[/font][/font][font=宋体] [/font][font=宋体][b]二、无细胞蛋白表达系统的缺点[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]成本较高:尽管无细胞蛋白表达系统可以大规模进行蛋白质表达,但是所需的原核和真核细胞提取物通常需要较高的成本。此外,涉及到的一些试剂和设备也比较昂贵,使得无细胞蛋白表达系统在应用过程中存在一定的经济压力。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]表达限制:由于无细胞蛋白表达系统缺乏复杂的代谢反应和细胞分化机制,因此它不适用于某些特定类型的蛋白。例如,它无法表达复杂的膜蛋白和困难的药物蛋白等。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]不稳定性:无细胞蛋白表达系统通常具有一定的稳定性问题。由于缺乏细胞膜的保护,无细胞蛋白表达体系会更容易受到外部条件的影响,如温度、[/font][font=Calibri]pH[/font][font=宋体]、离子浓度等,从而导致蛋白质的不稳定性、聚集和降解等现象。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]不适合复杂蛋白结构:无细胞蛋白表达系统对于复杂蛋白结构的模拟效果不佳。例如,膜蛋白、多肽和糖蛋白等复杂蛋白质可能会被无细胞蛋白表达系统无法很好地复制,从而限制了其应用范围。[/font][/font][font=宋体] [/font][font=宋体]无细胞蛋白表达系统具有高效、灵活、易操作、简单纯化等优点,但同时也存在着成本较高、表达限制、不稳定性和不适合复杂蛋白结构等缺点。在实际应用中,需要根据具体的研究目的和需求进行选择,并结合其他技术手段来弥补其不足之处。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/cell-free-protein-synthesis-service][b]无细胞蛋白表达服务[/b][/url],服务优势:[/font][font=宋体]①快速、高效 ②高成功率 ③一致性 ④高难度抗体表达[/font][/font][font=宋体] [/font][font=宋体][font=宋体]详情可以咨询,具体[/font][font=Calibri]https://cn.sinobiological.com/services/cell-free-protein-synthesis-service[/font][/font]
[font='times new roman'][size=18px]ODC1[/size][/font][font='times new roman'][size=18px]在[/size][/font][font='times new roman'][size=18px]DLBCL[/size][/font][font='times new roman'][size=18px]中的表达及[/size][/font][font='times new roman'][size=18px]ODC1[/size][/font][font='times new roman'][size=18px]低表达细胞模型的构建[/size][/font][font='times new roman'][size=18px]ODC1 [/size][/font][font='times new roman'][size=18px]低表达细胞模型的构建[/size][/font][font='times new roman'][size=16px][color=#000000]应用慢病毒感染[/color][/size][/font][font='times new roman'][size=16px][color=#000000]技术敲低[/color][/size][/font][font='times new roman'][size=16px][color=#000000]DLBCL[/color][/size][/font][font='times new roman'][size=16px][color=#000000]细胞系[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Pfeiffer ODC1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的表达,同时设置对照组除外病毒本身对细胞产生的影响,待细胞状态良好使用嘌呤霉素筛选;荧光显微镜下观察如图,可见[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Pfeiffer-[/color][/size][/font][font='times new roman'][size=16px][color=#000000]shNC[/color][/size][/font][font='times new roman'][size=16px][color=#000000]、[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Pfeiffer-shODC1-1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]、[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Pfeiffer-shODC1-2[/color][/size][/font][font='times new roman'][size=16px][color=#000000]细胞均产生绿色荧光,表明人[/color][/size][/font][font='times new roman'][size=16px][color=#000000]DLBCL[/color][/size][/font][font='times new roman'][size=16px][color=#000000]细胞系慢病毒感染成功。[/color][/size][/font][align=center][img]" style="max-width: 100% max-height: 100% [/img][/align][align=center][font='times new roman'][color=#000000]图[/color][/font][font='times new roman'][color=#000000] [/color][/font][font='times new roman'][color=#000000]慢病毒感染后[/color][/font][font='times new roman'][color=#000000] 4X [/color][/font][font='times new roman'][color=#000000]荧光显微镜下图片([/color][/font][font='times new roman'][color=#000000]Pfeiffer[/color][/font][font='times new roman'][color=#000000]明场及荧光照片)[/color][/font][/align][font='times new roman'][size=18px]敲低[/size][/font][font='times new roman'][size=18px] ODC1 [/size][/font][font='times new roman'][size=18px]后转录水平和蛋白水平验证[/size][/font][font='times new roman'][size=16px][color=#000000]分别提取对数生长期的[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Pfeiffer-NC[/color][/size][/font][font='times new roman'][size=16px][color=#000000]、[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Pfeiffer-shODC1-1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]、[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Pfeiffer-shODC1-2[/color][/size][/font][font='times new roman'][size=16px][color=#000000]细胞的[/color][/size][/font][font='times new roman'][size=16px][color=#000000]RNA[/color][/size][/font][font='times new roman'][size=16px][color=#000000]和蛋白,利用[/color][/size][/font][font='times new roman'][size=16px][color=#000000]q-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url] [/color][/size][/font][font='times new roman'][size=16px][color=#000000]技术分别检测各细胞[/color][/size][/font][font='times new roman'][size=16px][color=#000000]ODC1 mRNA [/color][/size][/font][font='times new roman'][size=16px][color=#000000]相对表达量,结果如图所示,与对照组相比,[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Pfeiffer-shODC1-1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]、[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Pfeiffer-shODC1-2[/color][/size][/font][font='times new roman'][size=16px][color=#000000]组[/color][/size][/font][font='times new roman'][size=16px][color=#000000]ODC1 mRNA [/color][/size][/font][font='times new roman'][size=16px][color=#000000]表达量明显降低([/color][/size][/font][font='times new roman'][size=16px][color=#000000]P [/color][/size][/font][font='times new roman'][size=16px][color=#000000]0.001[/color][/size][/font][font='times new roman'][size=16px][color=#000000])。利用[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Western blot[/color][/size][/font][font='times new roman'][size=16px][color=#000000]技术检测各细胞内[/color][/size][/font][font='times new roman'][size=16px][color=#000000] ODC1 [/color][/size][/font][font='times new roman'][size=16px][color=#000000]蛋白的表达情况。结果如图所示,与对照组相比,[/color][/size][/font][font='times new roman'][size=16px][color=#000000]ODC1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]蛋白表达在[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Pfeiffer-shODC1-1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]、[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Pfeiffer-shODC1-2[/color][/size][/font][font='times new roman'][size=16px][color=#000000]细胞中明显降低。表明[/color][/size][/font][font='times new roman'][size=16px][color=#000000]ODC1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]低表达细胞模型构建成功。[/color][/size][/font][align=center][img]" style="max-width: 100% max-height: 100% [/img][/align][align=center][font='times new roman'][color=#000000]图[/color][/font][font='times new roman'][color=#000000] [/color][/font][font='times new roman'][color=#000000]敲低[/color][/font][font='times new roman'][color=#000000] ODC1 [/color][/font][font='times new roman'][color=#000000]在转录水平和蛋白水平的验证([/color][/font][font='times new roman'][color=#000000]***[/color][/font][font='times new roman'][color=#000000]P [/color][/font][font='times new roman'][color=#000000]0.001[/color][/font][font='times new roman'][color=#000000])[/color][/font][/align][font='times new roman'][size=20px]小结[/size][/font][font='times new roman'][size=16px][color=#000000]1. [/color][/size][/font][font='times new roman'][size=16px][color=#000000]公共数据库分析显示[/color][/size][/font][font='times new roman'][size=16px][color=#000000]ODC1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]在[/color][/size][/font][font='times new roman'][size=16px][color=#000000]DLBCL[/color][/size][/font][font='times new roman'][size=16px][color=#000000]中的表达高于正常组织,与[/color][/size][/font][font='times new roman'][size=16px][color=#000000]DLBCL[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的[/color][/size][/font][font='times new roman'][size=16px][color=#000000]分期无[/color][/size][/font][font='times new roman'][size=16px][color=#000000]明显关系,[/color][/size][/font][font='times new roman'][size=16px][color=#000000]高表达[/color][/size][/font][font='times new roman'][size=16px][color=#000000]ODC1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的[/color][/size][/font][font='times new roman'][size=16px][color=#000000]DLBCL[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的[/color][/size][/font][font='times new roman'][size=16px][color=#000000]DFS[/color][/size][/font][font='times new roman'][size=16px][color=#000000]明显降低;实时荧光定量[/color][/size][/font][font='times new roman'][size=16px][color=#000000][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/color][/size][/font][font='times new roman'][size=16px][color=#000000]([/color][/size][/font][font='times new roman'][size=16px][color=#000000]q-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/color][/size][/font][font='times new roman'][size=16px][color=#000000])及[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Western blot[/color][/size][/font][font='times new roman'][size=16px][color=#000000]结果显示[/color][/size][/font][font='times new roman'][size=16px][color=#000000]ODC1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]在人[/color][/size][/font][font='times new roman'][size=16px][color=#000000]DLBCL[/color][/size][/font][font='times new roman'][size=16px][color=#000000]细胞系中的表达均显著增加。[/color][/size][/font][font='times new roman'][size=16px][color=#000000]2. [/color][/size][/font][font='times new roman'][size=16px][color=#000000]应用[/color][/size][/font][font='times new roman'][size=16px][color=#000000]shODC1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]慢病毒载体感染[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Pfeiffer[/color][/size][/font][font='times new roman'][size=16px][color=#000000]细胞后,利用[/color][/size][/font][font='times new roman'][size=16px][color=#000000]q-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/color][/size][/font][font='times new roman'][size=16px][color=#000000]及[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Western blot[/color][/size][/font][font='times new roman'][size=16px][color=#000000]实验验证[/color][/size][/font][font='times new roman'][size=16px][color=#000000]ODC1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]在[/color][/size][/font][font='times new roman'][size=16px][color=#000000]mRNA[/color][/size][/font][font='times new roman'][size=16px][color=#000000]及蛋白水平的表达,结果显示,与对照组相比,[/color][/size][/font][font='times new roman'][size=16px][color=#000000]Pfeiffer-shODC1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]组[/color][/size][/font][font='times new roman'][size=16px][color=#000000]ODC1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]的[/color][/size][/font][font='times new roman'][size=16px][color=#000000]mRNA[/color][/size][/font][font='times new roman'][size=16px][color=#000000]及蛋白的表达明显降低。表明[/color][/size][/font][font='times new roman'][size=16px][color=#000000]ODC1[/color][/size][/font][font='times new roman'][size=16px][color=#000000]低表达细胞模型构建成功,可以用于后续实验。[/color][/size][/font]
请教电化学专家模拟电路的阻抗值表达式。看到曹楚南《电化学阻抗谱导论》书中34页的一个表达式,感觉有点问题,跪求指教。正确的是A还是B由于不会粘贴图片,给大家带来不便,不好意思。问题见附件[~134220~]
把焦点放在你希望看到的结果上。你希望对方在听完你的陈述后,他的想法、感觉或行动有何不同?你希望他对你的看法为何?如何在工作场合中有效表达自己的想法?以下十则方法不妨一试:1、把焦点放在你希望看到的结果上。你希望对方在听完你的陈述后,他的想法、感觉或行动有何不同?你希望他对你的看法为何?2、写下你想表达的关键讯息。这个讯息必须具有吸引力而且简洁,自问:如果这是一条新闻标题,你会想看这条新闻吗?想象你是自己的听众之一,你会想听自己所说的话吗?3、在有限的时间内,尽量包含所有想说的内容。说太多却没有重点,不如挑选出精华,让对方了解重点。4、内容结构清楚。对方很难将你的字字句句都听进去,有结构的表达方式,对方会比较容易消化。5、准备好对方的情绪。情绪具有传染性,对方会受你的影响,从自己出发,鼓舞对方对你的谈话产生兴趣。6、表达的方式尽量流畅,而不是死背出来的。如果你使用投影片等辅助器材,确定自己知道投影片之间的连贯性,由你主导谈话思路,而不是以辅助器材为主,看到内容有什么才讲什么。7、你和对方间不要有东西阻隔。尽量与所有听众眼神接触,如果你和对方之间有东西阻碍视线,把东西移开。8、变换音量、音高和音调。如果你的语调平平,对方很可能会打瞌睡或无法集中注意力,适时使用停顿,沉默是获取注意力,以及强调某一观点的好方法。9、显示出人性。谈话中适时微笑。10、反复练习。把谈话内容大声说出来,和在自己脑中暗暗思考不同,事前先把内容练习说出来,如果有人可以当你的听众会更好。
[font=宋体][font=宋体]重组蛋白是利用[/font][font=Calibri]DNA(RNA)[/font][font=宋体]重组技术表达的蛋白重组。蛋白表达是将目的基因通过电转化或者热激等手段转入合适的宿主中,利用宿主的特定生理、生化和遗传特点进行目标蛋白大量表达及纯化的生物技术。目前,较为主流的表达宿主有大肠杆菌([/font][font=Calibri]E.coli[/font][font=宋体])、毕赤酵母([/font][font=Calibri]P.pastoris[/font][font=宋体])、昆虫[/font][font=Calibri]-[/font][font=宋体]杆状病毒([/font][font=Calibri]Bac-to-Bac[/font][font=宋体]系统)以及哺乳动物细胞系([/font][font=Calibri]CHO[/font][font=宋体]、[/font][font=Calibri]HEK293[/font][font=宋体])等。鉴于目标蛋白的应用场景和自身理化性质的差异,选择合适的表达宿主尤为关键。[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]大肠杆菌([/font][font=Calibri]E.coli[/font][font=宋体]):[/font][/font][/b][font=宋体] [/font][font=宋体]表达系统:原核[/font][font=宋体]优势:经济、快速、高产量、应用广泛[/font][font=宋体]劣势:包涵体;无翻译后修饰;大分子蛋白表达困难[/font][font=宋体]推荐表达:细菌类蛋白;抗原类蛋白;细胞因子;酶类[/font][font=宋体] [/font][b][font=宋体]酵母细胞:[/font][/b][font=宋体]表达系统:真核[/font][font=宋体]优势:经济、快速、高产量;部分翻译修饰[/font][font=宋体]劣势:非人源糖基化;高甘露糖修饰[/font][font=宋体]推荐表达:细胞因子;少分子量蛋白;酶类[/font][font=宋体] [/font][b][font=宋体][font=宋体]杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫细胞:[/font][/font][/b][font=宋体]表达系统:真核[/font][font=宋体]优势:基因容量大;可溶蛋白;适合毒性蛋白;类似哺乳动物系统;翻译后修饰[/font][font=宋体]劣势:周期长;成本高;缺少部分糖基化[/font][font=宋体]推荐表达:细胞质蛋白;毒性蛋白;跨膜蛋白;分泌蛋白;激酶;[/font][font=宋体] [/font][b][font=宋体]哺乳动物细胞[/font][font=宋体]表达[/font][font=宋体]:[/font][/b][font=宋体]表达系统:真核[/font][font=宋体]优势:可溶蛋白;更低内毒素;更好的活性;更好的翻译后修饰;可瞬时转染与稳定转染表达[/font][font=宋体]劣势:周期长;成本高;[/font][font=宋体]推荐表达:分泌蛋白;跨膜蛋白;重组抗体;抗体等[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州拥有原核细胞表达平台、哺乳动物瞬时表达平台、杆状病毒[/font][font=Calibri]-[/font][font=宋体]昆虫蛋白表达平台,同时提供[url=https://cn.sinobiological.com/services/e-coli-protein-expression-service][b]原核([/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/services/e-coli-protein-expression-service][b]E. coli[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/e-coli-protein-expression-service][b])蛋白表达服务[/b][/url]……可实现重组蛋白和重组抗体的高通量和高产量表达,可为客户提供[url=https://cn.sinobiological.com/services/recombinant-antibody-production-service][b]重组表达服务[/b][/url]及一站式定制需求。详情可以关注 大肠杆菌蛋白表达平台:[/font][font=Calibri]https://cn.sinobiological.com/services/platform/e-coli-protein-expression[/font][/font][font=宋体] [/font][font=宋体] [/font]
由武汉大学生命科学院教授、武汉禾元生物科技有限公司董事长杨代常领衔的研发团队从2006年开始进行植物源替代血浆来源的医药蛋白的研究与开发,现已取得突破性进展并已跨入规模化生产的阶段,填补了国际上此项技术空白。相关论文“Large-scale production of functional human serum albumin from transgenic rice seeds ”(利用转基因水稻规模化生产重组人血清白蛋白)于2011年10月31日在线发表于《美国科学院院报》( PNAS ) 。该论文在线之际,受到国外Scientist , Nature news , The Australian , Thomson Reuters, Fox News , Agence France Presse (AFP法新社) 等美国、英国、俄罗斯、德国、巴西、印度各专业杂志及媒体的广泛关注和报道。该研究表明由转基因水稻种子生产的重组人血清白蛋白(OsrHSA)在生理生化性质、物理结构,生物学功能、免疫原性与血浆来源的人血清白蛋白一致;并建立了大规模生产重组人血清白蛋白的生产工艺,获得了高纯度和高产量重组人血清白蛋白产品。利用大量数据证明了转基因水稻种子可取代现有基于发酵的表达技术来生产重组蛋白质是经济有效的。正如PNAS 审稿人对该文章的评价:“这篇文章解决了在科学上振奋人心、在经济上都非常重要的议题--即用转基因植物生产血浆产品或其他蛋白产品的技术平台,可代替其他基于发酵的表达技术,其重要性也不言而喻……这篇文章近乎完美地证实了植物生产的医药蛋白和批准临床使用的血浆来源医药蛋白是完全相同的,并提供了翔实数据证明植物系统规模化容易和成本优势。”目前,人血清白蛋白(human serum albumin)广泛应用于临床治疗和细胞培养领域。常见的人血清白蛋白大多数从人的血浆中提取,这样的生产方式不仅受到血浆供应的限制,而且还具有携带病毒传播的高风险性。国际上以重组人血白蛋白替代血源产品的应用已成为趋势,国内市场需求也逐年扩大,2010年已达150吨。尽管市场广阔,但高纯度重组人血白蛋白的规模化生产技术和质量控制技术却是世界性难题。武汉禾元历经多年的技术攻关,利用水稻胚乳表达技术平台,研发出国际先进水平的重组人血白蛋白产品生产技术,并成功实现重组人血白蛋白规模化和产业化,完全摆脱了相关制约,具有纯度更高、无动物组分、安全、高效、绿色环保、廉价、无限量供应等优势。随着植物源重组人血清白蛋白的发展,我国人血清白蛋白日益紧张的局面必将得到缓解。详细论文,请点击下载:http://www.oryzogen.com/category/22/2011-11-01/93315359.html注:《美国科学院院报》(Proceedings of the National Academy of Sciences of the United States of America, 缩写 PNAS,ISSN:0027-8424)是被引用次数最多的综合学科文献之一。它是美国科学院的院刊。自1914年创刊至今,PNAS提供具有高水平的前沿研究报告、学术评论、学科回顾及前瞻、学术论文以及美国国家科学学会学术动态的报道和出版。PNAS收录的文献涵盖生物、物理和社会科学,2008年的影响因子为9.38,2009年影响因子为9.432, 2010年影响因子为9.771。在SCI综合科学类排名第三位,因而已成为全球科研人不可缺少的科研资料。
初学英语的人,常用expense来表示一切“费用”。其实expense主要是“花费”、“开支”之意,如current expenses“日常开支”,selling expenses“销售费用”,travelling expenses“旅费”等等。在现实生活中,各种“费用”有各种不同的表达法:一、admission (n.)指入场费。 如:admission by ticket only凭票入场二、charge (n.)“原价、要价”。 常用复数,主要用于一次性劳务所收取的费用,如服务费、行李超重费、旅馆费等等。 如:What are the charges in the hotel? 这家旅馆收费多少?三、cost (n.)本义为“成本”、“原价”。 常常用来表示对已取得的货物或劳务所支付的费用。 如:The cost of seeing a movie is seven dollars.看一场电影要花七美元。四、fare (n.)指旅客乘公共汽车、出租车、火车、轮船、飞机等所支付的费用。 如:All fares, please. (公共汽车售票员用语)请买票。五、fee (n.)医生、律师或其它专门职业的佣金及会费、手续费、停车费等。 如:My lawyer's hourly fee is 130 dollars. 我的律师的佣金是每小时130美元。六、freight (n.)运费,指海运、空运、陆运的费用。 如:Who will pay the freight on this order? 谁支付这批定货的运费?七、postage (n.)指邮费。 如:How much postage do I need to send this package?寄这个包裹须付多少钱?八、rent (n. )土地、建筑物、房舍、机器等定期的租费。 如:The student owed three months’rent for my house.那学生欠我三个月的房租。九、tip (n.)小费。 如:I gave my barber a fat tip. 我给理发师优厚的小费。十、toll (n.)道路、桥梁、港口、市场的捐税、通行费及电话费等。 如:This month I had to pay 200 yuan toll call.这个月我要缴200元的电话费。十一、tuition (n.)学费。 如:John took out a loan to pay his tuition.
区别呢 原核表达载体 在原核生物表达 ,真核的在真核表达 很像废话 呵呵呵呵。。。。 就是 原核载体可以将真核基因表达,但是表达出来的蛋白是没有活性的,因为缺少翻译后修饰系统。。。真核的表达载体呢 由于比较大 不适合大量快速扩增,所以要在其载体上构建可以在原核生物 如大肠杆菌中复制的所需的复制原件 。。。。综上 在应用的时候 要构建 穿梭质粒 可以穿梭于 原核和 真核 呵呵 还有就是 原核表达载体的基本元件和真核的有不同的地方 。。。。。总觉得不够正确答案 。。。。。有些人缘的蛋白在原核里没有蛋白翻译后修饰,表达后没有活性,这时候就得在真核里表达了原核表达做抗体,真核表达做功能研究。(1)原核载体,将克隆化基因插入合适载体后导入大肠杆菌用于表达大量蛋白质的方法一般称为原核表达。这种方法在蛋白纯化、定位及功能分析等方面都有应用。大肠杆菌用于表达重组蛋白有以下特点:易于生长和控制;用于细菌培养的材料不及哺乳动物细胞系统的材料昂贵;有各种各样的大肠杆菌菌株及与之匹配的具各种特性的质粒可供选择。但是,在大肠杆菌中表达的蛋白由于缺少修饰和糖基化、磷酸化等翻译后加工,常形成包涵体而影响表达蛋白的生物学活性及构象。 你可以就其在蛋白纯化等方面的作用进一步进行说明。(2)真核载体,要表达真核生物的蛋白质,采用真核表达系统自然应比原核系统优越,常用的酵母、昆虫、动物和哺乳类细胞等表达系统。真核表达载体的应用比较广,通过真核表达,可以研究某一基因的功能,比如把载有目标基因的载体导入到特定的哺乳动物细胞中以后,如果该基因发挥着某种功能,则可以通过其引起细胞的变化来说明问题等等。你可以搜索一下,这方面还是很多的。
[size=15px][color=#595959][b]茱萸丸(ZYP)[/b]最早记录在宋代《太平圣惠方》中,由[b]黄连、吴茱萸按1:1[/b]的比例组成。在中医理论中,肝胆之气是肝胆功能的概括,肝胆之气功能障碍往往导致[b]消化系统[/b]疾病。ZYP是传统上[b]治疗肝胆胃肠疾病的药物[/b],具有明显的改善肝胆之气的作用。[/color][/size] [size=15px][color=#595959]先前的研究表明,ZYP通过调节粪便代谢稳态和粪便微生物丰度的双重作用,以及调节肝脏中miR-147等miRNA及其靶基因的表达,具有显著的抗胆汁淤积作用。然而,ZYP治疗胆汁淤积的机制尚未完全确定。 [size=15px]探讨ZYP对胆汁淤积大鼠模型mRNA-seq分析干预作用的机制。[/size] [size=15px]将所有大鼠随机分为5组:对照组(Control)、模型组(Model)、ZYP低剂量组(ZYP_L,0.6 g/kg)、ZYP高剂量组(ZYP_H,1.2 g/kg)、熊去氧胆酸组(UDCA,60 mg/kg),每组6只。适应饲养4天后,从第5天开始,ZYP_L、ZYP_H和UDCA组大鼠分别每天灌胃给药,直至第10天。同时,模型组和对照组给予等量的纯净水。第11天,试验组小鼠灌胃橄榄油溶异硫氰酸-A-萘酯(ANIT)溶液50 mg/kg,给予对照大鼠相应剂量的橄榄油。第12-14天,ZYP_L组、ZYP_H组和UDCA组大鼠分别灌胃0.6 g/kg、1.2 g/kg ZYP和60 mg/kg UDCA,模型组和对照组大鼠灌胃等量纯净水。第15天,用150 mg/kg戊巴比妥钠麻醉处死各组大鼠,取各组血液和肝组织进行检测。[/size][size=15px]采用血清生化和组织病理学结果评价ZYP的治疗效果,采用实时荧光定量[url=https://insevent.instrument.com.cn/t/jp]PCR[/url] (qRT-[url=https://insevent.instrument.com.cn/t/jp]PCR[/url])进行mRNA-Seq分析和验证。结合GO、KEGG和GSEA分析来确定ZYP影响胆汁淤积大鼠的机制。[/size][/color][/size][align=center] [/align][size=15px][color=#595959]ZYP能明显改善胆汁淤积大鼠血液生化指标及肝脏组织病理学的异常变化,调节脂肪酸代谢、视黄醇代谢、类固醇激素生物合成等胆汁、脂质代谢相关通路,减轻炎症、胆汁淤积及脂质代谢紊乱。必备基因Cyp2a1、Ephx2、Acox2、Cyp1a2、Cyp2c11、Sult2a1的相对表达量经qRT-[url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url]验证,与mRNA-seq分析趋势一致。[/color][/size][size=16px][color=#3573b9]结论[/color][/size] [size=15px][color=#595959]ZYP[b]通过调节胆汁代谢和脂质代谢相关通路,具有显著的抗胆汁淤积作用[/b]。这些结果表明,ZYP是一种治疗胆汁淤积症的新方法。[/color][/size]
[font=宋体][font=宋体]无细胞蛋白表达是一种体外重组蛋白质表达技术也称为无细胞蛋白质合成技术([/font][font=Calibri]CFPS[/font][font=宋体]:[/font][font=Calibri]Cell-free protein synthesis[/font][font=宋体]),是指用含有蛋白合成必需的组分(核糖体,转运[/font][font=Calibri]RNA[/font][font=宋体],氨酰合成酶,启动[/font][font=Calibri]/[/font][font=宋体]延伸[/font][font=Calibri]/[/font][font=宋体]终止因子,三磷酸鸟苷,[/font][font=Calibri]ATP[/font][font=宋体],[/font][font=Calibri]Mg2+[/font][font=宋体]和[/font][font=Calibri]K+[/font][font=宋体])的细胞裂解物在体外进行蛋白合成。无细胞蛋白表达技术适用于制备各种类型的蛋白质,包括难表达蛋白质、毒性蛋白质、复杂蛋白质等。在药物研究、生物制造和生命科学等领域中得到广泛关注和应用,无论是研究、开发还是商业化应用过程。目前无细胞蛋白表达主要应用于药物研发领域,例如抗体制备和生物药物生产等。随着人工智能技术的不断发展,无细胞蛋白表达技术可以与人工智能算法结合,构建计算机辅助的高通量生产系统,实现个性化、精准的生物医学治疗。除此之外,还能够应用于其他领域,例如基因工程、环境保护和农业生产等。随着无细胞蛋白表达技术的不断发展和人工智能技术的不断进步,我们可以看到更多的新领域和新应用出现,给生物科技行业带来更多的机遇和挑战。[/font][/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]相较于传统的活细胞蛋白表达技术,无细胞蛋白表达技术具有以下几个显著的优势:[/font][/b][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]更高的蛋白质表达量:传统的活细胞蛋白表达技术受限于细胞本身的多方面因素,其表达的蛋白质数量往往受到限制。而无细胞蛋白表达技术通过在体外底物浓度高的环境中进行合成反应,不但避免了传统活细胞表达所面临的方方面面的限制,还能够很好地控制反应体系,从而获得表达量更高的蛋白质。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]更快的表达速度:传统活细胞蛋白表达需要细胞生长并达到最佳密度才能进行蛋白质表达,这个过程往往需要数天时间。而无细胞蛋白表达技术通常只需要数小时就能够完成蛋白质的表达,这个速度明显快于传统活细胞表达技术。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]更精准的蛋白质合成:无细胞蛋白表达技术在体外进行蛋白质合成,能够精确控制底物浓度、反应温度、反应剂比例等参数,因此可以更加精准地合成定制的蛋白质,这对于研究和应用来讲具有重要意义。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4. [/font][font=宋体]更灵活控制:在无细胞蛋白表达技术中,可以使用分离的组分体系进行蛋白质的合成,可以控制底物和反应剂的比例,也可以在适当的反应条件下进行自定义的修饰,如蛋白质标记、药效分析等。这些优点使得无细胞蛋白表达技术更加灵活、可控,适用于更广泛的应用领域。[/font][/font][font=宋体] [/font][b][font=宋体] [/font][font=宋体]无细胞蛋白表达应用[/font][/b][font=宋体] [/font][font=宋体]无细胞蛋白表达技术是一种飞速发展的新型生物技术,具有广阔的应用前景和潜力。该技术可以快速、高效、经济地合成蛋白质,可广泛应用于医疗、制药、农业、生物材料等多个领域。[/font][font=宋体] [/font][font=宋体][font=Calibri]1. [/font][font=宋体]医疗领域:无细胞蛋白表达技术在医疗领域应用广泛,可以用于生产多种蛋白质药品,如单克隆抗体等。其中,单克隆抗体是一种重要的治疗药物,具有高度特异性和亲和力,可用于肿瘤、心血管疾病、自身免疫性疾病等疾病的治疗。传统单克隆抗体生产方法需要花费大量时间和成本,而无细胞蛋白表达技术则可以在短时间内大规模合成单克隆抗体,从而大大缩短生产周期,并且可以降低成本。此外,无细胞蛋白表达技术也可以用于疫苗研发。比如疟疾疫苗研究开发昂贵又耗时,目前利用[/font][font=Calibri]WGE[/font][font=宋体]系统可加速疫苗研发,并建立高通量疟原虫抗体筛查系统。[/font][font=Calibri]Stark[/font][font=宋体]等利用大肠杆菌的便携式冻干裂解物再水化,[/font][font=Calibri]1h[/font][font=宋体]内合成高致病性病原体土拉弗朗西斯菌亚种的生物偶联疫苗,与工程菌生产的疫苗相比,其可引发更高水平的病原体特异性抗体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2. [/font][font=宋体]制药领域:是无细胞蛋白表达技术的一个重要应用领域。药物开发的成功率取决于药物分子对目标蛋白的亲和力,而目标蛋白对于专一的细胞表达系统和分类的组织或器官非常敏感。通过无细胞蛋白表达技术,研究人员可以在不依赖于细胞的情况下直接生产大量需要的蛋白质,为药物研发提供了更快更便捷的方法。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3. [/font][font=宋体]基础研究领域:利用无细胞蛋白质合成系统可以直接对表达产物进行核磁共振分析,目前已确定了数千个蛋白质的结构。可以通过合成蛋白质建立蛋白质阵列,解开基因产物的功能;应用核糖体展示和 [/font][font=Calibri]mRNA [/font][font=宋体]展示技术,更有利于实现高通量筛选,全面深入研究基因特征和功能。通过无细胞蛋白表达技术可以实现对大型蛋白质的生产和分析,同时也为基础研究打开了新的研究领域。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]目前义翘神州无细胞合成服务正在活动中,活动时间[/font][font=Calibri]2023[/font][font=宋体]年[/font][font=Calibri]10[/font][font=宋体]月[/font][font=Calibri]23[/font][font=宋体]日[/font][font=Calibri]-12[/font][font=宋体]月[/font][font=Calibri]31[/font][font=宋体]日。有需求的可以咨询或者进入义翘神州网进行查看。更多详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/services/cell-free-protein-synthesis-service[/font][/font]
老板给了小弟这样一个课题:小麦苗期旱胁迫差异表达分析。当前考虑的大致方向就是寻找表达的差异基因,关于差异基因的寻找,跟朋友交流期间,总结了以下几条建议,选取样品进行:1. 转录组测序;2. 表达谱测定;3. 建个cDNA文库或SSH文库。由于之前对分子领域知之甚少,听别人给说的很好,自己听不太明白,想问问以上几种方法都有什么特点呢?适于进行什么类型的试验呢?老板的意思是我负责寻找并克隆几个差异基因并进行功能验证,基于这样的目的,以上的那种方法比较好呢?或者有其他更好的办法,请详细一讲解下,不胜感激呢,快憋屈死了
一、原理1、E .coli 表达系统E .coli 是重要的原核表达体系。在重组基因转化入E .coli 菌株以后,通过温度的控制,诱导其在宿主菌内表达目的蛋白质,将表达样品进行SDS-PAGE 以检测表达蛋白质。2、外源基因的诱导表达提高外源基因表达水平的基本手段之一,就是将宿主菌的生长与外源基因的表达分成两个阶段,以减轻宿主菌的负荷。常用的有温度诱导和药物诱导。本实验采用异丙基硫代-β-D-半乳糖昔(IPTG)诱导外源基因表达。不同的表达质粒表达方法并不完全相同,因启动子不同,诱导表达要根据具体情况而定。二、材料1、诱导表达材料(1 )LB (Luria—Bertani))培养基酵母膏 (Yeast extract)5g 蛋白胨 (Peptone)10gNaCl10g 琼脂 (Agar)1-2%蒸馏水 (Distilled water)1000ml pH 7.0适用范围:大肠杆菌(2 )IPTG 贮备液:2 g IPTG溶于10 ml 蒸馏水中,0 .22 μm 滤膜过滤除菌,分装成1 ml /份,-20 ℃ 保存。(3 )l× 凝胶电泳加样缓冲液:50 mmol / L Tris -CI (pH 6 .8 )50 mmol / L DTT2 % SDS (电泳级)0.1 % 溴酚蓝10 % 甘油2、大肠杆菌包涵体的分离与蛋白纯化材料1 )酶溶法(1)裂解缓冲液:50 mmol / L Tris-CI (pH 8 .0 )1 mmol / L EDTA100 mmol / LNaCI(2)50 mmol / L 苯甲基磺酰氟(PMSF )。(3)10 mg / ml 溶菌酶。(4)脱氧胆酸。(5)1 mg / ml DNase I。2 )超声破碎法(1 )TE 缓冲液。(2 )2×SDS -PAGE 凝胶电泳加样缓冲液:100 mmol / L Tris-HCI (pH 8 .0 )100 mmol / L DTT4 %SDS0.2 % 溴酚蓝20 % 甘油
[b][font=宋体]前言[/font][/b][font=宋体]在当今的生物技术领域,高通量重组蛋白表达技术在基础研究和商业应用中扮演着非常重要的角色。随着后基因组时代的到来,研究人员对大规模蛋白表达和纯化的需求日益增长,大肠杆菌因其易于遗传操作、低成本、生长迅速成为生产重组蛋白的首选微生物宿主。本文将综述大肠杆菌中高通量重组蛋白表达的现状和未来展望,探讨从目的基因获取到蛋白表达和纯化的先进技术,并讨论如何克服[/font][url=https://cn.sinobiological.com/resource/protein-review/protein-expression][u][font=宋体][color=#0000ff]重组蛋白表达[/color][/font][/u][/url][font=宋体]过程中的挑战。[/font][font=Calibri] [/font][b][font=宋体]高通量重组蛋白表达技术[/font][/b][font=宋体][font=宋体]高通量研究是一种能够同时检测数千个生物分子,使大规模重复成为可能的研究。[/font][font=Calibri]20[/font][font=宋体]世纪[/font][font=Calibri]90[/font][font=宋体]年代初,第一台[/font][font=Calibri]DNA[/font][font=宋体]测序仪被开发出来,人类基因组计划随之开启,高通量技术在[/font][font=Calibri]DNA[/font][font=宋体]、[/font][font=Calibri]RNA[/font][font=宋体]、蛋白质、脂质和代谢物检测的需求也急剧增加。自该技术提出以来,大肠杆菌中高通量重组蛋白表达和纯化已经得到了广泛的应用。[/font][/font][font=Calibri] [/font][font=Calibri]1. [/font][b][font=宋体]目的基因的制备[/font][/b][font=宋体][font=宋体]获取目的基因是重组蛋白表达的第一步。传统的方法是从[/font][font=Calibri]cDNA[/font][font=宋体]文库中直接克隆基因,但这种方法存在局限性,如从库中筛选基因较为费时以及难以添加融合标签等。高通量[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]技术是目前获取目的基因最常用的技术,设计引物并调整好参数后,即可在[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]仪中自动完成目的基因的制备。[/font][/font][font=Calibri] [/font][font=Calibri] [/font][font=Calibri]2. [/font][b][font=宋体]表达载体的高通量构建[/font][/b][font=宋体][font=宋体]研究人员开发了多种构建表达载体的克隆方法,包括基于限制性内切酶的克隆、重组克隆和不依赖于连接反应的克隆等。这些方法各有优势和局限性,但在近年来都有显著改进。例如,基于限制性内切酶的克隆因其简单、高效、通用和成本效益而备受关注。一个理想的大肠杆菌表达载体应具备选择标记、复制起点、转录启动子、[/font][font=Calibri]5'[/font][font=宋体]非翻译区([/font][font=Calibri]5'UTR[/font][font=宋体])和翻译起始位点。此外,融合标签的添加对于目的基因的转录和蛋白表达同样至关重要。[/font][/font][b][font=Calibri] [/font][/b][font=Calibri]3. [/font][b][font=宋体]大肠杆菌表达菌株的选择和细胞培养[/font][/b][font=宋体][font=宋体]为保证蛋白质表达成功及其表达质量,应选择合适的大肠杆菌菌株,如[/font][font=Calibri]BL21[/font][font=宋体]及其衍生菌株是较常用的重组蛋白生产菌株。培养大肠杆菌比较简单的方法是分批培养,但此方法对生长的控制比较有限。近年来,高通量培养技术使研究人员能够在一系列发酵条件下处理大量样品,大大加快了生产时间。[/font][/font][b][font=Calibri] [/font][/b][font=Calibri]4. [/font][b][font=宋体]高通量蛋白表达和纯化[/font][/b][font=宋体][font=宋体]高通量平台可以快速克隆基因、挑选菌落、分离质粒[/font][font=Calibri]DNA[/font][font=宋体]、转化细菌、表达和纯化蛋白质。这些平台虽然成本高昂,但为复杂的分子生物学实验操作提供了极大的便利。[/font][/font][font=Calibri] [/font][b][font=宋体]结论与展望[/font][/b][font=宋体]大肠杆菌中的[/font][url=https://cn.sinobiological.com/services/high-throughput-antibody-production-service][u][font=宋体][color=#0000ff]高通量重组蛋白表达技术[/color][/font][/u][/url][font=宋体][font=宋体]极大的推进了重组蛋白的表达进程。尽管存在挑战,但通过不断优化和创新,研究人员正在朝着更高效可靠的蛋白质生产系统改进。未来的发展方向包括进一步优化克隆方法、开发新的融合标签、改进表达载体和菌株,以及利用高通量技术实现从[/font][font=Calibri]DNA[/font][font=宋体]到大规模蛋白质生产的快速转变等。[/font][/font][font=Calibri] [/font][font=宋体]参考文献:[/font][font=Calibri]Jia B, Jeon CO. High-throughput recombinant protein expression in Escherichia coli: current status and future perspectives. Open Biol. 2016 6(8):160196. doi:10.1098/rsob.160196[/font]
如果说一个人一次献血200ml,一亩转基因水稻产出的血清白蛋白量约等于300人献的血——转基因水稻胚乳可提取血清白蛋白——转基因水稻胚乳可提取血清白蛋白2012年09月01日 来源: 中国科技网 关注转基因 白蛋白供应紧张一直困扰着人类。我国每年需求150—160吨,全球每年需求量则高达500吨,由于血浆来源紧张,我国目前从血浆中提取量仅可供应1/3,其中2/3依赖进口。 2011年10月31日,武汉大学生命科学学院教授杨代常撰写的论文《利用转基因水稻规模化生产重组人血清白蛋白》在《美国科学院院报》发表,吸引了世界的目光。 文章用翔实的科学数据证明,植物来源的重组人血清白蛋白与临床使用的血浆来源血清白蛋白,无论是在生理生化性质,还是功能用途等方面,都具有高度的等同性。 为何这项研究引发种种关注?稻米血清白蛋白是否会危及生态及人身安全?其何时能用于临床治疗?……带着这些问题,记者采访了杨代常和他的团队。 “借腹生子”:从水稻胚乳中提取血清白蛋白 植物种子生物反应器,是将植物种子作为一个蛋白质“生产车间”,利用植物作为合成蛋白质的“机器”来合成人类所需的蛋白质。“通俗地解释,便是‘借腹生子’。”杨代常说。 国外从1989年已开始利用DNA重组技术生产血清白蛋白,但由于血清白蛋白产量低、纯化工艺复杂、生产成本远高于市场成本,始终无法进入市场。 杨代常带领研究团队,从水稻基因组数据入手,根据水稻种子储藏蛋白与血清白蛋白的生化性质差异,设计出从提取到纯化的一整套工艺方案,最大限度地提取血清白蛋白,最低限度去除种子的内源蛋白,成为一项原始创新的科研成果。 “具体来说,是由表达元件组成的载体,通过遗传工程整合到水稻基因组内,在种子特异性调控元件的指导下,水稻种子在成熟过程中也不断地合成和积累人血清白蛋白,然后通过规模化种植获得原料,再经过提取、纯化等步骤获得高纯度的血清白蛋白。”杨代常介绍,目前大约每亩水稻可以产生1.5—2公斤血清白蛋白,如果说一个人一次能献血200ml,一亩转基因水稻产出的血清白蛋白量约等于300人献血。 “天然屏蔽”:可杜绝肝炎、艾滋病毒等风险 植物源重组血清白蛋白优势明显,它来源于非动物,避免了各种病毒和病原菌的污染,并由于不受血浆供应限制,可无限量供应。但是转基因农业作物安全性向来争议不断,植物源血清白蛋白有望未来直接应用于人体中,有人担心会危及生态及人身安全。 对此,杨代常解释,首先,就人血清白蛋白本身安全性而言,血清白蛋白本就是人体的蛋白质,占血浆中蛋白的30%,是一种安全的蛋白质。目前,根据获取的数据,植物来源的人血清白蛋白从生物活性、分子结构和理化性质与血浆来源的人血清白蛋白完全一致,从水稻胚乳中提取的血清白蛋白可杜绝携带如肝炎病毒、艾滋病毒等风险。研究发现,人体对植物蛋白的耐受能力大于对细菌和酵母的耐受能力。从安全性考虑,已建立高纯度符合医药级别纯度的血清白蛋白。其次,就转基因生物安全而言,由于采取地理和时间双重隔离方法,要求比美国更为严格。第三,为杜绝进入食物链,在研究中采取了专用收割机、烘干机、稻米加工设备以及专用仓库等措施,建立了严格的监管规范,能做到可管可控和可追溯。 未来预期:进入临床需4至5年 从2005年始,杨代常自主研发的水稻胚乳细胞蛋白质高效表达技术平台,填补了国际上此项技术规模化生产的空白,已获美、日、欧盟以及我国的多项专利。 杨代常说,目前,植物源重组血清白蛋白的质量已达到非临床应用标准,可替代血源人血白蛋白用于细胞培养基添加剂,成为细胞培养中血浆来源的血清白蛋白的替代品;可减少培养基中胎牛血清的使用量;还可用于高纯试剂、细胞冷冻保护剂、医疗器械包埋剂、药物载体、化妆品组分、体外诊断等。 国外已在疫苗及生物医药产品的细胞培养的稳定剂上使用。我国按照国家药监局的要求,要通过临床研究后才能进入临床应用。 通过治疗大鼠肝硬化腹水对比,进行植物源重组血清白蛋白的药效研究,发现大鼠肝硬化腹水的治疗效果在降低腹围、增加尿量和尿蛋白量等指标优于血浆来源的血清白蛋白。 “植物源重组血清白蛋白正在进行临床前研究,已完成大部分的药学研究,预计在2013年上半年可望完成临床前研究;预计进入临床研究至少需要2年时间,进入临床应用至少需要4—5年或更长的时间,这取决于临床研究的结果与进度以及国家的法规。”杨代常说。 从实验室走向产业化 去年年初,杨代常带着多年的研发成果,入驻武汉东湖国家自主创新示范区光谷生物城,一年内实现了项目产业化。 “这一过程我们走得很艰难。”杨代常说,为了让投资者更有信心,他在商业模式上从长中短期产品计划入手,将技术做好做精。在科技部转基因重大专项、国家863计划和武汉东湖国家自主创新示范区光谷生物城的支持下,加速了项目产业化进程。 “我国生物产业要走在世界前列,在心理上要打破‘奴性’思维,在政策上要突破传统观念,要敢做别人不能做或不敢做的事情。”杨代常说,“现在一谈到转基因,很多人就‘谈虎色变’。实际上,理解上存在很多误区。转基因技术是通过遗传工程的手段,将人类需要的基因(一段DNA片段)导入到植物或任何一种生物的一项高科技技术,是人类由必然王国走向自由王国的必由之路。” 近日,杨代常的科研团队又传出喜讯,在水稻中“种”出了“人抗胰蛋白酶”。目前,重组抗胰蛋白酶与重组血清白蛋白一样,有效地避免人血液中病毒病原菌感染的风险,但需要进行一系列的免疫原性、急性、毒性等相关实验和临床研究后,方能应用于临床。 杨代常透露,未来,其团队研发重心将着重原创性技术研究,建立单克隆抗体的表达平台,使我国的单克隆抗体药物的价格降到5万元左右,重组血清白蛋白进入临床应用。(记者 马爱平) 《科技日报》(2012-09-01 三版)
在基因表达研究中,研究者比较注意选择合适的表达载体和宿主系统,而往往忽视基因本身是否与载体和宿主系统为最佳匹配这样一个实质性问题。基因的最佳化表达可以通过对基因的重新设计和合成来实现,如消除稀有密码子而利用最佳化密码子,二级结构最小化,调整GC含量等。以下就密码子最佳化、翻译终止效率和真核细胞中异源蛋白表达的问题加以说明。密码子最佳化(codon optimization)遗传密码有64种,但是绝大多数生物倾向于利用这些密码子中的一部分。那些被最频繁利用的称为最佳密码子(optimal codons),那些不被经常利用的称为稀有或利用率低的密码子(rare or low-usage codons)。实际上用做蛋白表达或生产的每种生物(包括大肠杆菌,酵母 ,哺乳动物细胞,Pichia,植物细胞和昆虫细胞)都表现出某种程度的密码子利用的差异或偏爱。大肠杆菌、酵母 、果蝇、灵长类等每种生物都有独特的8个密码子极少被利用。有趣的是,灵长类和酵母 有6个同样的利用率低的密码子。大肠杆菌、酵母 和果蝇中编码丰度高的蛋白质的基因明显避免低利用率的密码子。因此,重组蛋白的表达可能受密码子利用的影响(尤其在异源表达系统中)的事实并不很奇怪。你的基因利用的密码子可能不是你正在利用的蛋白生产系统进行高水平表达所偏爱的密码子,这种情况是可能的。利用偏爱密码子(preferred codons)并避免利用率低的或稀有的密码子可以合成基因,基因的这种重新设计叫密码子最佳化。在同源表达系统中,同较低水平表达的基因相比,较高表达的基因可能有很不同的密码子偏爱。通过对密码子利用的归类分析,人们可以真正预测任何基因在酵母 中的表达水平。在诸如Zea mays的其他生物中,大量高表达基因强烈偏爱以G或C结尾的密码子。而且,在Dictyostelium中,同低水平表达的基因比较,高表达基因有较大数目的偏爱密码子。在大肠杆菌中表达哺乳动物基因是不可预测和具有挑战的。例如直到最近才实现了人血红蛋白的过表达。为了达到血红蛋白的好的表达水平,Alpha-球蛋白cDNA不得不用大肠杆菌偏爱的密码子进行重新合成。在异源宿主中实现象血红蛋白这样复杂的蛋白质的过表达可能需要最佳化密码子,这些研究者为此提供了令人信服的资料。成簇的低利用率的密码子抑制了核糖体的运动,这是基因不能以合适水平表达的一个明显机制。核糖体翻译由九个密码子组成的信使(含几个低利用率密码子或全部为低利用率密码子)时的运动速度要比翻译不含低利用率密码子的同样长的信使的速度慢。即使低利用率密码子簇位于3'端,信使最后也会被核糖体”拥挤”而损害,核糖体又回到5'端。3'端低利用率密码子簇的抑制效应可以和全部信使都由低利用率密码子组成的抑制效应一样大。如果低利用率密码子簇位于5'端,其效应是起始核糖体数目的全面减少,导致蛋白合成中信使的低效率。散在分布的稀有密码子对翻译的效应还未很好地研究,但是有证据表明这种情况的确对翻译效率有负面效应。其他因素也可以影响蛋白表达,包括使mRNA去稳定的序列。重新设计合成基因可以去除或改变这些序列,导致高水平表达。消除稀有密码子、去除任何去稳定序列和利用最佳密码子的基因的重新设计都可能增加蛋白产量,使的蛋白生产更有效和经济。翻译终止效率蛋白表达水平受许多不同因素和过程影响。蛋白稳定性、mRNA稳定性和翻译效率在蛋白生产和积累中起主要作用。翻译过程分为起始、延伸和终止三个期。对于翻译的起始,原核mRNA需要5'端非翻译前导序列中有一段叫Shine-Dalgarno序列的特异核糖体结合序列。在真核细胞,有效的起始依赖于围绕在起始密码子ATG上下游的一段叫Kozak序列的序列。密码子利用或偏爱对延伸有深刻的影响。例如,如果mRNA有很多成簇的稀有密码子,这可能对核糖体的运动速度造成负面影响,大大减低了蛋白表达水平。翻译终止是蛋白生产必须的一步,但其对蛋白表达水平的影响还没有被研究清楚。但是最近的科学研究表明终止对蛋白表达水平有很大的影响。总的来说,更有效的翻译终止导致更好的蛋白表达。绝大多数生物都有偏爱的围绕终止密码子的序列框架。酵母 和哺乳动物偏爱的终止密码子分别是UAA和UGA。单子叶植物最常利用UGA,而昆虫和大肠杆菌倾向于用UAA。翻译终止效率可能受紧接着终止密码子的下游碱基和紧靠终止密码子的上游序列影响。在酵母 中通过改变围绕终止密码子的局部序列框架,翻译终止效率可能被减低几个100倍。对于UGA和UAA,紧接着终止密码子的下游碱基对有效终止的影响力大小次序为GU,AC;对于UAG是U、ACG。对于大肠杆菌,翻译终止效率可因终止密码子及临近的下游碱基的不同而显著不同,从80%(UAAU)到7%(UGAC)。对于UAAN和UAGN系列,终止密码子下游碱基对翻译的有效终止的影响力大小次序为UGA、C。UAG极少被大肠杆菌利用,相比UAAN和UGAN,UAG表现了有效的终止,但其后的碱基对有效终止的影响力为GU,AC。对于哺乳动物,偏爱的终止密码子为UGA,其后的碱基可以对in vivo翻译终止有8倍的影响(A、GC、U)。对于UAAN系列,in vivo终止效率可以有70倍的差别,UGAN系列为8倍。如果终止密码子附近序列没有最佳化,可能发生明显增加的翻译通读,因此减少了蛋白表达。例如,在兔网状细胞无细胞翻译系统里,UGAC的翻译通读可以高达10%,而第四个碱基如果为A,G或C,翻译通读为1%。总的来说,翻译起始框架、翻译终止序列框架和密码子利用应该仔细选择,以利于蛋白的最高水平表达。翻译终止序列框架能几倍地改变蛋白生产水平。真核细胞中的异源蛋白表达异源蛋白质在细菌中表达是目前使用的主要的蛋白生产系统。大肠杆菌一直是最经济的系统之一。然而为了生产需要特异修饰、胞外分泌或有特异折叠需要的蛋白质,其他表达系统也是需要的。真核细胞在表达原核来源的基因、真核基因的cDNA拷贝或其他无内含子的基因时可能表现很多特异问题。富含AT的基因在很多真核细胞中表达时会遭遇很剧烈的障碍。主要的真核信号序列如 加poly-A的位点、酵母 转录终止位点和真核mRNA去稳定序列都是富含AT的。内含子序列也趋向于富含AT,尽管他们有参与剪切过程的很特异的识别序列。虽然绝大多数原核基因没有剪切或聚腺苷过程,但这些真核过程需要的保守序列可能存在于原核基因中,因此当这些基因在真核细胞中表达时可能引起特异的问题。而且诸如哺乳动物和单子叶植物细胞的特异真核表达系统可能不能有效地表达无内含子的基因。 真核mRNA在离开细胞核进而在胞浆的核糖体上被翻译前需要特异的处理和修饰。这些过程包括去除内含子、5'端甲基化帽子形成和3'端加poly-A。内含子去除需要5'剪切位点、G75/G100U100A65AG65U保守序列、3'剪切位点、富含密啶NC66A100G100/G56保守序列和C72T98R77A100Y75保守序列。有效的加poly-A和mRNA剪切需要一个由两个部分组成的信号:加poly-A保守序列AAUAAA和在切割位点内的50个碱基的富含GT的序列。酵母 真核转录终止序列(几个不同的富含AT序列,如含TTTTTATA,TATATA,TACATA,TAGTAGTA的一个38bp区域)被研究的最清楚。这些结果来自对酵母 突变体CYCI mRNA的mRNA水平和相对长度的确定的实验。近期用in vivo质粒稳定性分析的研究结果证明:TATATA似乎和原始的38bp野生型区域一样有效地终止转录,而TAGATATATATGTAA和TACATA效率差些,TTTTTTTATA几乎没有效率。所有这些序列在反方向时没有终止转录功能。不幸的是几乎没有其他真核表达系统转录终止序列方面的信息。内含子对几个哺乳动物基因的正常表达是必需的,包括Beta-球蛋白、SV40 late mRNA和二氢叶酸还原酶基因。单子叶植物细胞充分表达乙醇脱氢酶的cDNA拷贝、报告基因氯霉素乙酰转移酶、Beta葡萄糖苷酸酶和其他缺乏内含子的基因时也依赖内含子。转录区域内引入内含子可以通过未确定的转录后机制增强表达。(免疫球蛋白基因)内含子可能也包含转录增强子,因此通过转录机制增强表达。 总的来讲,如果存在某些DNA序列,真核异源蛋白表达可能是个难题。为避免剧烈的表达减少,需要对基因进行扫描,确认是否含上述提及的富含AT的序列。而且,在几个真核系统表达无内含子基因可能需要引入内含子以实现外源蛋白的充分表达。
本人用大肠杆菌W3110表达一个Ⅱ型膜蛋白,此蛋白具11个跨膜区,tac启动子控制,1mM IPTG 16℃诱导时OD600逐渐下降,同时菌液变粘,可能是菌体破裂核酸释放导致。而37℃诱导时却无此现象。请论坛的各位朋友帮忙分析一下,该如何改进?在此谢过。
胆固醇稳态对机体正常的细胞和系统功能至关重要,胆固醇平衡失调是心血管疾病、神经退行性疾病和癌症等其他疾病的基础[1]。胆固醇代谢包括内源性胆固醇合成、吸收和排泄等环节。研究表明,胆固醇在体内不能被降解,有效排泄是维持其稳态的重要环节[2]。体内积累的胆固醇最终通过肠道以粪便消除胆固醇和胆汁酸的形式达到平衡,目前已知的胆固醇排泄途径包括了胆固醇逆转运(reverse cholesterol transport,RCT)途径和经肠胆固醇排泄(transintestinal cholesterol excretion,TICE)途径;前者是肝脏将胆固醇转化为胆汁酸后经肠排出,后者是由血直接经肠道分泌和排出血浆脂蛋白来源的胆固醇,二者交汇于肠道,因此,肠道在胆固醇稳态中发挥了重要作用[3-4]。调血脂治疗是防治体内高胆固醇含量诱导的相关疾病的有效方法,目前临床常用调血脂药物他汀类的作用是通过降低低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)以限制内源性胆固醇合成,从而防治心血管等疾病的发生发展,但其相关发病率和死亡率仅降低了30%[5]。这意味着需要更多策略来解决这个严重的公共卫生事件。 雷公藤红素(celastrol,CeT)是一种从传统中药雷公藤Tripterygium wilfordii Hook. f.中提取分离出的活性成分,具有抗炎、抗癌和抗动脉粥样硬化等多种药理活性[6],且具有良好的成药性,被《Cell》杂志列为最可能转化为现代药物的5种有潜力传统药物之一[7]。Zhang等[8]前期研究发现,体外有效成分为CeT的南蛇藤能够通过在促进RCT减少脂质蓄积方面具有积极作用,其机制主要是通过激活清除剂受体B类成员1(scavenger receptor class B member 1,SRB1)、ABC转运体和细胞色素P450家族7亚家族A成员1(cytochrome P450 family 7 subfamily A member 1,CYP7A1)途径促进胆固醇代谢。然而,有关CeT调控胆固醇代谢的作用机制探索尚不完善。此外,迄今为止,并无有关CeT通过调控肠道TICE途径介导胆固醇代谢的相关研究。因此,本研究采用网络药理学和系统生物学理论,通过构建“CeT-靶点-肠道胆固醇代谢”多层次网络,初步预测CeT调控肠上皮细胞胆固醇代谢的作用机制[9-10],并结合实验深入探讨和验证CeT调控肠上皮细胞胆固醇代谢的作用及机制,旨在为维持体内胆固醇稳态提供新的方向和理论依据。 1 材料 1.1 细胞 大鼠小肠隐窝上皮IEC-6细胞(批号ZQ0783)由中国科学院上海细胞库提供。 1.2 药品与试剂 CeT(批号C0869)购自美国Sigma公司;肝X受体α(liver X receptor α,LXRα)抑制剂GSK2033(批号HY-108688)、Bodipy荧光染色(批号HY-W090090)购自美国MCE公司;0.25%胰蛋白酶(批号PB180229)购自美国Hyclone公司;DMEM高糖完全培养基(批号ZQ-121)、DMEM基础培养基(批号09122)购自上海中乔新舟生物科技有限公司;磷酸酶抑制剂(批号CW2383S)、蛋白酶抑制剂(批号CW2200S)、BCA试剂盒(批号CW0014S)、SDS-PAGE试剂盒(批号CW0022S)、Loading buffer(批号CW0028S)液购自康为世纪生物科技股份有限公司;CCK-8试剂盒(批号C0037)、RIPA裂解液(批号P0013B)、ECL化学发光试剂盒(批号P0018S)购自碧云天生物技术股份有限公司;油红O染色试剂盒(批号G1262-4)购自北京索莱宝科技有限公司;PVDF膜(批号ISEQ00010)购自美国Millipore公司;兔抗三磷酸腺苷结合盒转运蛋白G5(adenosine triphosphate-binding cassette transporters G5,ABCG5)抗体(批号27722-1-AP)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号10494-1-AP)、山羊抗兔二抗(批号SA00001-2)购自美国Proteintech公司;兔抗ATP结合盒转运蛋白G8(ATP-binding cassette transporters G8,ABCG8)抗体(批号A01482-2)购自武汉博士德生物工程有限公司;兔抗NPC1样细胞内胆固醇转运蛋白1(NPC1 like intracellular cholesterol transporter 1,NPC1L1)抗体(批号PA5-116672)购自美国Thermo Fisher Scientific公司;兔抗LXRα抗体(批号ab41902)、DAPI染液(批号ab228549)购自英国Abcam公司。 1.3 仪器 ix 73型倒置荧光显微镜(日本Olympus公司);FC型酶标仪、Forma 3系列CO2培养箱、EVOS fl auto全自动荧光倒置荧光学显微镜(美国Thermo Fisher Scientific公司);ChemiDoc XRS+化学发光成像系统、Mini-PROTEAN Tetra蛋白电泳系统(美国Bio-Rad公司)。 2 方法 2.1 网络药理学研究 将PubChem(https://pubchem.ncbi.nlm.nih.gov/)得到的CeT 3D结构导入PharmMapper(http://www. lilab-ecust.cn/pharmmapper/)进行药物靶点预测。通过NCBI(https://www.ncbi.nlm.nih.gov/)得到肠道和胆固醇代谢靶点。并与CeT靶点取交集得到共有靶点;通过STRING(https://STRING-db.org)进行蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建,并导入Cytoscape 3.9.1软件构建网络模型并分析;通过DAVID(https://david. ncifcrf.gov/)进行基因本体(gene ontology,GO)功能及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析;利用PDB(https://www.rcsb.org/)筛选并下载分辨率小于0.25 nm的靶点的结晶复合式,结合上述得到的CeT 3D结构,采用Autodock进行分子对接,运用PyMol可视化处理。 2.2 实验验证 2.2.1 IEC-6细胞培养 IEC-6细胞用DMEM高糖完全培养基于37 ℃、5% CO2的恒温培养箱中常规培养。 2.2.2 CCK-8法检测细胞存活率 将对数生长期的IEC-6细胞接种于96孔板中,5×103个/孔。每孔加入100 μL含不同浓度(0.05、0.10、0.20、0.40、0.80 μmol/L)CeT的培养基,另设置加入无药物培养基的对照组,每组设置5个复孔,培养箱中培养24、48 h。每孔加入10 μL CCK-8试剂,于培养箱中孵育1~2 h后,采用酶标仪在450 nm处检测吸光度(A)值,计算细胞存活率。 细胞存活率=A给药/A对照 2.2.3 油红O染色评估CeT对肠上皮细胞胆固醇的影响 设置对照组、模型组和CeT(0.05、0.10、0.20 μmol/L)组,除对照组外,其余各组加入DMEM基本培养基配制的胆固醇胶束(cholesterol micelles, C-M,10 mmol/L)构建肠上皮细胞高胆固醇模型[11],给药组加入不同浓度的CeT溶液,对照组加入不含药物的培养基。干预24 h后,加入ORO Fixative固定液固定细胞;加入1 mL 60%异丙醇浸洗;加入油红O染液(ORO Stain A∶ORO Stain B=3∶2),洗涤至孔内无红色剩余;加入Mayer苏木素染色液,洗涤;加入油红O染液缓冲液;加入蒸馏水覆盖细胞并拍照,使用Image-Pro Plus软件以脂滴与整个图像的面积比进行定量。 2.2.4 Bodipy荧光标记法 按“2.2.3”项下方法进行分组和给药,干预24 h后,PBS洗涤,室温下多聚甲醛固定30 min;每孔加入2 μmol/L Bodipy染色液,于37 ℃细胞培养箱中孵育15 min;弃去染色液,PBS洗涤;DAPI复染核5 min,PBS洗涤;观察并拍照。使用Image-Pro Plus软件以荧光强度进行统计。 2.2.5 Western blotting检测TICE相关蛋白表达 按“2.2.3”项下方法进行分组和给药,干预24 h后,收集细胞;PBS洗涤后使用蛋白裂解液提取总蛋白质,BCA定量法测定蛋白质浓度。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,加入5%脱脂牛奶封闭3 h,用TBST洗涤后加入一抗,4 ℃孵育过夜;洗涤后加入二抗,室温孵育2 h;洗涤后进行显影,使用Image-Pro Plus软件分析条带灰度值。 2.2.6 免疫荧光检测LXRα/ABCG8和LXRα/ NPC1L1通路相关蛋白的影响 设置对照组、模型组、CeT(0.1 μmol/L)组、GSK2033(10 μmol/L)组和CeT+GSK2033组,除对照组外,其余各组加入DMEM基本培养基配制的胆固醇胶束(10 mmol/L)构建肠上皮细胞高胆固醇模型,各给药组加入相应药物,对照组加入不含药物的培养基。干预24 h后,PBS洗涤3次;4%多聚甲醛固定30 min,PBS洗涤3次后加入Trition X-100,室温下通透10 min;PBS洗涤3次后,加入免疫染色封闭液封闭60 min,吸去多余的牛血清白蛋白;分别滴加100 μL LXRα(1∶200)、ABCG8(1∶200)、NPC1L1(1∶200)一抗,4 ℃孵育过夜;回收一抗,PBS浸洗3次,滴加100 μL二抗(1∶300),室温避光孵育60 min;PBS洗涤3次,滴加DAPI复染核15 min,PBS洗涤3次;滴加抗淬灭剂10 μL,扣片,正面朝下盖在载玻片上,荧光显微镜下观察并拍照。使用Image-Pro Plus软件分析荧光强度。 2.2.7 统计学分析 采用GraphPad Prism 9.0和SPSS 26.0软件进行统计分析,数据以表示。两组间数据分布的正态性和方差齐性分别以Kolmogo? rov-Smirnov和Levene检验确定。组间均数比较采用t检验;多组间均数比较采用单因素方差分析,组间有差异进一步采用SNK-q检验进行两两比较。 3 结果 3.1 网络药理学研究 3.1.1 CeT-肠道胆固醇代谢靶点 通过TCMSP等数据库得到94个CeT相关靶点。通过NCBI Gene等数据库得到15 415个肠道相关靶点、14 177个胆固醇代谢相关靶点。并构建韦恩图预测CeT-肠道胆固醇代谢共有靶点,见图1。 图片 3.1.2 CeT-靶点-肠道胆固醇代谢网络构建 将PPI导入Cytoscape 3.8.1软件进行可视化,发现1个关键的子网络,见图2。 图片 3.1.3 CeT-肠道胆固醇代谢的GO功能富集分析 对CeT调控肠道胆固醇代谢的作用及机制进行GO富集分析,分别得到855个生物进程、17个细胞组成、53个分子功能,根据P<0.05,选出排名前10的条目,见图3。 图片 3.1.4 CeT-肠道胆固醇代谢的KEGG通路富集分析 CeT调控肠道胆固醇代谢的通路涉及34条,根据P<0.05,选出排名前10的通路,见图4。其中,主要涉及脂肪的消化和吸收、过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor,PPAR)等信号通路。其中,肠道脂质代谢的关键通路(fat digestion and absorption)的靶点(ABCG5、ABCG8、NPC1L1)主要涉及CeT-靶点-肠道胆固醇代谢网络的关键网络之一(图5)。并且该网络主要涉及胆固醇排泄的关键途径——TICE途径。 图片 图片 3.2 分子对接分析 CeT与NR1H3(LXRα)结合能为?28.131 4 kJ/mol,可视化显示,匹配度良好,化合物与靶点结合的最优构象以氢键的方式呈现,结合活性良好,见图6。 图片 3.3 体外实验研究 3.3.1 CeT浓度筛选 不同浓度(0.05、0.1、0.2、0.4、0.8 μmol/L)的CeT分别干预IEC-6细胞24、48 h后,如图7所示,干预24 h时随着CeT浓度的增加细胞存活率降低,CeT的半数抑制浓度(half inhibitory concentration,IC50)为0.2 μmol/L。本研究在探索CeT安全浓度调控IEC-6细胞胆固醇代谢活性的同时,为了更进一步研究CeT在IC50时是否较安全浓度的效果更好,因此,选择0.05、0.10、0.20 μmol/L的CeT处理细胞24 h进行后续研究。 图片 3.3.2 CeT对IEC-6细胞内脂质的影响 如图8所示,油红O染色与Bodipy荧光标记结果均显示,与对照组比较,胆固醇胶束干预显著增加脂滴染色和荧光强度(P<0.001),表明造模成功;与模型组比较,各剂量CeT均显著抑制IEC-6细胞中脂质积累(P<0.05、0.01、0.001)。 图片 3.3.3 CeT对TICE途径关键蛋白的影响 NPC1L1是胆固醇吸收的重要蛋白,ABCG5/G8与胆固醇流出密切相关。如图9所示,与对照组比较,模型组NPC1L1蛋白表达水平显著升高(P<0.05),ABCG5和ABCG8蛋白表达水平显著降低(P<0.05、0.01);与模型组比较,CeT(0.2 μmol/L)组NPC1L1蛋白表达水平显著降低(P<0.05),CeT(0.1、0.2 μmol/L)组ABCG5和ABCG8蛋白表达水平显著升高(P<0.05、0.01)。因此,CeT可能通过抑制NPC1L1,促进ABCG5、ABCG8的表达,调控TICE途径介导的胆固醇摄取和流出。 图片 3.3.4 LXRα是CeT调控TICE途径的关键蛋白 如图10所示,与对照组比较,模型组LXRα、ABCG8表达显著降低(P<0.01),NPC1L1表达显著增加(P<0.001);与模型组比较,CeT组LXRα、ABCG8表达显著增加(P<0.001),NPC1L1表达显著降低(P<0.01),LXRα抑制剂GSK2033组ABCG8表达显著降低(P<0.01),NPC1L1表达显著增加(P<0.05);与CeT组比较,CeT+GSK2033组LXRα、ABCG8表达显著降低(P<0.01),NPC1L1表达显著增加(P<0.01)。因此,CeT可能通过促进LXRα的表达,调控TICE途径中的关键蛋白NPC1L1、ABCG8介导的胆固醇摄取和流出。 图片 4 讨论 胆固醇广泛存在于机体中,具有广泛的生理作用,是组织细胞中不可缺少的重要物质,它不仅参与细胞膜的形成,也是合成胆汁酸、维生素D及甾体激素的重要原料,但当其过量时便会导致高胆固醇血症,研究表明,心血管疾病、胆石症和肿瘤与高胆固醇血症密切相关[12-13]。胆固醇在体内不能被降解,机体有效排泄胆固醇是维持胆固醇稳态的重要环节[2]。因此,促进体内胆固醇排泄以维持体内胆固醇的动态平衡可能是治疗胆固醇失衡相关疾病的新策略。 基于此,本研究通过网络药理学方法,探讨CeT通过调控肠上皮细胞胆固醇代谢的潜在靶点及相关机制。PPI网络发现,CeT调控肠上皮细胞胆固醇代谢涉及1个核心子网络。其中,ABCG5/8与NPC1L1为胆固醇摄取与流出相关的核心靶点。本研究通过体外构建和模拟肠上皮细胞高胆固醇环境,探索CeT调控肠上皮细胞胆固醇代谢的机制,油红O和Bodipy结果均显示,CeT能够呈浓度相关性地降低胆固醇胶束干预的肠上皮细胞内的脂质积蓄。进一步通过结合KEGG通路分析发现,该子网络中的核心靶点与肠道脂质代谢的关键通路(fat digestion and absorption)相匹配,通过深度分析该通路发现,其主要涉及肠上皮细胞摄取与流出胆固醇中的TICE途径。已有研究表明,胆固醇从体内排出的唯一途径是通过粪便直接排出或转化为胆汁酸后排出,粪便排泄可通过2种独立途径进行,第1种途径是胆汁分泌,该途径已被广泛描述和研究。第2种途径是通过TICE途径[14]。在2009年Van团队初步研究估计,TICE对野生型小鼠体内排出的粪便中性固醇总量的贡献约为30%[15]。接下来,该团队在2010年通过实验得出在小鼠中TICE途径占粪便中性甾醇排泄的70%[16]。在人体生理情况下,TICE途径排泄的胆固醇占粪便胆固醇排泄总量的35%[2,17]。TICE指由血直接经肠道分泌和排出血浆脂蛋白来源的胆固醇。包括肝源性含载脂蛋白B的脂蛋白被基底膜侧低密度脂蛋白受体(low density lipoprotein receptor,LDLR)和其他可能受体吸收、内化,最终通过ABCG5/G8以及其他可能的转运体从顶端膜流出排泄到肠腔[18]。另有研究发现,利用Ezetimibe抑制NPC1L1介导的胆固醇摄取可显著增强TICE途径[2]。而本研究表明,CeT干预处于高胆固醇环境中的肠上皮细胞后,NPC1L1被抑制,而ABCG5、ABCG8被激活。提示,CeT主要通过抑制NPC1L1减少肠上皮细胞胆固醇摄取和促进ABCG5、ABCG8增加胆固醇流出。 LXRα由于其抗动脉粥样硬化、去除胆固醇和抗炎活性,在胆固醇稳态的转录调控中发挥极其关键作用[19]。研究发现,LXRα可调控NPC1L1在肠上皮细胞中的表达,降低肠道胆固醇的吸收[20]。此外,ABCG5和ABCG8是LXRα的直接靶基因,常形成异二聚体ABCG5/G8发挥作用,负责将细胞内胆固醇泵入肠腔并最终通过粪便排出体外[21]。PPI子网络表明,NPC1L1、ABCG5以及ABCG8主要由LXRα交联。因此,在上述研究的基础上,通过分子对接模拟了CeT与LXRα的对接模式,结合活性良好。采用LXRα抑制剂GSK2033处理,结果显示,NPC1L1和ABCG5/G8主要受LXRα调控。提示,CeT可能通过LXRα/ABCG5/ABCG8和LXRα/ NPC1L1途径分别介导IEC-6细胞胆固醇摄取和流出,进而促进TICE途径介导的胆固醇排泄。 本研究通过网络药理学和相关实验发现,CeT可能通过抑制肠上皮细胞胆固醇摄取和促进胆固醇流出维持机体胆固醇稳态,这一效应与核心靶点LXRα密切相关,本研究拓展了CeT调控体内胆固醇代谢的机制,为维持体内胆固醇稳态和胆固醇失衡相关疾病的新药研发提供了新思路。
很多朋友问这样一个问题:为什么毕赤酵母表达困难?他们自己也很纳闷,重组酵母pcr检测也证明目的基因重组了,但是诱导之后就是在表达上清中检测不到目的蛋白,仔细研究操作手册后仍然不知道原因。本人,根据自己的经验,采用倒推的方法,按实验过程从后向前分析,供大家参考:1、诱导之后表达上清中检测不到目的蛋白:分析1:检测的方法是否有问题,要考虑是不是蛋白表达量低而没有检测到? 如果是蛋白表达低,可以选择浓缩蛋白,具体的方法很多,有TCA、丙酮、浓缩柱等等方法,之前在本版已经发过帖,在此不赘述。 2、如果蛋白浓缩N倍之后仍然检测不到,那基本可以确证蛋白并不在上清中。那么蛋白到哪里去了,考虑是否没有分泌出来,而是在胞内,那就需要通过裂解酵母来检 测胞内蛋白,具体的方法很多,在此也不赘述,曾整理过相关破碎的帖子。 3、如果胞内也没有目的蛋白表达,那么基本可以确定蛋白并没有表达。 4、为什么没有表达呢?倒推回来就是诱导的过程了,诱导体系是什么?甲醇浓度是多少?培养问题是多少,转速是多少?这些都要注意。甲醇一般是0.5%-1.0%,本人用的 是0.5%,也有很多人也用1.0%,曾见过一个帖子,说超过1.5%反而会抑制表达,没有验证过,供大家参考。培养问题28-30度比较合适,转速250rpm比较合适,诱导 体系没有固定的体系,说明书上推荐的是BMGY到OD600 2~6,换到BMMY中OD600 为1左右。 5、如果诱导的过程也没有问题,那问题就复杂了,特别是重组酵母PCR检测证明目的基因确实已经发生了重组。这个时候是最郁闷的了,但是郁闷怎么办,还是要找原 因,在此我给的建议是先做RT-PCR证明mRNA水平的情况,也就是说有没有转录。如果转录了,后续的操作也没有问题(本帖的1、2、3、4项),那么只有重新设计实 验,比如换酵母株,有文章上说:用GS115表达不出蛋白,换KM71H后,大部分克隆能表达。 6、有个帖子说的很好,在此和大家分享一下。 1、 菌株:用GS115表达不出蛋白,换KM71H后,大部分克隆能表达。 2、温度: 在28度和室温下诱导表达,表达水平可能都不低。 3、pH:手册上用6.0,pH提高到6.8,不表达的蛋白可能就表达出来。BMMY的pH7.0-7.5比较合适。国内外做的最好的rHSA,最适pH大概5-6左右。pH3的时 候yeast和peptone好像会沉淀的,可以用磷酸和磷酸二氢钾调,具体比例自己去试试。 4、偏爱密码子: codon bias一般不是主要的问题,你要表达的蛋白特性才是主要问题,酵母对分子量大(30KD以上),结构复杂(如一些蛋白酶),二硫键含量多的 蛋白往往不能有效表达,尤其是分泌表达。密码子改造对一些较小的而且结构简单的蛋白表达量的提高可能有一些作用。比如一位战友用Pichia酵母表达一个单链 抗体,29KD,含有2对二硫键,表达量约几毫克每升,选用酵母偏好密码子全基因合成后,表达量没有什么提高。 5、表达时间与空质粒转化对照:诱导时间长了以后,是会有很多蛋白分泌出来的,时间越长杂蛋白就越多,且分子量都比较大。最好做一个空质粒转化的对照, 这样就会比较肯定到底是不是自身的蛋白分泌的结果。 6、污染:每个样品从G418板上挑10个左右单克隆于2ml BMGY摇菌(30ml玻璃管,比LB管大一点),纱布一般用8层,一天左右看着比较浑离心,留样1ml,余 1ml换2ml BMMY诱导表达,3,4层纱布足够了。 污染一般都是跟瓶口覆盖有关的原因造成的,只盖纱布肯定会污染。加盖报纸后,就再没遇到过污染。如果只用6层纱布,污染的可能当然很大,100ml三角瓶, 装量10ml培养液,用橡筋把8层纱布和2层报纸拴紧封口,空气浴摇床。 7、不表达:蛋白有没有表达就要看你的运气了,一般重复2-3次实验都没有表达菌株,这个蛋白就放弃表达了。 8、表达量: 30KD,10mg/L表达量已经很高,最直接的方法是发酵,一般提高5-10倍。大肠杆菌一样出现大团的超表达蛋白。 9、糖基化:酵母分泌表达的N糖基化是可以预测的,有如下序列:N X S/T就是潜在的糖基化位点,X为任意氨基酸,1个糖基化位点会加上1-3KD左右的糖基。另外可 能还有O糖基化话,但是无法预测其位点,不过很少听说表达蛋白有O糖基化的。如果胞内表达,不存在糖基化的问题。 10、表型与表达:重组SalI和BglII酶切产生单交换和双交换,结果就是产生Mut+和Muts表型的菌株;前者在甲醇诱导表达时生长快,消耗的甲醇多,后者生长慢,消耗 的甲醇少,所以诱导表达时Muts表型要求更高的菌体浓度。一般用Mut+表型的较多,但是对某些蛋白Muts菌株可能表达的更好,只有试试才知道你的蛋白用那种菌 株表达较好。 11、培养基 YPD:最基本的培养用;BMGY:诱导表达前培养用;BMMY:诱导表达用;MD:电转化后筛选his+用。 YEPD是不能代替BMGY的,因为有葡萄糖,这样残留的葡萄糖会影响下一步的诱导表达。不过有一种方法是可行的,就是用YPG培养基代替,只是把YEPD中的葡萄糖 用3%的甘油代替,也可以降低成本。摇瓶毕竟不能和发酵罐比,甘油残余会抑制甲醇利用。 BMGY、BMMY灭菌后才能加甲醇、磷酸钾、生物素。配制BMMY时也没必要用5%过滤除菌的甲醇,在灭菌后使用前加100%甲醇至你要的浓度。 YNB可以高压灭菌,没问题的,也可以0.22um过滤处理,天冬氨酸和苏氨酸要待培养基高压灭菌后加入;配YPD时可以加入YPD一起灭菌,但时间不能太长,温度不能 太高,一般121-125度12-15分钟足够了。若时间过长,温度过高,可能导致YPD焦化。glucose和含氮化合物在一起容易产生美拉德反应,这是配制培养基中的禁忌。 颜色很深的话,基本不能使用了。或者含有葡萄糖和/或YNB的培养基108度35min高压灭菌。 小量发酵其实可以把培养基成分中的YNB和生物素去除,培养基价格便宜,操作又方便,可以直接灭菌,效果也很好(效果不比含YNB的差)。 如果是用自己配置的培养基,如玉米浸提液、麦芽浸提液、麦麸浸提液等等,可以不用换液,采取添料来维持酵母对培养基的营养需要。 用无机盐进行大规模发酵,更省钱。更多有关蛋白表达纯化的相关资料,请点击:资料专区
比如氰化物的测定 HJ 484-2009异烟酸-吡唑啉酮分光光度法此法检出限为0.004mg/L,检出下限为0.016mg/L一般我们对于样品未检出的表达是<0.004mg/L但今年复审时,某市监测站专家说他们的表达是<0.016mg/L不知道大家实验室是如何表达的呢?
[b]2017/6/14 科研仪器英语口语每日一练(适合化工英语,外企面试口语,出国留学交流,日常英语口语)[/b]作者:chaos今天,我们将开展我们的即兴表达的第一课:怎样训练自己的表达连贯性,连贯性并不是表达连续不断,而是表达具有逻辑性,思路清晰。句子连贯,对今后进行英语交流是绝对有好处的。这一部分,我将从话题定位,段落安排衔接两个方面来具体展开。今天,我具体展开第一方面关于话题定位来讨论。[b]话题定位[/b]首先,我相信不管是writing English 还是oral English, 话题定位这一方面是每个人的鸡肋,大部分学习者不会适当地将话题展开来讨论,以至于自己在聊天或者演讲中话穷了。接下来我将介绍口语中的一种话题定位方法。先看下面三组符号:CM STREET $这三个符号可以帮助我们快速记忆下面的九组共18个英文单词。请您先把下面每一行词汇的第一个单词看一遍,每行的第二个词先不看:Culture&PopulationMind & SoulSociety & CrimeTime & SpaceRights & ResponsibilitiesEnvironment & HealthEmpIoyment&CompetitionTechnology & EfficiencyMoney&Fun您会发现,每行的第一个单词首字母拼在一起,就是CM STREET $这三个符号。把三个符号多写几遍,同时回忆对应的9个单词,几次下来,每行的第一个词就记住了。再看每行的第二个词,您会发现和每行的第一个词是严格的逻辑关系:文化人口(创造)头脑(对应)精神社会犯罪(严重)时间(对应)空间权利(对应)义务环境(影响)健康就业竞争(激烈)科技(提高)效率财富(提升)乐趣这样,我们通过CM STREET $三组符号可以记住每行的第一个词,再通过逻辑关系牢记每行的第二个词。当我们讨论任何一个话题时,只要想到第一个词,然后将第二个词也相应展开讲述,这样,您的话题定位就做到了。下面。我们来实战体验一下:1. People today can perform the everyday tasks such as shopping, banking or even business transactions, without meeting others face to face. What effects will this phenomenon have on individuals and society as a whole?分析:What effects will this phenomenon have on individuals and society as a whole?其实也就是电子商务对个人或社会有什么影响?这样可以利用上面的方法迅速话题定位,然后展开。首先对个人影响可以从efficiency,money,fun这几方面很快就能确定。然后对对社会的影响从efficiency,crime,emp}employment这几方面可以迅速确定。这样,各选取一两个方面,就完全搞定了。2. As most people spend a major part of their adult life at work, job satisfaction Isabel important element of individual Wellington. What factors contribute to jobsatisfaction? How realistic is the expectation of job satisfaction of all workers?分析:第一个问题问的是有哪些因素会影响员工的工作满意度呢?第二个问题本质是问从现实情况说雇主可以在哪些方面提高员工的满意度呢?当我们能熟记上面三组符号,各种因素马上就能在我们脑子里浮现:影响员工满意度的因素可以从efficiency,soul( stress1,rights.environment.health.competition.money等很多方面中选择论述。而雇主可以为改善员工满意度所做的事情则可以通过responsibilities.money,space,fun.culture(corporate culture企业文化)等方面瞬间搞定。当内容敲定了以后,接下来我们开始考虑怎样安排段落之间的衔接了。好了,今天就学会这一门小技巧吧。