超声技术——灭杀新冠病毒新思路
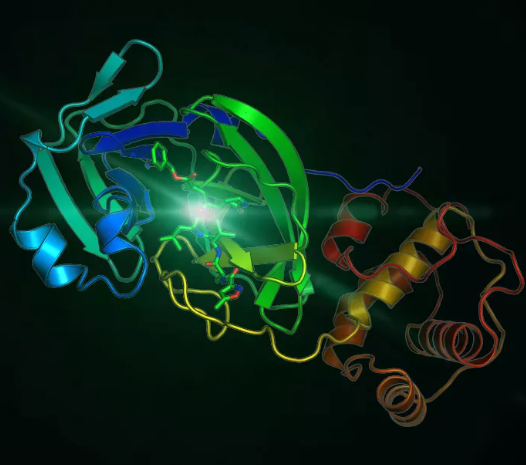
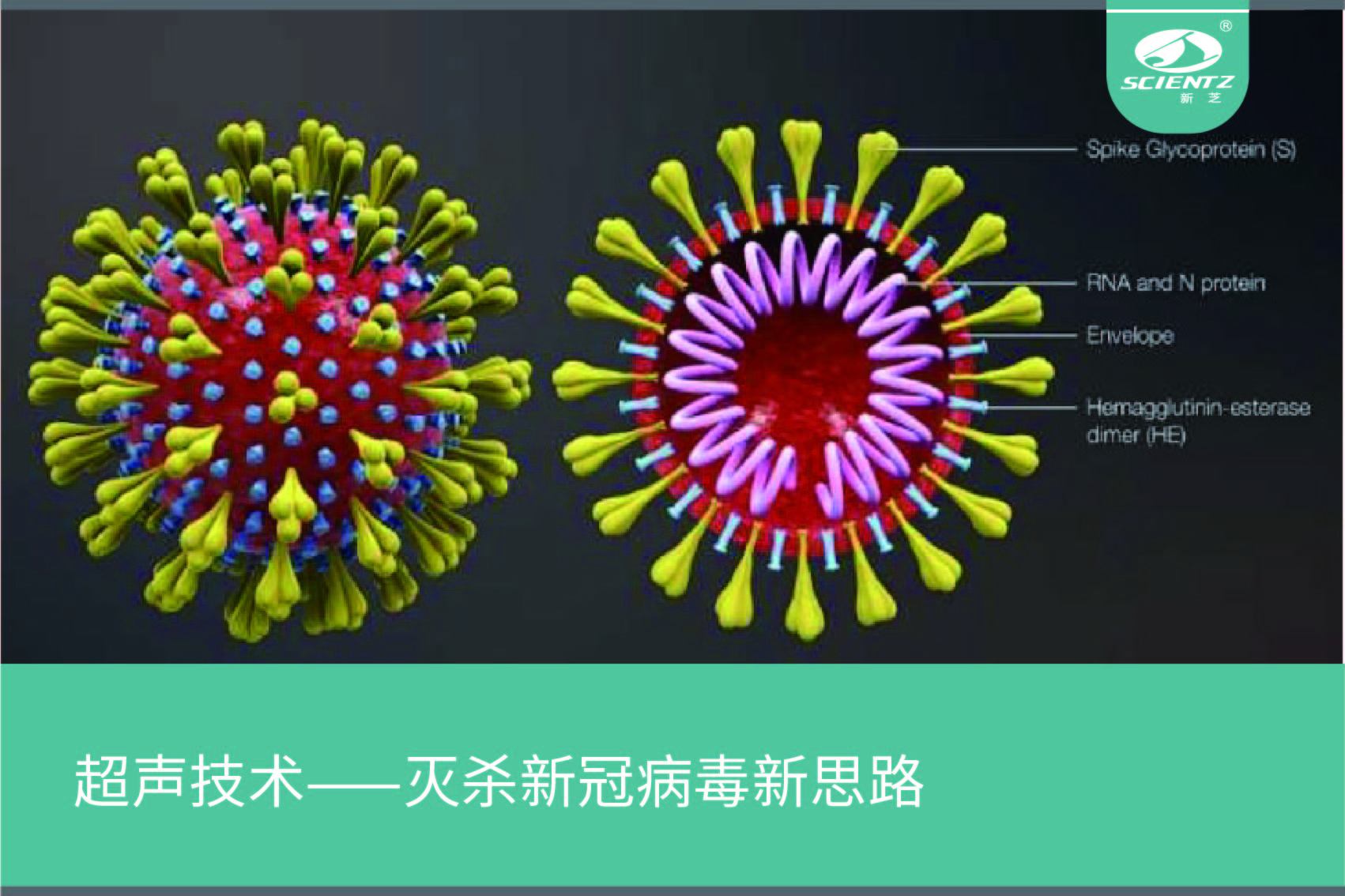
冠状病毒组成结构2021年2月18日, 麻省理工学院tomasz wierzbicki研究团队在国际固体力学权威期刊“journal of the mechanics and physics of solids”(《固体力学与固体物理学杂志》)上发表文章,文章表示新型冠状病毒可能容易受到医学诊断成像中使用的超声波振动频率的影响。即在人体安全适用的超声波频率范围内,超声波振动能够破坏冠状病毒结构甚至杀死病毒。[1]新型冠状病毒主要由核心rna、衣壳以及衣壳上的刺突蛋白组成,其中刺突蛋白对于病毒识别入侵宿主细胞具有关键作用。由于病毒是寄生生物,无法独立生存,因此寻找一种可以有效破坏冠状病毒衣壳及其刺突蛋白结构的方法,对于治疗以及预防冠状病毒感染具有很大的意义。研究内容与结果wierzbicki团队通过计算机模拟构建冠状病毒模型,并模拟其在一系列超声波频率振动的机械反应。结果发现在100 mhz(冠状病毒衣壳自然振动频率)的振动频率下,病毒产生共振效应,病毒衣壳和刺突蛋白发生向内弯曲,类似于一个球在从地面反弹时会出现的凹痕现象,并于几毫秒内发生破裂。并且随着研究人员增加超声波振动的幅度和强度,在 25mhz 和 50mhz 的频率之间时,弯曲和破裂的速度加快,这种效应在空气及与人体体液密度相等的水模拟环境中都可以看到。最重要的是这次模拟实验证明了存在着在人体医学成像适用范围内(1mhz-30mhz)利用超声波治疗人体新冠感染的可能性。 wierzbicki补充说:该试验已成功表明,在超声波激发下,新冠病毒的外壳和刺突蛋白会发生共振,振动的幅度会非常大,产生的张力可能会破坏病毒的某些部分,对外壳造成可见的损伤,并可能对内部的核糖核酸造成不可见的损伤。 研究缺陷与展望目前,他们正计划与西班牙微生物学家合作探索,使用原子力显微镜,来观察超声波振动对猪体内一种冠状病毒的影响。如果实验成功,可以预见该试验研究结果会为超声波治疗和预防新冠病毒感染带来一个崭新的方向。像超声破碎肾结石一样,未来我们不仅可以利用超声技术应用于冠状病毒的临床治疗,甚至还可以将超声波发生器内置于手机等便携式设备,随身预防保护人类免受病毒侵害。该研究成果的推论固然让人感到兴奋,但目前该研究方向仅仅只是踏出了一小步,局限于物理模型阶段。依旧有很多的问题等待着科学家们的研究和验证,比如如何精准地使用超声波在复杂的人体内有效破坏病毒将是日后解决的关键性问题之一,而距离超声波应用于灭杀治疗冠状病毒未来将有很长一段路等待去探索。超声波除了具有应用于灭杀病毒的可能性,目前其在病毒的医疗诊断治疗领域或是各种微生物实验研究中也有着相当广泛的应用。比如当前新冠病毒的监测诊断领域中必要的超声成像技术,其可以为临床医生及时提供患者的各种重要生命体征,在急性重症肺炎的诊断、治疗以及疗效评估上具有不可替代的地位。 正常肺超声m型图像(沙滩样征) 肺炎患者m型超声图像(平流层征)超声其他领域应用 以病毒、细胞、真菌等为代表的微生物学领域,超声波技术具有广泛的应用场景:利用超声波细胞粉碎机(scientz-iid),从重组大肠杆菌中破碎提取包涵体并纯化得到h1n1流感病毒抗原(ha抗原),用于对血液中抗体(抗-ha)的检测,从而筛选出可用于治疗流感病毒感染的免疫血浆[2];利用超声波细胞粉碎机(scientz-iid)破碎重组大肠杆菌得到表达的目标蛋白酶(hnmt1,可以催化蛋白发生豆蔻酰化),进而研究该酶所催化的豆蔻酰化修饰对于小rna病毒蛋白衣壳装配的影响[3];利用超声波细胞粉碎机(scientz-iid)分解重组工程表达菌株,从中得到肠道病毒的重组蛋白抗原,用于多克隆抗体的制备[4]。 新芝部分超声波系列产品: 超声波技术作为一项通用技术,在医学成像、细胞工程、微生物研究、病毒研究等领域具备广阔的应用前景。新芝生物成立三十多年来,专注于超声技术的研发与应用,开发了包括超声波细胞粉碎机、非接触式超声波细胞粉碎机、超声波提取仪、超声波清洗机、超声波除垢设备等系列产品。新芝生物超声波系列产品遍布全球知名生命科学研究实验室,为科研工作者提供专业、周到的服务!参考文献:[1]tomasz wierzbicki, wei li, yuming liu, juner zhu. effect of receptors on the resonant and transient harmonic vibrations of coronavirus. journal of the mechanics and physics of solids, 2021 150: 104369 doi: 10.1016/j.jmps.2021.104369[2]江小工,修冰水,王国华,张向颖,陈坤,宋晓国,杨君,朱翠霞,周友,魏堤,房涛,张贺秋.接种甲型h1n1流感疫苗献血者血清中血凝素igg抗体的检测[j].中国输血杂志,2010,23(03):168-170.[3]王苗苗,董虎,卢渊录,郭慧琛,孙世琪,闻晓波.n-豆蔻酰基转移酶在大肠埃希氏菌中的表达、纯化及活性检测[j].动物医学进展,2021,42(06):1-7.[4]任富利,周辉,孟胜利,王泽鋆,申硕.兔抗肠道病毒71型截短vp1抗体的制备及鉴定[j].微生物学免疫学进展,2016,44(03):14-18.▼end