背景简介小麦灌浆期叶片的持绿功能期对籽粒产量具有重要意义,是小麦育种专家极为重视的表型特征,目前小麦叶片衰老态势主要通过叶色、绿叶相对面积以及叶绿素荧光等方法来评价前两种方法受观测者的主观感受影响,后者则受太阳辐射等因素影响,且叶室夹具容易对叶片造成损伤低场核磁共振以1H 为探针,可用于探测植物水分生理状态。比如植物叶片的核磁共振T2弛豫特性( NMR T2 Relaxivity) 与含水率、水分分布、蒸腾活性以及水势等密切相关。与其他技术相比,核磁共振技术具有检测快速、检测方式多样、无损和非接触等优点。利用核磁共振T2弛豫谱技术和磁共振成像技术,建立小麦植株的核磁共振活体检测系统,研究小麦叶片含水率、叶绿素含量与核磁共振T2弛豫谱的关系,并在此基础上评价核磁共振T2弛豫谱和磁共振成像技术反映叶片衰老态势的有效性。http://pic.yupoo.com/niumagqw2/FCKpAOb9/13DK4k.png小麦叶片的T2弛豫谱幅度和含水率随日序的变化如图2 所示。5 月下旬为陕229 灌浆乳熟期,该时期倒2 叶进入降解期,叶色开始变黄,而旗叶亦有衰老迹象,叶色亦开始变淡,但是T2 弛豫谱幅度和含水率并未出现明显变化。6 月上旬陕229 灌浆趋近结束,叶片进入衰亡期,T2弛豫谱幅度和含水率均出现显著减小。http://pic.yupoo.com/niumagqw2/FCKpCldR/DRLQ6.png小麦叶片的平均T2弛豫时间和叶绿素含量的日序变化如图3 所示。叶片在衰老前期( 6 月1 日之前) 平均T2弛豫时间逐渐增大,叶绿素含量逐渐减小,旗叶的叶绿素含量大于倒2 叶,而且旗叶的平均T2弛豫时间相对较小; 6 月4 日选取的陕229 植株均有倒2 叶完全衰亡,其平均T2弛豫时间和叶绿素含量均达到最小值,而旗叶仍保持一定的含水率,虽然其叶绿素含量亦基本达到最小值,但平均T2弛豫时间仍未到衰减阶段。http://pic.yupoo.com/niumagqw2/FCKpCqOU/qLGHx.png同时,核磁共振成像技术可以对活体小麦样品进行成像分析http://pic.yupoo.com/niumagqw2/FCKpCyvo/82VIT.png参考文献:“小麦叶片衰老态势核磁共振分析” 《农业机械学报》2014年4月 第45 卷第4
Li-6400系统的标准叶室在测水稻、小麦等狭长叶片作物或其他叶片长宽小于标准叶室长宽的植物光合时,常常难以获得准确的叶面积数据,导致测量难以进行。本人在测水稻光合过程中总结了一套比较准确且行之有效的叶面积测定方法,希望对那些实验室只有6400标准叶室的朋友提供一些试验方法上的支持。另注:附件中叶片上的黑线是沿着6400叶室黑色垫圈的外侧用铅笔标记所得,教程中后半部分用IPP测叶面积的过程其实也可以在PS中一并完成,会更加方便,不当之处希望各位批评指正。
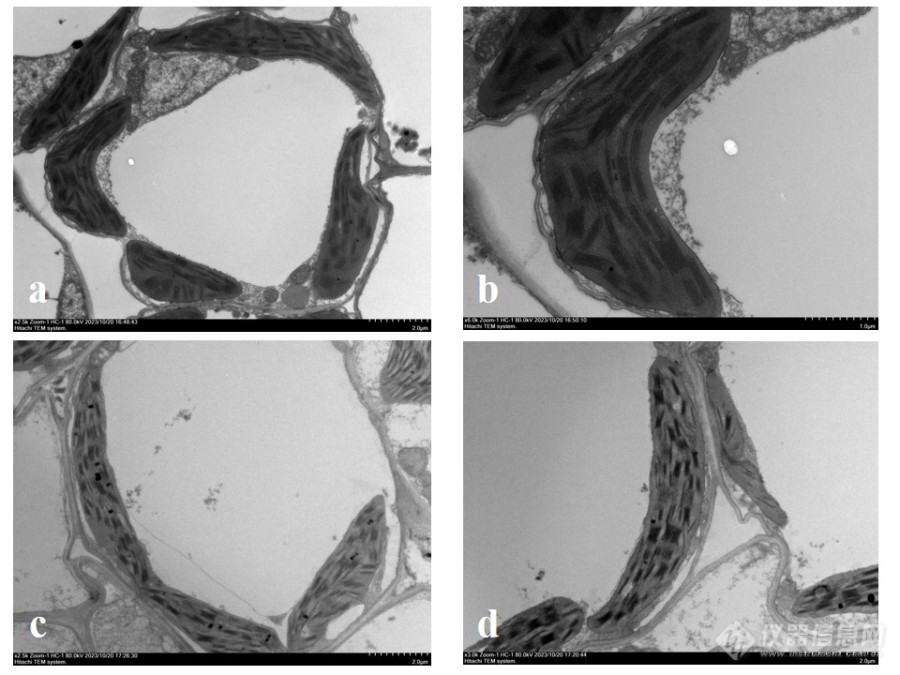
[align=center]不同环氧树脂对水稻叶片超微结构的影响[/align][align=center]吴佳楠[url=#footnote_1]1[/url][font=times new roman][size=13px],张丽娜[/size][/font][font=times new roman][sup][size=13px]2[/size][/sup][/font][/align][align=center](中国农业科学院 作物科学研究所 重大平台中心,北京 100089)[/align]摘要:树脂包埋是制备超薄切片前的关键一步,良好的包埋效果是保证超微结构真实的保证,不同的包埋剂根据其自身特点对样品包埋过程产生不同的影响。本文以水稻超微结构为例,对比实验室常用的两种环氧树脂spurr和epon812的包埋效果,发现spurr的包埋效果整体上要优于epon812,但是在干燥的环境下,epon812包埋效果较好。关键词:树脂;spurr;epon812;水稻叶片实验室常用环氧树脂spurr和epon812均可以用于制备水稻叶片超薄切片,其中spurr树脂的流动性好、黏度小,常用于植物组织的包埋;epon812由于黏度大、易吸潮,较少的用于植物组织。但因为epon812具有高度反差和良好的切割性能,在保证环境湿度的前提下,epon812也可以用于植物组织的渗透包埋。本文以水稻叶片为例,通过相同的样品制备流程,对比spurr和epon812在不同环境条件下的包埋效果,spurr树脂的整体包埋效果,如切片的平整度和衬度要优于epon812,但是在干燥环境中epon812包埋的样品,其切片的平整度和衬度要优于spurr,并且在切片的时候无需采用氯仿薰片,即可获得平整的超薄切片。1[font=宋体] 实验方法[/font]1.1取材取新鲜的水稻叶片,蒸馏水清洗表面杂质,用干净的双面刀片切成1mm[sup]3[/sup]大小的组织块,立即投入2.5%戊二醛+4%多聚甲醛固定液中抽真空固定24h[font=calibri][sup][1][/sup][/font]。1.2清洗、脱水固定完成的水稻叶片经0.1mol PB清洗后采用30%、50%、70%、90%、100%、100%丙酮依次脱水10min。1.3树脂渗透分别配置spurr和epon812树脂,具体配方见表1和表2。采用丙酮:树脂为1:1和1:3的比例配置spurr和epon812的树脂渗透液,每个梯度渗透12小时。纯树脂渗透2次,每次24小时树脂渗透过程需辅助旋转装置,保证渗透完全[font=calibri][sup][2][/sup][/font]。[align=center]表1 spurr树脂配方[/align][table][tr][td][align=center]树脂单体[/align][/td][td][align=center]质量(g)[/align][/td][/tr][tr][td][align=center]ERL-4221[/align][/td][td][align=center]10[/align][/td][/tr][tr][td][align=center]DER-736[/align][/td][td][align=center]4[/align][/td][/tr][tr][td][align=center]NSA[/align][/td][td][align=center]26[/align][/td][/tr][tr][td][align=center]DMAE[/align][/td][td][align=center]0.4ml[/align][/td][/tr][/table][align=center]表2 epon812树脂配方(Luft配方,1961)[/align][table][tr][td][/td][td][align=center]树脂单体[/align][/td][td][align=center]质量(ml)[/align][/td][/tr][tr][td=1,2][align=center]A液[/align][/td][td][align=center]Epon812[/align][/td][td][align=center]62[/align][/td][/tr][tr][td][align=center]DDSA[/align][/td][td][align=center]100[/align][/td][/tr][tr][td=1,2][align=center]B液[/align][/td][td][align=center]Epon812[/align][/td][td][align=center]100[/align][/td][/tr][tr][td][align=center]MNA[/align][/td][td][align=center]89[/align][/td][/tr][tr][td=3,1][align=center]根据湿度将A和B液在使用前混合:[/align][align=center]夏季A:B=1:4;冬季A:B=1:9[/align][align=center]混合后滴加催化剂DMP-30[/align][/td][/tr][/table]1.4包埋聚合spurr和epon812渗透的水稻组织均采用包埋板包埋(包埋板使用之前需在70℃烘箱中过夜,去除微滴水分),其中spurr70℃聚合48h,epon812 40℃聚合6h后60℃聚合42h。1.5切片染色观察聚合好的叶片经超薄切片机切片70nm,捞于铜网上干燥后染色,于HT7700透射电子显微镜下观察,记录实验结果。2 实验结果与讨论2.1干燥环境下两种环氧树脂渗透的水稻叶片及叶绿体[align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310311528566275_9449_3446098_3.jpg[/img][/align][align=center]图1 干燥环境(北京4、5月份)下spurr树脂和epon812树脂渗透的水稻叶片和叶绿体[/align][align=center]a和b为spurr树脂渗透包埋的水稻叶片及叶绿体;[/align][align=center]c和d为epon812树脂渗透包埋的水稻叶片及叶绿体[/align]图1为干燥环境下spurr树脂和epon812树脂渗透的水稻叶片及叶绿体,从图中可以看出,干燥环境下,两种环氧树脂渗透的水稻叶片切片的平整度和均一性良好,细胞结构清晰、细胞膜完整,叶绿体类囊体层次清晰;且epon812树脂渗透的水稻叶片及叶绿体的衬度较高。2.2干燥环境下两种环氧树脂渗透的水稻叶片及叶绿体[align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310311528566912_7299_3446098_3.jpg[/img][/align][align=center]图2 潮湿环境(北京6、7月份)下spurr树脂和epon812树脂渗透的水稻叶片和叶绿体[/align][align=center]a和b为spurr树脂渗透包埋的水稻叶片及叶绿体;[/align][align=center]c和d为epon812树脂渗透包埋的水稻叶片及叶绿体[/align][align=center][img]https://ng1.17img.cn/bbsfiles/images/2023/10/202310311528570282_501_3446098_3.jpg[/img][/align][align=center]图3 潮湿环境(北京6、7月份)下epon812树脂渗透的水稻叶片和叶绿体[/align]图2为潮湿环境下spurr树脂和epon812树脂渗透的水稻叶片及叶绿体,从图中可以看出,潮湿环境下,spurr树脂渗透的水稻叶片及叶绿体结构完整、清晰,叶绿体类囊体层次清晰。而图2中epon812树脂渗透的水稻叶片及叶绿体结构模糊,衬度明显下降;在图3中可以看到叶片呈现“磨砂玻璃”状形态,提示严重吸潮。2.3讨论从实验结果中我们发现,spurr树脂在干燥(本文选择的是北京4.5月份)和潮湿(本文选择的是北京6、7月份)的环境中均能获得良好的切片效果,切片的平整度和均一性较高,切片衬度良好。这是因为spurr树脂的黏度较低(60CPS)[font=calibri][sup][3][/sup][/font],对于有细胞壁限制的植物细胞较友好,容易渗透;而且不易吸潮,即使环境潮湿,也可以获得良好的细胞结构。epon812树脂在潮湿环境下(北京6、7月份)渗透的组织,其切片平整度和衬度较差。主要在于epon812配方中使用的NMA和DDSA均为酸酐,极容易吸潮[font=calibri][sup][4][/sup][/font],而且催化剂DMP-30可以溶于水,尤其是相对湿度在35%以上的环境,会将水分子引入已脱水的组织中,导致组织渗透聚合不良,影响交联反应的均一度和完整度[font=calibri][sup][5][/sup][/font],最终降低切片质量。树脂受到水分子的干扰,切片会呈现出一种被“磨砂玻璃”覆盖的状态,显示出细胞结构模糊不清,对比度下降;树脂渗透不良,会造成细胞结构出现空洞并造成切片的整体支撑度不均一,致使切片出现长条形的褶皱。此外,吸潮的epon812树脂发脆,切片修块时,容易崩断或呈现粉末状态,严重影响切片操作。但是在干燥环境下(北京4.5月份),spurr和epon812树脂渗透的组织切片平整度无较大差异,并且epon812的衬度要优于spurr,这主要是因为epon812分子量和黏度均较大,可以提高切片的整体支撑度,并且epon812中包含两种酸酐成分,与环氧集团的交联反应优于spurr。Epon812树脂的此种特性也决定切片时,epon812不用采用氯仿薰片即可获得平整的切片,减少了氯仿的使用,节约了切片时间[font=calibri][sup][6][/sup][/font]。3 结论本文对比组织切片中常用的两种环氧树脂在水稻叶片的渗透和包埋效果,发现在保证环境湿度的情况下可以可以优先考虑使用epon812树脂,但是对于密度较高、结构坚硬的组织或者环境湿度较大的情况下,则优先考虑spurr树脂。也有文章指出,可以将两者进行混合使用,根据组织的特点选择不同的比例进行渗透聚合,也可以很好的正好两种树脂的优点[font=calibri][sup][3][/sup][/font]。参考文献:黄吉雷,伦璇,刘传荷.水稻叶片透射电镜制样方法探讨[J].电子显微学报, 2018, 37(4):4..曹媛,陈家宝,殷亚方.通过改良超薄切片制样法观察汉代饱水考古木材细胞壁的超微构造[J].电子显微学报, 2022(003):041.杨慧,金良韵,姬曼,等.不同树脂对特殊生物样品包埋效果的比较[J].分析仪器, 2019(5):46-51.吴丽莉,颜永碧,陆月良.使用Epon-812包埋剂的体会[J].解剖学杂志, 1998, 21(06):521.刘庆宏,何幼英.不同湿度下Epon812,Epon618对电镜制样的影响[J].临床与实验病理学杂志, 2015, 31(7):824-825.[color=#333333]Finck.H.Epoxy resin in electron microscopy.J Biophys Biochem Cytol,1960,7(2):27-30[/color][url=#footnote_back_1]1[/url] [font=calibri][size=12px]1作者介绍:吴佳楠,[/size][/font][size=12px]([/size][size=12px]1989-[/size][size=12px]),女(汉族),河北石家庄人,工程师[/size][size=12px].[/size][size=12px] [/size][size=12px]E-mail[/size][size=12px]:[/size][size=12px]wujianan1989@126.com[/size][font=calibri]2[/font][font=calibri][size=12px]通讯作者:张丽娜,[/size][/font][size=12px]女(汉族),辽宁丹东人,副研究员[/size][size=12px].[/size][size=12px] [/size][size=12px]E-mail[/size][size=12px]:[/size][size=12px]zhanglina@caas.cn[/size][font='Times New Roman'][color=#333333] [/color][/font]
我需要把叶子所有的颜色去除,包括叶绿素、叶黄素以及其他色素。我有2组叶片,需要进行不同的处理,最后达到2个效果:一部分叶片我需要它们变透明。另一部分叶片我需要他们被漂白。 我已经尝试用乙醇泡叶片,在不同的浓度中进行梯度脱水,这个过程一方面脱去叶绿素,另一方面把水分置换出来。再放入和乙醇相溶的透明剂和漂白剂进行浸泡,置换出叶片里的乙醇。我发现泡过的叶片只是脱去了一部分绿色素。但叶子仍然残留有色素,并非完全透明。至于漂白,我准备尝试双氧水,但是不知道漂白效果稳定否。大家帮我看看我现在做的方法对不对 ?请告诉我效果比较稳定持久的透明剂和漂白剂。当然,如果是有毒危险物质也请顺带说明。其实我只要达到下面2个目的就行 1.一是要使叶片透明,如果大家有更好的方法,请告诉我具体步骤和需要的材料。(注意是透明,不含任何色素) 2.清告诉我漂白叶片需要的材料及方法步骤。(请仔细考虑漂白后效果的稳定性) 诚求善解.谢谢了!
挥发性成分的定义```测叶片挥发性成分有什么用 测叶片挥发性的意义```
我的实验,叶片干粉末材料(约80目)预处理时需要用水冲洗至冲洗液无色或无混浊(参照外文文献),现在请教大家,冲洗的具体方法?
钨灯丝电镜想拍植物叶片看看细胞结构,想知道怎么制样?
各位大佬请教个问题 使用钼蓝比色法测定植物叶片无机磷 为什么不显色呢?
我要做一个实验,将植物叶片放进一个盛溶液的容器当中,需要将植物叶片的水分抽空,并且让溶液渗透进去,这样叶片就会在沉入液体中,但是前提是我选用的溶液只有在4°左右的环境中才能保持其活性,请问各位老师,大侠我需要用什么仪器比较合适啊!!http://simg.instrument.com.cn/bbs/images/default/emyc1004.gif谢谢!!!
刚才我们的问题还少了一个,请各位前辈帮我分析一下我上传2个光谱图,一个是叶片对照,一个是叶片逆境处理的。
最近去医院配药,医生告知银杏叶片被踢出医保范围了,所以医院都不给处方了。这是为什么?是否银杏叶片出问题了?是不安全还是副作用大?

植物的叶片一般由上表皮,叶肉组织,下表皮,保卫细胞,气孔五个部分组成,由于下表皮含有保卫细胞和气孔两个组织,在实验中一般选择植物叶片下表皮细胞来观察植物叶片生长发育情况。而植物下表皮作为叶片一部分,而且十分轻薄,要怎样快速的获得该组织呢?http://ng1.17img.cn/bbsfiles/images/2017/10/2015071521495131_01_3021049_3.png我搜查了一下有关剥离植物叶片下表皮的方法。包括有透明法,铬酸离析法,指甲油、琼脂等物质的印拓法和次氯酸钠离析法等。不过指甲油和琼脂的印拓法的指甲油和琼脂在显微镜下影像模糊,影像气孔数据统计,而次氯酸钠离析法剥离下表皮操作时比较复杂,以上这些方法都相对来说操作较复杂。对于一般的叶片,比如玉米,可以有最简便的办法。方法一是直接撕取法,选取一些相对老的叶片较容易剥离,手指夹紧叶片,用尖头夹紧一小片,直接撕取,在撕下的叶片边缘会有一些只有下表皮层,这个方法要多试几次。方法二,胶带撕取法。先用刀片在叶片背面轻轻的划一些小道,要轻轻的,不能划穿了叶片。然后用胶带粘住叶片,可以用力按压,然后快速撕下胶带,在胶带上会沾上下表皮层,可以直接观察。http://ng1.17img.cn/bbsfiles/images/2017/10/2015071522180481_01_0_3.jpghttp://ng1.17img.cn/bbsfiles/images/2017/10/2015071522181077_01_3021049_3.jpg本人推崇简单,一般采用下面两个最简单的办法。下面是拍摄的图片。接下来想做叶片纵切,不知道大家有谁有简便的叶片纵切方法,希望能一起交流。http://ng1.17img.cn/bbsfiles/images/2015/07/201507152224_555710_3021049_3.jpg
谁是做小麦氨基酸方面的 能不能提供几篇关于小麦氨基酸方面的英文文章~谢谢了~[em61] [em61] 谢谢大家
怎样获取叶片的最佳波段?
请问测定“植物叶片水势”的仪器?哪里有?
求助,大家做过植株叶片钠氯等元素含量的测定吗,求方法,找了半天找不到完整的方法
GCMS测植物叶片代谢产物(氨基酸、有机酸、糖))前,样品处理的标准化,应该怎么处理植物叶片,从采摘下后,越详细越好,非常感谢
你们的抽风机叶片旋转方向是朝哪面的?是顺时针还是逆时针方向?
当涂县小麦配方施肥试验研究【作 者】 叶明海;王秀龙;胡现荣【刊 名】安徽农学通报(下半月刊)【出版日期】2011【期 号】第24期小麦测土配方施肥对比试验【作 者】 姜兴顺【刊 名】安徽农学通报(上半月刊)【出版日期】2011【期 号】第1期鄂北岗地小麦测土配方施肥效果评价【作 者】 母虎生;段建设;周丽娟【刊 名】现代农业科技【出版日期】2011【期 号】第10期
在植物样品中,水稻的叶片因含有较多硅,故比较难磨。即便是用机械研磨设备,有时也不容易研细,可以说如果水稻叶片如果研好了,草本植物的叶片就都没啥大问题了。我们是通过在某省农科院的实验室反复试验,得到以下条件提供参考: 1 将离心管编号,对应编号将相应的水稻叶片截成1cm左右的小段,每个离心管中放3段,用镊子夹住中间位置,放入管底。2 分装珠子:内侧两排装2颗5mm珠子和5颗3mm珠子;外侧两排装1颗5毫米珠子和6颗3mm珠子。3 冷冻:将摆好的夹具,放到泡沫盒中,加液氮冷冻,3-5分钟,充分冷冻夹具及管内样品。4 *转速与时间设定:1500转/分钟 3min5 研磨:在上夹具时,要注意一是要带上厚一点的手套,防止被液氮冻伤;一是要迅速,且要保证螺栓拧紧,卡上保险扣。然后,启动研磨。6 取下夹具,使整体离心管盖子向上,在桌面上拍一拍,使样品粉末沉落管底,进行下一步实验。*目前研磨仪的速度可以达到更高,但考虑离心管材质差异,建议一开始不要设定太高的速度,根据实际情况调整。感谢大家的积极回复,虽然没有像样的照片,但我还是很佩服各位的见识,正如“雾非雾”所说,刚研磨出的样品就是粉末状的,细度比咱们平时冲的豆奶,芝麻糊之类的粉末更细一点,但由于在常温下很容易化冻,如果不抓紧处理,这种粉末很快就会变成“菜泥”状,就是给宝宝吃的那种蔬菜泥。 另外其实就像雾非雾所说,很多实验室也是将样品经低温冷冻,一般是-80℃,这种低温对样品中温度敏感的成分保护已经足够了,但浸液氮的作用除了降温还有一个重要的作用就是脱水,使样品变干变脆,研磨过程中研磨珠与样品进行刚性作用,就像铁锤砸石头,作用力完全被样品吸收,才会被打得粉碎。以前像水稻叶片这种样品之所以不好磨,就是因为叶片本身比较韧,低温冻过之后变蔫变软,研磨珠有劲使不上。 目前我们在植物样品的研磨上获得了不少的经验,下一步还会在其他类型的样品上下功夫,当然,在不透露更多机密的情况下,我会拿来和大家分享。
扫描电镜能否观察植物细胞器尊敬的老师们,大家好!我做了植物叶片的断面,看了其中的细胞器,发现细胞里面全都是大小不一得圆颗粒,但是分不清是什么细胞器,请问扫描电镜能否观察细胞器,由于细胞经过干燥处理后,里面的细胞器自然就分散开来,细胞仪破碎后,细胞器全部掉出,请问大家有没有什么好办法可以看见细胞里面的细胞器呢?补充一下:如果想用扫描电镜观察植物叶片的断面,应当怎么操作?在固定之前就用刀切断,还是干燥完了之后切呢?我在干燥之后掰断的叶片,发现细胞都是破的,而且很不整齐。
蒸馏水浸泡液。关键词 柳树叶,浸提方式,小麦发芽1. 材料和方法1.1 材料柳树叶, 偃师41101.2 提取方式蒸馏水浸泡法:采集新鲜柳树叶,称量其鲜重,用烘箱烘干称量干物质重量计算出柳树叶的含水量,取一定量柳树叶折算后按照280g/L浓度使用蒸馏水浸泡24h。取浸提液分别配制成;280g/L、200g/L、 120g/L、40g/L四个浓度梯度,备用。沸水煎煮法:采集新鲜柳树叶,称量其鲜重,用烘箱烘干称量干物质重量计算出柳树叶的含水量,取一定量柳树叶折算后按照280g/L浓度放入铝锅内,电炉加热至沸腾30min。取煎煮液分别配制成;280g/L、200g/L、 120g/L、40g/L四个浓度梯度,备用。乙醚萃取法:取沸水煎煮柳树叶4h的煎煮液50ml,使用等体积的乙醚萃取三次,留其上清液和沉淀,备用。甲醇浸泡法:采集新鲜柳树叶,称量其鲜重,用烘箱烘干称量干物质重量计算出柳树叶的含水量,取一定量柳树叶折算后按照280g/L浓度甲醇浸泡24h。取浸泡液,备用。1.3 小麦籽粒发芽处理精选籽粒饱满大小均匀,无病虫害,胚部无损伤的小麦种子。用3%的次氯酸钠浸泡消毒30min。反复用蒸馏水冲洗后用蒸馏水浸泡12h,再用各浸提液浸泡12h。取浸泡好的种子将其腹沟朝下,置于垫有双层饱和湿润滤纸的培养皿中。每培养皿中放小麦种子50粒,设两个重复,以蒸馏水为对照。放入26℃恒温培养箱中培养,每隔12h观察一次,做好萌动发芽记录,以胚部破裂为萌动标准,以胚芽鞘长度达种子长度一半时为发芽标准。2. 结果与分析2.1 蒸馏水浸提方式对小麦籽粒发芽的影响表1 柳树叶蒸馏水浸提液对小麦籽粒发芽的影响 处理 萌动率% 发芽率% 36h48h 60h2h84h96h108h空白对照100 100 98.0 100 100 100 100 40g/L100 100 97.8 100 100 100 100 120g/L94.6 95.7 96.6 99.2 99.5 99.5 99.7 200g/L94.2 95.7 96.3 96.9 98.0 98.0 99.1 280g/L65.5 91.0 93.9 95.6 97.2 98.0 98.0 柳树叶蒸馏水浸泡液对小麦籽粒发芽的影响结果如表1。可知:培养36h时间段,280g/L浓度处理与其它浓度处理和空白对照相比小麦籽粒萌动率差异显著,萌动率为65.5%,其它浓度处理和空白对照的萌动率都大于90%。随着时间的推移四种浓度的处理与空白对照相比无明显差异,而且在108h时抑制作用得到解除,种子发芽率恢复到正常水平。说明在蒸馏水浸泡液中抑制小麦发芽的物质含量低。2.2 沸水煎煮提取方式对小麦籽粒发芽的影响表2柳树叶沸水煎煮提取液对小麦籽粒发芽的影响 处理 萌动率% 发芽率 % 36h 48h 60h 72h 84h 96h 108h 空白对照40g/L120g/L200g/L280g/L 77.5 a76.3 a59.4 a34.3 a0 b 98.5 a98.1 a97.1 a74.4 a18.4 b 85.0 a81.7 a63.5 a57.7 a28.7 b 96.1 a95.3 a93.6 a93.2 a49.9 b 99.0 a98.0 a97.6 a93.2 a52.4 b 100 a98.6 a97.6 a94.9 a63.3 a 100 a98.6 a97.6 a96.0 a81.2 a 注;小写字母为0.05水平下显著性比较(下同)。柳树叶沸水煎煮提取液对小麦籽粒发芽的影响结果如表2。可以看出,280g/L、200g/L、 120g/L、40g/L四个浓度处理与空白对照相比,对小麦籽粒萌动发芽的影响不同,在48h时间段,280g/L浓度处理小麦籽粒萌动率仅为18.4%,而其它三个浓度的萌动率依次为;74.4%、97.1%、98.1%。在36h--48h时间段,各个浓度对小麦籽粒发芽的抑制作用随着时间的推移而减弱。对于各个浓度来说,最低浓度40g/L处理的发芽率是100%,最高浓度处理的发芽率是81.2%,随着浓度的增加抑制效果相比于空白对照差异越明显。在108h后低浓度的处理抑制作用就可以解除,种子发芽率恢复到正常水平。说明沸水煎煮提取液中含有抑制小麦籽粒发芽的物质。2.3 乙醚萃取、甲醇浸泡提取方式对小麦籽粒发芽的影响表3 乙醚、甲醇浸提液对小麦籽粒发芽的影响 处理 萌动率% 发芽率% 36h 48h 60h 72h 84h 96h 108h 空白对照甲醇对照乙醚对照甲醇浸泡乙醚沉淀乙醚萃取 88.9 a88.6 a84.2 a6.6 b0 b0 b 77.9 a77.0 a76.4 a0 b0 b0 b[td=1
叶片光谱测定仪器与方法?请求高手指点!yishilai@126.comqq37703501(中国农科院柑橘研究所)

下午摘的红掌新鲜叶片,剪刀剪的断层。不知道这些针状物是什么。30微米左右长,是细胞还是纤维?电镜照的http://ng1.17img.cn/bbsfiles/images/2013/05/201305282049_442046_2539681_3.jpg
细长叶片的风车风能的利用率高?

[size=16px] 植物冠层分析仪是用于研究植物群落结构、生长和生态系统功能的仪器。测量植物叶片的平均倾角是其中的一个重要参数,它可以揭示植物在空间上的排列方式、生长状态以及对光能的吸收利用情况。以下是一般情况下植物冠层分析仪测量植物叶片平均倾角的基本步骤: 仪器设置和安装: 安装冠层分析仪,确保其与被测量的植物位于适当的距离和角度。通常,仪器需要放置在离植物适度远的位置,以获取整体叶片分布的信息。 数据采集: 冠层分析仪通常会发射激光束或其他传感信号,然后测量信号的反射或传播情况。这些信号在与植物叶片交互时会发生变化,从而可以推断出叶片的倾角信息。 数据处理: 仪器收集到的数据需要进行处理,以计算出植物叶片的平均倾角。处理的方法可能因仪器型号和工作原理而异。一种常见的方法是基于接收到的信号强度变化来计算叶片的角度。 统计分析: 多次测量不同位置的数据,然后对这些数据进行统计分析,以获得叶片的平均倾角。这可以帮助消除单一测量点的误差,并提供更准确的结果。 需要注意的是,不同的植物冠层分析仪可能有不同的工作原理和测量方法,因此在使用特定仪器时,应该参考其使用手册或操作指南,以了解详细的操作步骤和数据处理方法。[/size][align=left] 此外,随着技术的不断发展,可能会有新的方法和技术用于测量植物叶片的平均倾角,所以建议在实际操作中保持关注最新的技术进展。[img=,690,690]https://ng1.17img.cn/bbsfiles/images/2023/08/202308251019084435_6824_6098850_3.png!w690x690.jpg[/img][/align]
请教如果用扫描要看叶片的断面怎么把样品固定在样品台上啊?[em09509]
40 g/L。关键词:植物源,抑制效应,小麦,穗发芽引言水稻、小麦、玉米、大麦、油菜等作物在收获季节如遇连阴雨,在田间植株穗上发芽,这种现象称为穗发芽。作物种子穗发芽是世界性灾害。在我国的长江中下游、西南、黄淮冬麦区和东北春麦区小麦穗发芽频繁发生,近年来,北部冬麦区也遭受了严重的危害。小麦穗发芽因α-淀粉酶活性上升,促使籽粒淀粉降解,造成籽粒品质劣化,同时蛋白酶的水解活动使蛋白酶降解为麦谷朊和小分子氨基酸,从而导致筋力下降。防治小麦种子穗发芽,最经济有效的途径就是选育和种植抗穗发芽品种。在目前白皮小麦品种抗穗发芽能力普遍较弱的情况下,化控成为防治小麦穗发芽的另一途径,具有简便、快速而有效的优点。我国防治小麦穗发芽已利用的一些生长延缓剂、激素类药剂,又成本过高,对人体健康危害严重。据研究,种子发芽抑制物质广泛存在于一些天然植物中,尤其在某些林木种子中含量丰富,其种类非常多,作用迅速,而且许多发芽抑制物质对抑制种子萌发无专一性,因此,可以从休眠期长,发芽抑制物质含量高的林木种子、果实或枝叶中提取抑制物质来防治小麦籽粒发芽。本研究在广泛筛选的基础上,以来源充足,含水杨酸(SA)等有效抑制成分且提取简便的几种林木枝叶为原料,分别研究其浸提液对小麦籽粒发芽的抑制效应,以期筛选出安全有效的小麦籽粒发芽抑制剂,为防治小麦穗发芽以及做到安全使用提供理论依据。1 材料和方法1.1 试验材料在广泛筛选的基础上,选择杨树、柳树等含水杨酸(SA)等抑制成分较为丰富的五种常见林木枝叶YS,LS,TS,DX和SL为提取植物源种子萌发抑制剂的天然材料。以当年收获,保存良好的小麦种子(偃师4110、矮抗58)为试验用种。1.2 试验方法1.2.1林木枝叶浸提液的提取 将采集的五种常见林木的新鲜枝叶用电子天平(JA5002)分别称取10 g,放入温度设定为75℃的电热恒温培养箱(DHP-420型),烘干3 h左右,待干物质重量不再随烘干时间而发生变化为止,再用电子天平称量各材料的干物质重,计算出各种材料的含水量。 根据各种材料的含水量,折算出配制200 mL浓度为280 g/L的母液所需要的各材料鲜重,用电子天平称取。 将称好的新鲜材料放入铝锅中,加入1 L自来水,置于电炉上进行煎煮浓缩(约4 h),直至浓缩到200 mL,彻底取出浸提液,以备用。1.2.2处理液浓度的配制 用各材料的浸提液母液稀释配制成280 g/L,200 g/L,120 g/L和40 g/L四个浓度梯度。1.2.3小麦籽粒发芽抑制效应鉴定 取保存良好的当年收获的小麦种子(偃师4110、矮抗58),精选籽粒饱满、大小均匀、无病虫害、胚部无损伤的小麦种子,先放入1%的NaCl O溶液中消毒30 min,然后用蒸馏水反复冲洗。将消过毒的小麦种子用蒸馏水浸泡12 h,然后将种子放入事先准备好的4个浓度梯度下的各处理液中浸泡12 h,CK则继续在蒸馏水中浸泡12 h。 将种子从各处理液中取出,将其腹沟向下置于垫有单层湿润滤纸的培养皿中,每个培养皿排放50粒种子,每个处理一个重复。培养皿放入设定为26℃的电热恒温培养箱中培养,每天定时补充水分,使培养皿中的滤纸保持湿润。每隔12 h观察一次并记录萌动和发芽种子数,3 d后每天观察记录一次,直到第7 d,以胚部破裂露白为萌动,以胚芽鞘达种子长度一半时为发芽。3d后根据发芽的籽粒数目计算发芽势,7 d后根据发芽的籽粒数目计算发芽率。1.2.4试验统计方法和计算公式 方差分析和相关分析采用SAS6.12统计软件和Excel2003数据处理软件。发芽抑制率(%)=(对照-处理)/对照×100 …………………………… (1)发芽势(%)=第3d发芽籽粒数/籽粒总数×100 ………………………… (2)发芽率(%)=第7d发芽籽粒数/籽粒总数×100 ………………………… (3)2 结果与分析2.1 各材料浸提母液不同时间段对小麦籽粒发芽的抑制效应表1 各材料浸提母液不同时间段对小麦籽粒发芽的影响 指 标 发芽观察时间(h)/(d) 12h 24h 36h 48h 60h 3d 4d 5d 6d 7d 萌动率(%) 处理 CK M3 M2 M5 M4 M184 97A 97aA 99A 99aA 100aA 100aA 100aA 100aA 100aA 5 40B 83bB 88B 92bA 92bA 93bA 93bA 93bA 93bA 0 9C 15cC 21C 24cB 28cB 30cB 38cB 57cB 69cB 0 5C 12cC 18C 22cdB 25cdB 28cdB 37cB 49dB 62dB 0 3C 6dD 16C 17dB 21dB 23dB 33cB 38eC 42eC 0 0D 0eD 0D 0eC 2eC 3eC 3dC 3fD 3fD 发芽率(%) 处理 CK M3 M2 M5 M4 M1 0 93 96 97A 99A 100aA 100A 100A 100aA 100A 0 0 2 20B 77B 88bB 91B 91B 91bB 91B 0 0 2 10C 17C 24cC 29C 37C 55cC 61C 0 0 1 10C 17C 19cdC 25C 32C 46dC 58C 0 0 0 9C 12C 17dC 22C 31C 33eD 36D 0 0 0 0D 0D 1eD 2D 3D 3fE 3E 注:1.小写字母表示0.05水平下的差异显著性,不同字母间表示差异显著;大写字母表示0.01水平下的差异显著性,不同字母间表示差异极显著。(下同) 2.表中各数值均为两个重复的平均值。(下同)从表1中可以看出,除了培养12 h时的发芽率各处理均为0外,其余观察时间各材料浸提液母液的萌动率和发芽率均低于CK,且随时间的延长而升高,特别是M3萌动率和发芽率随时间延长增长最为明显,其萌动率在24 ~36 h之间由40%迅速增加到83%,发芽率在48~60 h之间由20%迅速增加到77%。M2,M5和M4的萌动率和发芽率在6d前随时间的延长增加平稳,在6 d时M2和M5突增并与M4差异显著,M4则增加基本稳定。M1随时间延长其萌动率和发芽率变化不大。经方差分析可知,除培养12 h时的发芽率各处理均为0,其余观察时间各材料浸提液母液的萌动率和发芽率均与CK差异显著;M5和M4在5d前萌动率和发芽率差异不显著;从整个观察时间的结果来看,可以将各材料的萌动率和发芽率大致分为M1一个,M4、M5和M2一个,M3一个3个水平;48 h以后,M1的萌动率和发芽率均与CK和其它处理差异极显著,72 h时种子萌动率仅为2

http://ng1.17img.cn/bbsfiles/images/2012/03/201203101411_353740_1615758_3.jpg微波消解水稻成熟叶片,HNO3/HF(5/1)为什么溶液是绿色的呢?不会是叶绿素吧?
LY/T 1855-2009 木制百叶窗帘和百叶窗叶片