请问二阶非线性光学的原理网上哪里有介绍,有什么仪器可以测量二阶非线性光学的性质
请问用什么仪器测量物质的二阶非线性光学性质
第一节概述 把一个有用的目的DN***段通过重组DNA技术,送进受体细胞中去进行繁殖和表达的工具叫载体(Vector)。细菌质粒是重组DNA技术中常用的载体。 质粒(Plasmid)是一种染色体外的稳定遗传因子,大小从1-200kb不等,为双链、闭环的DNA分子,并以超螺旋状态存在于宿主细胞中。质粒主要发现于细菌、放线菌和真菌细胞中,它具有自主复制和转录能力,能在子代细胞中保持恒定的拷贝数,并表达所携带的遗传信息。质粒的复制和转录要依赖于宿主细胞编码的某些酶和蛋白质,如离开宿主细胞则不能存活,而宿主即使没有它们也可以正常存活。质粒的存在使宿主具有一些额外的特性,如对抗生素的抗性等。F质粒(又称F因子或性质粒)、R质粒(抗药性因子)和Col质粒(产大肠杆菌素因子)等都是常见的天然质粒。 质粒在细胞内的复制一般有两种类型:紧密控制型(Stringent control)和松驰控制型(Relaxed control)。前者只在细胞周期的一定阶段进行复制,当染色体不复制时,它也不能复制,通常每个细胞内只含有1个或几个质粒分子,如F因子。后者的质粒在整个细胞周期中随时可以复制,在每个细胞中有许多拷贝,一般在20个以上,如Col E1质粒。在使用蛋白质合成抑制剂-氯霉素时,细胞内蛋白质合成、染色体DNA复制和细胞分裂均受到抑制,紧密型质粒复制停止,而松驰型质粒继续复制,质粒拷贝数可由原来20多个扩增至1000-3000个,此时质粒DNA占总DNA的含量可由原来的2%增加至40-50%。 利用同一复制系统的不同质粒不能在同一宿主细胞中共同存在,当两种质粒同时导入同一细胞时,它们在复制及随后分配到子细胞的过程中彼此竞争,在一些细胞中,一种质粒占优势,而在另一些细胞中另一种质粒却占上风。当细胞生长几代后,占少数的质粒将会丢失,因而在细胞后代中只有两种质粒的一种,这种现象称质粒的不相容性(Incompatibility)。但利用不同复制系统的质粒则可以稳定地共存于同一宿主细胞中。质粒通常含有编码某些酶的基因,其表型包括对抗生素的抗性,产生某些抗生素,降解复杂有机物,产生大肠杆菌素和肠毒素及某些限制性内切酶与修饰酶等。 质粒载体是在天然质粒的基础上为适应实验室操作而进行人工构建的。与天然质粒相比,质粒载体通常带有一个或一个以上的选择性标记基因(如抗生素抗性基因)和一个人工合成的含有多个限制性内切酶识别位点的多克隆位点序列,并去掉了大部分非必需序列,使分子量尽可能减少,以便于基因工程操作。大多质粒载体带有一些多用途的辅助序列,这些用途包括通过组织化学方法肉眼鉴定重组克隆、产生用于序列测定的单链DNA、体外转录外源DNA序列、鉴定片段的插入方向、外源基因的大量表达等。一个理想的克隆载体大致应有下列一些特性:(1)分子量小、多拷贝、松驰控制型;(2)具有多种常用的限制性内切酶的单切点;(3)能插入较大的外源DN***段;(4)具有容易操作的检测表型。常用的质粒载体大小一般在1kb至10kb之间,如PBR322、PUC系列、PGEM系列和pBluescript(简称pBS)等。 从细菌中分离质粒DNA的方法都包括3个基本步骤:培养细菌使质粒扩增;收集和裂解细胞;分离和纯化质粒DNA。采用溶菌酶可以破坏菌体细胞壁,十二烷基磺酸钠(SDS)和Triton X-100可使细胞膜裂解。经溶菌酶和SDS或Triton X-100处理后,细菌染色体DNA会缠绕附着在细胞碎片上,同时由于细菌染色体DNA比质粒大得多,易受机械力和核酸酶等的作用而被切断成不同大小的线性片段。当用强热或酸、碱处理时,细菌的线性染色体DNA变性,而共价闭合环状DNA(Covalently closed circular DNA,简称cccDNA)的两条链不会相互分开,当外界条件恢复正常时,线状染色体DN***段难以复性,而是与变性的蛋白质和细胞碎片缠绕在一起,而质粒DNA双链又恢复原状,重新形成天然的超螺旋分子,并以溶解状态存在于液相中。在细菌细胞内,共价闭环质粒以超螺旋形式存在。在提取质粒过程中,除了超螺旋DNA外,还会产生其它形式的质粒DNA。如果质粒DNA两条链中有一条链发生一处或多处断裂,分子就能旋转而消除链的张力,形成松驰型的环状分子,称开环DNA(Open circular DNA, 简称ocDNA);如果质粒DNA的两条链在同一处断裂,则形成线状DNA(Linear DNA)。当提取的质粒DNA电泳时,同一质粒DNA其超螺旋形式的泳动速度要比开环和线状分子的泳动速度快。
[b][font=宋体]一、质粒提取的原理:[/font][/b][font=宋体] [/font][font=宋体][font=宋体]质粒是细胞内的一种环状的小分子[/font][font=Calibri]DNA[/font][font=宋体],是进行[/font][font=Calibri]DNA[/font][font=宋体]重组的常用载体。作为一个具有自身复制起点的复制单位独立于细胞的主染色体之外,质粒[/font][font=Calibri]DNA[/font][font=宋体]上携带了部分的基因信息,经过基因表达后使其宿主细胞表现相应的性状。在[/font][font=Calibri]DNA[/font][font=宋体]重组中,质粒或经过改造后的质粒载体可通过连接外源基因构成重组体。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]从宿主细胞中提取质粒[/font][font=Calibri]DNA[/font][font=宋体],是[/font][font=Calibri]DNA[/font][font=宋体]重组技术中最基础的实验技能。分离质粒[/font][font=Calibri]DNA[/font][font=宋体]有三个步骤:培养细菌使质粒扩增,收集和裂解细菌,分离和纯化质粒[/font][font=Calibri]DNA[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]在质粒提取过程中,由于机械力、酸碱度、试剂等的原因,可能使质粒[/font][font=Calibri]DNA[/font][font=宋体]链发生断裂。所以,多数质粒粗提取物中含有三种构型的质粒:共价闭合环状[/font][font=Calibri]DNA[/font][font=宋体]([/font][font=Calibri]cccDNA[/font][font=宋体]): 质粒的两条链没有断裂;超螺旋开环[/font][font=Calibri]DNA[/font][font=宋体]([/font][font=Calibri]ocDNA[/font][font=宋体]): 质粒的一条链断裂;松弛的环状分子线形[/font][font=Calibri]DNA[/font][font=宋体]([/font][font=Calibri]lDNA[/font][font=宋体]): 质粒的两条链均断裂;线性分子质粒[/font][font=Calibri]DNA[/font][font=宋体]的分子构型 。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]质粒[/font][font=Calibri]DNA[/font][font=宋体]琼脂塘凝胶电泳模式图可分为:松弛线性的[/font][font=Calibri]DNA[/font][font=宋体]; 松弛开环的[/font][font=Calibri]OC[/font][font=宋体]构型; 超螺旋的[/font][font=Calibri]SC[/font][font=宋体]构型。由于琼脂糖中加有嵌入型染料溴化乙锭,因此,在紫外线照射下[/font][font=Calibri]DNA[/font][font=宋体]电泳带成橘黄色。 道中的[/font][font=Calibri]SC DNA[/font][font=宋体]走在最前沿,[/font][font=Calibri]OC DNA[/font][font=宋体]则位于凝胶的最后边;道中的[/font][font=Calibri]L DNA [/font][font=宋体]是经核酸内切限制酶切割质粒之后产生的,它在凝胶中的位置介于[/font][font=Calibri]OC DNA [/font][font=宋体]和 [/font][font=Calibri]SC DNA [/font][font=宋体]之间。[/font][/font][font=宋体] [/font][font=宋体][b]二、质粒提取方法[/b][/font][font=宋体] [/font][font=宋体][font=宋体]质粒[/font][font=Calibri]DNA[/font][font=宋体]的提取方法主要有碱裂解法、煮沸法、酚氯仿裂解法。跟据不同的实验目的和仪器设备择取不同的实验方案。[/font][/font][font=宋体] [/font][font=宋体] [/font][font=宋体][b]三、质粒提取的常见问题[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1.[/font][font=宋体]时间控制问题[/font][/font][font=宋体] [/font][font=宋体][font=宋体]裂解时间太长,加入溶液[/font][font=Calibri]P2[/font][font=宋体]后裂解时间不应超过[/font][font=Calibri]5 [/font][font=宋体]分钟;吸附时间不够;溶解时间不够都会导致质粒[/font][font=Calibri]DNA[/font][font=宋体]提取实验失败。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.[/font][font=宋体]大肠杆菌老化[/font][/font][font=宋体] [/font][font=宋体]建议涂布平板培养后,重新挑选新菌落进行液体培养。[/font][font=宋体] [/font][font=宋体][font=Calibri]3.[/font][font=宋体]质粒拷贝数低[/font][/font][font=宋体] [/font][font=宋体][font=宋体]由于使用低拷贝数载体引起的质粒[/font][font=Calibri]DNA [/font][font=宋体]提取量低,可更换具体相同功能的高拷贝数载体。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]4.[/font][font=宋体]溶液使用不当[/font][/font][font=宋体] [/font][font=宋体][font=宋体]溶液[/font][font=Calibri]P2[/font][font=宋体]、[/font][font=Calibri]P3 [/font][font=宋体]在温度较低时可能出现浑浊,应置于[/font][font=Calibri]37[/font][font=宋体]℃保温片刻直至溶解为清亮的溶液,才能使用。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]5.[/font][font=宋体]吸附柱过载[/font][/font][font=宋体] [/font][font=宋体][font=宋体]不同产品中吸附柱吸附能力不同,如果需要提取的质粒量很大,请分多次提取。若用富集培养基,例如[/font][font=Calibri]TB [/font][font=宋体]或者 ×[/font][font=Calibri]YT [/font][font=宋体]菌液体积必须减少;若质粒或宿主菌是非常高的拷贝数或生长率,则需调整[/font][font=Calibri]LB [/font][font=宋体]培养液体积。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]6.[/font][font=宋体]质粒未全部溶解[/font][/font][font=宋体] [/font][font=宋体]洗脱溶解质粒时,可适当加温或延长溶解时间。[/font][font=宋体] [/font][font=宋体][font=Calibri]7.[/font][font=宋体]乙醇残留[/font][/font][font=宋体] [/font][font=宋体]漂洗液洗涤后应离心尽量去除残留液体,树脂型试剂盒漂洗后应晾干树脂,再加入洗脱缓冲液。[/font][font=宋体] [/font][font=宋体][font=Calibri]8.[/font][font=宋体]洗脱液加入位置不正确[/font][/font][font=宋体] [/font][font=宋体]洗脱液应加在硅胶膜中心部位以确保洗脱液会完全覆盖硅胶膜的表面达到最大洗脱效率。[/font][font=宋体] [/font][font=宋体][font=Calibri]9.[/font][font=宋体]洗脱液不合适[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]DNA [/font][font=宋体]只在低盐溶液中才能被洗脱。洗脱效率取决于[/font][font=Calibri]pH [/font][font=宋体]值。最大洗脱效率在[/font][font=Calibri]pH7.0[/font][font=宋体]~ [/font][font=Calibri]8.5 [/font][font=宋体]间。当用水洗脱时确保其 [/font][font=Calibri]pH [/font][font=宋体]值在此范围内,如果[/font][font=Calibri]pH [/font][font=宋体]过低可能性导致洗脱量低。洗脱时将灭菌蒸馏水或洗脱缓冲液加暖至 [/font][font=Calibri]60 [/font][font=宋体]℃后使用有利于提高洗脱效率。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]10.[/font][font=宋体]洗脱体积太小[/font][/font][font=宋体] [/font][font=宋体]洗脱体积对来回收率有一定影响。随着洗脱体积的增大回收率增高,但产品浓度降低。为了得到较高的回收率可以增大洗脱体积[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州能够提供快速、高通量、高品质以及个性化的[url=https://cn.sinobiological.com/services/plasmid-dna-preparation-service][b]质粒[/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/services/plasmid-dna-preparation-service][b]DNA[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/plasmid-dna-preparation-service][b]制备服务[/b][/url]。不仅满足实验室研究人员的小量质粒[/font][font=Calibri]DNA[/font][font=宋体]制备需求,也可为生物工业用户和医药公司等提供大规模的质粒[/font][font=Calibri]DNA[/font][font=宋体]制备服务。义翘神州升级改造后的质粒[/font][font=Calibri]DNA[/font][font=宋体]制备平台,采用[/font][font=Calibri]GMP[/font][font=宋体]级别的生产线,对过程和最终产品的严格管控,确保了最终产品质量符合客户需求。义翘神州可以提供从μ[/font][font=Calibri]g[/font][font=宋体]级别,[/font][font=Calibri]mg[/font][font=宋体]级别至[/font][font=Calibri]g[/font][font=宋体]级别不同规模的科研级和工业级别的质粒生产服务,满足不同的需求。详情可以关注:[/font][font=Calibri]https://cn.sinobiological.com/services/plasmid-dna-preparation-service[/font][/font]
质粒提取柱(大中/硅胶膜)CommaAffin™质粒中提柱http://www.biocomma.cn/images/nucleic-11.jpg产品组成外管医疗级PP,15ml,耐受酸碱和大部分的 有机溶剂 ,用来收集离心液。内管医疗级PP,耐受酸碱和大部分的 有机溶剂 ,底部鲁尔接口设计,方便离心液收集。直径11.0mm筛板特殊 纤维材料 ,在高速离心过程中,支撑硅胶膜,保证硅胶膜的完整性,耐受酸碱和大部分的 有机溶剂 ,厚度仅为0.3-0.5mm,孔径50um,孔隙率只有不到百分之二十,相比市场上同类产品,比面积小,静电小,DNA吸附极低。硅胶膜孔径1um,高盐低pH值选择性吸附DNA、RNA,低盐高pH值释放DNA、RNA压圈医疗级PP,固定筛板与硅胶膜。CommaAffin™质粒大提柱http://www.biocomma.cn/images/nucleic-3.jpg产品组成外管医疗级PP,50ml,耐受酸碱和大部分的 有机溶剂 ,用来收集离心液。内管医疗级PP,耐受酸碱和大部分的 有机溶剂 ,底部鲁尔接口设计,方便离心液收集。直径24.0mm筛板特殊 纤维材料 ,在高速离心过程中,支撑硅胶膜,保证硅胶膜的完整性,耐受酸碱和大部分的 有机溶剂 ,厚度仅为0.3-0.5mm,孔径50um,孔隙率只有不到百分之二十,相比市场上同类产品,比面积小,静电小,DNA吸附极低。硅胶膜孔径1um,高盐低pH值选择性吸附DNA、RNA,低盐高pH值释放DNA、RNA压圈医疗级PP,固定筛板与硅胶膜。CommaAffin™核酸中/大提柱可用在核酸提取过程(见图1)中过柱结合、洗涤、洗脱步骤中核酸吸附量:CommaAffin™质粒中提柱:0-100ug 规格:15ml离心管+吸附柱CommaAffin™质粒大提柱:0-500ug 规格:50ml离心管+吸附柱 http://www.biocomma.cn/images/nucleic-7.jpg 图1 质粒提取过程适用范围:核酸提取原理是在特定溶液环境下(高盐、低pH)使核酸吸附在固相介质(硅胶膜)上,洗涤去除杂质后,再改 变溶液环境使DN A溶解到纯水或TE中。质粒DNA提取:抽提缓冲液,或者结合液中需要胍盐(如硫氰酸胍等) 辅助DNA吸附到膜上。【注意事项】 1.上柱前溶液的PH值应小于7;2.洗涤液中的乙醇浓度不得低于50%,一般55%--80%之间。3.最后洗脱,可以用去离子水或者TE(10 mmol/LTris-Cl,1 mmol/L EDTA (pH8.0))。如果长期保存DNA,建议使用TE。订购信息Cat#品名柱管规格包装004407质粒中提过滤管20ml50套/包004410质粒中提过滤管30ml50套/包004416质粒大提过滤管60ml20套/包
[font=宋体][font=宋体]质粒是染色体外能够进行自主复制的遗传单位,当前通常用其来特指细菌、真菌、酵母菌和放线菌等生物中染色体以外的[/font][font=Calibri]DNA[/font][font=宋体]分子。[/font][/font][font=宋体] [font=宋体]在基因工程领域,质粒常常被当做基因的载体使用。在分子生物学中,质粒[/font][font=Calibri]DNA[/font][font=宋体]被当做基因运载工具具有非常广泛的应用。[/font][/font][font=宋体] [font=宋体]在质粒[/font][font=Calibri]DNA[/font][font=宋体]的应用过程中,其纯度对于酶切、[/font][font=Calibri][url=https://insevent.instrument.com.cn/t/jp][color=#3333ff]PCR[/color][/url][/font][font=宋体]扩增等实验结果有着比较大的影响,因此需要保证质粒[/font][font=Calibri]DNA[/font][font=宋体]提取的纯度和效率。[/font][/font][font=宋体] [font=宋体]在细菌中提取质粒[/font][font=Calibri]DNA[/font][font=宋体]通常按照以下步骤进行[/font][font=Calibri]:[/font][/font][font=宋体] [font=宋体]第一步,培养细菌,使质粒扩增[/font][font=Calibri] [/font][/font][font=宋体] [font=宋体]第二步,进行细菌的收集和裂解[/font][font=Calibri] [/font][/font][font=宋体] [font=宋体]第三步,质粒[/font][font=Calibri]DNA[/font][font=宋体]的分离和纯化。[/font][/font][font=宋体] [font=宋体]在质粒[/font][font=Calibri]DNA[/font][font=宋体]的提取过程中,其提取效果和其大小呈现出正比例关系,越小越容易进行提取,这主要是由于,如果质粒[/font][font=Calibri]DNA[/font][font=宋体]比较大的话,其特性机会和染色体[/font][font=Calibri]DNA[/font][font=宋体]比较接近,这样想要将二者分离开来难度就会变大。[/font][/font][font=宋体] [font=宋体]在进行质粒[/font][font=Calibri]DNA[/font][font=宋体]的分离时,适宜的条件是非常重要的,主要包括[/font][font=Calibri]pH[/font][font=宋体]值、[/font][font=Calibri]SDS[/font][font=宋体]浓度、时间和溶菌温度等,在适宜的条件下质粒[/font][font=Calibri]DNA[/font][font=宋体]和染色体[/font][font=Calibri]DNA[/font][font=宋体]才能够更好的分离开来。[/font][/font][font=宋体] [font=宋体]细菌浓度对于质粒[/font][font=Calibri]DNA[/font][font=宋体]的提取也是非常重要的,如果细菌的浓度比较高,那么在溶菌时,溶菌液很难和细菌液充分混合,导致溶菌不彻底的问题,这样会造成质粒的回收率比较低;[/font][/font][font=宋体] [font=宋体]而如果细菌溶度比较低,溶菌液和菌液均分混合,会造成溶液中含有较多的蛋白质、染色体以及菌体碎片,在这样的情况下,沉淀时质粒回合这些物质共沉,进而导致质粒的回收率也会比较低。[/font][/font][font=宋体] [font=宋体]在生物学的相关研究之中,细菌质粒[/font][font=Calibri]DNA[/font][font=宋体]的提取是比较常规的技术和操作,主要的方法有碱裂解法、煮沸法以及[/font][font=Calibri]SDS[/font][font=宋体]裂解法等,下面对碱裂解法进行介绍。[/font][/font][font=宋体] [/font][b][font=宋体]碱裂解法[/font][/b][font=宋体] [font=宋体]碱裂解法是当前应用比较广泛的质粒[/font][font=Calibri]DNA[/font][font=宋体]提取方法,这种方法的优点在于提取的质粒[/font][font=Calibri]DNA[/font][font=宋体]纯度高,操作便捷,缺点是需要较长的提纯时间。研究人员在缩短这一方法的提纯时间方面做了大量的研究,但是没有得到理想的效果,当前这一方法提取[/font][font=Calibri]DNA[/font][font=宋体]的时间都在[/font][font=Calibri]1.5h[/font][font=宋体]以上。[/font][/font][font=宋体] [font=宋体]碱裂解法提取质粒[/font][font=Calibri]DNA[/font][font=宋体]的基本原理[/font][font=Calibri]:[/font][font=宋体]首选,在菌液中加入溶液Ⅰ,细菌细胞悬浮,同时其中的[/font][font=Calibri]EDTA[/font][font=宋体]会和[/font][font=Calibri]Ca2+[/font][font=宋体]以及[/font][font=Calibri]Mg2+[/font][font=宋体]鳌合,起到抑制[/font][font=Calibri]DNase[/font][font=宋体]活性的作用;然后,加入溶液Ⅱ,将细胞裂解,在这个过程中蛋白质和少量质粒将会变质;[/font][/font][font=宋体] [font=宋体]再次,加入溶液[/font][font=宋体]Ⅲ,使多数蛋白质以及染色体[/font][font=Calibri]DNA[/font][font=宋体]被沉淀,并使得质粒[/font][font=Calibri]DNA[/font][font=宋体]复性。其中,该方法中起到裂解细菌作用的主要是溶液Ⅱ中的[/font][font=Calibri]NaOH[/font][font=宋体],正因如此该方法被称为碱裂解法,如果将其换为[/font][font=Calibri]SDS[/font][font=宋体],也能够提取出少量的质粒[/font][font=Calibri]DNA[/font][font=宋体],这是由于[/font][font=Calibri]SDS[/font][font=宋体]也是碱性的,可以一定程度上破坏细菌的细胞膜。[/font][/font][font=宋体] [font=宋体]在这一方法中需要注意,[/font][font=Calibri]NaOH[/font][font=宋体]溶液要现用现配,这个主要是由于其能够和空气中的[/font][font=Calibri]CO2[/font][font=宋体]反应,从而使溶液的碱性降低,这样会影响提纯的效率。[/font][/font][font=宋体] [font=宋体]另外在加入溶液[/font][font=宋体]Ⅱ之后,操作时间不能够过长,这是因为染色体[/font][font=Calibri]DNA[/font][font=宋体]在碱性条件下片段会慢慢断裂。另外需要注意的是,在操作过程中,混匀是一定要轻柔,从而在保证细菌沉淀可以充分的扩散在试剂中的前提下,避免已变性质粒[/font][font=Calibri]DNA[/font][font=宋体]和染色体基因组[/font][font=Calibri]DNA[/font][font=宋体]被机械剪切。[/font][/font][font=宋体][font=宋体]此外,在溶液[/font][font=宋体]Ⅲ加入之后,其中的[/font][font=Calibri]SDS[/font][font=宋体]会和蛋白质结合,会产生大量的沉淀,[/font][font=Calibri]SDS[/font][font=宋体]还会和醋酸钾结合,生成[/font][font=Calibri]PDS[/font][font=宋体],这一物质的溶解度远低于[/font][font=Calibri]SDS[/font][font=宋体],从而可以将大部分蛋白质和染色体[/font][font=Calibri]DNA[/font][font=宋体]共沉淀,进而获得质粒。[/font][/font][font=宋体][font=宋体]义翘神州能够提供快速、高通量、高品质以及个性化的[url=http://cn.sinobiological.com/services/plasmid-dna-preparation-service][b]质粒[/b][/url][/font][font=Calibri][url=http://cn.sinobiological.com/services/plasmid-dna-preparation-service][b]DNA[/b][/url][/font][font=宋体][url=http://cn.sinobiological.com/services/plasmid-dna-preparation-service][b]制备服务[/b][/url]。不仅满足实验室研究人员的小量质粒[/font][font=Calibri]DNA[/font][font=宋体]制备需求,也可为生物工业用户和医药公司等提供大规模的质粒[/font][font=Calibri]DNA[/font][font=宋体]制备服务。义翘神州升级改造后的质粒[/font][font=Calibri]DNA[/font][font=宋体]制备平台,采用[/font][font=Calibri]GMP[/font][font=宋体]级别的生产线,对过程和最终产品的严格管控,确保了最终产品质量符合客户需求。义翘神州可以提供从μ[/font][font=Calibri]g[/font][font=宋体]级别,[/font][font=Calibri]mg[/font][font=宋体]级别至[/font][font=Calibri]g[/font][font=宋体]级别不同规模的科研级和工业级别的质粒生产服务,满足不同的需求。更多详情可以参看:[/font][font=Calibri]http://cn.sinobiological.com/services/plasmid-dna-preparation-service[/font][/font]
请教大家一个问题,我问同学要了个1301的质粒,用BglII 和EcoRI切出4条带来,本来应该两条带。而且我可以保证酶切是完全的。可同学说他给我的质粒没问题,前几天他用还是好的。高手给解决一下吧!!
1.质粒提取实验中各物质的作用2.电泳实验中 电泳液的作用 MARK的组成及质粒溶度的基本判断方法和基本原理
有谁见过有JNK-GFP 或JNK-YFP 或JNK-CFP质粒的文章吗?谢谢
分子生物学(基因工程)的实验中,经常要做细胞质粒DNA的提取和检测工作,以便获得运载基因的载体DNA;或用于实行电泳检测分析,了解样品是否含有质粒DNA(包括重组质粒DNA),判断其分子量大小,区别不同质粒等等。因此质粒DNA的提取是基因工程实验中最常用的手段之一。质粒是一种染色体外的稳定遗传银子,大小从1kb到200kb不等,大多数来自细菌的质粒是双链、共价闭合环状的分子,并以超螺旋形式存在于宿主的细胞质中。它是细菌内的共生型遗传因子,主要发现于细菌、放线菌和真菌细胞中,质粒具有自主复制和转录能力,能在子代细胞中保持恒定的拷贝数,并表达所携带的遗传信息。质粒的分离是利用质粒DNA和染色体DNA在变性与复性中的差异来达到的目的。当菌体在NaOH和SDS溶液中裂解时,蛋白质与DNA发生变性,由于染色体DNA与质粒DNA拓扑构型不同,染色体DNA双螺旋结构解开,而共价闭合质粒DNA的氢键虽被断裂,但两条互补链彼此相互盘绕仍会紧密地结合在仪器。当加入中和液后,溶液pH恢复至中性,在高盐浓度的情况下,染色体DNA之间交联形成不溶性网状结构并与蛋白质SDS复合物等形成沉淀;不同的是质粒DNA复性迅速而准确,保持可溶状态而留在上清中。这样,通过离心可沉淀大部分细胞碎片、染色体DNA、RNA及蛋白质。除去沉淀后上清中的质粒可用酚氯仿抽提进一步纯化质粒DNA。前面提取质粒DNA的方法就是实验室常用的碱裂解法,该法的操作过程如下:首先讲含有质粒的细菌接种到培养基,经过大约12小时的恒温摇陪后弃去上清液,加入中和液后用漩涡混匀器将溶液充分混匀,然后加入碱液进行沉淀,这就是变性与复性,最后的操作就是实验室常用的沉淀的分离、纯化。分离、纯化DNA首先取上清液,加入分离液后采用漩涡混匀器混匀溶液,离心取上清液,加入无水乙醇后混匀,离心后弃上清液,干燥DNA即可。这个实验中常用到漩涡混匀器进行溶液混匀,意大利VELP公司推出多种型号的漩涡混匀器可满足每一个实验室的需要和安全标准。特别是红外漩涡混匀器,这是VELP公司的专利,该漩涡混匀器一旦检测到试管即自动开始震动混匀,不需要施加任何外力,震动速度可调,时间可设,漩涡混匀器稳定性高,非常适合细胞质粒提取实验。
请教一下各位:药品质粒保有率检测是指什么?
[font=宋体][font=宋体]质粒[/font][font=Calibri]DNA[/font][font=宋体]的质量和纯度对于生命科学实验至关重要。本文将系统地介绍确定质粒[/font][font=Calibri]DNA[/font][font=宋体]质量[/font][font=Calibri]/[/font][font=宋体]纯度的最佳方法,包括实验室检测与生物信息学分析,旨在为研究人员提供专业、准确和可靠的评估手段。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]1. [/font][font=宋体]引言[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]质粒[/font][font=Calibri]DNA[/font][font=宋体]在生物科学研究中扮演着关键角色,涉及基因表达、基因治疗、基因组编辑等多个领域。因此,确保质粒[/font][font=Calibri]DNA[/font][font=宋体]的质量和纯度对于实验的成功至关重要。随着技术的不断发展,确定质粒[/font][font=Calibri]DNA[/font][font=宋体]质量[/font][font=Calibri]/[/font][font=宋体]纯度的方法也在不断改进和完善。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]2. [/font][font=宋体]质粒[/font][font=Calibri]DNA[/font][font=宋体]质量的评估[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]评估质粒[/font][font=Calibri]DNA[/font][font=宋体]质量的方法主要包括电泳分析、酶切鉴定和生物信息学比对。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2.1 [/font][font=宋体]电泳分析:琼脂糖凝胶电泳是最常用的方法。通过观察电泳图谱,可以判断[/font][font=Calibri]DNA[/font][font=宋体]是否完整,是否存在降解现象。[/font][/font][font=宋体][font=Calibri]2.2 [/font][font=宋体]酶切鉴定:使用限制性内切酶对质粒[/font][font=Calibri]DNA[/font][font=宋体]进行酶切,再通过电泳分离酶切产物。如果酶切产物的大小与预期一致,说明质粒[/font][font=Calibri]DNA[/font][font=宋体]的结构是正确的。[/font][/font][font=宋体][font=Calibri]2.3 [/font][font=宋体]生物信息学比对:利用基因组学和序列分析工具,对质粒[/font][font=Calibri]DNA[/font][font=宋体]的序列进行比对,检测是否存在突变、插入或缺失等变异。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]3. [/font][font=宋体]质粒[/font][font=Calibri]DNA[/font][font=宋体]纯度的评估[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]评估质粒[/font][font=Calibri]DNA[/font][font=宋体]纯度的方法主要包括紫外分光光度计测定、高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法和生物信息学分析。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3.1 [/font][font=宋体]紫外分光光度计测定:在[/font][font=Calibri]260[/font][font=宋体]纳米处测定吸光度值,可以计算出[/font][font=Calibri]DNA[/font][font=宋体]的浓度。同时观察[/font][font=Calibri]A260/A280[/font][font=宋体]比值,纯度良好的质粒[/font][font=Calibri]DNA[/font][font=宋体]在该波长下的吸光度值应该较高,且[/font][font=Calibri]A260/A280[/font][font=宋体]比值应接近[/font][font=Calibri]1.8[/font][font=宋体]。[/font][/font][font=宋体][font=Calibri]3.2 [/font][font=宋体]高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法([/font][font=Calibri]HPLC[/font][font=宋体]):可以分离和测定质粒[/font][font=Calibri]DNA[/font][font=宋体]的组成和浓度,具有较高的灵敏度和特异性,能够检测到低浓度的杂质。[/font][/font][font=宋体][font=Calibri]3.3 [/font][font=宋体]生物信息学分析:利用软件工具对质粒[/font][font=Calibri]DNA[/font][font=宋体]的序列进行分析,预测可能的杂质成分,如蛋白质、[/font][font=Calibri]RNA[/font][font=宋体]等。[/font][/font][font=宋体] [/font][b][font=宋体][font=Calibri]4. [/font][font=宋体]结论[/font][/font][/b][font=宋体] [/font][font=宋体][font=宋体]确定质粒[/font][font=Calibri]DNA[/font][font=宋体]质量[/font][font=Calibri]/[/font][font=宋体]纯度的最佳方法需要综合运用多种手段。实验室检测方法如电泳分析、紫外分光光度计测定和高效[url=https://insevent.instrument.com.cn/t/5p][color=#3333ff]液相色谱[/color][/url]法提供了快速、直观的结果。而生物信息学分析则从序列和组分的角度提供了深入的洞察,使研究人员能够更全面地了解质粒的属性和潜在问题。结合这两类方法,研究人员可以获得关于质粒[/font][font=Calibri]DNA[/font][font=宋体]质量[/font][font=Calibri]/[/font][font=宋体]纯度的准确、可靠的信息,从而确保实验结果的准确性。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供快速、高通量、高品质以及个性化的[url=https://cn.sinobiological.com/services/plasmid-dna-preparation-service][b]质粒[/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/services/plasmid-dna-preparation-service][b]DNA[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/plasmid-dna-preparation-service][b]制备服务[/b][/url]。不仅满足实验室研究人员的小量质粒[/font][font=Calibri]DNA[/font][font=宋体]制备需求,也可为生物工业用户和医药公司等提供大规模的质粒[/font][font=Calibri]DNA[/font][font=宋体]制备服务。义翘神州升级改造后的质粒[/font][font=Calibri]DNA[/font][font=宋体]制备平台,采用[/font][font=Calibri]GMP[/font][font=宋体]级别的生产线,对过程和最终产品的严格管控,确保了最终产品质量符合客户需求。义翘神州可以提供从μ[/font][font=Calibri]g[/font][font=宋体]级别,[/font][font=Calibri]mg[/font][font=宋体]级别至[/font][font=Calibri]g[/font][font=宋体]级别不同规模的科研级和工业级别的质粒生产服务,满足不同的需求。详情关注:[/font][font=Calibri]https://cn.sinobiological.com/services/plasmid-dna-preparation-service[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
名称:质粒房工作守则关键词:质粒目的:操作规范化,减少污染!主体内容:一、 常规操作1、 进入质粒房须换专用工作服,自己的白大衣或厚外套可脱在门外的衣帽架上;2、 工作时尽量避免交谈,无实验时少在其中逗留;3、 请勿随意调节培养箱和摇床的温度,以免对他人实验造成影响。如实验确实需要调动温度,应公告他人;4、 超净工作台勿用酒精擦洗,使用前可用紫外灭菌10分钟,使用后清理干净;5、 枪头、废液请分开放置,实验完成后枪头倒于垃圾桶,废液倒于洗手间的卫生专用池,并将垃圾杯冲洗干净;6、 做完实验后,试剂用品等放回原处,台面及时清理干净;7、 用过的培养瓶、培养皿和无用的菌液等请及时清理;8、 感受态细胞和培养液等常用试剂快用完时请及时通知值日生。二、 值日生工作职责1、 每周值日生时间从周六开始,至下周五结束;2、 在周六周日或之前准备好灭菌的枪头、离心管(包括0.5、1.5、10和50ml)、培养皿和培养基(一般固体200ml、液体300ml)等常用物品;3、 及时制作酒精棉球,给酒精灯添加酒精,及时清理垃圾;4、 及时做好公用试剂的配制工作,如50%甘油、70%乙醇、Solution I、II、III、10N NaOH和10%SDS等;5、 每周督促他人清理冰箱中各自废弃物品,每周全面清理打扫质粒房一次,紫外灭菌一次(30分钟)。三、 常用试剂的配制1、 Solution I:50mM Glucose,25mM Tris-HCL(pH 8.0),10mM EDTA(pH 8.0),灭菌后存于4℃;2、 Solution II:0.2N NaOH,1% SDS(现配现用);3、 Solution III:5M 乙酸钾 60ml,冰乙酸11.5ml,加水到100ml即可;4、 LB:25g LB粉加水1000ml,固体LB加入1.5-1.7g琼脂粉/100ml即可,分装灭菌,4℃保存;5、 Ampi:配成100mg/ml的母液,存于-20℃,使用浓度为100ug/ul;Kana:配成100mg/ml的母液,存于-20℃,使用浓度为50ug/ul。
一、实验目的与原理质粒多为一些双链、环状的DNA分子,是独立于细菌染色体之外进行复制和遗传的辅助性遗传单位。质粒是进行分子生物学实验操作,进行遗传工程改良物种等工作时最主要的DNA载体。提取质粒的基本步骤分为三步:①细菌的培养和质粒的扩增②细菌菌体的裂解③质粒DNA的纯化本实验采取的菌体裂解方法为碱解法,质粒纯化方法为梯度离心法。二、材料与试剂1、材料:大肠杆菌2、仪器:超净工作台,培养箱,摇床,恒温水浴锅,台式离心机,取液器一套,低温冰箱,冷冻真空干燥机,电泳仪,水平电泳槽,紫外观测仪3、试剂:Solution I 25 mM Tris-Hcl(pH7.4) 10 mM EDTA(pH8.0) 50 mM葡萄糖 高压灭菌,4℃保存 Solution II 0.2 M NaOH, 1%SDS 现配现用 Solution III 5 N KAc pH4.8 高压灭菌,4℃保存 3 M NaAc PH5.2, 高压灭菌,4℃保存。异丙醇,溶菌酶(8 mg/ml),酚/氯仿,无水乙醇,70%乙醇,LB培养基,电泳试剂三、操作步骤1、细菌繁殖LB培养基,2 ml/20ml,37℃,200rpm,摇一摇,过夜2、离心10 min,5000 rpm, 4℃;弃上淸液3、沉淀(菌体细胞)预冷的TES缓冲液洗涤,离心10 min,5000 rpm, 4℃加入预冷的1 ml Solution I,冰浴,10 min4、重新悬浮,加入150 ul溶菌酶母液,室温放置5 min5、加入1.2 ml Solution II, 冰浴,5 min6、加入0.9 ml预冷乙酸钾,混匀,离心10 min,12000 rpm, 4℃7、加入1.5 ml异丙醇,-20℃冰箱内放置15 min8、离心10 min,12000 rpm, 4℃9、取沉淀,悬于400 ul TE缓冲液中10、加入40 ul,3 M NaAc11、酚/氯仿,抽提,乙醇沉淀12、离心10 min,12000 rpm, 4℃13、取沉淀,冷冻干燥,再悬浮于50 ul TE缓冲液中。14、电泳检测提取DNA的质量四、结果与分析超螺旋结构DNA
[em0804] 我用的是岛津QP2010Plus,做标准曲线的时候参数选择二阶线性和选择一阶线性对样品的定量结果有什么影响?做曲线的时候该怎么选择曲线性质呢?
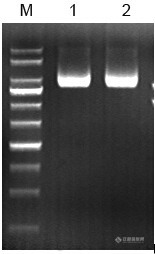
利用硅胶膜法提取纯化质粒DNA摘要:系统的阐述了质粒核酸提取过程中针对裂解和核酸纯化两大关键步骤的研究,重点介绍了利用硅胶膜法提取纯化核酸,以及在实验过程中的一些经验。关键词:硅胶膜法;纯化;质粒DNA一、前言随着分子生物学技术的发展,核酸的分子生物学技术成为了药物研发、遗传病和感染性疾病的诊断、基因研究及物种鉴定等的常用研究手段之一。然而,核酸提取质量是进行下游一系列研究的关键,因此提取的方法会直接影响后续实验。细菌质粒是一类双链闭合环状的DNA,大小范围从1kb至200kb以上不等。各种质粒都是存在于细胞质中、独立于细胞染色体之外的自主复制的遗传成份。质粒已成为目前最常用的基因克隆的载体分子,重要的条件是可获得大量纯化的质粒DNA分子。硅胶膜法是一种应用最为广泛的提取纯化质粒DNA的方法,因硅基质材料可特异吸附核酸DNA,使用方便、快捷,不需要使用有毒溶剂如酚、氯仿等,使得提取质粒核酸像过滤一样简单。二、实验部分2.1 原理硅基质材料吸附核酸的原理主要利用DNA在高盐低pH值环境下与硅基质材料相结合,在低盐高pH值环境下与硅基质材料脱离的特征。其机理是带负电荷的DNA和带正电的二氧化硅粒子之间有很强的亲和力。在高浓度盐离子的作用下,盐离子打破水中的氢和二氧化硅上带负电荷的氧离子间的氢键,DNA与硅基质紧密结合,洗涤除去其他杂质;再用低离子强度的TE缓冲液或蒸馏水洗脱结合的DNA分子,机理是当盐被清除后,再水化的硅基质破坏了基质和DNA之间的吸引力,因而DNA从硅基质上被洗脱下来。2.2 主要试剂溶液Ⅰ:50mM葡萄糖,25mM Tris-HCl(pH 8.0),10mM EDTA(pH 8.0)。溶液Ⅱ:0.2NNaOH,1% SDS。溶液Ⅲ:醋酸钾(KAc)缓冲液,pH 4.8。漂洗液:60mM 乙酸钾、10mM Tris-HCl (pH 7.5) 、60% 乙醇TE:10mMTris-HCl(pH 8.0),1mM EDTA(pH 8.0)。2.3 主要步骤该步骤采用CommaPrePTM的质粒小提纯化柱。http://ng1.17img.cn/bbsfiles/images/2015/07/201507171513_556042_3310_3.jpgCommaPrep™核酸小提柱可用在核酸提取过程中过柱结合、洗涤、洗脱步骤中http://ng1.17img.cn/bbsfiles/images/2015/07/201507171516_556043_3310_3.jpg1. 取1.5ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12,000 rpm 离心1 min, 尽量吸除上清。 (注意:应根据所培养菌体的浓度与质粒的拷贝数,确定收集的菌液量。菌量过大可能导致溶菌不充分,纯化时会影响质粒纯度菌液较多时可以通过多次离心将菌体沉淀收集到一个离心管中)。2. 将细菌沉淀重悬于100uL溶液Ⅰ中,移液器或涡旋振荡器彻底悬浮细菌沉淀,使菌体分 散混匀。 (注意:如果有未彻底混匀的菌块,会影响裂解,导致提取量和纯度偏低。并且溶液Ⅰ中 要加入适量的RNA酶)3. 向离心管中加入200uL溶液Ⅱ,温和地上下翻转数次,并将离心管放置于冰上2-3min,使细胞膜裂解。(注意:温和地混合,不要剧烈震荡,以免污染基因组DNA。此时菌液应变得清亮,如果未变得清亮,可能由于菌体过多,裂解不彻底,应减少菌体量。)4. 加入150uL溶液Ⅲ,立即将管温和颠倒数次混匀,见白色絮状沉淀。12000rpm, 离心2分钟。 (注意:加入溶液Ⅲ后,要立即将管温和颠倒,避免产生局部沉淀。如果上清液中存在沉淀,可再一次离心。溶液Ⅲ为中和溶液,此时质粒DNA复性,染色体和蛋白质不可逆变性,形成不可溶复合物。)5. 吸取上清至吸附柱(内管)中(吸附柱在离心管中),尽量不要吸出沉淀,12000rpm,离心30秒。弃去废液,将吸附柱重新放入一个新的离心管中。6. 加入750uL的漂洗液(漂洗液要在实验前加入无水乙醇)12000rpm离心,1min。取出 DNA结合柱,弃废液,重新插入DNA结合柱到离心管中。7. 用500uL漂洗液重复冲洗过程。12000rpm离心,1min。(注意:重复一次可以增加质粒的回收效率。)8. 转移DNA结合柱到1个新的1.5mL离心管中,加入60uL的无核酸酶的水到DNA结合柱中,洗脱质粒DNA,室温条件下,12000rpm离心,1min。 (注意:不要转入DNA结合柱中的漂洗液,如果混有,就需要12000rpm离心,1min。洗脱缓冲液体积不少于50uL,体积小会影响回收效率。 洗脱液的pH值对于洗脱效率有很大的影响,若用水洗脱应保证pH值在7.0-8.5范围内, pH小于7会降低洗脱效率。如果长期保存DNA,洗脱液建议使用TE。)9. 加入100uL的无核酸酶水到结合柱中,洗脱质粒DNA,离心12000rpm,1min。(注意:重复一次,增加洗脱效率。)10.洗脱DNA后,从1.5mL离心管中取出DNA结合柱并废弃。11.取2uLDNA进行电泳,检测DNA质量。12.将纯化的DNA溶液于-20℃中。三、实验结果图为质粒DNA(10kb)的凝胶电泳图,说明提取效果较好。http://ng1.17img.cn/bbsfiles/images/2015/07/201507171525_556044_3310_3.jpg
同样是高锰酸钾溶液,有的颜色深,有的颜色浅,甚至无色。那么我们是否能说同种物质的微粒的物理性质不同?
小量快速抽提革兰氏阴性菌的质粒优点:便宜、简单、无需过柱、得率高。特别适用于检验阳性克隆。缺点:质粒纯度不高,长时间室温或4℃保存用该方法抽提的质粒,可能会发生质粒降解。建议-20℃冻存,如果需要,应该尽快过柱或酚氯仿抽提精制纯化质粒,然后才能长期保存。 试剂配方Buffer P1: 6.06 g Tris,3.72 g EDTA,去离子水(<1L)溶解后,用HCl调pH为8.0,然后用去离子水定容到1L。最后添加RNaseA 100 mg,保存4℃。即:50 mM Tris, pH 8.0 ;10 mM EDTA;100 μg/ml RNaseA Buffer P2:8.0 g NaOH溶解于950ml 去离子水,然后加入50 ml 20%SDS溶液。室温保存。注意:NaOH和SDS固体一起加水溶液可能会相互干扰,导致不溶,所以要分开溶解后再混合!即:200 mM NaOH;1% SDS Buffer P3:294.5 g乙酸钾溶解于500 ml 去离子水,用冰乙酸调调pH为5.5(约需要110 ml的冰乙酸),然后用去离子水定容到1L。保存4℃。注意:如果没有乙酸钾,可以用乙酸钠,终浓度保持为3.0 M即可。即:3.0 M 乙酸钾,pH 5.5 ;
我做的是纳米晶镍,请问谁那有XRD计算物质粒子大小的程序,请发到我的邮箱:simon1755@sina.com 谢谢!!!
从质粒抽提谈起复旦大学生化与分子生物学实验室 碱裂解法从大肠杆菌制备质粒,是从事分子生物学研究的实验室每天都要用的常 规技术。可以我收研究生十几年了,几乎毫无例外的是我那些给人感觉什么都知道的 优秀学生却对碱法质粒抽提的原理知之甚少。追其原因,我想大概是因为《分子克隆 》里面只讲实验操作步骤,而没有对原理进行详细的论述。这是导致我的学生误入歧途的主要原因。后来我发现其实是整个中国的相关领域的研究生水平都差不多,甚至有很多“老师”也是这个状态。这就不得不让人感到悲哀了。我想这恐怕和我们的文化有点关系。中国人崇尚读书,“学而优则仕”的观念深入人心。经常听到的是父母对他们的独苗说,你只要专心读好书就可以了。所以这读书的定义就是将教课书上的东西记住,考试的时候能拿高分……这就是现代科学没有在中国萌发的根本原因。如果中国文化在这一点上不发生变化,那么科学是不能在中国真正扎根的,它只能蜕化成新的“八股学”。生命科学是实验科学,它讲究动手。如果实验科学只要看看书就可以了,那我想问有那位神仙看看书就会骑自行车了?或者听听体育老师的讲解就会滑冰了?可是光动手不思考,不就成了一个工匠?一个合格的生命科学研究者,需要在这两方面完善自己。一个杰出的科学工作者,是一个熟知科学原理并善于应用的“艺术家”。每个曾经用碱法抽提过质粒的同学,希望你看本文后能有所思考,让中国的未来有希望。 为了方便理解,这里罗列一下碱法质粒抽提用到三种溶液:溶液I,50 mM葡萄糖/ 25 mM Tris-Cl / 10 mM EDTA,pH 8.0;溶液II,0.2 N NaOH / 1% SDS;溶液III,3 M 醋酸钾 / 2 M 醋酸。让我们先来看看溶液I的作用。任何生物化学反应,首先要控制好溶液的pH,因此用适当浓度的和适当pH值的Tris-Cl溶液,是再自然不过的了。那么50 mM葡萄糖是
【序号】:【作者】: 高群玉 周俊侠 张力田 【题名】:豌豆淀粉颗粒性质的研究【期刊】: 粮食与饲料工业 1998年06期【年、卷、期、起止页码】: 1998年 第6期 41-42页 共3页【全文链接】:http://lib.cnki.net/cjfd/LSYS806.018.htmlhttp://www.cqvip.com/QK/92934X/1998006/3071502.html
大家好,到哪里可以查到各种药物的理化性质?比如网站什么的
书名《水玻璃 制造、性质及应用》作者:(苏)格里戈利耶夫,П.Н.,(苏)马特维耶夫,М.А.著;黄虹译 页数:445 出版社:中国工业出版社 出版日期:1965
我做的是CN薄膜,想测一下它的光学性质,请教各位应用什么仪器,在哪里测?谢拉!!
从事化工相关行业,都需要了解试剂的性质,各位版友都是从哪里查到的相关数据?对查到数据的准确性是否怀疑过?

[img]http://ng1.17img.cn/bbsfiles/images/2008/06/200806191615_94067_1622715_3.jpg[/img]据美国宇航局太空网报道,神秘的暗物质遍布整个宇宙,但其特性却是数十年来一直困扰天体物理学家的谜题。如今,一组科研人员开始对太阳内部展开研究,以探讨其最可能的成因之一,从而创造了首次有 望破解这一谜团的机会。 [B]十个小组全力寻找 [/B] 人类一直认为,这种被称为暗物质的不可见东西,占据了宇宙中90%的空间。到目前为止,天体物理学家只是通过重力对恒星和星系的影响,推断出某些神秘物质的存在(例如,暗物质使星系的旋转比原本预期的要快)。 在人类假设中,暗物质的基本组成成份主要可能由两种粒子组成:即所谓的axions和WIMPs(即微弱反应大粒子)。目前有十个小组正在致力于找寻这种重量较大的WIMPs,其中GLAST小组就专门探寻假设WIMPs及其反物质自我相互消亡过程中会产生的伽玛射线。另有少数几个小组则致力于探寻重量较轻的粒子----axions。 在佛罗里达大学物理学家大卫.坦纳和其他科学家看来,无论从社会学角度还是从技术原因,WIPM小组的数量都远远多于axion小组。比如,WIMPs小组会吸引更多的天体物理学家的专业意见,另外,这一重量较大的大粒子也更让人浮想联翩。坦纳教授对SPACE.com表示,“WIMPs还意味着超对称性和超大尺寸,因此一旦被探测到,会给理论学者们提供大量的可研究空间,有很大的发展潜力。” 来自伯克利大学的X射线天文学家休.哈德森则率领一个小组进行axion研究,他表示,他们发现了一项极有前途的探寻axion的新方法:探查太阳内部。最近在圣路易斯召开的全美天文学年会上,哈德森发布了自己的研究成果。 [B] 太阳可能是暗物质粒子制造工厂[/B] 无论在电荷之下或是旋转之中,axion的重量都极轻,因此极难与宇宙中周围的物质相结合--即使在这种粒子存在的情况下。太阳被认为可能是制造这些暗物质粒子axions的工厂,具体的想法是:当太阳核心的光量子受到磁场吸引时,他们就会变成axions。由于微粒子只是偶而会与普通物质发生相合作用,因而很容易就会飞越太阳的核心部分,一路畅通地到达由其它粒子组成的太阳表层。一旦到了太阳光环之上,这里的太阳磁场是非常之强的,axions会再度变回成光量子。 哈德森小组希望,通过能够观测到太阳X射线的三大卫星--Yohkoh、RHESSI和Hinode的现有设备能找到这些光量子。哈德森表示,到目前为止的X射线影像已经显示出发现了axion信号。他整个小组成员希望,通过综合大量的映像信息产生更强的潜在的复合信号,进一步增强其探索的灵敏度。这一复合映像可以帮助天体物理学家们去除所谓的背景噪音,它可能是由任何其它物质生成的,而决不是axions。
Nucl. Acids Res.:结构和生化方法研究质粒分配蛋白ParB和着丝粒DNA的相互作用近期北京生命科学研究所所叶克穷实验室在Nucleic Acids Research杂志在线发表论文,通过结构和生化的方法研究了质粒分配蛋白ParB和着丝粒DNA的相互作用。该研究由科技部、北京市政府和国家自然科学基金资助,在北京生命科学研究所完成。本文的第一作者为北京生命科学研究所和武汉大学联合培养的博士研究生黄林,研究员叶克穷博士是本文的通讯作者。此研究还得到研究生朱星,武汉大学的殷平和张翼教授的帮助。所有的细胞需要将遗传物质DNA的稳定分配到子代细胞,这个分配过程在真核生物中非常复杂。对于细菌的一些低拷贝质粒,由着丝粒DNA、马达蛋白ParA以及着丝粒结合蛋白ParB三个成分构成的简单系统就能完成质粒在子代细菌中的分配。ParB和着丝粒DNA结合形成分配复合物,分配复合物进一步和ParA结合。ParA能形成纤维结构,并通过纤维的生长把结合在纤维两端的质粒推向分裂细胞的两级。这个系统提供了一个简单并且易于操作的模型来研究遗传物质的分配。革兰氏阳性菌Leifsonia xyli subsp. Cynodontis的质粒pCXC100包含一个Ib型质粒分配系统。然而一直以来研究人员对于ParB包含的DNA结合结构域尚不清楚,叶克穷实验室通过结构和生化的方法研究了ParB的三维空间结构以及ParB和着丝粒DNA之间的作用方式。研究人员解析了ParB DNA结合结构域的晶体结构,发现它折叠成RHH二聚体结构域,这个结果进一步说明RHH结构域在结合着丝粒过程中的普遍性。研究人员还利用高分辨DNA印迹实验和定量DNA结合实验分析了ParB和着丝粒DNA的相互作用,发现着丝粒区域由九个无间隔的9碱基对正向重复序列组成,ParB和连续重复序列的结合时具有高度的协同性。有意思的是,单独一个ParB二聚体分子和DNA结合时,至少需要一个重复序列以及两边相邻序列共18个碱基对DNA。研究人员分析了ParB识别这18个碱基对中每个序列的特异性。研究结果说明pCXC100 在形成分配复合物时,每个着丝粒重复序列能被相邻的ParB分子同时识别的独特方式
各位朋友,在哪里可以找到比较集中的有关有机磷、有机氯类等常见物质的理化性质资料呢谢谢了
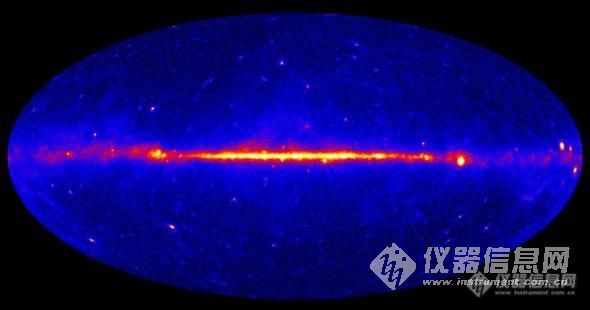
http://ng1.17img.cn/bbsfiles/images/2010/12/201012151306_267198_2193245_3.jpg银河核心深处神秘物质相撞在一起产生的伽马射线 据国外媒体报道,宇宙学家表示,他们已经在银河核心深处发现与暗物质粒子有关的最令人信服的证据。该地的这种神秘物质相撞在一起产生伽马射线的次数,比天空中的其他临近区域更频繁。 最近几年,科学杂志上不断出现类似研究,不过要证实信息来源一直非常困难。然而费米实验室和芝加哥大学的宇宙学家、最新研究的第一论文作者丹·霍普表示,10月13日出现在arXiv.org网站上的这项最新研究与此不同。他说:“除了暗物质以外,我们考虑每一个天文学来源,然而我们了解的知识无法解释这些观测资料。也没有与之密切相关的解释。”这一断言还没得到其他科学家的严格审查,不过看过这篇论文的人表示,他们还需要对该成果进行更多讨论。 费米实验室的天体物理学家克雷格·霍甘并没参与这项研究,他说:“这是我所知道的第一项通过一个简单粒子模型,把少量与暗物质的证据有关的线索拼接在一起的研究。虽然它还没有充足证据,但它令人兴奋,值得我们去追根究底。”暗物质从137亿年前开始在庞大的能量膨胀——宇宙大爆炸过程中形成。能量冷却后形成普通物质、暗物质和暗能量,目前它们在宇宙中的比例分别是4%、23%和73%。 跟普通物质一样,暗物质具有引力,几十亿颗恒星正是在它们的帮助下聚集到星系里。但是这种物质很难与普通物质发生互动,人们看不到它。微中子是唯一一种曾在实验室里发现的暗物质粒子,但是它们几乎是零质量,而且在暗物质的宇宙能量部分里仅占很小比例。天体物理学家认为,剩下的很大一部分是由弱相互作用大质量粒子(WIMP)构成,这种粒子的能量大约比质子多10到1000倍。如果两个暗物质粒子撞在一起,它们就会彼此摧毁对方,产生伽马射线。 霍普和他的科研组通过对费米伽马射线太空望远镜在两年多时间里传回地球的数据进行分析,发现这种高能死亡信号。费米太空望远镜是美国宇航局的伽马射线望远镜,主要用来扫描银河的高能活跃区。他们发现,发出信号的相撞在一起的暗物质粒子,比质子大约重8到9倍。霍普说:“它比我们大部分人猜测的结果可能更轻一些。迄今为止我们很擅长这方面。不过人们猜测的暗物质粒子的重量范围不会一成不变。” 该科研组在银河核心处一个直径100光年的区域收集到的数据里发现这些信号。霍普解释说,他们之所以会关注这个区域,是因为它是暗物质最喜欢的聚集地,银河这个区域的暗物质密度,是银河边缘的10万倍。简而言之,银河核心就是一个暗物质大量聚集在一起,经常相撞的地方。 然而,其他科学家希望看到卡尔·萨根的名言“不同凡响的发现需要不同凡响的证据”能变成现实。也就是说,他们希望看到从自然界和实验室两方面获得的证据。芝加哥大学的宇宙学家迈克尔·特纳没参与这项研究,他说:“没人提供像萨根提到的那种证据。接受这一观点最困难的部分是,你必须拒绝接受天体物理学解释。大自然非常非常聪明,这可能是我们至今从没思考过的事情。” 特纳表示,好消息是几项有希望的暗物质探测试验目前正在进行。相干锗中微子技术(CoGeNT)等深埋地下的探测器可助霍普一臂之力。该探测器近几年可能已经发现弱相互作用大质量粒子的迹象。特纳说:“这十年是暗物质的十年。这个问题即将解决。现在所有这些探测器都在观测正确方位。”霍普同意两人的观点,不过他表示,与他交谈过的天体物理学家,没人能解释清楚这一现象。他认为,在他的发现得到支持或痛批前,也许只要数周时间就能在实验室里验证暗物质是否存在。他说:“我从没像现在一样为自己是一名宇宙学家而感到激动不已。”
有谁对医院里的污水性质比较了解!为什么会汞含量很高?