104家检测机构监督检查情况通报
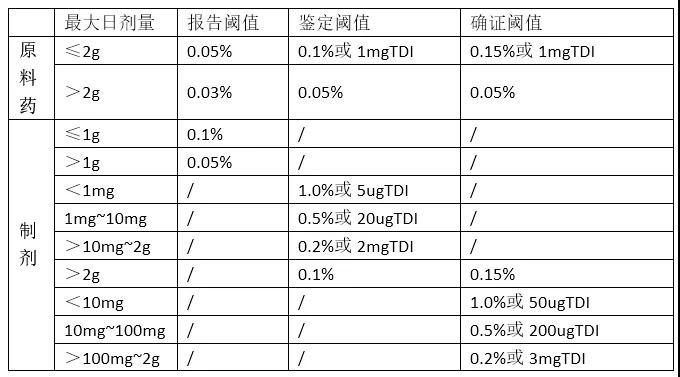
贵州省市场监管局省生态环境厅 贵州省住房城乡建设厅 贵州省药品监管局关于2022年检验检测机构监督检查情况的通报各市(州)市场监管局、生态环境局、住房城乡建设局,各相关检验检测机构:为加强检验检测机构监管,严肃查处不实和虚假检验检测等违法违规行为,净化检验检测市场环境,按照《省市场监管局省生态环境厅省住房城乡建设厅省药品监管局关于开展2022年检验检测市场专项整治行动的通知》(黔市监办发〔2022〕41号)的工作部署,省市场监管局、省生态环境厅、省住房城乡建设厅、省药品监管局以“双随机、一公开”监管的方式,在全省联合组织开展了2022年检验检测机构监督抽查工作。现将检查情况通报如下:一、基本情况本次联合监督抽查将医疗器械防护用品、碳排放核查、食品、个体防护装备、建工建材、生态环境、刑事司法检验检测作为重点,以打击不实和虚假检验检测报告违法行为为主要目标,共计抽取了104家资质认定检验检测机构。其中碳排放核查、医疗器械防护用品和个体防护装备等检验检测领域机构12家,生态环境监测机构25家,食品检验机构15家,建工建材检验检测机构32家,刑事司法及其他省级发证机构20家。其中,有4家机构在现场检查前已主动申请注销资质认定证书(食品检验1家、建工建材机构3家),实际现场检查100家。本次检查,共随机选派执法人员75名,匹配技术专家60名,组成35个检查组,以打击出具不实检验检测报告、虚假检验检测报告等严重违法违规行为为重点,采取不预先通知的方式开展了现场检查。在本次双随机抽查的100家机构中,有15家机构存在一般性的管理和技术问题 3家机构存在不符合《检验检测机构监督管理办法》规定、但无需追究行政和刑事法律责任的情形 45家机构存在未按规定办理变更、分包不规范等违规行为 34家机构涉嫌存在出具不实检验检测报告、出具虚假检验检测报告、超范围出报告等严重违法违规行为 3家机构质量管理措施未实施、不再符合资质认定条件和要求。二、检查中发现的主要问题(一)场所环境条件不满足标准要求。一是个别机构场所环境条件不能持续保持满足检验检测相关技术标准要求 二是个别实验室环境布置不合理,存在互相干扰的风险。(二)仪器设备管理不规范。一是个别机构仪器设备未按规定及时进行检定/校准 二是检测仪器设备档案信息不完整,缺少检测仪器设备使用记录 三是仪器设备使用状态标识管理混乱。四是检验仪器设备未按标准安装,使用环境不符合要求。(三)样品管理不够规范。一是个别检验检测机构样品的留样和处置不符合相关标准、规范 二是个别检验检测机构样品标识、流转等信息不够完整 三是个别检验检测机构样品流转记录与原始记录、试验报告及设备使用记录的时间不吻合。(四)检验检测报告和原始记录不够规范。一是部分检验检测机构未严格依据相关标准或者技术规范规定的程序和要求,出具检验检测数据、结果 二是部分检验检测报告和原始记录信息不够完整,无法溯源 三是部分检验检测机构未按规定对原始记录和报告进行有效管理、保存。(五)人员素质和责任意识有待提高。一是个别机构疏于管理或管理不规范,检验检测报告存在漏签、非授权签字人签发报告等行为 二是个别机构法定代表人、技术负责人、授权签字人发生变化,检验检测标准、方法发生变化未按规定进行变更。(六)涉嫌出具不实、虚假报告。一是个别机构未按照检验检测规程向社会出具具有证明作用的报告,结果存在错误且无法复核 二是个别机构在不具备相关检测设备的情况下向社会出具具有证明作用且涉及该设备所检参数的报告 三是个别机构伪造授权签字人签发报告 四是个别检验检测机构出具的检验检测数据、结果的纸质原始记录与电子存储记录不一致。(七)超资质认定范围出具报告。个别机构超出资质认定证书规定的检验检测能力范围,擅自向社会出具具有证明作用的检验检测报告。(八)基本条件和技术能力不符合资质认定条件。个别机构基本条件和技术能力不能持续符合资质认定条件和要求,擅自向社会出具具有证明作用的数据、结果。三、检查结果处理依据《检验检测机构监督管理办法》《检验检测机构资质认定管理办法》,对相关检验检测机构的处理结果如下:(一)立案调查。对涉嫌出具不实、虚假检验检测报告,超范围出报告的34家机构,已依据《市场监督管理行政处罚程序规定》,移交属地市场监管部门进行立案调查。经核查,如果案件属于其他行业主管部门管辖的,依法依规移交有关行业主管部门处理。对存在虚假检验检测行为等违法失信机构,严格依据《市场监督管理严重违法失信名单管理办法》纳入严重违法失信名单管理。(二)责令限期改正。对存在未按规定办理变更、分包不规范等违规行为的45家机构,属地市场监管部门责令机构限期改正,逾期未改正或改正后仍不符合要求的,按规定处以罚款。(三)不得向社会出具具有证明作用的检验检测数据和结果。对质量管理措施未实施、不再符合资质认定条件和要求的3家机构,由市(州)市场监管局督促机构在重新符合资质认定条件和要求前,不得向社会出具具有证明作用的检验检测数据和结果。(四)说服教育、提醒纠正。对存在不符合《检验检测机构监督管理办法》规定、但无需追究行政和刑事法律责任情形的3家机构,属地市场监管部门采用说服教育、提醒纠正等非强制性手段予以处理。(五)自行整改。对存在一般性的管理和技术问题的15家机构,由市(州)市场监管局通知机构自行完成整改。四、工作要求(一)狠抓整改落实。各检验检测机构要强化主体责任,规范检验检测行为,切实提高法律意识和责任意识,深入分析原因,制订可行的整改计划,迅速整改到位。要加强对管理体系、检验检测政策的跟踪学习和理解,树立质量意识和风险意识,确保检验质量。(二)严格依法立案查处。对于本次监督检查发现的问题线索,各地严格按照《行政处罚法》《市场监督管理行政处罚程序规定》等法律法规程序规定,调查核实问题线索,对符合立案条件的依法立案调查处理。(三)严厉打击违法违规行为。对存在出具不实检验检测报告、虚假检验检测报告、超出资质认定范围出具报告等严重违法违规问题的检验检测机构,要严格按照《检验检测机构资质认定管理办法》《检验检测机构监督管理办法》等法律法规进行严肃处理。(四)及时报送结果。请各市(州)市场监管局按照“双随机、一公开”监管要求,依法做好信息公开,及时将查处案件录入国家企业信用信息公示系统,并将处理结果于2022年12月10日前报送省市场监管局,同时抄送同级相关行业主管部门。联系人:吴春宣 电话:0851-86509801。附件:1.2022年碳排放核查、医疗防护等重点领域机构双随机检查结果汇总表2.2022年生态环境监测机构监督检查结果汇总表3.2022年食品检验机构双随机检查结果汇总表4.2022年建工建材机构双随机检查结果汇总表5.2022年刑事司法及其他省级发证机构双随机检查结果汇总表省市场监管局 省生态环境厅省住房城乡建设厅 省药品监管局2022年10月1日附件:2022年碳排放核查、医疗防护等重点领域机构双随机检查结果汇总表序号检查对象名称被检查领域发现主要问题涉嫌违反的法规条款处理建议属地1贵州省煤田地质局实验室碳排放核查管理不规范。《检验检测机构资质认定管理办法》第18条第1款。自行改正,通过贵阳2贵州省煤炭产品质量监督检验院碳排放核查原始记录不规范。自行改正,通过六盘水3贵州省疾病预防控制中心防护用品标签标识与程序文件描述不一致自行改正,通过贵阳4贵州省医疗器械检测中心医疗器械个别仪器设备标识不规范。自行改正,通过贵阳5贵州兴昌瑞实业发展有限公司职业卫生管理欠规范。自行改正,通过六盘水6贵州省地质矿产勘查开发局一0六地质大队(遵义市矿产品检测中心)碳排放核查未按规定办理变更。《检验检测机构资质认定管理办法》第14条。责令限期改正遵义7贵州大西南检验检测集团有限公司个体防护装备未按规定办理变更。《检验检测机构资质认定管理办法》第14条。责令限期改正贵阳8中国建材检验认证集团贵州有限公司个体防护装备未按规定办理变更。《检验检测机构资质认定管理办法》第14条。责令限期改正贵阳9贵州省地质矿产勘查开发局(贵州地矿西部检测中心)碳排放核查1.样品保存不符合标准规定,存在样品性状异常改变的情形。2.使用未经检定或校准的仪器。《检验检测机构监督管理办法》第13条第2款第1项。市(州)市场监管局立案调查六盘水10贵州电网有限责任公司(电力工业贵州发电用煤质量监督检验中心)碳排放核查样品流转、保存不符合标准规定。《检验检测机构监督管理办法》第13条第2款第1项。市(州)市场监管局立案调查贵阳11毕节市宏益煤矿检测技术服务有限责任公司碳排放核查样品流转、保存不符合标准规定,存在样品污染、丢失的情形。《检验检测机构监督管理办法》第13条第2款第1项。市(州)市场监管局立案调查毕节12贵州道兴建设工程检测有限责任公司个体防护装备减少、遗漏应当检验检测的项目。《检验检测机构监督管理办法》第14条第2款第3项。市(州)市场监管局立案调查贵阳2022年环境监测机构双随机检查结果汇总表序号检查对象名称发现主要问题涉嫌违反的法规条款处理建议属地1贵阳环境监测中心管理欠规范。自行改正,通过贵阳2贵州省辐射环境监理站管理欠规范。自行改正,通过贵阳3贵州净美环保科技有限公司个别项目不具备检测能力,但未出具该项目的报告。《检验检测机构监督管理办法》第24条。说服教育、提醒纠正铜仁4