请问2005版药典中纯化水的微生物限度检查中的薄膜过滤法使用的仪器在哪里可以买到以及价钱是多少?谢谢!!!!
EP中微生物限度检查:控制菌大肠埃希菌接种在麦康凯肉汤中培养于42-44℃下培养,为什么选这个温度?有什么讲究?不选一般细菌最适温度。
微生物限度检查及控制_王旭[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=173895]微生物限度检查及控制_王旭.rar[/url]
微生物限度检查方法验证模板
2010年版药典附录无菌检查和微生物限度检查方法增修定内容
无菌检查法和微生物限度检查是一回事吗
对于纯化水?你们是怎么检查它微生物限度的?我们是直接取纯化水来培养的,有通过过滤膜培养的么?专业人士请提供下,谢谢,拉拉敬上。
药品包装对包装药品的质量和使用安全起着十分重要的作用,因药品包装应能保证药品在生产、运输、贮存及使用过程中的质量,并便于临床使用。本章所述的药品包装是指直接与药品接触的内包装,这些包装材料和容器,简称药包材。药包材的微生物污染直接影响药品质量,可引起药品发霉、腐败,从而造成药品变质失效,特别是含有营养成分的药物制剂更易遭受污染、霉变,若温度适宜,空气中湿度又较高,则更有利于微生物的生长繁殖。因此,对微生物污染的监控是药包材质量和安全性评价的重要指标。一、分类 常用的药品包装材料、容器按材质成分可分为:塑料、玻璃、橡胶、金属及上述成分的组合材料。按包装的形状划分可分为:①容器,如口服固体药用高密度聚乙烯瓶等。②片、膜、袋,如聚氯乙烯固体药用硬片和药品包装用复合膜、袋等。③塞,如药用氯化丁基橡胶塞。④盖,如口服液瓶撕拉铝盖。⑤辅助用途。二、检验量 检验量是一次试验所用的供试量(瓶、支或cm2)。膜、袋、铝箔、复合硬片等的检验量为100cm2;软膏管、铝塑封口垫片检验量为10支(片)。三、微生物限度检查1.滴眼剂瓶(1),取数个试瓶,加入1/2标示容量的0.9﹪无菌氯化钠溶液,将盖旋紧,振摇1min,提取液进行薄膜过滤,按照微生物限度检查法测定。(2),标准:细菌数:每瓶不得过100个霉菌、酵母菌:不得检出金黄色葡萄球菌、铜绿假单胞菌:不得检出2液体药用瓶(1),取数个试瓶,加入1/2标示容量的0.9﹪无菌氯化钠溶液,将盖旋紧,振摇1min,提取液进行薄膜过滤,按照微生物限度检查法测定。(2),标准 项目 口服液体药用瓶 外用液体药用瓶 细菌数个/瓶 ≦1000 ≦100 霉菌、酵母菌个/瓶 ≦100 ≦100 大肠埃希菌 不得检出 — — 金黄色葡萄球菌 — — 不得检出 铜绿假单胞菌 — — 不得检出 3口服固体药用瓶(1),取数个试瓶,加入1/2标示容量的0.9﹪无菌氯化钠溶液,将盖旋紧,振摇1min,提取液进行薄膜过滤,按照微生物限度检查法测定。(2),标准:细菌数:每瓶不得过1000个霉菌、酵母菌:每瓶不得过100个大肠埃希菌:不得检出4药品包装用复合膜、袋、铝箔、复合硬片(1)取试样用开孔面积20cm2的消毒过无菌的金属模板压在内层面上,将无菌棉签用氯化钠注射液稍沾湿,在板孔范围内擦抹5次,换[/c
关于微生物限度检查中MVD(最大有效稀释倍数):指试验中供试品溶液被允许达到的最大稀释倍数。这个稀释指的是单次最大允许稀释的倍数还是可以多次稀释但每次最多稀释一倍?
微生物限度检查法标准操作规程共37页[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=70022]微生物限度检查法标准操作规程[/url]
谁有细菌内毒素 微生物限度检查 检验记录样本有的话,能共享下吗!谢谢
中国药典2005年版无菌、微生物限度及细菌内毒素检查方法学验证内容简介[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=117279]无菌、微生物限度及细菌内毒素检查方法学验证[/url]
讨论一下:微生物限度检查是否都需要取连续2-3个稀释级?
请假大家,有没有膏状制剂做微生物限度检查时的取样经验,就是类似清凉油那种盒装软膏,粘且油,怎么称量取样呢,容易粘药勺 挂着掉不下来,谢谢各位提供宝贵建议
2010年版药典附录无菌检查和微生物限度检查方法增修定内容 杜平华
响应大家的要求!传一份"微生物限度检查方法的验证"请大家一切分享! [img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=23248]微生物限度检查方法的验证[/url]
请教各位:水溶性差的样品,做微生物限度检查时,加入pH7.0氯化钠-蛋白胨缓冲液后,供试液下层有不溶性沉淀,是否可直接取上层清液进行试验?
问: 做无菌验证时阳性对照菌是怎么加入的?可以在加完培养基后用无菌的注射器把菌液注入吗?答:严格的说是要在最后一遍冲洗液中加入阳性对照菌的,这主要是考量滤膜对于阳性菌的截留性~但是滤器如果可以提供滤膜对于阳性菌的充分截留的话在最后的培养体系中加入阳性菌也是未尝不可的. 如果供试品没有抑菌作用,可以在加完培养基后用无菌的注射器把菌液注入,摇匀如果供试品有抑菌作用,正如安哥洛卡所讲,在最后一次冲洗液中加入阳性对照菌,摇匀,抽虑,加培养基. 无菌检查,加入阳性的方法可以有许多种,可以根据个人的习惯。只是注意:1、避免人为污染。2、阳性菌加入数量,符合“2005版中国药典XIJ微生物限度检查法”的规定。关键词:阳性对照菌 问: 离心沉淀法的原理、操作和注意事项是什么? 答:原理:利用沉降系数的差异将供试品和微生物进行分离; 操作:取规定量的供试液,3000转/分离心20分钟(供试液如有沉淀,先以500转/分离心5分钟,取全部上清液再离心),弃去上清液,留底部集菌液约2ml,加稀释剂至原规定量. 注意事项:真菌由于沉降系数比较小, 500r/min离心5min,黑曲霉、白色念珠菌回收率为20%,因此其检查不适宜用低速离心沉淀法. [col
[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=157531]药品微生物限度与无菌检查方法验证实验的要点及体会[/url]
中国药品生物制品检定所---药品微生物限度与无菌检查方法验证实验的要点及体会 2007年1月[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=49203]验证实验要点及体会[/url]
希望对大家有用[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=14942]微生物限度检查法验证范[/url]
我发现在做冻干粉针剂的无菌检查时,用0.9%氯化钠溶液溶解药品,后薄膜过滤?有一次,同事错用了pH7.0氯化钠-蛋白胨缓冲液,结果药粉都没溶解。在做一种药品的原料药的微生物限度检查时,一种用pH7.0氯化钠-蛋白胨缓冲液,然后薄膜过滤。请问微生物无菌检查和限度检查时用的冲洗液,为什么有时候用0.9%氯化钠溶液,有时候用pH7.0氯化钠-蛋白胨缓冲液?如何去选择?依据是什么?谢谢!
1、目的:建立微生物限度检查规程,规范微生物限度检查。2、范围:本公司成品、中间体、产品用原料、辅料、内包材。3、责任人:QC检验员。4、正文:4.1简述:微生物限度检查系指非规定灭菌制剂及其原、辅料受到微生物污染程度的一种检查方法。包括染菌量及控制菌的检查。4.2仪器与用具:生化培养箱、微生物限度检查室、蒸汽灭菌器、玻璃器皿(试管、量筒、三角瓶、刻度容量瓶等)、手术镊、剪刀、酒精灯、脱脂卫生棉。4.3试液与试药:培养基、稀释剂、对照用菌液等。4.4试液、试药的制备。4.4.1培养基及其制备方法:4.4.1.1营养琼脂培养基取本品31克,加蒸馏水1000毫升,浸泡数分钟后,加热至全部溶解,分装,经121℃15分钟灭菌后备用。 4.4.1.2玫瑰红钠琼脂培养基取本品30克,加蒸馏水1000毫升,加热至全部溶解,分装,经115℃15分钟灭菌后备用。4.4.1.3胆盐乳糖培养基(BL)取本品36克,加1000毫升蒸馏水,加热至全部溶解,分装,经115℃15分钟灭菌后备用。4.4.1.4曙红美亚甲蓝琼脂培养基(EMB)取本品42克,加蒸馏水1000毫升,混合,放置10分钟,经115℃15分钟1、目的:建立微生物限度检查规程,规范微生物限度检查。2、范围:本公司成品、中间体、产品用原料、辅料、内包材。3、责任人:QC检验员。4、正文:4.1简述:微生物限度检查系指非规定灭菌制剂及其原、辅料受到微生物污染程度的一种检查方法。包括染菌量及控制菌的检查。4.2仪器与用具:生化培养箱、微生物限度检查室、蒸汽灭菌器、玻璃器皿(试管、量筒、三角瓶、刻度容量瓶等)、手术镊、剪刀、酒精灯、脱脂卫生棉。4.3试液与试药:培养基、稀释剂、对照用菌液等。4.4试液、试药的制备。4.4.1培养基及其制备方法:4.4.1.1营养琼脂培养基取本品31克,加蒸馏水1000毫升,浸泡数分钟后,加热至全部溶解,分装,经121℃15分钟灭菌后备用。 4.4.1.2玫瑰红钠琼脂培养基取本品30克,加蒸馏水1000毫升,加热至全部溶解,分装,经115℃15分钟灭菌后备用。4.4.1.3胆盐乳糖培养基(BL)取本品36克,加1000毫升蒸馏水,加热至全部溶解,分装,经115℃15分钟灭菌后备用。4.4.1.4曙红美亚甲蓝琼脂培养基(EMB)取本品42克,加蒸馏水1000毫升,混合,放置10分钟,经115℃15分钟
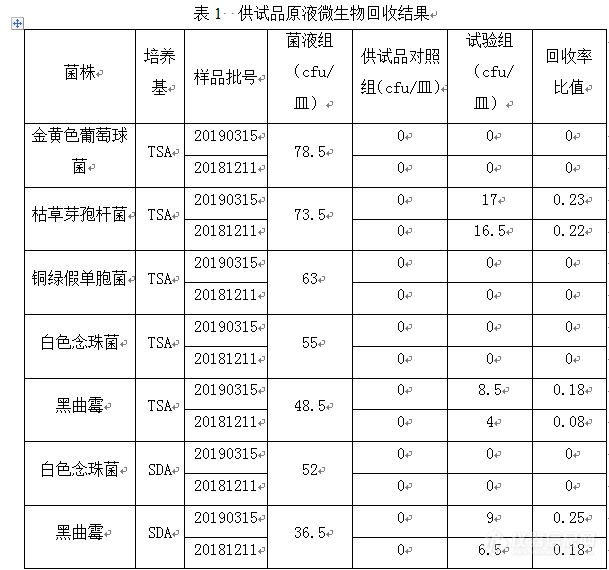
妇科止痒洗剂微生物限度检查方法适用性试验一、检验依据:《中国药典》2015年版四部1105、1106二、仪器与实验材料1、仪器 高压锅 型号:G154DW 致微(厦门)仪器有限公司生物安全柜 型号:AC2-4S1 新加坡艺思高公司生化培养箱 型号:SHP-350 上海精宏实验设备有限公司生化培养箱 型号:LRH-250 上海一恒科学仪器有限公司天平 型号:LD3102 沈阳龙腾电子有限公司恒温水温箱 型号:S.HH.W21.600S 上海跃进医疗器械有限公司2、样品 品名:妇科止痒Ⅰ号洗剂 批号:20190221;20190315;20181211 规格: 250ml/瓶 生产单位:南平市人民医院3、培养基胰酪大豆胨液体培养基(TSB)(批号:1901222)沙氏葡萄糖液体培养基(SDB)(批号:180925)胰酪胨大豆琼脂培养基(TSA)(批号:1901162)沙氏葡蔔糖琼脂培养基(SDA)(批号:190116)梭菌增菌培养基(批号:181213)哥伦比亚琼脂培养基(批号:170914)以上培养基均由北京三药科技有限公司提供;溴化十六烷基三甲铵培养基(批号:20180403)由海博生物技术有限公司提供;甘露醇氯化钠琼脂培养基(批号:3104327)由广东环凯微生物科技有限公司提供。4、菌种枯草芽孢杆菌【CMCC(B)63501】(第4代)金黄色葡萄球菌【CMCC(B)26003】(第4代)铜绿假单胞菌【CMCC(B)10 104】(第4代)白色念珠菌【CMCC(F)98001】(第3代)黑曲霉【CMCC(F)98 003】(第3代)大肠埃希菌【CMCC(B)44 102】(第5代)生孢梭菌【CMCC(B)64 941】(第3代)以上菌种均来源于广东环凯微生物科技有限公司。三、菌液制备1、接种金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、大肠埃希氏菌至胰酪大豆胨液体培养基中,经30~35℃培养18~24小时后,分别取金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、大肠埃希氏菌的胰酪大豆胨液体培养基培养物1ml,用0.9%无菌氯化钠溶液,10倍稀释至10-5~10-7,做活菌计数备用,选择适宜梯度使细菌数不大于100cfu/ml。2、将生孢梭菌接种于梭菌增菌培养基中置厌氧条件下30~35℃培养24~48小时,用0.9%无菌氯化钠溶液制成菌悬液或者孢子悬液,10倍稀释至10-3~10-5做活菌计数备用,选择适宜梯度使菌数不大于100cfu/ml。3、接种白色念珠菌至沙氏葡萄糖液体培养基中,经20~25℃培养48~72小时取白色念珠菌液体培养物1ml,用0.9%无菌氯化钠溶液,10倍稀释至10-4~10-6做活菌计数备用,选择适宜梯度使菌数不大于100cfu/ml。4、接种黑曲霉至沙氏葡萄糖琼脂培养基中,经20~25℃培养7天,取黑曲霉新鲜培养物,加入5ml含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液,将孢子洗脱,吸出孢子悬液用0.9%无菌氯化钠溶液进行10倍稀释至10-4~10-6,做活菌计数备用,选择适宜梯度使菌数不大于100 cfu/ml。四、计数方法适用性试验1、供试液制备 取10mL供试品,用胰酪大豆胨液体培养基稀释制成1:10的供试液,备用。2、供试品中微生物的回收试验组:取上述制备好的供试液,加入金黄色葡萄球菌菌悬液,混匀,使每1ml供试液中含菌量不大于100 cfu,取该混合液2ml(lml/皿),分别置直径为90mm的无菌平皿中,注入15~20ml温度不超过45℃相应的琼脂培养基。置规定温度、时间培养,观察计数结果。铜绿假单胞、桔草芽孢杆菌、白色念珠菌、黑曲霉均依法操作。供试品对照组:取制备好的供试液,以稀释液代替菌液同试验组操作。菌液组:取相应的稀释液代替供试液,按试验组操作加入试验菌液并进行微生物回收试验。3.结果判断计数方法适用性试验中,采用平皿法时,试验组菌落数减去供试品对照组菌落数的值与菌液对照组菌落数的比值应在0.5~2范围内,若各试验菌的回收试验均符合要求,照所用的供试液制备法及计数方法进行该供试品的需氧菌总数、霉菌和酵母菌总数计数。试验结果详见表1。[img=,609,570]https://ng1.17img.cn/bbsfiles/images/2019/09/201909152300475214_6517_2232106_3.png!w609x570.jpg[/img]表1结果表明:按此方法进行适用性检查,所有试验菌的回收比值均小于0.5,试验菌的回收比值均不在0.5~2范围内,因此采用1:10的供试液重新进行适用性试验。[img=,432,585]https://ng1.17img.cn/bbsfiles/images/2019/09/201909152302434224_4507_2232106_3.png!w432x585.jpg[/img]表2结果表明:按此方法进行适用性检查,所有试验菌的回收比值均在0.5~2范围内,故可采用制备1:10供试液按平皿法进行该供试品的需氧菌总数、霉菌和酵母菌总数计数。五、控制菌1、铜绿假单胞菌试验组:取1:10供试液10ml接种至100ml的胰酪大豆胨液体培养基中,加入54cfu/ml的铜绿假单胞菌菌悬液1ml,混匀,30~35℃培养18~24小时,取上述培养物划线接种于溴化十六烷基三甲铵琼脂培养基平板上,30~35℃培养18~72小时,观察并记录。阴性对照组:以稀释液代替供试液,不加试验菌,其他同试验组的控制菌检查。阳性对照组:不加供试液,其他同试验组的控制菌检查。供试品对照组:不加试验菌,其他同试验组的控制菌检查。[img=,650,235]https://ng1.17img.cn/bbsfiles/images/2019/09/201909152303530254_4222_2232106_3.png!w650x235.jpg[/img]2、金黄色葡萄球菌试验组:取1:10供试液10ml接种至100ml的胰酪大豆胨液体培养基中,加入72 cfu/ml的金黄色葡萄球菌菌悬液1ml,混匀,30~35℃培养18~24小时,取上述培养物划线接种于甘露醇氯化钠琼脂培养基平板上,30~35℃培养18~72小时,观察并记录。阴性对照组:以稀释液代替供试液,不加试验菌,其他同试验组的控制菌检查。阳性对照组:不加供试液,其他同试验组的控制菌检查。供试品对照组:不加试验菌,其他同试验组的控制菌检查。[img=,658,530]https://ng1.17img.cn/bbsfiles/images/2019/09/201909152305306414_5621_2232106_3.png!w658x530.jpg[/img][img=,602,169]https://ng1.17img.cn/bbsfiles/images/2019/09/201909152305386274_4226_2232106_3.png!w602x169.jpg[/img]注:+代表沙氏葡萄糖琼脂培养基平板上有典型菌落生长,-代表沙氏葡萄糖琼脂培养基平板上无典型菌落生长。4、梭菌试验组:取1:10供试液10ml,另取一份1:10供试液10ml置80℃保温10min后迅速冷却分别接种至100ml的梭菌增菌培养基中,分别加入71cfu/ml生孢梭菌菌悬液1ml,混匀,置厌氧条件下30~35℃培养48小时。取上述培养物划线接种于哥伦比亚琼脂培养基平板上,置厌氧条件下30~35℃培养48~72小时。阴性对照组:以稀释液代替供试液,不加试验菌,其他同试验组的控制菌检查。阳性对照组:不加供试液,其他同试验组的控制菌检查。供试品对照组:不加试验菌,其他同试验组的控制菌检查。[img=,674,615]https://ng1.17img.cn/bbsfiles/images/2019/09/201909152307107304_5206_2232106_3.png!w674x615.jpg[/img]
[size=4]做限度检测和无菌检查,只知道如何做,但是不明白为什么2个选择的方法不同。[/size][size=4]并且,限度检查的结果如果为0,是否可以说等同于无菌检查的结果?如果不能,为什么呢?[/size][size=4]限度检查又为什么检查出来是0呢,不知道这个0说明了什么?[/size]
最近早报一个药品,做杂质检查,此杂质是辅料降解产生的有害杂质.发现,杂质检查有两种方法,一个是定量试验,一个是限度试验.什么情况下按定量做,什么情况下按限度试验方法做呢.有什么具体的规定吗.我看了不少都是用的限度试验.
[font=SimSun, STSong, &]微生物限度检查的内容有:[/font][font=SimSun, STSong, &]1)微生物限度计数[/font][font=SimSun, STSong, &]计数方法适用性试验[/font][font=SimSun, STSong, &]供试品的微生物限度计数[/font][font=SimSun, STSong, &]2)微生物限度控制菌检查[/font][font=SimSun, STSong, &]控制菌检查方法适用性试验[/font][font=SimSun, STSong, &]供试品微生物限度控制菌检查[/font][font=SimSun, STSong, &]除了这些还有吗?具体怎么操作?每次实验都需要质控吗?[/font]
1. 包装材料的大肠埃希菌检查?答:根据包装材料的不同,大肠埃希菌的检查方法大致有两种,一种是将浸提液合并后,取一部分,接种胆盐乳糖培养基进行检查;另一种是将浸提液合并后,薄膜过滤,然后按规定的方法检验。2. 抗真菌药品的微生物限度检查法答:这类产品的霉菌和酵母菌计数方法需要进行调整,可以根据产品剂型的不同,选择薄膜过滤法或培养基稀释法等方法。3. 为什么在日常样品检测中还需要做阳性对照(国外不需要)?答:为了确保每一次检测对可能存在的微生物都是有效的。4. 对于同一个品种,药典为什么不规定统一的检测方法?答:本版药典进行过这样的尝试,也有某些品种已经收载了统一的检测方法,如注射用头孢类抗生素的无菌检查。之所以没有大量收载,主要是由于检测方法还没有经过必要的复核。将微生物检验的统一方法收载在品种的各论项下,始终是努力的方向。5. 梭菌检查中需置厌氧条件下培养48小时,是否指在厌氧培养箱中?答:需要在厌氧培养装置中进行培养,未必一定是厌氧培养箱。6. 控制菌检查方法验证时,采用多种方法均未检出控制菌,如何处理?答:在确保所使用的各种方法都没有错误的情况下,如果仍无法使试验菌生长,则应该采用薄膜过滤法进行检查。理由是该方法能够最大程度地去除产品的抑菌作用。7. 常规的监督抽样检品(包括原料)在进行微生物限度检查时,是否一定要进行活螨检查并在原始记录与报告书中体现?答:需要进行检查。可以在原始记录中体现,报告书上可以不出现,除非当发现有活螨检出。8. 药包材微生物限度检查规定了合格质量水平,通常产量下取样8个,要求8个瓶子均符合规定,如何进行?答:每个瓶子分别进行实验。9. 大肠埃希菌具体操作规程?答:参见中国药品检验标准操作规程。10. 动物组织及动物类原药材的提取物入药,是否需要检沙门菌?答:需要进行沙门菌检查。11. 关于中国药典菌落计数结果的判断还存在疑义,望能举例说明。答:不清楚所指的存在疑义是指哪方面。2010年版对结果报告进行了较大篇幅的修订,目前的规定应该比05版更为清晰、明确。12. 需做沙门菌检验样品量的确定?答:10g(ml)用于样品计数检验和其他控制菌检查,10g(ml)用于沙门菌检查,10g(ml)用于沙门菌检查的阳性对照。需要进行沙门菌检查的样品,检验用量应为30g(ml)。13. 日常的实验室装备能否达到梭菌无氧的培养要求?答:完全可以。可以采用厌氧培养盒(罐)。14. 如果一个产品有两个规格,是否可以取其中之一做阳性对照?答:每个规格均需进行阳性对照。15. 细菌数为100g/g的,样品稀释级只做1:10,1:100的倍数就可以了吗?答:可以。16. 培养时间3天,5天,可理解为72小时,120小时吗?答:可以。这样更为严谨。17. 中国药品检验标准操作规范“已做验证试验的供试品,在检查时刻不必再做阳性对照”如何理解?答:该标准操作规范中在无菌检查法中规定“供试品无菌检查应进行阳性对照试验”,表明不论是否进行了方法验证,在产品的每一次检验过程中,还必须进行阳性对照。在控制菌检查的大肠埃希菌项下,指出“已做验证试验的供试品,在该供试品检查时不必再作阳性对照”。该规定仅适用方法验证与供试品检查同时开展的情况。2005年版药典和2010年版药典在控制菌检查中均对阳性对照试验有明确规定,“进行供试品控制菌检查时,应做阳性对照试验。”产品检验中应以药典规定为准。18. 无菌检查和微生物限度检查中,产品中规定的溶解液是否可以换成其他的溶液?答:可以。19. 制剂通则中,没有微生物检查项目的,是否可不进行微生物项目检测?答:可以。主要是二部制剂通则中口服片剂、胶囊剂、丸剂和颗粒剂。20. 在细菌、霉菌和酵母菌计数中,适用性检查细菌是培养48小时,霉菌和酵母菌是培养72小时,供试品检查中细菌是培养3天,霉菌和酵母菌是培养5天,那方法验证中应参照哪个时间进行培养。答:应按照供试品检验时的条件,即细菌3天,霉菌和酵母菌5天。21. 测定纯化水微生物限度时,每张滤膜过滤量是多少合适?需要先稀释吗?过滤完后需不需要冲洗?假如我取10ml纯化水通过双杯体封闭式薄膜过滤器过滤,每张滤膜上的计数是以5ml为单位还是10ml为单位?答:过滤量应以培养后出现的微生物数不超过100cfu/膜为标准。一般可不稀释。不需要冲洗。每张滤膜的过滤量为5ml。22. 药典中关于纯化水的微生物限度是:细菌、霉菌及酵母菌总数每1ml不得过100个。这句话的意思是细菌总数每1ml不得过100个,霉菌及酵母菌总数不得过100个,还是细菌+霉菌+酵母菌总数每1ml不得过100个。如果是三者总数的话,那细菌总数限度是多少?霉菌及酵母菌总数限度又是多少?答:是总数不得过100个。没有必要考虑各自的限度值。
问:煮沸消毒法中为何加碳酸钠或石碳酸效果更佳? 答:加碳酸钠或碳酸氢钠的目的为提高水的沸点,可以提到到105摄氏度,还可以去污去锈;详细请查阅物理化学或化学手册 石炭酸又名来苏尔,本身就是化学消毒剂,可以加强消毒效果 关键词:煮沸消毒法 碳酸钠或石碳酸 问:对微生物检品取样工具有什么要求? 答:微生物检品取样工具,1、一次性耗材 2、能够反复使用的耐高温、高压、不易与药品产生反应。关键词: 取样工具 要求 问:黑曲霉的传代是否和其它菌一样?我之前接好的第二代黑曲霉是白白的,呈棉絮状,用普通方法是否能够传代?请问斜面如何保持干燥?答:黑曲霉就是这样的,前7天生长的白色物质是菌丝体,后期培养基中的营养用完了才会产生黑色的孢子~这是正常的生长状态,注意传代时的改良马丁斜面培养基要保持干燥,水分过多的话孢子颜色会偏黄.把培养基放在35℃的恒温培养箱里培养1天,应该可以去掉水分的。 关键词:黑曲霉 传代 干燥 我也没怎么来过 帮大家整理几个吧:问:薄膜过滤法做限度验证,药典中说冲洗量过大有可能会造成微生物的损伤,是说的供试品中的微生物吗?一般冲洗量在什么范围内算是适当呢? [
每个公司的质检部门肯定都在做上市药品的稳定性考察,如果是口服药,有效期是3年,长期稳定性考察的频率为3、6、9、12、18、24、36、48个月,那么检测微生物限度的频率是12、24、36、48个月,还是仅在效期的36个月和效期后一年的48个月?如果是注射剂,有效期是2年,无菌检查是12、24、36个月都做,还是仅在效期的24个月和效期后一年的36个月做呢?药典上和GMP中都没有明确说明。