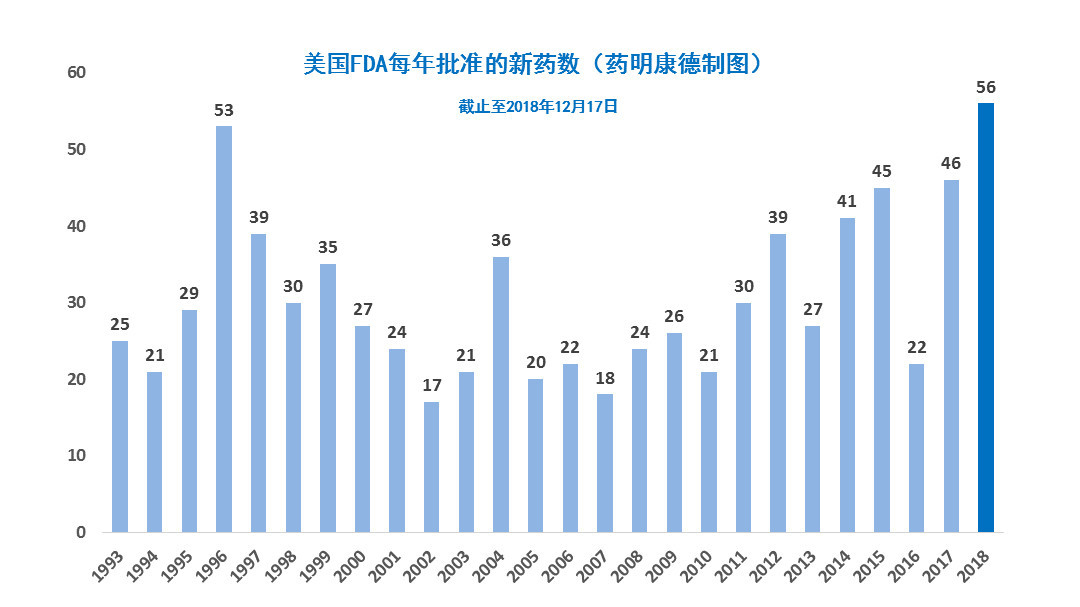
K药、O药、T药、B药、I药用药信息大汇总!
p PD-1/PD-L1免疫疗法(immunotherapy)是当前备受全世界瞩目、正掀起肿瘤治疗的革命,引领癌症治疗的变革,为患者带来新的希望的新一类抗癌免疫疗法,旨在充分利用人体自身的免疫系统抵御、抗击癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡,具有治疗多种类型肿瘤的潜力,实质性改善患者总生存期。br//pp 与传统疗法相比,免疫疗法最大的优势之一,就是疗效具有持久性。比如,在黑色素瘤里,欧美20%左右的晚期患者能实现临床治愈,成为“超级幸存者”,这是免疫疗法带来的生命奇迹。/pp span style="color: rgb(0, 112, 192) "全球肿瘤专家对免疫药物感到无比兴奋,有几个最大的原因:/span/ppspan style="color: rgb(0, 112, 192) " 1:它有更广谱的抗癌效果(O药已经在全球获批治疗9个癌种,k药获批9个癌种)。/span/ppspan style="color: rgb(0, 112, 192) " 2:它比化疗的整体副作用要小得多。/span/ppspan style="color: rgb(0, 112, 192) " 3:它如果起效,可能让晚期患者长期存活,甚至临床治愈,这是免疫药物区别于其它所有药物最大的不同/spanbr/strong style="text-align: center " PD-1/PD-L1/strong/pp 目前,全球上市的免疫检查点抑制剂PD-1或PD-L1抑制剂共5个,/pp strongO药:Opdivo(Nivolumab)、/strong/ppstrong K药:Keytruda(Pembrolizumab)、/strong/ppstrong T药:Tecentriq(Atezolizumab)、/strong/ppstrong I药:Imfinzi(Durvalumab)、/strong/ppstrong B药:Bavencio(Avelumab)。/strong/pp 近两日让癌友圈振奋的好消息是O药和K药都以正式运抵中国,并且O药在国内的价格也已全面公布,中国的患者终于迎来了真正的免疫治疗元年!全球肿瘤医生网医学部将药物用药信息总结如下,供癌症患者参考。/pp style="text-align: center "strong药品名称/strong/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201810/uepic/9410a867-8db5-4a17-a2f7-bd711cd62d74.jpg" title="1.png" alt="1.png"//pp style="text-align: center "strong生产商/strongbr//pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201810/uepic/4007757f-e92d-4fec-b6c3-4993751f65e4.jpg" title="2.png" alt="2.png"//pp style="text-align: center "strong作用靶点/strongbr/strong/strong/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201810/uepic/646a142f-a180-4e0f-a2e4-1083a2530539.jpg" title="3.png" alt="3.png"//pp style="text-align: center "strong适应症/strongbr/strong/strong/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201810/uepic/1db715cc-0408-47d3-96ff-dac1ccbb9da5.jpg" title="4.png" alt="4.png"//pp style="text-align: center "strong首次获批时间/strong/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201810/uepic/6590050f-966e-4edc-b85b-d7cd391d6fca.jpg" title="5.png" alt="5.png"//pp style="text-align: center "strong使用周期/strong/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201810/uepic/acc77539-ab66-4b96-8a9b-682f3ea911ef.jpg" title="6.png" alt="6.png"//pp style="text-align: center "strong使用剂量/strong/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201810/uepic/8a0d0ae5-cac7-4c0d-97e3-38595415f70e.jpg" title="7.png" alt="7.png"//pp style="text-align: center "strong剂型规格/strong/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201810/uepic/01529019-778a-4c4f-800c-fe559167b8e9.jpg" title="7.png" alt="7.png"//pp style="text-align: center "strong全球比价/strong/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201810/uepic/6f737146-29a4-4942-ad7c-7453af0d0bf0.jpg" title="9.png" alt="9.png"//pp style="text-align: center "strong国内上市情况/strong/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201810/uepic/512d101a-398a-40a7-bdcc-9ac8a3a9e748.jpg" title="10.png" alt="10.png"//pp style="text-align: center " strong关于PD-1患者关心的六大问题/strong/pp span style="color: rgb(0, 112, 192) "strong一、副作用的处理/strong/span/pp PD-1抑制剂,总体的副作用远小于传统的放化疗。最常见的副作用是“流感”样的表现:发热、乏力、头晕、全身肌肉酸痛、嗜睡等,发生率在30%左右,对症处理即可。/pp 肺部问题(肺炎):新发或恶化的咳嗽 胸痛 气短。/pp 肠道问题(结肠炎):可能导致肠道内的炎症或穿孔。包括:腹泻或排便次数多于平常 便血和腹部严重(腹部)疼痛或压痛。/pp 肝病(肝炎):皮肤或眼睛变黄 严重恶心或呕吐 腹部右侧的疼痛(腹部) 嗜睡 尿黄(茶色) 皮肤容易出血或瘀血 常有饥饿感。/pp 内分泌问题(特别是甲状腺,垂体,肾上腺和胰腺):激素腺体不能正常工作,包括:持续头痛或不寻常的头痛 极度疲劳,体重增加或减少 眩晕或昏厥 情绪或行为的变化,如性行为减少,烦躁或健忘 脱发、感冒、便秘 声音改变、口渴或尿多。/pp 肾脏问题:包括肾炎和肾衰竭。包括:尿量减少 尿液中的血液、脚踝肿胀和食欲不振。/pp 皮肤问题:这些问题的迹象可能包括:皮疹、瘙痒、皮肤起泡和口腔或其他粘膜中的溃疡。/pp 大脑炎症(脑炎):包括:头痛、发热、疲倦或虚弱混乱、记忆问题、嗜睡、幻觉、癫痫发作。/pp 其他器官的问题:视力的变化 严重或持续的肌肉或关节疼痛和严重的肌肉无力。/pp 严重的输液反应:发冷或寒战、瘙痒或皮疹、呼吸困难、头晕、发热。/pp 使用pd-1治疗,慎用异体干细胞移植并发症。这些并发症可能很严重,可能导致死亡。/pp 此外,大约5%-10%的患者,会出现严重的免疫相关的炎症反应:甲状腺炎症(表现为甲亢、甲减、或先甲亢后甲减)、免疫性肺炎、免疫性肠炎、免疫性肝炎、甚至免疫性心肌炎。免疫性炎症,如果发现不及时,处理不到位,偶尔发生致命的事故。/pp 对于甲状腺问题,可以请内分泌科医生会诊。甲亢可以服用抗甲状腺药物,甲减可以补充优甲乐。/pp 对于免疫性炎症,如肺炎、肝炎、肠炎等,需要酌情加上口服或静脉的糖皮质激素,如地塞米松、泼尼松、甲强龙等,对于病情较重的,还需要加上环磷酰胺、霉纷酸脂等免疫抑制剂。/pp 对于发生细胞因子风暴的患者,需要及时使用IL-6抗体,托珠单抗。/pp style="text-align: center"img src="https://img1.17img.cn/17img/images/201810/uepic/f714a9e0-700b-4875-b1d2-4c828e41eb4f.jpg" title="11.jpg" alt="11.jpg"//ppspan style="color: rgb(0, 112, 192) "strong二、PD-1抑制剂的疗效如何?/strong/span/pp 在绝大多数、未经挑选的实体瘤中,单独使用PD-1抑制剂的有效率,其实并不高:10%-30%左右。唯一的例外,是经典型霍奇金淋巴瘤,有效率突破60%以上。/pp PD-1抑制剂有效率偏低,为何学术界和癌友圈还如此疯狂和痴迷呢?主要的原因是:PD-1抑制剂疗效的持久性。由于免疫系统具有记忆功能,因此一旦PD-1抑制剂起效,其中部分病友实现临床治愈,也就是说五年、十年不复发、不进展、长期生存。尤其是较早的恶性黑色瘤、肾癌以及非小细胞肺癌中,都已经观察到了类似的现象:PD-1抑制剂的出现,将晚期恶性黑色素瘤和晚期非小细胞肺癌的生存率提高了数倍:晚期恶性黑色素瘤的5年生存率从15%左右,提高到了35%上下 而晚期非小细胞肺癌的5年生存率从5%左右,提高到了15%上下!/pp 此外,通过联合治疗,把原来不适合PD-1抑制剂治疗的病人,转化为可以从中获益的人群也可以提高治疗效果。目前,PD-1抑制剂主流的搭档有如下几个:/pp (1) 联合另一个免疫治疗药物:PD-1抑制剂联合CTLA-4抗体,已经被批准用于恶性黑色素瘤 在肾癌、TMB高的非小细胞肺癌中三期临床试验已经成功。此外,IDO抑制剂、TIM-3抑制剂、LAG-3抗体等新型的免疫治疗新药,正在研发中。/pp (2) 联合化疗:PD-1抑制剂联合化疗,已经被批准用于晚期非鳞非小细胞肺癌一线治疗 类似的方案,用于胃癌、肠癌、三阴性乳腺癌等也有不错的初步数据。/pp (3) 联合放疗:PD-1抑制剂联合放疗,在肺癌、恶性黑色素瘤等肿瘤中,已有不错的数据 回顾性研究甚至提示,放疗联合PD-1抑制剂,可以将生存期提高数倍。/pp (4) 联合靶向药:PD-1抑制剂联合抗血管生成的靶向药(贝伐、阿西替尼、乐伐替尼、卡博替尼等),已有不错的初步数据 但联合EGFR抑制剂(如易瑞沙、特罗凯、凯美钠、阿法替尼、泰瑞沙等),需要当心,可能发生严重的副作用。/pp (5) 联合溶瘤病毒:PD-1抑制剂联合溶瘤病毒T-VEC,在恶性黑色素瘤中,有效率超70%,完全缓解率突破30%,非常有前景。在其他肿瘤中,多种溶瘤病毒正在研发中。/pp (6) 联合个性化肿瘤疫苗:基于肿瘤基因突变所产生的新生抗原(neoantigen),可以设计和合成多肽或RNA疫苗。PD-1抗体联合这类私人订制、个性化肿瘤疫苗,已经有初步的成功经验,可以预防肿瘤复发,可以初步临床治愈晚期肿瘤。/pp (7) 联合特异性肿瘤免疫细胞治疗:PD-1抑制剂联合CAR-T等新型的特异性肿瘤免疫细胞治疗,在血液肿瘤中,已有初步的、不俗的数据。/ppspan style="color: rgb(0, 112, 192) "strong三、如何预测PD-1的效果?/strong/span/pp PD-1抑制剂在未经选择的实体瘤患者中,有效率只有10%-30% 究竟哪些患者能够最终获益,医学人员仍在不断研究,目前主要的评价指标有以下四个供临床医生参考:/pp (1) PD-L1表达/pp PD-1与PD-L1如同一对“情侣”,其中PD-1位于免疫细胞的表面,而PD-L1则位于肿瘤细胞的表面。这对“情侣”一旦结合,负责杀伤肿瘤细胞的免疫细胞就会把肿瘤细胞当作“朋友”,从而不再对其进行攻击。/pp 研究发现,当肿瘤细胞表面有PD-L1的表达,那么使用PD-1抑制剂或者PD-L1抑制剂抑制肿瘤的概率就会增加,所以,肿瘤组织中PD-L1的表达情况,就成为预测PD-1/PD-L1抑制剂有效率的一个指标。在非小细胞肺癌的临床实验中,人们发现,如果肿瘤组织中PD-L1的表达率超过50%,PD-1抑制剂可以作为首选治疗方法治疗肿瘤,而如果PD-L1的表达率 1%,免疫检查点抑制剂可以使一线化疗失败的肺癌患者获益。/pp (2) MSI(微卫星)检测/pp 微卫星不稳定性是我们身体中基因的一种病态情况,与肿瘤的发生密切相关。/pp 研究表明,如果肿瘤组织中微卫星处于高度不稳定的状态,即MSI-H,使用PD-1抑制剂的有效率高于微卫星不稳定性低的状态(MSI-L)和微卫星稳定的状态(MSS)。所以,MSI-H就成为了预测PD-1抑制剂的一个重要的生物标志物。/pp (3) 肿瘤基因突变负荷(TMB)检测/pp 肿瘤突变负荷高,从免疫治疗中获益的概率就大。在CheckMate-032临床研究中,按照TMB高低划分成TMB高、TMB中、TMB低三类病人,在接受联合治疗的人群中,三组的有效率分别为62%、20%、23% 而三组的中位总生存期,分别为:22.0个月、3.6个月、3.4个月——22.0个月与3.4个月,相差6倍!所以,TMB也是预测PD-1抑制剂的一个重要的生物标志物指标。/pp (4) 肿瘤浸润淋巴细胞(TIL)检测/pp 通过免疫组化染色(CD3、CD4、CD8等),可以看出肿瘤组织中是否有较多的淋巴细胞浸润。浸润的淋巴细胞越多,PD-1抑制剂的有效率越高。/ppspan style="color: rgb(0, 112, 192) "strong四、如果PD-1起效,到底应该用多久?/strong/span/pp 目前国内外,标准的方案是:手术或同步放化疗后,巩固性、辅助性使用的病友,PD-1抑制剂建议用满1年 而晚期的、全身转移的病友,建议用满2年。然而,越来越多的证据支持,使用PD-1抑制剂满6个月,且肿瘤缩小达到完全缓解、部分缓解(肿瘤缩小超过30%以上)的病友,可以再巩固2-3次后,酌情停药或调整剂量和间隔。/ppspan style="color: rgb(0, 112, 192) "strong五、PD-1耐药后应该怎么办?/strong/span/pp PD-1抑制剂有效的病人,一般疗效持久 但是,目前已经观察到30%左右的患者,出现了疾病的耐药。克服耐药的关键,主要是两点:/pp 首选,如果可能,可以通过对新增的或者不断增大的耐药部位,进行穿刺活检和深入的免疫分析,找到耐药的原因,根据原因治疗。比如,有的病人是由于TIM-3、LAG-3或IDO代偿性高表达 那么选择,PD-1抑制剂联合TIM-3抑制剂、LAG-3抗体、IDO抑制剂,就是最好的治疗方案。/pp 其次,对于不能明确耐药原因的病友,可以结合具体病情,选择最佳的联合搭档,逆转耐药,延长生存期 或者,更换为放化疗、介入、射频、粒子植入等传统治疗。/ppspan style="color: rgb(0, 112, 192) "strong六、使用PD-1,患者需要注意哪些问题?/strong/span/pp 首先,如下病人不适合、不建议尝试PD-1抑制剂:病情进入终末期、卧床不起的病人 有急性细菌感染,尚未控制的病人 做过肝移植、肾移植的病人 有系统性红斑狼疮、白塞病、干燥综合征、血管炎等自身免疫病,尚未控制的病人 携带MDM2扩增、EGFR突变、JAK突变等病人等(有些患者可以首选靶向治疗)。/pp 其次,使用PD-1抑制剂前,一般建议完善如下检查,基本正常,然后再使用:血常规、肝肾功、电解质、凝血、甲状腺功能,心电图、腹部B超、胸部X线。/pp 最后,也是最重要的一点:越来越多的证据支持,PD-1抑制剂这类免疫治疗,应该在患者一般情况比较好,肿瘤负荷比较小的时候,尽早用。/p