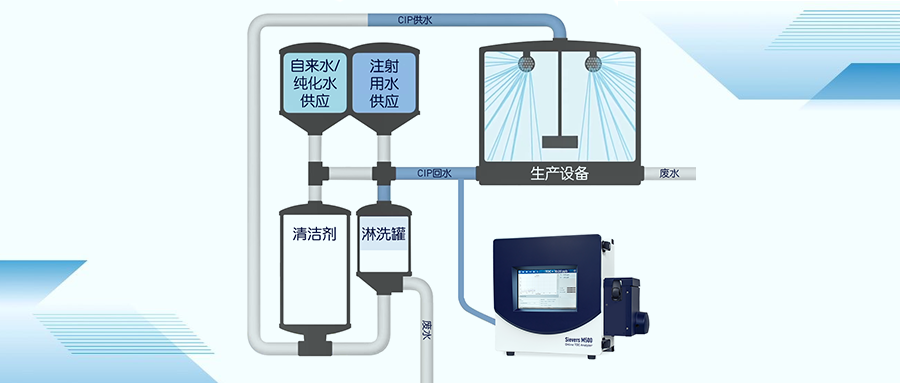
根据工艺能力判断合适的清洁验证总有机碳TOC限值
观察根据擦拭和淋洗样品总有机碳(TOC)的历史或当前数据而采用工艺能力方法,能够证明清洁工艺及用于此工艺的限度是否可行、可实现、可检验。在下图所示的工艺中,上下游过程都使用1ppmC的“默认”限值,此限值将用于确定工艺能力。但是,TOC样品通常接近TOC方法的检测限(LOD)或定量限(LOQ),因此最可行的方法是使用单侧接受标准来显示工艺能力。对于单侧接受标准来说,工艺能力比率是Cnpk,而不是传统的CpK方法。评估限值对于任何清洁工艺来说,要评估两个清洁验证关键性质量属性(TOC擦拭和淋洗样品)的某个接受标准是否切实可行和可以实现,通常对于特定的生产工艺,使用工艺能力指数。如果从工艺中采集的历史或当前TOC数据满足特定的工艺能力比率,则TOC与对特定工艺的当前接受标准,适用于清洁验证。为表明这种判断,请看以下例子,表现了使用这个特定的设备,对特定的生产工艺进行的清洁工艺的合适程度。将评估以下TOC接受标准:&bull 上下游TOC擦拭样品:统计原理要评估已建立的接受标准是否切实可行和可以实现,需使用工艺能力指数。工艺能力指数旨在确定,考虑到已经观察到的当前与历史上的TOC擦拭与淋洗数据的变化率,该清洁工艺是否能够满足此接受标准。为了判断此方法是否合适,合适的工艺意味着,已建立的接受标准从统计学的角度来看,是合理的。合适的工艺是指能够确保工艺能力指数大于或等于1.25的工艺。此特定比率与传统的大1.33同,因为清洁验证接受标准是单侧规格1。为了选择工艺能力指数的正确计算方法,需同TOC擦拭和淋洗数据分布一起来考虑接受标准的类型(单侧或双侧)。如果TOC擦拭和淋洗接受标准确定TOC擦拭百分比分布目前用于特定产品清洁过程的清洁验证,使用对设备性能确认(PQ)或持续确认(定期监测)和产品转换所进行的整个清洁过程的TOC擦拭和淋洗数据。以上示例数据用直方图形式来确定正态分布。如上表所示,数据显示了同正态分布的明显偏离。大部分数据非常接近方法的检测限,因此将数据转换为近似正态分布是不合理的。所以,TOC擦拭数据要求用百分比分布来计算工艺能力比率,百分比分布应由统计程序来确定。 // 在此示例中,TOC擦拭数据的百分比分布确定了TOC擦拭数据的99.5%为0.8 ppm或800 ppb,TOC淋洗数据的百分比分布确定了TOC淋洗数据的99.5%为0.6 ppm或600 ppb。这些数值在用百分比分布来计算单侧规格工艺能力指数时很重要。对于新的清洁工艺,可升级或更换现行方法,用TOC来验证关键性的清洁工艺参数(TACT)。确定擦拭和淋洗样品的TOC工艺能力确定百分比分布之后,应使用以下公式来确定TOC擦拭和淋洗样品的工艺能力指数。对于单侧规格(如清洁验证应用中的规格),指数计算公式为:CnpK =(USL - 中位数)/(p(0.995) - 中数)其中:&bull Cnpk=非参数工艺能力指数&bull USL=Upper Specification Limit, TOC清洁验证擦拭和淋洗样品的规格上限值&bull 中位数=样品的50%百分比分布。由于TOC数据的50%非常接近检测限,因而TOC样品的中位数通常为0.1 ppm,或者0与检测限的中点值。&bull p (0.995)=数据的 99.5 %可以用此计算方法和相应的百分比分布(擦拭:0.8 ppm;淋洗:0.6 ppm)来计算工艺能力(Cnpk)如下:TOC擦拭:Cnpk=1.4;TOC淋洗:Cnpk=1.8单侧接受标准的合格工艺是指能力指数大于或等1.25的工艺,这表明清洁验证工艺及其关键性参数(时间、搅拌/速度、浓度、温度)能够满足TOC擦拭和淋洗所收集样品的参考文献1. Montgomery, D.C., (1991). Introduction to Statistical Quality Control, 统计质量控制入门, John Wiley and Sons New York, New York, 第373页2. NIST/SEMATECH e-Handbook of Statistical Methods, 统计方法手册, 第6.1.6节, What is Process Capability? 什 么 是 工 艺 能 力 ?http://www.itl.nist.gove/div898/handbook/index.htm◆ ◆ ◆联系我们,了解更多!