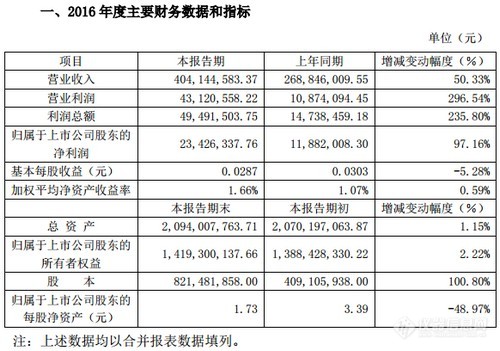
北京市红十字血液中心289.43万元采购细胞计数器
详细信息 [公开]血小板及HLA抗体检测试剂盒及安全输血室质量控制检测试剂耗材(二次)公开招标公告 北京市-海淀区 状态:公告 更新时间: 2023-11-01 招标文件: 附件1 [公开]血小板及HLA抗体检测试剂盒及安全输血室质量控制检测试剂耗材(二次)公开招标公告 2023-11-01 项目概况 血小板及HLA抗体检测试剂盒及安全输血室质量控制检测试剂耗材 招标项目的潜在投标人应在北京市政府采购电子交易平台获取招标文件,并于2023-11-22 09:30(北京时间)前递交投标文件。 一、项目基本情况 项目编号:11000023210200060319-XM001 项目名称:血小板及HLA抗体检测试剂盒及安全输血室质量控制检测试剂耗材 预算金额:289.4308 万元(人民币) 最高限价:289.4308 万元(人民币) 采购需求: 包号 标的名称 数量 采购包预算金额(万元) 简要技术需求或服务要求 1 血小板及HLA抗体检测试剂盒 130盒 50.7 用于血小板输注无效患者及免疫性血小板减少症患者血小板抗体HPA及血小板相关HLA抗体检测 2 血小板抗体检测试剂盒 132盒 52.8 用于血小板输注无效患者的血小板交叉配型 3 HLA-A、B、C、DRB1、DQB1基因PCR-SSOP流式磁珠分型试剂盒 700 份 49 用于骨髓库供受者HLA-A,B,C,DR,DQ基因中、高分辨分型、用于临床供、受者骨髓和器官移植组织配型、 HLA与疾病相关联检测等 4 HLA高分辨基因定型HLA-A、B、C、DRB1、DQB1测序分型试剂盒 840人份 119.3 用于供/受者骨髓配型HLA高分辨基因定型 5 五分类质控品(高、中、低值) 1.5ml×24×3(高、中、低值) 4.68 用于血细胞计数仪质控 6 厌氧培养瓶、需氧培养瓶 各50瓶/箱×16箱 7.2 用于血液制品抽检无菌试验 7 血凝仪试剂耗材 Clean A清洗液 500mL*4 5.0026 ACL Elite/Elite Pro血凝分析仪操作使用 rotors分析转盘 100/PKg *3 参比液 1L*4 定标血浆校准品 10*1mL*3 乏VIII因子血浆 10*1mL*5 活化的部分凝血活酶时间APTT 5*10mL*5 因子测定稀释液 3*100mL 血凝试剂质控品(正常中值) 10*1mL*3 8 pH计试剂 7瓶 0.1762 pH4.00校准品250mL/瓶×2pH7.00校准品250mL/瓶×2pH测定电极保养液250mL/瓶×3 9 吸管(塑料刻度移液管) 一批 0.572 2mL×20005mL×200 合同履行期限:合同执行期限为自签订之日起一年。 本项目不接受联合体投标。 二、申请人的资格要求: 1.满足《中华人民共和国政府采购法》第二十二条规定; 2.落实政府采购政策需满足的资格要求: 2.1 中小企业政策:本项目不专门面向中小企业采购。 2.2 其它落实政府采购政策的资格要求(如有): 无 3.本项目的特定资格要求: 3.1本项目是否接受分支机构参与投标:□是 ◆否; 3.2本项目是否属于政府购买服务: ◆否 □是,公益一类事业单位、使用事业编制且由财政拨款保障的群团组织,不得作为承接主体; 3.3其他特定资格要求(如有):1)本项目接受进口产品投标;2)投标产品如涉及药品,应提供国家食品药品监督管理局药品注册证,药品生产许可证或药品经营许可证。如为进口药品,还应提供中华人民共和国进口药品注册证;3)投标产品如涉及医疗器械,应提供中华人民共和国医疗器械注册证;4)投标人是制造商的应提供医疗器械生产许可证;投标人是代理商的应提供医疗器械经营许可证;5)投标产品如涉及标准物质及标准品,应提供国家质量监督检疫总局颁发的相应证书。 三、获取招标文件 时间:2023-11-01 至 2023-11-08 ,每天上午09:00至11:30,下午13:30至16:30(北京时间,法定节假日除外) 地点:北京市政府采购电子交易平台 方式: 供应商持CA数字认证证书登录北京市政府采购电子交易平台(http://zbcg-bjzc.zhongcy.com/bjczj-portal-site/index.html#/home)获取电子版招标文件。 售价:¥0 元,本公告包含的招标文件售价总和 四、提交投标文件截止时间、开标时间和地点 2023-11-22 09:30(北京时间) 地点:北京市海淀区复兴路乙12号中国铝业大厦11层1111会议室 五、公告期限 自本公告发布之日起5个工作日。 六、其他补充事宜 1.本项目需要落实的政府采购政策:《中华人民共和国政府采购法》(主席令第68号)、《关于中国环境标志产品政府采购实施的意见》(财库[2006]90号)、《国务院办公厅关于建立政府强制采购节能产品制度的通知》(国办发【2007】51号)、《关于开展政府采购信用担保试点工作的通知》(财库【2011】124号)、《关于印发《政府采购促进中小企业发展管理办法》的通知》(财库【2020】46号)、《财政部、司法部关于政府采购支持监狱企业发展有关问题的通知》(财库【2014】68号、《三部门联合发布关于促进残疾人就业政府采购政策的通知》(财库〔2017〕141号)等。 2.采用线上获取招标文件,线下递交纸质投标文件的方式: 2.1办理CA认证证书 供应商登录北京市政府采购电子交易平台查阅 “用户指南”—“操作指南”—“市场主体CA办理操作流程指引”,按照程序要求办理。 2.2注册 供应商登录北京市政府采购电子交易平台“用户指南”—“操作指南”—“市场主体注册入库操作流程指引”进行自助注册绑定。 2.3驱动、客户端下载 供应商登录北京市政府采购电子交易平台“用户指南”—“工具下载”—“招标采购系统文件驱动安装包”下载相关驱动。 2.4 获取电子招标文件 供应商持CA数字认证证书登录北京市政府采购电子交易平台获取电子招标文件。未在规定期限内通过北京市政府采购电子交易平台获取招标文件的投标无效。 七、对本次招标提出询问,请按以下方式联系。 1.采购人信息 名 称:北京市红十字血液中心 地址:北京市海淀区北三环中路37号 联系方式:石老师,82807673 2.采购代理机构信息 名 称:北京宏信天诚国际招标有限公司 地 址:北京市海淀区复兴路乙12号中国铝业大厦11层1110室 联系方式:闫文娟、吉国侠,010-52837446(购买文件)、010-63961210(项目咨询) 3.项目联系方式 项目联系人:闫文娟、吉国侠 电 话: 010-52837446(购买文件)、010-63961210(项目咨询) 血小板及HLA抗体检测试剂盒及安全输血室质量控制检测试剂耗材项目-公开招标公告-二次.docx × 扫码打开掌上仪信通App 查看联系方式 基本信息 关键内容:细胞计数器 开标时间:2023-11-22 09:30 预算金额:289.43万元 采购单位:北京市红十字血液中心 采购联系人:点击查看 采购联系方式:点击查看 招标代理机构:北京宏信天诚国际招标有限公司 代理联系人:点击查看 代理联系方式:点击查看 详细信息 [公开]血小板及HLA抗体检测试剂盒及安全输血室质量控制检测试剂耗材(二次)公开招标公告 北京市-海淀区 状态:公告 更新时间: 2023-11-01 招标文件: 附件1 [公开]血小板及HLA抗体检测试剂盒及安全输血室质量控制检测试剂耗材(二次)公开招标公告 2023-11-01 项目概况 血小板及HLA抗体检测试剂盒及安全输血室质量控制检测试剂耗材 招标项目的潜在投标人应在北京市政府采购电子交易平台获取招标文件,并于2023-11-22 09:30(北京时间)前递交投标文件。 一、项目基本情况 项目编号:11000023210200060319-XM001 项目名称:血小板及HLA抗体检测试剂盒及安全输血室质量控制检测试剂耗材 预算金额:289.4308 万元(人民币) 最高限价:289.4308 万元(人民币) 采购需求: 包号 标的名称 数量 采购包预算金额(万元) 简要技术需求或服务要求 1 血小板及HLA抗体检测试剂盒 130盒 50.7 用于血小板输注无效患者及免疫性血小板减少症患者血小板抗体HPA及血小板相关HLA抗体检测 2 血小板抗体检测试剂盒 132盒 52.8 用于血小板输注无效患者的血小板交叉配型 3 HLA-A、B、C、DRB1、DQB1基因PCR-SSOP流式磁珠分型试剂盒 700 份 49 用于骨髓库供受者HLA-A,B,C,DR,DQ基因中、高分辨分型、用于临床供、受者骨髓和器官移植组织配型、 HLA与疾病相关联检测等 4 HLA高分辨基因定型HLA-A、B、C、DRB1、DQB1测序分型试剂盒 840人份 119.3 用于供/受者骨髓配型HLA高分辨基因定型 5 五分类质控品(高、中、低值) 1.5ml×24×3(高、中、低值) 4.68 用于血细胞计数仪质控 6 厌氧培养瓶、需氧培养瓶 各50瓶/箱×16箱 7.2 用于血液制品抽检无菌试验 7 血凝仪试剂耗材 Clean A清洗液 500mL*4 5.0026 ACL Elite/Elite Pro血凝分析仪操作使用 rotors分析转盘 100/PKg *3 参比液 1L*4 定标血浆校准品 10*1mL*3 乏VIII因子血浆 10*1mL*5 活化的部分凝血活酶时间APTT 5*10mL*5 因子测定稀释液 3*100mL 血凝试剂质控品(正常中值) 10*1mL*3 8 pH计试剂 7瓶 0.1762 pH4.00校准品250mL/瓶×2pH7.00校准品250mL/瓶×2pH测定电极保养液250mL/瓶×3 9 吸管(塑料刻度移液管) 一批 0.572 2mL×20005mL×200 合同履行期限:合同执行期限为自签订之日起一年。 本项目不接受联合体投标。 二、申请人的资格要求: 1.满足《中华人民共和国政府采购法》第二十二条规定; 2.落实政府采购政策需满足的资格要求: 2.1 中小企业政策:本项目不专门面向中小企业采购。 2.2 其它落实政府采购政策的资格要求(如有): 无 3.本项目的特定资格要求: 3.1本项目是否接受分支机构参与投标:□是 ◆否; 3.2本项目是否属于政府购买服务: ◆否 □是,公益一类事业单位、使用事业编制且由财政拨款保障的群团组织,不得作为承接主体; 3.3其他特定资格要求(如有):1)本项目接受进口产品投标;2)投标产品如涉及药品,应提供国家食品药品监督管理局药品注册证,药品生产许可证或药品经营许可证。如为进口药品,还应提供中华人民共和国进口药品注册证;3)投标产品如涉及医疗器械,应提供中华人民共和国医疗器械注册证;4)投标人是制造商的应提供医疗器械生产许可证;投标人是代理商的应提供医疗器械经营许可证;5)投标产品如涉及标准物质及标准品,应提供国家质量监督检疫总局颁发的相应证书。 三、获取招标文件 时间:2023-11-01 至 2023-11-08 ,每天上午09:00至11:30,下午13:30至16:30(北京时间,法定节假日除外) 地点:北京市政府采购电子交易平台 方式: 供应商持CA数字认证证书登录北京市政府采购电子交易平台(http://zbcg-bjzc.zhongcy.com/bjczj-portal-site/index.html#/home)获取电子版招标文件。 售价:¥0 元,本公告包含的招标文件售价总和 四、提交投标文件截止时间、开标时间和地点 2023-11-22 09:30(北京时间) 地点:北京市海淀区复兴路乙12号中国铝业大厦11层1111会议室 五、公告期限 自本公告发布之日起5个工作日。 六、其他补充事宜 1.本项目需要落实的政府采购政策:《中华人民共和国政府采购法》(主席令第68号)、《关于中国环境标志产品政府采购实施的意见》(财库[2006]90号)、《国务院办公厅关于建立政府强制采购节能产品制度的通知》(国办发【2007】51号)、《关于开展政府采购信用担保试点工作的通知》(财库【2011】124号)、《关于印发《政府采购促进中小企业发展管理办法》的通知》(财库【2020】46号)、《财政部、司法部关于政府采购支持监狱企业发展有关问题的通知》(财库【2014】68号、《三部门联合发布关于促进残疾人就业政府采购政策的通知》(财库〔2017〕141号)等。 2.采用线上获取招标文件,线下递交纸质投标文件的方式: 2.1办理CA认证证书 供应商登录北京市政府采购电子交易平台查阅 “用户指南”—“操作指南”—“市场主体CA办理操作流程指引”,按照程序要求办理。 2.2注册 供应商登录北京市政府采购电子交易平台“用户指南”—“操作指南”—“市场主体注册入库操作流程指引”进行自助注册绑定。 2.3驱动、客户端下载 供应商登录北京市政府采购电子交易平台“用户指南”—“工具下载”—“招标采购系统文件驱动安装包”下载相关驱动。 2.4 获取电子招标文件 供应商持CA数字认证证书登录北京市政府采购电子交易平台获取电子招标文件。未在规定期限内通过北京市政府采购电子交易平台获取招标文件的投标无效。 七、对本次招标提出询问,请按以下方式联系。 1.采购人信息 名 称:北京市红十字血液中心 地址:北京市海淀区北三环中路37号 联系方式:石老师,82807673 2.采购代理机构信息 名 称:北京宏信天诚国际招标有限公司 地 址:北京市海淀区复兴路乙12号中国铝业大厦11层1110室 联系方式:闫文娟、吉国侠,010-52837446(购买文件)、010-63961210(项目咨询) 3.项目联系方式 项目联系人:闫文娟、吉国侠 电 话: 010-52837446(购买文件)、010-63961210(项目咨询) 血小板及HLA抗体检测试剂盒及安全输血室质量控制检测试剂耗材项目-公开招标公告-二次.docx