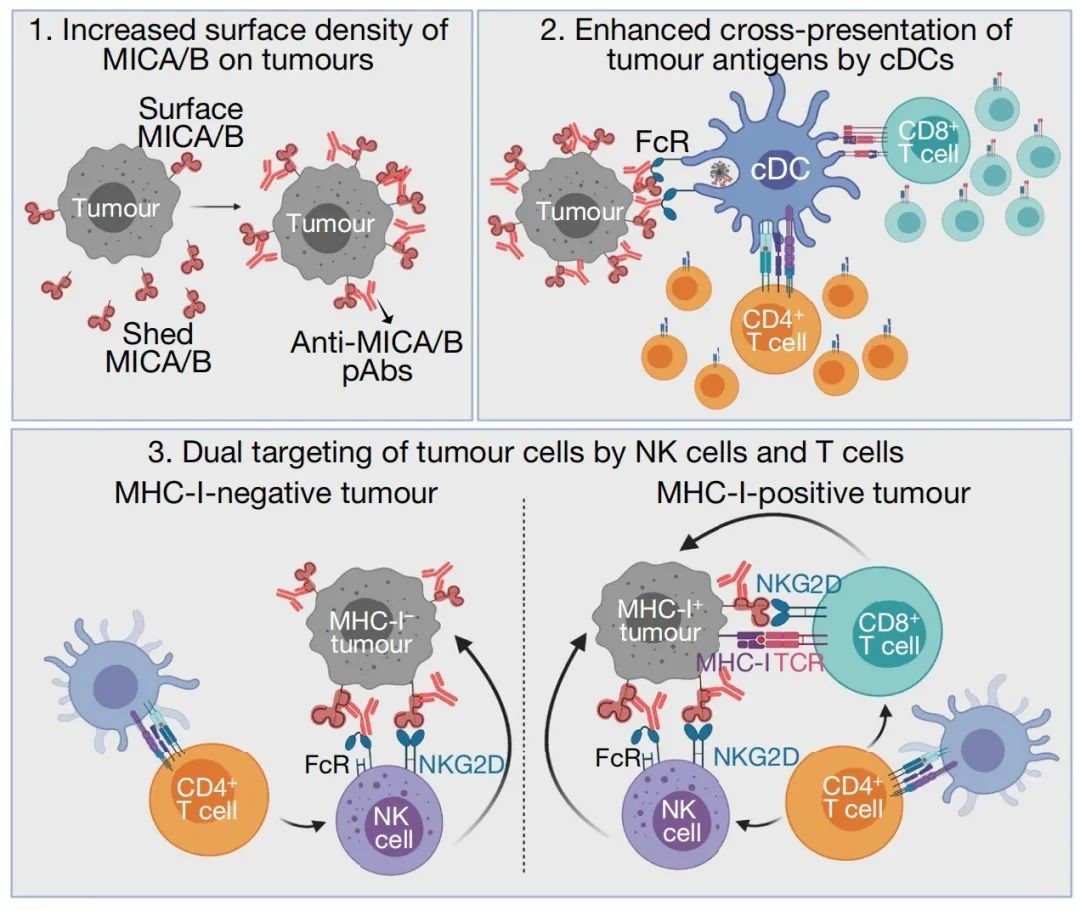
奥豪斯助力HPV疫苗生产, 加速中国宫颈癌疫苗国产化进程
浦东区新闻办9月27日发布消息, 沪东社区卫生服务中心和浦东和睦家医院已经开针,其他接种门诊也将从今天(9月27日)开始陆续配送。需要接种的女士可以去各接种门诊进行预约,告知门诊医生年龄、居住地等,预约成功后门诊接种医生会与您确认接种时间。 不用飞到国外去打疫苗,也无需连续往返三次在香港接种疫苗。现在,家门口的社区医院,就为需要接种的女士提供9价疫苗,为预防HPV病毒感染、宫颈癌多了一重保险。 你知道吗? 宫颈癌是女性常见的恶性肿瘤之一,在中国其发病率和死亡率在女性生殖系统恶性肿瘤中居第一位。在全球范围内每年大约有20万妇女死于这种疾病,2015年中国宫颈癌新发病例约十万人,死亡约三万人。宫颈癌是由人类乳头瘤病毒(HPV病毒)感染所致,可通过接种疫苗来预防,这是目前唯一病因明确,可早发现、早预防的癌症。 *请向医疗保健专业人士咨询以获得个人医疗建议中国HPV疫苗国产化进程随着葛兰素史克、默沙东等国际制药巨头入驻国内HPV疫苗市场,国内企业加快了HPV疫苗的研发生产进程。 利用新型重组疫苗研发平台,我国生物制药公司正在研发一系列新型重组疫苗产品,包括已经进入临床III期的二价人乳头状瘤病毒(HPV)疫苗、已申报临床的九价人乳头瘤病毒(HPV)疫苗以及其他多个市场前景良好的、处于临床前研究阶段的重组疫苗品种; 目前已在多地建立先进的生物技术药高端制造基地。后期会陆续完成宫颈癌疫苗国内防、治癌症等重大疾病的系列重磅产品投产上市。国产HPV疫苗旨在打破国外专利药市场垄断,填补国内需求空白,为中国患者提供急需的、物美价优的高端药品。 奥豪斯奋战国产疫苗第一线WHO对HPV疫苗质量、安全性及有效性指导原则生产建议:生产必须符合GMP要求,生物安全上要求无菌。不同类型HPV L1 VLP应分别生产。同时,还要有充分的清洁验证。抗原生产过程,须验证以证明生产的稳定性,至少要连续三批。但如两种蛋白的纯化步骤一样,可只用验证一种。生产一致性评估应包括关键质量参数评估及它们相应的特征,宿主DNA与HCP清除、工艺过程系数如柱负荷。不同批次抗原蛋白生产过程验证应与之前HPV VLP生产的规格保持一致,如抗原特性和纯度。 一. 检测DNA残留含量宿主细胞DNA(Host Cell Proteins)在具有商业规模的生物药品中,治疗性蛋白药物在细胞培养中的表达是一种比较便宜有效的方法。但是这些产品在生产和纯化过程中,很容易引起宿主细胞DNA残余污染。尽管残余宿主细胞DNA对治疗性蛋白药物的影响在很大程度上还是未知的,但是也有研究表明宿主细胞DNA可能包含一些有害的DNA片段,使其具有传染性和致瘤性。因此,在生物制药中,对宿主细胞DNA的检测是非常有必要的。 二. 检测方法:杂交法(Hybridization-based)根据宿主DNA序列设计DNA探针用于测定产品中配对DNA 的数量。双链DNA被变性成单链后固定在尼龙膜或硝化纤维膜上,DNA探针被放射或荧光随机掺入标记以后,与膜上固定的样品宿主DNA杂交结合,并在胶片或成像仪对应位置中显现斑点。对于荧光标记的探针,斑点的光密度结果可以在仪器中定量分析。斑点光密度对应结合在目标DNA上的探针数,进而推测出残留DNA 的数量。通过目测方法可以半定量地检测样品中残留DNA,仪器读片可以对应斑点光密度绘制标准曲线,对应检测结果更加准确。奥豪斯恒温培养3D波动摇床闪亮登场!实验室中通过杂交法来检测DNA残留含量,其中的步骤之一,就是在双链DNA被变性成单链后固定在尼龙膜或硝化纤维膜上,DNA探针被放射或荧光随机掺入标记以后,与膜上固定的样品宿主DNA杂交结合,并在胶片或成像仪对应位置中显现斑点。奥豪斯恒温培养3D波动摇床就是用于清洗尼龙膜。该尼龙膜用SCS+10%SDS溶液作为清洗缓冲液清洗, 置于恒温62℃的3D波动摇床内,匀速摇匀。 奥豪斯3D波动恒温培养摇床用于在高于环境温度5°至65°C培养的样品,以提供准确可重复的结果。3D波动摇床可提供顺畅、样品不易气泡的3D“波动”摇荡。所有型号均配有带有触摸板控制器的LED显示器以及配有安全特征,可保护用户和样品。小编就带您来了解一下吧。 1. LED显示屏通过触摸平板进行控制,并带有易于读取的独立温度、速度和倾斜度以及时间LED显示屏,操作人员可同时查看所有设置。始终提供可重复和准确的结果,在实验室工作台即可轻松查看。定时器将显示已用时间,也可将其编程为用户定义的限值,从而在时间达到零时自动关闭装置。显示屏将显示上一次使用的设置,即使断电后也可显示。 2. 微处理控制器微处理器控制提供了电动倾斜度调节,让用户能够在装 置运行的同时轻松地将摇摆角度从0调节到15°。精确的速度控制功能, 不仅能够保证震荡的均匀性,而且最低可达1 rpm。 3.PID温度控制器在+5°C至65°C的环境温度下可实现精确的温度控制。使用简便的控件让用户能够以1°C为增量调节温度。 除此以外,奥豪斯摇床还专门在安全保障体系方面做了贴心的设计:l 过载保护:当系统检测到障碍物或托盘过载时,将发出声光信号。l 加速保护:将速度缓慢升至目标设定值,以免溅出。l 警报器:在定时模式下,当时间达到零值时,警报器将发出声音。l 当心高温指示器:将腔体内空气温度达到40°C时符号将亮起,并在温度冷却下来之前一直保持亮起状态。l 防溢设计:通过引导使流体远离内部组件。l 聚碳酸酯盖:允许查看样品,且不干扰内部温度。 自2017年10月以来,国家相关部门鼓励医药药品创新,化解临床实验难题,支持临床研究机构的发展,激励临床研究的创新。着重针对重点改革临床实验管理,加快审核审评制度,努力创新,放管结合。特别是对药品的临床机构实现管理,未来会取消一次性资格认定。同时,第三方评估进行机构认证,鼓励社会力量进行临床实验机构的建设。支持临床实验机构人员开展实验,医学科研院所、医学院校开展临床实验,配备职业化的临床实验研究者。允许境外企业或者科研机构跟境内企业、科研就够依法同步开展实验临床。一系列新政的出台,正使得我国疫苗产业与国际上的差距越来越小。HPV疫苗的自主研发成功,为抗HPV肿瘤癌变及癌细胞转移复发和尖锐湿疣治疗,提出了全新的解决方案,为广大患者提供了有效治疗途径。*请向医疗保健专业人士咨询以获得个人医疗建议 HPV 你问我答HPV 是什么?HPV即人乳头瘤病毒(Human Papillomavirus),是某一类型病毒的统称,可以分为致癌型和非致癌型。致癌型可以引起宫颈癌及相关的癌前病变;非致癌型主要引起低度的宫颈病变以及生殖器疣。大部分生殖器感染了HPV后都可以自愈,但如果感染致癌型HPV并持续感染,就有可能引发宫颈细胞病变,这种病变可能导致宫颈癌。全球范围内,99%的宫颈癌与HPV感染有关。 HPV感染有多常见?和感冒一样,HPV感染也非常普遍。大约80%的女性一生都会感染HPV,但是,大部分的感染在一两年内可自动消除或被自身免疫力抑制,不会引起任何病变,无需治疗。 哪些人可能感染HPV? 80-90%有性生活的女性一生中都会被HPV感染,而且可能反复感染HPV,也可能同时感染多种不同型别的HPV。使用安全套可以降低感染的可能性,但却不能完全阻止HPV的传播。 HPV 的传播途径?HPV 主要通过性行为传播。仅有一小部分HPV感染者会发生宫颈癌,且此过程需10 年或更久。 如果感染了HPV,患宫颈癌的机率有多大? 致癌性HPV 基因型的持续感染与宫颈癌的发生密切相关。全球每年宫颈癌新发病例约52.8 万例,26.6 万人因此而死亡。在侵袭性宫颈癌患者中HPV-16 和HPV-18 是最常见的HPV 基因型,约占所有宫颈癌病例的70%。HPV 感染的其他表现还包括阴道、外阴、阴茎、口咽部和肛门的癌症。此外,HPV-6 和HPV-11 可引起肛门和生殖器疣以及复发性呼吸道乳头状瘤病。大多数HPV 所致病变的受害者见于资源匮乏地区的成年女性,超过80%的宫颈癌病例发生于不发达区域,其死亡率在发达国家和发展中国家之间的差异达18 倍。一些国家由于适当实施了宫颈癌筛查项目,宫颈癌死亡率降低。 HPV疫苗有什么作用?“价”代表了疫苗可预防的病毒种类。目前已有三种HPV 疫苗上市:九价疫苗,四价疫苗和二价疫苗,均基于通过重组DNA 技术获得的非感染性病毒样颗粒(virus-like particles,VLPs)。四价疫苗含针对HPV-6、HPV-11、HPV-16 和HPV-18 的VLPs,而二价疫苗仅针对HPV-16 和HPV-18 两型。9价HPV疫苗针对HPV6、11、16、18、31、33、45、52、58九种亚型,是目前覆盖HPV型别最多的疫苗,能够预防90%的宫颈癌和其他因HPV病毒引起的相关疾病。三种疫苗在预防相应HPV 基因型所诱发的癌前病变和其他肛门和生殖道病变方面均具备极佳的安全性和效力,对HPV-16/18 相关感染及其所致宫颈病变的保护效力已证明至少可持续8 年。截至2014 年8 月,已有58 个国家(占全球国家的30%)在本国的免疫规划中针对女孩接种HPV 疫苗。 HPV疫苗的接种注意的具体事项请参照当地的产品说明书,并咨询医疗保健专业人士。本信息仅供参考。 接种HPV疫苗有年龄限制吗?由于HPV 疫苗用于无疫苗相关HPV 基因型暴露史的女性最为有效,年龄不是最重要的,只要没有性行为,或者有性行为但没有感染HPV,或者HPV感染已经治愈,接种疫苗都是有效的。根据官方说明,疫苗适宜接种人群为9到45岁的女性,以及9到15岁的男性。其实疫苗适用于9岁以上的人群,这是根据美国人群第一次性接触年龄以及频繁度推算出来的。 就二价疫苗,四价疫苗和九价疫苗而言, 世卫组织建议建议年满15岁的女性采用3 剂次接种程序(0、1- 2、6 个月)。最大间隔时间不超过12-15 个月,以在进入性活跃期之前及早完成接种程序。如两个剂次的间隔时间短于5 个月,则应在接种首剂后至少间隔6 个月再接种第3 剂。 *请向医疗保健专业人士咨询以获得个人医疗建议奥豪斯作为一家拥有百年经验的仪器厂商,致力于与更多的客户分享优质的产品和服务,让奥豪斯的产品助力客户获得共同成长。在中国,疫苗创新与生产正在快速发展,奥豪斯也一直着力中国本地研发能力,帮助客户不断提升生物制药的研发能力。我们非常高兴看到越来越多的中国企业不断创新并加速其国际化进程。今后,我们将继续与本土合作伙伴在广泛生物制药以及精准医疗等领域不断合作,深化合作。 如果您想了解奥豪斯恒温培养3D波动摇床的详情,请拨打电话奥豪斯销售服务专线「4008-217-188」或者进入「阅读原文」,留下您的信息,我们的专业工程师将竭诚为您服务! 参考文献:1. WHO. Comprehensive Cervical Cancer Control: A Guide to Essential Practice: WHO Guidelines Approved by the Guidelines Review Committee. Comprehensive Cervical Cancer Control: A Guide to Essential Practice. Geneva: World Health Organization Copyright (c) World Health Organization 2014. 2014. 2. Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015. CA: a cancer journal for clinicians 2016 66(2): 115-32.3. 国家卫生和计划生育委员会. 宫颈癌及癌前病变规范化诊疗指南(试行). In: 国家卫生和计划生育委员会, editor. Beijing: 国家卫生和计划生育委员会办公厅 2013. p. 34. 4. 乔友林, 赵宇倩. 宫颈癌的流行病学现状和预防. 中华妇幼临床医学杂志(电子版) 2015 (02): 1-6. 5. Lei T, Mao WM, Lei TH, et al. Incidence and mortality trend of cervical cancer in 11 cancer registries of china. Chinese journal of cancer research = Chung-kuo yen cheng yen chiu 2011 23(1): 10-4. 6. Cai HB, Liu XM, Huang Y, et al. Trends in cervical cancer in young women in Hubei, China. International journal of gynecological cancer : official journal of the International Gynecological Cancer Society 2010 20(7): 1240-3. 7. Allemani C, Weir HK, Carreira H, et al. Global surveillance of cancer survival 1995-2009: analysis of individual data for 25,676,887 patients from 279 population-based registries in 67 countries (CONCORD-2). Lancet (London, England) 2015 385(9972): 977-1010.8. Sawaya GF, Kulasingam S, Denberg TD, Qaseem A. Cervical Cancer Screening in Average-Risk Women: Best Practice Advice From the Clinical Guidelines Committee of the American College of Physicians. Annals of internal medicine 2015 162(12): 851-9. 9. Moscicki AB, Schiffman M, Burchell A, et al. Updating the natural history of human papillomavirus and anogenital cancers. Vaccine 2012 30 Suppl 5: F24-33. 10. Stanley. A.Plokin WAO, Paul A. Offit. Vaccines, Fifth Edition. Singapore: Elsevier ( Singapore) Pte Ltd 2011. 11. GSK. 希瑞适® 产品说明书(2016年7月12日核准). 2016. 12. Dunne EF, Markowitz LE. Genital human papillomavirus infection. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 2006 43(5): 624-9. 13. Bosch FX, Broker TR, Forman D, et al. Comprehensive control of human papillomavirus infections and related diseases. Vaccine 2013 31 Suppl 7: H1-31. 14. Zhao FH, Lewkowitz AK, Hu SY, et al. Prevalence of human papillomavirus and cervical intraepithelial neoplasia in China: a pooled analysis of 17 population-based studies. International journal of cancer Journal international du cancer 2012 131(12): 2929-38. 15. 孙晓冬 刁. 人乳头瘤病毒疫苗. 实用疫苗学.16. 湖州申科生物技术有限公司, 中国科学院上海生命科学研究院湖州营养与健康产业创新中心.宿主细胞DNA 残留检测技术培训手册.2016 年12 月17. 世界卫生组织关于人乳头瘤病毒(HPV)疫苗的立场文件:内容提要18. GUIDELINES TO ASSURE THE QUALITY, SAFETY, AND EFFICIENCY OF RECOMBINANT HUMAN PAPILLOMAVIRUS VIRUS-LIKE PARTICLE VXCINNES HPV19. 吴浩飞综述,黄仕和孟胜利审校,生物制品残留DNA分析技术的研究进展, 国际生物制品学杂志2013年2月第36卷第1期Int J Biologicals。February 2013,Vo1.36。No.1