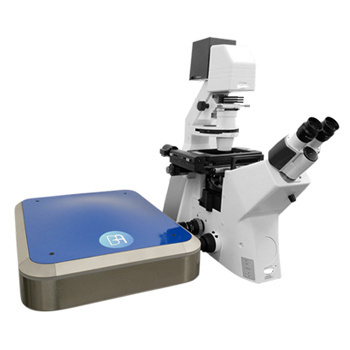
abbelight发布3D超分辨成像系统新品
3D单分子荧光成像系统 abbelight SAFe360是一款基于单分子定位的显微成像(SMLM)的3D单分子成像系统,它独有的DAISY技术整合了散光技术和超临界角光技术,能够极大的提高定位精度,达到最高的xyz同时15nm的定位精度,可以提供清晰度最高的三维的亚细胞结构图像,最高同时四色成像观测,可以实时研究不同的结构功能蛋白的共定位信息,在单分子水平研究分子动力学反应以及细胞间的相互作用等。3D单分子荧光成像系统-SAFe 360 设备参数 + 成像模式:PALM、STORM、PAINT、smFRET 、SPT+ 光源模式:Epi、TIRF、HILO+ 最高分辨率:15 nm的XYZ轴分辨率+ 超大视野:200 × 200 μm2的视野+ 一次可同时采集1.2 μm深度图像信息+ 最高图像深度:10 μm+ 实时漂移矫正+ 最高四色同时成像+ 活细胞成像模式 加装TIRFPALMSTORMSPTsmFRET...... 兼容ConfocalSpinning-DeskWidefieldSIMSTED Now We See...... 3D线粒体结构核孔复合物老鼠海马神经元微管蛋白网络 配套试剂 Smart kitCompatible dyes• 10 doses per box• 200 μL per dose• 30 sec prepartion• 2 months in a fridge• 2 weeks on sample• Atto 488, WGA-AF® 488• AF® 532, CF® 532, Cy3b• AF® 555, AF® 594, CF® 555, AF® 568, CF® 568, Cy5, MemBriteTM 568, TMR• AF® 647, CF® 647, AF® 680, CF® 680, MemBriteTM 640, Actin-stain 670, SiR647 发表文献列表 [1] Cabriel, Clément, et al. "Combining 3D single molecule localization strategies for reproducible bioimaging." Nature communications 10.1 (2019): 1980.[2] Woodhams, Stephen G., et al. "Cell type–specific super-resolution imaging reveals an increase in calcium-permeable AMPA receptors at spinal peptidergic terminalsas an anatomical correlate of inflammatory pain." Pain 160.11 (2019): 2641-2650.[3] Belkahla, Hanen, et al. "Carbon dots, a powerful non-toxic support for bioimaging by fluorescence nanoscopy and eradication of bacteria by photothermia." Nanoscale Advances (2019).[4] Denis, Kevin, et al. "Targeting Type IV pili as an antivirulence strategy against invasive meningococcal disease." Nature microbiology 4.6 (2019): 972.[5] Szabo, Quentin, et al. "TADs are 3D structural units of higher-order chromosome organization in Drosophila." Science advances 4.2 (2018): eaar8082. [6] Boudjemaa, Rym, et al. "Impact of bacterial membrane fatty acid composition on the failure of daptomycin to kill Staphylococcus aureus." Antimicrobial agents and chemotherapy 62.7 (2018): e00023-18.[7] Culley, Sian, et al. "Quantitative mapping and minimization of super-resolution optical imaging artifacts." Nature methods 15.4 (2018): 263.[8] Berger, Stephen L., et al. "Localized myosin II activity regulates assembly and plasticity of the axon initial segment." Neuron 97.3 (2018): 555-570.[9] Cabriel, Clément, et al. "Aberration-accounting calibration for 3D single-molecule localization microscopy." Optics letters 43.2 (2018): 174-177. [10] Bouissou, Ana?s, et al. "Podosome force generation machinery: a local balance between protrusion at the core and traction at the ring." ACS nano 11.4 (2017): 4028-4040. [11] Sellés, Julien, et al. "Nuclear pore complex plasticity during developmental process as revealed by super-resolution microscopy." Scientific reports 7.1 (2017): 14732.[12] Bourg, Nicolas, et al. "Direct optical nanoscopy with axially localized detection." Nature Photonics 9.9 (2015): 587. 创新点:SAFe 360是一款基于单分子定位的显微成像(SMLM)的3D单分子成像系统。它独有的DAISY技术整合了散光技术和超临界角光技术,能够极大的提高定位精度,达到最高的xyz同时15nm的定位精度,可以提供清晰度最高的三维的亚细胞结构图像,最高同时四色成像观测,可以实时研究不同的结构功能蛋白的共定位信息,在单分子水平研究分子动力学反应以及细胞间的相互作用等。 3D超分辨成像系统