[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=72752]清开灵注射液中的黄芩苷[/url]
【作者】 李慧; 姚惠芬(广州市药品检验所六分所; 广州市花都区人民医院 广东广州510800; 广东广州510800)【摘要】 目的:比较HPLC法和紫外分光光度法测定清开灵注射液中黄芩苷的含量。方法:十八烷基硅烷键合硅胶为填充剂,色谱柱Diamonsil C18(4.6mm×250mm,5μm),以甲醇-水-磷酸(47:53:0.2)为流动相,流速为1.0ml/min,检测波长为276nm。结果:清开灵注射液中黄芩苷在10~70μg/ml浓度范围内呈良好的线性关系,平均回收率为99.1%,RSD=0.75%(n=6)。结论:HPLC法较紫外分光光度法简便、快速、准确、可靠,可以作为清开灵注射液含量控制的有效方法。谱图:无
我测的是注射液里的钠,钾,铯,可是注射液里有葡萄糖和枸橼酸,是不是必须硝化啊,硝化的方法在那里着找啊,我是新手,忘各位前辈指点指点。我在一些专利网上没有查到。
注射液是常用的药品之一,而且因其药效迅速、作用可靠,正越来越广泛地应用于临床。因注射液直接进入血液,对其无菌性的要求非常高,《中国药典》规定,注射液中不应含有任何活的微生物,这就需要抗氧剂来帮忙。那么在注射液中常用的抗氧剂 有哪些?
近日有群友求助,群里尚未有人应答,现在版面上贴出,希望有人予以回应: 依据依######注射液处方,配制#####注射液作为制剂空白。精密量取B、Mg、Al、K、Ca、Cr、Fe、Zn、Ba、As、Cd、Pb、Co、Ti、Mn、Sb标准液适量于10ml量瓶中,用1%硝酸稀释至刻度,得对照储备液精密量取对照储备液适量于50ml量瓶中,加入制剂空白溶液10ml, 1%硝酸稀释至刻度,得系列浓度溶液。以含20%制剂空白的1%硝酸溶液为标准空白溶液。测定标准空白溶液和标准溶液系列,仪器自动绘制标准曲线。然后根据此线性进行样品测定,及方法学考察。不知这样的做法是否有不妥的地方?
多多药业有限公司生产的双黄连注射液被叫停。今天,国家食品药品监督管理局在其网站上发出通知,要求各地暂停销售使用标示为多多药业有限公司生产的双黄连注射液。 16日,国家药品不良反应监测中心报告称,标示为黑龙江多多药业有限公司生产的双黄连注射液在使用中出现严重不良事件。为确保公众用药安全,决定暂停销售和使用标示为多多药业有限公司生产的双黄连注射液。 目前,国家食品药品监督管理局和卫生部正在对该事件发生的原因进行调查。 大家对此事件如何看待的,有什么想法、看法、观点,说说,晒晒![em09502]
喜炎平脉络宁注射液引起严重过敏2012年06月27日08:47新华网国家食品药品监督管理局26日发布通报,提示生产企业和医患人员关注喜炎平注射液和脉络宁注射液引起严重过敏反应的问题。据了解,喜炎平注射液的成分是穿心莲内酯磺化物,主要用于解热消炎。2011年,国家药品不良反应监测中心病例报告数据库有关喜炎平注射液的病例报告数共计1476例,其中涉及14岁以下儿童报告达1048例。主要不良反应表现为过敏样反应、过敏性休克、紫绀、呼吸困难等。脉络宁注射液是2009版国家基本药目录品种,其功能与主治为清热养阴、活血化瘀。用于血栓闭塞性脉管炎、动脉硬化性闭塞症、脑血栓形成及后遗症、静脉血栓形成等。2011年,国家药品不良反应监测中心病例报告数据库共收到有关脉络宁注射液药品不良反应病例报告1500例,其中严重病例报告189例。严重不良反应主要为呼吸系统损害、全身性损害和心血管系统损害等。国家食品药品监管局建议,由于这两种注射液易发生过敏反应,建议医护人员在用药前详细询问患者的过敏史,特殊人群和过敏体质者应慎重使用。使用时应严格按照说明书规定的用法用量给药,不得超剂量使用;谨慎联合用药。如确需联合使用其他药品时,应谨慎考虑与此两种药品的间隔时间以及药物相互作用等问题。对于药品生产企业,国家食品药品监管局建议,加强临床合理用药的宣传,确保产品的安全性信息及时传达给患者和医生;完善生产工艺、提高产品质量标准,开展相应安全性研究。(新华网)
想配制一个不含主药成分的注射液空白,看了下某注射液的辅料,为丙二醇,但没写浓度。有人告诉我大概就按照1%~10%的浓度配制这个辅料溶液就可以了,但我一估算,主药成分是10ml:0.1g,相当于1%的浓度。想不到名为辅料,这个浓度居然跟主药浓度相当甚至还超过啊,所以有点吃不准,特来请教各位老师,还望赐教。
中药注射剂浴火重生2010-02-26 来源:中国医药报 是生存,还是毁灭?如今哈姆雷特式的命题摆在了中药注射剂生产企业的面前。 2月6日,由山西太行药业牵头,中国中药协会主持, 北京康派特医药经济技术研究中心组织的生脉注射液、清开灵注射液安全性再评价专家论证及项目启动会在北京召开。 一场中药注射剂自救与新生的战役已悄然打响。 抱团取暖 据业内人士估算,目前中药注射剂的国内市场年销售额有200亿元左右,许多品种被临床广泛认可,大范围使用。然而,随着近年来中药注射剂因种种原因发生多起不良反应事件,社会对中药注射剂安全性发出质疑,中药注射剂存废之争浮出水面。 2009年7月,国家食品药品监督管理局(SFDA)印发了《关于做好中药注射剂安全性再评价工作的通知》。通知明确,国家局组织制定《中药注射剂安全性再评价质量控制要点》(以下简称《质量控制要点》),中药注射剂生产企业必须对照《质量控制要点》要求,全面排查本企业在药品生产质量控制方面存在的问题和安全风险,主动采取有效措施,切实控制安全风险,提高产品质量。随后,中国中药协会着手搭建中药注射剂安全性再评价研究平台。生脉注射液和清开灵注射液安全性再评价是中药协会中药注射剂安全性再评价平台上首个课题研究项目。 生脉注射液和清开灵注射液均为国家基本药物目录品种,前者同时还是国家保护品种。按照SFDA的要求,参麦(两味为参麦,三味为生脉)注射液和清开灵注射液为首批安全性再评价品种,两者的市场容量高达几十亿元,全国有十几家主要生产企业。山西太行药业股份有限公司董事长李林葆表示,中药注射剂是传统中药的创新产物,该品尽管生产时间较长,临床疗效确切,应用广泛,但在标准、临床研究等方面存在不足,亟待改善和提高。生脉注射液和清开灵注射剂双双入围基本药目录,说明老百姓认可这两个产品,同时也要求生产企业必须保障产品的安全,启动安全性再评价已经迫在眉睫。 此次,生脉注射液和清开灵注射液主要生产企业太行药业、四川川大华西药业、云南个旧生物药业、正大青春宝药业、四川升和制药,以及国内科研院所中国药品生物制品检定所(以下简称 “中检所”)、国家药物安全评价监测中心、北京大学、中国中医科学院、军事医学科学院、广安门医院、东直门医院、中日友好医院等携手参与该课题研究。对此,北京康派特医药经济技术研究中心主任李磊评价认为,中药注射剂安全性再评价工作投入较大,且面临不少困难,现在许多同品种企业开始抱团取暖,共渡难关。 直面难题 事实上,中药注射剂安全性再评价的难度比人们想象的大得多,仅技术层面就要面对许多开创性工作。项目启动会上,专家的忧虑弥漫会场。 中检所中药民族药标准研究与检测中心主任林瑞超等专家认为,中药注射剂安全性再评价难度较大。以清开灵注射液为例,由于组方药味复杂(含植物药、动物药、矿物药和提取物),物质基础研究是其药学研究的难点,所有原料、中间体、制剂的质量控制必须建立在大类物质成分清楚的前提下,特别是涉及“炮制”的原料更需要加强物质基础研究,只有在物质基础明晰的前提下,才有可能进行中药注射剂致敏原探索研究,盲目上马进行临床有效性和安全性再评价是不科学的。林瑞超强调,本次的安全性再评价必须增加含量测定项目,提高标准,含测项必须进行上、下限规定。例如,清开灵注射液中绿原酸既是有效成分又是致敏原,若不进行上限规定,安全性难以保障。 中国中药协会会长房书亭认为,在中药注射剂安全性再评价中,生产企业面临四方面的难题:一是中药注射剂药学、非临床工作基础研究较少,90%以上的临床工作基本未开展,产品本身就存在先天缺陷;二是此次中药注射剂安全性再评价工作要求很高,SFDA已经下决心淘汰掉一部分研究水平低、安全性问题严重的产品,这会给产业带来巨大震荡;三是目前很多中药注射剂的生产工艺、质量标准差别很大,与法定标准大多不一致,多家生产,多家标准,国家安评任务要求在基本统一工艺的基础上再提高中药注射剂的质量标准、有效性和安全可控性;四是此次中药注射剂安全性再评价涉及到药品生产的各个环节,药学、非临床、临床研究同时进行,是一项复杂的工程,各部门必须协作联动,实现资源合理配置。中药注射剂安全性再评价课题研究组成立,希望能给企业提供一种研究方向和合作共享的研究模式。 据了解,由于中药注射剂标准不统一,各企业工艺标准相差甚远,曾出现过同一品种8个主要生产企业、7个生产工艺的现象,企业间利益博弈非常激烈。 李磊表示,建立安全性评价研究平台的基础就是形成合力,共同提高。在统一标准中难免有的企业受到“伤害”,有的企业被迫退出。 积极闯关 产业升级、淘汰落后无疑是安全性再评价希望达到的一大目的,也因此搅动了全行业的神经。李林葆将药品安全性再评价比喻为企业的“二次重生”。这也代表了大多数加入到安评行列中的企业的心态。 按照中药注射剂安全性评价要求,中药注射剂临床研究必须完成安全性、有效性和用药方案三部分的研究工作,总研究病例数在3万例以上。一般估算,一个品种通过安全性评价起码要1500万元。业内人士认为,长期以来正是中药研究的高投入迟滞了中药产业科技进步的脚步,而今天安全性再评价已关乎企业产品的生死存亡,因而显得十分紧迫。 据了解,为提高产品质量,各企业生产层面调整早已开始。比如,目前多数中药注射剂生产企业原水针车间虽然有国家GMP认证证书,但最终灭菌温度F0均小于8,不能完全保证制剂达到无菌水平。针对这一情况,太行药业已对水针车间进行了技术改造,改单机灌装为联动线灌装,灌装区域为百级条件无菌灌装。太行药业、正大青春宝药业等还对原药材进行质量控制:生脉注射液所用红参、五味子、麦冬三味药材,清开灵注射液所用的金银花、栀子等均采用国家GAP药材种植基地药材;提高了这两个品种的质量控制标准;分别对生脉和清开灵注射液进行了指纹图谱研究,这对质量控制起到关键性作用。此外,各安评企业还及时完善细化说明书,在所有基础研究完成的基础上,重新修订说明书,完善如不良反应、禁忌、注意事项、特殊人群用药等项目,为医生提供完善的临床用药指南。 事实上,知难而退,审时度势也已成为不少企业的选择。一位业内人士透露,某企业原有十几个中药品种,现在仅对其中两个品种加大投入进行安全性再评价,其他注射剂全部被放弃。把钱用在刀刃上,把好品种做得更好!业内评价认为,这种“自然状态的”优胜劣汰正是产业走向健康理性的开始。而对于中药企业来说,产品安全性再评价的热情和投入也有了可预期的回报。 神威药业是参麦注射液和清开灵注射液主要生产企业。早在去年9月,该企业已经率先启动参脉注射液上市后安全性再评价工作,至今已累计投入上千万元,其起草的提高后的标准已上报国家药典委员会。除参麦注射液外,神威清开灵注射液、舒血宁注射液等其他十余个中药注射剂品种的再评价工作也于去年全面启动,预计总投入将超亿元。神威药业董事长李振江表示,SFDA启动中药注射剂安全性再评价工作,是规范中药注射液行业、促进其科学发展的举措。作为中药注射剂生产领军企业,神威药业责无旁贷,坚决支持这一行动。清开灵注射[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]量提升研究,必定为今后将该品打造成上10亿元的大品种夯实基础。 无论是企业的抱团取暖,还是大企业的率先行动,都充分显示中药注射剂安全性再评价已开启中药与现代科学交汇的大门。 房书亭表示,中国中药协会课题组组织同品种多家生产企业共同参与协调标准,寻求标准的基本统一且保留相对独特的技术要点的做法是一项十分重要而又迫切的工作。否则的话,同品种、多标准、多工艺的问题将阻碍中药注射剂安全性再评价工作的快速推进。希望企业以大局为重,共渡难关,提升标准。 李磊认为,在中药注射剂安全性再评价工作困难重重的情况下,中国中药协会把有责任感的企业和有志于进行中药注射剂安全性再评价研究的专家聚集在一起,搭建一体化、系统化的中药注射剂研究平台,制定顶端的、系统的研究方案和实施步骤,是推进当前中药注射剂安全性再评价工作的有效路径。 协会搭台唱戏,科研机构鼎力相助,企业积极参与,构成了今天推动中药注射剂安全性再评价工作的合力。尽管这些还仅仅是个开始。
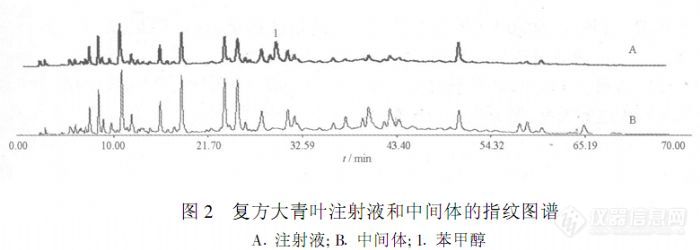
【作者中文名】刘瑞; 刘志刚; 李磊; 任冲; 袁波; 李发美;【作者英文名】LIU Rui; LIU Zhi-gang; LI Lei; REN Chong; YUAN Bo; LI Fa-mei(School of Pharmacy; Shenyang Pharmaceutical University; Shenyang 110016; China);【作者单位】沈阳药科大学药学院; 沈阳药科大学药学院 辽宁沈阳; 辽宁沈阳;【摘要】目的:采用HPLC建立复方大青叶注射液的指纹图谱测定方法。方法:采用Diamonsil C18色谱柱,甲醇-水-磷酸为流动相进行梯度洗脱,流速1.0 mL.min-1,检测波长254 nm。结果:建立了复方大青叶注射液的HPLC对照指纹图谱,标示了注射液中的20个共有峰,并初步确定注射液的相似度阈值为0.85。结论:该方法准确、重复性好,为复方大青叶注射液的质量控制提供了依据。http://ng1.17img.cn/bbsfiles/images/2012/08/201208131758_383604_2379123_3.jpg
土霉素注射液用高效液相怎么检测?谢谢!
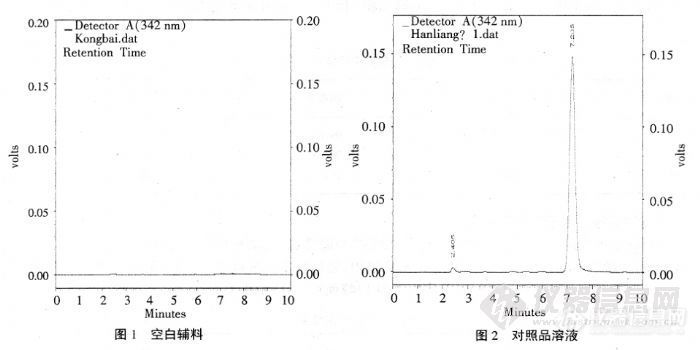
标题:5.1 甲钴胺注射液含量的方法学研究作者:常 明 1, 李 晶 1, 武玉洁 2, 张文双 2( 1.石家庄学院 化工学院, 河北 石家庄 050035; 2.石家庄栢奇制药有限公司, 河北 石家庄 050035)摘要: 摘 要: 以乙腈- 甲醇- 0.05 mol /L磷酸二氢钾溶液( 10∶ 20∶ 70) (用磷酸调节 pH 值为 4.0)为流动相, 采用迪马钻石 C18( 250 mm× 4.6 mm, 5 μ m)色谱柱及紫外检测器, 建立了甲钴胺注射液中甲钴胺含量的反相高效液相色谱检测方法. 柱温: 40℃; 检测波长为 264 nm; 流速: 1.0 mL /min. 本方法测定的日内精密度为 0.59%, 日间精密度为 0.67%, 回收率为 99.7%~ 100.5%, 在 160~ 240 μ g /mL范围内线性关系满足要求( r=0.999 9) ; 结果表明方法准确、 操作简单、 专属性强, 可用于定量测定甲钴胺注射液含量.http://ng1.17img.cn/bbsfiles/images/2012/07/201207161648_377914_2379123_3.jpg
看到氢化可的松注射液的辅料里有乙醇和注射用水,想扣除辅料干扰就得配制相应浓度的辅料,谁能透露下,这处方里头的乙醇大概浓度多少啊? 叩谢各位大大。
【中国药典】从1985年版至1995年版均采用显微镜法检查注射液中的不溶性微粒。检查≥10μm与≥25μm两档,与美国药典标准基本相同。在2000年版【中国药典】显微镜法检查注射液中不溶性微粒的基础上增加了第二法----光阻法。在2005年版【中国药典】中增加了对小剂量注射液的检测。【中国药典】2005年版初稿对注射液中不溶性微粒污染的监控作了修订,将光阻法修订为第一法,显微镜法为第二法。修订后的结果判定也与美、英、欧共体、日本基本一致。原文来自:http://pssnicomp.cn/zhuanti.html
复方氨基比林注射液说明书(兽用)【兽药名称】通用名:复方氨基比林注射液 英文名:Compound Aminophenzone Injection 汉语拼音:Fufang Anjibilin Zhusheye【主要成分】为氨基比林与巴比妥混合制成的灭菌水溶液。含氨基比林7.15%和巴比妥2.85%。【性 状】本品为无色或淡黄色的澄明液体。【药理作用】本品给药后即时产生镇痛作用,其解热镇痛作用强而持久,氨基比林与巴比妥合用能增强其镇痛作用,有利于缓解疼痛症状。本品还有抗风湿和消炎作用。半衰期为1~4小时。【适 应 症】用于发热性疾患、关节炎、肌肉痛和风湿症等。【用法用量】 肌内、皮下注射:一次量,马、牛20~50mg;羊、猪5~10mg。【注意事项】连续长期应用可引起粒性白细胞减少症,应定期检查血象。【停 药 期】28日,弃奶期7日。【有 效 期】二年【规 格】10ml【包 装】10ml /支×5支/盒【贮 藏】遮光、密闭保存。
中药注射液的前途渺茫还是?大家说说看[em0801]
中药注射液,确切的说我要做香丹注射液的重金属及有害元素检查,可以制剂取10ml加5ml置赶酸仪中130°,加热至近干,就稀释等上机做可以吗?
2010版药典中盐酸利多卡因注射液含测项下结果乘以1.156是什么意思,这个数据是根据什么公式得来的呢?
最近在测注射液中的Ca,选用了Ca43,44,He碰撞模式和标准模式(无反应碰撞气)都选了,发现Ca44标准模式的测定结果比Ca44 He模式、Ca43 He模式和Ca43标准模式这3种的结果高不少,后面3种模式差不多一致。然后做了样品加标实验,发现4种模式的加标回收率都是合格的,这是什么原因导致的呢,Ca44标准模式的测定存在干扰吗?Sr88双电荷吗?
RT、硫酸鱼精蛋白注射液告急什么原因造成的???有知道的吗?
药典制剂通则中注射剂项下没有色泽均匀或一致的规定,如发现同批注射液色泽深浅不一、经检验均符合标准规定,如何下结论?
USP的各论中,有些注射液没有提到是检查内毒素还是热原,这些注射液不检查内毒素或热原吗?注射液中,只提到了无菌,也没有提到热原和内毒素的要求。
复方氨基酸注射液 含量测定 是用液相色谱吗?哪位大侠知道怎么弄的,指导我呀。谢啦! 我13914681818 wcj.yc@163.com
[center]脑蛋白水解物注射液药品标准不完善[/center] 据国家药监局网站消息,为确保公众用药安全,国家药监局日前通知要求各地进一步加强对脑蛋白水解物注射液的监督检查。 通知称,在全国开展注射剂类药品生产工艺和处方核查工作中,发现脑蛋白水解物注射液品种在药品标准和执行工艺处方等方面存在着较为突出的问题,主要是企业选用猪脑原料的质量标准不完善;企业之间现行生产工艺差别较大;猪脑水解所用的蛋白酶种类、酶量及水解温度、时间等不一致,甚至有补加氨基酸的行为。针对上述突出问题,部分地区已采取了控制措施。 通知指出,一、要充分认识到脑蛋白水解物注射液在产品质量方面存在的安全风险,各地应在注射剂类药品生产工艺和处方核查工作的基础上,积极组织力量认真做好监督检查工作。要建议辖区内脑蛋白水解物注射液生产企业主动停止该品种的生产,并要求脑蛋白水解物注射液生产企业按相关技术要求,组织开展改进工艺和质量控制方法的研究工作,在相关工艺改进和质量标准未经批准前,暂不宜恢复生产。 二、对于生产企业认为其脑蛋白水解物注射液生产工艺合理、质量可控,继续进行生产的,所在地省级食品药品监督管理局应对其生产全过程予以跟踪检查,并对监督生产的产品进行现场抽样,由省级药品检验所检验。 凡生产企业存在未按批准变更生产处方工艺生产,或在制成品中补加氨基酸等违法违规行为,以及现场抽样检验不合格的,应依法予以严厉查处。 三、国家局将组织有关专家开展脑蛋白水解物注射液有效性、安全性评价工作,组织对脑蛋白水解物注射液生产工艺的改进、质量控制标准的提高工作,并在此基础上提出监管措施和改进意见。信息来源:中国新闻网
复方氨基酸注射液采用丁基胶塞密封,胶塞中的硫磺可能会浸出到注射液中,需要对药液中的硫磺含量进行测定。但是,方法学建立过程中,进行药液的加标回收率测定,发现其不合格,并且随氨基酸浓度升高,硫磺回收率降低。求助可能的原因,有哪位大神做过相关的实验吗?请不吝赐教,大谢
小弟最近忙AAS,火焰测了4个,石墨炉要测至少4个。现在忙铅,不知道国标对于注射液的含铅量有没有要求,这样我测得时候就有数了,有知道的就发个话吧,我这边附上不错的资料以示表达[img]http://www.instrument.com.cn/bbs/images/affix.gif[/img][url=http://www.instrument.com.cn/bbs/download.asp?ID=58278]多种微量元素注射液中铁锌锰铜硒铬钼的测定[/url]
在英国药典附录colour of solution中指描述了标准比色液的配制,但如果注射液正文中没有对颜色的描述,是否就表明对该品种的颜色不做要求呢?还是说没有描述就是要求澄清无色?药典的其他地方有没有溶液颜色的规定?请指点,谢谢!
为对庆大霉素和林可霉素注射液的安全性进行毒理学评价,采用急性毒性试验、溶血试验、局部血管刺激性试验、肌肉及皮肤刺激试验及豚鼠全身用药的过敏试验,考察庆大霉素和林可霉素注射液制剂的安全性。结果表明,庆大霉素和林可霉素注射液对小鼠肌肉注射的LD 。为4.989 mL/kg,0.1~0.5 mL该注射液在4 h内对兔红细胞不产生溶血和凝聚作用;静脉注射部位血管及周围组织均未见充血、水肿、出血和坏死等病理改变,肌肉注射部位充血范围在0.5 cm×1.0 cm 以下,4块股四头肌反应级的最高与最低之差等于0,家兔四块股四头肌反应级之和小于1O;以相当于临床用量2倍的剂量涂抹皮肤,停药后1、24、48、72 h镜下观察均未见明显异常的病理变化;豚鼠首次致敏后第14天及第21天静脉注射液攻击,在观察期内未见过敏反应。表明庆大霉素和林可霉素注射液在该试验条件下是安全的。过敏试验猪链球菌病是由猪链球菌引起的人畜共患传染病,是规模化养猪场中最常见的细菌病之一(蔡宝祥,2001)。本病一年四季均可发生,但以5一l1月发生较多,大小猪均能感染发病,但多见于断奶仔猪和育肥猪。庆大霉素和林可霉素注射液主要用于治疗断奶仔猪链球菌病,临床多肌肉注射给药。为了考察该给药方法的安全性,根据《新药注册管理办法》及有关法规的要求,作者对庆大霉素和林可霉素注射液进行了急性毒性试验、溶血试验、局部刺激性试验(肌肉、血管、皮肤)及全身过敏试验,供临床参考。

测定替硝唑氯化钠注射液中的砷锑铅镉有没有人做过http://ng1.17img.cn/bbsfiles/images/2015/07/201507280914_557476_1638062_3.jpg
哪 位朋友有氨基酸注射液含量的液相检测方法,传过来学习一下。谢谢!